Method Article
Protocoles pour les essais la résistance aux herbicides robuste chez différentes espèces de mauvaises herbes
Dans cet article
Résumé
A robust and flexible approach to confirm herbicide resistance in weed populations is presented. This protocol allows the herbicide resistance levels to be inferred and applied to a wide range of weed species and herbicides with minor adaptations.
Résumé
Robust protocols to test putative herbicide resistant weed populations at whole plant level are essential to confirm the resistance status. The presented protocols, based on whole-plant bioassays performed in a greenhouse, can be readily adapted to a wide range of weed species and herbicides through appropriate variants. Seed samples from plants that survived a field herbicide treatment are collected and stored dry at low temperature until used. Germination methods differ according to weed species and seed dormancy type. Seedlings at similar growth stage are transplanted and maintained in the greenhouse under appropriate conditions until plants have reached the right growth stage for herbicide treatment. Accuracy is required to prepare the herbicide solution to avoid unverifiable mistakes. Other critical steps such as the application volume and spray speed are also evaluated. The advantages of this protocol, compared to others based on whole plant bioassays using one herbicide dose, are related to the higher reliability and the possibility of inferring the resistance level. Quicker and less expensive in vivo or in vitro diagnostic screening tests have been proposed (Petri dish bioassays, spectrophotometric tests), but they provide only qualitative information and their widespread use is hindered by the laborious set-up that some species may require. For routine resistance testing, the proposed whole plant bioassay can be applied at only one herbicide dose, so reducing the costs.
Introduction
Les herbicides sont la mesure de contrôle des mauvaises herbes les plus largement utilisés, ce qui représente jusqu'à 50% du marché de la protection mondiale des plantes 1. Ils sont des outils relativement bon marché, éviter les pratiques de la culture des sols main-d'œuvre et de temps, et, finalement, aboutir à une production rentable, sûre et rentable alimentaire 2. Cependant, la grande phénologique et la variabilité génétique présente chez de nombreuses espèces de mauvaises herbes, avec une sur-dépendance sur l'utilisation d'herbicides, se traduit souvent par la sélection des populations de mauvaises herbes résistantes aux herbicides. L'introduction d'herbicides sélectifs avec une cible métabolique très spécifique 3-5 a considérablement augmenté le nombre de cas de résistance au fil des ans. À ce jour, 240 espèces de mauvaises herbes dicotylédones (140 et 100 monocotylédones) à travers le monde ont développé une résistance aux différents sites d'herbicides d'action (SoA) 4. Ceci est une préoccupation majeure pour la gestion des mauvaises herbes et plus généralement pour la production agricole durable.
e_content "> La détection précoce de la résistance, basée sur des tests fiables, fréquemment exécutées dans une serre, est une étape clé pour gérer les mauvaises herbes résistantes aux herbicides. Différentes approches ont été développées selon les objectifs, le niveau de précision, le temps et les ressources disponibles nécessaires, comme ainsi que les espèces de mauvaises herbes considérées 6-12. Toutefois, lorsque la confirmation du statut de la résistance d'un nouveau biotype des mauvaises herbes est nécessaire (par exemple, un groupe d'individus qui partagent plusieurs caractéristiques physiologiques, y compris la capacité de survivre un ou plusieurs herbicides appartenant à un groupe particulier est utilisé à une dose qui, normalement, les contrôler), un dosage biologique robuste de la plante entière doit être effectuée dans un environnement contrôlé 4, 11.Un biotype est rarement résistant à un seul herbicide. Chaque biotype est donc caractérisé par un profil de résistance certaine, à savoir, le nombre et le type de SoA des herbicides, il est résistant à, et par une résistance donnéeà chaque niveau 13 herbicide. La détermination précoce et fiable de la tendance de fond ou une résistance multiple 5, 14 est important pour la gestion de la résistance sur le terrain.
Il est à noter que la résistance aux herbicides n'a rien à voir avec la tolérance naturelle que certains présentent des espèces de mauvaises herbes à certains herbicides, par exemple, les espèces de dicotylédones vs herbicides ACCase inhibant, espèces monocotylédones vs 2,4-D, Equisetum arvense vs. glyphosate.
Cet article présente une approche robuste pour tester biotypes résistants aux herbicides putative échantillonnés dans des domaines où un mauvais contrôle par l'herbicide (s) avait été signalée. Variantes pertinentes aux protocoles standards en ce qui concerne les espèces de mauvaises herbes impliqués sont présentés. Les avantages par rapport à d'autres techniques / protocoles basés soit sur des essais biologiques de la plante entière à l'aide de seulement une dose d'herbicide 15, ou le traitement des graines dans des boîtes de Pétri 8 sont liés à la Reliab ultérieureilité et la possibilité de déduire le niveau de résistance en raison de l'inclusion de deux doses d'herbicides dans les expériences. Cependant, pour les tests de résistance de routine, les mêmes méthodes peuvent être appliquées à une seule dose d'herbicide, réduisant ainsi les coûts.
En plus de permettre la confirmation du statut de la résistance, l'information obtenue peut être utilisée à la fois pour optimiser les étapes de recherche suivants et / ou concevoir des stratégies de gestion de la résistance sonores.
Protocole
1. l'échantillonnage des semences et stockage
- Surveiller les champs cultivés pour la performance de l'herbicide pauvres injustifiée, à savoir, pas en raison de conditions climatiques défavorables ou de traitements herbicides de faible qualité.
- Prélever un échantillon de semences d'une espèce à la fois et attribuer un code unique. Les graines mûres sont généralement recueillies avant la récolte des cultures de plantes qui avaient survécu au traitement (s) de l'herbicide. Moniteur en temps opportun d'observer si les graines tombent par plante mère à maturité.
- Remplir un formulaire pour chaque échantillon en indiquant le code unique attribué, nom de l'espèce, la date de collecte, coordonnées GPS, la municipalité, le nom de l'agriculteur, la taille du champ, le niveau d'infestation, la culture, l'herbicide (s) utilisés au cours de la saison et des documents historiques du champ .
- Récupérer les graines à partir d'au moins 30 plantes choisies au hasard qui sont représentatifs de l'infestation de champ. Assurez-vous que l'échantillon de semence contient au moins 5000 graines matures. Pour un obligatoires outcrossing espèces de mauvaises herbes(Par exemple, Lolium spp. Ou Amaranthus spp.), De réduire le nombre de plantes à 10-15, en gardant le nombre total de graines autour de 5000 11.
- Sous-échantillonner le champ si des taches de mauvaises herbes sont dispersés sur de vastes zones (plus d'un hectare) que les différents biotypes résistant aux herbicides sont sélectionnés.
- graines de magasins dans des sacs en papier non scellées marquées avec le code unique attribué.
- Laisser évaporer l'humidité pour, mais ne pas exposer les semences à une température élevée (par exemple, éviter de les laisser dans une voiture sous le soleil) ou à des fluctuations extrêmes de température pour éviter l'induction de dormance secondaire.
- Clean (enlever les balles, les graines de coque, etc.) et de les stocker à température ambiante dans un endroit sec. Après avoir effectué les premiers tests de résistance, stocker les semences pour de longues périodes de temps dans une pièce sombre à 4 ° C, de préférence dans des sacs de plastique scellés sous vide. De cette manière, les graines de préserver leur viabilité pendant une période beaucoup plus longue.
2. La dormance des graines de rupture
NOTE: La dormance des graines fournit un mécanisme souple et efficace qui permet d'adapter les mauvaises herbes et de persister dans les agro-écosystèmes. Pour lever la dormance et de permettre la germination des graines, différents protocoles doivent être utilisés en fonction des espèces de mauvaises herbes, à savoir le type de dormance 16.
Il existe trois principales façons d'éliminer la dormance:
- Vernalisation
NOTE: Pour obtenir la germination simultanée et la levée des semis, une période de vernalisation de semences allant de quelques jours à une semaine est nécessaire pour éliminer la dormance physiologique de nombreuses espèces:. Par exemple, Amaranthus retroflexus, Chenopodium album, Lolium spp, Avena fatua, Polygonum persicaria , Phalaris paradoxa 17-19. Une période de jusqu'à 15 jours de plus est nécessaire pour Papaver rhoeas, Cyperus difformis et Ammania coccinea et jusqu'à 30 jours pour les Schoenoplectus mucronatus 20.- Mettez un peu d'eau déminéralisée dans les plats en plastique. Coupez deux couches de papier filtre et les faire tremper dans l'eau, enlever tout excès. Placez les graines séchées à l'air sur le papier. Transférer les plats en plastique à un réfrigérateur à 4 ° C pour la période de temps requise.
- Scarification
NOTE: Certaines espèces de mauvaises herbes sont plus récalcitrants à la germination que d'autres en raison de la dormance mécanique, à savoir les caractéristiques du tégument, et nécessitent l'utilisation d'une scarification chimique utilisant de l'acide sulfurique à germer 21.- Préparer un bêcher avec de l'acide sulfurique concentré (95-98%). Préparez un bécher rempli d'eau. Mettez les graines dans une enveloppe de tissu non-tissé.
- Faire tremper par exemple, Echinochloa spp. Ou des graines de sorgho halepense pendant 20 min ou 5 min, respectivement, dans de l'acide sulfurique concentré.
- Prenez l'enveloppe sur le bécher en utilisant une paire de pinces et le mettre dans le bécher rempli d'eau. Ouvrez leenveloppe, mettre les graines dans une petite passoire et rincer abondamment sous l'eau courante.
- Faire tremper les graines pendant 2 min dans du chloroforme. Rincer les graines avec de l'eau déminéralisée et les sécher avec du papier absorbant. Tremper les graines dans de l'acide sulfurique à 80% pendant 5 min.
- Mettez les graines dans une petite passoire et les rincer sous l'eau courante.
- Post-récolte maturation des graines
NOTE: Graines d'autres espèces de mauvaises herbes ne germent pas du tout pendant quelques mois après l'échéance, quelle que soit la méthode utilisée pour lever la dormance.- Stocker les graines pendant une période d'au moins 3-4 mois à température ambiante et une faible humidité et suivez les protocoles ci-dessus pour levée de dormance (par exemple, Oryza sativa var. Sylvatica ou P. rhoeas).
3. Germination
- Placer les semences à germer dans plastic plats contenant 0,6% (m / v) de gélose à 0,1% de nitrate de potassium (KNO 3) ajoutés:
- Préparer une solution de gélose à 0,6% + 0,1% de KNO 3, en utilisant de l'eau désionisée. Dissoudre la gélose dans un four à micro-ondes.
- Verser la solution d'agar dans des boîtes en plastique. Refroidir le substrat et ensuite mettre dans les graines.
- Placer des plats en plastique dans une armoire de germination pendant environ une semaine dans des conditions de lumière et de température en fonction des conditions optimales pour chacune des espèces de mauvaises herbes. Pour la plupart des espèces d'hiver, la plage de température est 15/25 ° C nuit / jour et 12 h photopériode avec des tubes de néon fournissant une densité de photons photosynthétiques Flux (PPFD) de 15-30 pmol m -2 s -1. Pour de nombreuses espèces d'été, la plage de température est 15/30 ° C la nuit / jour.
Variante: Some espèces, telles que S. halepense, besoin d'un traitement thermique. Par conséquent après la scarification, les graines de S. halepense sont soumis aux conditions suivantes: cycles de 4 heures à 45 ° C et 20 heures à 24 ° C pendant trois jours dans l'armoire de germination, puis trois jours dans des conditions normales.
4. Semis repiquage et la croissance
- Transplant quinze à vingt jeunes plants dans des plateaux en plastique (325 x 265 x 95 mm) remplis d'un mélange standard de rempotage (60% loam limoneux, 15% de sable, 15% et 10% agriperlite tourbe - en volume).
NOTE: Le repiquage, au lieu de l'ensemencement direct, permet un support uniforme des plantes au même stade de croissance à obtenir, ce qui est une condition préalable importante pour optimiser le rendement du traitement herbicide. - Identifier chaque plateau avec un code à barres, y compris toutes les informations pour l'identification unique: Code de la population, l'herbicide testé, répliquer nombre et numéro de plateau progressive <./ Li>
- La place des plateaux dans une des plantes à effet de serre et de l'eau chauffée au besoin pour maintenir le substrat à ou près de la capacité au champ.
REMARQUE: La température de croissance varie selon les espèces de mauvaises herbes. Souvent tests sont effectués au cours de l'automne / hiver / printemps, si léger est complété en utilisant des lampes de 400 W aux halogénures métalliques, qui fournissent une PPFD d'environ 150 pmol m -2 s -1 et une photopériode de 12 h 24, 19. Espèces de mauvaises herbes d'été avec C 4 cycle de photosynthèse nécessitent habituellement intensité lumineuse plus élevée et donc des tests sont effectués en fin de printemps-été ou l'intensité de la lumière complété est d'environ 400 pmol m -2 s -1 avec une photopériode de 14 h. - Utilisez un protocole différent pour certaines espèces de mauvaises herbes qui infestent le riz paddy, par exemple, A. plantago-aquatica, S. et C. mucronatus Difformis comme décrit dans 22.
- Transplanter les plants dans des barquettes en polystyrène avec 24 cellules rondes (de 55 mm de diamètre, 64 mm de profondeur) filconduit avec 60% loam limoneux, 30% de sable et 10% de tourbe (en volume).
- Définissez les plateaux dans 12 cm contenants de plastique remplis d'eau profondes et fermé hermétiquement par des tiges en acier inoxydable vissés pour empêcher les flottante (figure 1).
- Maintenir le niveau d'eau dans les récipients à 1-2 cm en dessous du niveau de la surface du sol et ajouter 1,5 g de sulfate de cuivre pour chaque récipient (qui contient de 10 à 12 L d'eau) afin d'éviter la prolifération des algues.
5. traitements herbicides
- Les traitements avec des herbicides de prélevée:
- Après environ trois jours dans l'armoire de germination tels que décrits dans la section 3, transplanter les graines en germination dans des bacs en plastique contenant le substrat décrit ci-dessus et couvrir avec une couche de sol (environ 1 cm). Ceci est une étape cruciale afin d'assurer que les semis ne sortiront pas en raison de l'effet de l'herbicide plutôt que d'une profondeur d'enfouissement excessive.
- Prenez le substrat au champ capaville en plaçant les plateaux, qui ont quelques trous dans le bas, sur les soucoupes remplis d'eau.
- Un jour après la transplantation, les bacs traiter avec l'herbicide de pré-émergence 25.
- Gardez le substrat au niveau ou la capacité de champ proche par addition d'eau au besoin à la fois au-dessus et ci-dessous par capillarité de la soucoupe. Cette procédure favorise la permanence de l'herbicide à la profondeur appropriée (par exemple, où les graines en germination sont) d'une bonne efficacité du traitement.
- Les traitements avec des herbicides de post-levée:
- Vaporiser les plantes quand elles atteignent le stade 2-3 feuilles (ie, le stade de croissance 12-13 de l'échelle de croissance BBCH Extended 26).
- A partir du jour après le traitement, régler le système d'irrigation selon les besoins en eau des espèces de mauvaises herbes et de la saison (par exemple, pour Echinochloa spp., Il fournit de l'eau pendant 3 minutes 4 fois par jour, à intervalles réguliers, de 9 h à 9 h). L'eau est DIScontribué à l'aide d'un système d'irrigation par aspersion automatique.
Variante: le glyphosate est appliqué à l'usine BBCH stade 14-21.
- la préparation de l'herbicide et de la distribution.
REMARQUE: Tous les herbicides (pré- et post-levée) sont appliquées en tant que formulations commerciales avec des tensioactifs à deux doses recommandées, la dose recommandée de champ (1x) et trois fois (3x).- Si nécessaire, préparer la solution d'agent tensio-actif en vrac, selon les instructions de l'étiquette; la concentration finale est généralement exprimé comme un pourcentage du volume final (par exemple, 0,3%) ou que le volume à distribuer par unité de surface (par exemple, une L ha -1).
- Utiliser la solution d'agent tensio-actif en tant que solvant pour la solution herbicide (soluté) afin de maintenir la bonne concentration de l'ingrédient actif. Préparer la solution de l'herbicide le plus concentré premier (3x). Calculer la quantité de produit commercial à être dissous dans la solution d'agent tensio-actif (ou dans de l'eau désionisée si unagent tensio-actif est non nécessaire) en utilisant l'équation suivante:
herbe Dose = [(Dose champ x Dose max) x V fin] / V del
Où: = dose Dose d'herbes aux herbicides (ml), dose champ = champ aux herbicides Dose (ml ha -1), Dose max = dose maximale délivrée, V nageoire = volume final de la solution (L), V del = volume délivré par le banc pulvérisateur (L ha -1). - Diluer (2: 1, v / v) de la solution herbicide 3x pour préparer le concentré moins une (1 x). Cette procédure réduit le risque de faire des erreurs lors de la pesée ou de pipetage des herbicides. concentration de la solution de l'herbicide est exprimée par le volume à distribuer par unité de surface (L ha -1).
- Lancer la séquence de traitement avec la dose d'herbicide inférieure (1x). De cette façon, il n'y a pas besoin de laver l'armoire de pulvérisation entre deux traitements avec le même herbicide.
- Distribuer la solutio herbiciden aide d'un pulvérisateur de précision banc délivrer 300 L ha -1 (± 1%), à une pression de 215 kPa, et une vitesse de 0,75 m sec -1, avec un boom équipé de trois ventilateurs plat (gamme étendue) des buses hydrauliques .
- Laver l'armoire de pulvérisation deux fois lorsque l'herbicide est modifié en utilisant l'eau de Javel à 1% (v / v), puis rincez.
Variante: le glyphosate est appliqué avec un volume de pulvérisation de 200 L ha -1 27.
REMARQUE: Une attention particulière doit être payée lorsque herbicides hautement biologiques, tels l'sulfométuron ou flazasulfuron sulfonylurées, sont utilisés. Dans ce dernier cas faire un lavage avec une solution d'eau de Javel et l'autre avec de l'ammoniac (2,5% v / v), suivi d'un rinçage avec de l'eau prudent.
6. Collecte et Analyse des données
- Grâce à un lecteur de code à barres, qui identifie automatiquement chaque plateau, enregistrer le nombre de plantes qui ont survécu au traitement ainsi que la biomasse estimée Visuel (VEB). Les plantes sont culEssed comme étant morts si elles ne montrent pas de croissance active indépendamment de la couleur ou d'une autre apparence.
- Procéder à l'évaluation de trois ou quatre semaines après traitement (WAT) en fonction des herbicides testés (par exemple, pour trois WAT inhibiteurs ACCase et quatre WAT pour des inhibiteurs de l'ALS ou le glyphosate).
- Évaluer l'efficacité générale de traitement en incluant une population sensible (vérifiez S) dans toutes les expériences, à savoir, une population recueillie dans un site qui n'a jamais ou rarement traitées avec des herbicides.
- La survie des plantes Express comme pourcentage du nombre de plantes traitées, compté juste avant le traitement à l'herbicide, et de calculer l'erreur standard (SE) par valeur moyenne (valeur des deux répétitions signifie).
- Le VEB est obtenue par une comparaison visuelle de la biomasse végétale entre les traités et le contrôle de la même population 25, 28 non-traitées. Une note, allant de 10 pour les plantes ne sont pas affectées par l'herbicide (par rapport au chèque non-traitée) à 0 quandles plantes sont bien morts, est remis à chaque bac traité.
- populations attribuent à quatre catégories basées sur les résultats obtenus à partir de traitements avec deux doses d'herbicides: S lorsque moins de 5% des plantes ont survécu à l'1x doses d'herbicide, SR où les survivants ont varié de 5% à 20% à 1x doses d'herbicides, R Lorsque plus 20% des plantes ont survécu aux 1x doses d'herbicides et RR où les survivants sont plus de 20% à la dose d'herbicide 1x et plus de 10% à la dose d'herbicide 3x 17.
Résultats
Pour évaluer l'état de résistance d'une population résistante putative, il est fondamental d'inclure un chèque sensibles dans le test afin de vérifier l'efficacité de l'herbicide. Les résultats d'un test de dépistage effectués sur P. populations rhoeas, une mauvaise herbe qui infestent les champs de blé, sont rapportés dans la figure 2, où l'efficacité de quatre herbicides de post-levée sur un chèque sensibles (09-36) et d'une résistante suspecté (10-91) sont présentés. Population 09-36 a été complètement contrôlé par les Inhibiteur de l'ALS iodosulfuron tandis que seulement une plante a survécu dose 1x des deux autres herbicides ALS testées, florasulam et tribenuron-méthyle (Figure 2). Au lieu de cela, environ 60% des plantes de la population 10-91 survécu deux doses d'herbicides de iodosulfuron et tribénuron-méthyle et environ 50% ont survécu à la dose de 1x florasulam. Ces résultats confirment que la population de 10 à 91 est très résistant (RR) et de l'iodosulfuron-méthyl et tribénuron-résistant(R) pour le florasulam. Une réponse différente a été observée avec le 2,4-D, un herbicide ayant une SoA différente (par exemple, il imite auxine endogène), largement utilisé pour contrôler les mauvaises herbes dicotylédones dans le blé. Seulement 33% des plantes de la vérification de S ont été tués avec cet herbicide à dose 1x et la valeur VEB était> 20% (Figure 2). Le manque d'efficacité sur la population de chèque ne confirme pas si la population 10-91 est résistant à cet herbicide ou non. Dans ce cas, il est recommandé d'effectuer à nouveau l'expérience et si les résultats sont confirmés, pour changer la population S. Un exemple d'un bon contrôle de la vérification sensibles est rapporté dans la figure 3. Le Echinochloa spp. 07-16L population a été complètement contrôlé par tous les herbicides à la dose recommandée de champ (1x). Dans ce cas, il est possible d'affirmer que la population 08-42 est hautement résistance croisée à tous les inhibiteurs de l'ALS testées, à savoir, l'azimsulfuron, bispyribac-Na, imazamox et penoxsulame. Le ch pas traitéeeck des deux populations est rapporté sur la gauche. Ces plantes sont utilisées pour calculer la VEB; la quantité de biomasse est estimée visuellement plateau en plateau donnant un score de 10 à la vérification non traitée puis en attribuant une note de 0, pour la répétition sans tissu végétal vert, à 10 lorsque la biomasse est comparable à la non-traité vérifier (Figure 3).
Un autre exemple de sortie est rapporté sur la figure 4, où l'usine de survie Lolium spp. au glyphosate est montré. Les populations testées ont été recueillies dans les systèmes de culture à base de blé où glyphosate exerce une pression de sélection différent (par exemple, à l'occasion ou 1-2 traitements par an ou 3-fois de plus par an). Les plantes ont été pulvérisées à début du tallage (BBCH 14-21) en utilisant deux doses de glyphosate: 480 et 1 440 g ae ha -1, qui représentent le minimum et la dose maximale recommandée de terrain pour les mauvaises herbes annuelles (c.-à-thérophytes) à ce que la croissance stâge. Les données ont été recueillies après quatre semaines de traitement. Basé sur les deux expériences, sept des populations testées avaient un taux de survie de 80% ou plus (populations 343, 383, 384, 403, 509, 512 et 537) à la dose la plus faible appliquée mais seulement 50% des plantes des populations 403 et 509 ont survécu la plus forte dose de glyphosate. Une population avait un taux d'environ 40% de survie à 1x dose, alors que quelques plantes de la population 509 ont survécu à la dose la plus faible et la population 508 a été entièrement contrôlés à tout dose. En résumé, ces expériences ont montré des niveaux différents de résistance au glyphosate reflétant souvent l'histoire du champ d'utilisation de l'herbicide. Le niveau de résistance au glyphosate était plus élevé pour les populations qui avaient été traités plus intensément:-à-dire, le nombre de demandes de terrain par an et le nombre d'années de pression de sélection était plus élevé.
Le protocole décrit pour un herbicide (figure 4) peut être appliqué à de nombreux autres ayant diffelouer SoA; De cette manière, le profil de résistance d'une ou plusieurs populations peut être déterminée. Un exemple de modèle de résistance variabilité des Echinochloa spp. populations sont rapportés dans le tableau 1. Les données historiques sur l'utilisation d'herbicides et de gestion des cultures obtenu à partir de l'agriculteur ont indiqué que les herbicides inhibant l'ALS étaient l'agent de sélection (c.-à-penoxsulame ou imazamox). Le test de résistance a donc été réalisée avec trois herbicides inhibant l'ALS (azimsulfuron, penoxsulame et imazamox) appartenant à différentes familles chimiques, et un herbicide ayant une autre SoA, l'herbicide profoxydime ACCase inhibant. Le témoin sensible (07-16L) a été complètement contrôlé par tous les herbicides testés (Tableau 1). Trois profils de résistance ont été détectés: treize populations entraîné comme étant résistants aux inhibiteurs de l'ALS ne, quatre populations ont entraîné comme étant résistant seulement à la profoxydime inhibiteur de ACCase, et trois populations ont montré un multiple profil de résistance à la fois au profoxydime inhibiteur de l'ACCase et les inhibiteurs de l'ALS. Au sein de chaque motif de résistance, il est possible de distinguer différents biotypes, par exemple, quatre populations résistantes à des inhibiteurs de l'ALS ont survécu seuls traitements avec l'azimsulfuron sulfonylurée tandis que deux des populations multi-résistantes ont survécu seul traitement avec l'azimsulfuron inhibiteur de la SLA mais sont tout à fait contrôlés par penoxsulame et imazamox.

Figure 1. Exemple de C. difformis, une espèce de mauvaises herbes qui infestent le riz paddy, l'expérience set-up. barquettes de polystyrène sont placés dans des contenants de plastique et bloquée par des tiges en acier inoxydable vissés pour empêcher leur flottant. L'eau est maintenue à 1-2 cm en dessous du niveau de la surface du sol afin d'imiter des conditions de riz paddy. La photographie a été prise quatre semaines après le traitement.p_upload / 52923 / 52923fig1large.jpg "target =" _ blank "> S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 2. Réponse de deux P. populations rhoeas de post-levée herbicides. Effet de l'iodosulfuron, le tribénuron, florasulam et le 2,4-D testé à la dose de terrain recommandée (1x) et trois fois plus que (3x) sur la survie de la plante (barres bleues) et l'estimation visuelle de la biomasse ( VEB; barres rouges) du témoin sensible (09-36) et d'une population résistante (10-91). L'évaluation a été réalisée quatre semaines après le traitement herbicide. la survie de la plante et VEB sont exprimés en pourcentage du nombre de plants traités et le VEB des contrôles non traités (%). La ligne horizontale à 20% de la survie de l'usine représente le seuil de discrimination entre les populations résistantes et sensibles lorsque les plantes sont traités à la dose de 1x. Les barres verticalesreprésenter erreurs types calculées sur la valeur moyenne des deux répétitions. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.

Figure 3. Les résultats visuels d'une projection sur deux Echinochloa spp. populations. Le témoin sensible, 07-16L (S), et de la population résistante, 08-42, ont été testés avec quatre inhibiteurs de l 'ALS (rapportés sur la droite) à deux doses, 1x et 3x, (rapportés au fond). Pour le contrôle de S seulement les résultats des 1x de dose sont signalés, parce que toutes les plantes ont déjà été contrôlés à la dose. Trois exemples de pointage VEB sont signalés en rouge: 0 = toutes les plantes mortes, 10 = toutes les plantes ont survécu et de la biomasse est comparable à la (NT) chèque non-traités (rapport sur la gauche), 5 = biomasse est environ la moitié de celui de un plateau de la non-traitéevérifier. S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
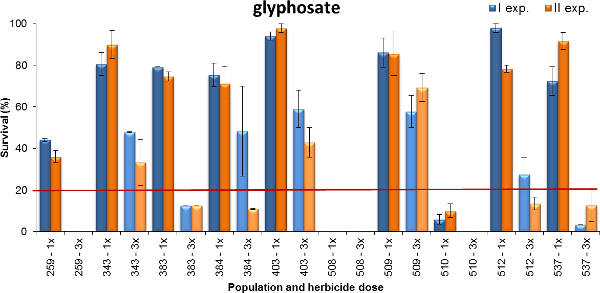
Figure 4. Pourcentage de la survie de l'usine pendant dix Lolium spp. populations testées à la survie des plantes glyphosate. enregistrée dans deux expériences (barres bleues et oranges des bars pour exp. I et II, respectivement). Les données sont exprimées sous forme de pourcentage (%) du nombre de plantes traitées. Deux contrôles sensibles ont été entièrement contrôlés à la dose 1x et ne sont donc pas présentés dans le graphique. Deux doses ont été testées, le minimum (1x = 480 g ae ha -1) et maximum (3x = 1440 g ae ha -1) doses rapportées sur l'étiquette du produit. La ligne horizontale à 20% de la survie de l'usine représente le seuil de discrimination entre les populations résistantes et sensibles lorsque les plantes étaient régaled à 1x la dose. Les barres verticales représentent les erreurs standard calculées sur la valeur moyenne des deux répétitions. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
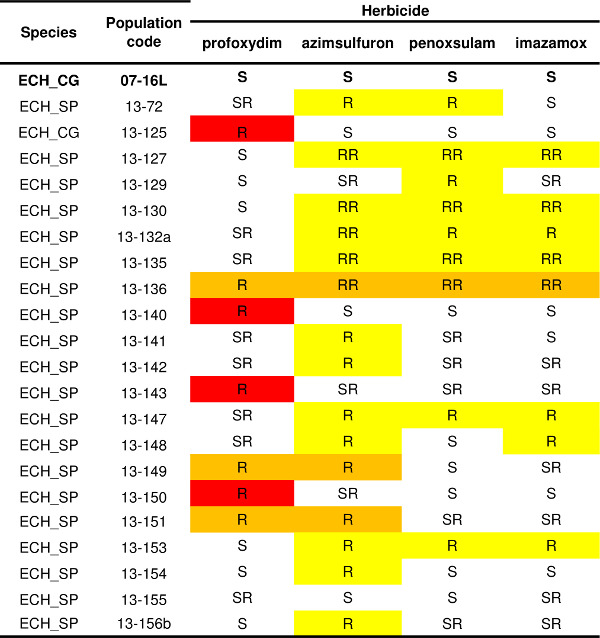
Tableau 1. Statut Résistance de vingt et un populations de Echinochloa spp. Sensible à cocher (07-16L) est signalé en caractères gras. Les niveaux de résistance sont signalés pour chacune des quatre herbicides testés (un inhibiteur de l'ACCase, profoxydime, et trois inhibiteurs de l 'ALS, azimsulfuron, penoxsulame et imazamox) selon quatre catégories: S = moins de 5% des plantes a survécu à l'1x doses d'herbicide, SR = la survie des plantes varie de 5% à 20% à 1x doses d'herbicides, R = plus de 20% des plantes ont survécu aux 1x doses d'herbicide, RR = survie de l'usine a été plus de 20% à la dose d'herbicide1x et plus de 10% à une dose 3 fois. Différents profils de résistance sont mises en évidence: rouge = résistance à seulement inhibiteur de ACCase, jaune = résistance à seulement inhibiteur (s) de la SLA, orange = résistance à l'inhibiteur de ACCase et à au moins un inhibiteur de l'ALS.
Discussion
Plusieurs étapes dans les protocoles sont essentiels pour une évaluation réussie de la résistance aux herbicides dans une population: 1) les graines doivent être prélevés à maturité à partir de plantes qui avaient survécu au traitement (s) de l'herbicide. Maturation des graines sur la plante mère est cruciale pour éviter des difficultés dans la germination des graines plus tard; 2) la bonne conservation des semences est recommandé d'éviter la prolifération de moisissures qui pourraient empêcher la germination; 3) les plants doivent être traités au stade de croissance droite, comme indiqué sur l'étiquette de l'emballage de l'herbicide. Des précautions doivent être prises pour que des plantes à traiter ont atteint approximativement le même stade de croissance; 4) les solutions d'herbicides doivent être préparés et manipulés avec une précision de sorte que les plantes sont pulvérisés avec la bonne concentration de l'ingrédient actif évitant ainsi des erreurs invérifiables; 5) après chaque traitement herbicide il est recommandé de nettoyer soigneusement le cabinet de pulvérisation et la verrerie utilisée pour préparer les solutions pour évitercontamination dans le traitement herbicide suivant, en particulier lorsque des herbicides très actifs biologiquement sont impliqués.
Les protocoles présentés ici peuvent être facilement adaptés à un large éventail d'espèces de mauvaises herbes avec les modifications nécessaires selon les espèces et les herbicides d'intérêt. En particulier, les méthodes pour briser la dormance des graines et la germination sont les mesures qui devraient être réexaminées pour chaque nouvelle espèce de mauvaises herbes (voir les sections 2 et 3). Matériel de pulvérisation parfois besoin d'ajustements lorsque différents herbicides sont utilisés, par exemple, le glyphosate nécessite différents paramètres de l'armoire de pulvérisation (voir rubrique 5.3) et les plantes sont traitées à un stade de croissance plus tard avec la plupart des herbicides.
Le temps et l'espace nécessaire pour effectuer ces protocoles peut être un facteur limitant et peuvent ne pas convenir à des tests de routine. Cependant, pour limiter les coûts, une seule dose d'herbicide peut être utilisé. De cette façon, l'information peut encore être obtenue si til est résistant à la population. Une limitation potentiel de cette approche est lié au fait que les pas de chèques résistantes sont inclus dans les expériences. En fait, en raison du grand nombre de biotypes évaluées (par exemple, les herbicides et les différentes espèces concernées), de nombreux contrôles doivent être inclus dans chaque expérience, augmentant ainsi les coûts.
Cependant, les avantages par rapport à d'autres techniques / protocoles basés sur des essais biologiques de la plante entière à l'aide de seulement une dose d'herbicide 15 sont liées à la plus grande fiabilité et la possibilité de déduire le niveau de résistance. Des tests de dépistage de diagnostic rapide et moins coûteux ont également été mis au point, in vivo ou in vitro (par exemple, des essais biologiques Boîte de Pétri 8, les tests spectrophotométriques herbicide sur l'enzyme cible 29). Cependant, elles ne fournissent que des informations qualitatives et nécessitent des travaux préliminaires, parfois laborieux, d'identifier la dose d'herbicide pour la discrimination entre resISTANT plantes et sensibles. Les essais in vitro ont également besoin d'être adaptés en fonction de l'ingrédient actif utilisé.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
The research was supported by the National Research Council (CNR) of Italy. The authors thank GIRE members for collecting seed samples and are grateful to Alison Garside for revising the English.
matériels
| Name | Company | Catalog Number | Comments |
| Paper bags | Celcar SAS | ||
| Plastic dishes | ISI plast S.p.A. | SO600 | Transparent plastic |
| Sulfuric acid 95-98% | Sigma-Aldrich | 320501 | |
| Non-woven fabric | Carretta Tessitura | Art.TNT17 | Weight 17 g m-2 |
| Chloroform >99.5% | Sigma-Aldrich | C2432 | |
| Agar | Sigma-Aldrich | A1296 | |
| Potassium nitrate >99.0% | Sigma-Aldrich | P8394 | |
| Plastic containers | Giganplast | 1875/M | 600 x 400 x 110 mm |
| Plastic trays | Piber plast | G1210A | 325 x 265 x 95 mm |
| Polystyrene trays | Plastisavio | S24 | 537 x 328 x 72 mm, 24 round cells (6x4) |
| Copper sulfate | Sigma-Aldrich | 451657 | |
| Agriperlite | Blu Agroingross sas | AGRI100 | |
| Peat | Blu Agroingross sas | TORBA250 | |
| Germination cabinet | KW | W87R | |
| Nozzles | Teejet | XR11002-VK, TP11001-VH | The second type of nozzles are used only for glyphosate |
| Barcode generator | Toshiba TEC | SX4 | |
| Labels with barcode | Felga | TT20200 | Stick-in labels with rounded corners |
| Barcode reader | Cipherlab | 8300-L | Portable data terminal |
| Bench sprayer | Built in house | ||
| Herbicides included in the results: | |||
| Commercial product | Active ingredient | Company | Comments |
| Altorex | imazamox | BASF | |
| Azimut | florasulam | Dow AgroSciences | |
| Biopower | Bayer Crop Science | Surfact to be used with Hussar WG | |
| Dash | BASF | Surfact to be used with Altorex | |
| Granstar | tribenuron-methyl | Dupont | |
| Gulliver | azimsulfuron | Dupont | |
| Hussar WG | iodosulfuron | Bayer Crop Science | |
| Nominee | bispyribac-Na | Bayer Crop Science | |
| Roundup | glyphosate | Monsanto | |
| Trend | Dupont | Surfact to be used with Granstar and Gulliver | |
| Viper | penoxsulam | Dow AgroSciences | |
| Weedone LV4 | 2,4-D | Isagro | |
Références
- Massa, D., Kaiser, Y. I., Andújar-Sánchez, D., Carmona-Alférez, R., Mehrtens, J., Gerhards, R. Development of a geo-referenced database for weed mapping and analysis of agronomic factors affecting herbicide resistance in Apera spica-venti L. Beauv. (Silky Windgrass). Agronomy. 3 (1), 13-27 (2013).
- Powles, S. B., Shaner, D. L. Herbicides Resistance and World Grains. , CRC Press LLC. Raton, FL. 308(2001).
- Sattin, M. Herbicide resistance in Europe: an overview. Proc. BCPC International Congress. , Crop Science & Technology. UK. 131-138 (2005).
- Heap, I. M. International Survey of Herbicide Resistant Weeds. , Available from: http://www.weedscience.org (2015).
- Jasieniuk, M., Le Corre, V. Deciphering the evolution of herbicide resistance in weeds. Trends Genet. 29 (11), 649-658 (2013).
- Heap, I. M. Identification and documentation of herbicide resistance. Phytoprotection. 75 (4), 85-90 (1994).
- Beckie, H. J., Heap, I. M., Smeda, R. J., Hall, L. M. Screening for herbicide resistance in weeds. Weed Technol. 14 (2), 428-445 (2000).
- Tal, A., Kotoula-Syka, E., Rubin, B. Seed-bioassay to detect grass weeds resistant to acetyl coenzyme A carboxylase inhibiting herbicides. Crop Prot. 19, 467-472 (2000).
- Boutsalis, P. Syngenta Quick-Test: a rapid whole-plant test for herbicide resistance. Weed Technol. 15 (2), 257-263 (2001).
- Menchari, Y., et al. Weed response to herbicides: regional-scale distribution of herbicide resistance alleles in the grass weed Alopecurus myosuroides. New Phytol. 171 (4), 861-874 (2006).
- Burgos, N. R., et al. Review: confirmation of resistance to herbicides and evaluation of resistance levels. Weed Sci. 61 (1), 4-20 (2013).
- Owen, M. J., Martinez, N. J., Powles, S. B. Multiple herbicide-resistant Lolium rigidum. (annual ryegrass) now dominates across the Western Australian grain belt. Weed Res. 54 (3), 314-324 (2014).
- Herbicide Resistance Action Committee. Classification of herbicides according to site of action. , Available from: http://www.hracglobal.com/Education/ClassificationofHerbicideSiteofAction.aspx (2015).
- Beckie, H. J., Tardif, F. J. Herbicide cross resistance in weeds). Crop Prot. 35, 15-28 (2012).
- Moss, S. R., et al. The occurrence of herbicide-resistant grass-weeds in the United Kingdom and a new system for designating resistance in screening assays. Proc. BCPC Weeds. , Brighton. 179-184 (1999).
- Baskin, C. C., Baskin, J. M. Seeds, Ecology, Biogeography and Evolution of dormancy and Germination. , Academic Press. San Diego, USA. 27-42 (1998).
- Sattin, M., Gasparetto, M. A., Campagna, C. Situation and management of Avena sterilis. ssp. ludoviciana. and Phalaris paradoxa. resistant to ACCase inhibitors in Italy. Proc. BCPC - Weeds. , Brighton, UK. 755-762 (2001).
- Scarabel, L., Varotto, S., Sattin, M. A European biotype of Amaranthus retroflexus. cross-resistant to ALS inhibitors and response to alternative herbicides. Weed Res. 47 (6), 527-533 (2007).
- Collavo, A., Panozzo, S., Lucchesi, G., Scarabel, L., Sattin, M. Characterisation and management of Phalaris paradoxa. resistant to ACCase-inhibitors. Crop Prot. 30 (3), 293-299 (2011).
- Scarabel, L., Carraro, N., Sattin, M., Varotto, S. Molecular basis and genetic characterisation of evolved resistance to ALS-inhibitors in Papaver rhoeas. Plant Sci. 166 (3), 703-709 (2004).
- Panozzo, S., Scarabel, L., Tranel, P. J., Sattin, M. Target-site resistance to ALS inhibitors in the polyploid species Echinochloa crus-galli. Pestic. Biochem. Phys. 105 (2), 93-101 (2013).
- Sattin, M., Berto, D., Zanin, G., Tabacchi, M. Resistance to ALS inhibitors in rice in north-western Italy. Proc. BCPC. Weeds. , Brighton. 783-790 (1999).
- Scarabel, L., Berto, D., Sattin, M. Dormancy breaking and germination of Alisma plantago-aquatica. and Scirpus mucronatus. Aspects of Applied Biology. 69, Wellesbourne, UK. 285-292 (2003).
- Collavo, A., Strek, H., Beffa, R., Sattin, M. Management of an ACCase-inhibitor-resistant Lolium rigidum. population based on the use of ALS inhibitors: weed population evolution observed over a 7 years field-scale investigation. Pest Manag. Sci. 69 (2), 200-208 (2013).
- Scarabel, L., Panozzo, S., Savoia, W., Sattin, M. Target-site ACCase-resistant Johnsongrass (Sorghum halepense). selected in summer dicot crops. Weed Technol. 28 (2), 307-315 (2014).
- Hess, M., Barralis, H., Bleiholder, H., Buhur, L., Eggers, T., Hack, H., Strauss, R. Use of the extended BBCH scale - general for the description of the growth stages of mono- and dicotyledonous weed species. Weed Res. 37 (6), 433-441 (1997).
- Collavo, A., Sattin, M. First glyphosate-resistant Lolium. spp. biotypes found in a European annual arable cropping system also affected by ACCase and ALS resistance. Weed Res. 54 (4), 325-334 (2014).
- Scarabel, L., Cenghialta, C., Manuello, D., Sattin, M. Monitoring and management of imidazolinone-resistant red rice (Oryza sativa. L., var. sylvatica.) in Clearfield® Italian paddy rice. Agronomy. 2 (4), 371-383 (2012).
- Zelaya, I. A., Anderson, J. A. H., Owen, M. D. K., Landes, R. D. Evaluation of spectrophotometric and HPLC methods for shikimic acid determination in plants: Models in glyphosate-resistant and-susceptible crops. J. Agric. Food Chem. 59 (6), 2202-2212 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon