Method Article
Protocolos para Robust Teste de resistência a herbicidas em diferentes espécies de plantas daninhas
Neste Artigo
Resumo
A robust and flexible approach to confirm herbicide resistance in weed populations is presented. This protocol allows the herbicide resistance levels to be inferred and applied to a wide range of weed species and herbicides with minor adaptations.
Resumo
Robust protocols to test putative herbicide resistant weed populations at whole plant level are essential to confirm the resistance status. The presented protocols, based on whole-plant bioassays performed in a greenhouse, can be readily adapted to a wide range of weed species and herbicides through appropriate variants. Seed samples from plants that survived a field herbicide treatment are collected and stored dry at low temperature until used. Germination methods differ according to weed species and seed dormancy type. Seedlings at similar growth stage are transplanted and maintained in the greenhouse under appropriate conditions until plants have reached the right growth stage for herbicide treatment. Accuracy is required to prepare the herbicide solution to avoid unverifiable mistakes. Other critical steps such as the application volume and spray speed are also evaluated. The advantages of this protocol, compared to others based on whole plant bioassays using one herbicide dose, are related to the higher reliability and the possibility of inferring the resistance level. Quicker and less expensive in vivo or in vitro diagnostic screening tests have been proposed (Petri dish bioassays, spectrophotometric tests), but they provide only qualitative information and their widespread use is hindered by the laborious set-up that some species may require. For routine resistance testing, the proposed whole plant bioassay can be applied at only one herbicide dose, so reducing the costs.
Introdução
Os herbicidas são a medida controle de plantas daninhas mais amplamente utilizado, sendo responsável por até 50% do mercado global de proteção de plantas 1. Eles são ferramentas relativamente baratas, evitar práticas de cultivo do solo e demorado de trabalho intensivo, e, finalmente, resultar na produção de custo-eficaz, segura e rentável comida 2. No entanto, a grande variabilidade genética fenológico e presente em muitas espécies de plantas daninhas, em conjunto com um excesso de confiança no uso de herbicidas, freqüentemente resulta na seleção de populações de plantas daninhas resistentes a herbicidas. A introdução de herbicidas selectivos com um alvo metabólica muito específico 3-5 aumentou dramaticamente o número de casos de resistência ao longo dos anos. Até o momento, 240 espécies de plantas daninhas dicotiledôneas (140 e 100 monocotiledôneas) no mundo todo desenvolveram resistência a diferentes herbicidas Sites de Ação (SoA) 4. Esta é uma grande preocupação para manejo de plantas daninhas e mais em geral, para a produção agrícola sustentável.
e_content "> A detecção precoce da resistência, com base em testes confiáveis, freqüentemente realizados em casa de vegetação, é um passo fundamental para manejo de ervas daninhas resistentes a herbicidas. Diferentes abordagens têm sido desenvolvidas de acordo com os objectivos, necessário nível de precisão, o tempo e os recursos disponíveis, como bem como as espécies de ervas daninhas considerados 12/06. No entanto, quando é requerida a confirmação do estado de resistência de um novo biótipo de ervas daninhas (isto é, um grupo de indivíduos que partilham várias características fisiológicas, incluindo a capacidade de sobreviver a um ou mais herbicidas pertencentes a um grupo particular utilizado a uma dose que normalmente controlá-los), uma planta inteira robusta bioensaio tem de ser realizada num ambiente controlado, 4, 11.Um biótipo raramente é resistente a apenas um herbicida. Cada biótipo é, portanto, caracterizada por um determinado padrão de resistência, isto é, o número e tipo de SOA dos herbicidas é resistente a, e por uma dada resistêncianível de cada herbicida 13. A determinação precoce e confiável do padrão de cruz ou resistência múltipla 5, 14 é importante para o manejo da resistência de campo.
Vale ressaltar que a resistência a herbicidas tem nada a ver com a tolerância natural que algumas exposições de plantas daninhas em relação a alguns herbicidas, por exemplo, espécies dicot vs. herbicidas inibidores da ACCase, espécies monocotiledôneas vs. 2,4-D, Equisetum arvense vs. glifosato.
Este artigo apresenta uma abordagem robusta para testar biótipos resistentes a herbicidas putativo amostradas em campos onde mau controle por herbicida (s) haviam sido relatados. Variantes relevantes para os protocolos padrão em relação às espécies de plantas daninhas envolvidos são apresentados. As vantagens sobre as técnicas alternativas / protocolos baseados em inteiros quer bioensaios vegetais utilizando apenas uma dose de herbicida 15, ou o tratamento de sementes em placas de Petri de 8 estão relacionados com a maior reliability e inferir a possibilidade de o nível de resistência devido à inclusão de duas doses do herbicida nas experiências. No entanto, para o teste de resistência de rotina, os mesmos métodos podem ser aplicados no apenas uma dose do herbicida, assim reduzindo os custos.
Bem como permitindo a confirmação do estado de resistência, a informação obtida pode ser usada para optimizar tanto as seguintes etapas de pesquisa e / ou a concepção de estratégias de gestão da resistência de som.
Protocolo
1. As sementes de amostragem e armazenamento
- Monitorar campos cultivados para injustificada mau desempenho herbicida, ou seja, não devido a condições climáticas desfavoráveis ou a tratamentos herbicidas de baixa qualidade.
- Coletar uma amostra de sementes de uma espécie de cada vez e atribuir um código único. As sementes maduras são geralmente recolhidos antes da colheita das culturas de plantas que haviam sobrevivido ao tratamento (s) herbicida. Monitor de oportuna para observar se as sementes são derramadas por planta mãe quando maduro.
- Preencher um formulário para cada amostra, indicando o código único atribuído, o nome da espécie, data da coleta, coordenadas GPS, município, nome do fazendeiro, tamanho do campo, nível de infestação, colheita, herbicida (s) utilizados durante a temporada e registros históricos do campo .
- Coletar sementes de pelo menos 30 plantas selecionadas aleatoriamente, que sejam representativas da infestação campo. Certifique-se de que a amostra de sementes contém pelo menos 5.000 sementes maduras. Para um obrigatórios de cruzamento espécies de plantas daninhas(Por exemplo, Lolium spp. Ou Amaranthus spp.), Reduzir o número de plantas a 10-15, mantendo-se o número total de sementes em torno de 5000 11.
- Sub-provar o campo se manchas de ervas daninhas estão espalhados em grandes áreas (mais de um hectare) como diferentes biótipos resistentes a herbicidas são selecionados.
- Armazene sementes em sacos de papel sem lacre marcados com o código único atribuído.
- Permitir que a umidade evapore, mas não exponha sementes a alta temperatura (isto é, evite deixá-los em um carro sob o sol) ou a flutuações extremas de temperatura para evitar a indução de dormência secundária.
- Limpo (remover palha, sementes de-casco, etc.) e armazená-los à temperatura ambiente em um quarto seco. Após a realização dos testes de resistência primeiros, armazenar as sementes por longos períodos de tempo em um quarto escuro a 4 ° C, de preferência em selado a vácuo sacos de plástico. Em desta forma preservar a sua viabilidade das sementes por um tempo significativamente maior.
2. Semente quebra de dormência
NOTA: dormência das sementes fornece um mecanismo flexível e eficiente que permite que as ervas daninhas se adaptar e persistem em agro-ecossistemas. Para quebrar a dormência e permitir a germinação de sementes, protocolos diferentes têm de ser utilizados dependendo das espécies de ervas daninhas, isto é, o tipo de dormência 16.
Existem três maneiras principais para remover dormência:
- Vernalização
NOTA: Para obter germinação e emergência das plântulas em simultâneo, um período de vernalização semente que varia de alguns dias a uma semana é necessária para remover dormência fisiológica de muitas espécies.: Por exemplo, Amaranthus retroflexus, Chenopodium album, Lolium spp, Avena fátua, persicaria Polygonum , Phalaris paradoxa 17-19. É necessário um longo período de até 15 dias para rhoeas, difformis Cyperus e Ammania coccinea e até 30 dias para Schoenoplectus mucronatus 20.- Coloque um pouco de água deionizada em pratos de plástico. Corte duas camadas de papel de filtro e mergulhe-os em água, retire todo o excesso. Coloque as sementes secas ao ar no papel. Transferir as placas de plástico para um frigorífico a 4 ° C durante o período de tempo requerido.
- Escarificação
NOTA: Algumas espécies de plantas daninhas são mais recalcitrante a germinação do que outros devido a dormência mecânica, ou seja, características do revestimento de semente, e exigir a utilização de uma escarificação química usando ácido sulfúrico a germinar 21.- Prepara-se uma proveta com ácido sulfúrico concentrado (95-98%). Prepare um copo cheio de água. Coloque as sementes num envelope de tecido não-tecido.
- Soak, por exemplo, Echinochloa spp. Sorghum halepense ou sementes durante 20 minutos ou 5 minutos, respectivamente, em ácido sulfúrico concentrado.
- Pegue o envelope para fora do copo usando um par de pinças e colocá-lo no copo cheio de água. Abra oenvelope, coloque as sementes em um pequeno coador e lave-os com água corrente.
- Embeber as sementes durante 2 min em clorofórmio. Lave as sementes com água deionizada e seque-os com papel absorvente. Húmido das sementes em ácido sulfúrico 80% durante 5 min.
- Coloque as sementes em um pequeno coador e lave-os com água corrente.
- Maturação das sementes pós-colheita
NOTA: Sementes de outras espécies de plantas daninhas não germinam em tudo por alguns meses após o vencimento, independentemente do método utilizado para quebrar a dormência.- Armazenar as sementes por um período de, pelo menos, 3-4 meses à temperatura ambiente e baixa umidade e siga os protocolos acima para quebra de dormência (por exemplo, Oryza sativa var. Sylvatica ou P. rhoeas).
A germinação 3. Semente
- Coloque as sementes de ser germinadas em plastic pratos contendo 0,6% (v / m) de ágar com nitrato de potássio a 0,1% (KNO 3) adicionado:
- Prepara-se uma solução de agar a 0,6% + 0,1% de KNO 3 usando água desionizada. Dissolve-se o ágar em um forno de microondas.
- Despeje a solução agar em pratos de plástico. Arrefecer o substrato e, em seguida, colocar nas sementes.
- Coloque pratos de plástico em uma câmara de germinação por cerca de uma semana com luz e temperatura condições, dependendo das condições óptimas para cada espécie de erva daninha. Para a maioria das espécies de inverno, a temperatura é 15/25 ° C dia / noite e 12 horas de fotoperíodo com tubos de néon proporcionando uma densidade de fluxo de fótons fotossintéticos (DFFF) de 15-30 mol m -2 s -1. Para muitas espécies de verão, a gama de temperaturas é de 15/30 ° C dia / noite.
Variante: Some espécies, tais como S. halepense, precisa de um tratamento térmico. Portanto, após a escarificação, as sementes de S. halepense são submetidos às seguintes condições: ciclos de 4 horas a 45 ° C e 20 h a 24 ° C durante três dias no gabinete de germinação, e, em seguida, três dias em condições normais.
4. das mudas e Crescimento
- Transplante de quinze a vinte mudas em bandejas plásticas (325 x 265 x 95 mm) carregada com uma mistura padrão de envasamento (60% solo franco silty, 15% de areia, 15% e 10% agriperlite turfa - por volume).
NOTA: O transplante, em vez de sementeira directa, permite um suporte uniforme de plantas, na mesma fase de crescimento a ser obtido, que é um importante pré-requisito para optimizar o rendimento do tratamento com herbicida. - Identificar cada bandeja com um código de barras, incluindo todas as informações para a identificação única: Código população, herbicida que está sendo testado, replicar número e número da bandeja progressiva <./ Li>
- Coloque as bandejas em uma aquecida com efeito de estufa e água plantas como necessários para manter o substrato em ou perto de capacidade de campo.
NOTA: A temperatura de crescimento varia dependendo das espécies de ervas daninhas. Muitas vezes, os testes são feitos durante o outono / inverno / primavera, para que a luz é completada utilizando lâmpadas de 400 W halógenas, que fornecem uma PPFD de cerca de 150 mol m -2 s -1 e fotoperíodo de 12 h 24, 19 espécies de plantas daninhas. Verão com C 4 ciclo fotossintético geralmente exigem maior intensidade de luz e, portanto, os testes são feitos no final de primavera-verão ou a intensidade da luz é completada cerca de 400 mol m -2 s -1 com um fotoperíodo de 14 horas. - Use um protocolo diferente para algumas espécies de plantas daninhas que infestam o arroz em casca, por exemplo, A. plantago-aquatica, S. mucronatus e C. difformis, tal como descrito em 22.
- Transplante as mudas em bandejas de poliestireno com 24 células redondas (55 mm de diâmetro, 64 mm de profundidade) filliderou com 60% solo franco silty, 30% de areia e 10% de turfa (em volume).
- Definir as bandejas 12 centímetros em recipientes de plástico cheios de água profundas e battened para baixo por hastes de aço inoxidável para impedi-los aparafusadas flutuante (Figura 1).
- Manter o nível de água nos recipientes em 1-2 cm abaixo do nível da superfície do solo e adicionar 1,5 g de sulfato de cobre para cada recipiente (que contém 10-12 L de água) para evitar a proliferação de algas.
5. tratamentos herbicidas
- Os tratamentos com herbicidas pré-emergentes:
- Após cerca de três dias na câmara de germinação, conforme descrito na seção 3, transplantar as sementes germinam em bandejas plásticas contendo substrato descrito acima e cubra com uma camada de solo (cerca de 1 cm). Este é um passo crítico para assegurar que as plantas não vão emergir devido ao efeito herbicida em vez de uma profundidade de enterramento excessiva.
- Leve o substrato para o campo capacidade, colocando os tabuleiros, que têm alguns furos na parte inferior, sobre discos cheios de água.
- Um dia após o transplante, tratar as bandejas com o herbicida pré-emergência 25.
- Manter o substrato na ou perto da capacidade de campo por adição de água conforme necessário, tanto a partir de cima e abaixo, por capilaridade a partir do disco. Este procedimento favorece a permanência do herbicida na profundidade apropriada (isto é, onde as sementes em germinação são) para uma boa eficácia do tratamento.
- Os tratamentos com herbicidas pós-emergentes:
- Spray de plantas quando atingem a fase de 2-3 folhas (isto é, fase de crescimento 12-13 da escala de crescimento BBCH estendida 26).
- A partir do dia após o tratamento, defina o sistema de irrigação de acordo com as necessidades de água das espécies de plantas daninhas e da época (por exemplo, para Echinochloa spp. Que fornece água para 3 min 4 vezes por dia, em intervalos regulares, das 9 horas às 9 pm). A água é disbuído usando um sistema de irrigação por aspersão automática.
Variante: glifosato é aplicada na planta fase BBCH 14-21.
- Preparação herbicida e distribuição.
NOTA: Todos os herbicidas (pré e pós-emergência) são aplicadas como formulações comerciais com surfactantes recomendadas em duas doses, dose recomendada campo (1x) e três vezes que (3x).- Se necessário, preparar a solução de agente tensioactivo em massa de acordo com as instruções do rótulo; a concentração final é normalmente expresso como uma percentagem do volume final (por exemplo, 0,3%) ou como o volume a ser distribuído por unidade de área (por exemplo, 1 L ha -1).
- Utilizar a solução de agente tensioactivo, como solvente para a solução de herbicida (soluto) de modo a manter a concentração correcta do ingrediente activo. Preparar a solução herbicida mais concentrada primeiro (3x). Calcular a quantidade do produto comercial para ser dissolvido na solução de agente tensioactivo (ou em água desionizada se umtensioactivo não é necessário) usando a seguinte equação:
Dose erva = [(Dose Dose campo x max) x V aleta] / V del
Onde: Dose erva = dose de herbicida (ml), de dose Dose campo = campo herbicida (ml ha -1), Dose Max = dose máxima entregue, V fin = volume final da solução (l), V del = volume entregue pela Pulverizador banco (L ha -1). - Diluir (2: 1, v / v) a solução 3x herbicida para preparar o menos concentrada (1x). Este procedimento reduz a chance de cometer erros quando pesagem ou pipetando os herbicidas. Concentração da solução herbicida é expressa como o volume a ser distribuído por unidade de área (L ha -1).
- Iniciar a sequência de tratamento com a dose de herbicida inferior (1x). Desta forma não há necessidade de lavar o armário de pulverização entre dois tratamentos com o mesmo herbicida.
- Distribua o solutio herbicidan, usando um pulverizador de banco precisão entregar 300 L ha -1 (± 1%), a uma pressão de 215 kPa e uma velocidade de 0,75 m seg-1, com um braço equipado com três ventoinha plana (faixa estendida) bicos hidráulicos .
- Lave o gabinete de pulverização duas vezes quando o herbicida é alterada utilizando água sanitária 1% (v / v) e depois enxaguar.
Variante: glifosato é aplicado com um volume de calda de 200 L ha -1 27.
NOTA: Particular atenção tem de ser pago quando herbicidas altamente biológicos, como o sulfometuron sulfoniluréias ou flazasulfuron, são usados. Neste último caso, fazer uma lavagem com uma solução alcalina e um outro com amónia (2,5% v / v), seguido de uma lavagem cuidadosa com água.
6. Coleta e análise dos dados
- Através de um leitor de código de barras, que identifica automaticamente cada bandeja, gravar o número de plantas que sobreviveram ao tratamento, bem como a biomassa Visual estimado (VEB). As plantas são assEssed como sendo mortos se eles não mostram o crescimento ativo independentemente da cor ou outra aparência.
- Faça a avaliação de três ou quatro semanas após o tratamento (WAT), dependendo dos herbicidas testados (por exemplo, três WAT para os inibidores de ACCase e quatro WAT para os inibidores de ALS ou glifosato).
- Avaliar a eficácia do tratamento geral, incluindo uma população suscetível (verifique S) em todos os experimentos, ou seja, uma população coletada em um site que nunca ou raramente tratado com herbicidas era.
- Expresso de sobrevivência das plantas, como percentagem do número de plantas tratadas, contado imediatamente antes do tratamento herbicida, e calcular o erro padrão (EP) por valor médio (valor das duas repetições média).
- O VEB é obtido através de uma comparação visual de biomassa vegetal entre tratados e não-tratados de verificação da mesma população 25, 28. Um escore, variando de 10 para as plantas não afetadas pelo herbicida (em comparação com o check-tratados não) para 0 quandoas plantas são claramente morta, é dada a cada bandeja tratada.
- Populações atribuir a quatro categorias com base nos resultados obtidos a partir dos tratamentos com duas doses de herbicida: S, quando menos do que 5% das plantas sobreviveram os 1x dose do herbicida, quando SR sobreviventes variou de 5% a 20% em 1x dose do herbicida, quando mais do que R 20% das plantas sobreviveram os 1x dose do herbicida e RR sobreviventes quando são mais do que 20% na dose de herbicida 1x e mais do que 10% na dose de herbicida 3x 17.
Resultados
Para avaliar o estado de resistência de uma população resistente putativo, é fundamental para incluir um controlo susceptível no ensaio, a fim de verificar a eficácia do herbicida. Os resultados de um teste de rastreio realizados em P. populações rhoeas, uma erva daninha infestante campos de trigo, são relatados na Figura 2, onde a eficácia de quatro herbicidas em pós-emergência sobre um cheque suscetível (09-36) e sobre a suspeita de um resistente (10-91) são apresentados. População 09-36 foi completamente controlado pelos inibidores da ALS iodossulfurão enquanto apenas uma planta sobreviveu de dose 1x dos outros dois herbicidas testados ALS, florasulame e tribenurão-metilo (Figura 2). Em vez disso, cerca de 60% das plantas da população 10-91 sobreviveram ambas as doses do herbicida de iodossulfurão e tribenurão-metilo e cerca de 50% sobreviveram a dose de 1x florasulame. Estes resultados confirmam que a população 10-91 é altamente resistente (RR) para iodossulfurão e tribenurão-metilo e resistente(R) a florasulame. Uma resposta diferente foi observada com 2,4-D, um herbicida tendo uma SOA diferente (isto é, simula um auxina endógena), amplamente utilizado para controlar as ervas daninhas dicotiledóneas em trigo. Apenas 33% das plantas da verificação de S foram mortos com este herbicida na dose 1x eo valor VEB era> 20% (Figura 2). A falta de eficácia na população de seleção não confirma se a população 10-91 é resistente ao herbicida ou não. Neste caso, recomenda-se a realização da experiência e novamente se os resultados forem confirmados, a alteração da população S. Um exemplo de um bom controlo da verificação susceptível é apresentado na Figura 3. A Echinochloa spp. população 07-16L foi completamente controlado por todos os herbicidas na dose recomendada campo (1x). Neste caso, é possível afirmar que a população 08-42 é altamente resistência cruzada a todos os inibidores de ALS testados, ou seja, azimsulfuron, bispiribac-Na, imazamox e penoxsulam. O ch tratado não-eck de ambas as populações é relatado à esquerda. Estas plantas são utilizados para calcular o VEB; a quantidade de biomassa é estimada visualmente por bandeja bandeja dando uma pontuação de 10 para a verificação não-tratadas e em seguida atribuindo uma pontuação de 0, para a replicar sem qualquer tecido da planta verde, a 10 quando a biomassa é comparável ao tratamento não- verificar (Figura 3).
Outro exemplo de saída é apresentado na Figura 4, onde a sobrevivência da planta de Lolium spp. ao glifosato é mostrado. As populações testadas foram coletados em sistemas de cultivo à base de trigo, onde o glifosato está exercendo pressão de seleção diferente (ou seja, ocasionalmente ou 1-2 tratamentos por ano ou 3-mais vezes por ano). As plantas foram pulverizadas na fase de perfilhamento cedo (BBCH 14-21), utilizando duas doses de glifosato: 480 e 1.440 g ea ha -1, que representam a dose máxima recomendada campo mínimo e para as ervas daninhas anuais (ou seja, terófitos) em que o crescimento stidade. Os dados foram recolhidos quatro semanas após tratamento. Com base em ambos os experimentos, sete das populações testadas tiveram uma taxa de sobrevivência de 80% ou mais populações (343, 383, 384, 403, 509, 512 e 537) com a dose mais baixa aplicada, mas apenas 50% de plantas de populações 403 e 509 sobreviveu à dose mais elevada de glifosato. Uma população tinha uma taxa de sobrevivência de cerca de 40% em 1x de dose, enquanto que apenas alguns plantas de população 509 sobreviveram a dose mais baixa e população 508 foi totalmente controlada em qualquer dose. Em resumo, estas experiências mostraram diferentes níveis de resistência ao glifosato que reflectiam frequentemente a história domínio da utilização de herbicidas. O nível de resistência ao glifosato foi maior para as populações que tinham sido tratados mais intensamente, ou seja, o número de aplicações de campo por ano e o número de anos de pressão de selecção foi mais elevada.
O protocolo descrito por um herbicida (Figura 4) pode ser aplicada a muitos outros que têm difealugar SoA; Deste modo, o padrão de resistência de uma ou mais populações podem ser determinadas. Um exemplo de resistência variabilidade padrão de Echinochloa spp. populações é relatado na Tabela 1. Os registros históricos de uso de herbicidas e manejo da cultura obtida a partir do agricultor indicaram que os herbicidas inibidores da ALS foram o agente selecionador (ou seja, penoxsulam ou imazamox). O teste de resistência foi, portanto, realizada com três inibidores da ALS (azimsulfurão, herbicida penoxsulam e imazamox) pertencentes a diferentes famílias de produtos químicos, e um herbicida ter outro SoA, o profoxidime herbicida inibidor de ACCase. A verificação susceptível (07-16L) foi completamente controlado por todos os herbicidas testados (Tabela 1). Foram detectados três padrões de resistência: treze populações resultou como sendo resistentes somente a inibidores de ALS, quatro populações resultou de ser resistente somente ao profoxidime inibidor ACCase, e três populações apresentaram um múltiplo padrão de resistência tanto ao profoxidime inibidor ACCase e inibidores de ALS. Dentro de cada padrão de resistência que é possível distinguir diferentes biótipos, por exemplo, quatro populações resistentes a inibidores da ALS sobreviveram apenas tratamentos com o azimsulfurão sulfonilureia, enquanto duas das populações multirresistentes sobreviveu apenas o tratamento com o inibidor ALS azimsulfurão, mas foram bastante controlados por penoxsulame e imazamox.

Figura 1. Exemplo de C. difformis, uma espécies de plantas daninhas que infestam o arroz em casca, experiência set-up. bandejas de poliestireno são colocadas em recipientes plásticos e bloqueado por hastes de aço inoxidável parafusado para impedi-los flutuando. A água é mantida a 1-2 cm abaixo do nível da superfície do solo para imitar as condições de arroz em casca. A fotografia foi tomada quatro semanas após o tratamento.p_upload / 52923 / "target =" _ blank 52923fig1large.jpg "> Clique aqui para ver uma versão maior desta figura.

Figura 2. Resposta de duas P. rhoeas populações de herbicidas pós-emergência. Efeito do iodossulfurão, tribenurão, florasulame e 2,4-D testados na dose recomendada campo (1x) e três vezes que (3x) na sobrevivência das plantas (as barras azuis) e biomassa estimativa visual ( VEB; barras vermelhas) da verificação de suscetíveis (09-36) e de uma população resistente (10-91). A avaliação foi feita de quatro semanas após o tratamento com herbicida. A sobrevivência da planta e VEB são expressos como percentagem do número de plantas tratadas e VEB dos controlos tratados com não (%). A linha horizontal a 20% de sobrevivência das plantas representa o limiar de discriminação entre as populações resistentes e suscetíveis quando as plantas são tratadas em 1x dose. As barras verticaisrepresentam erros padrão calculados sobre o valor médio das duas repetições. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Os resultados visuais de uma triagem em dois Echinochloa spp. populações. A verificação susceptíveis, 07-16L (S), e a população resistente, 08-42, foram testados com quatro inibidores de ALS (reportada à direita) em duas doses, 1x e 3x, relatados (na parte inferior). Para a verificação de S apenas resultados de 1x doses são relatados, porque todas as plantas já foram controlados em que dose. Três exemplos de pontuação VEB são relatados em vermelho: 0 = todas as plantas mortas, 10 = todas as plantas sobreviveram e biomassa é comparável com o cheque não-tratados (NT) (reportado à esquerda), 5 = biomassa é cerca de metade do que em uma bandeja do tratado não-verificar. Por favor clique aqui para ver uma versão maior desta figura.
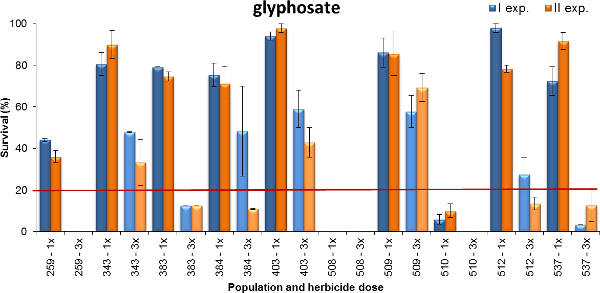
Figura 4. Percentagem de sobrevivência das plantas durante dez Lolium spp. populações testadas com a sobrevivência glifosato. Planta gravado em dois experimentos (barras azuis e bares laranja para exp. I e II, respectivamente). Os dados são expressos como uma percentagem (%) do número de plantas tratadas. Dois controlos sensíveis foram totalmente controlada na dose 1x e portanto não são relatados no gráfico. Foram testadas duas doses, o mínimo (1x = 480 g ea ha -1) e máximo (3x = 1.440 g ea ha -1) doses referidas no rótulo do produto. A linha horizontal a 20% de sobrevivência das plantas representa o limiar de discriminação entre as populações resistentes e suscetíveis quando as plantas estavam deleiteed em 1x dose. As barras verticais representam erros padrão calculados sobre o valor médio das duas repetições. Por favor clique aqui para ver uma versão maior desta figura.
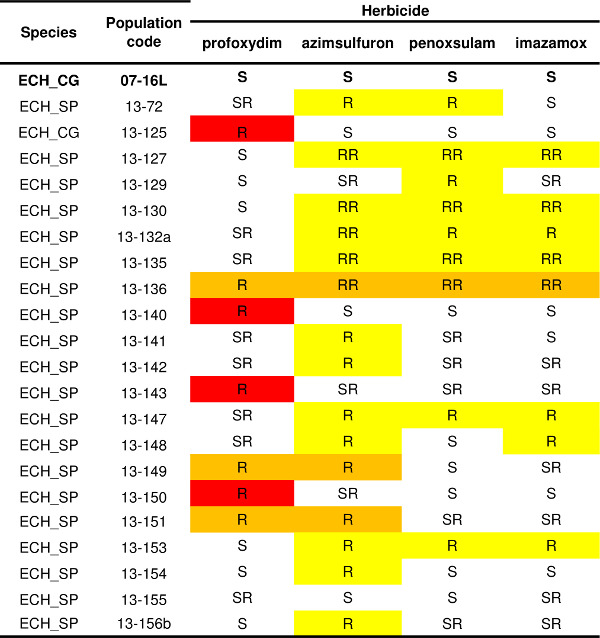
Tabela 1. Resistência estado de vinte e uma populações de Echinochloa spp. Verificação Suscetíveis (07-16L) é relatada em negrito. Os níveis de resistência são referidos para cada um dos quatro herbicidas testados (um inibidor ACCase, profoxidime, e três inibidores de ALS, azimsulfurão, penoxsulam e imazamox) de acordo com quatro categorias: S = menos de 5% das plantas sobreviveram à dose de herbicida 1x, SR = sobrevivência das plantas variou de 5% a 20% em 1x dose do herbicida, R = mais de 20% das plantas sobreviveram os 1x dose do herbicida, RR = sobrevivência da planta era mais do que 20% na dose de herbicida1x e mais de 10% na dose de 3x. Diferentes padrões de resistência são realçados: vermelho = resistência apenas à inibidor ACCase, amarelo = resistência única aos inibidores da ALS (s), laranja = resistência ao inibidor ACCase e a pelo menos um inibidor de ALS.
Discussão
Várias medidas no âmbito dos protocolos são críticos para uma avaliação bem sucedida de resistência a herbicidas em uma população: 1) sementes devem ser coletadas quando madura a partir de plantas que sobreviveram ao tratamento (s) herbicida. Maturação das sementes na planta mãe é crucial para evitar dificuldades na germinação das sementes mais tarde; 2) É recomendado o armazenamento adequado das sementes para evitar a proliferação de fungos que possam impedir a germinação; 3) mudas devem ser tratadas na fase de crescimento para a direita, tal como indicado no rótulo da embalagem herbicida. Deve ser tomado cuidado de modo que as plantas a ser tratada, atingiram, aproximadamente, a mesma fase de crescimento; 4) as soluções do herbicida deve ser preparado e manuseado com precisão de modo que as plantas são pulverizadas com a concentração correcta de ingrediente activo, por conseguinte, evitar os erros não verificáveis; 5) depois de cada tratamento herbicida, recomenda-se limpar completamente o gabinete de pulverização e copos usados para preparar as soluções para evitarcontaminação na seguinte tratamento herbicida, especialmente quando herbicidas altamente biologicamente activos estão envolvidos.
Os protocolos aqui apresentados podem ser rapidamente adaptados a uma vasta gama de espécies de ervas daninhas, com as modificações necessárias de acordo com a espécie de interesse e herbicidas. Em particular, os métodos para quebrar a dormência das sementes e para a germinação são passos que devem ser reexaminadas para cada nova espécie de plantas daninhas (ver secções 2 e 3). Equipamento de pulverização, por vezes, necessita de ajustes quando diferentes herbicidas são usados, por exemplo, o glifosato requer diferentes configurações do gabinete de pulverização (ver secção 5.3) e as plantas são tratadas numa fase de crescimento mais tarde do que a maioria dos herbicidas.
O tempo e espaço necessário para realizar estes protocolos podem ser um factor limitativo e pode não ser adequado para testes de rotina. No entanto, para limitar os custos, apenas uma dose de herbicida podem ser usadas. Desta forma, a informação pode ainda ser obtido na se tele população é resistente. Uma limitação da abordagem potencial está relacionado com o facto de que não há controlos resistentes estão incluídos nas experiências. Na verdade, devido ao grande número de biótipos avaliadas (ou seja, diferentes espécies envolvidas e herbicidas), muitas verificações devem ser incluídos em cada experiência, de modo a aumentar os custos.
No entanto, as vantagens sobre as técnicas / protocolos alternativos baseados em bioensaios planta inteira usando apenas um herbicida de dose 15 está relacionado com a maior fiabilidade e a possibilidade de se inferir o nível de resistência. Testes rápido e menos dispendioso de pesquisa de diagnóstico também têm sido desenvolvidos, in vivo ou in vitro (por exemplo, os bioensaios prato de Petri 8, ensaios espectrofotométricos de herbicida enzima alvo 29). No entanto, eles só fornecem informações qualitativas e exigir algum trabalho preliminar, às vezes trabalhoso, identificar a dose herbicida para discriminar entre resplantas istant e suscetíveis. Os ensaios in vitro também têm de ser adaptados de acordo com o princípio ativo utilizado.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
The research was supported by the National Research Council (CNR) of Italy. The authors thank GIRE members for collecting seed samples and are grateful to Alison Garside for revising the English.
Materiais
| Name | Company | Catalog Number | Comments |
| Paper bags | Celcar SAS | ||
| Plastic dishes | ISI plast S.p.A. | SO600 | Transparent plastic |
| Sulfuric acid 95-98% | Sigma-Aldrich | 320501 | |
| Non-woven fabric | Carretta Tessitura | Art.TNT17 | Weight 17 g m-2 |
| Chloroform >99.5% | Sigma-Aldrich | C2432 | |
| Agar | Sigma-Aldrich | A1296 | |
| Potassium nitrate >99.0% | Sigma-Aldrich | P8394 | |
| Plastic containers | Giganplast | 1875/M | 600 x 400 x 110 mm |
| Plastic trays | Piber plast | G1210A | 325 x 265 x 95 mm |
| Polystyrene trays | Plastisavio | S24 | 537 x 328 x 72 mm, 24 round cells (6x4) |
| Copper sulfate | Sigma-Aldrich | 451657 | |
| Agriperlite | Blu Agroingross sas | AGRI100 | |
| Peat | Blu Agroingross sas | TORBA250 | |
| Germination cabinet | KW | W87R | |
| Nozzles | Teejet | XR11002-VK, TP11001-VH | The second type of nozzles are used only for glyphosate |
| Barcode generator | Toshiba TEC | SX4 | |
| Labels with barcode | Felga | TT20200 | Stick-in labels with rounded corners |
| Barcode reader | Cipherlab | 8300-L | Portable data terminal |
| Bench sprayer | Built in house | ||
| Herbicides included in the results: | |||
| Commercial product | Active ingredient | Company | Comments |
| Altorex | imazamox | BASF | |
| Azimut | florasulam | Dow AgroSciences | |
| Biopower | Bayer Crop Science | Surfact to be used with Hussar WG | |
| Dash | BASF | Surfact to be used with Altorex | |
| Granstar | tribenuron-methyl | Dupont | |
| Gulliver | azimsulfuron | Dupont | |
| Hussar WG | iodosulfuron | Bayer Crop Science | |
| Nominee | bispyribac-Na | Bayer Crop Science | |
| Roundup | glyphosate | Monsanto | |
| Trend | Dupont | Surfact to be used with Granstar and Gulliver | |
| Viper | penoxsulam | Dow AgroSciences | |
| Weedone LV4 | 2,4-D | Isagro | |
Referências
- Massa, D., Kaiser, Y. I., Andújar-Sánchez, D., Carmona-Alférez, R., Mehrtens, J., Gerhards, R. Development of a geo-referenced database for weed mapping and analysis of agronomic factors affecting herbicide resistance in Apera spica-venti L. Beauv. (Silky Windgrass). Agronomy. 3 (1), 13-27 (2013).
- Powles, S. B., Shaner, D. L. Herbicides Resistance and World Grains. , CRC Press LLC. Raton, FL. 308(2001).
- Sattin, M. Herbicide resistance in Europe: an overview. Proc. BCPC International Congress. , Crop Science & Technology. UK. 131-138 (2005).
- Heap, I. M. International Survey of Herbicide Resistant Weeds. , Available from: http://www.weedscience.org (2015).
- Jasieniuk, M., Le Corre, V. Deciphering the evolution of herbicide resistance in weeds. Trends Genet. 29 (11), 649-658 (2013).
- Heap, I. M. Identification and documentation of herbicide resistance. Phytoprotection. 75 (4), 85-90 (1994).
- Beckie, H. J., Heap, I. M., Smeda, R. J., Hall, L. M. Screening for herbicide resistance in weeds. Weed Technol. 14 (2), 428-445 (2000).
- Tal, A., Kotoula-Syka, E., Rubin, B. Seed-bioassay to detect grass weeds resistant to acetyl coenzyme A carboxylase inhibiting herbicides. Crop Prot. 19, 467-472 (2000).
- Boutsalis, P. Syngenta Quick-Test: a rapid whole-plant test for herbicide resistance. Weed Technol. 15 (2), 257-263 (2001).
- Menchari, Y., et al. Weed response to herbicides: regional-scale distribution of herbicide resistance alleles in the grass weed Alopecurus myosuroides. New Phytol. 171 (4), 861-874 (2006).
- Burgos, N. R., et al. Review: confirmation of resistance to herbicides and evaluation of resistance levels. Weed Sci. 61 (1), 4-20 (2013).
- Owen, M. J., Martinez, N. J., Powles, S. B. Multiple herbicide-resistant Lolium rigidum. (annual ryegrass) now dominates across the Western Australian grain belt. Weed Res. 54 (3), 314-324 (2014).
- Herbicide Resistance Action Committee. Classification of herbicides according to site of action. , Available from: http://www.hracglobal.com/Education/ClassificationofHerbicideSiteofAction.aspx (2015).
- Beckie, H. J., Tardif, F. J. Herbicide cross resistance in weeds). Crop Prot. 35, 15-28 (2012).
- Moss, S. R., et al. The occurrence of herbicide-resistant grass-weeds in the United Kingdom and a new system for designating resistance in screening assays. Proc. BCPC Weeds. , Brighton. 179-184 (1999).
- Baskin, C. C., Baskin, J. M. Seeds, Ecology, Biogeography and Evolution of dormancy and Germination. , Academic Press. San Diego, USA. 27-42 (1998).
- Sattin, M., Gasparetto, M. A., Campagna, C. Situation and management of Avena sterilis. ssp. ludoviciana. and Phalaris paradoxa. resistant to ACCase inhibitors in Italy. Proc. BCPC - Weeds. , Brighton, UK. 755-762 (2001).
- Scarabel, L., Varotto, S., Sattin, M. A European biotype of Amaranthus retroflexus. cross-resistant to ALS inhibitors and response to alternative herbicides. Weed Res. 47 (6), 527-533 (2007).
- Collavo, A., Panozzo, S., Lucchesi, G., Scarabel, L., Sattin, M. Characterisation and management of Phalaris paradoxa. resistant to ACCase-inhibitors. Crop Prot. 30 (3), 293-299 (2011).
- Scarabel, L., Carraro, N., Sattin, M., Varotto, S. Molecular basis and genetic characterisation of evolved resistance to ALS-inhibitors in Papaver rhoeas. Plant Sci. 166 (3), 703-709 (2004).
- Panozzo, S., Scarabel, L., Tranel, P. J., Sattin, M. Target-site resistance to ALS inhibitors in the polyploid species Echinochloa crus-galli. Pestic. Biochem. Phys. 105 (2), 93-101 (2013).
- Sattin, M., Berto, D., Zanin, G., Tabacchi, M. Resistance to ALS inhibitors in rice in north-western Italy. Proc. BCPC. Weeds. , Brighton. 783-790 (1999).
- Scarabel, L., Berto, D., Sattin, M. Dormancy breaking and germination of Alisma plantago-aquatica. and Scirpus mucronatus. Aspects of Applied Biology. 69, Wellesbourne, UK. 285-292 (2003).
- Collavo, A., Strek, H., Beffa, R., Sattin, M. Management of an ACCase-inhibitor-resistant Lolium rigidum. population based on the use of ALS inhibitors: weed population evolution observed over a 7 years field-scale investigation. Pest Manag. Sci. 69 (2), 200-208 (2013).
- Scarabel, L., Panozzo, S., Savoia, W., Sattin, M. Target-site ACCase-resistant Johnsongrass (Sorghum halepense). selected in summer dicot crops. Weed Technol. 28 (2), 307-315 (2014).
- Hess, M., Barralis, H., Bleiholder, H., Buhur, L., Eggers, T., Hack, H., Strauss, R. Use of the extended BBCH scale - general for the description of the growth stages of mono- and dicotyledonous weed species. Weed Res. 37 (6), 433-441 (1997).
- Collavo, A., Sattin, M. First glyphosate-resistant Lolium. spp. biotypes found in a European annual arable cropping system also affected by ACCase and ALS resistance. Weed Res. 54 (4), 325-334 (2014).
- Scarabel, L., Cenghialta, C., Manuello, D., Sattin, M. Monitoring and management of imidazolinone-resistant red rice (Oryza sativa. L., var. sylvatica.) in Clearfield® Italian paddy rice. Agronomy. 2 (4), 371-383 (2012).
- Zelaya, I. A., Anderson, J. A. H., Owen, M. D. K., Landes, R. D. Evaluation of spectrophotometric and HPLC methods for shikimic acid determination in plants: Models in glyphosate-resistant and-susceptible crops. J. Agric. Food Chem. 59 (6), 2202-2212 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados