Method Article
Los protocolos para pruebas de resistencia a los herbicidas robusta en diferentes especies de malezas
En este artículo
Resumen
A robust and flexible approach to confirm herbicide resistance in weed populations is presented. This protocol allows the herbicide resistance levels to be inferred and applied to a wide range of weed species and herbicides with minor adaptations.
Resumen
Robust protocols to test putative herbicide resistant weed populations at whole plant level are essential to confirm the resistance status. The presented protocols, based on whole-plant bioassays performed in a greenhouse, can be readily adapted to a wide range of weed species and herbicides through appropriate variants. Seed samples from plants that survived a field herbicide treatment are collected and stored dry at low temperature until used. Germination methods differ according to weed species and seed dormancy type. Seedlings at similar growth stage are transplanted and maintained in the greenhouse under appropriate conditions until plants have reached the right growth stage for herbicide treatment. Accuracy is required to prepare the herbicide solution to avoid unverifiable mistakes. Other critical steps such as the application volume and spray speed are also evaluated. The advantages of this protocol, compared to others based on whole plant bioassays using one herbicide dose, are related to the higher reliability and the possibility of inferring the resistance level. Quicker and less expensive in vivo or in vitro diagnostic screening tests have been proposed (Petri dish bioassays, spectrophotometric tests), but they provide only qualitative information and their widespread use is hindered by the laborious set-up that some species may require. For routine resistance testing, the proposed whole plant bioassay can be applied at only one herbicide dose, so reducing the costs.
Introducción
Los herbicidas son la medida de control de malas hierbas más ampliamente utilizado, que representa hasta un 50% del mercado global de protección de las plantas 1. Son herramientas relativamente baratas, evitar prácticas de cultivo del suelo en mano de obra intensiva y requiere mucho tiempo, y en última instancia resultar en la producción rentable, segura y rentable de alimentos 2. Sin embargo, la gran variabilidad genética fenológico y presente en muchas especies de malezas, junto con un exceso de confianza en el uso de herbicidas, se traduce con frecuencia en la selección de poblaciones de malezas resistentes a los herbicidas. La introducción de herbicidas selectivos con un objetivo metabólica muy específico 3-5 se ha incrementado dramáticamente el número de casos de resistencia a lo largo de los años. Hasta la fecha, 240 especies de malezas (140 dicotiledóneas y monocotiledóneas 100) en todo el mundo han desarrollado resistencia a los diferentes sitios de herbicidas de acción (SOA) 4. Esta es una preocupación importante para el manejo de malezas y más en general, para la producción agrícola sostenible.
e_content "> La detección temprana de la resistencia, con base en pruebas fiables, se realizan con frecuencia en un invernadero, es un paso clave para manejar malezas resistentes a los herbicidas. Los diferentes enfoques se han desarrollado de acuerdo con los objetivos, el nivel requerido de precisión, el tiempo y los recursos disponibles, como así como las especies de malas hierbas consideradas 6-12. Sin embargo, cuando se requiere la confirmación del estado de resistencia de un nuevo biotipo de malezas (es decir, un grupo de individuos que comparten varias características fisiológicas, incluyendo la capacidad de sobrevivir a uno o más herbicidas pertenecientes a una grupo particular utilizado en una dosis que normalmente controlar ellos), un robusto bioensayo de toda la planta se debe realizar en un ambiente controlado 4, 11.Un biotipo rara vez es resistente a un solo herbicida. Por tanto, cada biotipo se caracteriza por un patrón de resistencia determinado, es decir, número y tipo de SoA de los herbicidas es resistente a, y por una resistencia dadanivel para cada herbicida 13. La determinación precoz y fiable del patrón de cruz o resistencia múltiple 5, 14 es importante para la gestión de la resistencia de campo.
Vale la pena mencionar que la resistencia a los herbicidas no tiene nada que ver con la tolerancia natural que algunos exhiben especies de malezas a algunos herbicidas, por ejemplo, las especies dicotiledóneas vs. herbicidas ACCasa inhibidoras, especies monocotiledóneas vs. 2,4-D, Equisetum arvense vs. glifosato.
Este artículo presenta un enfoque sólido para probar biotipos resistentes a herbicidas putativo muestreados en los campos donde se había reportado un mal control por el herbicida (s). Se presentan variantes relevantes a los protocolos estándar en relación con las especies de malas hierbas que participan. Las ventajas sobre las técnicas / protocolos alternativos basados en cualquiera de los bioensayos de plantas enteras utilizando sólo una dosis de herbicida 15, o el tratamiento de semillas en placas de Petri 8 están relacionados con la mayor reliability y la posibilidad de inferir el nivel de resistencia debido a la inclusión de dos dosis de herbicidas en los experimentos. Sin embargo, para las pruebas de resistencia de rutina, los mismos métodos pueden ser aplicados en una sola dosis de herbicida, por lo que la reducción de los costes.
Además de permitir la confirmación de la condición de la resistencia, la información obtenida se puede utilizar tanto para la optimización de los siguientes pasos de la investigación y / o la elaboración de estrategias de manejo de resistencia.
Protocolo
1. Semilla Muestreo y almacenamiento
- Monitorear campos cultivados para el rendimiento herbicida pobres injustificada, es decir, no se debe a las condiciones climáticas adversas o tratamientos herbicidas de baja calidad.
- Se recoge una muestra de semillas de una especie a la vez y asignar un código único. Las semillas maduras suelen ser recogidos antes de la cosecha de cultivos de plantas que habían sobrevivido al tratamiento (s) herbicida. Monitor oportuna para observar si las semillas se desprenden de la planta madre cuando madura.
- Rellenar un formulario para cada muestra que indica el código único asignado, el nombre de la especie, fecha de recolección, coordenadas GPS, municipio, el nombre del agricultor, el tamaño del campo, nivel de infestación, los cultivos, los herbicidas (s) que se utilizan durante la temporada y los registros históricos del campo .
- Recoger las semillas de al menos 30 plantas seleccionadas al azar que son representativos de la infestación de campo. Asegúrese de que la muestra de semillas contiene al menos 5.000 semillas maduras. Por una especie de malezas obligados cruzamiento(Por ejemplo, Lolium spp. O Amaranthus spp.), Reducir el número de plantas a 10-15, manteniendo el número total de semillas alrededor de 5000 11.
- Sub-muestrear el campo si los parches de malezas se encuentran dispersos en grandes áreas (más de una hectárea) como los diferentes biotipos resistentes a herbicidas son seleccionados.
- Tienda semillas en bolsas de papel sin sellar marcadas con el código único asignado.
- Deje que se evapore la humedad pero no exponga semillas de alta temperatura (es decir, evitar lo que les deja en un coche bajo el sol) o fluctuaciones extremas de temperatura para evitar la inducción de la latencia secundaria.
- Limpio (quitar la paja, las semillas de-casco, etc.) y almacenar a temperatura ambiente en un lugar seco. Después de realizar las primeras pruebas de resistencia, almacenar las semillas por largos períodos de tiempo en un cuarto oscuro a 4 ° C, preferiblemente en bolsas de plástico selladas al vacío. En esta manera semillas preservar su viabilidad durante un tiempo significativamente más largo.
2. Semillas latencia Breaking
NOTA: latencia de la semilla proporciona un mecanismo flexible y eficiente que permite a las malas hierbas para adaptarse y persistir en los agroecosistemas. Para romper la latencia y permitir la germinación de semillas, diferentes protocolos tienen que ser utilizados, dependiendo de las especies de malezas, es decir, el tipo de latencia 16.
Hay tres formas principales para eliminar la latencia:
- Vernalización
NOTA: Para obtener la germinación simultánea y emergencia de las plántulas, un período de vernalización semillas que van desde unos pocos días a una semana es necesario para eliminar la latencia fisiológica de muchas especies:. Por ejemplo, Amaranthus retroflexus, Chenopodium album, Lolium spp, Avena fatua, Polygonum persicaria , Phalaris paradoxa 17-19. Se requiere un período de hasta 15 días más para Papaver rhoeas, Cyperus difformis y coccinea Ammania y hasta 30 días para que Schoenoplectus mucronatus 20.- Ponga un poco de agua desionizada en platos de plástico. Corte dos capas de papel de filtro y remojar en el agua, eliminar cualquier exceso. Coloque las semillas secadas al aire en el papel. La transferencia de los platos de plástico de una nevera a 4 ° C durante el período de tiempo requerido.
- Escarificación
NOTA: Algunas especies de malas hierbas son más recalcitrantes a la germinación que otros debido a la latencia mecánica, es decir, características de la capa de semillas, y requieren el uso de una escarificación química con ácido sulfúrico a germinar 21.- Preparar un vaso de precipitados con ácido sulfúrico concentrado (95-98%). Preparar un vaso lleno de agua. Ponga las semillas en un sobre de tela no tejida.
- Remojar por ejemplo, semillas halepense Echinochloa spp. O sorgo durante 20 min o 5 min, respectivamente, en ácido sulfúrico concentrado.
- Tome el sobre del vaso de precipitados con un par de pinzas y lo puso en el vaso lleno de agua. Abre elsobre, poner las semillas en un pequeño colador y enjuague a fondo con agua corriente.
- Remoje las semillas durante 2 minutos en cloroformo. Enjuague las semillas con agua desionizada y secar con papel absorbente. Dunk las semillas en ácido sulfúrico 80% durante 5 min.
- Ponga las semillas en un pequeño colador y enjuague a fondo con agua corriente.
- Poscosecha maduración de la semilla
NOTA: Las semillas de otras especies de malas hierbas no germinan en absoluto durante unos meses después de su vencimiento, independientemente del método utilizado para romper la latencia.- Guarde las semillas por un período de al menos 3-4 meses a temperatura ambiente y la humedad baja y luego siga los protocolos anteriores para romper la latencia (por ejemplo, Oryza sativa var. Fagus o P. rhoeas).
Germinación 3. Semilla
- Coloque las semillas a germinar en plasplatos de tics que contienen 0,6% (m / v) de agar con nitrato de potasio al 0,1% (KNO 3) ha añadido:
- Preparar una solución de agar al 0,6% + 0,1% KNO 3 usando agua desionizada. Se disuelve el agar en un horno microondas.
- Verter la solución de agar en platos de plástico. Enfriar el sustrato y luego poner en las semillas.
- Coloque platos de plástico en un armario de germinación por alrededor de una semana con condiciones de luz y temperatura en función de las condiciones óptimas para cada especie de maleza. Para la mayoría de las especies de invierno, el rango de temperatura es 15/25 ° C noche / día y 12 hr fotoperíodo con tubos de neón que proporcionan una densidad de flujo de fotones fotosintético (PPFD) de 15-30 mol m -2 seg -1. Para muchas especies de verano, el rango de temperatura es 15/30 ° C la noche / día.
Variante: SOme especies, tales como S. halepense, necesitará un tratamiento térmico. Por lo tanto después de la escarificación, semillas de S. halepense se someten a las siguientes condiciones: ciclos de 4 horas a 45 ° C y 20 horas a 24 ° C durante tres días en el armario de la germinación, y luego tres días en condiciones normales.
4. El trasplante de plántulas y Crecimiento
- Trasplante de quince a veinte plántulas en bandejas de plástico (325 x 265 x 95 mm) llenos de una mezcla estándar de encapsulamiento (60% suelo franco limoso, 15% de arena, 15% y 10% Agriperlite turba - por volumen).
NOTA: El trasplante, en lugar de la siembra directa, permite un soporte uniforme de las plantas en la misma etapa de crecimiento que se obtiene, que es una condición previa importante para optimizar el rendimiento del tratamiento herbicida. - Identifique cada bandeja con un código de barras que incluye toda la información para la identificación única: Código de la población, el herbicida se está probando, replicar número y número de bandeja progresiva <./ Li>
- Coloque las bandejas en una sala climatizada plantas de invernadero y el agua según sea necesario para mantener el sustrato en o cerca de la capacidad de campo.
NOTA: La temperatura de crecimiento varía dependiendo de las especies de malas hierbas. A menudo se realizan pruebas durante el otoño / invierno / primavera, así que la luz se complementa utilizando 400 W lámparas de halogenuros metálicos, que proporcionan una PPFD de aproximadamente 150 mol m -2 s -1 y un fotoperíodo de 12 h 24, 19. Especies de malezas de verano con C 4 ciclo fotosintético por lo general requieren una mayor intensidad de la luz y por lo tanto, las pruebas se realizan a finales de primavera-verano o la intensidad de la luz es complementado aproximadamente 400 mol m -2 s -1 con un fotoperiodo de 14 h. - Use un protocolo diferente para algunas especies de malezas que infestan arroz con cáscara, por ejemplo, A. plantago-aquatica, S. mucronatus y C. difformis como se describe en 22.
- Transplante las plántulas en bandejas de poliestireno con 24 células redondas (55 mm de diámetro, 64 mm de profundidad) filconducido con 60% de suelo franco limoso, 30% de arena y 10% de turba (en volumen).
- Establecer las bandejas de 12 cm envases plásticos profundos llenos de agua y aseguradas mediante varillas roscadas de acero inoxidable para evitar que se flotante (Figura 1).
- Mantener el nivel de agua en los recipientes a 1-2 cm por debajo del nivel de la superficie del suelo y añadir 1,5 g de sulfato de cobre a cada recipiente (que contiene 10-12 L de agua) para evitar la proliferación de algas.
5. Tratamientos herbicidas
- Los tratamientos con herbicidas de pre-emergencia:
- Después de tres días en el gabinete de la germinación como se describe en la sección 3, transplantar las semillas que germinan en bandejas de plástico que contienen el sustrato descrito anteriormente y cubrir con una capa de tierra (aproximadamente 1 cm). Este es un paso crítico a fin de garantizar que las plántulas no surgirán debido al efecto herbicida en lugar de una profundidad de enterramiento excesiva.
- Tome el sustrato de campo capaciudad mediante la colocación de las bandejas, que tienen unos agujeros en la parte inferior, en platillos llenos de agua.
- Un día después del trasplante, el tratamiento de las bandejas con el herbicida de preemergencia 25.
- Mantenga el sustrato o por la capacidad de campo cerca de la adición de agua, según sea necesario, tanto desde arriba y abajo por capilaridad desde el platillo. Este procedimiento favorece la permanencia del herbicida a la profundidad adecuada (es decir, donde las semillas en germinación son) para una buena eficacia del tratamiento.
- Los tratamientos con herbicidas de post-emergencia:
- Rociar las plantas cuando llegan a la etapa de 2-3 hojas (es decir, etapa de crecimiento 12-13 de la escala BBCH crecimiento extendido 26).
- A partir del día después del tratamiento, ajuste el sistema de riego en función de las necesidades de agua de las especies de malezas y la temporada (por ejemplo, para Echinochloa spp. Que suministra agua durante 3 minutos 4 veces al día, a intervalos regulares, de 9 am a 9 pm). El agua es discontribuido mediante un sistema de riego por aspersión automática.
Variante: glifosato se aplica en la planta de la etapa BBCH 14-21.
- Preparación de herbicidas y la distribución.
NOTA: Todos los herbicidas (pre y post-emergencia) se aplican como formulaciones comerciales con surfactantes recomendados en dos dosis, la dosis recomendada de campo (1x) y tres veces mayor que (3x).- Si es necesario, preparar la solución de tensioactivo a granel con arreglo a las instrucciones de la etiqueta; la concentración final se expresa generalmente como un porcentaje del volumen final (por ejemplo, 0,3%) o como volumen a ser distribuido por unidad de área (por ejemplo, 1 L ha -1).
- Utilice la solución de tensioactivo como disolvente para la solución de herbicida (soluto) con el fin de mantener la concentración correcta del ingrediente activo. Preparar la solución herbicida más concentrada primero (3x). Calcular la cantidad de producto comercial que se disuelve en la solución de tensioactivo (o en agua desionizada si unatensioactivo no es necesario) usando la siguiente ecuación:
Hierbas Dosis = [(Dosis campo x Dosis máxima) x V aleta] / V del
Dónde: hierba = dosis Dosis herbicida (ml), dosis de campo = campo herbicida Dosis (ml ha -1), Dose max = dosis máxima entregada, V aleta = volumen final de la solución (L), V = volumen del emitido por el pulverizador de banco (L ha -1). - Diluir (2: 1, v / v) la solución 3x herbicida para preparar el menos concentrado (1x). Este procedimiento reduce la posibilidad de cometer errores al pesar o pipetear los herbicidas. Concentración de la solución herbicida se expresa como volumen a ser distribuido por unidad de área (L ha -1).
- Iniciar la secuencia de tratamiento con la dosis de herbicida inferior (1x). De esta manera no hay necesidad de lavar el gabinete de pulverización entre dos tratamientos con la misma herbicida.
- Distribuya el solutio herbicidan usando un pulverizador de banco precisión la entrega de 300 L ha -1 (± 1%), a una presión de 215 kPa, y una velocidad de 0,75 m s-1, con un brazo equipado con tres abanico plano (rango extendido) boquillas hidráulicas .
- Lave el gabinete rociar dos veces cuando el herbicida se cambia el uso de cloro al 1% (v / v) y luego enjuague.
Variante: glifosato se aplica con un volumen de pulverización de 200 L ha-1 27.
NOTA: Especial atención tiene que ser pagado cuando, como el sulfometuron o flazasulfuron sulfonilureas, se utilizan herbicidas altamente biológicos. En este último caso hacer un lavado con una solución de lejía y otro con amoniaco (2,5% v / v), seguido de un enjuague cuidadoso con agua.
6. Recopilación y Análisis de los Datos
- A través de un lector de código de barras, que identifica automáticamente cada bandeja, registre el número de plantas que sobrevivieron al tratamiento, así como la biomasa estimada Visual (VEB). Las plantas son culocomputan como estar muerto si no muestran crecimiento activo, independientemente del color o de otro aspecto.
- Hacer la evaluación de tres o cuatro semanas después del tratamiento (WAT) en función de los herbicidas probados (por ejemplo, tres WAT para los inhibidores ACCasa y cuatro WAT para los inhibidores de ALS o glifosato).
- Evaluar la eficacia del tratamiento en general mediante la inclusión de una población susceptible (comprobar S) en todos los experimentos, es decir, una población recogida en un sitio que nunca o raramente tratados con herbicidas era.
- Supervivencia de las plantas Express como porcentaje del número de plantas tratadas, contó justo antes del tratamiento con herbicida, y calcular el error estándar (SE) por valor medio (valor de las dos repeticiones significa).
- El VEB se obtiene a través de una comparación visual de la biomasa vegetal entre tratado y verificación de la misma población de 25, 28 no tratados. Una puntuación, que van desde 10 para las plantas no afectadas por el herbicida (en comparación con la comprobación no tratada) a 0 Cuándolas plantas son claramente muerto, se le da a cada bandeja tratada.
- Poblaciones atribuyen a cuatro categorías en función de los resultados obtenidos de los tratamientos con dos dosis de herbicidas: S cuando menos del 5% de las plantas sobrevivieron los 1x dosis de herbicidas, SR cuando los sobrevivientes oscilaron entre 5% a 20% en 1x dosis de herbicidas, R cuando más de 20% de las plantas sobrevivió a los 1x dosis de herbicida y RR cuando los sobrevivientes son más de 20% en dosis de herbicida 1x y más de 10% en dosis de herbicida 3x 17.
Resultados
Para evaluar el estado de resistencia de una población resistente putativo, es fundamental para incluir un cheque susceptible en el ensayo con el fin de verificar la eficacia herbicida. Los resultados de una prueba de detección llevados a cabo en P. poblaciones rhoeas, una mala hierba que infestan los campos de trigo, se presentan en la Figura 2, donde se presenta la eficacia de cuatro herbicidas de post-emergencia en un testigo susceptible (09-36) y, por un presunto resistente (10-91). Población 09-36 fue completamente controlado por los ALS inhibidor iodosulfuron mientras que sólo una planta sobrevivió 1x dosis de los otros dos herbicidas ALS probados, florasulam y tribenurón-metilo (Figura 2). En cambio, en torno al 60% de las plantas de la población 10-91 sobrevivió ambas dosis de herbicidas de yodosulfurón y tribenurón-metilo y alrededor del 50% sobrevivió a la dosis de 1 x florasulam. Estos resultados confirman que la población de 10-91 es altamente resistente (RR) para yodosulfurón y tribenurón-metilo y resistente(R) para florasulam. Una respuesta diferente se observó con 2,4-D, un herbicida que tiene una SoA diferente (es decir, que imita la auxina endógena), ampliamente utilizado para controlar las malas hierbas dicotiledóneas en trigo. Sólo el 33% de las plantas de la verificación de S fueron muertos con este herbicida a 1x dosis y el valor VEB fue> 20% (Figura 2). La falta de eficacia en la población de verificación no confirma si la población 10-91 es resistente a este herbicida o no. En este caso se recomienda realizar el experimento de nuevo y si se confirman los resultados, para cambiar la población S. Un ejemplo de un buen control de la comprobación susceptible se expone en la figura 3. El Echinochloa spp. 07-16L población fue completamente controlado por todos los herbicidas en la dosis de campo recomendada (1x). En este caso, es posible afirmar que la población de 08 a 42 es altamente resistencia cruzada a todos los agentes inhibidores de ALS probados, es decir, azimsulfurón, bispiribaco-Na, imazamox y penoxsulam. La ch no tratadaeck de ambas poblaciones se informa a la izquierda. Estas plantas se utilizan para calcular el VEB; la cantidad de biomasa se estima visualmente bandeja por bandeja de dar una puntuación de 10 para el cheque no tratada y luego asigna una puntuación de 0, para la réplica sin ningún tejido vegetal verde, a 10 cuando la biomasa es comparable al tratado sin la comprobar (Figura 3).
Otro ejemplo de la producción se informó en la Figura 4, donde supervivencia de las plantas de Lolium spp. al glifosato se muestra. Las poblaciones analizadas fueron recogidas en los sistemas de cultivo a base de trigo, donde el glifosato está ejerciendo diferentes presiones de selección (es decir, de vez en cuando o 1-2 tratamientos por año o 3-más veces al año). Las plantas se pulverizan en la etapa de macollaje temprano (BBCH 14-21) utilizando dos dosis de glifosato: 480 y 1 440 g ea ha -1, que representan la dosis máxima recomendada de campo mínima y para las malas hierbas anuales (es decir, terófitas) en que el crecimiento stla edad. Los datos se recogieron cuatro semanas después del tratamiento. Sobre la base de ambos experimentos, siete de las poblaciones analizadas tenían una tasa de supervivencia del 80% o más (poblaciones 343, 383, 384, 403, 509, 512 y 537) con la menor dosis aplicada, pero sólo el 50% de las plantas de las poblaciones 403 y 509 sobrevivieron a la dosis más alta de glifosato. Una población tuvo una tasa de supervivencia de alrededor del 40% en 1x dosis, mientras que sólo una pocas plantas de población 509 sobrevivieron a la dosis más baja y la población 508 fue totalmente controlados en cualquier dosis. En resumen, estos experimentos mostraron diferentes niveles de resistencia a glifosato que a menudo reflejan la historia campo de uso de herbicidas. El nivel de resistencia al glifosato fue mayor para las poblaciones que habían sido tratados más intensamente: es decir, el número de aplicaciones de campo por año y el número de años de presión de selección fue mayor.
El protocolo descrito para un herbicida (Figura 4) se puede aplicar a numerosos otros que tienen difealquilar SoA; de esta manera el patrón de resistencia de una o más poblaciones se puede determinar. Un ejemplo de resistencia patrón de variabilidad de Echinochloa spp. poblaciones se presentan en la Tabla 1. Los registros históricos del uso de herbicidas y el manejo del cultivo obtenido desde el agricultor indicaron que los herbicidas inhibidores de ALS eran el agente de selección (es decir, penoxsulam o imazamox). Por tanto, la prueba de resistencia se realizó con tres herbicidas inhibidores de ALS (azimsulfurón, penoxsulam y imazamox) que pertenecen a diferentes familias químicas, y un herbicida que tiene otro SoA, la profoxidim herbicida inhibidor de ACCasa. El cheque susceptible (07-16L) fue completamente controlado por todos los herbicidas ensayados (Tabla 1). Se detectaron tres patrones de resistencia: trece poblaciones como resultado de ser resistente sólo a los inhibidores de ALS, cuatro poblaciones como resultado de ser resistente sólo a la profoxidim inhibidor de ACCasa, y tres poblaciones mostraron un múltiplo patrón de resistencia tanto a la profoxidim inhibidor de la ACCasa y agentes inhibidores de ALS. Dentro de cada patrón de resistencia es posible distinguir diferentes biotipos, por ejemplo, cuatro poblaciones resistentes a los inhibidores de ALS sobrevivieron únicos tratamientos con el azimsulfurón sulfonilurea mientras que dos de las poblaciones multi-resistentes sobrevivieron único tratamiento con el inhibidor de ALS azimsulfurón pero fueron bastante controlados por penoxsulam y imazamox.

Figura 1. Ejemplo de C. difformis, unas especies de malezas que infestan el arroz con cáscara, configuración de la prueba. bandejas de poliestireno se ponen en envases plásticos y bloqueadas por varillas de acero inoxidable atornilladas para evitar que flotante. El agua se mantuvo a 1-2 cm por debajo del nivel de la superficie del suelo para imitar las condiciones arrozal. La fotografía fue tomada cuatro semanas después del tratamiento.p_upload / 52923 / 52923fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Respuesta de dos P. poblaciones rhoeas de post-emergencia herbicidas. Efecto de yodosulfurón, tribenurón, florasulam y 2,4-D se probó en la dosis de campo recomendada (1x) y en tres veces que (3x) sobre la supervivencia de las plantas (barras azules) y la biomasa estimación visual ( VEB; barras rojas) del testigo susceptible (09-36) y de una población resistente (10-91). La evaluación se llevó a cabo cuatro semanas después del tratamiento con herbicidas. La supervivencia de la planta y VEB se expresan como porcentaje del número de plantas tratadas y el VEB de los controles no tratados con (%). La línea horizontal en el 20% de supervivencia de las plantas representa el umbral de discriminación entre las poblaciones resistentes y susceptibles cuando las plantas son tratados con una dosis 1x. Las barras verticalesrepresentan errores estándar calculados sobre el valor medio de las dos repeticiones. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. Los resultados visuales de una proyección en dos Echinochloa spp. poblaciones. El testigo susceptible, 07-16L (S), y la población resistente, 08-42, se pusieron a prueba con cuatro inhibidores de ALS (reportados a la derecha) en dos dosis, 1x y 3x, (reportados en la parte inferior). Para la comprobación de S sólo se informan los resultados de dosis 1x, porque todas las plantas ya se controlaron a esa dosis. Tres ejemplos de puntuación VEB se reportan en rojo: 0 = todas las plantas muertas, 10 = todas las plantas sobrevivieron y biomasa es comparable a la (NT) cheque no tratada (reportado a la izquierda), 5 = la biomasa es aproximadamente la mitad de la de una bandeja de no-tratada lacomprobar. Haga clic aquí para ver una versión más grande de esta figura.
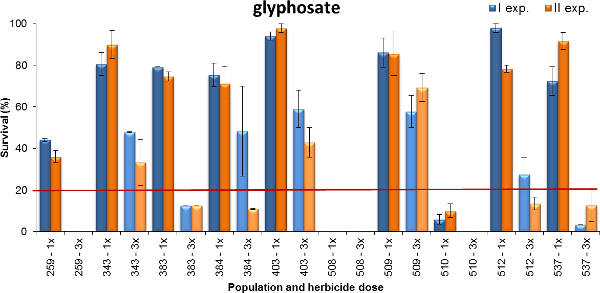
Figura 4. Porcentaje de supervivencia de las plantas durante diez Lolium spp. poblaciones probadas con glifosato. supervivencia Planta registrado en dos experimentos (barras azules y bares naranja para exp. I y II, respectivamente). Los datos se expresan como un porcentaje (%) del número de plantas tratadas. Dos controles susceptibles estaban completamente controlados en 1x dosis y por lo tanto no se presentan en el gráfico. Dos dosis se pusieron a prueba, el mínimo (1x = 480 g ea ha -1) y máximo (3x = 1440 g ea ha -1) las dosis indicado en la etiqueta del producto. La línea horizontal en el 20% de supervivencia de las plantas representa el umbral de discriminación entre las poblaciones resistentes y susceptibles cuando las plantas estaban regaloed en dosis 1x. Las barras verticales representan los errores estándar calculados sobre el valor medio de las dos repeticiones. Por favor, haga clic aquí para ver una versión más grande de esta figura.
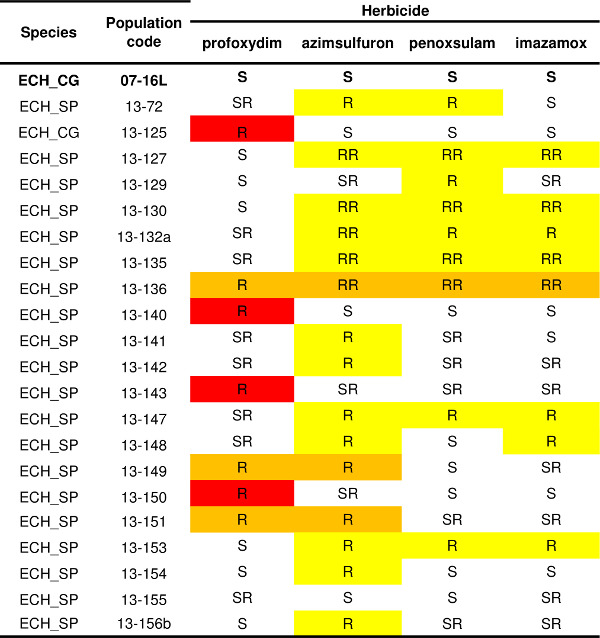
Tabla 1. Estado Resistencia de veintiuna poblaciones de Echinochloa spp. Cheque Susceptible (07-16L) se reporta en negrita. Los niveles de resistencia son reportados para cada uno de los cuatro herbicidas probados (un inhibidor de la ACCasa, profoxidim, y tres inhibidores de ALS, azimsulfurón, penoxsulam y imazamox) de acuerdo con cuatro categorías: S = menos de 5% de las plantas sobrevivió a la dosis 1x herbicida, SR = supervivencia de las plantas varió de 5% a 20% en 1x dosis de herbicidas, R = más del 20% de las plantas sobrevivió a las dosis 1x herbicida, RR = supervivencia de las plantas fue de más de 20% en dosis de herbicida1x y más de 10% en dosis de 3x. Diferentes patrones de resistencia se destacan: rojo = resistencia sólo para inhibidor de ACCasa, amarillo = resistencia sólo para inhibidor de la (s) ALS, naranja = resistencia al inhibidor de la ACCasa y a por lo menos un inhibidor de ALS.
Discusión
Varios pasos dentro de los protocolos son fundamentales para una evaluación exitosa de resistencia a los herbicidas en una población: 1) las semillas deben recogerse en la madurez de las plantas que habían sobrevivido al tratamiento (s) herbicida. La maduración de las semillas de la planta madre es crucial para evitar dificultades en la germinación de las semillas más tarde; 2) Se recomienda el almacenamiento adecuado de semillas para evitar la proliferación de mohos que impidan la germinación; 3) las plántulas deben ser tratados en la etapa de crecimiento de la derecha, como se informa en la etiqueta del paquete herbicida. Se debe tener cuidado para que las plantas a ser tratadas han alcanzado aproximadamente la misma etapa de crecimiento; 4) las soluciones herbicidas se deben preparar y manejar con precisión para que las plantas se pulverizan con la concentración correcta de ingrediente activo, por lo tanto evitando errores no verificables; 5) después de cada tratamiento herbicida se recomienda limpiar a fondo el gabinete de pulverización y cristalería usada para preparar las soluciones para evitarla contaminación en el siguiente tratamiento con herbicidas, especialmente cuando herbicidas altamente biológicamente activos están involucrados.
Los protocolos presentados en este documento se pueden adaptar fácilmente a una amplia gama de especies de malas hierbas con las modificaciones necesarias de acuerdo a las especies y herbicidas de interés. En particular, los métodos para romper latencia de las semillas y para la germinación son pasos que deben ser reconsiderados por cada nueva especie de malas hierbas (ver las secciones 2 y 3). Equipo de pulverización a veces necesita ajustes cuando se usan diferentes herbicidas, por ejemplo, el glifosato requiere diferentes configuraciones del gabinete pulverización (ver sección 5.3) y las plantas se tratan en una etapa de crecimiento, a más tardar con la mayoría de los herbicidas.
El tiempo y el espacio necesario para realizar estos protocolos pueden ser un factor limitante y puede no ser adecuado para las pruebas de rutina. Sin embargo, para limitar los costos, se puede usar una sola dosis del herbicida. De esta manera la información todavía se puede conseguir de si tque es resistente población. Una limitación potencial del enfoque está relacionado con el hecho de que no hay testigos resistentes se incluyen en los experimentos. De hecho, debido a la gran cantidad de biotipos evaluados (es decir, diferentes especies y herbicidas involucrados), muchos controles deben incluirse en cada experimento, lo que aumenta los costos.
Sin embargo, las ventajas sobre las técnicas / protocolos alternativos basados en bioensayos de plantas enteras utilizando sólo una dosis de herbicida 15 están relacionados con la mayor fiabilidad y la posibilidad de inferir el nivel de resistencia. Pruebas de cribado de diagnóstico rápido y menos costoso también se han ideado, in vivo o in vitro (por ejemplo, los bioensayos plato de Petri 8, pruebas espectrofotométricas sobre herbicida enzima diana 29). Sin embargo, sólo proporcionan información cualitativa y requieren un trabajo preliminar, a veces laborioso, para identificar la dosis de herbicida para discriminar entre resplantas Istant y susceptibles. Los ensayos in vitro también deben adaptarse de acuerdo con el principio activo utilizado.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
The research was supported by the National Research Council (CNR) of Italy. The authors thank GIRE members for collecting seed samples and are grateful to Alison Garside for revising the English.
Materiales
| Name | Company | Catalog Number | Comments |
| Paper bags | Celcar SAS | ||
| Plastic dishes | ISI plast S.p.A. | SO600 | Transparent plastic |
| Sulfuric acid 95-98% | Sigma-Aldrich | 320501 | |
| Non-woven fabric | Carretta Tessitura | Art.TNT17 | Weight 17 g m-2 |
| Chloroform >99.5% | Sigma-Aldrich | C2432 | |
| Agar | Sigma-Aldrich | A1296 | |
| Potassium nitrate >99.0% | Sigma-Aldrich | P8394 | |
| Plastic containers | Giganplast | 1875/M | 600 x 400 x 110 mm |
| Plastic trays | Piber plast | G1210A | 325 x 265 x 95 mm |
| Polystyrene trays | Plastisavio | S24 | 537 x 328 x 72 mm, 24 round cells (6x4) |
| Copper sulfate | Sigma-Aldrich | 451657 | |
| Agriperlite | Blu Agroingross sas | AGRI100 | |
| Peat | Blu Agroingross sas | TORBA250 | |
| Germination cabinet | KW | W87R | |
| Nozzles | Teejet | XR11002-VK, TP11001-VH | The second type of nozzles are used only for glyphosate |
| Barcode generator | Toshiba TEC | SX4 | |
| Labels with barcode | Felga | TT20200 | Stick-in labels with rounded corners |
| Barcode reader | Cipherlab | 8300-L | Portable data terminal |
| Bench sprayer | Built in house | ||
| Herbicides included in the results: | |||
| Commercial product | Active ingredient | Company | Comments |
| Altorex | imazamox | BASF | |
| Azimut | florasulam | Dow AgroSciences | |
| Biopower | Bayer Crop Science | Surfact to be used with Hussar WG | |
| Dash | BASF | Surfact to be used with Altorex | |
| Granstar | tribenuron-methyl | Dupont | |
| Gulliver | azimsulfuron | Dupont | |
| Hussar WG | iodosulfuron | Bayer Crop Science | |
| Nominee | bispyribac-Na | Bayer Crop Science | |
| Roundup | glyphosate | Monsanto | |
| Trend | Dupont | Surfact to be used with Granstar and Gulliver | |
| Viper | penoxsulam | Dow AgroSciences | |
| Weedone LV4 | 2,4-D | Isagro | |
Referencias
- Massa, D., Kaiser, Y. I., Andújar-Sánchez, D., Carmona-Alférez, R., Mehrtens, J., Gerhards, R. Development of a geo-referenced database for weed mapping and analysis of agronomic factors affecting herbicide resistance in Apera spica-venti L. Beauv. (Silky Windgrass). Agronomy. 3 (1), 13-27 (2013).
- Powles, S. B., Shaner, D. L. . Herbicides Resistance and World Grains. , 308 (2001).
- Sattin, M. Herbicide resistance in Europe: an overview. Proc. BCPC International Congress. , 131-138 (2005).
- Jasieniuk, M., Le Corre, V. Deciphering the evolution of herbicide resistance in weeds. Trends Genet. 29 (11), 649-658 (2013).
- Heap, I. M. Identification and documentation of herbicide resistance. Phytoprotection. 75 (4), 85-90 (1994).
- Beckie, H. J., Heap, I. M., Smeda, R. J., Hall, L. M. Screening for herbicide resistance in weeds. Weed Technol. 14 (2), 428-445 (2000).
- Tal, A., Kotoula-Syka, E., Rubin, B. Seed-bioassay to detect grass weeds resistant to acetyl coenzyme A carboxylase inhibiting herbicides. Crop Prot. 19, 467-472 (2000).
- Boutsalis, P. Syngenta Quick-Test: a rapid whole-plant test for herbicide resistance. Weed Technol. 15 (2), 257-263 (2001).
- Menchari, Y., et al. Weed response to herbicides: regional-scale distribution of herbicide resistance alleles in the grass weed Alopecurus myosuroides. New Phytol. 171 (4), 861-874 (2006).
- Burgos, N. R., et al. Review: confirmation of resistance to herbicides and evaluation of resistance levels. Weed Sci. 61 (1), 4-20 (2013).
- Owen, M. J., Martinez, N. J., Powles, S. B. Multiple herbicide-resistant Lolium rigidum. (annual ryegrass) now dominates across the Western Australian grain belt. Weed Res. 54 (3), 314-324 (2014).
- Beckie, H. J., Tardif, F. J. Herbicide cross resistance in weeds). Crop Prot. 35, 15-28 (2012).
- Moss, S. R., et al. The occurrence of herbicide-resistant grass-weeds in the United Kingdom and a new system for designating resistance in screening assays. Proc. BCPC Weeds. , 179-184 (1999).
- Baskin, C. C., Baskin, J. M. . Seeds, Ecology, Biogeography and Evolution of dormancy and Germination. , 27-42 (1998).
- Sattin, M., Gasparetto, M. A., Campagna, C. Situation and management of Avena sterilis. ssp. ludoviciana. and Phalaris paradoxa. resistant to ACCase inhibitors in Italy. Proc. BCPC - Weeds. , 755-762 (2001).
- Scarabel, L., Varotto, S., Sattin, M. A European biotype of Amaranthus retroflexus. cross-resistant to ALS inhibitors and response to alternative herbicides. Weed Res. 47 (6), 527-533 (2007).
- Collavo, A., Panozzo, S., Lucchesi, G., Scarabel, L., Sattin, M. Characterisation and management of Phalaris paradoxa. resistant to ACCase-inhibitors. Crop Prot. 30 (3), 293-299 (2011).
- Scarabel, L., Carraro, N., Sattin, M., Varotto, S. Molecular basis and genetic characterisation of evolved resistance to ALS-inhibitors in Papaver rhoeas. Plant Sci. 166 (3), 703-709 (2004).
- Panozzo, S., Scarabel, L., Tranel, P. J., Sattin, M. Target-site resistance to ALS inhibitors in the polyploid species Echinochloa crus-galli. Pestic. Biochem. Phys. 105 (2), 93-101 (2013).
- Sattin, M., Berto, D., Zanin, G., Tabacchi, M. Resistance to ALS inhibitors in rice in north-western Italy. Proc. BCPC. Weeds. , 783-790 (1999).
- Scarabel, L., Berto, D., Sattin, M. Dormancy breaking and germination of Alisma plantago-aquatica. and Scirpus mucronatus. Aspects of Applied Biology. 69, 285-292 (2003).
- Collavo, A., Strek, H., Beffa, R., Sattin, M. Management of an ACCase-inhibitor-resistant Lolium rigidum. population based on the use of ALS inhibitors: weed population evolution observed over a 7 years field-scale investigation. Pest Manag. Sci. 69 (2), 200-208 (2013).
- Scarabel, L., Panozzo, S., Savoia, W., Sattin, M. Target-site ACCase-resistant Johnsongrass (Sorghum halepense). selected in summer dicot crops. Weed Technol. 28 (2), 307-315 (2014).
- Hess, M., Barralis, H., Bleiholder, H., Buhur, L., Eggers, T., Hack, H., Strauss, R. Use of the extended BBCH scale - general for the description of the growth stages of mono- and dicotyledonous weed species. Weed Res. 37 (6), 433-441 (1997).
- Collavo, A., Sattin, M. First glyphosate-resistant Lolium. spp. biotypes found in a European annual arable cropping system also affected by ACCase and ALS resistance. Weed Res. 54 (4), 325-334 (2014).
- Scarabel, L., Cenghialta, C., Manuello, D., Sattin, M. Monitoring and management of imidazolinone-resistant red rice (Oryza sativa. L., var. sylvatica.) in Clearfield® Italian paddy rice. Agronomy. 2 (4), 371-383 (2012).
- Zelaya, I. A., Anderson, J. A. H., Owen, M. D. K., Landes, R. D. Evaluation of spectrophotometric and HPLC methods for shikimic acid determination in plants: Models in glyphosate-resistant and-susceptible crops. J. Agric. Food Chem. 59 (6), 2202-2212 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados