Method Article
Протокол Lentiviral трансдукции и вниз по течению анализа заболеваемости кишечными органоиды
В этой статье
Резюме
In this video protocol we give a step by step explanation of lentiviral transduction in organoids of primary intestinal epithelium and of processing and downstream analysis of these cultures by quantitative RT-PCR, RNA-microarray and immunohistochemistry.
Аннотация
Intestinal crypt-villus structures termed organoids, can be kept in sustained culture three dimensionally when supplemented with the appropriate growth factors. Since organoids are highly similar to the original tissue in terms of homeostatic stem cell differentiation, cell polarity and presence of all terminally differentiated cell types known to the adult intestinal epithelium, they serve as an essential resource in experimental research on the epithelium. The possibility to express transgenes or interfering RNA using lentiviral or retroviral vectors in organoids has increased opportunities for functional analysis of the intestinal epithelium and intestinal stem cells, surpassing traditional mouse transgenics in speed and cost. In the current video protocol we show how to utilize transduction of small intestinal organoids with lentiviral vectors illustrated by use of doxycylin inducible transgenes, or IPTG inducible short hairpin RNA for overexpression or gene knockdown. Furthermore, considering organoid culture yields minute cell counts that may even be reduced by experimental treatment, we explain how to process organoids for downstream analysis aimed at quantitative RT-PCR, RNA-microarray and immunohistochemistry. Techniques that enable transgene expression and gene knock down in intestinal organoids contribute to the research potential that these intestinal epithelial structures hold, establishing organoid culture as a new standard in cell culture.
Введение
Кишечного эпителия является одним из самых быстро размножающихся тканях организма, что вызвало это, чтобы привлечь широкий интерес со изучению рака и стволовых клеток. В 2009 методика была опубликована генерировать длительные культуры малочисленных кишечных крипт в матригеле, сохраняя в 3 трехмерную структуру 1. Эти структуры, называемые кишечные органоиды, можно культивировать с использованием стандартных методик, с окружающей средой с добавлением нескольких определенных факторов роста, в том числе БМП-сигнализации ингибитора пути Noggin (Nog), Wnt-сигнального пути энхансер rspondin 1 (RSPO1) и эпидермальный фактор роста (EGF) всех найденных в целях повышения кишечной пролиферации 2-4.
Органоиды превзойти традиционные линии раковых клеток в тех аспектах, что они немутированный, сохранили иерархию стволовых клеток, отображения нетронутыми сотовой поляризацию и выставочная дифференциации во всех линиях клеток, находящихся в зарождающейся небольшой Intestinal эпителий. Так как они могут быть трансдуцированных осуществлять трансгенов или РНК-интерференции создает 5, они используются для изучения специфических генетических элементов, перевешивает эксперименты с использованием трансгенных мышей, в аспектах стоимости и скорости. Трансгенные выражение органоидам может быть выполнена с использованием либо мышиный ретровирусную или лентивирусов векторов 6,7. Из-за ограничений мышиных ретровирусов, способных к трансдукции митотических клеток исключительно 8, лентивирусов трансдукции чаще используется для клеток, которые трудно заразить, например, органоидам.
Виралли трансдуцированных и стабильно экспрессирующие трансгенные органоиды может быть использован для множества последующих анализов, в том числе количественный анализ РНК и иммуногистохимии. Взятые вместе, культура органоидов из первичных клеток эпителия кишечника превратилась в обычного метода, который легко реализовать без особых лабораторных требований, и стал роман стандарт CELL культура в исследованиях по кишечного эпителия.
Методы вирусного преобразования и последующей вниз по течению анализа в органоидов утомительны для выполнения и оказания помощи Органоид эксперименты мы получили это видео Протокола, с указанием методов лентивирусным трансдукции в культуре органоидов. Мы дополнительно показать, как корректная обработка органоидов может увеличить урожайность и, следовательно, повысить производительность ниже по течению анализа с использованием методов РНК или иммуногистохимии. В протоколе, органоиды, которые получены из небольших кишечных крипт были исключительно используются, хотя способы, описанные, могут быть применены к ободочной органоидам а.
протокол
1. Получение полиэтиленимина (PEI) в качестве реагента для трансфекции
- Растворите приблизительно 150 мг PEI в 100 мл H 2 O.
- Отрегулируйте рН раствора до 7,4 добавлением HCl до тех пор, пока раствор не станет ясно, и размешать до полного растворения. Это может занять от 10 до 60 мин и добавить воду до конечного концентрации 1 мг / мл.
- Когда ясно, профильтровать раствор PEI через стерильный фильтр 0,22 мкм и в магазине в -80 ° C морозильник в аликвоты по 5 мл.
2. Производство Lentiviral частиц
День 1:
- Разделение HEK293T клетки на 60% -80% слияния в 162 см 2 колбу или большой чашке Петри в клеточной линии культуральной среде (DMEM с добавлением 10% FCS, 1% пенициллина / стрептомицина и 2 мМ глутамина добавки).
День 2:
- Подготовка ДНК для трансфекции раствора, содержащего 45 мкг тотальной ДНК плазмиды путем сложениялентивирусов упаковки векторы (7 мкг на pVSVg; 5 мкг ВКПП оборот; 13 мкг на pMDL) и 20 мкг лентивирусов плазмиды, кодирующей интересующий ген или shRNA интереса. Регулировка до объема 1 мл, используя DMEM.
- Подготовка PEI трансфекции раствора добавлением 90 мкл 1 мг / мл PEI в 930 мкл DMEM и инкубировать в течение 5 мин при комнатной температуре.
- Добавить ДНК трансфекции решение к решению PEI. Вихревой или инвертировать несколько раз и инкубировать в течение 5 мин при комнатной температуре, чтобы получить раствор ДНК трансфекции.
- Капельное 2 мл трансфекции ДНК раствор на HEK293T клеток и инкубируют в течение 4 часов в увлажненной инкубаторе для клеточных культур на 37 ° C.
- После 4 ч, обновить культуральной среды, чтобы удалить PEI. Это не нужно мыть клетки перед добавлением новую среду.
ПРИМЕЧАНИЕ: пей цитотоксические и инкубации раз дольше, чем 4 часа может причинить вред HEK293T клеток.
День 4:
- Замените Супеrnatant с новой культуральной среды. Держите супернатант (содержащие вирус); это будет использоваться на этапе 2,10.
- Поместить супернатант в 15 мл колбу. Чтобы удалить отмершие клетки, центрифуги в течение 5 мин при 500 х г.
- Нажмите супернатант через фильтр 0,45 мкм с помощью большого 60 мл шприц. Хранить в течение ночи при 4 ° С.
День 5:
- Соберите вторую партию супернатанта; центрифуги и фильтр, как на этапах 2,8-2,9.
- Бассейн Супернатанты из шагов 2,9 и 2,10 в Ультрацентрифуга труб и центрифуге при 50000 х г в ультрацентрифуге в течение 90 мин.
- Выньте капсулы очень тщательно, содержащие ультрацентрифуга трубы и поставить в ламинарном потоке, вспоминая ориентацию трубы внутри центрифуги.
- Открытый капсулы проведения ультрацентрифужную пробирку и тщательно декантируйте среду таким образом, что осадок на верхней стороне трубы. Поскольку вирусные гранулы могут быть трудно представить себе, помните о том, чтосторона трубки осадок будет сформирован. Возьмите микропипетку и удалить последнюю часть среды, заботясь, чтобы не волновать непрозрачный коричневый осадок, который виден на стороне нижней части ультрацентрифужную трубки.
- Ресуспендируют этот осадок в 500 мкл культуральной среды Органоид с добавлением 10 мМ никотинамида, 10 мкМ Chir99021, 10 мкМ Y27632 и 8 мкг / мл полибрена. Ресуспендирование в этой среде очень важно, поскольку вируса с высоким титром используется для transduct органоиды непосредственно.
- Дополнительно: заморозить вирус в этой среде аликвоты в двух пакетах по 250 мкл в -80 ° С.
3. Lentiviral Трансдукция органоиды
День 0:
- Сплит полный 0,95 см 2 колодец органоидов за два дня до трансдукции в новой скважины, с целью получения примерно 50 небольших органоиды. Разделение органоиды соответствии с ранее опубликованным протоколом 1 (фиг 3а, б).
- Дополнение Органоид культуральной среды с 10 мкМ Chir99021 и 10 мМ никотинамида, чтобы получить кистозный гипер-пролиферативных склепы (рис 3в).
ПРИМЕЧАНИЕ: Кистозные склепы будут развиваться лучше, когда только что раскол органоиды выращивают в присутствии Chir99021.
День 2:
- Урожай органоиды с помощью пипетки вверх и вниз по матригеле и среды, тем самым нарушая смеси с P1000 микропипеткой. Поместите смесь в 15 мл пробирку.
- Лишить дальнейшего использования Пастера пипетки, в котором дистальное отверстие была снижена путем плавления. Центрифуга органоиды для осаждения в течение 5 мин при 100 х г.
Примечание: В зависимости от размера центрифуги, использовать другую скорость центрифуги. Необходимо найти точное значение скорости, в котором нарушено органоиды отделены от смеси. - Удалить супернатант и добавить 500 мкл подогретого 1x трипсина (по аналогии с 0,25% трипсина). Ресуспендируют органоиды в трипсин и инкубировать3 мин на водяной бане 37 °.
- Деактивировать трипсина путем добавления 3,5 мл клеточной линии культуральной среде (DMEM, дополненной 10% FCS, 1% пенициллина / стрептомицина и глутамина). Центрифуга в течение 5 мин при 500 х г.
- Удалить супернатант, чтобы оставить осадок в приблизительно 20 мкл среды. Передача органоиды в этом последнем небольшом количестве среды в скважине на 48 скважин пластины.
- Добавить высоком титре лентивирус в передаче среде, как описано в шаге 2,14, ресуспендируют и перейдите к шагу 3,10. При встрече низкую эффективность трансдукции, шаг 3,9 могут быть добавлены.
ПРИМЕЧАНИЕ: Для эффективной трансдукции, как правило, добавить одну аликвоту 250 мкл с высоким титром лентивирусом в одну лунку органоидов. Это представляет 50% всех собранных лентивирусом от одного производства, как описано в шаге 2 этого протокола. - Дополнительно: для повышения трансдукции эффективность, выполните spinoculation, поставив 48-луночного планшета, содержащие органоиды в предварительно нагретой центрифуги на 326; С и вращаются на 600 мкг в течение 1 часа.
- Поместить Органоид вирусов смеси в культуральной инкубатора и инкубировать в течение 1 часа при 37 ° С в питательной инкубаторе, чтобы трансдукции.
- Дополнительно: для дальнейшего повышения эффективности трансдукции, инкубировать органоиды еще 3 ч при 37 ° С в питательной инкубаторе.
- Добавить 1 мл Органоид культуральной среде и ресуспендируют Органоид вирусов смесь, трансфер в микроцентрифужных трубки и центрифуги в микроцентрифуге 5 мин при 850 мкг для осаждения органоиды.
- Удалить супернатант и ресуспендируют осадок в 20 мкл охлажденного льдом Матригель. Так как материал затвердевает, когда он становится теплее, использовать наконечники пипеток, которые охлаждается с помощью пипетки вверх и вниз охлажденного льдом PBS в течение нескольких раз.
- Поместите каплю в середине и в 48 скважин пластины и инкубировать в культуральной инкубаторе при 37 ° С в течение 15 мин, чтобы затвердеть.
- Через 15 мин, осторожно добавить 250 мкл Органоид культуральной среде, содержащей10 мМ никотинамида, 10 мкМ Chir99021 и 10 мкМ Y27632. Небольшие разрушенные Органоид фрагменты формируются в небольших кистозных органоидов в течение 24 часов.
День 5:
- Обновить средних и дополнить с выбором антибиотика (для пуромицином, используйте 4 мкг / мл).
День 7:
- Замените среду для стандартного Органоид культуральной среде, дополненной выбора антибиотика.
ПРИМЕЧАНИЕ: Многообещающий будет завершена через 2-3 недели после Chir99021 вывода. После выбора, органоиды могут быть выращены без выбора антибиотика.
4. Органоид Получение РНК для количественного RT-PCR или Microarray
- Для приготовления РНК, использования коммерческого набора в соответствии с протоколом производителя. Удалить среду из органоидов и добавить 350 мкл буфера RLT, дополняющие β-меркаптоэтанола прямо на куполе матригель, содержащий органоидов. Ресуспендируют материааль в RLT с помощью пипетки с помощью P1000 микропипетку.
- Выполните дальнейшие РНК приготовительные в соответствии с протоколом производителя.
- Дополнительно: увеличить РНК урожай на амплификации с использованием системы Ovation Pico WTA, требуя первоначальный вклад в 50 мкг общей РНК в соответствии с протоколом производителя.
- Дополнительно: для контроля качества до РНК микрочипов, запускать образцы на 2100 Bioanalyzer, использующие эукариотов общей РНК нано чип, стремясь к номеру целостности РНК (РИН) 8,5 или более (рис 5) в соответствии с протоколом производителя.
5. Обработка органоиды для парафин и иммуногистохимии
- До начала Органоид вложения предварительно нагреть алюминиевый блок с отверстиями подходящие 12 мм Диаметр стеклянных трубок в инкубаторе при 70 ° С, чтобы парафин жидкий.
- Возьмите одну скважину Матерый органоидов и снимите среду, оставляя встроенные органоиды нетронутыми.
- Добавить 1 мл4% параформальдегида в PBS прямо так и исправить при 4 ° С в пределах от 1 ч до в течение ночи.
- Замените параформальдегида с 1 мл ледяного PBS.
Дополнительно: сохранить фиксированные органоиды в PBS до 1 недели при 4 ° С после этого шага. - Ресуспендируют фиксированные органоиды в 1 мл PBS и поместить в стеклянную пробирку.
- Пусть органоиды опускаются на дно в течение 1 мин, декантируют PBS и заменить 70% -ным этанолом, в котором пару капель раствора эозина растворенного чтобы позволить визуализацию органоидам в течение всего процесса погружения.
- Оставьте органоиды в 70% -ном этаноле при комнатной температуре. Через 30 мин удалить 70% этанола, тщательно декантируют, будучи в состоянии визуализировать органоиды на глаз из-за незначительного розоватого цвета эозином. Заменить вложение раствор с 96% -ным этанолом.
- Повторите шаг 5,7, каждый раз заменяя вложение решение со следующей. Проход через органоиды следующих растворов: впоследствии 70% -ным этанолом, 90% этанолом, 96% этанолом, 100% ETHAнол, 100% этанола, ксилол, ксилол.
- Слейте последний ксилола мыть и залить парафином в трубку. Поместите трубку непосредственно в предварительно нагревают алюминиевым блоком при 70 ° С в течение 30 мин и заменить парафин с новой чистой парафина.
- Налейте парафин с и пипетки органоиды в парафиновый блок форму, используя предварительно нагретой Пастера пипетки с большим отверстием. Держите Пастера пипетки теплым, используя горелку. Поместите все органоиды в парафиновый блок пресс-формы в небольшом слое жидкого парафина.
- Насколько это возможно, пытаются манипулировать все органоиды в направлении центра парафинового блока пресс-формы с помощью нагретого рассечение иглу. Держите рассечение иглы тепло с помощью горелка Бунзена.
- Когда локализация органоидов в форме удовлетворительное, кокиль слегка затвердеть слой парафина.
- Закончите блок, подливая керосин сверху и добавить стандартную гистологическую вложение кассету.
Результаты
Органоид лентивирусный трансдукции
Техника Органоид трансдукции с использованием лентивирусные частицы зависит от правильного обращения с органоидов до и во время трансдукции. Органоидам (3А) культивировали и они были разрушены на отдельные крипт (фиг.3В). Как сообщалось ранее, эти единичные склепы, при культивировании в присутствии GSK3 ингибитора Chir99021 стал кистозные склепы 9 (рис 3в). Впоследствии органоиды обрабатывали трипсином, чтобы позволить проникновение вирусных частиц в отдельных клетках. При трансдукции клеток с лентивирусов частиц, количество методов может быть рассмотрено, чтобы повысить эффективность трансдукции, такие как spinoculation или длительной инкубации. С высоким титром ПГК-EGFP лентивирус был использован для того, чтобы визуализировать трансдукции эффективности флуоресцентной микроскопии. Трансдукция эффективность органоидов с этой плазмиды был высоким и приближается к 100% (Figurе 4E, F). Повышение эффективности использования spinoculation (фиг.4а, б) или длительной инкубации с лентивирусов частиц (фиг.4С, д) так, следовательно, не дают дополнительные преимущества.
Выделение РНК
Были выращены Следующая органоиды для экстракции РНК. Матерый органоиды были собраны, подвергшихся гамма-облучения или лечения управления, чтобы показать нарушение целостности РНК (рисунок 5). После облучения 6 Гр, РНК деградации и по сравнению с контрольными обработанные органоиды, количество целостность РНК (RIN) уменьшается.
Иммуногистохимии залитых парафином органоидов
После инкубации органоиды в течение 2 часов в культуральной среде с добавлением ВДУ, органоиды в формалине фиксировали и обрабатывали для иммуногистохимии (Рисунок 6). Использование мыши против BrdU, пролиферативные клетки можно было наблюдать в Crypt-SEGMдоставляет услуги органоидов, а не в дифференцированном отсека.
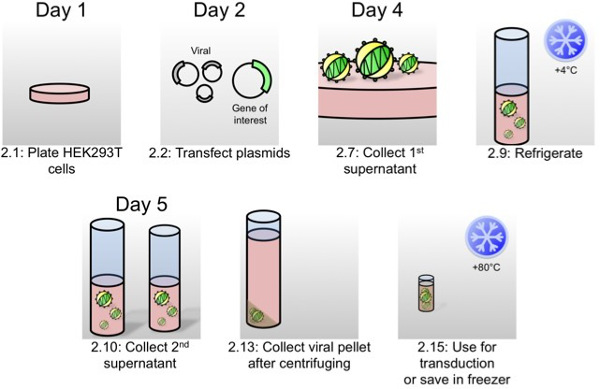
Рисунок 1:. Схема лентивирусом продукции для Органоид трансдукции Как написано в протокольной части 2, в этой схеме, наиболее важные шаги производства вируса представлены с шагом протокол чисел и времени.
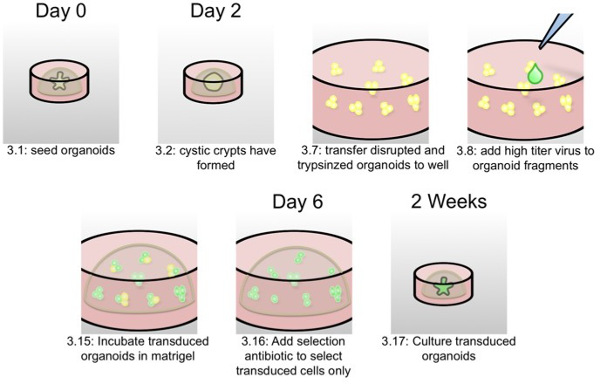
Рисунок 2:. Схема лентивирусным трансдукции органоидов Как написано в протокольной части 3, в этой схеме, наиболее важные шаги Органоид трансдукции представлены с шагом протокол чисел и времени.
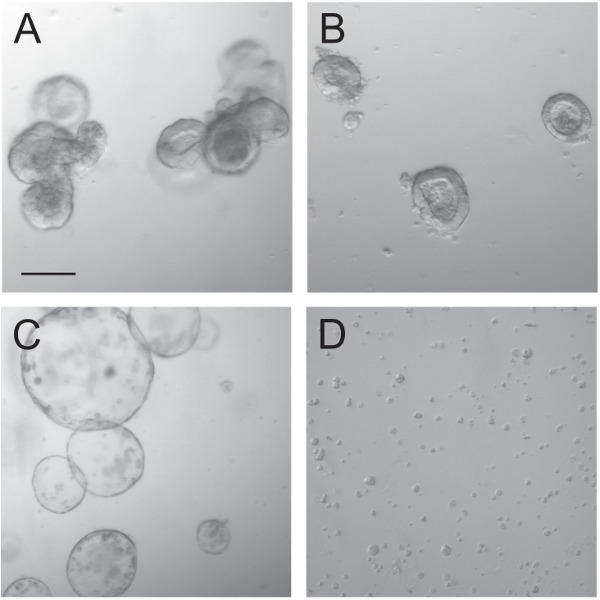
Рисунок 3: органоиды до и во время Transduction. Обычно растущие органоиды (A) делятся на плотно растущих малых органелл (B), которые становятся кистозный после инкубации с Chir99021 для количества дней (С). По диссоциации этих органоидов, используя трипсин, отдельные клетки и небольшие скопления клеток остается (D), которые трансдуцировали впоследствии. Шкала бар 100 мкм.

. Рисунок 4: трансдукция органоидам использованием лентивирусов векторов экспрессии светлого изображения (А, С, Е, G) и флуоресцентные изображения (В, D, F, H) от органоидам, которые были трансфицированы либо PGK-EGFP лентивирусов (- F) или контролировать лентивирус (G, H). EGFP выражение в органоидов после лентивирусным трансдукции с использованием как spinoculation и расширенный инкубации (A, B), spinoculation только (C, D) или каких-либо дополнительных шагов, чтобы увеличить трансдукции эффективность (E, F), по сравнению с контрольными векторные трансдуцировали органоиды, которые этого не делают выразить EGFP (G, H). Заметим, что использование ПГК-EGFP Lentiviral конструкцию, трансдукция эффективность не значительно увеличилось за счет дополнительных шагов. Шкала бар 100 мкм.
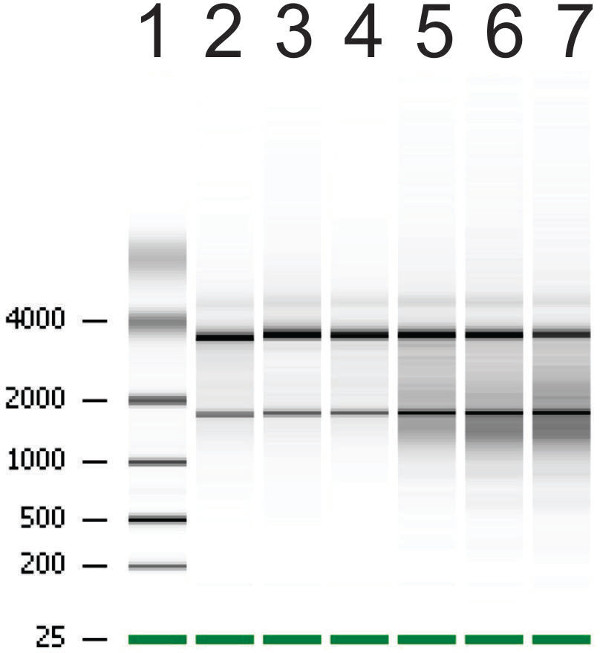 Рисунок 5:. Представитель результатом РНК Preps из органоидов на Bioanalyzer Примечание сильный демаркации полос, представляющих высокую степень целостности РНК в дорожках 2-4 и смазать вокруг полосы на дорожках 5-7, представляющих целостность журнала РНК. Количество целостность РНК (РИН) полос 2-4 8.7, 9.2 и 9 соответственно, в то время как тон РИН полос 5-7 6.4, 6.6 и 5.5.
Рисунок 5:. Представитель результатом РНК Preps из органоидов на Bioanalyzer Примечание сильный демаркации полос, представляющих высокую степень целостности РНК в дорожках 2-4 и смазать вокруг полосы на дорожках 5-7, представляющих целостность журнала РНК. Количество целостность РНК (РИН) полос 2-4 8.7, 9.2 и 9 соответственно, в то время как тон РИН полос 5-7 6.4, 6.6 и 5.5.

Рис. 6: иммуногистохимический анализ фиксированных формалином парафином органоидам Фиксированные в формалине и парафин 4 мкм секцию органоидам культивируемых в присутствии BrdU в течение двух часов и затем фиксируется. Раздел окрашивали анти-BrdU антителами. Масштабная линейка 100 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
| Щелочной среде | Дополнения | |
| Клеточная линия питательная среда | DMEM | 10% ФТС |
| 1% пенициллина / стрептомицина | ||
| 2 мМ Glutamine | ||
| Органоид культуральной среды | Расширенный DMEM F12 | HEPES |
| 1% пенициллина / стрептомицина | ||
| 1x Glutamax | ||
| 1% N2 добавка | ||
| 2% B27 дополнения | ||
| 125 нМ н-ацетилцистеин | ||
| мыши Egf (50 нг / мл) | ||
| 10% моголь-Fc-кондиционированной среды (эквивалент 100 нг / мл) | ||
| 10% RSPO1-Fc-кондиционированной среды (эквивалент 500 нг / мл) |
Таблица 1: Состав среды культивирования.
Обсуждение
Протокол ток ролик описывает Lentiviral трансдукции органоидов из первичного кишечного эпителия и вниз по течению анализа этих органоидов, используя количественные методы РНК и иммуногистохимии.
Lentiviral трансдукция часто выполняется в прикрепленных или плавающих клеток в культуре пластин. Поскольку трехмерная структура органоидам делает их трудно проникнуть вирусными частицами, ряд методов, чтобы увеличить эффективность использования. Предварительная обработка органоидов, используя Chir99021 увеличивает пролиферацию и тем самым жизнеспособность после трансдукции. Важно, чтобы поддерживать небольшие кластеры клеток после обработки трипсином, так отдельные клетки уменьшились выживаемость. В отличие от вирусных трансдукции с использованием мышиного ретровируса, лентивирусные каскадов являются более эффективными и обычно не требуют spinoculation, технику, известную на повышение трансдукции эффективности в ЭС клеток 10. При использовании мышиных ретровирусов или WHан лентивирусов трансдукции урожайности низкой эффективности, spinoculation необязательно могут быть использованы для увеличения скорости трансдукции. Мы не регулярно оценивать титр вируса, так как все имеющиеся вируса от одного раунда продукции для трансдукции органоидов, полученных из максимально два 0,95 см 2 скважин был использован. Кроме того, как правило, используют выбор антибиотиков для удаления не-трансдуцированных клеток. Оценка титра вируса, однако, может иметь значение при возникновении проблем с трансдукции эффективности.
Идентичный адгезивных клеток, уровень выбора антибиотика может увеличить количество вирусных интеграции и тем самым экспрессию трансгена. Использование высокого уровня пуромицин (10 мкг / мл), чтобы получить высокий трансгенной экспрессии и эффективного нокдаун, но когда органоиды проявляют признаки токсичности, более низкие уровни могут быть использованы (минимально 1 мкг / мл). Кроме того, альтернативные антибиотики отбора могут быть использованы или выбора может быть исключен, хотя трансдукции, вероятно,быть неполной и не может привести к долгосрочной стабильной экспрессии. Кроме того, поскольку интеграции лентивирусов в геноме неоднородна по всей популяции клеток, экспрессию трансгена может быть подавить изменения после культивирования клеток в течение длительного времени. Это может быть результатом селективного давления на экспрессии трансгена. Хотя выбор антибиотика ограничивает эти изменения, они могут оставаться, особенно в случае конститутивной экспрессии трансгенов. Этот недостаток может быть преодолен путем одной клетки клонирования органоидам, но этот метод требует много времени. Лентивирусов трансдукции может быть выполнена с широким спектром плазмид, которые приводят к любой стабильной или индуцируемой экспрессии трансгенов. Эти трансгены, как правило, выражается в повсеместно промоторов, таких как CMV или PGK промотора и может привести к сверхъестественной экспрессии. Как трансгенной сверхэкспрессии в раковых клеточных линий или модельных животных, осторожность оправдана интерпретации результатов сюдам избыточная экспрессия.
Для экспериментов, которые требуют РНК, низкое количество жизнеспособных клеток, обычно выращивают в одном 0,95 см 2 (а стандартной площади поверхности 48 а) в отличие от адгезивных клеток, которые могут быть легко выращенных в больших колб является скорость ограничивающим фактором для качества и множества вниз по течению анализа. Мы обнаружили, что, как правило, один и около 50 полных выращенных органоиды выходами от 0,4 мкг до 1 мкг тотальной РНК, является достаточным для количественной ОТ-ПЦР РНК и микрочипов без дальнейшего усиления. Некоторые схемы лечения или генетические изменения могут снизить содержание РНК существенно то ни было. Первый шаг к повышению общей РНК является объединение нескольких скважин.
Для парафин из органоидов, очень важно, чтобы получить достаточное количество материала для того, чтобы визуализировать органоиды в ходе процесса. Добавление незначительных количеств эозином в основных органоидов позволяет визуализировать органоидам во всейПроцесс, но не является обязательным для нормального вложения и может быть пропущен, когда эта стадия мешает дальнейшему анализу. Как правило, парафиновые-вложение кассеты имеют отверстия в них, чтобы фиксирующие поток и технологических решений в ткани в кассете.
Lentiviral Органоид трансдукции и подготовка для последующих методов стандартных повышает научный потенциал этих культур и повышает уровень в клеточной культуре в трехмерных методов из первичного кишечного эпителия. Диапазон вниз по течению экспериментов должны быть выполнены, однако, не ограничивается способами, описанными в данном протоколе, и может включать в себя все методы, выполненные на клеточных линий или мышей, учитывая количество клеточного материала, генерируемого культуры достаточно. В исследовании на конкретных генетических элементов и их функции в кишечном эпителии, гомологичных методов рекомбинации в модельных животных, в первую очередь мышей, остаются золотым стандартом. Культуры органоидов сделатьне содержат мезенхимальные или иммунологические клетки ниши и культурные склепы постоянно расширяется, контрастируя ситуации, сложившейся в естественных условиях. Тем не менее, эти культуры подняли качество результатов в пробирке значительно, и принимая во внимание мириады вниз по течению методы, которые могут быть выполнены, Органоид культура имеет и будет в значительной активизации исследований, посвященных кишечного эпителия.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
J. Heijmans is supported by a stipendium from the Dutch cancer foundation (KFW). G.R. van den Brink is supported by funding from the European Research Council under the European Community’s Seventh Framework Program (FP7/2007-2013)/European Research Council grant agreement number 241344 and by a VIDI grant from the Netherlands Organization for Scientific Research (GvdB).
Материалы
| Name | Company | Catalog Number | Comments |
| Polyethylene imine | Polysciences | 23966-2 | |
| DMEM medium | Lonza | BE12-614F | |
| Fetal calf serum | Lonza | DE14-801F | |
| Penicillin-streptomycin | Invitrogen | 15140-122 | |
| Glutamin | Invitrogen | 25030-024 | |
| matrigel | BD | BD 356231 | |
| Advanced DMEM-F12 | Gibco | 12634-010 | |
| N2 | Invitrogen | 17502-048 | |
| B27 | Invitrogen | 17504-044 | |
| N-acetyl cysteine | Sigma | A9165-1G | |
| mouse Egf | Invitrogen | PMG8045 | |
| Hepes 1 M | Invitrogen | 15630-056 | |
| glutamax 100x | Invitrogen | 35050-038 | |
| Chir 99021 | Axon | 1386 | |
| Y27632 | Sigma | Y0503-5MG | |
| polybrene | Sigma | 107689 | |
| nicotinamide | Sigma | N0636 | |
| Trypsin | Lonza | BE02-007E | |
| puromycin | Sigma | P 7255 | |
| Rneasy mini kit | Qiagen | 74106 | |
| β-mercaptoethanol | Merck | 8,057,400,250 | |
| Ovation Pico WTA system | NuGen | 3300-12 | |
| paraformaldehyde | Sigma | 252549-1L | |
| glass vial conical 12 mm x 75 mm 5 ml | VWR | LSUKM12 | |
| Eosin Yellowish | VWR | 1,159,350,025 |
Ссылки
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Al-Nafussi, A. I., Wright, N. A. The effect of epidermal growth factor (EGF) on cell proliferation of the gastrointestinal mucosa in rodents. Virchows Archiv. B, Cell Pathology Including Molecular Pathology. 40 (1), 63-69 (1982).
- Haramis, A. P., et al. De novo crypt formation and juvenile polyposis on BMP inhibition in mouse intestine. Science. 303 (5664), 1684-1686 (2004).
- Zhao, J., et al. R-spondin1, a novel intestinotrophic mitogen, ameliorates experimental colitis in mice. Gastroenterology. 132 (4), 1331-1343 (2007).
- Schwank, G., Andersson-Rolf, A., Koo, B. K., Sasaki, N., Clevers, H. Generation of BAC transgenic epithelial organoids. PLoS One. 8 (10), e76871(2013).
- Koo, B. K., et al. Controlled gene expression in primary Lgr5 organoid cultures. Nature Methods. 9 (1), 81-83 (2012).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Rep. 3 (4), 1128-1139 (2013).
- Roe, T., Reynolds, T. C., Yu, G., Brown, P. O. Integration of murine leukemia virus DNA depends on mitosis. The EMBO Journal. 12 (5), 2099-2108 (1993).
- Lau, W., et al. Lgr5 homologues associate with Wnt receptors and mediate R-spondin signalling. Nature. 476 (7360), 293-297 (2011).
- Bahnson, A. B., et al. Centrifugal enhancement of retroviral mediated gene transfer. Journal Of Virological Methods. 54 (2-3), 131-143 (1995).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены