Method Article
レンチウイルス形質導入と腸オルガノイドの下流分析のためのプロトコル
要約
In this video protocol we give a step by step explanation of lentiviral transduction in organoids of primary intestinal epithelium and of processing and downstream analysis of these cultures by quantitative RT-PCR, RNA-microarray and immunohistochemistry.
要約
Intestinal crypt-villus structures termed organoids, can be kept in sustained culture three dimensionally when supplemented with the appropriate growth factors. Since organoids are highly similar to the original tissue in terms of homeostatic stem cell differentiation, cell polarity and presence of all terminally differentiated cell types known to the adult intestinal epithelium, they serve as an essential resource in experimental research on the epithelium. The possibility to express transgenes or interfering RNA using lentiviral or retroviral vectors in organoids has increased opportunities for functional analysis of the intestinal epithelium and intestinal stem cells, surpassing traditional mouse transgenics in speed and cost. In the current video protocol we show how to utilize transduction of small intestinal organoids with lentiviral vectors illustrated by use of doxycylin inducible transgenes, or IPTG inducible short hairpin RNA for overexpression or gene knockdown. Furthermore, considering organoid culture yields minute cell counts that may even be reduced by experimental treatment, we explain how to process organoids for downstream analysis aimed at quantitative RT-PCR, RNA-microarray and immunohistochemistry. Techniques that enable transgene expression and gene knock down in intestinal organoids contribute to the research potential that these intestinal epithelial structures hold, establishing organoid culture as a new standard in cell culture.
概要
腸上皮は、それが癌や幹細胞の研究から幅広い関心を引き付けるために引き起こした最も急速に増殖する身体組織の一つである。 2009年には技術が3次元構造1を保全、マトリゲルに小腸陰窩の長期的な文化を生成するために出版された。これらの構造は、腸のオルガノイドと呼ばBMPのシグナル伝達経路阻害剤のノギン(ノグ)を含む定義された成長因子の数は、1(Rspo1)をrspondinはWntシグナル伝達経路の増強剤を補充した周囲の媒体との、標準的な技術を用いて培養することができ上皮成長因子(EGF)は、すべての腸の増殖2-4を増強することが見出さ。
オルガノイドは、それらが非変異している点で、伝統的な癌細胞株を上回る幹細胞の階層構造を維持している、発生期の小さなint型で見つかったすべての細胞系統にそのまま携帯分極、展示分化を表示estinal上皮。これらは導入遺伝子を担持するように形質導入され得るか、またはRNA干渉は5構築ので、コストと速度のファセットトランスジェニックマウスを用いた実験を上回るため、特定の遺伝的要素を研究するために使用される。オルガノイドにおけるトランスジェニック発現は、マウスレトロウイルスまたはレンチウイルスベクターは6,7のいずれかを用いて行うことができる。による有糸分裂細胞もっぱら8を形質導入することが可能なマウスレトロウイルスの制限のため、レンチウイルス形質導入は、より頻繁にオルガノイドのように感染することが困難である細胞のために使用される。
ウイルス形質導入および安定的に発現するトランスジェニックオルガノイド分析および免疫組織化学、定量的RNAを含む、下流の分析の多数のために使用することができる。総合すると、主要な腸上皮細胞からオルガノイドの文化は、特定の実験室の要件なしに実装するのは簡単ですルーチン技術へと進化してきました、およびCEにおける新規標準となっている腸上皮の研究におけるLL文化。
オルガノイドでのウイルス形質導入およびその後の下流の分析の技術は、実行することが、我々は、培養オルガノイドのレンチウイルス形質導入のための方法を示し、このビデオプロトコルを生成したオルガノイド実験を支援するために面倒である。我々はさらに、収率を増加させるので、RNA技術または免疫組織化学を用いて、下流の分析の性能を向上させることができる方法を正しい処理オルガノイドを示す。説明される技術は、同様に、結腸オルガノイドに適用することができるが、プロトコルでは、小腸の陰窩から誘導されるオルガノイドが独占的に使用された。
プロトコル
トランスフェクション試薬としてポリエチレンイミン(PEI)の調製
- H 2 O 100ml中にPEIの約150mgの溶解
- 溶液が透明になるまで塩酸を加えてpHを7.4に溶液を調整し、完全に溶解するまで撹拌する。これは、10〜60分を取り、1mg / mlの最終濃度に水を追加してもよい。
- ときに明確な、5ミリリットルの分量で℃の冷凍庫-80℃で滅菌した0.22μmのフィルターとストアを介してPEI溶液をフィルタリングする。
レンチウイルス粒子の2生産
1日目:
- 細胞株の培養液162 25cm 2フラスコまたは大きなペトリ皿中の60%-80%集密に分割HEK293T細胞(DMEM、10%FCS、1%ペニシリン/ストレプトマイシンおよび2mMグルタミンサプリメントを補充した)。
2日目:
- 一緒に添加することにより、総プラスミドDNAの45μgのを含有するDNAトランスフェクション溶液を準備レンチウイルスパッケージングベクター(pVSVgの7μgの、のpRSVのREV5μgの、PMDLの13μgの)と、興味や関心のあるshRNAの遺伝子をコードするレンチウイルスプラスミド20μgの。 DMEMを用いて、1ミリリットルの容積に調整します。
- DMEMの930μlに1 mg / mlのPEIの90μLを添加することにより、PEIのトランスフェクション溶液を調製し、室温で5分間インキュベートする。
- PEI溶液へのDNAのトランスフェクション溶液を加える。ボルテックスまたは回数を反転し、DNAトランスフェクション溶液を得るために、室温で5分間インキュベートする。
- HEK293T細胞へのDNAのトランスフェクション溶液2mlを滴下すると、37℃で加湿細胞培養インキュベーター中で4時間インキュベートする。
- 4時間後、PEIを除去して、培地をリフレッシュ。これは、新たな培地を添加する前に細胞を洗浄する必要はない。
注:PEIは4時間よりも長く細胞毒性およびインキュベーション時間はHEK293T細胞に害を引き起こす可能性がある。
4日目:
- Supeのを交換してください新しい培地でrnatant。上清(ウイルスを含む)を保持する。これは、ステップ2.10において使用される。
- 15ミリリットルのフラスコに上清を入れてください。死細胞、500×gで5分間遠心分離を削除するには。
- 大60ミリリットル注射器を用いて0.45μmのフィルターで上清を押してください。 4℃で一晩保管してください。
5日目:
- 上澄みの第二のバッチを収集。ステップ2.8から2.9のように遠心分離し、フィルター。
- 90分間超遠心機50,000×gでのステップ2.9と超遠心管中で2.10と遠心機からの上清をプール。
- 非常に慎重に超遠心管を含むカプセルを取り出し、遠心内側チューブの向きを覚えて、層流フードに入れた。
- ペレットは、チューブの上側になるような方法で慎重に超遠心管とデカント媒体を保持開放カプセル。ウイルスのペレットが視覚化するのが難しい場合がありますので、何に覚えているチューブの側面は、ペレットを形成しているでしょう。マイクロピペットを取り、超遠心分離管の底部の側に表示されている不透明な茶色のペレットを攪拌しないように注意しながら、媒体の最後のビットを削除する。
- 10 mMのニコチンアミド、10μMCHIR99021、10μMのY27632及び8 / mlのポリブレンを補足したオルガノイド培養液500μlにこのペレットを再懸濁。高力価ウイルスを直接オルガノイドをtransductするために使用されるので、この培地中で再懸濁することが重要である。
- オプション:-80℃における250μLの2回に分けて等分し、この中でウイルスを凍結する。
オルガノイド3.レンチウイルス形質導入
0日目:
- 約50の小さなオルガノイドを得ることを目指し、新たな井戸に形質導入2日前オルガノイドのフル0.95センチメートル2うまく分割します。以前に公開されたプロトコル1( 図3A、B)に応じてオルガノイド分割します。
- 嚢胞ハイパー増殖陰窩( 図3C)を取得するために、10μMCHIR99021および10 mMのニコチンアミドを含む培養培地をオルガノイドサプリメント。
注:たてスプリットオルガノイドはCHIR99021の存在下で増殖させた場合嚢胞性陰窩は、最高の開発します。
2日目:
- それによってP1000マイクロピペットとの混合物を破壊し、ピとマトリゲルとメディアダウンによる収穫オルガノイド。 15ミリリットルチューブに混合物を配置します。
- 遠位開口部を溶融することにより減少されたパスツールピペットを用いてさらに混乱させる。遠心分離機は、100×gで5分間ペレット化しオルガノイド。
注:遠心機の大きさに依存は、異なる遠心分離速度を使用しています。これは、破壊されたオルガノイドを混合物から分離された正確な速度を求める必要がある。 - 上清を除去し、予め温めておいた500μlのを追加する1×トリプシン(0.25%トリプシンに似ています)。トリプシンでオルガノイドを再懸濁し、インキュベート37℃の水浴中で3分間。
- 細胞株の培養培地中の3.5を加えてトリプシンを不活性化(DMEM、10%FCS、1%ペニシリン/ストレプトマイシンおよびグルタミンを補充した)。 500×gで5分間遠心。
- メディアの約20μlのペレットを残して上清を取り除きます。 48ウェルプレート上のウェルに培地のこの最後の少量オルガノイドを転送します。
- ステップ2.14で説明したように、伝達媒体中の高力価レンチウイルスを追加し再懸濁し、3.10に進みます。低い形質導入効率に遭遇した場合は、ステップ3.9を添加してもよい。
注:効率的な形質導入のために、典型的オルガノイドの1ウェルに高力価レンチウイルス250μlのの1アリコートを追加します。このプロトコールのステップ2に記載したように、これは、単一の生産からのすべての収穫レンチウイルスの50%を占める。 - オプション:32に予め温め遠心機でオルガノイドを含む48ウェルプレートを置くことによってピノキュレーションを行い、形質導入効率を向上させるために6; C、1時間、600×gで回転させる。
- 培養インキュベーター中オルガノイド、ウイルス混合物を入れて形質導入を可能にするために培養インキュベーター中、37℃で1時間インキュベートする。
- オプション:さらに培養インキュベーター中、37℃でさらに3時間インキュベートオルガノイドを、形質導入効率を向上させることができる。
- オルガノイド培養液の1ミリリットルを追加し、オルガノイドウイルス混合物を再懸濁し、オルガノイドをペレットに850×gで5分間微量マイクロ遠心チューブと遠心分離機に移す。
- 上清を除去し、氷冷マトリゲル20μlのペレットを再懸濁。それは暖かくなったときに材料が固化するので、回数のために冷PBSアップピペットで氷下で冷却されたピペットチップを使用しています。
- 48ウェルプレートにウェルの中央に小滴を入れて、固化し、15分間37℃で培養インキュベーター中でインキュベートする。
- 15分後、慎重に補充したオルガノイド培養培地250μlを添加する10 mMのニコチンアミド、10μMCHIR99021および10μMY27632。小型破砕オルガノイドの断片は24時間以内に小さな嚢胞オルガノイドに形成することになる。
5日目:
- メディア更新し、選択抗生物質で補う(ピューロのために、4 / mlのを使用します)。
7日目:
- 選択抗生物質を補充した標準オルガノイド培養液、ための媒体を交換してください。
注:出芽は2~3週間CHIR99021の撤退後に完了します。選択後、オルガノイド、選択抗生物質なしに成長させることができる。
定量的RT-PCRまたはマイクロアレイ4.オルガノイドRNAの準備
- RNA調製のために、製造者のプロトコールに従って市販のキットを使用する。オルガノイドから培地を除去し、バッファRLT350μlのを追加し、ストレートオルガノイドを含むマトリゲルのドームにβメルカプトエタノールを補充した。 materiを再懸濁P1000のマイクロピペットを用いてピペッティングすることによりRLTでアル。
- 製造業者のプロトコルに従って、さらにRNAの準備を行います。
- オプション:製造業者のプロトコールに従って50μgの総RNAの初期入力を必要とする、オベーションピコWTAシステムを使用して増幅することによってRNAの収量を増加させる。
- オプション:RNAマイクロアレイの前に、品質管理のために、製造業者のプロトコールに従って8.5以上( 図5)のRNA完全性番号(RIN)を目指して、真核生物全RNAナノチップを使用して2100バイオアナライザー上で実行したサンプル。
パラフィン包埋し、免疫組織化学5.処理オルガノイド
- パラフィン、液体を保持する穴に前加温アルミニウムブロックを70℃のインキュベーター中に嵌合する直径12mmのガラス管を埋め込むオルガノイドの開始前。
- そのまま埋め込まれたオルガノイドを残して、完全に成長したオルガノイドで単一のウェルを取り、培地を除去。
- 1ミリリットルを追加PBS中の4%パラホルムアルデヒドのストレートによく、どこでも1時間一晩に4℃で固定してください。
- 氷冷PBS 1mlのホルムアルデヒドを交換してください。
オプション:このステップの後、4℃で1週間までのPBSで固定オルガノイドを保つ。 - 1mlのPBSで固定オルガノイドを再懸濁し、ガラスバイアルに入れる。
- オルガノイドは、1分間の底に沈むPBSをデカントし、エオシン溶液の液滴のカップルが埋め込みプロセスを通してオルガノイドの可視化を可能にするために溶解した70%エタノールで代わっ。
- 室温で70%エタノールでオルガノイドのままにしておきます。 30分後、慎重にあるため若干のピンクがかったエオシン色の目でオルガノイドを視覚化することができるという、デカンテーションによって70%のエタノールを除去。 96%エタノールに埋め込むソリューションを交換してください。
- 手順を繰り返し5.7、次の1と埋め込みソリューションを交換するたびに。続いて、次のソリューションを通じてオルガノイドを渡す:70%エタノール、90%エタノール、96%エタノール、100%ETHAをタノール、100%エタノール、キシレン、キシレン。
- 最後のキシレン洗浄をデカントし、チューブにパラフィンを注ぐ。 30分間、70℃でアルミブロックを温め前にすぐにチューブを入れて、新しいクリーンなパラフィンでパラフィンを交換してください。
- 大きな開口部を予め温めパスツールピペットを用いて、パラフィンブロックの型にオフパラフィン及びピペットオルガノイドを注ぐ。ブンゼンバーナーを使用して、パスツールピペットを暖かく保つ。流動パラフィンの小さな層にパラフィンブロック金型内のすべてのオルガノイドを置きます。
- できる限り、温め解剖針を用いてパラフィンブロック金型の中心に向かってすべてのオルガノイドを操作してみてください。ブンゼンバーナーを使用して、解剖針を暖かく保つ。
- 鋳型内のオルガノイドの局在化が良好である場合に、パラフィン層を固化するためにわずかに金型を冷却する。
- 上に多くのパラフィンを注ぐことにより、ブロックを終了し、標準的な組織学的埋め込みカセットを追加します。
結果
オルガノイドレンチウイルス形質導入
レンチウイルス粒子を使用したオルガノイド形質導入の技術は前と形質導入時のオルガノイドの正しい取り扱いに依存します。オルガノイド( 図3A)を培養し、それらは単一の陰窩( 図3B)に破砕した。既報の通り、GSK3阻害剤CHIR99021の存在下で培養されたこれらの単一陰窩は、嚢胞性陰窩9( 図3C)をとなった。その後オルガノイドは、単一の細胞にウイルス粒子の侵入を可能にするためにトリプシン処理した。レンチウイルス粒子を細胞に形質導入する際に、多くの方法は、スピノキュレーションまたは長期インキュベーションなどの伝達効率を向上させることを試みてもよい。高力価PGK-eGFPをレンチウイルスは、蛍光顕微鏡法によって形質導入効率の可視化を可能にするために使用した。このプラスミドオルガノイドの形質導入効率が高く、100%に近づいた(FIGUR電子4E、F)。レンチウイルス粒子( 図4C、D)でピノキュレーション( 図4A、B)を使用して、有効性または長期のインキュベーションを改善することは、したがって付加価値を得られなかった。
RNA抽出
RNA抽出のための次のオルガノイドを成長させた。完全に成長したオルガノイドが低減RNAの完全性( 図5)を表示するためにガンマ線照射または対照処理を施したことを採取した。 Gyを、RNAが分解処理されたオルガノイドを制御するために比較される6を照射すると、RNA完全性番号(RIN)が低減される。
パラフィン包埋オルガノイド上の免疫組織化学
BrdUを補充した培地中で2時間オルガノイドをインキュベートした後、ホルマリンでオルガノイドを固定し、免疫組織化学( 図6)のために処理した。マウス抗BrdUをを使用して、増殖性細胞は、陰SEGMで観察することができオルガノイドのとしないの分化の区画にエント。
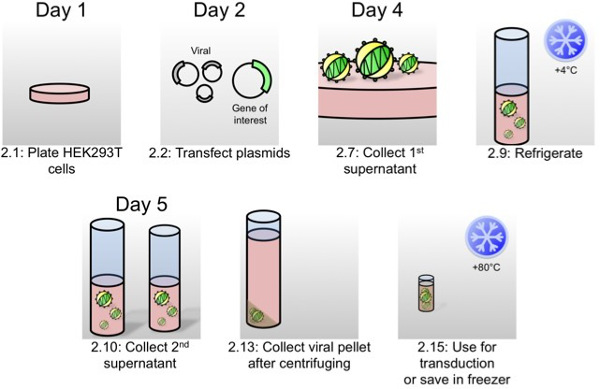
図1:オルガノイド形質導入のためのレンチウイルス産生の概略プロトコルで記述されたよう部2は、この概略図において、ウイルス産生の最も重要なステップは、プロトコルのステップ番号とタイミングで表されている。
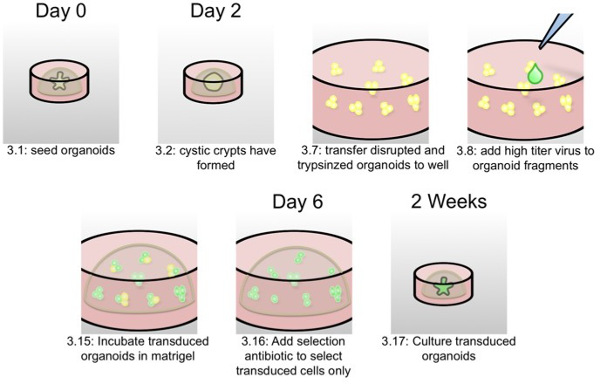
図2:オルガノイドのレンチウイルス形質導入の回路図この回路図では、プロトコル部分3で書かれたように、オルガノイド形質導入の最も重要なステップは、プロトコルのステップ番号とタイミングで表されます。
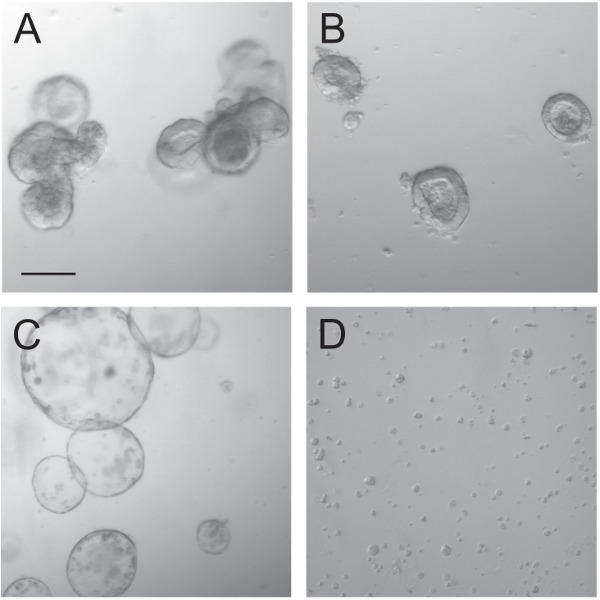
図3:オルガノイド前およびトラン間にsduction。通常は成長しているオルガノイド(A)は、日数(C)用のCHIR99021とのインキュベーション後に嚢胞になる高密度に成長している小さなオルガノイド(B)に分割されている。トリプシンを用いてこれらのオルガノイドの解離により、単一細胞、細胞の小塊は、その後、形質導入された(D)のままである。スケールバーは100μm。

図4:レンチウイルス発現ベクターを用いてオルガノイドの形質明視野画像(A、C、E、G)および蛍光画像(B、D、F、H)、PGK-eGFPをレンチウイルス(A - F)のいずれかでトランスフェクトしたオルガノイドから。または、(Gをレンチウイルスを制御する H)をngの。スピノキュレーション拡張インキュベーションの両方を使用してレンチウイルス形質導入後オルガノイドにおけるeGFP発現は、(A、B)は 、スピノキュレーションのみ(C、D)または形質導入効率(E、F)を向上させる追加手順なし、しないベクターで形質導入オルガノイドを、対照と比較しeGFPを(G、H)を発現する。 PGK-eGFPをレンチウイルス構築物を用いて、形質導入の有効性が大幅に追加のステップによって増加しないことに注意してください。スケールバーは100μm。
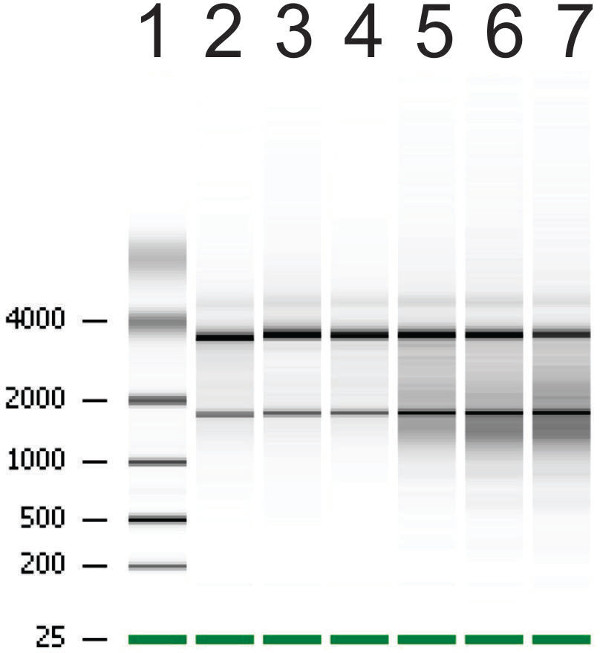 図5:バイオアナライザー上のオルガノイドからのRNAプレップの代表的な結果は、レーン2-4で高いRNAの完全性を表すバンドの強い境界に注意し、ログRNAの完全性を表すレーン5-7上のバンドの周りに塗抹。バンド2-4のRNA完全性番号(RIN)は、Tに対し、それぞれ8.7、9.2および9である彼のバンド5-7のRINは6.4、6.6及び5.5である。
図5:バイオアナライザー上のオルガノイドからのRNAプレップの代表的な結果は、レーン2-4で高いRNAの完全性を表すバンドの強い境界に注意し、ログRNAの完全性を表すレーン5-7上のバンドの周りに塗抹。バンド2-4のRNA完全性番号(RIN)は、Tに対し、それぞれ8.7、9.2および9である彼のバンド5-7のRINは6.4、6.6及び5.5である。

図6:ホルマリン固定パラフィン包埋オルガノイドの免疫組織化学的分析ホルマリン固定パラフィン2時間のBrdUの存在下で培養したオルガノイドの4μmのセクションを埋め込 み、その後固定。。セクションは、抗BrdU抗体で染色される。スケールバーは100μm。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 塩基性媒体 | 追加 | |
| 細胞株の培養培地 | DMEM | 10%のFCS |
| 1%ペニシリン/ストレプトマイシン | ||
| 2 mMの胃腸utamine | ||
| オルガノイド培養液 | 高度なDMEM F12 | HEPES |
| 1%ペニシリン/ストレプトマイシン | ||
| 1Xグルタ | ||
| 1%のN2サプリメント | ||
| 2%のB27サプリメント | ||
| 125nMのn-アセチルシステイン | ||
| マウスEGF(50 ng / ml)を | ||
| (100ngの個/ mlに相当)、10%ノグ-Fcの馴化培地 | ||
| (500ngの個/ mlに相当)、10%Rspo1-Fcの馴化培地 |
表1:培養培地組成物。
ディスカッション
現在のビデオプロトコルは、プライマリ腸上皮からオルガノイドのレンチウイルス形質導入および定量的RNA技術と免疫組織化学を使用して、これらのオルガノイドの下流の分析を記載する。
レンチウイルス形質導入は、多くの場合、培養プレート中の付着または浮遊細胞で行われる。オルガノイドの三次元構造は、ウイルス粒子に浸透し、それらを困難にするので、有効性を高めるために多くの方法が使用されている。 CHIR99021を使用したオルガノイドの前処理は、形質導入後、増殖し、それによって生存能力を向上させます。これは、単一の細胞が生存率の低下しておりますので、トリプシン処理した後に小細胞クラスターを維持することが重要である。マウスレトロウイルスを用いたウイルスの形質導入とは対照的に、レンチウイルス形質導入は、より効率的であり、通常、ES細胞10に増加伝達効率に公知の技術をスピノキュレーションを必要としない。マウスレトロウイルスまたはWHを使用する場合レンチウイルス形質導入の収量が低い効力エン、スピノキュレーションは、任意の形質導入率を高めるために利用することができる。最大限2 0.95センチメートル2井戸から派生オルガノイドの形質導入のための生産のシングルラウンドから利用可能なすべてのウイルスが使用されたので、私たちは定期的に、ウイルス力価を評価しないでください。また、一般に、非形質導入細胞の除去のための抗生物質選択を使用しています。形質導入の有効性に問題が発生した際にウイルス力価の評価は、しかし、価値がある。
接着細胞と同一の、選択抗生物質のレベルは、ウイルスの積算回数を増加させ、それによって導入遺伝子の発現ができる。高いトランスジェニック発現および効果的なノックダウンを得るために高レベルのピューロマイシン(10μg/ ml)を使用するが、毒性のオルガノイドを示す符号は、低いレベル(最小限の1μg/ ml)を使用することができる時。また、代替の選択抗生物質を用いてもよいし、形質導入の可能性があるが、選択が、省略してもよい不完全であることが、これは長期的に安定した発現を生じないことがあります。ゲノム中のレンチウイルス組込みが細胞集団全体にわたって不均一であるので、また、導入遺伝子の発現は、長時間にわたって細胞を培養した後の変化に抑えることができる。これは、導入遺伝子の発現により選択圧に起因し得る。抗生物質の選択は、これらの変更を制限するが、それらは、特に、導入遺伝子の構成的発現の場合には、残ることがある。この欠点は、オルガノイドの単一細胞クローニングによって克服することができるが、この技術は時間がかかる。レンチウイルス形質導入は、導入遺伝子の安定性または誘導性のいずれかの発現を生じるプラスミド、多種多様に行うことができる。これらの導入遺伝子は、通常、CMVまたはPGKプロモーターなどの遍在性プロモーターから発現され、超自然的な表現になることがあります。癌細胞株またはモデル動物におけるトランスジェニック過剰発現と同様に、注意が往復結果を解釈保証されるm個の過剰発現。
RNAを必要とする実験のために、容易に大型フラスコ中で増殖させることができ、通常、付着細胞とは対照的に、ならびに単一0.95センチメートル2(48ウェルの標準の表面積)で増殖させ、生存細胞の数が少ない品質の律速因子であると下流の分析の多数。我々はさらに増幅なし、定量的RT-PCRおよびRNAマイクロアレイのために十分である、0.4および1μgの全RNAの間に約50のフル成長しオルガノイド利回りの通常、単一のウェルがわかります。特定の治療レジメンまたは遺伝的変化が大幅がRNA含有量を減少させることができる。トータルRNAを増加させる最初のステップは、複数のウェルをプールしている。
オルガノイドのパラフィン包埋のためには、プロセス中オルガノイドを可視化するために十分な材料を得ることが重要である。固定オルガノイドへエオシンの微量の添加は全体の中にオルガノイドの可視化を可能にするプロセスが、通常の埋め込みのために必要とされず、このステップは、さらなる分析を妨害するときに省略されてもよい。通常、パラフィン包埋カセットは、カセット内の組織に固定液とプロセスソリューションの流れを可能にするためにそれらに穴を持っている。
下流の標準技術のためのレンチウイルス形質導入オルガノイドおよび製剤は、これらの培養物の科学的可能性を増大させ、一次腸上皮から3次元技法細胞培養における標準を上げる。下流の実験の範囲で十分である培養によって生成された細胞物質の量が与えられ、ただし、現在のプロトコルに記載された技術に限定されず、実行されると、細胞株またはマウスで実行されたすべての技術を包含することができる。特定の遺伝的要素および腸上皮におけるそれらの機能に関する研究では、モデル動物における相同組換え技術、とりわけマウスは、ゴールドスタンダードのままである。オルガノイドの培養物をやる間葉または免疫学的ニッチ細胞と培養し陰窩が今までに生体内で見つかった状況を対比、拡大している含まれていませ。それにもかかわらず、これらの培養物が大幅にin vitroでの調査結果の質を上げ、考慮に入れ、オルガノイド培養が持って行うことができ、大幅に腸上皮の研究を強化する無数の下流の手法を取っている。
開示事項
The authors have nothing to disclose.
謝辞
J. Heijmans is supported by a stipendium from the Dutch cancer foundation (KFW). G.R. van den Brink is supported by funding from the European Research Council under the European Community’s Seventh Framework Program (FP7/2007-2013)/European Research Council grant agreement number 241344 and by a VIDI grant from the Netherlands Organization for Scientific Research (GvdB).
資料
| Name | Company | Catalog Number | Comments |
| Polyethylene imine | Polysciences | 23966-2 | |
| DMEM medium | Lonza | BE12-614F | |
| Fetal calf serum | Lonza | DE14-801F | |
| Penicillin-streptomycin | Invitrogen | 15140-122 | |
| Glutamin | Invitrogen | 25030-024 | |
| matrigel | BD | BD 356231 | |
| Advanced DMEM-F12 | Gibco | 12634-010 | |
| N2 | Invitrogen | 17502-048 | |
| B27 | Invitrogen | 17504-044 | |
| N-acetyl cysteine | Sigma | A9165-1G | |
| mouse Egf | Invitrogen | PMG8045 | |
| Hepes 1 M | Invitrogen | 15630-056 | |
| glutamax 100x | Invitrogen | 35050-038 | |
| Chir 99021 | Axon | 1386 | |
| Y27632 | Sigma | Y0503-5MG | |
| polybrene | Sigma | 107689 | |
| nicotinamide | Sigma | N0636 | |
| Trypsin | Lonza | BE02-007E | |
| puromycin | Sigma | P 7255 | |
| Rneasy mini kit | Qiagen | 74106 | |
| β-mercaptoethanol | Merck | 8,057,400,250 | |
| Ovation Pico WTA system | NuGen | 3300-12 | |
| paraformaldehyde | Sigma | 252549-1L | |
| glass vial conical 12 mm x 75 mm 5 ml | VWR | LSUKM12 | |
| Eosin Yellowish | VWR | 1,159,350,025 |
参考文献
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Al-Nafussi, A. I., Wright, N. A. The effect of epidermal growth factor (EGF) on cell proliferation of the gastrointestinal mucosa in rodents. Virchows Archiv. B, Cell Pathology Including Molecular Pathology. 40 (1), 63-69 (1982).
- Haramis, A. P., et al. De novo crypt formation and juvenile polyposis on BMP inhibition in mouse intestine. Science. 303 (5664), 1684-1686 (2004).
- Zhao, J., et al. R-spondin1, a novel intestinotrophic mitogen, ameliorates experimental colitis in mice. Gastroenterology. 132 (4), 1331-1343 (2007).
- Schwank, G., Andersson-Rolf, A., Koo, B. K., Sasaki, N., Clevers, H. Generation of BAC transgenic epithelial organoids. PLoS One. 8 (10), e76871(2013).
- Koo, B. K., et al. Controlled gene expression in primary Lgr5 organoid cultures. Nature Methods. 9 (1), 81-83 (2012).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Rep. 3 (4), 1128-1139 (2013).
- Roe, T., Reynolds, T. C., Yu, G., Brown, P. O. Integration of murine leukemia virus DNA depends on mitosis. The EMBO Journal. 12 (5), 2099-2108 (1993).
- Lau, W., et al. Lgr5 homologues associate with Wnt receptors and mediate R-spondin signalling. Nature. 476 (7360), 293-297 (2011).
- Bahnson, A. B., et al. Centrifugal enhancement of retroviral mediated gene transfer. Journal Of Virological Methods. 54 (2-3), 131-143 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。