Method Article
Un protocollo per lentivirali trasduzione e analisi valle di intestinale organoidi
In questo articolo
Riepilogo
In this video protocol we give a step by step explanation of lentiviral transduction in organoids of primary intestinal epithelium and of processing and downstream analysis of these cultures by quantitative RT-PCR, RNA-microarray and immunohistochemistry.
Abstract
Intestinal crypt-villus structures termed organoids, can be kept in sustained culture three dimensionally when supplemented with the appropriate growth factors. Since organoids are highly similar to the original tissue in terms of homeostatic stem cell differentiation, cell polarity and presence of all terminally differentiated cell types known to the adult intestinal epithelium, they serve as an essential resource in experimental research on the epithelium. The possibility to express transgenes or interfering RNA using lentiviral or retroviral vectors in organoids has increased opportunities for functional analysis of the intestinal epithelium and intestinal stem cells, surpassing traditional mouse transgenics in speed and cost. In the current video protocol we show how to utilize transduction of small intestinal organoids with lentiviral vectors illustrated by use of doxycylin inducible transgenes, or IPTG inducible short hairpin RNA for overexpression or gene knockdown. Furthermore, considering organoid culture yields minute cell counts that may even be reduced by experimental treatment, we explain how to process organoids for downstream analysis aimed at quantitative RT-PCR, RNA-microarray and immunohistochemistry. Techniques that enable transgene expression and gene knock down in intestinal organoids contribute to the research potential that these intestinal epithelial structures hold, establishing organoid culture as a new standard in cell culture.
Introduzione
L'epitelio intestinale è uno dei tessuti corporei più rapida proliferazione, che ha causato di attrarre grande interesse dalla ricerca sulle cellule tumorali e staminali. Nel 2009 una tecnica è stata pubblicata per generare culture durevoli di piccole cripte intestinali in matrigel, conservando una struttura dimensionale 3 1. Tali strutture, denominate organoidi intestinali, possono essere coltivate utilizzando tecniche standard, con circostante medio integrato con una serie di fattori di crescita definiti, compreso il BMP-segnalazione inibitore pathway zucca (Nog), il Wnt-via di segnalazione enhancer rspondin 1 (Rspo1) e fattore di crescita epidermico (EGF) tutto ha trovato per migliorare la proliferazione intestinale 2-4.
Organoidi superano linee tradizionali di cellule di cancro negli aspetti che sono non-mutato, hanno mantenuto la gerarchia di cellule staminali, mostrano la polarizzazione cellulare intatta e la differenziazione mostra in tutte le linee cellulari presenti nel piccolo int nascenteepitelio estinal. Dal momento che possono essere trasdotte per trasportare transgeni o RNA interference costruisce 5, vengono utilizzati per studiare elementi genetici specifici, compensa esperimenti con topi transgenici in aspetti di costo e di velocità. Espressione transgenica in organoidi può essere eseguita utilizzando retrovirale murino o vettori lentivirali 6,7. A causa delle limitazioni di retrovirus murini, in grado di trasduzione cellule mitotiche esclusivamente 8, trasduzione lentivirali viene più frequentemente utilizzata per le celle che sono difficili da infettare, come organoidi.
Viralmente trasdotte e esprimono stabilmente organoidi transgenici possono essere usati per una moltitudine di analisi a valle, tra cui RNA quantitativo analisi ed immunoistochimica. Nel loro insieme, la cultura di organoidi da cellule epiteliali intestinali primarie si è evoluto in una tecnica di routine che è facile da implementare, senza requisiti specifici di laboratorio, ed è diventato il romanzo standard cecultura ll nella ricerca sul epitelio intestinale.
Tecniche di trasduzione virale e successiva analisi a valle in organoidi sono noiosi da eseguire e per aiutare gli esperimenti organoide abbiamo generato questo protocollo video, che mostra i metodi per lentivirali trasduzione del organoidi coltivate. Mostriamo inoltre come la corretta elaborazione del organoidi può aumentare la resa e quindi migliorare le prestazioni di analisi a valle con tecniche di RNA o immunoistochimica. Nel protocollo, organoidi che sono derivati da piccole cripte intestinali sono stati usati esclusivamente, sebbene le tecniche descritte possono essere applicate a organoidi colon pure.
Protocollo
1. Preparazione di polietilenimmina (PEI) come Transfection Reagent
- Disciogliere circa 150 mg di PEI in 100 ml di H 2 O.
- Regolare soluzione a pH 7.4 con l'aggiunta di HCl fino soluzione diventa chiara e mescolare fino a completa dissoluzione. Questo può richiedere tra 10 e 60 min e aggiungere acqua ad una concentrazione finale di 1 mg / ml.
- Quando chiaro, filtrare la soluzione PEI attraverso sterile filtro da 0,22 micron e conservare in un -80 ° C freezer in aliquote di 5 ml.
2. Produzione di particelle lentivirali
Giorno 1:
- HEK293T cellule Spalato al 60% -80% di confluenza in 162 cm 2 fiasco o grande Petri in linea cellulare terreno di coltura (DMEM supplementato con 10% FCS, 1% di penicillina / streptomicina e integratore di glutammina 2 mm).
2 ° giorno:
- Preparare la soluzione trasfezione di DNA contenente 45 mg di DNA totale plasmide sommandovettori lentivirali imballaggio (7 mg di pVSVg, 5 mcg di pRSV giri; 13 mcg di pMDL) e 20 microgrammi di plasmide lentivirali codificanti del gene di interesse o shRNA di interesse. Regolare ad un volume di 1 ml utilizzando DMEM.
- Preparare la soluzione trasfezione PEI aggiungendo 90 ml di 1 mg / ml PEI a 930 ml di DMEM e incubare per 5 minuti a temperatura ambiente.
- Aggiungere la soluzione trasfezione DNA soluzione PEI. Vortex o invertire un numero di volte e incubare per 5 min a temperatura ambiente per ottenere una soluzione trasfezione di DNA.
- Drip 2 ml della soluzione di trasfezione di DNA sulle cellule HEK293T e incubare per 4 ore in un incubatore umidificato coltura cellulare da 37 ° C.
- Dopo 4 ore, aggiornare il terreno di coltura per rimuovere PEI. Non è necessario lavare cellule prima di aggiungere nuovo mezzo.
NOTA: PEI è citotossici e di incubazione più di 4 ore può causare danni alle cellule HEK293T.
4 ° giorno:
- Sostituire supernatant con il nuovo terreno di coltura. Tenere surnatante (contenente virus); questo sarà usato nella fase 2.10.
- Mettere surnatante in 15 ml pallone. Per rimuovere le cellule morte, centrifugare per 5 min a 500 x g.
- Spingere surnatante tramite 0,45 micron filtro con una grossa siringa da 60 ml. Conservare notte a 4 ° C.
5 ° giorno:
- Raccogliere il secondo lotto di surnatante; centrifuga e filtro come in passaggi 2,8-2,9.
- Pool il surnatante da passi 2.9 e 2.10 in tubi ultracentrifuga e centrifugare a 50.000 xg in un'ultracentrifuga per 90 min.
- Estrarre capsule contenenti attentamente le provette ultracentrifuga e messo in una cappa a flusso laminare, ricordando l'orientamento del tubo all'interno della centrifuga.
- Aprire capsula tenendo il tubo un'ultracentrifuga e medie decantare attentamente in modo tale che il pellet è sul lato superiore del tubo. Dal pellet virale può essere difficile da visualizzare, ricordare su qualilato del tubo un pellet sarà formata. Prendere una micropipetta e rimuovere ultimo bit di media facendo attenzione a non agitare il pellet marrone opaco che è visibile sul lato del fondo del tubo ultracentrifuga.
- Risospendere questo pellet in 500 ml di terreno di coltura organoide integrati con nicotinamide 10 mm, 10 micron Chir99021, 10 micron Y27632 e 8 mg / ml polibrene. Risospensione in questo mezzo è importante poiché virus titolo elevato viene utilizzato per transduct direttamente organoidi.
- Facoltativamente: congelare il virus in questo mezzo frazionato in due lotti di 250 microlitri a -80 ° C.
3. lentivirali trasduzione di organoidi
Giorno 0:
- Dividere una completa 0,95 centimetri 2 e di organoidi due giorni prima trasduzione in un nuovo pozzo, al fine di ottenere circa 50 piccoli organoidi. Split organoidi secondo il protocollo precedentemente pubblicato 1 (Figura 3A, B).
- Supplemento organoide mezzo di coltura con 10 micron Chir99021 e nicotinamide 10 mm per ottenere iper cistica cripte proliferative (Figura 3C).
NOTA: cripte cistica svilupperanno meglio quando organoidi appena divisi sono coltivati in presenza di Chir99021.
2 ° giorno:
- Organoidi Harvest pipettando su e giù per il matrigel e media, interrompendo in tal modo il composto con una micropipetta p1000. Posizionare la miscela in una provetta da 15 ml.
- Disrupt ulteriormente utilizzando Pasteur pipetta in cui l'apertura distale è stato diminuito da fusione. Organoidi centrifuga a pellet per 5 min a 100 x g.
NOTA: A seconda della dimensione della centrifuga, utilizza una velocità di centrifuga diversa. È necessario trovare l'esatta velocità in cui interrotte organoidi sono separati dalla miscela. - Rimuovere il surnatante e aggiungere 500 ml di tripsina preriscaldata 1x (simile al 0,25% tripsina). Risospendere organoidi in tripsina e incubare3 min in un bagno di 37 ° C dell'acqua.
- Inattivare tripsina aggiungendo 3,5 ml di terreno di coltura linea cellulare (DMEM supplementato con 10% FCS, 1% di penicillina / streptomicina e glutammina). Centrifugare per 5 min a 500 x g.
- Rimuovere il surnatante di lasciare pellet in circa 20 ml di media. Trasferire i organoidi in questa ultima piccola quantità di mezzo in un pozzo in un piatto di 48 pozzi.
- Aggiungi alto lentivirus titolo nel medio trasduzione come descritto al punto 2.14, risospendere e continuare con il passo 3.10. Quando incontra bassa efficacia di trasduzione, punto 3.9 possono essere aggiunti.
NOTA: Per la trasduzione efficiente, tipicamente aggiungere un'aliquota di 250 microlitri di alta lentivirus titolo ad un pozzetto di organoidi. Questo rappresenta il 50% di tutti i lentivirus raccolti da una singola produzione come descritto al punto 2 di questo protocollo. - Facoltativamente: per migliorare l'efficacia trasduzione, effettuare spinoculation mettendo 48 pozzetti contenente organoidi in un pre-riscaldato centrifuga da 326; C e ruotare a 600 xg per 1 ora.
- Mettere miscela organoide-virus in cultura incubatore e incubare per 1 ora a 37 ° C in un incubatore culturale per consentire trasduzione.
- Facoltativamente: per migliorare ulteriormente l'efficacia di trasduzione, incubare organoidi Per ulteriori 3 ore a 37 ° C in un incubatore cultura.
- Aggiungere 1 ml di terreno di coltura organoide e risospendere la miscela organoide-virus, il trasferimento in una provetta e centrifugare in una microcentrifuga per 5 minuti a 850 xg per far sedimentare organoidi.
- Rimuovere il surnatante e risospendere il pellet in 20 ml di Matrigel ghiacciata. Poiché il materiale solidifica quando diventa caldo, utilizzare puntali che vengono refrigerati pipettando su e giù ghiacciata PBS per un numero di volte.
- Mettere la goccia nel mezzo di un pozzetto in una piastra 48 pozzetti e incubare in coltura incubatore a 37 ° C per 15 minuti per solidificare.
- Dopo 15 minuti, aggiungere con cautela 250 ml di terreno di coltura organoide integrato conNicotinamide 10 mM, 10 mM Chir99021 e 10 pM Y27632. Piccoli frammenti organoide perturbato formeranno in piccoli organoidi cistica entro 24 ore.
5 ° giorno:
- Aggiorna medio e integrare con un antibiotico selezione (per puromicina, utilizzare 4 mg / ml).
7 ° giorno:
- Sostituire mezzo per terreno di coltura organoide serie, integrato con la selezione antibiotica.
NOTA: in erba sarà completa di 2-3 settimane dopo Chir99021 ritiro. Dopo la selezione, organoidi possono essere coltivate senza selezione antibiotica.
4. organoide RNA Preparazione quantitativa RT-PCR o Microarray
- Per la preparazione di RNA, utilizzare un kit commerciale secondo il protocollo del produttore. Rimuovere il supporto da organoidi e aggiungere 350 ml di tampone RLT, integrati con β-mercaptoetanolo dritto sulla cupola di Matrigel contenente organoidi. Risospendere le Material in RLT pipettando utilizzando p1000 micropipetta.
- Eseguire inoltre RNA preparazione secondo il protocollo del produttore.
- Facoltativamente: aumentare la resa di RNA mediante amplificazione utilizzando il sistema Ovation Pico WTA, richiede input iniziale di 50 mg di RNA totale secondo il protocollo del produttore.
- Facoltativamente: per il controllo di qualità prima di RNA microarray, campioni eseguito su un bioanalizzatore 2100 con un totale di chip eucariote RNA nano, puntando per un numero di integrità dell'RNA (RIN) di 8.5 o più (Figura 5) secondo il protocollo del produttore.
5. TRATTAMENTO organoidi per paraffina e immunoistochimica
- Prima di iniziare organoide incorporamento pre-riscaldare un blocco di alluminio con fori 12 millimetri tubi di vetro di diametro montaggio in incubatore a 70 ° C per mantenere la paraffina liquida.
- Prendete un singolo bene con organoidi pienamente sviluppati e rimuovere il supporto, lasciando intatte le organoidi incorporati.
- Aggiungere 1 mldel 4% paraformaldeide in PBS dritto al bene e fissare a 4 ° C ovunque da 1 ora a notte.
- Sostituire paraformaldeide con 1 ml di ghiaccio freddo PBS.
Facoltativamente: mantenere organoidi fissi in PBS fino a 1 settimana a 4 ° C dopo questo passaggio. - Risospendere organoidi fissi in 1 ml di PBS e riporre in flacone di vetro.
- Let organoidi depositano inferiore per 1 min, decantare PBS e sostituire con il 70% di etanolo in cui una coppia di goccioline di soluzione eosina vengono sciolti per consentire la visualizzazione del organoidi tutto il processo di incorporazione.
- Lasciare organoidi in etanolo al 70% a temperatura ambiente. Dopo 30 minuti, rimuovere il 70% di etanolo con attenzione decantazione, essendo in grado di visualizzare i organoidi occhio a causa del leggero colore rosato eosina. Sostituire soluzione incasso con 96% di etanolo.
- Ripetere passaggio 5.7, ogni volta sostituendo la soluzione incorporamento con la successiva. Passare organoidi attraverso le seguenti soluzioni successivamente: il 70% etanolo, 90% etanolo, 96% etanolo, 100% ethanol, 100% etanolo, xilene, xilene.
- Decantare l'ultimo lavaggio xilene e versare la paraffina nel tubo. Inserire il tubo immediatamente nel blocco di alluminio pre riscaldato a 70 ° C per 30 min e sostituire paraffina con paraffina nuova pulita.
- Versare la paraffina off e pipette organoidi nello stampo blocco di paraffina con una pipetta Pasteur preriscaldata con grande apertura. Mantenere Pasteur pipetta calda usando un becco Bunsen. Mettere tutti organoidi nello stampo blocco di paraffina in un piccolo strato di paraffina liquida.
- Per quanto possibile, cercare di manipolare tutti organoidi verso il centro dello stampo blocco di paraffina utilizzando un ago dissezione riscaldato. Mantenere dissezione ago calda usando becco Bunsen.
- Quando localizzazione organoidi nello stampo è soddisfacente, conchiglia leggermente a solidificare lo strato di paraffina.
- Termina il blocco versando più di paraffina sulla parte superiore e aggiungere una cassetta embedding istologico standard.
Risultati
Organoide trasduzione lentivirali
La tecnica di trasduzione organoide utilizzando particelle lentivirali dipende corretta gestione dei organoidi prima e durante la trasduzione. Organoidi (Figura 3A) sono state coltivate e furono interrotto in cripte singoli (Figura 3B). Come riportato in precedenza, queste singole cripte, quando coltivate in presenza dell'inibitore GSK3 Chir99021 divennero cripte cistiche 9 (Figura 3C). Successivamente sono stati organoidi tripsinizzate per consentire la penetrazione di particelle virali di singole cellule. Quando trasduzione cellule con particelle lentivirali, un certo numero di metodi può essere cercato di migliorare l'efficacia trasduzione come spinoculation o incubazione prolungata. Alto titolo PGK-eGFP lentivirus stato usato per consentire la visualizzazione di efficacia trasduzione mediante microscopia a fluorescenza. Trasduzione efficacia di organoidi con questo plasmide era alto e si avvicinò al 100% (Figure 4E, F). Migliorare l'efficacia utilizzando spinoculation (4A, B) o l'incubazione prolungata con particelle lentivirali (Figura 4C, D) non ha quindi cede valore aggiunto.
Estrazione di RNA
Organoidi successivi per l'estrazione di RNA sono state coltivate. Organoidi full-grown sono state raccolte che sono stati sottoposti a raggi gamma o il trattamento di controllo per dimostrare integrità dell'RNA ridotta (Figura 5). Dopo irraggiamento con 6 Gy, RNA è degradata e confrontato con il controllo organoidi trattati, il numero integrità dell'RNA (RIN) è ridotto.
Immunoistochimica su paraffina organoidi
Dopo incubazione organoidi per 2 ore in terreno di coltura addizionato con BrdU, organoidi in formalina sono stati fissati e trattati per immunoistochimica (Figura 6). Usando topo anti BrdU, le cellule proliferative potrebbero essere osservate in cripta-segmEnt di organoidi e non nel vano differenziato.
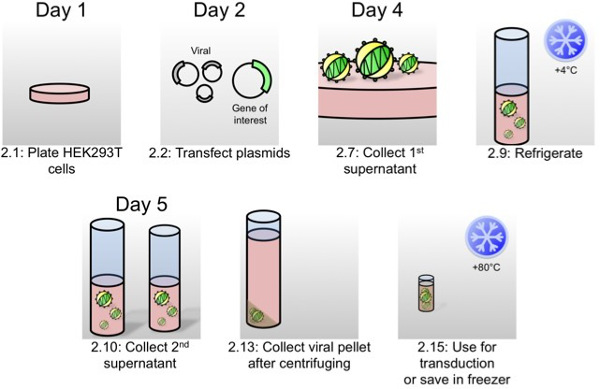
Figura 1:. Schema di produzione lentivirus per la trasduzione organoide Come scritto nel protocollo parte 2, in questo schema, le fasi più critiche della produzione di virus sono rappresentate con i numeri di passo protocollo e tempi.
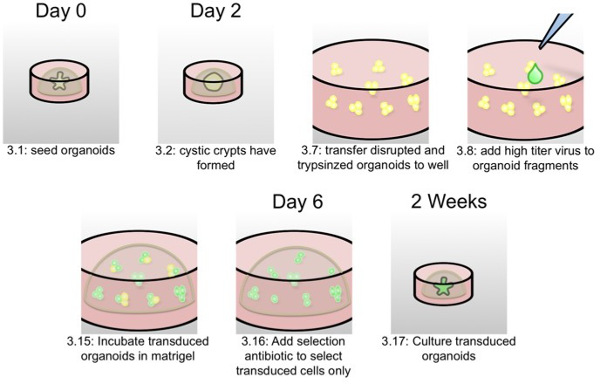
Figura 2:. Schema di trasduzione lentivirali di organoidi Come scritto nella parte relativa al protocollo 3, in questo schema, le fasi più critiche di trasduzione organoide sono rappresentate con i numeri di passo protocollo e tempi.
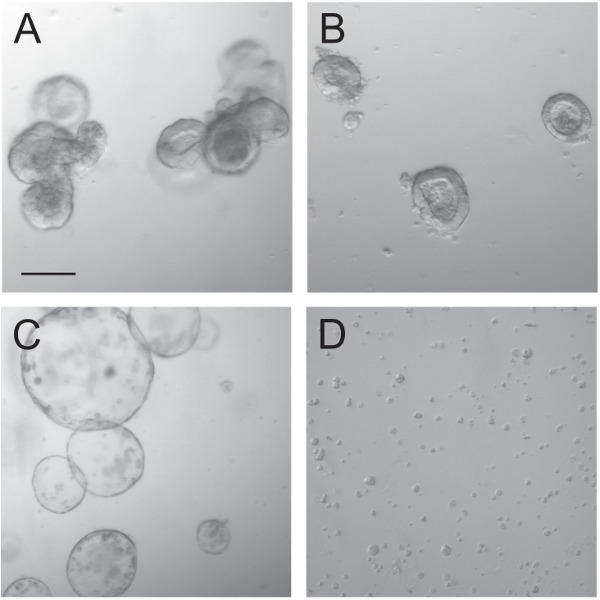
Figura 3: organoidi prima e durante transduction. organoidi normalmente crescenti (A) sono suddivisi in densamente crescenti piccoli organoidi (B) che diventano cistica dopo incubazione con Chir99021 per un numero di giorni (C). Dopo la dissociazione di questi organoidi utilizzando tripsina, celle singole e piccoli gruppi di cellule rimangono (D), che sono trasduzione seguito. Scale bar 100 micron.

. Figura 4: trasduzione del organoidi utilizzando vettori di espressione lentivirali immagini Brightfield (A, C, E, G) e le immagini fluorescenti (B, D, F, H) da organoidi che sono state trasfettate sia con PGK-eGFP lentivirus (A - F) o controllare lentivirus (G, H). espressione eGFP in organoidi dopo lentivirali trasduzione utilizzando sia spinoculation e di incubazione (A, B), spinoculation solo (C, D) o non passi ulteriori per aumentare l'efficacia di trasduzione (E, F), rispetto al controllo vettoriale trasdotte organoidi, che non lo fanno esprimere eGFP (G, H). Si noti che l'utilizzo di PGK-eGFP lentivirali costrutto, l'efficacia di trasduzione non è notevolmente aumentata di ulteriori passi. Scale bar 100 micron.
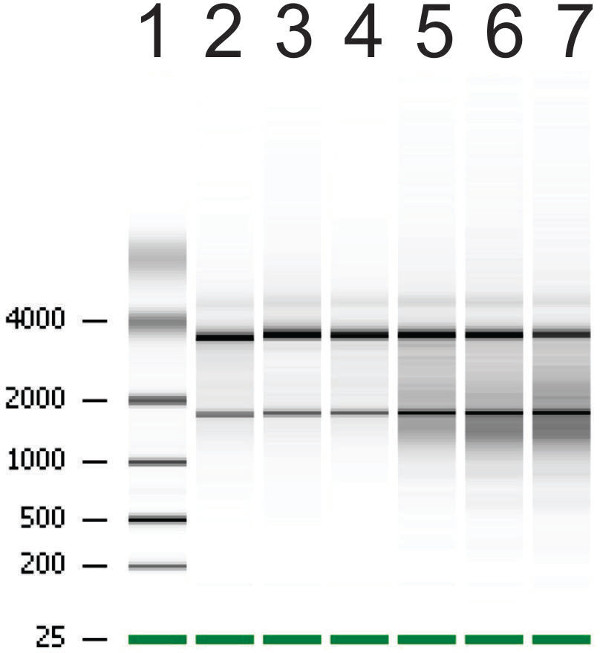 Figura 5:. Risultato Rappresentante di preparazioni di RNA da organoidi su bioanalizzatore Nota forte demarcazione delle bande che rappresentano un'elevata integrità RNA in corsie 2-4 e striscio intorno bande su corsie 5-7 rappresentano integrità log RNA. Numero integrità dell'RNA (RIN) di bande 2-4 è 8.7, 9.2 e 9 rispettivamente, mentre tegli RIN di bande 5-7 è 6.4, 6.6 e 5.5.
Figura 5:. Risultato Rappresentante di preparazioni di RNA da organoidi su bioanalizzatore Nota forte demarcazione delle bande che rappresentano un'elevata integrità RNA in corsie 2-4 e striscio intorno bande su corsie 5-7 rappresentano integrità log RNA. Numero integrità dell'RNA (RIN) di bande 2-4 è 8.7, 9.2 e 9 rispettivamente, mentre tegli RIN di bande 5-7 è 6.4, 6.6 e 5.5.

Figura 6:. Analisi immunoistochimica di paraffina fissati in formalina organoidi formalina paraffina fisso incorporato 4 micron sezione organoidi coltivate in presenza di BrdU per due ore e poi fissato. Sezione è macchiato con l'anticorpo anti-BrdU. Bar Scala 100 micron. Cliccate qui per vedere una versione più grande di questa figura.
| Supporto di base | Aggiunte | |
| Linea cellulare terreno di coltura | DMEM | 10% FCS |
| 1% di penicillina / streptomicina | ||
| 2 Gl mMutamine | ||
| Terreno di coltura organoide | Avanzato DMEM F12 | HEPES |
| 1% di penicillina / streptomicina | ||
| 1x Glutamax | ||
| 1% N2 supplemento | ||
| 2% Supplemento B27 | ||
| 125 nM n-acetil cisteina | ||
| Mouse Egf (50 ng / ml) | ||
| 10% Nog-Fc mezzo condizionato (equivalente a 100 ng / ml) | ||
| 10% Rspo1-Fc mezzo condizionato (equivalente a 500 ng / ml) |
Tabella 1: Terreno di coltura composizione.
Discussione
Il protocollo video corrente descrive trasduzione lentivirale di organoidi da epitelio intestinale primaria e l'analisi a valle di queste organoidi utilizzando tecniche RNA quantitative e immunoistochimica.
Trasduzione lentivirali è spesso eseguita in cellule aderenti o galleggianti in piastre di coltura. Poiché la struttura tridimensionale di organoidi li rende difficile da penetrare da particelle virali, sono utilizzati diversi metodi per aumentare l'efficacia. Pretrattamento di organoidi utilizzando Chir99021 aumenta la proliferazione e, quindi, la vitalità dopo trasduzione. E 'importante mantenere piccoli ammassi di cellule dopo tripsinizzazione, dal momento che le singole cellule sono diminuiti sopravvivenza. In contrasto trasduzioni virali utilizzando retrovirus murino, trasduzione lentivirali sono più efficienti e normalmente non richiedono spinoculation, una tecnica nota all'efficacia aumenti trasduzione in cellule ES 10. Quando si utilizzano retrovirus murini o when rendimenti trasduzione lentivirali bassa efficacia, spinoculation può opzionalmente essere utilizzato per aumentare la percentuale di trasduzione. Noi non valutiamo regolarmente titolo del virus, dato che tutti i virus disponibile da un unico turno di produzione per la trasduzione di organoidi derivati da massimo due 0,95 centimetri 2 pozzi è stato utilizzato. Inoltre, generalmente utilizzano selezione antibiotica per la rimozione delle cellule non trasdotte. Valutazione del titolo virale può tuttavia essere utile in caso di problemi con efficacia trasduzione.
Identica a cellule aderenti, il livello di selezione antibiotica può aumentare il numero di integrazioni virali e quindi espressione del transgene. Utilizzare puromicina di alto livello (10 mg / ml) per ottenere un'alta espressione transgenica e atterramento efficace, ma quando segni organoidi mostrano di tossicità, livelli inferiori possono essere utilizzati (minimo 1 mg / ml). Inoltre, gli antibiotici di selezione alternativi possono essere utilizzati o selezione possono essere omessi, anche se la trasduzione è probabileincompleto e questo non può tradursi in espressione stabile a lungo termine. Inoltre, poiché l'integrazione lentivirale nel genoma è eterogenea tutta una popolazione di cellule, espressione del transgene può essere sottomettere a cambiamenti dopo coltura di cellule per un tempo prolungato. Ciò può derivare da pressione selettiva dalla espressione del transgene. Sebbene la selezione antibiotica limita questi cambiamenti, possono rimanere, soprattutto nel caso di espressione costitutiva di transgeni. Tale inconveniente può essere superato clonazione singola cella di organoidi, ma questa tecnica richiede molto tempo. Trasduzione lentivirali può essere eseguita con una grande varietà di plasmidi che portano sia espressione stabile o inducibile di transgeni. Tali transgeni sono di solito espresse da promotori ubiquitari, come il CMV o il promotore PGK e può comportare espressione soprannaturale. Simile a sovraespressione transgenico in linee cellulari di tumore o di modello animali, si richiede cautela nell'interpretazione dei risultati from sovraespressione.
Per esperimenti che richiedono RNA, il basso numero di cellule vitali normalmente coltivata in una singola 0,95 centimetri 2 ben (superficie standard ben 48) in contrasto con cellule aderenti che possono essere facilmente coltivate in fiaschi grandi è il fattore limitante per la qualità e la moltitudine di analisi a valle. Troviamo che normalmente, un singolo pozzo di circa 50 pieno cresciuto organoidi rendimenti tra 0,4 mg e 1 mg di RNA totale, essendo sufficiente per RT-PCR quantitativa e RNA microarray senza ulteriore amplificazione. Alcuni regimi di trattamento o di alterazioni genetiche in grado di ridurre il contenuto di RNA in modo significativo comunque. Un primo passo per aumentare RNA totale viene messa in comune di più pozzi.
Per paraffina di organoidi, è fondamentale per ottenere materiale sufficiente per visualizzare organoidi durante il processo. L'aggiunta di piccole quantità di eosina a organoidi fissi permette di visualizzare organoidi durante tuttoprocesso, ma non è necessario per l'incorporamento normale e può essere omesso quando questo passo interferisce con ulteriori analisi. Solitamente, cassette-paraffina hanno buchi per permettere il flusso di soluzioni fissative e di processo al tessuto nella cassetta.
Lentivirali trasduzione organoide e preparazione per le tecniche standard a valle aumenta il potenziale scientifico di queste culture e solleva lo standard di coltura cellulare di tecniche tridimensionali da epitelio intestinale primaria. La serie di esperimenti a valle da eseguire è comunque non limitato alle tecniche descritte nel protocollo attuale e può comprendere tutte le tecniche eseguite su linee cellulari o topi, data la quantità di materiale cellulare generata dalla cultura è sufficiente. Nella ricerca su specifici elementi genetici e la loro funzione a livello dell'epitelio intestinale, tecniche di ricombinazione omologa in modelli animali, in particolare i topi, rimane il gold standard. Culture di organoidi donon contenere mesenchimali o di nicchia immunologica delle cellule e cripte coltivate sono sempre in espansione, contrastare la situazione trovata in vivo. Tuttavia, queste culture hanno sollevato la qualità dei risultati in vitro notevolmente e tenendo conto delle tecniche a valle miriade che possono essere eseguite, cultura organoide ha e permetterà di migliorare notevolmente la ricerca sulla epitelio intestinale.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
J. Heijmans is supported by a stipendium from the Dutch cancer foundation (KFW). G.R. van den Brink is supported by funding from the European Research Council under the European Community’s Seventh Framework Program (FP7/2007-2013)/European Research Council grant agreement number 241344 and by a VIDI grant from the Netherlands Organization for Scientific Research (GvdB).
Materiali
| Name | Company | Catalog Number | Comments |
| Polyethylene imine | Polysciences | 23966-2 | |
| DMEM medium | Lonza | BE12-614F | |
| Fetal calf serum | Lonza | DE14-801F | |
| Penicillin-streptomycin | Invitrogen | 15140-122 | |
| Glutamin | Invitrogen | 25030-024 | |
| matrigel | BD | BD 356231 | |
| Advanced DMEM-F12 | Gibco | 12634-010 | |
| N2 | Invitrogen | 17502-048 | |
| B27 | Invitrogen | 17504-044 | |
| N-acetyl cysteine | Sigma | A9165-1G | |
| mouse Egf | Invitrogen | PMG8045 | |
| Hepes 1 M | Invitrogen | 15630-056 | |
| glutamax 100x | Invitrogen | 35050-038 | |
| Chir 99021 | Axon | 1386 | |
| Y27632 | Sigma | Y0503-5MG | |
| polybrene | Sigma | 107689 | |
| nicotinamide | Sigma | N0636 | |
| Trypsin | Lonza | BE02-007E | |
| puromycin | Sigma | P 7255 | |
| Rneasy mini kit | Qiagen | 74106 | |
| β-mercaptoethanol | Merck | 8,057,400,250 | |
| Ovation Pico WTA system | NuGen | 3300-12 | |
| paraformaldehyde | Sigma | 252549-1L | |
| glass vial conical 12 mm x 75 mm 5 ml | VWR | LSUKM12 | |
| Eosin Yellowish | VWR | 1,159,350,025 |
Riferimenti
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Al-Nafussi, A. I., Wright, N. A. The effect of epidermal growth factor (EGF) on cell proliferation of the gastrointestinal mucosa in rodents. Virchows Archiv. B, Cell Pathology Including Molecular Pathology. 40 (1), 63-69 (1982).
- Haramis, A. P., et al. De novo crypt formation and juvenile polyposis on BMP inhibition in mouse intestine. Science. 303 (5664), 1684-1686 (2004).
- Zhao, J., et al. R-spondin1, a novel intestinotrophic mitogen, ameliorates experimental colitis in mice. Gastroenterology. 132 (4), 1331-1343 (2007).
- Schwank, G., Andersson-Rolf, A., Koo, B. K., Sasaki, N., Clevers, H. Generation of BAC transgenic epithelial organoids. PLoS One. 8 (10), e76871(2013).
- Koo, B. K., et al. Controlled gene expression in primary Lgr5 organoid cultures. Nature Methods. 9 (1), 81-83 (2012).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Rep. 3 (4), 1128-1139 (2013).
- Roe, T., Reynolds, T. C., Yu, G., Brown, P. O. Integration of murine leukemia virus DNA depends on mitosis. The EMBO Journal. 12 (5), 2099-2108 (1993).
- Lau, W., et al. Lgr5 homologues associate with Wnt receptors and mediate R-spondin signalling. Nature. 476 (7360), 293-297 (2011).
- Bahnson, A. B., et al. Centrifugal enhancement of retroviral mediated gene transfer. Journal Of Virological Methods. 54 (2-3), 131-143 (1995).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon