Method Article
协议的慢病毒转导与肠组织体下游分析
摘要
In this video protocol we give a step by step explanation of lentiviral transduction in organoids of primary intestinal epithelium and of processing and downstream analysis of these cultures by quantitative RT-PCR, RNA-microarray and immunohistochemistry.
摘要
Intestinal crypt-villus structures termed organoids, can be kept in sustained culture three dimensionally when supplemented with the appropriate growth factors. Since organoids are highly similar to the original tissue in terms of homeostatic stem cell differentiation, cell polarity and presence of all terminally differentiated cell types known to the adult intestinal epithelium, they serve as an essential resource in experimental research on the epithelium. The possibility to express transgenes or interfering RNA using lentiviral or retroviral vectors in organoids has increased opportunities for functional analysis of the intestinal epithelium and intestinal stem cells, surpassing traditional mouse transgenics in speed and cost. In the current video protocol we show how to utilize transduction of small intestinal organoids with lentiviral vectors illustrated by use of doxycylin inducible transgenes, or IPTG inducible short hairpin RNA for overexpression or gene knockdown. Furthermore, considering organoid culture yields minute cell counts that may even be reduced by experimental treatment, we explain how to process organoids for downstream analysis aimed at quantitative RT-PCR, RNA-microarray and immunohistochemistry. Techniques that enable transgene expression and gene knock down in intestinal organoids contribute to the research potential that these intestinal epithelial structures hold, establishing organoid culture as a new standard in cell culture.
引言
肠上皮细胞是最迅速增殖的身体组织,这导致它吸引了来自研究癌症和干细胞广泛兴趣之一。在2009年的技术被发布到基质胶产生的小肠隐窝持久的文化,涵养一个三维结构1。这些结构中,称为肠组织体,可以使用标准技术进行培养,与周围的介质补充有若干所定义的生长因子,包括BMP-信号通路抑制剂头发生素(木栓)中,Wnt信号通路的增强rspondin 1(Rspo1)和表皮生长因子(EGF)的所有发现增强肠道增殖2-4。
类器官超越了传统方面的癌细胞系,他们都是非突变,保持干细胞的层次结构,显示完整的细胞极化,表现出分化成新生的小INT发现的所有细胞系estinal上皮。因为它们可被转导携带的转基因或RNA干扰构造5,它们被用于研究特定的遗传元件,使用转基因小鼠在成本和速度的面抵销实验。就可以利用小鼠逆转录病毒或慢病毒载体6,7进行转基因表达的组织体。由于鼠逆转录病毒,能够转导分裂细胞只8的局限性,慢病毒转导是更频繁地用于细胞,很难感染,如组织体。
病毒转导和稳定表达的转基因组织体可用于多种下游分析,包括定量的RNA分析和免疫组织化学。综合来看,从小学肠上皮细胞组织体的文化已经演变成一个常规技术,很容易没有具体的实验室要求实施,并已成为CE小说标准LL文化对肠道上皮细胞的研究。
病毒转导和组织体随后的下游分析技术是繁琐的执行,并帮助组织体实验,我们产生这个视频协议,显示培养的组织体的慢病毒转导的方法。我们还展示了如何组织体正确处理可以提高产量,因此利用RNA技术或免疫增强下游的分析性能。在协议中,从它们的小肠隐窝中衍生的组织体被单独使用,但所描述的技术可应用于结肠组织体为好。
研究方案
1.制备聚乙烯亚胺(PEI)作为转染试剂的
- 溶解约150毫克的PEI入100毫升的H 2 O.
- 通过添加盐酸,直到解决方案变得清晰,搅拌至完全溶解调节溶液的pH值7.4。这可能需要10至60分钟,并添加水至1毫克/毫升的终浓度。
- 当清晰,筛选在5毫升分装到无菌的0.22微米的过滤器和存储的解决方案,PEI在-80℃的冰柜。
2.生产慢病毒颗粒的
第1天:
- 拆分HEK293T细胞,以60%-80%汇合162 平方厘米烧瓶或细胞系培养基大陪替氏培养皿(DMEM补充有10%FCS,1%青霉素/链霉素和2mM谷氨酰胺补充)。
第2天:
- 制备含有45微克总质粒DNA加在一起的DNA转染溶液慢病毒载体的包装(7微克pVSVg的; 5微克PRSV转的13微克PMDL)的编码感兴趣感兴趣或shRNA基因的慢病毒载体和20微克。调整到使用的DMEM 1ml的体积。
- 制备PEI的转染溶液加入90微升1mg / ml的PEI与930微升DMEM中,并孵育5分钟,在室温下进行。
- 加入DNA转染的解决方案PEI。涡流或反转的次数,并孵育5分钟,在室温下,获得的DNA转染溶液。
- 滴将2ml DNA转染溶液到HEK293T细胞孵育4小时,在湿润的细胞培养箱中于37℃。
- 4小时后,刷新培养基去除PEI。这是没有必要添加新介质之前洗涤细胞。
注:PEI是细胞毒性和孵育时间长于4小时可能造成伤害HEK293T细胞。
第4天:
- 更换苏佩rnatant新的培养基。保持上清(含病毒);这将在步骤2.10中使用。
- 把上清液在15毫升烧瓶中。要去除死细胞,离心5分钟500×克。
- 采用大60毫升注射器通过0.45微米的过滤器推上清。隔夜存放于4℃。
第5天:
- 收集第二批上清液;离心和过滤器与步骤2.8-2.9。
- 在超速离心90分钟,从池步2.9和超速离心管2.10和离心机上清50,000 XG。
- 取出含有超速离心管非常仔细胶囊并放入层流罩,记住在离心机内的管的方向。
- 打开胶囊保持超速离心管和倾析培养基小心以这样的方式,该粒料是在管的上侧。由于病毒丸粒可能难以显现,记住什么管侧的粒料将已经形成。取微量和除去介质的最后一个比特,同时小心不要搅动不透明棕色沉淀是在超速离心管的底部的侧可见。
- 重悬该沉淀在500μl类器官培养基补充了10mM烟酰胺,10μMCHIR99021,10μMY27632和8微克/毫升聚凝胺。再悬浮在该介质是重要的,因为高滴度病毒用于直接转导组织体。
- 可选:冻结病毒在这个媒介分装在两批250微升-80℃。
组织体3慢病毒转导
第0天:
- 拆分全0.95厘米2以及类器官两天转成新井之前的,旨在获得约50个小类器官。根据此前公布的方案1( 图3A,B)分裂组织体。
- 补充类器官用10μM的CHIR99021和10mM烟酰胺培养基,得到囊性增生过度隐窝( 图3C)。
注:囊性隐窝将开发最好当新鲜分裂组织体生长在CHIR99021的存在。
第2天:
- 收获组织体通过上下抽吸基质胶和介质,从而打乱了P1000微量的混合物。放置在一个15毫升管的混合物。
- 使用巴斯德吸移管,其中所述远端开口已经下降了熔化进一步扰乱。离心机组织体以沉淀5分钟,在100×g下。
注:依赖于离心机的大小,使用不同的离心机的速度。有必要在其中找到破坏组织体从混合物中分离出的确切的速度。 - 除去上清液,并加入500μl预热1X胰蛋白酶(类似于0.25%胰蛋白酶)的。悬浮类器官的胰蛋白酶和孵化3分钟在37℃水浴。
- 通过加入3.5毫升细胞系培养基的灭活胰蛋白酶(DMEM补充有10%FCS,1%青霉素/链霉素和谷氨酰胺)。离心5分钟,在500×g。
- 除去上清液留下沉淀在大约20微升培养基。传送在此最后少量介质的组织体成井在48孔板。
- 加入高滴度慢病毒的转导中的步骤2.14,重悬描述和继续加强3.10。当遇到低转导效率,加强3.9可以添加。
注:为了有效地传导,一般加250微升的高滴度慢病毒1等分,以组织体的一个孔。这代表在本协议的第2步描述从单一生产的收获慢50%。 - 任选:以提高转导效率,通过将48孔平板含有组织体在预温热离心机上32执行spinoculation6; C和旋转,在600×g离心1小时。
- 把组织体病毒混合物在培养箱中孵育1小时,在37℃的培养箱中,以允许转导。
- 任选:进一步提高转导效率,在一个培养箱中孵育组织体另外3小时,在37℃。
- 加入1毫升组织体培养基和悬浮的组织体病毒混合物,在850×g离心转移到微量离心管中并离心以微量为5分钟以沉淀组织体。
- 去除上清,悬浮颗粒在20微升冰冷的基质胶的。因为当它成为温暖的材料固化,使用由上下吹打冰冷PBS为多次冷却的吸头。
- 把液滴中的阱中一个48井板中的中间和孵化在培养箱中在37℃下进行15分钟固化。
- 15分钟后,小心地加入250微升补充有类器官培养基的10mM烟酰胺,10μMCHIR99021和10μMY27632。小打乱类器官片段将组建成小囊状类器官在24小时内。
第5天:
- 刷新介质和选择的抗生素补充(用于嘌呤霉素,使用4微克/毫升)。
第7天:
- 更换培养基为标准类器官培养液,辅以抗生素的选择。
注意:发芽的将是完整CHIR99021停药后2-3周。选择后,组织体可生长没有选择抗生素。
4.组织体RNA准备定量RT-PCR和基因芯片
- 用于RNA制备,使用根据制造商的协议的商业试剂盒。从类器官取出中期和直含基质胶类器官的圆顶增加350微升缓冲RLT的,辅以β巯基乙醇。悬浮马泰人在RLT使用P1000微量移液。
- 根据制造商的协议来执行进一步的RNA制备。
- 任选:使用的Ovation微微WTA系统增加的RNA产量通过扩增,根据制造商的协议规定的50微克的总RNA的初始输入。
- 任选:对于前RNA的微阵列的质量控制,使用真核生物总RNA纳米芯片,旨在为8.5以上( 图5),根据制造商的协议的RNA完整性数(RIN)上的2100生物分析仪上运行样本。
5.加工类器官的石蜡包埋及免疫组化
- 前类器官嵌入的起始预温热的铝块具有孔配件12毫米直径的玻璃管在培养箱中在70℃下保持液态石蜡。
- 采取单井与完全成熟的组织体,并删除介质,使嵌入式类器官完好。
- 加入1毫升在PBS中的4%多聚甲醛直井和在4℃下的任何地方从1小时至固定过夜。
- 用1ml冰冷的PBS代替多聚甲醛。
任选:在此步骤之后保持固定组织体在PBS中长达1周,在4℃。 - 重悬固定组织体在1ml的PBS中,并放置到玻璃小瓶中。
- 让组织体沉入底部,持续1分钟,滗PBS中并替换,用70%的乙醇,其中一对夫妇的曙红溶液液滴的溶解,使组织体的可视化在整个嵌入处理。
- 留在70%乙醇组织体在室温下。 30分钟后,通过小心地倾析,能够用肉眼来可视化,因为轻微带粉红色的曙红颜色的组织体除去70%的乙醇。更换96%的乙醇嵌入解决方案。
- 重复步骤5.7,每次更换与下一个嵌入解决方案。 70%乙醇,90%乙醇,96%乙醇,100%ETHA:通过以下的溶液随后通过组织体NOL,100%的乙醇,二甲苯,二甲苯等。
- 倒出最后二甲苯洗净,倒入石蜡入管。把该管立即在预加热的铝块,在70℃进行30分钟,并用新的清洁石蜡代替石蜡。
- 使用预温热巴斯德吸管的大开口倾石蜡起飞和吸管组织体入石蜡块模具。保持巴斯德吸管用温暖的本生灯。放置在蜡块模具的所有类器官的一小层液体石蜡。
- 尽可能,尝试操纵使用加热夹层针朝蜡块模具中心的所有组织体。保持解剖针用温暖的本生灯。
- 当组织体在模具中的定位是令人满意的,硬模稍微固化的石蜡层。
- 浇在上面更完成的石蜡块,并添加一个标准组织包埋盒。
结果
类器官慢病毒转导
利用慢病毒颗粒类器官传导技术事先和传导过程依赖于正确处理组织体。组织体( 图3A)进行培养,它们被破碎成单个隐窝( 图3B)。如以前报道的,这些单隐窝,当GSK3抑制剂CHIR99021的存在下培养成为囊性隐窝9( 图3C)。随后组织体进行胰蛋白酶处理,以允许病毒颗粒的单细胞的渗透。当转导细胞的慢病毒颗粒,许多方法可以尝试以提高转导效率,如spinoculation或长时间孵育。高滴度PGK-EGFP慢病毒,使用荧光显微镜,使转导效力的可视化。类器官用这种质粒转导疗效高,接近100%( 造型玩具ê4E,F)。改善使用效能spinoculation( 图4A,B)或延长孵育慢病毒颗粒( 图4C,D)并因此不能产生额外的价值。
RNA提取
下一步类器官的RNA提取生长。完全成熟的组织体收获经受伽马辐照或控制的治疗,以显示降低的RNA的完整性( 图5)。在与6戈瑞,RNA被降解和比较,以控制处理的组织体照射中,RNA完整性数(RIN)被减少。
免疫组化对石蜡包埋组织体
温育组织体2小时在补充有BrdU的培养基后,在福尔马林组织体固定并处理用于免疫组织化学( 图6)。用鼠抗BrdU的,增殖细胞可以在地穴SEGM观察组织体和不经过微分的隔室需求测试。
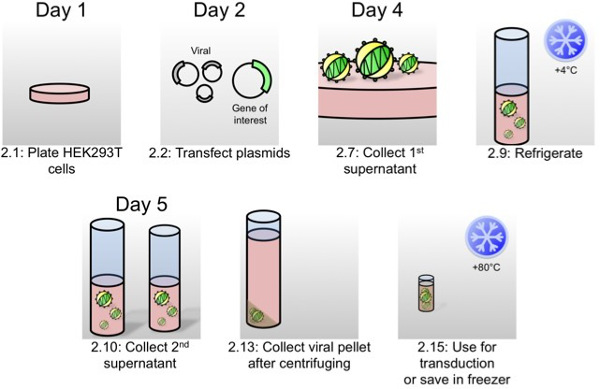
图1:示意慢病毒的生产对于组织体转导的作为写在协议部2,在该示意性病毒产生的最重要的步骤被表示具有协议的步骤编号 和定时。
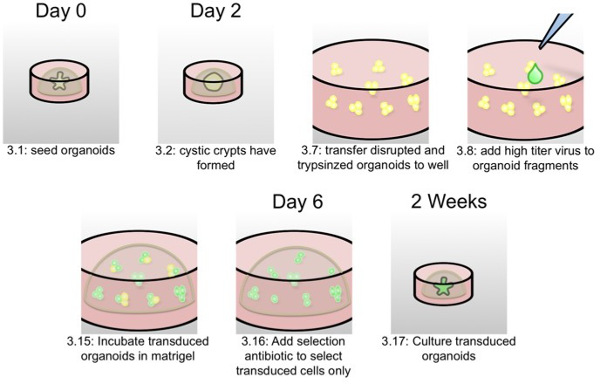
图2:组织体慢病毒转导的示意图作为写入协议部3,在该示意性组织体转导的最重要的步骤被表示具有协议的步骤编号 和定时。
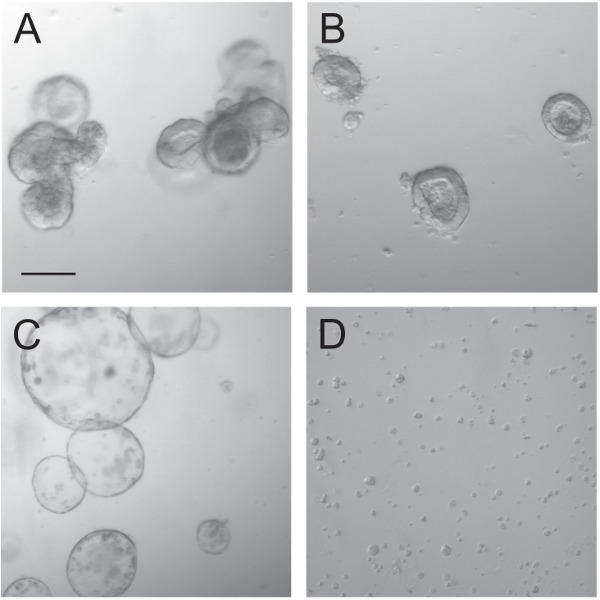
图3:组织体之前和期间TRANsduction。正常生长组织体(A)中被分成密 集生长小组织体(B),该变囊性孵育CHIR99021为天数(C)的后。在这些组织体用胰蛋白酶解离,单细胞和细胞小团块保持(D),它们随后转导。比例尺为100μm。

图4:利用慢病毒表达载体组织体转明场图像(A,C,E,G)和荧光图像(B,D,F,H)从类器官的转染要么PGK-EGFP慢病毒(A - F)或控制慢病毒(G, H)。同时使用spinoculation和扩展孵化慢病毒转导后,组织体EGFP表达(A,B),spinoculation只(C,D)或没有额外的步骤,以增加转导效率(E,F),相比控制载体转类器官,不绿色荧光蛋白表达(G,H)。注意,使用的PGK-EGFP慢病毒构建体,转导药效不大大增加了额外的步骤。比例尺为100μm。
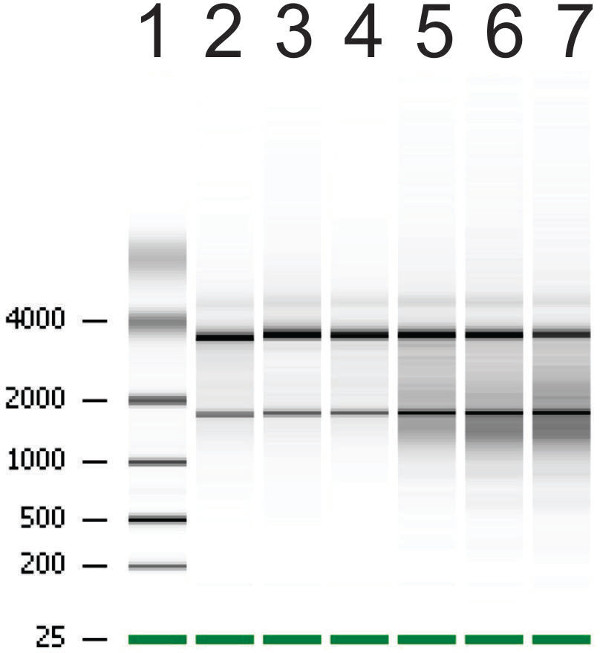 图5:RNA棉片从生物分析仪组织体的代表结果注意车道2-4代表高RNA完整乐队强烈的划分和周围涂抹在泳道5-7代表日志RNA完整性乐队。带2-4的RNA完整性数(RIN)是8.7,9.2和9分别,而吨带5-7,他RIN是6.4,6.6和5.5。
图5:RNA棉片从生物分析仪组织体的代表结果注意车道2-4代表高RNA完整乐队强烈的划分和周围涂抹在泳道5-7代表日志RNA完整性乐队。带2-4的RNA完整性数(RIN)是8.7,9.2和9分别,而吨带5-7,他RIN是6.4,6.6和5.5。

图6:对福尔马林固定的石蜡包埋组织体免疫组织化学分析福尔马林固定的石蜡包埋组织体两小时中的BrdU的存在下培养的4微米部分并随后固定。科用抗BrdU抗体。比例尺100微米。 请点击此处查看该图的放大版本。
| 基本培养基 | 添加 | |
| 细胞系培养基 | DMEM | 10%FCS中 |
| 1%青霉素/链霉素 | ||
| 2毫米GLutamine | ||
| 类器官培养基 | 先进的DMEM F12 | HEPES |
| 1%青霉素/链霉素 | ||
| 1X谷氨酰胺 | ||
| 1%N2补充 | ||
| 2%B27补充剂 | ||
| 125nM的N-乙酰半胱氨酸 | ||
| 鼠EGF(50毫微克/毫升) | ||
| 10%的木栓-Fc的条件培养基(相当于100毫微克/毫升) | ||
| 10%Rspo1-Fc的条件培养基(相当于500毫微克/毫升) |
表1:培养基组合物。
讨论
目前的视频协议描述了从初级肠上皮而这些类器官采用定量RNA技术和免疫组化下游分析组织体的慢病毒转导。
往往是在贴壁或悬浮细胞在培养板中进行慢病毒转导。自组织体的三维结构使得它们难以通过病毒颗粒渗透,使用了若干方法来增加疗效。转导后使用CHIR99021组织体的预处理增加增殖,从而可行性。重要的是要保持小细胞群体胰蛋白酶消化后,由于单电池已减少存活是重要的。而相比之下,使用鼠逆转录病毒转导的病毒,慢病毒转导效率更高,通常不需要spinoculation,在ES细胞中10个已知的增加转导效力的技术。当使用鼠类逆转录病毒或WH烯慢病毒转导的产量低功效,spinoculation可任选地用于增加传导速度。我们不经常从单轮生产从最多两个0.95厘米2井派生类器官的转导评估病毒滴度,因为所有可用的病毒使用。此外,一般采用抗生素选择用于除去非转导的细胞。病毒滴度评价遇到的问题与转导功效时可能不过是有价值的。
相同,以贴壁细胞,选择抗生素的水平可以增加病毒的积分次数,从而表达所述转基因的。使用高级别嘌呤(10微克/毫升),以获得较高的转基因表达和有效敲低,但是,当毒性的组织体显示出迹象,较低水平,可以使用(最小1微克/毫升)。此外,可替代选择的抗生素,可以使用或选择可以省略,尽管转导可能是不完整的,这可能不会导致长期稳定的表达。此外,由于慢病毒的整合在基因组中是在整个细胞群异质,转基因的表达可以被制伏的变化的时间较长培养细胞之后。这可能是由于通过转基因的表达选择压力。尽管抗生素选择限制这些改变,它们可能仍然存在,尤其是在转基因的组成型表达的情况下。该缺点可通过组织体的单细胞克隆来克服,但是这种技术是耗时的。慢病毒转导可与多种导致在稳定或可诱导的转基因的表达质粒来进行。这些转基因通常由普遍存在的启动子,例如CMV或PGK启动子表达的,并可能导致超自然表达。类似于肿瘤细胞系或模型动物的转基因过度表达,谨慎是必要的解释结果来回回米表达。
对于需要的RNA的实验中,活细胞的数量很少在单个0.95厘米2井(48标准表面积孔)在对比,可以很容易地在大烧瓶中生长贴壁细胞正常生长为质量的限速因子和苠下游分析。我们发现,通常,大约50充分生长组织体0.4微克和1微克的总RNA,足以为定量RT-PCR和RNA微阵列之间的产量没有进一步放大的单个井。某些治疗方案或遗传改变可以显著但是降低RNA含量。第一步,以增加总RNA汇集多个井。
对组织体的石蜡包埋,这是至关重要的,以获得足够的材料,以便在过程中的可视化组织体。加入微量曙红对组织体的固定,可以使整个过程中组织体的可视化的过程,但不要求用于正常嵌入和当这一步干扰进一步分析可以省略。通常情况下,石蜡包埋磁带有破洞,让流动的固定液和流程解决方案,在纸盒的组织。
慢病毒类器官传导,准备下游的标准技术增加了这些文化的科学潜力,并提出了在细胞培养中,从原发性小肠上皮细胞三维技术的标准。要执行的下游实验的范围然而并不限定于在当前协议中描述的技术,并且可以包含在细胞系或小鼠中进行的所有技术中,给定的通过培养产生足够的细胞物质的量。在特定的遗传元件和它们在肠上皮的功能,在模型动物的同源重组技术,最显着的小鼠的研究,仍的黄金标准。组织体的文化做不含有间质或免疫细胞的利基,培养隐窝的不断扩大,对比在体内发现的情况。尽管如此,这些培养提出的体外研究结果大大的质量,并考虑到了可以执行,类器官培养具有和将大大提高研究对肠上皮的无数的下游的技术。
披露声明
The authors have nothing to disclose.
致谢
J. Heijmans is supported by a stipendium from the Dutch cancer foundation (KFW). G.R. van den Brink is supported by funding from the European Research Council under the European Community’s Seventh Framework Program (FP7/2007-2013)/European Research Council grant agreement number 241344 and by a VIDI grant from the Netherlands Organization for Scientific Research (GvdB).
材料
| Name | Company | Catalog Number | Comments |
| Polyethylene imine | Polysciences | 23966-2 | |
| DMEM medium | Lonza | BE12-614F | |
| Fetal calf serum | Lonza | DE14-801F | |
| Penicillin-streptomycin | Invitrogen | 15140-122 | |
| Glutamin | Invitrogen | 25030-024 | |
| matrigel | BD | BD 356231 | |
| Advanced DMEM-F12 | Gibco | 12634-010 | |
| N2 | Invitrogen | 17502-048 | |
| B27 | Invitrogen | 17504-044 | |
| N-acetyl cysteine | Sigma | A9165-1G | |
| mouse Egf | Invitrogen | PMG8045 | |
| Hepes 1 M | Invitrogen | 15630-056 | |
| glutamax 100x | Invitrogen | 35050-038 | |
| Chir 99021 | Axon | 1386 | |
| Y27632 | Sigma | Y0503-5MG | |
| polybrene | Sigma | 107689 | |
| nicotinamide | Sigma | N0636 | |
| Trypsin | Lonza | BE02-007E | |
| puromycin | Sigma | P 7255 | |
| Rneasy mini kit | Qiagen | 74106 | |
| β-mercaptoethanol | Merck | 8,057,400,250 | |
| Ovation Pico WTA system | NuGen | 3300-12 | |
| paraformaldehyde | Sigma | 252549-1L | |
| glass vial conical 12 mm x 75 mm 5 ml | VWR | LSUKM12 | |
| Eosin Yellowish | VWR | 1,159,350,025 |
参考文献
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Al-Nafussi, A. I., Wright, N. A. The effect of epidermal growth factor (EGF) on cell proliferation of the gastrointestinal mucosa in rodents. Virchows Archiv. B, Cell Pathology Including Molecular Pathology. 40 (1), 63-69 (1982).
- Haramis, A. P., et al. De novo crypt formation and juvenile polyposis on BMP inhibition in mouse intestine. Science. 303 (5664), 1684-1686 (2004).
- Zhao, J., et al. R-spondin1, a novel intestinotrophic mitogen, ameliorates experimental colitis in mice. Gastroenterology. 132 (4), 1331-1343 (2007).
- Schwank, G., Andersson-Rolf, A., Koo, B. K., Sasaki, N., Clevers, H. Generation of BAC transgenic epithelial organoids. PLoS One. 8 (10), e76871 (2013).
- Koo, B. K., et al. Controlled gene expression in primary Lgr5 organoid cultures. Nature Methods. 9 (1), 81-83 (2012).
- Heijmans, J., et al. ER stress causes rapid loss of intestinal epithelial stemness through activation of the unfolded protein response. Cell Rep. 3 (4), 1128-1139 (2013).
- Roe, T., Reynolds, T. C., Yu, G., Brown, P. O. Integration of murine leukemia virus DNA depends on mitosis. The EMBO Journal. 12 (5), 2099-2108 (1993).
- Lau, W., et al. Lgr5 homologues associate with Wnt receptors and mediate R-spondin signalling. Nature. 476 (7360), 293-297 (2011).
- Bahnson, A. B., et al. Centrifugal enhancement of retroviral mediated gene transfer. Journal Of Virological Methods. 54 (2-3), 131-143 (1995).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。