Method Article
Высокая пропускная Анализ млекопитающих обонятельные рецепторы: измерение рецептора активации через активность люциферазы
В этой статье
Резюме
Обонятельные модели активации рецептора кодировать личность запах, но отсутствие опубликованных данных, идентифицирующих одоранта лиганды для млекопитающих обонятельных рецепторов препятствует развитию комплексной модели кодирования запахов. Этот протокол описывает способ, чтобы облегчить идентификацию высокой пропускной обонятельных рецепторных лигандов и количественного определения активации рецептора.
Аннотация
Отдушки создавать уникальные и перекрывающиеся паттерны активации обонятельных рецепторов, что позволяет семейство примерно 1000 мышиных и 400 человека рецепторов признать тысячи пахучих веществ. Одоранта лиганды были опубликованы для меньше чем на 6% человеческих рецепторов 1-11. Это отсутствие данных отчасти из-за трудностей функционально, выражающих эти рецепторы в гетерологичных системах. Здесь мы описываем способ для выражения большинство обонятельной семейства рецепторов в клетках Hana3A, а затем оценки высокой пропускной активации обонятельного рецептора с использованием репортера люциферазы анализа. Этот анализ может быть использован для (1) экрана панелей пахучих веществ против панелей обонятельных рецепторов; (2) подтвердить взаимодействие одоранта / рецептора с помощью кривых доза-ответ; и (3) сравнить уровни активации рецептора среди вариантов рецепторов. В наших выборочных данных, 328 обонятельные рецепторы были отобраны в отношении 26 пахучих веществ. Пары одоранта / рецепторов с различной оценки реагирования были селекцияТед и испытаны в зависимости от дозы. Эти данные свидетельствуют о том, что экран является эффективным методом для обогащения пар одоранта / рецепторов, что пройдет эксперимент доза-ответ, то есть рецепторы, которые имеют добросовестное ответ на одоранта. Таким образом, эта высокой пропускной люциферазы анализ является эффективным методом для характеристики обонятельных рецепторов-важный шаг на пути модели запаха кодирования в обонятельной системы млекопитающих.
Введение
Обонятельной системы млекопитающих обладает способностью реагировать на огромное количество пахучих стимулов, что позволяет для обнаружения и дискриминации тысяч пахучих веществ. Обонятельные рецепторы (ОШ) молекулярные датчики, выраженные обонятельных сенсорных нейронов в обонятельный эпителий 12. Млекопитающих признание запах происходит через дифференциальной активации ORs по пахучих веществ, а также ИЛИ семейство генов, весьма обширен, с примерно 1000 мышиных и 400 человека рецепторов 12-16. Предыдущие функциональный анализ ORs в обонятельных нейронов и в гетерологичных клетках показали, что различные отдушки признаны уникальным, но перекрывающихся ансамбли ОШ 10,17-20. Соответствующие лиганды к ORs имеет решающее значение для понимания обонятельный код и необходимы для построения жизнеспособных моделей обоняния. В связи с трудностями, экспрессирующих ORs в гетерологичных системах, а также большого количества обоих одорантов и ОР, эти данные в значительной степени отсутствует из Fдно сть; действительно, менее 6% человеческих ORs есть опубликованный лиганд 1-11. Этот протокол описывает использование люциферазы охарактеризовать одоранта / или взаимодействий. Этот анализ позволяет с высокой пропускной характеристику ORs, задачу, которая имеет важное значение для понимания одоранта / или взаимодействий, а также разрабатывает модель кодирования запахов.
Высокая пропускная исследования ORs сталкиваются с тремя основными проблемами. Во-первых, ОШ, выраженные в гетерологичных клетках были сохранены в ЭР, а затем разрушается в протеасомы 21,22, предотвращая ПРС от взаимодействия с одорантов в системе анализа 23-25. Эта проблема была адресована в связи с открытием вспомогательных белков, которые способствуют стабильной клеточной поверхности выражение широкого спектра ПРС 19,26,27. Рецептор-транспортер-белки 1 и 2 (RTP1 и 2) содействие или выражение клеточной поверхности и активация в ответ на одоранта стимуляции 19. На основе этой работы, HEK293T клеткиизменение в стабильной экспрессии RTP1 длинный (RTP1L) и RTP2, рецептор экспрессии белка, повышающих 1 и G αolf, в результате клеточной линии Hana3A 19,27. Кроме того, мускариновых рецепторов ацетилхолина типа 3 (M3-R) взаимодействует с ОР на поверхности клеток и усиливает активацию в ответ на одорантов 26. Котрансфекция из или RTP1S и M3-R в Hana3A клетках приводит к надежной, последовательной и функциональная экспрессия широкого круга ORs на клеточной поверхности 27. Во-вторых, млекопитающих или репертуары довольно большие. У человека, например, в репертуаре или на порядок больше, чем вкусовой репертуара рецепторов, и на 2 порядка больше, чем визуального репертуара рецепторов. Хотя клонирование одного или является относительно простым протоколом, значительная авансовые усилий требуется для создания обширную библиотеку. В-третьих, хотя мы знаем, что в видении, длина волны приводит к цвету ив частоте прослушивание переводит на поле, организация запахов еще плохо изучены, что затрудняет для исследователей для интерполяции из репрезентативной выборки пахучих веществ. Несмотря на некоторый прогресс был достигнут на этой передней 10,28, карта обонятельной пейзаж остается неполным. Скрининг десятки тысяч молекул против сотен ORs является непростой задачей; высокой пропускной экраны в этой области требуют тщательно определенные кампании. Основными нерешенные проблемы являются те, логистики и стоимости, а не проблем, связанных с техникой. Хотя гетерологичная скрининг не была широко используется для идентификации лигандов на академических групп, частная компания использовала ту же технику, чтобы определить лигандов на 100 человека ORs 29. К сожалению, эти данные остаются частной собственностью.
Высокой пропускной люциферазы анализа изложены здесь имеет ряд преимуществ по сравнению с альтернативными методами, используемыми для оценки или активации. Хотя ответственСЭС родных обонятельных сенсорных нейронов были измерены с помощью электрофизиологии и визуализации кальция, эти методы трудно дразня друг от друга, которые ИЛИ приводит к реакции нейрона из-за перекрытия в свойствах реагирования для обонятельных нейронов. Хотя стук-в GFP-меченого рецептора типа 30,31, обеспечивая специфические рецепторы через аденовируса с мышиным обонятельные нейроны 32,33, или при выполнении ОТ-ПЦР после записи 17,24,33 можно связать записи на отдельных типов рецепторов, эти методы низкой пропускной способности и не подходит для крупномасштабных экранов. Гетерологичные системы скрининга более масштабируемой и две основные формы встречаются в литературе: цАМФ проводящих путей репортеры и инозиттрифосфата (IP3) путь журналистам. После запаха стимуляции, ORs активации сигнального каскада G αolf трансдукции, что приводит к образованию циклического АМФ (цАМФ) 12. К со-трансфекции светлячка репортерный ген люциферазы под контролем переменногоAMP элемент ответа (CRE), производство люциферазы может быть измерено как функция отклика запаха, что позволяет для количественной оценки или активации. ИЛИ активации также могут быть связаны с пути IP3 по коэкспрессирующей G-белки, такие как G α15/16 или G α15-олф химеры 24,25,34. Мы выбрали анализ представленные здесь на основе трех факторов: (1) коэкспрессией RTP1 с Ро-меченых обонятельных рецепторов повышает экспрессию обонятельных рецепторов на клеточной поверхности 19,27; (2) использование гена-репортера цАМФ аспекты позволяет для измерения или активации через канонической вторичного мессенджера пути; и (3) анализ хорошо подходит к экранам высокой пропускной.
Это высокой пропускной люциферазы анализ применим к различных исследований ценных в области обоняния. Во-первых, большое количество ORs могут быть подвергнуты скринингу против одного одоранта, чтобы определить шаблон активации рецептора для зрecific одоранта. Этот тип исследования определены OR7D4 как ИЛИ ответственность за ответы на стероидного одоранта андростенону 8. С другой стороны, один или могут быть подвергнуты скринингу против панели одорантов, чтобы определить профиль реакции рецепторов 10. Когда кандидат обонятельная одоранта / ИЛИ пары идентифицируются с помощью этих экранов, взаимодействие может быть подтверждена путем проведения реакции эксперимент дозы рассматривая реакцию или возрастающих концентраций одоранта. Кривые зависимости от дозы может также оценить, как генетические вариации в OR влияет в пробирке одоранта ответ 8,9,11,35, и эти исследования могут быть распространены на межвидовых или изменения, что позволяет для рассмотрения эволюции рецепторов у разных видов и причинных мутаций в эволюции 36,37, наконец, этот анализ может быть использован для скрининга антагонистов запаха, которые способны противодействовать или ответа на конкретный одоранта при известном одоранта / рецептора пары 38,39. Таким образом, этот высокийПропускной люциферазы анализа применима к целому ряду исследований, которые помогут охарактеризовать или шаблонов активации и обеспечивают лучшее понимание кодирования запахов в обонятельной системы.
протокол
1. Культура Hana3A клеток
- Подготовка M10 носитель путем дополнения минимальную поддерживающую среду (MEM) с добавлением 10% (объем / объем) FBS.
- Культура обслуживание
- Поддерживать клетки в М10 СМИ. Примечание: экспрессирующие векторы для RTP1L, RTP2, REEP1 и G αolf придают устойчивость к пуромицин Hana3A клеток, но поддержание клеток с этого антибиотика не оказывает существенного влияния опробования результатов.
- Субкультура в соотношении 1:08 в 10 см чашки каждые 2-3 дня.
- Инкубируют при 37 ° С с 5% CO 2.
2. Плакировка Клетки для трансфекции
- Аспирируйте медиафайлы от 100% сливающийся 10 см блюдо Hana3A клеток.
- Вымойте клеток путем добавления 10 мл PBS, циркулируя блюдо, и аспирационных PBS.
- Добавьте 3 мл 0,05% трипсина / ЭДТА и ждать клетки отделить (около 1 мин).
- Деактивировать трипсин добавлением 5 мл M10 и распадаются клеточные скопления, растирая примерно в 10 раз &# 160; с 10 мл пипетки. Внесите тщательно, чтобы избежать введения пузырьков воздуха в средствах массовой информации.
- Для каждого 96-луночный планшет, передача 1 мл клеток в 15 мл коническую трубку центрифуги, при 200 х г в течение 5 мин и аспирации супернатант, не нарушая клеточный осадок.
- Ресуспендируют клеток в 6 мл M10 в 1 мл клеток, переданных на шаге 2.5.
- 50 мкл клеток в каждую лунку 96-луночного планшета и инкубировать в течение ночи при 37 ° С с 5% CO 2.
3. Трансфекцию обонятельных рецепторов
- Приготовление плазмидной ДНК
- Подготовка ДНК плазмиды с помощью протокола эндотоксинов. Примечание: подготовка комплектов Использование плазмидной ДНК обозначенные "эндотоксина", или добавить экстракции шаг фенол-хлороформ протокола препарата плазмидной ДНК.
- Развести ДНК в концентрации 100 нг / мкл в буфере ТЕ.
- Соблюдайте пластинчатые клетки (этап 2.7) для обеспечения надлежащего слияния из приближенииДЕТАЛЬ 30-50% на лунку и возврата в инкубаторе. Примечание: Хотя это сплошности не является оптимальным для реагента для трансфекции липидов, сплошности 30-50% на этом этапе является оптимальным для измерения активности люциферазы 24 ч после трансфекции.
- Подготовка смесь для трансфекции
- Внесите RTP1S-PCI, М3-R-PCI, PCRE-Люк и pSV40-RL плазмиды в среде МЕМ в объемах, описанных в таблице 1, чтобы сделать плазмиды смеси (объемы, указанный указаны за 96-луночный планшет).
Плазмиды смесь на лунку в 96-луночный планшет MEM - 500 мкл RTP1S-PCI 5 нг 480 нг M3-R-PCI 2,5 нг 240 нг PCRE-Люк 10 нг 960 нг pSV40-RL 5 нг 480 нг
Таблица 1. Компоненты смеси плазмиды. На лунку и в 96-а объемы плит от RTP1S-PCI, M3-R-PCI, PCRE-Люк и pSV40-RL и MEM. - Для каждого 96-луночного планшета, развести 18 мкл липидного реагента для трансфекции в 450 мкл MEM среде.
- Внесите плазмиды смесь (из шага 3.3.1), родопсина с метками обонятельные рецепторы в PCI плазмиды (Ро-ИЛИ-PCI), и липидного смесь для трансфекции (с шага 3.3.2), чтобы сделать комплекс подробно описаны в Таблица 2. Смешайте раствор растиранием и инкубируют при комнатной температуре в течение 15 мин. Остановить реакцию, добавив M10 согласно таблице 2. Примечание: эта реакция срочных и не должно быть позволено продолжаться более 30 минут. И расчет + 10% важно обеспечить достаточный объем для последующих шагов.
Комплекс на лунку на лунку + 10% Плазмиды смесь 4.2 мкл 4,58 мкл Ро-ИЛИ-PCI 0,05 нг 0.06 нг Липидов смесь для трансфекции 4.2 мкл 4,58 мкл M10 41,7 мкл 45,83 мкл
Таблица 2. Комплексными компонентами. На лунку и на лунку + 10% объемов плазмиды смеси (таблица 1), обонятельный рецептор плазмиду (Rho-ИЛИ-PCI), и смесь для трансфекции липидов. M10 добавлена, чтобы погасить реакцию следующий 15 минут инкубации при комнатной температуре.
- Внесите RTP1S-PCI, М3-R-PCI, PCRE-Люк и pSV40-RL плазмиды в среде МЕМ в объемах, описанных в таблице 1, чтобы сделать плазмиды смеси (объемы, указанный указаны за 96-луночный планшет).
- Нажимайте в СМИ на клеточных пластин.
- 50 мкл комплекса в каждую лунку и инкубировать в течение ночи при 37 ° С с 5% CO 2.
4. Запах Стимуляция
- Соблюдайте трансфекции клеток для обеспечения надлежащего слияния 50-80% на лунку и вернуться в инкубаторе. Примечание: Если клетки менее 50% Сливающиеся, люциферазы светляков и рениллы люциферазы показания может быть слишком низкой для измерения активации рецептора. Рассмотрим отбрасывая тарелку.
- Подготовьте 1 м растворы каждого запаха в ДМСО.
- Подготовка запах стимуляции решения в CD293 среды.
- Для скрининга экспериментов, разбавить исходный раствор запаха до 100 мкм. Также подготовить контроль не-запах (CD293 только), чтобы контролировать для ИЛИ фоне активации. ПРИМЕЧАНИЕ: Для скрининга экспериментов, каждая пара ИЛИ / запах проверяется только один раз в эксперименте. Поскольку некоторые запах диффузии через скважинах возможна, рекомендуется, чтобы стимулировать с одним одоранта для каждой пластины.
- Для экспериментов доза-ответ, подготовить семь 10-кратные серийные разведения запах исходного раствора в трех экземплярах, начиная с 1 мМ для каждого рецептора. Также подготовьте те же запах разведения в трех экземплярах для пустой векторных трансфицированными клеток с целью контроля за запах фоне активации. ПРИМЕЧАНИЕ: Для экспериментов доза-ответ, каждый одор лечение концентрация должна проводиться в трех экземплярах.
- Нажимайте в СМИ на клеточных пластин.
- Внесите 25 мкл запаха стимуляции раствора в каждую лунку и инкубировать в течение 4 часов.
5. Измерения или активности с помощью люциферазы
- Ресуспендируйте люциферазы светляков субстрат в соответствии с инструкциями изготовителя и хранить при температуре -80 ° С.
- Разморозить 1 мл субстрата люциферазы светл за 96-луночный планшет.
- Подготовка свежий люциферазы светлячка реакцию жажду и субстрата люциферазы Renilla реагент (5 мкл люциферазы гаситель / субстрата люциферазы Renilla в 1 мл буфера). Примечание: приблизительно 1 мл реагента необходимо в 96-луночный планшет.
- Подготовка читателя люминесцентные микропланшетного. Откройте программу микропланшет-ридера. В значок системы:
- Под "подогрев" Tab, установите флажок для "ON" и установить температуру машины до 25 °; С.
- На вкладке "распылитель", премьер каждый распылитель с 1000 мкл 70% этанола с последующим 1000 мкл дистиллированной воды. ПРИМЕЧАНИЕ: Используйте отдельные аликвоты спирта и воды для каждого дозатора. Этанол используется для дезинфекции дозаторы, и вода удаляется остаточного этанола.
- Премьер каждый распылитель с 1500 мкл воздуха (удаление дозаторы от жидкости). ПРИМЕЧАНИЕ: грунтовки с воздухом гарантирует, что люциферазы субстраты не разбавляют остаточной воды.
- Премьер-распределитель 1 с 1080 мкл светлячка субстрата люциферазы (с шагом 5.2). Премьер-дозатор 2 с Renilla субстрата люциферазы (с шагом 5.3). ПРИМЕЧАНИЕ: Будьте осторожны, не кросс-загрязняют люциферазы субстратов. Грунтование люциферазных субстратов заполняет мертвое пространство внутри дозаторов реагентов.
- Настройте следующий протокол прочитать и светлячка и Renilla люциферазы свечение. В программного обеспечения, связанного с микропланшет-ридера, UNдер в меню "Файл", нажмите на кнопку "Новая задача". Выделите "Протоколы" и нажмите "Создать новый". В следующем окне, круг рядом с "Standard протокола" должен быть выбран. Нажмите "OK". Дважды щелкните на "процедуры" на левой стороне экрана.
- Внесите 10 мкл светлячка субстрата люциферазы во все лунки с помощью дозатора 1. В меню «Действия» нажмите кнопку «Отказаться от". В окне "Внесите Шаг", установите: "Диспенсер" 1, "Грунтовка" никому ", обойтись Volume" до 10 мкл и "курс" до 225 мкл / сек. Нажмите "OK".
- Встряхнуть тарелку в течение 30 сек. В меню "Действия", выберите "трясется". В окне "встряхнуть Шаг", установить "Intensity" на средний и "Продолжительность" в 0:30 MM: SS. Нажмите "OK".
- Читайте свечение всех скважин на 0,5 сек на лунку. В меню "Действия", нажмите кнопку «Прочитать»;. В окне "Read Шаг", установите: "Метод обнаружения" к люминесценции, "Читать Type" в конечный пункт, "Время интеграции" в 0:00:50 MM: SS: сс ", наборы фильтров" 1, "Выброс" в отверстие, "Оптика Позиция" вверх, "Усиление" до 135, и "Read Рост" до 1,00 мм. Нажмите "OK".
- Внесите 10 мкл Renilla субстрата люциферазы во все лунки с помощью дозатора 2. Установите условия, как в шаге 5.6.1, за исключением набора "Диспенсер" до 2.
- Встряхнуть тарелку в течение 30 сек. Задайте условия, как в шаге 5.6.2.
- Читайте свечение всех скважин на 0,5 сек на лунку. Задайте условия, как в шаге 5.6.3.
- Удалить крышку с 96-луночного планшета и поместите пластину в считывающее устройство микропланшет. Запустите программу, установленный в шаге 5.5 читать пластины свечение.
- Очистите реагентов дозаторы насосы. От иконы системы на вкладке "распылитель":
- Выпустите 1000 мкл Firefly субстрата люциферазы из люциферазы светляков дозатора в рекуперации трубки. Примечание: люциферазы светлячка можно хранить при -80 ° С и использовать повторно.
- Prime каждый распылитель с 1000 мкл дистиллированной воды, а затем 1000 мкл 70% этанола и, наконец, 1500 мкл воздуха (удаление дозаторы из жидкости). ПРИМЕЧАНИЕ: Вода выводит люциферазы субстраты из реагентов насосов, этанола дезинфицирует и сушит воздух остаточного этанола.
6. Анализ данных
- Экспорт данных
- В программном обеспечении микропланшет-ридере, дважды щелкните на "Отчет / Экспорт строителей" на левой стороне экрана.
- Нажмите на кнопку "Новый Экспорт в Excel" и нажмите "ОК".
- Выделите Export1 и нажмите кнопку "Изменить".
- В разделе "Содержимое" проверить "Описание системы", "процедуры", "Тарелка Описание" и "плиты Макет Матрица". Включите "исходные данные" ай "Расчетные данные".
- В разделе "Workflow", проверьте "Автовыполнение на завершении процедуры". В режиме экспорта, проверить "Все пластины в той же книге" и "как новый лист".
- Под "Файл" выберите формат имени файла и расположение файла и нажмите кнопку "ОК".
- Закройте окно "отчет / Экспорт строителей».
- Для получения нормированные значения люциферазы, разделите люциферазы светляков чтение люминесценции для каждого хорошо (этап 5.6.3) по люминесценции чтения Renilla для каждой скважины (этап 5.6.6).
Результаты
Основной экран испытания 328 ORs против 26 запахов в концентрации 100 мкМ. Эта концентрация запаха было продемонстрировано, чтобы эффективно активировать большую часть ОР с известными лигандами 10. Во-первых, нормализованное активность люциферазы рассчитывается путем деления светлячка чтение люциферазы люциферазы Renilla чтения. Далее, базовая версия рассчитывали путем вычитания нормированные люциферазы показания для контроля нет запаха от нормированных люциферазных показаний для каждого а (рис. 1). Кривые зависимости от дозы проводили на 48 одоранта / или пары случайным образом распределены по всему спектру значений базовой версии, о чем свидетельствует цветными полосами на рисунке 1. ORs обрабатывали 7 концентраций одорантов, охватывающей 1 нм до 1 мм, и полученные ответы были пригодны чтобы сигмоидальной кривой с использованием нелинейной регрессии. Одоранта / ИЛИ считался агонистом если он встретил трех критериев: (1) стандартная ошибкаLogEc 50 было меньше, чем 1 единица журнала; (2) 95% доверительные интервалы для верхней и нижней параметров кривой не перекрываются; и (3) дополнительные суммы из-квадратов тест подтвердил, что одоранта активировали ИЛИ клеток, содержащих значительно больше, чем у контрольных клеток, которые были трансфицированных пустым вектором. Результаты зависимости от дозы приведены в таблице 3.
Эти данные были затем использованы для определения того, насколько хорошо аналитические измерения в первичной экране предсказать результаты соответствующей кривой. Синие бары в рисунке 1 отвечают парам, которые были классифицированы как агонисты в эксперименте в ответ полный дозы, в то время как красные столбики не соответствует нашим трем критериям, изложенным выше. Значения от основного экрана предсказал результаты от полной дозы эксперимента ответ (площадь под приемником, работающим характеристику (AUC) = 0,68, р <0,01, Манна-Уитни U-тест), указывая, что наша основная экран является полезным методом для обогащения одоранта / ИЛИ пар, которые будут классифицированы как агонисты в ответном эксперимента полный дозы (рис. 2).
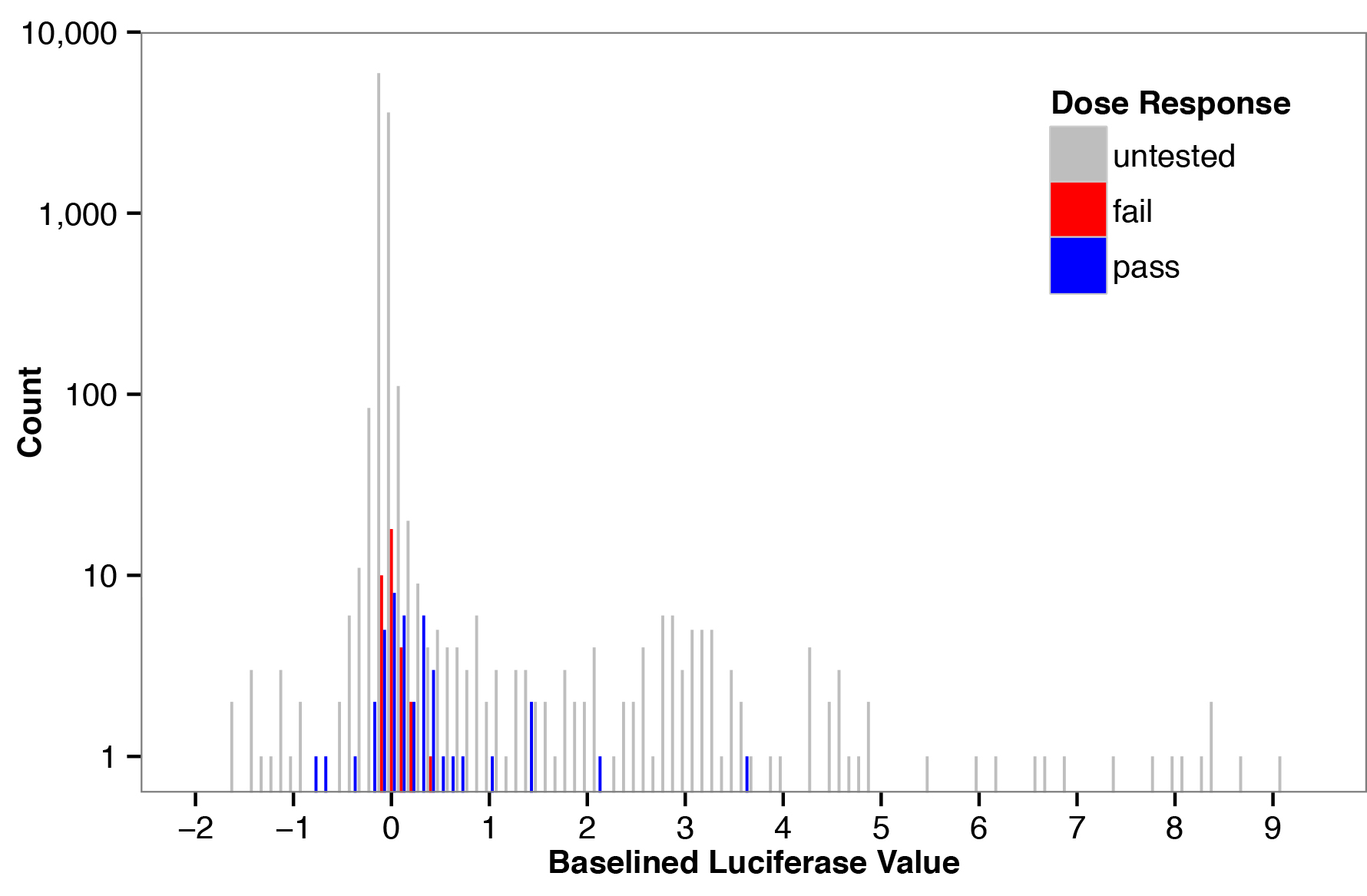
Рисунок 1. Частота базовой версии значений люциферазы для экрана с панели обонятельных рецепторов и отдушек. Гистограмму частоты (граф) из базовой версии значений люциферазы, рассчитанных для каждого одоранта / ИЛИ пары на первичном экране. Как пары активации одоранта / рецептор редки, большинство значений с центром в нуле и большой центральный распределение оценивает распределение шума для этого анализа. Цветные полоски показывают одоранта / рецептор пары, выбранные для анализа реакции на дозу; синие полосы являются пары, которые были классифицированы как агонистов, основанных на ответ полный дозы, и красные бары пары, которые не были классифицированы как агонистов.е = "https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/51640/51640fig1highres.jpg" целевых = "_blank"> Нажмите здесь, чтобы посмотреть увеличенное изображение.
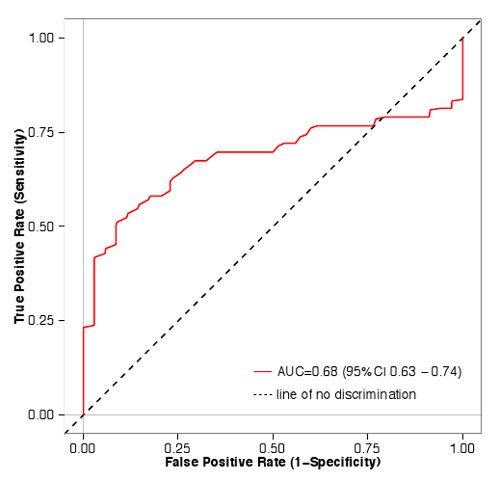
Рисунок 2. ROC кривая для экрана одоранта / рецептора. Пары одоранта / рецептор 48 были классифицированы как агонисты или как не агонисты. Правда положительные темпы (чувствительность) затем заговор против ложных срабатываний (1-специфичность) с помощью статистического пакета R 40. Площадь под кривой (AUC) составляет 0,68, что указывает на пары одоранта / рецепторов с более высокими значениями люциферазы экрана, скорее всего, пройдет реакцию дозы, чем те, с более низкими значениями. Кликните здесь, чтобы посмотреть увеличенное изображение.
| Базовая версия Значение | Доза отклика |
| 0,051793067 | провал |
| 0,006376956 | провал |
| 0,331936398 | проходить |
| 0,591006519 | проходить |
| 0,049093369 | проходить |
| 0,396788976 | проходить |
| -0,013655743 | проходить |
| 0,011080217 | проходить |
| 0,004203349 | провал |
| 0,003975049 | провал |
| -0,077935718 | проходить |
| -0,084488317 | проходить |
| 0,030236078 | провал |
| -0,042963576 | провал |
| 0,031466406 | провал |
| 0,025897747 | провал |
| -0,030434651 | провал |
| -0,004122795 | провал |
| -0,010075533 | провал |
| 0,028883452 | провал |
| 0,019402373 | провал |
| 0,047508749 | провал |
| 0.00255344 | провал |
| 0,017221449 | провал |
| 0,340216655 | проходить |
| -0,026912181 | провал |
| 0,037140428 | провал |
| 0,467763017 | проходить |
| 0,097665337 | провал |
| 0,080657267 | проходить |
| 0,172819211 | проходить |
| 0.05568393 | проходить |
| -0,106721064 | проходить |
| 0,136614849 | проходить |
| 0,457839849 | провал |
| 0,211751741 | провал |
| 0.1581464 | проходить |
| -0,62099155 | проходить |
| -0,066949491 | проходить |
| -0,78712035 | проходить |
| 0,752503007 | проходить |
| 1,433407558 | проходить |
| 0,475431098 | проходить |
| 1,457936815 | проходить |
| 0,048652537 | провал |
| 0,027196782 | провал |
| 0,129599842 | провал |
| -0,069781272 | провал |
| 0,016450039 | провал |
| -0,025639207 | провал |
| 0,158152141 | провал |
| -0,032570055 | провал |
| 0,140139926 | провал |
| -0,052030276 | провал |
| 0,657140133 | проходить |
| 1,040410297 | проходить |
| проходить | |
| 0,399588712 | проходить |
| 0,188094387 | проходить |
| 0,039371424 | проходить |
| 0,016784352 | проходить |
| 0,229959571 | проходить |
| 0,238381997 | провал |
| 0,074118909 | провал |
| 0,423901128 | проходить |
| 0,152621022 | проходить |
| проходить | |
| 0,075301806 | проходить |
| 0,395233972 | проходить |
| 0,261892958 | проходить |
| 0,156693306 | провал |
| 2,163418147 | проходить |
| 3,649862104 | проходить |
| 0,025716169 | проходить |
| -0,033258008 | проходить |
| -0,026984127 | провал |
| -0,338441868 | проходить |
| 0.37398618 | проходить |
Таблица 3. Olfactory пары рецептор / запах испытанные в зависимости от дозы. Базовой версии значения люциферазы и результаты доза-ответ (или не передавать) в течение 48 ИЛИ / запаха пар, выбранных из экрана. Для 30 пар протестированных на экране дважды, оба базовой версии значения люциферазы включены.
Обсуждение
Одорант идентичность кодируется обонятельных варианты активации рецептора, но модели активации рецепторов, в том числе, которые рецепторы активируются и в какой степени, известны меньше, чем 6% человеческих обонятельных рецепторов 1-11. Усилия, направленные на характеризуют обонятельных рецепторов были ограничены их методов трудоемких или применимости только подмножества обонятельной семейства рецепторов 17,23,24,33,34. Гетерологичной системе экспрессии Hana3A поддерживает надежную экспрессию большинства протестированных обонятельные рецепторы, и может быть использован в сочетании с цАМФ-репортера люциферазы реагировать системы мониторинга обонятельный активацию рецептора 19,26,27. Производительность данного анализа в формате 96-луночного поддерживает ряд высокопроизводительных экспериментальных конструкций, в том числе экранов, чтобы определить вероятными кандидатами на пар одоранта / обонятельных рецепторов и кривых доза-ответ для подтверждения взаимодействия и оценить, как уровни активации рецептора афзывает влияние внутри-и межвидовых вариаций. Пары одоранта / рецептор с более высокими значениями активности в экране, более вероятно, чтобы продемонстрировать значительное реакцию дозы. Эти данные позволяют предположить, что этот метод скрининга способен обогатить для пар одоранта / рецепторов, которые будут проходить реакцию дозы, тем самым облегчая идентификацию запахов лигандов и обонятельных варианты активации рецептора.
Успех этого анализа, оптимизированного для обонятельной анализа рецепторов зависит от нескольких факторов. Все плазмидную ДНК должна быть подготовлена с помощью протокола эндотоксинов. В соответствии обонятельный экспрессии рецептора на поверхности клетки имеет решающее значение. Клеточная линия Hana3A стабильно выражает несколько вспомогательных белков, которые помогают ИЛИ выражение, но котрансфекции RTP1S и M3-R усиливает экспрессию рецептора и активации, соответственно 27. Такое сочетание выражения аксессуар белка приводит к надежной выражения большинстве обонятельных рецепторов, что позволяет comparisoп или активации среди экспериментов и рецепторов. Кроме того, мониторинг клеток слияния важно для получения согласованных результатов. Если предположить, что клетки в исходном 10 см 2 чашке грубо 100% сливной, согласно протоколу, описанному здесь приведет к надежной клеток слияния в течение всего эксперимента. Важно отметить, что достаточные клетки будут покрытием для получения измеримое чтение люциферазы, но клетки не будут чрезмерно выросли, состояние, которое может повлиять на активацию рецептора следующий одоранта стимуляции. Нормализация для конститутивной экспрессии рениллы дальнейших управления не только для плотности клеток, но и для эффективности трансфекции. Рениллы люциферазы чтения более чем в 2,5 стандартных отклонения ниже среднего может указывать потерю клеток. Клетки должны быть покрыты равномерно, чтобы избежать плотные бляшки, что отторгла легче от поверхности пластины, чем более редких элементов, и трансфекции и одоранта растворы должны быть добавлены осторожно в сторону скважины, чтобы избежать стягивающих CELлевая сторона Потерю клеток также может быть из-за гибели клеток, вызванной одоранта токсичности, проблема, которая может быть обойдена путем снижения концентрации одоранта, или чрезмерного ДМСО, который можно избежать посредством концентрации ДМСО ниже 0,5%. Наконец, обработкой каждого рецептор-экспрессирующих клеток население с 1 мкМ форсколина, с активатором аденилатциклазы, который вызывает экспрессию репортера люциферазы из стана аспекты промотора, может служить в качестве положительного контроля для анализа.
Хотя описанный здесь анализ представляет собой усовершенствование по сравнению с альтернативными методами, в том числе формат высокой пропускной и более общее применение к млекопитающему обонятельной семейства рецепторов, он имеет ограничения. Во-первых, наш анализ в пробирке не хватает многих компонентов в естественных условиях обонятельной системы, в том числе пахучих связывающих белков, слой слизистой оболочки, внутриклеточных молекул и нюхают поведения. Во-вторых, этот метод опирается на люциферазы системы репортера для измерения обонятельный рецепторактивация в отличие от распространенных альтернативных методов, которые используют визуализации кальция. Последние работы показывают, что эти два метода можно производить противоречивые результаты; действительно, несколько обонятельные рецепторы реагируют на конкретном одоранта при исследовании с помощью визуализации кальция, но не для анализа люциферазы 41. Будь один тип анализа является более актуальным исследованиям обоняния восприятия человека, остается неясным, но оба метода могут быть полезны в зависимости от контекста и типа рецепторов. В-третьих, хотя это функциональная система выражение успешно используется для выражения большинство протестированных млекопитающих обонятельных рецепторов, некоторые ОШ может не поддаваться выражения, используя эту систему. Если ранее неохарактеризованных рецепторы не реагируют на запахом, это может быть связано с отсутствием экспрессии на клеточной поверхности, а не отсутствие взаимодействия одоранта и рецептора. Экспрессии рецепторов на поверхности клетки могут быть рассмотрены через иммунофлюоресценции прежде чем делать выводы из отрицательного анализа результатов 27,42 . Наконец, в связи с низкой фоновой активности люциферазы в условиях не-запах, наш анализ не предназначен для обнаружения ингибирующие ответов. Чтобы определить запах антагонисты рецепторов обонятельной 38,39, большинство рецепторы должны быть сначала стимулировали с запахом, чтобы наблюдать снижение активности люциферазы.
Несмотря на эти ограничения, этот анализ системы имеет возможность значительно увеличить сбор данных в области обоняния. Во-первых, формат высокой пропускной 96-луночный делает рецепторов и / или запах экраны масштабные возможным. Во-вторых, его гетерологичный система экспрессии применим к различным млекопитающих обонятельные рецепторы. В-третьих, активность люциферазы может быть использован для измерения обонятельный активацию рецептора, который является ценным в описании картины активации рецептора для конкретного одоранта. В-четвертых, предыдущие результаты от аналогичных лабораторных тест-систем в предсказать человеческое обонятельный восприятие 8,11,35. Эти характеристики являются частбенно важно, учитывая большой размер млекопитающих обонятельной семейства рецепторов и наша ограниченность знаний в отношении ИЛИ варианты активации вызываемых специфическими запахами. Широкое применение этого анализа системы, оптимизированной для обонятельной анализа рецепторов будет способствовать более полной картины обонятельных рецепторов / одоранта взаимодействия и молекулярной основы кодирования запахов.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Эта работа была поддержана R01 DC013339, R03 DC011373 и Рут Л. Kirschstein Национальный исследовательский Service Award T32 DC000014. Часть работ была выполнена с использованием Monell хемосенсорных рецептора Сигнализация Core, который поддерживается, в частности, путем финансирования из P30 DC011735 NIH-NIDCD Основной Грант. Авторы выражают благодарность С. Sezille за помощь в сборе данных.
Материалы
| Name | Company | Catalog Number | Comments |
| Hana3A cells | Avaiable from the Matsunami Laboratory upon request | ||
| RTP1S-pCI | Avaiable from the Matsunami Laboratory upon request | ||
| M3-R-pCI | Avaiable from the Matsunami Laboratory upon request | ||
| pCRE-luc | Agilent | 219076 | LUC |
| pSV40-RL | Promega | E2231 | RL |
| Minimum Essential Media, Eagle | Sigma Aldrich | M4655 | MEM |
| FBS | Life Technologies | 16000-044 | FBS |
| PBS (without Ca2+ and Mg2+) | Cellgro | 21-040-CV | PBS |
| Trypsin (0.05% Trypsin EDTA) | Life Technologies | 25300 | Trypsin |
| CD293 | Life Technologies | 11913-019 | CD293 |
| 96-well PDL white/clear plate | BD BioCoat | 356693 | plates |
| Lipid transfection reagent: Lipofectamine 2000 | Life Technologies | 11668-019 | Lipofectamine |
| Firefly luciferase substrate, firefly luciferase quencher/Renilla luciferase substrate: Dual-Glo Assay | Promega | E2980 | dual glo |
| Synergy S2 | BioTek | SLAD | BioTek S2 |
| Microplate reader software: Gen5 Data Analysis Software | BioTek | Gen5 | Gen5 |
| BIOSTACK | BioTek | BIOSTACK2WR | BioStack |
| Multiflo | BioTek | MFP | MultiFlo |
| 300 μl GripTips | Integra | 4433 | GripTips |
| 12.5 μl GripTips | Integra | 4414 | GripTips |
| 300 μl GripTips ViaFlo96 | Integra | 6433 | XYZ tips |
| 12.5 μl GripTips 384 XYZ | Integra | 6403 | XYZ tips |
| 384ViaFlo | Integra | 6030 | 384ViaFlo |
| TE buffer | Macherey Nagel | 740797.1 | |
| DMSO | Sigma Aldrich | D2650-100ML | DMSO |
| Forskolin | Enzo Life Sciences | BML-CN100-0010 | FOR |
Ссылки
- Wetzel, C. H., Oles, M., Wellerdieck, C., Kuczkowiak, M., Gisselmann, G., Hatt, H. Specificity and sensitivity of a human olfactory receptor functionally expressed in human embryonic kidney 293 cells and Xenopus Laevis oocytes. The Journal of neuroscience the official journal of the Society for Neuroscience. 19 (17), 7426-7433 (1999).
- Spehr, M., et al. Identification of a testicular odorant receptor mediating human sperm chemotaxis. Science. 299 (5615), 2054-2058 (2003).
- Sanz, G., Schlegel, C., Pernollet, J. -. C., Briand, L. Comparison of odorant specificity of two human olfactory receptors from different phylogenetic classes and evidence for antagonism. Chemical senses. 30 (1), 69-80 (2005).
- Matarazzo, V., et al. Functional characterization of two human olfactory receptors expressed in the baculovirus Sf9 insect cell system. Chemical senses. 30 (3), 195-207 (2005).
- Jacquier, V., Pick, H., Vogel, H. Characterization of an extended receptive ligand repertoire of the human olfactory receptor OR17-40 comprising structurally related compounds. Journal of neurochemistry. 97 (2), 537-544 (2006).
- Neuhaus, E. M., Mashukova, A., Zhang, W., Barbour, J., Hatt, H. A specific heat shock protein enhances the expression of mammalian olfactory receptor proteins. Chemical senses. 31 (5), 445-452 (2006).
- Shirokova, E., et al. Identification of specific ligands for orphan olfactory receptors. G protein-dependent agonism and antagonism of odorants. The Journal of biological chemistry. 280 (12), 11807-11815 (2005).
- Keller, A., Zhuang, H., Chi, Q., Vosshall, L. B., Matsunami, H. Genetic variation in a human odorant receptor alters odour perception. Nature. 449 (7161), 468-472 (2007).
- Menashe, I., et al. Genetic elucidation of human hyperosmia to isovaleric acid. PLoS biology. 5 (11), (2007).
- Saito, H., Chi, Q., Zhuang, H., Matsunami, H., Mainland, J. D. Odor coding by a Mammalian receptor repertoire. Science signaling. 2 (60), (2009).
- Jaeger, S. R., et al. A Mendelian Trait for Olfactory Sensitivity Affects Odor Experience and Food Selection. Current Biology. 23, 1-5 (2013).
- DeMaria, S., Ngai, J. The cell biology of smell. The Journal of cell biology. 191 (3), 443-452 (2010).
- Zhang, X., Firestein, S. The olfactory receptor gene superfamily of the mouse. Nature nauroscience. 5 (2), 124-1233 (2002).
- Glusman, G., Yanai, I., Rubin, I., Lancet, D. The complete human olfactory subgenome. Genome research. 11 (5), 685-702 (2001).
- Olender, T., Lancet, D., Nebert, D. W. Update on the olfactory receptor (OR) gene superfamily. Human Genomics. 3 (1), 87 (2008).
- Mombaerts, P. Genes and ligands for odorant, vomeronasal and taste receptors. Nature reviews. Neuroscience. 5 (4), 263-278 (2004).
- Malnic, B., Hirono, J., Sato, T., Buck, L. B. Combinatorial receptor codes for odors. Cell. 96 (5), 713-723 (1999).
- Araneda, R. C., Kini, a. D., Firestein, S. The molecular receptive range of an odorant receptor. Nature. 3 (12), 1248-1255 (2000).
- Saito, H., Kubota, M., Roberts, R. W., Chi, Q., Matsunami, H. RTP family members induce functional expression of mammalian odorant receptors. Cell. 119 (5), 679-691 (2004).
- Katada, S., Hirokawa, T., Oka, Y., Suwa, M., Touhara, K. Structural basis for a broad but selective ligand spectrum of a mouse olfactory receptor: mapping the odorant-binding site. The Journal of neuroscience the official journal of the Society for Neuroscience. 25 (7), 1806-1815 (2005).
- Lu, M., Echeverri, F., Moyer, B. D. Endoplasmic Reticulum Retention, Degradation, and Aggregation of Olfactory G-Protein Coupled Receptors. Traffic. 4 (6), 416-433 (2003).
- McClintock, T. S., et al. Functional expression of olfactory-adrenergic receptor chimeras and intracellular retention of heterologously expressed olfactory receptors. Brain research. Molecular brain research. 48 (2), 270-278 (1997).
- Zhao, H. Functional Expression of a Mammalian Odorant Receptor. Science. 279 (5348), 237-242 (1998).
- Kajiya, K., Inaki, K., Tanaka, M., Haga, T., Kataoka, H., Touhara, K. Molecular bases of odor discrimination: Reconstitution of olfactory receptors that recognize overlapping sets of odorants. The Journal of neuroscience the official journal of the Society for Neuroscience. 21 (16), 6018-6025 (2001).
- Krautwurst, D., Yau, K., Reed, R. R., Hughes, H. Identification of Ligands for Olfactory Receptors. Cell. 95, 917-926 (1998).
- Li, Y. R., Matsunami, H. Activation state of the M3 muscarinic acetylcholine receptor modulates mammalian odorant receptor signaling. Science signaling. 4 (155), (2011).
- Zhuang, H., Matsunami, H. Evaluating cell-surface expression and measuring activation of mammalian odorant receptors in heterologous cells. Nature. 3 (9), 1402-1413 (2008).
- Haddad, R., Khan, R., Takahashi, Y. K., Mori, K., Harel, D., Sobel, N. A metric for odorant comparison. Nature methods. 5 (5), 425-429 (2008).
- Veithen, A., Wilkin, F., Philippeau, M., Van Osselaer, C., Chatelain, P. Olfactory Receptors: From basic science to applications in flavors and fragrances. Perfumer and Flavorist. 35 (1), 38-40 (2010).
- Bozza, T., Feinstein, P., Zheng, C., Mombaerts, P. Odorant receptor expression defines functional units in the mouse olfactory system. The Journal of neuroscience the official journal of the Society for Neuroscience. 22 (8), 3033-3043 (2002).
- Oka, Y., Katada, S., Omura, M., Suwa, M., Yoshihara, Y., Touhara, K. Odorant receptor map in the mouse olfactory bulb: in vivo sensitivity and specificity of receptor-defined glomeruli. Neuron. 52 (5), 857-869 (2006).
- Zhao, H., Ivic, L., Otaki, J. M., Hashimoto, M., Mikoshiba, K., Firestein, S. Functional expression of a mammalian odorant receptor. Science. 279 (5348), 237-242 (1998).
- Touhara, K., et al. Functional identification and reconstitution of an odorant receptor in single olfactory neurons. Proceedings of the National Academy of Sciences of the United States of America. 96 (7), 4040-4045 (1999).
- Zhuang, H., Matsunami, H. Synergism of accessory factors in functional expression of mammalian odorant receptors. The Journal of biological chemistry. 282 (20), 15284-15293 (2007).
- McRae, J. F., Mainland, J. D., Jaeger, S. R., Adipietro, K. A., Matsunami, H., Newcomb, R. D. Genetic variation in the odorant receptor OR2J3 is associated with the ability to detect the "grassy" smelling odor, cis-3-hexen-1-ol. Chemical senses. 37 (7), 585-593 (2012).
- Adipietro, K. A., Mainland, J. D., Matsunami, H. Functional evolution of mammalian odorant receptors. PLoS genetics. 8 (7), (2012).
- Zhuang, H., Chien, M. -. S., Matsunami, H. Dynamic functional evolution of an odorant receptor for sex-steroid-derived odors in primates. Proceedings of the National Academy of Sciences of the United States of America. 106 (50), 21247-21251 (2009).
- Oka, Y., Nakamura, A., Watanabe, H., Touhara, K. An odorant derivative as an antagonist for an olfactory receptor. Chemical senses. 29 (9), 815-822 (2004).
- Oka, Y., Omura, M., Kataoka, H., Touhara, K. Olfactory receptor antagonism between odorants. The EMBO journal. 23 (1), 120-126 (2004).
- Fawcett, T. An introduction to ROC analysis. Pattern Recognition Letters. 27 (8), 861-874 (2006).
- Baghaei, K. A. Olfactory Receptors. Olfactory Recept. Methods Protoc. 1003, 229-238 (2013).
- Dey, S., Zhan, S., Matsunami, H. Assaying surface expression of chemosensory receptors in heterologous cells. Journal of visualized experiments JoVE. (48), (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены