Method Article
受体激活的测量通过荧光素酶活性:哺乳动物的嗅觉受体的高通量分析
摘要
嗅觉受体的激活模式进行编码气味的身份,但缺乏公布的数据识别气味的配体哺乳动物的嗅觉受体的阻碍气味编码进行了全面的发展模式。这个协议描述了一种方法,以促进嗅觉受体的配体和受体活化的定量高通量鉴定。
摘要
创建的气味嗅觉受体激活的独特和重叠的图案,让一个家庭的约1,000名鼠和400人的受体识别数以千计的气味的。加臭剂的配体已经公布人类受体1-11少于6%。这种缺乏数据的部分原因是由于功能上的困难表达这些受体在异源系统。在这里,我们描述了用于表达大多数嗅觉受体家族中Hana3A细胞,然后用荧光素酶报告基因分析嗅觉受体活化的高通量评估的方法。此法可用于(1)屏幕对嗅觉受体面板的气味的面板; (2)通过剂量反应曲线确定气味/受体相互作用;和(3)中的受体的变体比较受体的激活水平。在我们的样本数据,328的嗅觉受体进行了筛选对26的气味。气味/受体对具有不同的反应得分均选择位泰德和剂量反应测试。这些数据表明,一个屏幕是丰富对加臭剂/受体对,将通过剂量反应实验, 即受体具有一种加臭剂善意响应的有效方法。因此,这种高通量荧光素酶测定法是表征嗅觉受体 - 一个基本朝向气味编码在哺乳动物嗅觉系统的一个模型的步骤的一种有效方法。
引言
哺乳动物嗅觉系统具有响应恶臭刺激广大,允许用于检测和数以千计的加臭剂的鉴别能力。嗅觉受体(OR值)是通过在嗅觉上皮12的嗅感觉神经元表达的分子传感器。哺乳动物的气味识别是通过激活不同的OR 通过的气味,而OR基因家族是广泛的,有大约1000小鼠和400人的受体12-16。在嗅觉神经元,并在异源细胞手术室以前的功能分析表明,不同的气味是由独特的认可,但重叠的OR 值10,17-20合奏。选配配体OR值是理解的嗅觉代码和建立嗅觉可行的模型必不可少的关键。由于表达OR值在异源系统,以及大量两者的气味和OR的困难,这一数据已经从F基本上不存在IELD;的确,人的口服补液盐少于6%已公布配体1-11。这个协议描述了使用荧光素酶测定法的表征气味/或相互作用。此法使手术室的高通量表征,任务是必不可少的理解气味/或相互作用以及发展气味编码的典范。
手术室的高通量研究面临的三大挑战。首先,表达的异源细胞的ORs被保留在ER中,并随后降解的蛋白酶体21,22,防止从OR值与在测定系统23-25 气味物质相互作用。这个问题是由辅助蛋白,以促进广泛的ORs 19,26,27的稳定的细胞表面表达的发现处理。受体转运蛋白1和2(RTP1和2)促进或响应于刺激的气味19的细胞表面表达和活化。在此基础上,将HEK293T细胞修饰以稳定表达RTP1长(RTP1L)和RTP2,受体表达增强蛋白1和Gαolf,导致Hana3A细胞系19,27。此外,3型毒蕈碱型乙酰胆碱受体(M3-R)进行交互的ORs在细胞表面,并增强活化响应于加臭剂26。共转染的或用RTP1S和M3-R的进Hana3A细胞的结果在宽范围的ORs的在细胞表面27的健壮的,一致的,和功能性表达。第二,哺乳动物或剧目都相当大。在人类中,例如,或剧目是一个数量级比味觉受体库越来越多,2个数量级比视觉受体剧目更多了的。虽然克隆一个OR是一个相对简单的协议,需要显著的前期工作,以产生一个综合库。第三,虽然我们知道,在视觉,波长转换成颜色和在试音的频率转换成沥青,气味的组织是知之甚少,使得研究人员很难从气味物质的代表性样品进行插值。虽然有些已经取得了进展在这方面10,28,嗅觉景观的地图仍然是不完整的。筛选分子数万数百对口服补液盐是一项艰巨的任务;在这一领域的高通量筛选需要仔细界定的活动。其余的主要挑战是那些后勤和成本的,而不是固有的技术问题。虽然异源筛查还没有被广泛使用的学术团体,以确定配体,一间私人公司使用同样的技术来识别配体的100人的OR 值29。不幸的是,这些数据仍然是专有的。
这里所概述的高通量荧光素酶测定具有超过用于评估或激活的替代方法的几个优点。虽然respon本地嗅感觉神经元的SES使用电和钙成像进行了测量,这些技术有困难戏弄除了这或将导致由于对嗅觉神经元反应特性的重叠神经元的反应。虽然敲在GFP-标记的受体型30,31,通过腺病毒递送的特异性受体鼠嗅觉神经元32,33,或记录后进行RT-PCR 17,24,33可以连接到记录单受体类型,这些方法低通量和不适合于大型画面。异源筛查系统更具扩展性,以及两种主要形式被发现在文学:cAMP途径记者和三磷酸肌醇(IP3)途径记者。一旦刺激气味,OR值激活A Gαolf转导信号级联导致生产环磷酸腺苷(cAMP)的12。通过共转染交流电的控制下,萤火虫荧光素酶报告基因AMP应答元件(CRE),荧光素酶的生产可测气味响应的函数,允许进行定量或激活。或激活也可通过共表达G蛋白如Gα15/16或A Gα15-OLF嵌合体24,25,34相连的IP3通路。我们选择了这里提出的测定法基于以下三个因素:(1)共表达RTP1用的Rho-标记的嗅觉受体改善嗅觉受体在细胞表面19,27的表达; (2)使用的cAMP应答报告基因可用于测量或通过规范的第二信使通路的激活;和(3)的测定是非常适合于高通量筛选。
这样的高通量荧光素酶测定法是适用于各种研究有价值的嗅觉的字段。第一,大量的ORs可以确定一个SP受体激活图案进行筛选针对单一的加臭剂ecific气味。这种类型的研究发现OR7D4作为或负责响应类固醇气味雄8。相反,一种或可以以确定的受体响应曲线图10来筛选对加臭剂的一个面板。当候选嗅气味/或通过对这些屏幕识别,相互作用可以通过进行剂量反应实验检查或对气味的浓度增加的反应得到证实。剂量响应曲线也可以评估一个或遗传变异如何影响体外加臭剂的反应8,9,11,35,和这些研究可以扩展到种间OR变化,从而对受体的进化的跨物种和因果突变的进化的检查36,37,最后,此测定法可用于筛选气味拮抗剂能够拮抗或响应于对一个已知的加臭剂/受体对38,39的特定气味。总之,这种高通量的荧光素酶测定法是适用于一系列的研究,这将有助于表征或激活模式,并提供一个更好的理解气味编码的嗅觉系统。
研究方案
Hana3A细胞1。文化
- 通过补充的最小必需培养基(MEM),用10%(V / V)FBS的制备M10介质。
- 文化维护
- 维持细胞M10的媒体。注意:对于RTP1L,RTP2,REEP1和G表达载体αolf赋予Hana3A细胞嘌呤霉素抗性,但保持了细胞的这种抗生素没有显著影响测定结果。
- 亚文化在1:8的10厘米菜每2-3天的比率。
- 在37℃,5%CO 2。
2,用于转染细胞的电镀
- 吸媒体从Hana3A细胞100%汇合10cm皿。
- 通过加入10ml PBS,涡旋盘中,并吸取PBS洗涤细胞。
- 加入3毫升0.05%胰蛋白酶/ EDTA,等待细胞解离(约1分钟)。
- 通过加入5ml M10灭活胰蛋白酶和拆散细胞团块通过捣碎大约10倍和#160;用10毫升吸管。吸管小心,以避免引入气泡进入媒体。
- 对于每个96孔板,转让1毫升细胞入15ml锥形管中,离心分离机,在200×g离心5分钟,吸出上清液,而不会干扰细胞沉淀。
- 每1ml在步骤2.5转移细胞重新悬浮于6ml M10细胞。
- 移液管加入50μl细胞到96孔板的每个孔中并孵育过夜,在37℃,5%的CO 2。
嗅觉受体3。转
- 质粒DNA的制备
- 通过无内毒素的协议制备质粒DNA。注意:使用质粒DNA制备试剂盒指定的“无内毒素”,或添加一个酚 - 氯仿提取步骤,质粒DNA制备的协议。
- 稀释的DNA至100毫微克/微升的TE缓冲液中的浓度。
- 观察接种细胞(步骤2.7),以确保近似的正确汇合tely 30-50%,每孔并返回到孵化器。注意:虽然此汇合不是最佳的脂质转染试剂,30-50%在此步骤中,汇合是最优的,用于测量荧光素酶活性24小时后转染。
- 转染混合物的制备
- 移液器RTP1S-PCI,M3-R-PCI,PCRE-LUC和PSV40-RL质粒导入MEM培养基每详述于表1中,使质粒混合物的体积(体积表示为每96 -孔板)。
质粒组合 每孔 每个96孔板 MEM - 500微升 RTP1S-PCI 5纳克 480纳克 M3-R-PCI 2.5纳克 240纳克 PCRE-LUC 10毫微克 960纳克 PSV40-RL 5纳克 480纳克
表1质粒混合元件。每井和每RTP1S-PCI,M3-R-PCI,PCRE-LUC和PSV40-RL,和MEM的96 -孔板的卷。 - 对于每个96孔板,稀释18微升脂转染试剂在450微升的MEM培养基。
- 移液器质粒组合(从步骤3.3.1)的PCI质粒(RHO-OR-PCI)视紫红质标记的嗅觉受体和脂质转染混合物(从步骤3.3.2),使在复杂细节表2。混合溶液通过研磨和在室温下孵育15分钟。停止反应,根据表2中加入M10请注意:该反应中是对时间敏感的,不应该被允许继续进行30分钟以上。井+ 10%的计算是非常重要的,以确保足够的容积用于随后的步骤。
复杂 每孔 每孔+10% 质粒组合 4.2微升 4.58微升 ρ-OR-PCI 0.05纳克 0.06纳克 脂质转染混合物 4.2微升 4.58微升 M10 41.7微升 45.83微升
表2。复杂的组件。每口井,每个质粒组合( 表1)以及±10%体积,嗅觉受体质粒(RHO-OR-PCI)和脂质转染混合物。 M10被加入以淬灭下列一个15分钟温育在室温下进行反应。
- 移液器RTP1S-PCI,M3-R-PCI,PCRE-LUC和PSV40-RL质粒导入MEM培养基每详述于表1中,使质粒混合物的体积(体积表示为每96 -孔板)。
- 挖掘出的电池板媒体。
- 移液管加入50μl的复合物至每孔中,并孵育过夜,在37℃,5%的CO 2。
4,气味刺激
- 观察转染细胞,以确保每孔50-80%正确的汇合,并返回到培养箱中。注意:如果电池是低于50%汇合,萤火虫荧光素酶和海肾荧光素酶的读数可能会太低,受体激活的测量。考虑放弃平板。
- 准备1个月股票的解决方案在DMSO每个气味。
- 准备在CD293中型刺激气味的解决方案。
- 用于筛选实验中,稀释气味的储备液至100μM的。还(仅CD293),以控制或激活后台准备一个没有气味控制。注:对于筛选实验,每个OR /气味对只每一次实验测试。因为整个井某些气味扩散是可能的,所以建议以刺激与一种加臭剂对每个板。
- 对于剂量响应实验,制备的气味原液,一式三份开始以1mM每种受体7 10倍连续稀释。还准备一式三份空载体转染细胞相同的气味稀释液,以控制气味的背景激活。注:对于剂量反应实验中,每个Ø多尔浓度治疗应一式三份进行。
- 挖掘出的电池板媒体。
- 移液管将25μl的刺激气味液到每个孔中并孵育4小时。
5,测量或活动通过萤光素酶检测
- 根据制造商的在-80℃下的指令和存储重悬萤火虫荧光素酶底物
- 解冻1毫升萤火虫荧光素酶底物的每个96孔板中。
- 准备新鲜的萤火虫荧光素酶反应淬灭剂和海肾萤光素酶底物试剂(5微升淬灭剂荧光素酶/ 海肾萤光素酶每1 ml缓冲液底物)。注:约1毫升试剂是需要每96孔板。
- 准备发光酶标仪。打开酶标仪软件。系统内的图标:
- 在“预热”选项卡,勾选为“ON”的框中,然后设定机器的温度为25°; C。
- 下的“分配器”标签中,首要每个分配器有1,000微升70%乙醇,随后由1,000微升蒸馏水。注意:使用醇与水的分离等份的每个分配器。乙醇是用来消毒的分配器,和水去除残留的乙醇。
- 首相每个饮水机与1500微升空气(从液体中移除掌柜)。注:与空气吸确保荧光素酶底物不与残留水稀释。
- 总理饮水机1与1,080微升萤火虫荧光素酶底物(从步骤5.2)中。素分配器2与海肾荧光素酶底物(来自步骤5.3)。注意:注意不要交叉污染的荧光素酶的底物。用荧光素酶底物吸填补了试剂掌柜的死角。
- 设置以下协议来读取这两种萤火虫和海肾萤光素酶发光。内用酶标仪,取消相关的软件DER“文件”菜单中,单击“新任务”。突出显示“协议”,然后单击“新建”。在接下来的窗口,旁边的“标准协议”圆应选择。单击“确定”。在屏幕的左侧双击“程序”。
- 将10μL萤火虫荧光素酶底物的利用分配器1的所有油井。在“操作”菜单上,单击“配给”。在“分装步”窗口中,设置:“饮水机”1,“灌注”到无“,分配容量”,以10微升和“速度”,以225微升/秒。点击“确定”。
- 摇板30秒。在“操作”菜单上,单击“摇”。在“步摇”窗口中,将“强度”,以中和“持续时间”到0时30 MM:SS。点击“确定”。
- 阅读所有孔的每孔0.5秒的发光。在“操作”菜单上,单击“读取”;。在“阅读步骤”窗口中,设置:“检测方法”来发光,“读类型”设置为端点,“积分时间”,以零时00分50秒MM:SS:SS,“过滤设置”设为1,“排放”以孔,“光学位置”上面,“增益”到135,和“读取高度”为1.00毫米。点击“确定”。
- 将10微升海肾萤光素酶底物的利用分配器2的所有油井。设置条 件,如步骤5.6.1,集“饮水机”,以2的除外。
- 摇板30秒。设定的条件,如步骤5.6.2。
- 阅读所有孔0.5秒的发光每口井。设定的条件,如步骤5.6.3。
- 从96孔板中除去盖子,然后将板在微量板读数器。启动程序设置步骤5.5读板发光。
- 清洁剂分配器泵。从“饮水机”选项卡下的系统图标:
- 清除1,000微升的f从萤火虫荧光素酶分配器到回收管irefly荧光素酶底物。注:萤火虫荧光素酶可以储存在-80℃并重复使用。
- 素每个分配器有1000微升的蒸馏水,接着1,000微升70%的乙醇,最后1500微升的空气(从液体移除分配器)。注:去除水中的荧光素酶底物的试剂泵,乙醇消毒杀菌,空气干燥残留的乙醇。
6,数据分析
- 数据导出
- 在酶标仪软件,双击屏幕左侧的“报告/导出建设者”。
- 点击按钮“新建导出到Excel”,然后单击“确定”。
- 突出EXPORT1并单击“编辑”。
- 在“内容”检查“系统说明”,“程序”,“盘说明”和“反应板布局矩阵”。包括“原始数据”一ND“计算数据”。
- 在“工作流”,勾选“自动执行的程序的完成”。在导出模式,勾选“在同一工作簿中的所有板”和“作为一个新的工作表”。
- 在“文件”选择文件名格式和文件位置,然后单击“确定”。
- 关闭“报告/导出建设者”窗口。
- 为了得到归一化的荧光素酶值,由海肾荧光读数为每口井(步骤5.6.6)将萤火虫荧光素酶发光读数每口井(步骤5.6.3)。
结果
一个主屏幕测试328对手术室26气味在100μm的浓度。这种气味浓度已被证明有效激活OR值与已知配体10的相当大的比例。首先,标准化的荧光素酶活性计算方式为将萤火虫荧光素酶的阅读由海肾萤光素酶的阅读。接着,基线值的计算中减去归一化的荧光素酶的读数用于从归一化的荧光素酶的读数没有气味控制每个孔( 图1)。剂量反应曲线上48加臭剂进行与/或对随机分布在基线值的范围,由图1中的彩色条所指示的。OR值分别与7个浓度的加臭剂跨越1纳米至1毫米的处理,并将得到的反应是合适使用非线性回归一个S形曲线。一种气味/或被认为是一种兴奋剂,如果它满足三个标准:(1)标准误差该logEC 50小于1日志单元; (2)在95%置信区间为曲线的顶部和底部的参数没有重叠;及(3)款项 - 的平方额外的测试证实,气味激活了含或细胞显著多于对照细胞,转染空载体。剂量反应结果归纳于表3中 。
这些数据被用来确定在一个主屏幕测定法测量如何很好地预测从剂量反应曲线的结果。在图1中蓝色条对应于被列为全剂量反应实验激动剂,同时红柱没有达到我们上述三个标准对。从主屏幕值预测(受试者工作特征曲线(AUC)下面积= 0.68,P <0.01,采用Mann-Whitney U检验)从全剂量反应实验结果,表明我们的主要屏幕是一个有用的方法以富集的加臭剂与/或对将在一个完整的剂量反应实验( 图2)被划分为激动剂。
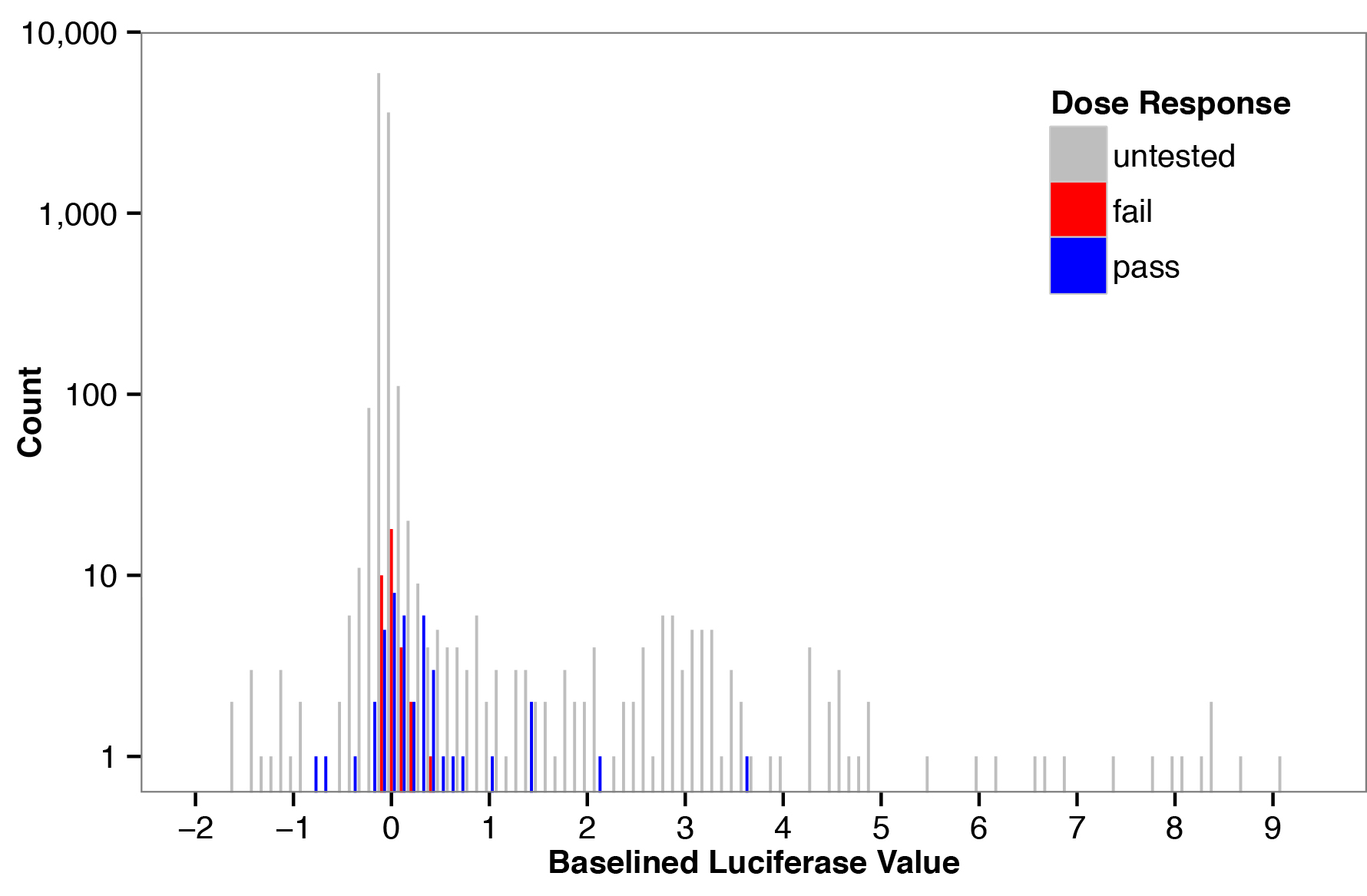
图1。频率与嗅觉受体和气味分子的频率计算每个气味/或对在主屏幕基线荧光素酶值的直方图 (计数) 的面板屏幕基线荧光素酶值 。作为臭气物/受体的激活对稀疏,多数值被集中在零和大型中央分布估计用于该测定的噪声分布。色条表示选择的剂量反应分析气味/受体对;蓝色条是被列为基础上,充分剂量反应激动剂,红酒吧是不列为激动剂对对。F =“https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/51640/51640fig1highres.jpg”目标=“_blank”>点击这里查看大图。
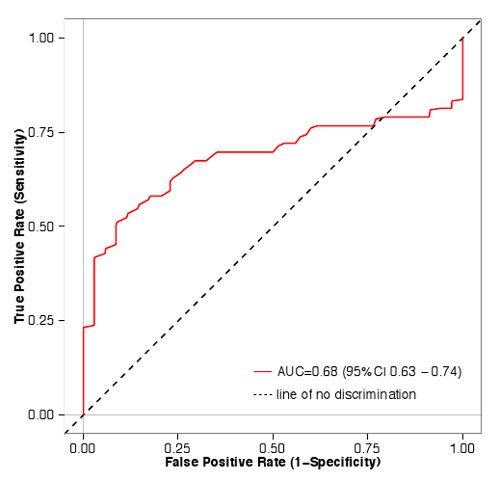
图2 ROC曲线的气味/受体的画面。48气味/受体对被归类为激动剂或不被激动剂。真阳性率(灵敏度),然后暗算使用R统计包40的假阳性率(1 -特异性)。在曲线(AUC)下面积为0.68,这表明气味/受体对具有较高的荧光素酶的屏幕值更可能通过比那些低价值的剂量反应。 点击这里查看大图。
| 基线值 | 剂量响应 |
| 0.051793067 | 失败 |
| 0.006376956 | 失败 |
| 0.331936398 | 通过 |
| 0.591006519 | 通过 |
| 0.049093369 | 通过 |
| 0.396788976 | 通过 |
| -0.013655743 | 通过 |
| 0.011080217 | 通过 |
| 0.004203349 | 失败 |
| 0.003975049 | 失败 |
| -0.077935718 | 通过 |
| -0.084488317 | 通过 |
| 0.030236078 | 失败 |
| -0.042963576 | 失败 |
| 0.031466406 | 失败 |
| 0.025897747 | 失败 |
| -0.030434651 | 失败 |
| -0.004122795 | 失败 |
| -0.010075533 | 失败 |
| 0.028883452 | 失败 |
| 0.019402373 | 失败 |
| 0.047508749 | 失败 |
| 0.00255344 | 失败 |
| 0.017221449 | 失败 |
| 0.340216655 | 通过 |
| -0.026912181 | 失败 |
| 0.037140428 | 失败 |
| 0.467763017 | 通过 |
| 0.097665337 | 失败 |
| 0.080657267 | 通过 |
| 0.172819211 | 通过 |
| 0.05568393 | 通过 |
| -0.106721064 | 通过 |
| 0.136614849 | 通过 |
| 0.457839849 | 失败 |
| 0.211751741 | 失败 |
| 0.1581464 | 通过 |
| -0.62099155 | 通过 |
| -0.066949491 | 通过 |
| -0.78712035 | 通过 |
| 0.752503007 | 通过 |
| 1.433407558 | 通过 |
| 0.475431098 | 通过 |
| 1.457936815 | 通过 |
| 0.048652537 | 失败 |
| 0.027196782 | 失败 |
| 0.129599842 | 失败 |
| -0.069781272 | 失败 |
| 0.016450039 | 失败 |
| -0.025639207 | 失败 |
| 0.158152141 | 失败 |
| -0.032570055 | 失败 |
| 0.140139926 | 失败 |
| -0.052030276 | 失败 |
| 0.657140133 | 通过 |
| 1.040410297 | 通过 |
| 通过 | |
| 0.399588712 | 通过 |
| 0.188094387 | 通过 |
| 0.039371424 | 通过 |
| 0.016784352 | 通过 |
| 0.229959571 | 通过 |
| 0.238381997 | 失败 |
| 0.074118909 | 失败 |
| 0.423901128 | 通过 |
| 0.152621022 | 通过 |
| 通过 | |
| 0.075301806 | 通过 |
| 0.395233972 | 通过 |
| 0.261892958 | 通过 |
| 0.156693306 | 失败 |
| 2.163418147 | 通过 |
| 3.649862104 | 通过 |
| 0.025716169 | 通过 |
| -0.033258008 | 通过 |
| -0.026984127 | 失败 |
| -0.338441868 | 通过 |
| 0.37398618 | 通过 |
在剂量反应测试表3。嗅觉受体/气味对。基线荧光素酶值和剂量反应结果(通过或失败)为48或/气味对从屏幕上选择。对于30对屏幕测试了两次,都包含两个基线荧光素酶值。
讨论
气味识别是通过嗅觉受体激活模式编码,但受体的激活模式,包括受体被激活到什么程度,被称为人类的嗅觉受体1-11少于6%。努力来表征嗅觉受体已经由劳动密集型方法或适用性不限于嗅觉受体家族17,23,24,33,34的一个子集。该Hana3A异源表达系统支持大多数测试嗅觉受体的鲁棒表达,并且可以在同一个的cAMP响应性荧光素酶报告系统,以监测嗅觉受体活化19,26,27一起使用。该测定在96孔格式的性能支持大量的高通量的实验设计,包括屏幕,以确定可能的候选对加臭剂/嗅觉受体对与剂量 - 反应曲线,以确认交互和评估受体活化水平是如何自动对焦由内和种间变异染病。加臭剂/受体对与在画面更高的活性值更可能表现出显著剂量响应。这些数据表明,该筛选方法是能够以富集的加臭剂/受体对,将通过剂量反应,从而有利于加臭剂的配体和嗅觉受体激活模式的识别。
此法对嗅觉受体分析而优化的成功取决于几个因素。所有质粒DNA必须通过一个无内毒素的协议来制备。在细胞表面一致的嗅觉受体的表达是至关重要的。该Hana3A细胞系稳定表达一些辅助蛋白中或表达式援助,但共转染RTP1S和M3-R的增强受体的表达和活化,分 别为27。辅助蛋白表达的组合导致最嗅觉受体的可靠表达,从而使试比较n个或中间试验和受体的激活。此外,监测细胞汇合的是用于获得一致的结果很重要。假设细胞在原始10cm 2的培养皿大致100%汇合时,下面的本文中所述的协议将导致可靠的细胞汇合整个实验。重要的是,充足的电池将被镀以获得一个可衡量的荧光素酶的阅读,但细胞不会被过度增长,这可能会影响受体激活以下气味刺激的条件。归为组成型表达Renilla荧光进一步的控制,不仅对细胞密度,而且对转染效率。一个海肾萤光素酶阅读超过2.5个标准差低于平均值可能表明细胞的损失。细胞应被均匀地镀以避免致密斑的分离更容易地从板面较稀疏的细胞,和转染与加臭剂溶液应轻轻地加入到孔的一侧,以避免分离大公LS。信元丢失也可能是由于由加臭剂的毒性,可以通过降低加臭剂浓度,或过量的DMSO,这可避免保持DMSO的浓度低于0.5%被规避问题的细胞死亡。最后,用1μM的毛喉素,一种腺苷酸环化酶激活剂引起的荧光素酶报告基因表达的cAMP的反应性启动子,将每个受体表达的细胞群,可以作为阳性对照用于测定。
虽然本文所描述的测定法代表一种改进的替代方法,包括高通量形式,更普遍的适用性的哺乳动物嗅觉受体家族,它具有局限性。首先,我们的体外测定缺乏体内嗅觉系统,包括气味结合蛋白,粘膜层,细胞内分子和嗅探行为的许多组件。第二,这种方法依赖于荧光素酶报告系统来测量嗅觉受体活化在对比,利用钙成像常见的替代方法。最近的研究表明,这两种方法都可以产生相互矛盾的结果;的确,一些嗅觉受体对特定的加臭剂反应时通过钙成像,但不能荧光素酶检测41检测。无论是一个实验型较为相关,人的嗅觉感知的研究仍不清楚,但根据上下文和受体型这两种方法可能是有用的。第三,尽管本功能表达系统已成功用于表达的大多数测试哺乳动物嗅觉受体,一些OR值可能不适合于使用该系统的表达。如果以前未知受体未能为一种气味响应,这可能是由于缺乏表达在细胞表面,而不是缺乏臭气物质和受体之间的相互作用。受体细胞表面表达可以通过免疫荧光由负法得出结论之前,检查结果27,42 。最后,由于无异味条件下低背景荧光素酶活性,我们的分析是不是设计用于检测抑制性反应。以确定气味拮抗剂嗅觉受体38,39,大多数受体必须首先用一个气味,以便观察在荧光素酶活性的降低刺激。
尽管有这些限制,该测定系统具有大大提高数据采集的嗅觉的字段的能力。首先,高通量的96孔格式使得大规模受体和/或气味的屏幕是可行的。第二,它的异源表达系统适用于多种哺乳动物的嗅觉受体。第三,荧光素酶活性,可用于测量嗅觉受体活化,这是在描述受体活化型态的特定气味有价值。第四,从类似的体外检测系统以前的结果预测人类的嗅觉感知8,11,35。这些特征是particularly重要的,因为哺乳动物的嗅觉受体家族的大尺寸和我们对特定的气味引起的或激活模式的知识有限。对于嗅觉受体分析优化这个检测系统的广泛应用将有助于嗅觉受体/气味的相互作用和气味编码的分子基础的一个更全面的了解。
披露声明
作者什么都没有透露。
致谢
这项工作是由R01 DC013339,R03 DC011373,和露丝属Kirschstein国家研究服务奖T32 DC000014支持。使用莫耐尔化学感受受体信号的核心,这是支持,部分由美国国立卫生研究院,NIDCD核心格兰特P30 DC011735资金进行的工作的一部分。作者感谢C. Sezille的帮助,收集数据。
材料
| Name | Company | Catalog Number | Comments |
| Hana3A cells | Avaiable from the Matsunami Laboratory upon request | ||
| RTP1S-pCI | Avaiable from the Matsunami Laboratory upon request | ||
| M3-R-pCI | Avaiable from the Matsunami Laboratory upon request | ||
| pCRE-luc | Agilent | 219076 | LUC |
| pSV40-RL | Promega | E2231 | RL |
| Minimum Essential Media, Eagle | Sigma Aldrich | M4655 | MEM |
| FBS | Life Technologies | 16000-044 | FBS |
| PBS (without Ca2+ and Mg2+) | Cellgro | 21-040-CV | PBS |
| Trypsin (0.05% Trypsin EDTA) | Life Technologies | 25300 | Trypsin |
| CD293 | Life Technologies | 11913-019 | CD293 |
| 96-well PDL white/clear plate | BD BioCoat | 356693 | plates |
| Lipid transfection reagent: Lipofectamine 2000 | Life Technologies | 11668-019 | Lipofectamine |
| Firefly luciferase substrate, firefly luciferase quencher/Renilla luciferase substrate: Dual-Glo Assay | Promega | E2980 | dual glo |
| Synergy S2 | BioTek | SLAD | BioTek S2 |
| Microplate reader software: Gen5 Data Analysis Software | BioTek | Gen5 | Gen5 |
| BIOSTACK | BioTek | BIOSTACK2WR | BioStack |
| Multiflo | BioTek | MFP | MultiFlo |
| 300 μl GripTips | Integra | 4433 | GripTips |
| 12.5 μl GripTips | Integra | 4414 | GripTips |
| 300 μl GripTips ViaFlo96 | Integra | 6433 | XYZ tips |
| 12.5 μl GripTips 384 XYZ | Integra | 6403 | XYZ tips |
| 384ViaFlo | Integra | 6030 | 384ViaFlo |
| TE buffer | Macherey Nagel | 740797.1 | |
| DMSO | Sigma Aldrich | D2650-100ML | DMSO |
| Forskolin | Enzo Life Sciences | BML-CN100-0010 | FOR |
参考文献
- Wetzel, C. H., Oles, M., Wellerdieck, C., Kuczkowiak, M., Gisselmann, G., Hatt, H. Specificity and sensitivity of a human olfactory receptor functionally expressed in human embryonic kidney 293 cells and Xenopus Laevis oocytes. The Journal of neuroscience the official journal of the Society for Neuroscience. 19 (17), 7426-7433 (1999).
- Spehr, M., et al. Identification of a testicular odorant receptor mediating human sperm chemotaxis. Science. 299 (5615), 2054-2058 (2003).
- Sanz, G., Schlegel, C., Pernollet, J. -C., Briand, L. Comparison of odorant specificity of two human olfactory receptors from different phylogenetic classes and evidence for antagonism. Chemical senses. 30 (1), 69-80 (2005).
- Matarazzo, V., et al. Functional characterization of two human olfactory receptors expressed in the baculovirus Sf9 insect cell system. Chemical senses. 30 (3), 195-207 (2005).
- Jacquier, V., Pick, H., Vogel, H. Characterization of an extended receptive ligand repertoire of the human olfactory receptor OR17-40 comprising structurally related compounds. Journal of neurochemistry. 97 (2), 537-544 (2006).
- Neuhaus, E. M., Mashukova, A., Zhang, W., Barbour, J., Hatt, H. A specific heat shock protein enhances the expression of mammalian olfactory receptor proteins. Chemical senses. 31 (5), 445-452 (2006).
- Shirokova, E., et al. Identification of specific ligands for orphan olfactory receptors. G protein-dependent agonism and antagonism of odorants. The Journal of biological chemistry. 280 (12), 11807-11815 (2005).
- Keller, A., Zhuang, H., Chi, Q., Vosshall, L. B., Matsunami, H. Genetic variation in a human odorant receptor alters odour perception. Nature. 449 (7161), 468-472 (2007).
- Menashe, I., et al. Genetic elucidation of human hyperosmia to isovaleric acid. PLoS biology. 5 (11), (2007).
- Saito, H., Chi, Q., Zhuang, H., Matsunami, H., Mainland, J. D. Odor coding by a Mammalian receptor repertoire. Science signaling. 2 (60), (2009).
- Jaeger, S. R., et al. A Mendelian Trait for Olfactory Sensitivity Affects Odor Experience and Food Selection. Current Biology. 23, 1-5 (2013).
- DeMaria, S., Ngai, J. The cell biology of smell. The Journal of cell biology. 191 (3), 443-452 (2010).
- Zhang, X., Firestein, S. The olfactory receptor gene superfamily of the mouse. Nature nauroscience. 5 (2), 124-1233 (2002).
- Glusman, G., Yanai, I., Rubin, I., Lancet, D. The complete human olfactory subgenome. Genome research. 11 (5), 685-702 (2001).
- Olender, T., Lancet, D., Nebert, D. W. Update on the olfactory receptor (OR) gene superfamily. Human Genomics. 3 (1), 87(2008).
- Mombaerts, P. Genes and ligands for odorant, vomeronasal and taste receptors. Nature reviews. Neuroscience. 5 (4), 263-278 (2004).
- Malnic, B., Hirono, J., Sato, T., Buck, L. B. Combinatorial receptor codes for odors. Cell. 96 (5), 713-723 (1999).
- Araneda, R. C., Kini, aD., Firestein, S. The molecular receptive range of an odorant receptor. Nature. 3 (12), 1248-1255 (2000).
- Saito, H., Kubota, M., Roberts, R. W., Chi, Q., Matsunami, H. RTP family members induce functional expression of mammalian odorant receptors. Cell. 119 (5), 679-691 (2004).
- Katada, S., Hirokawa, T., Oka, Y., Suwa, M., Touhara, K. Structural basis for a broad but selective ligand spectrum of a mouse olfactory receptor: mapping the odorant-binding site. The Journal of neuroscience the official journal of the Society for Neuroscience. 25 (7), 1806-1815 (2005).
- Lu, M., Echeverri, F., Moyer, B. D. Endoplasmic Reticulum Retention, Degradation, and Aggregation of Olfactory G-Protein Coupled Receptors. Traffic. 4 (6), 416-433 (2003).
- McClintock, T. S., et al. Functional expression of olfactory-adrenergic receptor chimeras and intracellular retention of heterologously expressed olfactory receptors. Brain research. Molecular brain research. 48 (2), 270-278 (1997).
- Zhao, H. Functional Expression of a Mammalian Odorant Receptor. Science. 279 (5348), 237-242 (1998).
- Kajiya, K., Inaki, K., Tanaka, M., Haga, T., Kataoka, H., Touhara, K. Molecular bases of odor discrimination: Reconstitution of olfactory receptors that recognize overlapping sets of odorants. The Journal of neuroscience the official journal of the Society for Neuroscience. 21 (16), 6018-6025 (2001).
- Krautwurst, D., Yau, K., Reed, R. R., Hughes, H. Identification of Ligands for Olfactory Receptors. Cell. 95, 917-926 (1998).
- Li, Y. R., Matsunami, H. Activation state of the M3 muscarinic acetylcholine receptor modulates mammalian odorant receptor signaling. Science signaling. 4 (155), (2011).
- Zhuang, H., Matsunami, H. Evaluating cell-surface expression and measuring activation of mammalian odorant receptors in heterologous cells. Nature. 3 (9), 1402-1413 (2008).
- Haddad, R., Khan, R., Takahashi, Y. K., Mori, K., Harel, D., Sobel, N. A metric for odorant comparison. Nature methods. 5 (5), 425-429 (2008).
- Veithen, A., Wilkin, F., Philippeau, M., Van Osselaer, C., Chatelain, P. Olfactory Receptors: From basic science to applications in flavors and fragrances. Perfumer and Flavorist. 35 (1), 38-40 (2010).
- Bozza, T., Feinstein, P., Zheng, C., Mombaerts, P. Odorant receptor expression defines functional units in the mouse olfactory system. The Journal of neuroscience the official journal of the Society for Neuroscience. 22 (8), 3033-3043 (2002).
- Oka, Y., Katada, S., Omura, M., Suwa, M., Yoshihara, Y., Touhara, K. Odorant receptor map in the mouse olfactory bulb: in vivo sensitivity and specificity of receptor-defined glomeruli. Neuron. 52 (5), 857-869 (2006).
- Zhao, H., Ivic, L., Otaki, J. M., Hashimoto, M., Mikoshiba, K., Firestein, S. Functional expression of a mammalian odorant receptor. Science. 279 (5348), 237-242 (1998).
- Touhara, K., et al. Functional identification and reconstitution of an odorant receptor in single olfactory neurons. Proceedings of the National Academy of Sciences of the United States of America. 96 (7), 4040-4045 (1999).
- Zhuang, H., Matsunami, H. Synergism of accessory factors in functional expression of mammalian odorant receptors. The Journal of biological chemistry. 282 (20), 15284-15293 (2007).
- McRae, J. F., Mainland, J. D., Jaeger, S. R., Adipietro, K. A., Matsunami, H., Newcomb, R. D. Genetic variation in the odorant receptor OR2J3 is associated with the ability to detect the "grassy" smelling odor, cis-3-hexen-1-ol. Chemical senses. 37 (7), 585-593 (2012).
- Adipietro, K. A., Mainland, J. D., Matsunami, H. Functional evolution of mammalian odorant receptors. PLoS genetics. 8 (7), (2012).
- Zhuang, H., Chien, M. -S., Matsunami, H. Dynamic functional evolution of an odorant receptor for sex-steroid-derived odors in primates. Proceedings of the National Academy of Sciences of the United States of America. 106 (50), 21247-21251 (2009).
- Oka, Y., Nakamura, A., Watanabe, H., Touhara, K. An odorant derivative as an antagonist for an olfactory receptor. Chemical senses. 29 (9), 815-822 (2004).
- Oka, Y., Omura, M., Kataoka, H., Touhara, K. Olfactory receptor antagonism between odorants. The EMBO journal. 23 (1), 120-126 (2004).
- Fawcett, T. An introduction to ROC analysis. Pattern Recognition Letters. 27 (8), 861-874 (2006).
- Baghaei, K. A. Olfactory Receptors. Olfactory Recept. Methods Protoc. 1003, 229-238 (2013).
- Dey, S., Zhan, S., Matsunami, H. Assaying surface expression of chemosensory receptors in heterologous cells. Journal of visualized experiments JoVE. (48), (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。