Method Article
Análisis de alto rendimiento de los mamíferos receptores olfativos: Medición de la activación del receptor a través de actividad luciferasa
En este artículo
Resumen
Los patrones de activación de receptores olfativos codifican identidad olor, pero la falta de datos publicados identificar ligandos de olor para los receptores olfativos de mamíferos dificulta el desarrollo de un modelo integral de olor de codificación. Este protocolo describe un método para facilitar la identificación de alto rendimiento de ligandos de receptores olfativos y cuantificación de la activación del receptor.
Resumen
Odorantes crear patrones únicos y solapados de la activación del receptor olfativo, lo que permite una familia de aproximadamente 1.000 murino y 400 receptores humanos de reconocer miles de sustancias odoríferas. Ligandos odorizantes se han publicado para menos de 6% de los receptores humanos 1-11. Esta falta de datos se debe en parte a las dificultades que expresan funcionalmente estos receptores en sistemas heterólogos. Aquí, se describe un método para la expresión de la mayoría de la familia del receptor olfativo en las células Hana3A, seguido de evaluación de alto rendimiento de la activación del receptor olfativo usando un ensayo de indicador de luciferasa. Este ensayo se puede utilizar para (1) paneles de la pantalla de odorantes contra paneles de receptores olfativos; (2) confirmar la interacción odorante / receptor a través de las curvas de dosis-respuesta; y (3) comparar los niveles de activación del receptor entre variantes del receptor. En nuestros datos de la muestra, 328 receptores olfativos se proyectaron contra 26 odorantes. Pares Odorante / receptor con puntuaciones de las respuestas fueron variadas selecciónTed y probado en respuesta a la dosis. Estos datos indican que una pantalla es un método eficaz para enriquecer para los pares de odorante / receptor que pasarán un experimento de respuesta a la dosis, es decir, los receptores que tienen una respuesta de buena fe a un odorante. Por lo tanto, este ensayo de luciferasa de alto rendimiento es un método eficaz para caracterizar los receptores olfativos-un paso esencial hacia un modelo de olor de codificación en el sistema olfativo de los mamíferos.
Introducción
El sistema olfativo de los mamíferos tiene la capacidad de responder a un gran número de estímulos olorosos, lo que permite la detección y la discriminación de miles de sustancias odoríferas. Los receptores olfativos (OR) son los sensores moleculares expresadas por las neuronas sensoriales olfativas en el epitelio olfatorio 12. Mamíferos reconocimiento de olores se produce a través de la activación diferencial de las RUP por olores, y la familia de genes OR es extensa, con aproximadamente 1.000 murino y 400 receptores humanos 12-16. Análisis funcionales anteriores de RUP en las neuronas olfativas y en células heterólogas han demostrado que distintas sustancias odoríferas son reconocidos por único, pero los conjuntos de las RUP 10,17-20 superpuestas. Coincidencia de ligandos para las RUP es fundamental para entender el código olfativo y esencial para la construcción de modelos viables de la olfacción. Debido a las dificultades que expresan RUP en sistemas heterólogos, así como el gran número de ambos odorantes y OR, estos datos ha sido en gran parte ausente de la field; de hecho, menos del 6% de los humanos RUP tienen un ligando publicada 1-11. Este protocolo describe el uso de un ensayo de luciferasa para caracterizar odorantes / o interacciones. Este ensayo permite la caracterización de alto rendimiento de las RUP, una tarea que es esencial para entender odorante / o interacciones, así como el desarrollo de un modelo de codificación de olores.
Estudios de alto rendimiento de las RUP se enfrentan a tres grandes retos. En primer lugar, RUP expresados en células heterólogas se mantuvieron en la sala de emergencia y posteriormente degradados en el proteasoma 21,22, la prevención de las RUP de la interacción con los odorantes en el sistema de ensayo de 23-25. Este problema fue abordado por el descubrimiento de proteínas accesorias que facilitan la expresión estable de la superficie celular de una amplia gama de RUP 19,26,27. Receptor-transportador de proteínas 1 y 2 (RTP 1 y 2) promover o expresión de la superficie celular y la activación en respuesta a la estimulación olor 19. Basándose en este trabajo, las células HEK293T fueronmodificado para expresar de forma estable a largo RTP 1 (RTP1L) y RTP 2, la expresión de proteína para mejorar el receptor de 1, y G αolf, lo que resulta en la línea celular Hana3A 19,27. Además, el tipo 3 del receptor de acetilcolina muscarínico (M3-R) interactúa con RUP en la superficie celular y aumenta la activación en respuesta a odorantes 26. La co-transfección de un OR con RTP1S y M3-R en Hana3A células da como resultado la expresión robusta, coherente, y funcional de una amplia gama de SRO en la superficie de la célula 27. En segundo lugar, los mamíferos O repertorios son bastante grandes. En los seres humanos, por ejemplo, el repertorio O es un orden de magnitud más numerosos que el repertorio de receptores gustativos, y 2 órdenes de magnitud más numerosos que el repertorio de receptores visual. Aunque la clonación de una sola O es un protocolo relativamente sencillo, se requiere un esfuerzo significativo por adelantado para generar una completa biblioteca. En tercer lugar, aunque sabemos que en la visión, la longitud de onda se traduce en color yen la frecuencia de la audición se traduce en el tono, la organización de los olores es poco conocida, por lo que es difícil para los investigadores interpolan a partir de una muestra representativa de los odorantes. Aunque se han hecho algunos progresos en este frente 10,28, el mapa del paisaje olfativo sigue siendo incompleta. La evaluación de decenas de miles de moléculas en contra de cientos de las RUP es una tarea de enormes proporciones; pantallas de alto rendimiento en este ámbito requieren campañas cuidadosamente definidas. Los principales retos que quedan son las de logística y costo en lugar de los problemas inherentes a la técnica. Aunque selección heteróloga no ha sido ampliamente utilizada para identificar ligandos por grupos académicos, una empresa privada ha usado la misma técnica para identificar ligandos para 100 humanos RUP 29. Desafortunadamente, estos datos siguen siendo propietaria.
El ensayo de luciferasa de alto rendimiento descrito aquí tiene varias ventajas sobre los métodos alternativos utilizados para evaluar o activación. Aunque la responses de las neuronas sensoriales olfativas nativas se han medido utilizando electrofisiología y de imágenes de calcio, estas técnicas tienen dificultades bromas aparte que O conduce a la respuesta de una neurona debido a la superposición de propiedades de respuesta de las neuronas olfativas. Aunque golpear-en un tipo de receptor de GFP marcada con 30,31, la entrega de receptores específicos a través de adenovirus a murino neuronas olfativas 32,33, o la realización de la RT-PCR después de grabaciones 17,24,33 puede ligarse grabaciones a tipos de receptores individuales, estos métodos son bajo rendimiento y no es adecuado para pantallas de gran escala. Sistemas de detección heterólogos son más escalables, y dos formas principales se encuentran en la literatura: los reporteros de la vía cAMP y el inositol trifosfato (IP3) de los reporteros de la vía. Al olor estimulación, RUP activan una cascada de señalización T transducción αolf que resulta en la producción de AMP cíclico (AMPc) 12. Por co-transfección de un gen reportero de luciferasa de luciérnaga bajo el control de ACElemento de respuesta a AMP (CRE), la producción de luciferasa se puede medir como una función de la respuesta de olor, lo que permite la cuantificación de o activación. O de activación también puede vincularse a la vía IP3 por la co-expresión de las proteínas G como G α15/16 o un G-α15 olf quimera 24,25,34. Hemos elegido el ensayo que aquí se presenta sobre la base de tres factores: (1) la co-expresión de RTP1 con receptores olfativos etiquetados-Rho mejora la expresión de los receptores olfativos en la superficie celular 19,27; (2) uso de un gen reportero-AMPc de respuesta permite la medición de la o activación a través de la ruta del segundo mensajero canónica; y (3) el ensayo se adapta bien a las pantallas de alto rendimiento.
Este ensayo de luciferasa de alto rendimiento es aplicable a una variedad de estudios valiosos en el campo del olfato. En primer lugar, un gran número de RUP puede cribarse contra un único odorante con el fin de determinar el patrón de activación del receptor para un SPodorante ecific. Este tipo de estudio identificó OR7D4 como el OR responsable de responder a la androstenona odorante esteroide 8. Por el contrario, uno o se pueden cribar contra un panel de olores con el fin de determinar el perfil de la respuesta del receptor 10. Cuando el candidato olfativa odorante / o pares se identifican a través de estas pantallas, la interacción se puede confirmar mediante la realización de un experimento de respuesta a la dosis de examinar la respuesta de la O a concentraciones crecientes de odorante. Curvas de respuesta a la dosis también pueden evaluar cómo la variación genética en una OR afecta en respuesta odorante vitro 8,9,11,35, y estos estudios pueden ampliarse a interespecíficos o variación, lo que permite el examen de la evolución del receptor a través de especies y mutaciones causales en la evolución 36,37, Por último, este ensayo puede ser utilizado para seleccionar antagonistas de olor que son capaces de antagonizar o respuesta a un odorante particular para un par odorante / receptor conocido 38,39. En resumen, este altoEnsayo de luciferasa rendimiento es aplicable a una gama de estudios que ayudarán a caracterizar o patrones de activación y proporcionar una mejor comprensión de olor de codificación en el sistema olfativo.
Protocolo
1. Cultivo de células Hana3A
- Preparar los medios de comunicación de M10 completándolo medio esencial mínimo (MEM) con 10% (v / v) de FBS.
- Mantenimiento Cultura
- Mantener las células en medios de M10. NOTA: Los vectores de expresión para RTP1L, RTP2, REEP1, y G αolf confieren resistencia a la puromicina a las células Hana3A, pero el mantenimiento de las células con este antibiótico no afecta significativamente a los resultados del ensayo.
- El subcultivo en una proporción de 01:08 en 10 cm de platos cada 2-3 días.
- Incubar a 37 ° C con 5% de CO 2.
2. Las células Plating para la transfección
- Aspirar los medios de un 100% de confluencia 10 cm placa de células Hana3A.
- Lavar las células mediante la adición de 10 ml de PBS, girando el plato, y aspirar el PBS.
- Añadir 3 ml de 0,05% de tripsina / EDTA y esperar para que las células se disocian (aproximadamente 1 min).
- Inactivar la tripsina añadiendo 5 ml M10 y romper los grumos de células mediante trituración o menos 10 veces y# 160; con una pipeta de 10 ml. Pipeta con cuidado para evitar la introducción de burbujas de aire en los medios de comunicación.
- Para cada placa de 96 pocillos, de transferencia de 1 ml de células en un tubo cónico de 15 ml, centrifugar a 200 xg durante 5 min, y aspirar el sobrenadante sin alterar el sedimento celular.
- Resuspender las células en 6 ml de M10 por 1 ml de células transferidas en el paso 2.5.
- Pipetear 50 l de células a cada pocillo de una placa de 96 pocillos y se incuba durante la noche a 37 ° C con 5% de CO 2.
3. La transfección de olfativas Receptores
- Preparación de ADN plásmido
- Preparar ADN plásmido a través de un protocolo libre de endotoxinas. NOTA: Los juegos de preparación de ADN plásmido Uso designados como "libre de endotoxina", o agregar una etapa de extracción con fenol-cloroformo para el protocolo de preparación de ADN plásmido.
- Diluir el ADN a una concentración de 100 ng / l en tampón TE.
- Observar las células chapada (Paso 2.7) para asegurar una adecuada confluencia de aproximacióndamente 30-50% por pozo y volver a la incubadora. NOTA: Mientras esta confluencia no es óptimo para el reactivo de transfección de lípidos, una confluencia del 30-50% en este paso es óptima para la medición de la actividad de luciferasa 24 horas después de la transfección.
- Preparación de la mezcla de transfección
- Pipetear RTP1S-PCI, M3-R-PCI, pCRE-luc y pSV40-RL plásmidos en medio MEM por los volúmenes que se detallan en la Tabla 1 para hacer la mezcla de plásmido (volúmenes indicados son por placa de 96 pocillos).
Mezcla de plásmido por pocillo por placa de 96 pocillos MEM - 500 l RTP1S pCI 5 ng 480 ng M3-R-pCI 2,5 ng 240 ng pCRE-luc 10 ng 960 ng pSV40-RL 5 ng 480 ng
Cuadro 1. Componentes de la mezcla de plásmidos. Per así y por volúmenes de placas de 96 pocillos de RTP1S pCI, M3-R-PCI, pCRE-luc y pSV40-RL, y el MEM. - Para cada placa de 96 pocillos, diluya 18 l de reactivo de transfección de lípidos en medio MEM 450 l.
- Pipeta plásmido mezcla (de la etapa 3.3.1), receptor olfativo rodopsina-etiquetados en el plásmido pCI (Rho-O-PCI), y la mezcla de transfección de lípidos (del Paso 3.3.2) para hacer que el complejo detallada en Tabla 2. Mezclar la solución por trituración y se incuba a temperatura ambiente durante 15 min. Detener la reacción añadiendo M10 de acuerdo con la Tabla 2 NOTA:. Esta reacción es sensible al tiempo y no se debe permitir que continúe durante más de 30 min. El cálculo así + 10% es importante para asegurar un volumen suficiente para las etapas posteriores.
Complejo por pocillo por pocillo + 10% Mezcla de plásmido 4.2 l 4,58 l Rho-OR-PCI 0,05 ng 0,06 ng Mezcla de transfección de lípidos 4.2 l 4,58 l M10 41,7 l 45.83 l
Tabla 2. Componentes complejos. Por pocillo y por así + 10% de los volúmenes de mezcla de plásmido (Tabla 1), el plásmido receptor olfativo (Rho-O-PCI), y la mezcla de transfección de lípidos. M10 se añade para extinguir la reacción tras una incubación de 15 min a temperatura ambiente.
- Pipetear RTP1S-PCI, M3-R-PCI, pCRE-luc y pSV40-RL plásmidos en medio MEM por los volúmenes que se detallan en la Tabla 1 para hacer la mezcla de plásmido (volúmenes indicados son por placa de 96 pocillos).
- Toque en el medio en las placas de células.
- Pipetear 50 l de complejo a cada pocillo e incubar durante la noche a 37 ° C con 5% de CO 2.
4. Olor Estimulación
- Observar las células transfectadas para asegurar una adecuada confluencia de 50-80% por pocillo y retorno a la incubadora. NOTA: Si las células son menos de 50Lecturas% confluentes, luciferasa de luciérnaga y luciferasa de Renilla pueden ser demasiado bajos para la medición de la activación del receptor. Considere la posibilidad de descartar la placa.
- Preparar 1 M soluciones madre de cada olor en DMSO.
- Preparar soluciones olor de estimulación en medio CD293.
- Para los experimentos de cribado, diluir la solución madre de olor a 100 mM. También hay que preparar un control sin olor (CD293 solamente) con el fin de controlar o activación de fondo. NOTA: Para los experimentos de detección, cada par O / olor se prueba sólo una vez por experimento. Debido a que algunos de difusión de olores a través de los pozos es posible, se recomienda para estimular con un odorante para cada placa.
- Para los experimentos de respuesta a la dosis, prepárame siete de 10 veces diluciones seriadas de solución olor de stock por triplicado a partir de 1 mM para cada receptor. También hay que preparar las mismas diluciones de olor en triplicado para las células transfectadas con el vector vacío con el fin de controlar para la activación olor fondo. NOTA: Para los experimentos de respuesta a la dosis, cada una oTratamiento con una concentración dor debe llevarse a cabo por triplicado.
- Toque en el medio en las placas de células.
- Pipeta 25 l de solución de estimulación olor a cada pocillo e incubar durante 4 horas.
5. Medición o actividad a través de ensayo de luciferasa
- Resuspender sustrato de luciferasa de luciérnaga según las instrucciones del fabricante y almacenarlos a -80 ° C.
- Descongelar 1 ml de sustrato de luciferasa de luciérnaga por placa de 96 pocillos.
- Preparar la reacción luciferasa de luciérnaga fresco extintor y el reactivo de sustrato de luciferasa de Renilla (5 l luciferasa extintor / sustrato de luciferasa de Renilla por 1 ml de tampón). NOTA: se necesita aproximadamente 1 ml de reactivo por placa de 96 pocillos.
- Prepare el lector de microplacas luminiscente. Abra el software de lector de microplacas. Dentro del icono del sistema:
- Bajo el "precalentamiento" Tab, marque la casilla de "ON" y ajuste la temperatura de la máquina a 25 °; C.
- Bajo la pestaña "Dispenser", acondicionar cada dispensador con 1.000 l de etanol al 70% seguido por 1000 l de agua destilada. NOTA: Use alícuotas separadas de alcohol y agua para cada distribuidor. El etanol se utiliza para la desinfección de los dispensadores, y el agua elimina el etanol residual.
- Primer cada dispensador con 1.500 l de aire (quitar dispensadores de líquido). NOTA: imprimación con aire asegura que los sustratos de luciferasa no se diluyen con agua residual.
- Primer dispensador 1 con 1080 l de sustrato de luciferasa de luciérnaga (de la Etapa 5.2). Primer dispensador 2 con sustrato de luciferasa de Renilla (de la Etapa 5.3). NOTA: Tenga cuidado de no contaminación cruzada de los sustratos de luciferasa. Cebado con sustratos de luciferasa llena el espacio muerto en los dispensadores de reactivos.
- Configure el protocolo siguiente para leer tanto luciérnagas y Renilla luciferasa luminiscencia. Dentro del software asociado con el lector de microplacas, de las Naciones Unidasder el menú "Archivo", haga clic en "Nueva tarea". Resalte "Protocolos" y hacer clic en "Crear nuevo". En la siguiente ventana, el círculo al lado de "protocolo estándar" debe ser seleccionado. Haga clic en "Aceptar". Haga doble clic en "Procedimiento" en el lado izquierdo de la pantalla.
- Dispensar 10 l de sustrato de luciferasa de luciérnaga a todos los pozos utilizando dispensador 1. En el menú "Actions", haga clic en "Dosificación". En la ventana "Dispense Paso", establezca: "Dispenser" a 1 "Cebado" ninguno, "Volumen de dispensación" a 10 l y "Cambio" a 225 l / seg. Haga clic en "Aceptar".
- Agitar la placa durante 30 segundos. Bajo el menú "Actions", haga clic en "Shake". En la ventana de "Shake Paso", ajuste "Intensidad" a medio y "Duración" a doce y media MM: SS. Haga clic en "Aceptar".
- Leer la luminiscencia de todos los pozos de 0,5 segundos por pocillo. Bajo el menú "Actions", haga clic en "Leer";. En la ventana "Leer Step", establezca: "Método de detección" de luminiscencia, "Leer Type" al punto extremo, "Tiempo de integración" a 0:00:50 MM: SS: ss "Filter Sets" a 1 "Emisión" a Hole, "Óptica posición" hacia arriba "Gain" a 135, y "Leer Altura" a 1,00 mm. Haga clic en "Aceptar".
- Dispensar 10 l de sustrato de luciferasa Renilla a todos los pozos utilizando dispensador 2. Establecer las condiciones que en el Paso 5.6.1, excepto set "Dispenser" a 2.
- Agitar la placa durante 30 segundos. Establecer las condiciones que en el paso 5.6.2.
- Leer luminiscencia de todos los pozos de 0,5 segundos por pocillo. Establecer las condiciones que en el paso 5.6.3.
- Retire la tapa de la placa de 96 pocillos y colocar la placa en el lector de microplacas. Inicie el programa creado en el paso 5.5 para leer la placa de luminiscencia.
- Limpie las bombas de distribución de reactivos. Desde el icono de sistema en la pestaña "dispensador":
- Purgar 1.000 l de fsustrato de luciferasa irefly desde el dispensador de la luciferasa de luciérnaga en un tubo de recuperación. NOTA: la luciferasa de la luciérnaga puede ser almacenado a -80 ° C y se reutiliza.
- Primer cada dispensador con 1.000 l de agua destilada, seguido de 1,000 l de etanol al 70%, y finalmente 1500 l de aire (quitar dispensadores de líquido). NOTA: El agua elimina sustratos de luciferasa de las bombas de reactivos, desinfecta etanol, y deje secar al aire toda etanol residual.
6. Análisis de Datos
- Exportación de datos
- En el software de lector de microplacas, haga doble clic en "Constructores Reportar / Exportar" en el lado izquierdo de la pantalla.
- Haga clic en el botón "Nuevo Exportar a Excel" y haga clic en "Aceptar".
- Resalte Export1 y haga clic en "Editar".
- En la sección "Contenido" check "Descripción del Sistema", "procedimiento", "Plate Descripción" y "Plate Layout Matrix". Incluir "Datos sin formato" unnd "Calculado de datos".
- En la sección "Flujo de trabajo", marque "autoexecute al finalizar el procedimiento." En el modo de exportación, compruebe "Todas las placas en el mismo libro" y "Como una nueva hoja de cálculo".
- En "Archivo" elegir el formato de nombre de archivo y ubicación del archivo y haga clic en "OK".
- Cierre la ventana "Report / Exportar Constructores".
- Para obtener valores de luciferasa normalizada, divida la lectura luciferasa de luciérnaga luminiscencia para cada pozo (Paso 5.6.3) por la lectura de luminiscencia Renilla para cada pozo (Paso 5.6.6).
Resultados
Una pantalla primarios probados 328 RUP contra olores 26 a una concentración de 100 mM. Esta concentración de olor ha sido demostrado para activar eficazmente una gran proporción de las RUP con ligandos conocidos 10. En primer lugar, la actividad de la luciferasa normalizada se calculó dividiendo la lectura de luciferasa de luciérnaga por la lectura de luciferasa de Renilla. A continuación, los valores baselined se calcularon restando las lecturas de luciferasa normalizada para el control sin olor a partir de las lecturas de luciferasa normalizada para cada pocillo (Figura 1). Curvas de respuesta a la dosis se realizaron en 48 odorante / o pares distribuidos al azar en toda la gama de valores baselined, como indican mediante barras de color en la Figura 1. RUP fueron tratados con 7 concentraciones de odorante que abarca 1 nM a 1 mM, y las respuestas resultantes se ajustaron a una curva sigmoidal usando regresión no lineal. Un odorante / O se consideró un agonista si cumplía tres criterios: (1) el error estándar dela LogEc 50 era menos de 1 unidad logarítmica; (2) los intervalos de confianza del 95% para los parámetros superior e inferior de la curva no se superponían; y (3) la prueba adicional sumas de cuadrados confirmó que el odorante activa las células O-que contienen significativamente más que las células de control, que se transfectaron con un vector vacío. Resultados de dosis-respuesta se resumen en la Tabla 3.
Estos datos se utilizaron para determinar qué tan bien mediciones de ensayo en una pantalla primaria predicen resultados de la curva de respuesta a la dosis. Las barras azules en la Figura 1 se corresponden con los pares que fueron clasificados como agonistas en un experimento de respuesta a la dosis completa, mientras que las barras rojas no cumplían los tres criterios mencionados anteriormente. Los valores de la pantalla principal predijeron los resultados de la dosis completa experimento de respuesta (área bajo la curva ROC (AUC) = 0,68, p <0,01, Mann-Whitney U test), lo que indica que nuestra pantalla principal es un método útil para enriquecer odorantes / o parejas que serán clasificados como agonistas en una respuesta experimento dosis completa (Figura 2).
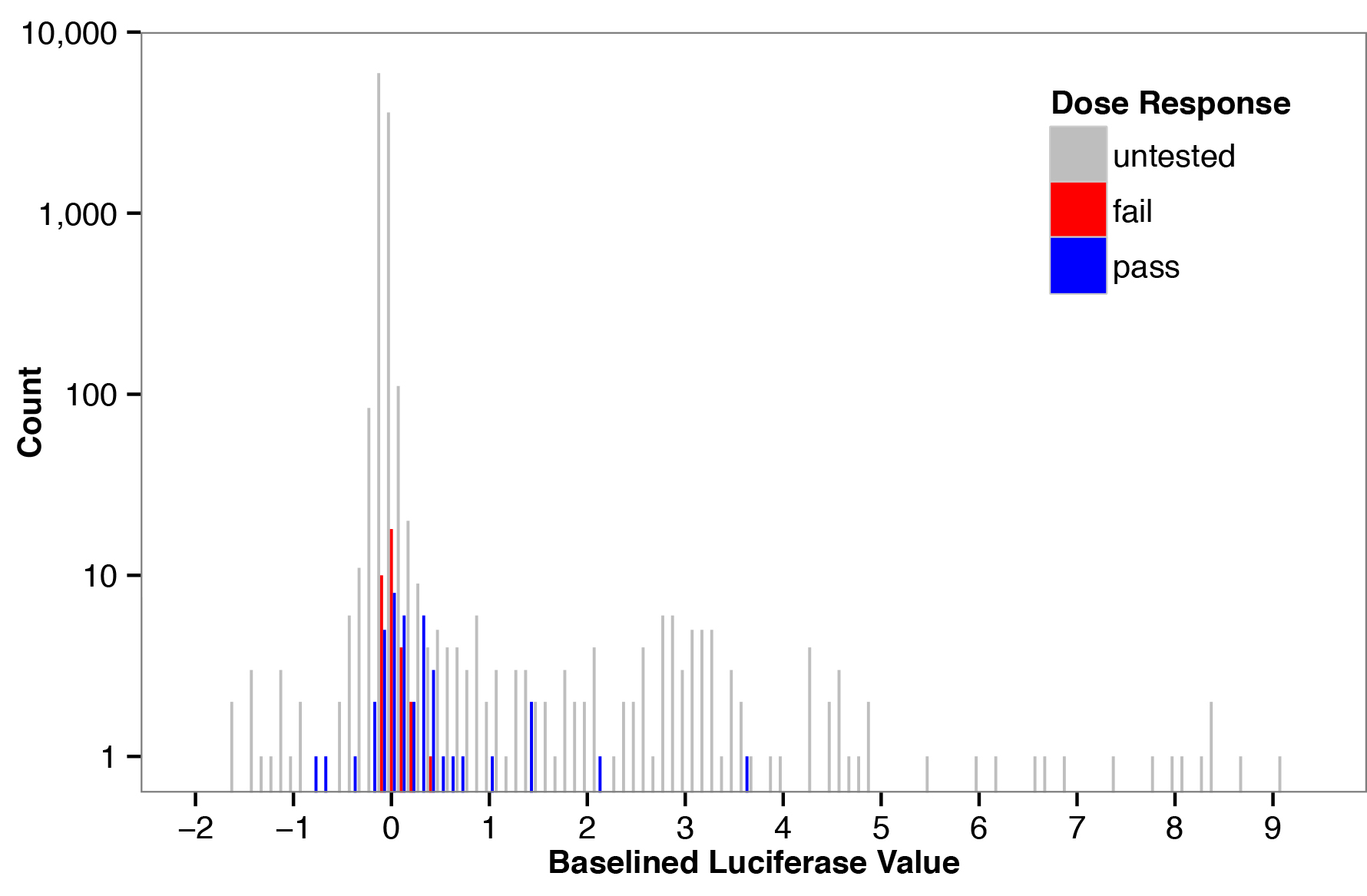
Figura 1. De frecuencia de valores de luciferasa baselined para una pantalla con un panel de receptores olfativos y odorantes. Histograma de la frecuencia (Count) de los valores de luciferasa baselined calculados para cada odorante / o un par en la pantalla primaria. Como pares de activación odorante / receptor son escasos, la mayoría de los valores están centrados en cero y la gran distribución central calcula la distribución de ruido para este ensayo. Las barras de colores indican pares odorante / receptor elegido para el análisis de dosis-respuesta; barras azules son pares que fueron clasificados como agonistas basados en la respuesta a la dosis completa, y barras rojas son parejas que no fueron clasificados como agonistas.f = "https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/51640/51640fig1highres.jpg" target = "_blank"> Haga clic aquí para ver la imagen más grande.
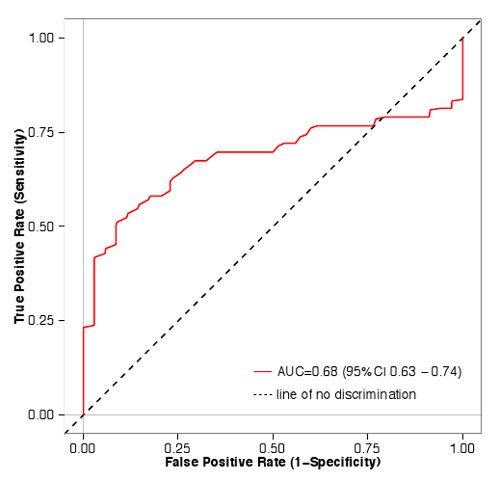
Figura 2. Curva ROC para la pantalla odorante / receptor. 48 pares odorante / receptor fueron clasificados como agonistas o como no ser agonistas. Entonces la tasa de verdaderos positivos (sensibilidad) se representó frente a la tasa de falsos positivos (1-especificidad) con el paquete estadístico R 40. El área bajo la curva (AUC) es de 0.68, lo que indica que los pares odorante / receptor con los valores de la pantalla de la luciferasa mayores tienen más probabilidades de pasar de dosis-respuesta que aquellos con valores más bajos. Haga clic aquí para ver la imagen más grande.
| Valor de línea base | Respuesta a la dosis |
| 0.051793067 | fallar |
| 0.006376956 | fallar |
| 0.331936398 | pasar |
| 0.591006519 | pasar |
| 0.049093369 | pasar |
| 0.396788976 | pasar |
| -0,013655743 | pasar |
| 0.011080217 | pasar |
| 0.004203349 | fallar |
| 0.003975049 | fallar |
| -0,077935718 | pasar |
| -0,084488317 | pasar |
| 0.030236078 | fallar |
| -0,042963576 | fallar |
| 0.031466406 | fallar |
| 0.025897747 | fallar |
| -0,030434651 | fallar |
| -0,004122795 | fallar |
| -0,010075533 | fallar |
| 0.028883452 | fallar |
| 0.019402373 | fallar |
| 0.047508749 | fallar |
| 0.00255344 | fallar |
| 0.017221449 | fallar |
| 0.340216655 | pasar |
| -0,026912181 | fallar |
| 0.037140428 | fallar |
| 0.467763017 | pasar |
| 0.097665337 | fallar |
| 0.080657267 | pasar |
| 0.172819211 | pasar |
| 0.05568393 | pasar |
| -0,106721064 | pasar |
| 0.136614849 | pasar |
| 0.457839849 | fallar |
| 0.211751741 | fallar |
| 0.1581464 | pasar |
| -0,62099155 | pasar |
| -0,066949491 | pasar |
| -0,78712035 | pasar |
| 0.752503007 | pasar |
| 1.433407558 | pasar |
| 0.475431098 | pasar |
| 1.457936815 | pasar |
| 0.048652537 | fallar |
| 0.027196782 | fallar |
| 0.129599842 | fallar |
| -0,069781272 | fallar |
| 0.016450039 | fallar |
| -0,025639207 | fallar |
| 0,158152141 | fallar |
| -0,032570055 | fallar |
| 0.140139926 | fallar |
| -0,052030276 | fallar |
| 0.657140133 | pasar |
| 1.040410297 | pasar |
| pasar | |
| 0.399588712 | pasar |
| 0.188094387 | pasar |
| 0.039371424 | pasar |
| 0.016784352 | pasar |
| 0.229959571 | pasar |
| 0.238381997 | fallar |
| 0.074118909 | fallar |
| 0.423901128 | pasar |
| 0.152621022 | pasar |
| pasar | |
| 0.075301806 | pasar |
| 0.395233972 | pasar |
| 0.261892958 | pasar |
| 0.156693306 | fallar |
| 2.163418147 | pasar |
| 3.649862104 | pasar |
| 0.025716169 | pasar |
| -0,033258008 | pasar |
| -0,026984127 | fallar |
| -0,338441868 | pasar |
| 0.37398618 | pasar |
Tabla 3. Olfativa pares receptor / olor a prueba en respuesta a la dosis. Valores de luciferasa línea base y los resultados de dosis-respuesta (aprobado o suspenso) para 48 O / olor pares seleccionados de la pantalla. Para 30 pares probados en la pantalla dos veces, se incluyen tanto los valores de luciferasa baselined.
Discusión
Identidad odorante es codificada por los patrones de activación de receptores olfativos, pero los patrones de activación del receptor, incluyendo el que los receptores se activan y en qué grado, son conocidos por menos del 6% de los receptores olfativos humanos 1-11. Los esfuerzos para caracterizar receptores olfativos han sido limitados por sus métodos o aplicabilidad de mano de obra intensiva para sólo un subconjunto de la familia de receptores olfativos 17,23,24,33,34. El sistema de expresión heterólogo Hana3A apoya la expresión robusta de la mayoría de los receptores olfativos probados, y se puede utilizar en conjunción con un sistema indicador de luciferasa-AMPc que responde para controlar la activación del receptor olfativo 19,26,27. El rendimiento de este ensayo en un formato de 96 pocillos apoya una serie de diseños experimentales de alto rendimiento, incluyendo pantallas para determinar posibles candidatos para parejas del receptor odorante / olfativa y las curvas de dosis-respuesta para confirmar interacciones y evaluar cómo los niveles de activación del receptor son afafectadas por las variaciones intra-e inter-específicas. Pares odorante / receptor con los valores de actividad más altos en una pantalla son más propensos a mostrar una respuesta a la dosis significativa. Estos datos sugieren que este método de detección es capaz de enriquecer para los pares de odorante / receptor que pasarán respuesta a la dosis, facilitando de este modo la identificación de ligandos odorizantes y los patrones de activación de receptores olfativos.
El éxito de este ensayo optimizado para el análisis de receptor olfativo depende de varios factores. Todos los ADN plásmido se debe preparar a través de un protocolo libre de endotoxinas. La expresión del receptor olfativo Consistente en la superficie celular es crítica. La línea celular expresa de forma estable Hana3A varias proteínas accesorias que ayudan en la expresión de O, pero la co-transfección de RTP1S y M3-R potencia la expresión y activación del receptor, respectivamente 27. Esta combinación de la expresión de proteínas accesorio resulta en la expresión fiable de la mayoría de los receptores olfativos, permitiendo que el COMPARACIÓNn de o activación entre los experimentos y los receptores. Además, el seguimiento de la confluencia de células es importante para obtener resultados consistentes. Suponiendo que las células en el original plato de 10 cm 2 son aproximadamente 100% de confluencia, siguiendo el protocolo descrito en el presente documento se traducirá en una confluencia celular fiable durante todo el experimento. Es importante destacar que suficientes células se sembraron para obtener una lectura de la luciferasa medible, pero las células no se sobre-crecido, una condición que puede afectar a la activación del receptor después de la estimulación olor. La normalización para la expresión de renilla más controles constitutivos no sólo por la densidad celular, pero también para la eficacia de transfección. A Renilla luciferase leer más de 2.5 desviaciones estándar por debajo de la media puede indicar la pérdida de células. Las células se deben sembraron uniformemente para evitar placas densas que se desprenden más fácilmente de la superficie de la placa de células dispersas, y soluciones de transfección y de olor deben añadirse suavemente al lado del pozo para evitar CEL separarls. La pérdida de células también podría ser debido a la muerte celular causada por la toxicidad odorante, un problema que puede ser eludido mediante la reducción de la concentración de odorante, o DMSO excesiva, que puede evitarse manteniendo concentraciones de DMSO por debajo de 0,5%. Por último, el tratamiento de cada población de células que expresan el receptor con forskolina 1 mM, un activador de la adenilato ciclasa que causa la expresión de informador de luciferasa a partir del promotor-AMPc que responde, puede servir como un control positivo para el ensayo.
Aunque el ensayo descrito en el presente documento representa una mejora sobre métodos alternativos, incluyendo un formato de alto rendimiento y más aplicabilidad general a la familia de receptores olfativos de mamíferos, tiene limitaciones. En primer lugar, nuestro ensayo in vitro carece de muchos de los componentes de un sistema olfativo in vivo, incluyendo proteínas de unión a odorantes, una capa de la mucosa, moléculas intracelulares y comportamientos de olfateo. En segundo lugar, este método se basa en un sistema indicador de luciferasa para medir receptor olfativoactivación en contraste con los métodos alternativos comunes que utilizan imágenes de calcio. Trabajos recientes sugieren que estos dos métodos pueden producir resultados contradictorios; de hecho, un par de receptores olfativos responden a un odorante particular, cuando se examina a través de imágenes de calcio, pero no de ensayo de luciferasa 41. Si un tipo de ensayo es más relevante para los estudios de la percepción olfativa humana aún no está claro, pero los dos métodos podría ser de utilidad en función del contexto y el tipo de receptor. En tercer lugar, mientras que este sistema de expresión funcional con éxito se ha utilizado para expresar la mayoría de los receptores olfativos de mamíferos probadas, algunas RUP pueden no ser susceptibles de expresión utilizando este sistema. Si los receptores no caracterizados previamente no responden a un olor, puede ser debido a la falta de expresión en la superficie celular en lugar de una falta de interacción entre odorante y el receptor. Expresión en la superficie celular del receptor puede ser examinado a través de inmunofluorescencia antes de sacar conclusiones a partir de los resultados de ensayo negativo 27,42 . Por último, debido a la baja actividad de la luciferasa fondo en condiciones de no-olor, nuestro ensayo no está diseñado para detectar las respuestas inhibitorias. Para determinar antagonistas de olor para los receptores olfativos 38,39, la mayoría de los receptores primero deben ser estimulados con un olor a fin de observar una reducción en la actividad de luciferasa.
A pesar de estas limitaciones, este sistema de ensayo tiene la capacidad de aumentar en gran medida la adquisición de datos en el campo del olfato. En primer lugar, el formato de alto rendimiento de 96 pocillos hace que las pantallas de los receptores y / o de olor a gran escala viable. En segundo lugar, su sistema de expresión heterólogo es aplicable a una variedad de receptores olfativos de mamíferos. En tercer lugar, la actividad de luciferasa se puede utilizar para medir la activación del receptor olfatorio, que es valioso en la descripción de los patrones de activación del receptor para un odorante en particular. En cuarto lugar, los resultados anteriores de sistemas de ensayo in vitro similares en predicen la percepción olfativa humana 8,11,35. Estas características son particialmente importante dado el gran tamaño de la familia del receptor olfativo de los mamíferos y de nuestro conocimiento limitado en cuanto a los patrones de activación O provocadas por los olores específicos. Amplia aplicación de este sistema de ensayo optimizado para el análisis de receptor olfativo contribuya a una visión más completa de receptor olfativo / interacción odorante y la base molecular del olor de codificación.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta labor fue apoyada por R01 DC013339, R03 DC011373, y Ruth L. Kirschstein Servicio Nacional de Investigación Premio T32 DC000014. Una parte del trabajo se ha realizado mediante el Monell quimiosensorial Receptor Signaling Core, que es apoyada, en parte, con fondos del NIH P30 DC011735-NIDCD Core Grant. Los autores agradecen a C. Sezille para ayudar con la recolección de datos.
Materiales
| Name | Company | Catalog Number | Comments |
| Hana3A cells | Avaiable from the Matsunami Laboratory upon request | ||
| RTP1S-pCI | Avaiable from the Matsunami Laboratory upon request | ||
| M3-R-pCI | Avaiable from the Matsunami Laboratory upon request | ||
| pCRE-luc | Agilent | 219076 | LUC |
| pSV40-RL | Promega | E2231 | RL |
| Minimum Essential Media, Eagle | Sigma Aldrich | M4655 | MEM |
| FBS | Life Technologies | 16000-044 | FBS |
| PBS (without Ca2+ and Mg2+) | Cellgro | 21-040-CV | PBS |
| Trypsin (0.05% Trypsin EDTA) | Life Technologies | 25300 | Trypsin |
| CD293 | Life Technologies | 11913-019 | CD293 |
| 96-well PDL white/clear plate | BD BioCoat | 356693 | plates |
| Lipid transfection reagent: Lipofectamine 2000 | Life Technologies | 11668-019 | Lipofectamine |
| Firefly luciferase substrate, firefly luciferase quencher/Renilla luciferase substrate: Dual-Glo Assay | Promega | E2980 | dual glo |
| Synergy S2 | BioTek | SLAD | BioTek S2 |
| Microplate reader software: Gen5 Data Analysis Software | BioTek | Gen5 | Gen5 |
| BIOSTACK | BioTek | BIOSTACK2WR | BioStack |
| Multiflo | BioTek | MFP | MultiFlo |
| 300 μl GripTips | Integra | 4433 | GripTips |
| 12.5 μl GripTips | Integra | 4414 | GripTips |
| 300 μl GripTips ViaFlo96 | Integra | 6433 | XYZ tips |
| 12.5 μl GripTips 384 XYZ | Integra | 6403 | XYZ tips |
| 384ViaFlo | Integra | 6030 | 384ViaFlo |
| TE buffer | Macherey Nagel | 740797.1 | |
| DMSO | Sigma Aldrich | D2650-100ML | DMSO |
| Forskolin | Enzo Life Sciences | BML-CN100-0010 | FOR |
Referencias
- Wetzel, C. H., Oles, M., Wellerdieck, C., Kuczkowiak, M., Gisselmann, G., Hatt, H. Specificity and sensitivity of a human olfactory receptor functionally expressed in human embryonic kidney 293 cells and Xenopus Laevis oocytes. The Journal of neuroscience the official journal of the Society for Neuroscience. 19 (17), 7426-7433 (1999).
- Spehr, M., et al. Identification of a testicular odorant receptor mediating human sperm chemotaxis. Science. 299 (5615), 2054-2058 (2003).
- Sanz, G., Schlegel, C., Pernollet, J. -C., Briand, L. Comparison of odorant specificity of two human olfactory receptors from different phylogenetic classes and evidence for antagonism. Chemical senses. 30 (1), 69-80 (2005).
- Matarazzo, V., et al. Functional characterization of two human olfactory receptors expressed in the baculovirus Sf9 insect cell system. Chemical senses. 30 (3), 195-207 (2005).
- Jacquier, V., Pick, H., Vogel, H. Characterization of an extended receptive ligand repertoire of the human olfactory receptor OR17-40 comprising structurally related compounds. Journal of neurochemistry. 97 (2), 537-544 (2006).
- Neuhaus, E. M., Mashukova, A., Zhang, W., Barbour, J., Hatt, H. A specific heat shock protein enhances the expression of mammalian olfactory receptor proteins. Chemical senses. 31 (5), 445-452 (2006).
- Shirokova, E., et al. Identification of specific ligands for orphan olfactory receptors. G protein-dependent agonism and antagonism of odorants. The Journal of biological chemistry. 280 (12), 11807-11815 (2005).
- Keller, A., Zhuang, H., Chi, Q., Vosshall, L. B., Matsunami, H. Genetic variation in a human odorant receptor alters odour perception. Nature. 449 (7161), 468-472 (2007).
- Menashe, I., et al. Genetic elucidation of human hyperosmia to isovaleric acid. PLoS biology. 5 (11), (2007).
- Saito, H., Chi, Q., Zhuang, H., Matsunami, H., Mainland, J. D. Odor coding by a Mammalian receptor repertoire. Science signaling. 2 (60), (2009).
- Jaeger, S. R., et al. A Mendelian Trait for Olfactory Sensitivity Affects Odor Experience and Food Selection. Current Biology. 23, 1-5 (2013).
- DeMaria, S., Ngai, J. The cell biology of smell. The Journal of cell biology. 191 (3), 443-452 (2010).
- Zhang, X., Firestein, S. The olfactory receptor gene superfamily of the mouse. Nature nauroscience. 5 (2), 124-1233 (2002).
- Glusman, G., Yanai, I., Rubin, I., Lancet, D. The complete human olfactory subgenome. Genome research. 11 (5), 685-702 (2001).
- Olender, T., Lancet, D., Nebert, D. W. Update on the olfactory receptor (OR) gene superfamily. Human Genomics. 3 (1), 87(2008).
- Mombaerts, P. Genes and ligands for odorant, vomeronasal and taste receptors. Nature reviews. Neuroscience. 5 (4), 263-278 (2004).
- Malnic, B., Hirono, J., Sato, T., Buck, L. B. Combinatorial receptor codes for odors. Cell. 96 (5), 713-723 (1999).
- Araneda, R. C., Kini, aD., Firestein, S. The molecular receptive range of an odorant receptor. Nature. 3 (12), 1248-1255 (2000).
- Saito, H., Kubota, M., Roberts, R. W., Chi, Q., Matsunami, H. RTP family members induce functional expression of mammalian odorant receptors. Cell. 119 (5), 679-691 (2004).
- Katada, S., Hirokawa, T., Oka, Y., Suwa, M., Touhara, K. Structural basis for a broad but selective ligand spectrum of a mouse olfactory receptor: mapping the odorant-binding site. The Journal of neuroscience the official journal of the Society for Neuroscience. 25 (7), 1806-1815 (2005).
- Lu, M., Echeverri, F., Moyer, B. D. Endoplasmic Reticulum Retention, Degradation, and Aggregation of Olfactory G-Protein Coupled Receptors. Traffic. 4 (6), 416-433 (2003).
- McClintock, T. S., et al. Functional expression of olfactory-adrenergic receptor chimeras and intracellular retention of heterologously expressed olfactory receptors. Brain research. Molecular brain research. 48 (2), 270-278 (1997).
- Zhao, H. Functional Expression of a Mammalian Odorant Receptor. Science. 279 (5348), 237-242 (1998).
- Kajiya, K., Inaki, K., Tanaka, M., Haga, T., Kataoka, H., Touhara, K. Molecular bases of odor discrimination: Reconstitution of olfactory receptors that recognize overlapping sets of odorants. The Journal of neuroscience the official journal of the Society for Neuroscience. 21 (16), 6018-6025 (2001).
- Krautwurst, D., Yau, K., Reed, R. R., Hughes, H. Identification of Ligands for Olfactory Receptors. Cell. 95, 917-926 (1998).
- Li, Y. R., Matsunami, H. Activation state of the M3 muscarinic acetylcholine receptor modulates mammalian odorant receptor signaling. Science signaling. 4 (155), (2011).
- Zhuang, H., Matsunami, H. Evaluating cell-surface expression and measuring activation of mammalian odorant receptors in heterologous cells. Nature. 3 (9), 1402-1413 (2008).
- Haddad, R., Khan, R., Takahashi, Y. K., Mori, K., Harel, D., Sobel, N. A metric for odorant comparison. Nature methods. 5 (5), 425-429 (2008).
- Veithen, A., Wilkin, F., Philippeau, M., Van Osselaer, C., Chatelain, P. Olfactory Receptors: From basic science to applications in flavors and fragrances. Perfumer and Flavorist. 35 (1), 38-40 (2010).
- Bozza, T., Feinstein, P., Zheng, C., Mombaerts, P. Odorant receptor expression defines functional units in the mouse olfactory system. The Journal of neuroscience the official journal of the Society for Neuroscience. 22 (8), 3033-3043 (2002).
- Oka, Y., Katada, S., Omura, M., Suwa, M., Yoshihara, Y., Touhara, K. Odorant receptor map in the mouse olfactory bulb: in vivo sensitivity and specificity of receptor-defined glomeruli. Neuron. 52 (5), 857-869 (2006).
- Zhao, H., Ivic, L., Otaki, J. M., Hashimoto, M., Mikoshiba, K., Firestein, S. Functional expression of a mammalian odorant receptor. Science. 279 (5348), 237-242 (1998).
- Touhara, K., et al. Functional identification and reconstitution of an odorant receptor in single olfactory neurons. Proceedings of the National Academy of Sciences of the United States of America. 96 (7), 4040-4045 (1999).
- Zhuang, H., Matsunami, H. Synergism of accessory factors in functional expression of mammalian odorant receptors. The Journal of biological chemistry. 282 (20), 15284-15293 (2007).
- McRae, J. F., Mainland, J. D., Jaeger, S. R., Adipietro, K. A., Matsunami, H., Newcomb, R. D. Genetic variation in the odorant receptor OR2J3 is associated with the ability to detect the "grassy" smelling odor, cis-3-hexen-1-ol. Chemical senses. 37 (7), 585-593 (2012).
- Adipietro, K. A., Mainland, J. D., Matsunami, H. Functional evolution of mammalian odorant receptors. PLoS genetics. 8 (7), (2012).
- Zhuang, H., Chien, M. -S., Matsunami, H. Dynamic functional evolution of an odorant receptor for sex-steroid-derived odors in primates. Proceedings of the National Academy of Sciences of the United States of America. 106 (50), 21247-21251 (2009).
- Oka, Y., Nakamura, A., Watanabe, H., Touhara, K. An odorant derivative as an antagonist for an olfactory receptor. Chemical senses. 29 (9), 815-822 (2004).
- Oka, Y., Omura, M., Kataoka, H., Touhara, K. Olfactory receptor antagonism between odorants. The EMBO journal. 23 (1), 120-126 (2004).
- Fawcett, T. An introduction to ROC analysis. Pattern Recognition Letters. 27 (8), 861-874 (2006).
- Baghaei, K. A. Olfactory Receptors. Olfactory Recept. Methods Protoc. 1003, 229-238 (2013).
- Dey, S., Zhan, S., Matsunami, H. Assaying surface expression of chemosensory receptors in heterologous cells. Journal of visualized experiments JoVE. (48), (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados