Method Article
Мышь Модель для патогенных микроорганизмов, вызванной хроническим воспалением на локальном и системном сайтов
* Эти авторы внесли равный вклад
В этой статье
Резюме
Модели на животных оказались бесценными инструментами в определении хозяина и возбудителем конкретные механизмы, которые способствуют развитию хронического воспаления. Здесь мы опишем модель мыши оральной инфекцией с человеческим патогеном Porphyromonas gingivalis и детальной методологии оценки прогрессирования воспаления в местных и системных сайтов.
Аннотация
Хроническое воспаление является одним из основных факторов патологического повреждения тканей и объединяющей характеристикой многих хронических заболеваний у людей, включая новообразований, аутоиммунных и хронических воспалительных заболеваний. Новые данные указывают патогенов, вызванной хроническим воспалением в развитии и прогрессировании хронических заболеваний с широким спектром клинических проявлений. В связи со сложным и многофакторного этиологии хронического заболевания, постановки опытов для доказательства причинности и установления механических связей почти невозможно для человека. Преимущество использования животных моделей является то, что оба генетических и экологических факторов, которые могут повлиять на ход конкретного заболевания можно контролировать. Таким образом, для целей разработки соответствующих моделей животных инфекции является ключевым шагом в выявлении хозяина и возбудителем конкретные механизмы, которые способствуют хроническому воспалению.
Здесь мы опишем модель мыши патогена, вызванной хронической Inflammation на местных и системных сайтов следующих инфекции ротовой возбудителя Porphyromonas gingivalis, бактерии тесно связаны с заболеваниями пародонта человека. Оральный инфекция конкретных-патогенов мышей индуцирует местной воспалительной реакции, что приводит к разрушению зуба поддержки альвеолярной кости, отличительной чертой заболеваний пародонта. В установленном мышиной модели атеросклероза, инфекции P. gingivalis ускоряет воспалительного налета отложение в пределах синуса аорты и подвздошной артерии, в сопровождении активации сосудистого эндотелия, повышенной инфильтрата иммунных клеток, и повышенной экспрессии медиаторов воспаления в пределах поражений. Мы подробно методологии оценки воспаления на локальном и системном сайтов. Использование трансгенных мышей и определенных бактериальных мутантов делает эту модель особенно подходит для идентификации хозяина и микробных факторов, участвующих в инициации, прогрессии, и исход болезни. Additionallу, модель может быть использована для выявления новых терапевтических стратегий, включая вакцинацию и фармакологического вмешательства.
Введение
Хроническое воспаление является одним из основных факторов патологического повреждения тканей и объединяющей характеристикой многих хронических заболеваний у человека. Эти заболевания включают неопластические, аутоиммунных и хронических воспалительных заболеваний 1. Этиология многих хронических заболеваний остается неясным, но понимается комплекс и многофакторная, включая как генетическая предрасположенность и введение экологических факторов. В то время как продолжательницей воспаления остаются неизвестными, клеточные и молекулярные профили иммунной активации значительно перекрываются с теми узорами, наблюдаемых в принимающих ответов на возбудителей 2.
Монтаж данные указывают инфекцию с патогенных микроорганизмов в развитии и прогрессировании хронического воспаления и его разнообразными клиническими проявлениями 2,3. Возбудители могут индуцировать и поддерживать хроническое воспаление непосредственно подрыв иммунной системы хозяина и установления стойких инфекций 4. В отсутствие микробной настойчивости, инфекция может ускорить хроническое воспаление от аутоиммунных реакций, вызванных молекулярной мимикрии в аутоантигены, изменения в аутоантигены, которые делают их иммуногенны, или ущерб, освобождает ранее хост скрыт антигены. Редко, однако, есть конкретные патогены были определены как универсального причины конкретного хронического заболевания. Скорее, большинство имеющихся данных показывает, что патогены использовать различные механизмы, чтобы выявить хроническое воспаление с широким спектром клинических проявлений и исходов болезни в генетически восприимчивого хозяина 3. Таким образом, детальное понимание механизмов, посредством которых конкретные возбудителями хроническое воспаление может иметь серьезные последствия для здоровья населения, а также лечения и профилактики многих хронических заболеваний.
Хотя хозяева и патогенных конкретные механизмы, способствующие индукции и поддержания хронического воспаления являютсяплохо понимал, достижения в моделировании патогена, вызванной хроническим воспалением начали углубить наше понимание этих процессов. П. gingivalis устной инфекции модель является уникальной, хорошо характеризуется мышиная модель патогена, вызванной хроническим воспалением, которое позволяет анализ хозяина и возбудителем конкретных механизмов, способствующих хронического воспаления на местном (устной потери костной массы) и системных сайтов (атеросклероз) 5,6.
П. gingivalis является грамотрицательная, анаэробная устной патоген вовлечен в заболевания пародонта человека, в хронических воспалительных заболеваний инфекционного приводом характеризуется разрушением зуба, поддерживающей ткани 7. В дополнение к патологии на начальном участке инфекции, накапливая данные указывают P. gingivalis -индуцированных хроническое воспаление в развитии и прогрессировании системных заболеваний, включая атеросклероз 5, заболевание, характеризующееся хронической inflammatioн стенки артериального сосуда. Оральный инфекция конкретных-патогенов мышей с P. gingivalis вызывает локальную воспалительную реакцию, которая приводит к разрушению зуба поддержки альвеолярной кости 8. P. gingivalis могут быть восстановлены из уст зараженных мышей до 42 дней после заражения 8 и мышей развивать высокие уровни патогена конкретных титров антител сыворотки 9. В установленном мышиной модели атеросклероза с помощью apo-липопротеина-E - / - мышей (АроЕ - / -), оральный инфицирование P. gingivalis вызывает хроническое воспаление, что приводит в воспалительный отложение бляшек в синусе аорты 10 и безымянной артерии 11. Прогрессивная воспаление в безымянной артерии P. gingivalis -infected мышей можно контролировать в живых животных, использующих в естественных условиях МРТ. Гистологически поражений артерий от P. gingivalis -infected мыши обнаруживают повышенное накопление липидов accompaNied путем активации сосудистого эндотелия, повышенной инфильтрата иммунных клеток, и повышенной экспрессии медиаторов воспаления 12. Использование этой модели в нокаут мышей выяснил роль компонентов сигнальных принимающих и медиаторов воспаления, а также ячейку специфических взаимодействий, которые управляют P. gingivalis -индуцированных иммунопатологии 12 - 14. Кроме того, эксперименты, использующие определенные бактериальные мутанты были определены критическим П. gingivalis факторов вирулентности способствуя хроническому воспалению в местных и системных сайтов 15.
В данной статье подробно методологии для оценки P. gingivalis -индуцированных хроническое воспаление в местных и системных сайтов. Мы предоставляем подробный протокол для анализа альвеолярного потери костной microCT с помощью программного обеспечения Amira. Кроме того, мы определяем полезность сериала в естественных условиях живой животных МРТ для оценки прогрессивной ввоспламенение в безымянной артерии. Мы включаем методологии для визуализации и количественной оценки воспалительного налета в артериальных поражений, и описать их гистологического характеристику. Использование трансгенных мышей и определенных бактериальных мутантов делает эту модель особенно подходит для идентификации хозяина и микробных факторов, участвующих в инициации, прогрессии, и исход болезни. Кроме того, модель может быть использована для выявления новых терапевтических стратегий, включая вакцинацию и фармакологического вмешательства.
протокол
1 Рост и культивирования бактерий
- Подряд заморожены запасы P. gingivalis 381 на анаэробных чашках с кровяным агаром и инкубировали в течение 3 - 5 дней в анаэробной камере (10% H 2/10% CO 2/80% Н 2) при 37 ° С.
- С помощью пластин, выращенных организмов для инокуляции 5 мл жидкой культуры с сердечно-мозговым бульоне (BHI), дополненной дрожжевым экстрактом (0,5%), гемин (10 мкг / мл), и менадионом (1 мкг / мл). После вывода / N роста, перевести 5 мл культуры в 45 мл BHI.
- Выдержите 50 мл жидких культур анаэробных для additional18 - 24 часа в сутки и урожай в середине-конце логарифмической фазы. ПРИМЕЧАНИЕ Чистота культуры всегда должна быть уточнена Граму до введения бактерий в животных.
- Заготавливают бактерии от центрифугирования при 7000 мкг в течение 10 мин. Аспирируйте супернатант и тщательно ресуспендируют бактериальный осадок клеток в 5 мл PBS, используя серологические пипетки. Добавить дополнительный45 мл PBS и центрифугировать при 7000 х г в течение 10 мин. Повторите этот шаг дважды в общей сложности трех стирок.
- После последней промывки, ресуспендируют осадок клеток в PBS таким образом, что разбавление 1:10 культуры имеет оптическую плотность 1,0 при 660 нм (OD 660 на 1 эквивалентно 10 9 КОЕ / мл). Взвесить достаточно карбоксиметилцеллюлозу (средний viscocity), чтобы достичь 2% вес / об раствора (например, 0,1 г на 5 мл культуры). Медленно добавить карбоксиметилцеллюлозу в бактериальной суспензии, а вортексе, чтобы избежать образования комков.
2 Оральный Инфекция
ПРИМЕЧАНИЕ: Как показано на рисунке 1, используя соответствующую модель мыши и пероральный прием инфекции, П. gingivalis вызывает хроническое воспаление и иммунопатологии на местном (полости рта) и системные сайтов (артерий).
- Администрирование сульфаметоксазол (0,87 мг / мл) и триметоприм (0,17 мг / мл) (Sulfatrim) в шести до 8-WK-OLD мышей-самцов вволю в питьевой воде в течение 2 недель, чтобы уменьшить нормальную флору. Держите антибиотиками решение в янтарных стеклянных бутылок и защитить его от света, чтобы предотвратить деградацию.
- Чтобы избежать оседания раствором антибиотика, встряхнуть бутылки один или два раза в день (то есть, в первой половине дня и вечером). Замените свежеприготовленным раствором каждые 3 - 5 дней.
- Через две недели, заменить антибиотик решение с обычной питьевой воды. Разрешить 2-дневный антибиотиками период отдыха перед оральной инфекцией.
- Загрузите P. gingivalis / подвески транспортного средства в 1 мл туберкулиновые шприцы с прикрепленным подачи иглы. Вручную сдерживать мышь, захватывая загривок на задней шею. Убедитесь, сцепление достаточно фирма, чтобы ограничить подвижность головы мыши.
- Infect мышей путем местного применения P. gingivalis в щечной поверхности челюстных костей. Расположите кормления иглы такой тхаT совмещена с щечной поверхности правой верхней челюсти коренных зубов и извлечения 50 мкл бактериальной суспензии. Дисперсные раствор осторожно вдоль десны в течение 1 мин с использованием шар на игле подачи.
- Разрешить мышь, чтобы отдохнуть в течение 30 сек до 1 мин до повторения процедуры на левой челюсти. Контрольные мыши получают предварительную обработку антибиотиками и желудочный зонд только наполнитель (2% карбоксиметилцеллюлозные в PBS).
- Для изучения патогенов, вызванной хроническим воспалением в местных сайтов индуцированных альвеолярного потеря костной массы, заражая мышам 3 раза в 2-дневными интервалами. Жертвоприношение мышей 6 недель спустя для оценки потери костной microCT.
- Для изучения патогенов, вызванной хроническим воспалением в местных и системных сайтов, заразить атеросклероза подверженных АРОЕ - / - мыши 5 раз в неделю в течение 3 недель.
ПРИМЕЧАНИЕ: Прогрессирование заболевания в безымянной артерии контролируется последовательный в естественных условиях МРТ. Мыши изображение в различных временных точках и пожертвовать 6-16 нед поздног. На момент жертвоприношения, оценки глобального атеросклеротического бремя по собственной анализа лица и определить альвеолярного потерю костной массы на microCT. Охарактеризовать атеросклеротические поражения по гистологии и иммуногистохимии.
3 Micro-компьютерная томография (microCT)
- Изготовление образцов
- Жертвоприношение мышей в нужной точке времени после заражения. Усыпить мышей СО 2 asphyxation или другим способом, утвержденным вивария учреждения.
Примечание: Сбор крови путем пункции сердца, отдельный сыворотки, и хранить при -80 ° С в течение анализа анти-IgG P.gingivalis, как описано в другом месте 9. - Используйте большую пару обезглавливания ножницами к тяжелой головы мыши на основания черепа. Снимите мясо с парой щипцов и поместите череп в 50 мл коническую трубку с 30 мл 4% буферном параформальдегиде. Закрепите образец для 24 - 48 ч при 4 ° С.
- После фиксации Rinsэлектронной образец тщательно с PBS.
- Создать гайморовы блоков биопсии.
- Храните полугидрата челюсть в гистологической класса 70% этанола при 4 ° С до оценки по microCT.
- Жертвоприношение мышей в нужной точке времени после заражения. Усыпить мышей СО 2 asphyxation или другим способом, утвержденным вивария учреждения.
- Приобретение изображения
- Выполните приобретения изображений, используя настольные microCT сканер. Установка рентгеновского источника в токе 114 мкА и напряжении 70 кВ. Загрузите индивидуальный полугидрата Максиллы в визуализации судна и сканировать с разрешением 12 мкм во всех трех пространственных измерениях.
ПРИМЕЧАНИЕ: Загрузите несколько полугидрата Максиллы одновременно в визуализации судна. - Выполните предварительный низким разрешением сканирования, которая позволяет пользователю, чтобы очертить границы для получения изображений и ограничить сканирование в области процентной (ROI) с помощью системы.
ПРИМЕЧАНИЕ: интенсивность эмали делает венец верхних моляров легко различимы. Используя моляров в качестве ориентира свободно установить границы визуализации, чтобы охватить три коренные зубы и окружающую альвеолярную бонэ. Эта функция также используется для различения индивидуального геми-максилл при сканировании нескольких образцов в пределах того же судна. - После завершения сканирования, преобразовать необработанные файлы изображений (.ISQ) в высококачественные dicoms (.DCM).
- Выполните приобретения изображений, используя настольные microCT сканер. Установка рентгеновского источника в токе 114 мкА и напряжении 70 кВ. Загрузите индивидуальный полугидрата Максиллы в визуализации судна и сканировать с разрешением 12 мкм во всех трех пространственных измерениях.
- Анализ изображений
В этом протоколе, анализ изображений производится с помощью визуализации данных, обработки и анализа программного обеспечения. Во-первых, использовать морфологические ориентиры для создания плоскость наилучшего для цементно-перехода (CEJ). Затем с помощью превратить полугидрата челюсть в стандартной ориентации для последующего измерения альвеолярного объема кости.- Откройте программу и нажмите кнопку "Открыть данных", расположенную в верхнем левом углу бассейна. Кроме того, использование File> Open Data.
- Выберите стека изображений DICOM и нажмите кнопку Загрузить. Появится окно DICOM погрузчик. Нажмите кнопку ОК.
- Соблюдайте установленные как зеленый значок в бассейне данные. Обратите внимание, что при нажатии на объект данных вызывает дополнительное, нотонн, которое будет отображаться в области кнопки в верхней части бассейна. Выбор значка также вызывает некоторую информацию о записи данных, который будет отображаться в области Свойства.
- Каждая иконка в бассейне, предоставляет выпадающее меню, в котором различные модули могут быть выбраны. Активируйте всплывающее меню, нажав на белой стрелкой в правом углу иконы данных. Под модулем дисплея, выберите изоповерхности (Дисплей> изоповерхности). Isosurface Иконка появится в бассейне. При выборе появляются дополнительные настройки в области Свойства.
- Установите Draw Style к прозрачным и порог к 2000. Убедитесь, что компактифицировать и Downsample кнопки выбираются по опционам. Под Средняя, обеспечить х, у, г все готово для 2 Нажмите Применить для создания изоповерхность.
ПРИМЕЧАНИЕ: Соблюдайте прозрачный 3D-реконструкция полугидратом челюсти в 3D-просмотра. Преимущество использования прозрачный стиль рисования для реконструкции изображения является то, что корни моляров можетбыть легко идентифицированы. Это будет важно при вводе образца в стандартной ориентации. - Выберите зеленый значок данных и в области Свойства выберите значок урожая. Соблюдайте окно, отображающее размеры и координаты данных. Отложите это на данный момент. Обратите внимание, что появится ограничительная рамка в 3D-просмотра с зелеными вкладок в каждом углу.
- Выберите кнопку взаимодействуют в панели инструментов средства просмотра. Изменить размер ограничительной рамки, перетащив на зеленых уголков. Убедитесь, что окно охватывает область интереса (ROI) и устраняет столько мертвое пространство и мусора, как это возможно. Это позволит снизить вычислительную нагрузку на компьютер.
- Используйте кнопку трекбол в панели инструментов средства просмотра, чтобы повернуть объект в 3D-просмотра, обеспечивающей рентабельность инвестиций полностью охватываются ограничительной рамки. Когда удовлетворены, нажмите кнопку ОК в окне урожая отмененного в шаге 8.
- Выберите значок данных и под модулем дисплея выберите Oblique Slice (OBS). (Дисплей> OBS)
- Выберите OBS. В области свойств, установить тип отображения для линейных, диапазон окна данных от -200 до 10000, и взятие проб для лучших. Теперь выберите вращаться под опций. Соблюдайте поворота переключатель в центре OBS.
- Выберите кнопку взаимодействуют в панели инструментов средства просмотра и использовать маркеры переключатель для регулировки плоскости резания среза. Создать сагиттальный, что идет параллельно корней зубов и перпендикулярно к жевательной поверхности зубов. Самолет должен пополам три коренные зубы (M1-M3), как показано на рисунке 2.
- Выключите вращаться и дублировать OBS (объект> дубликат объекта). Новый OBS появится под названием OBS 2. Включите поворота на для OBS 2.
- Используйте поворота рукоятки переориентировать OBS 2 так, чтобы она была перпендикулярна с OBS 1 (рисунок 2).
- Включите повернуть прочь для OBS 2 и создать 3 дубликаты ломтики. Они будут называть OBS 3, 4 и 5.
- Выбор Очки для плоскости наилучшего соответствия
ПРИМЕЧАНИЕ: Шаги 3.4.1-3.4.5 описать расположение 8 баллов по CEJ создает плоскость наилучшего. Выберите четыре из точек из сагиттальных и других четырех из корональных ломтиками (рисунок 3). При выборе точки, расположенные на сагиттальных в разделе 3.4.6, это может быть необходимо для регулировки OBS 1.- Совместите OBS 1 с центром самой медиальной корне M1 в сагиттальной плоскости. Выравнивание OBS 2 с центром наиболее медиальной корень М1 в корональной плоскости.
- Выравнивание OBS 3 с центром в щечно-дистальный корень М1 в корональной плоскости. При необходимости отрегулируйте OBS 1 так, чтобы она примерно в середине с щечно-дистального корня M1 в сагиттальной плоскости при выборе очков в шаге 20.
- Совместите OBS 4 с развилки щечной корней М2. OBS 4 следует по центру между щечно-медиальных и щечно-дистального корней М2. При необходимости отрегулируйте OBS 1 так, чтобы она находилась приблизительно в центре остроумиеч щечно-дистальный М2 в сагиттальной плоскости при выборе очков в шаге 20
- Отрегулируйте OBS 5 так, что он работает по центру M3 в поперечной плоскости. При необходимости отрегулируйте OBS 1 так, чтобы она примерно в середине с наиболее дистальной корне M3 в сагиттальной плоскости при выборе очков в шаге 20.
- Дубликат любой из OBSS (OBS 6) и выберите нужным точек в окне свойств. Нужным точкам тумблером позволяет исследователю выбрать 3 или больше очков на 2D или 3D объектов в зрителя, а затем вычисляет плоскость наилучшего. В этом случае 2D OBSS, описанные в предыдущих шагах используется для выбора 8 точках вдоль CEJ.
- Скрыть OBS 6 из 3D-просмотра, нажав на оранжевом поле в правом углу иконы данных. Скрыть изоповерхность от 3D-просмотра, чтобы сделать CEJ видны на всех 2D ломтиками. Shift-клик и выбрать 8 очков по CEJ, как описано выше.
ПРИМЕЧАНИЕ: Если ключ Сдвиг не удерживается при выбореточки, самолет автоматически будет рассчитываться после первых трех пунктов. - После выбора всех 8 очков, сделать OBS 6 видно. Отметим, что это осевое ломтик, который работает приблизительно параллельно окклюзионной плоскости.
- Трансформация и переориентация ПРИМЕЧАНИЕ: самолет наилучшего соответствия используется для преобразования данных в стандартной ориентации для последующих измерений объема.
- Нажмите на иконку Data> Compute> ApplyTransform. Значок ApplyTransform появляется в бассейн. Отметьте белый квадрат в углу значка ApplyTransform выберите ссылкой, и нажмите на OBS 6.
- В области Свойства выберите стандарт для метода интерполяции и продлен режим. Применить трансформацию.
- Создайте изоповерхность и корональной OBS для нового файла данных. Поворот OBS в осевом направлении таким образом, что она приблизительно перпендикулярно с M1 (показано на фиг.2). Используйте створок коренного зуба и прикуса Curvatures в качестве руководства.
- Используйте этот самолет для преобразования данных, как на этапах 3.5.1 и 3.5.2. Сохранить преобразованный файл данных.
- Сегментация и Кость Измерение объема
ПРИМЕЧАНИЕ: Приведенные ниже шаги описывают сегментацию и измерение альвеолярной кости. Ломтик соответствующая плоскости наилучшего для CEJ идентифицируется и базовая плоскость выбирается. Альвеолярного костного между CEJ и опорной плоскости на щечной поверхности моляров сегментирован и измерить. Наиболее мезиальная равен М1 и самый дистальный М3 служить конечных ориентиров. Установка базовой плоскости 15-20 ломтиков ниже CEJ дает оптимальные результаты. Включение дополнительных ломтиками вводит изменчивость что маски различия в объеме костной между группами лечения.- Откройте редактор Сегментация и создать новый ярлык для преобразованных данных.
- Создайте новый материал и назовите его альвеолярной кости.
- Под зумом и данных Window, установить диапазон данных сюдам -200 до 10000.
- Под дисплеем и маскировки выберите 2D перекрестие, 3D MPR и 3D объемные оказания иконки. Установите диапазон данных от 2500 до 8000. Включить маскировку данных.
- Выберите настройку из панели инструментов средства просмотра дисплей Четыре зрителей. Дисплей разделен на четыре квадранта, позволяющих одновременное рассмотрение сагиттальной, корональной и осевой стеки, а также 3D-визуализации объема.
- Используйте все четыре квадранта для определения последнего кусочек, где эмаль видно на щечной лицах М1 и М3. Это расположение соответствует плоскости наилучшего для CEJ. Запишите осевой номер слайса.
- В осевой плоскости, продолжают 15-20 ломтиков в сторону альвеолярного гребня. Это представляет собой опорную плоскость.
- Используйте любую комбинацию сегментации инструментов, чтобы выбрать альвеолярной кости на щечной поверхности моляров между CEJ и плоскости отсчета. Используйте наиболее Мезиальный корень M1 и наиболее дистальной корень M3 в качестве ориентиров конечных.
- Когда удовлетворены, добавления выбранного объекта альвеолярной кости под списком материалов.
- Вернуться на пул объектов. Новый значок с расширением ".Labels" должен быть приложен к иконе данных изображения. Выберите значок этикетках и в выпадающем меню выберите Материалы> MaterialStatistics.
- В области свойств выберите Материал и нажмите применить. Таблица отображающий несколько параметров для каждого материала в списке материалов. Запишите объем альвеолярной кости.
4 Оценка атеросклероза
- Расслоение аорты
- Жертвоприношение мыши по CO 2 удушья в нужной точке времени после заражения.
- Наведите на спинной стороне, ленты вниз и протрите мышь с 70% этанола. Разрежьте кожу на брюшной стороне с середины живота чуть выше xyphoid процесса.
- Разрежьте кожи живота, пока xyphoid процесс не видно. Поднимите xyphoid процесс с небольшим годовыхИК щипцов, сделать надрезы на обе стороны грудной клетки, и сократить диафрагму. Затем сделайте два надреза вниз обе стороны грудной клетки, чтобы разоблачить сердце.
- Обескровить мыши с помощью 27 G инсулиновый шприц помещен в вершины правого желудочка. Во время сбора крови, периодически поворачивать иглу, чтобы предотвратить блокирование открытия на стенки желудочка. Как правило, 0,8 - 1 мл крови могут быть получены с помощью этого метода.
- SUP> Примечание: Отдельный сыворотки и хранить при -80 ° С в течение анализа анти-IgG P.gingivalis, как описано в другом месте 9
- Используйте ножницы, чтобы удалить правое предсердие.
- Найдите левого желудочка на задней стороне сердца. Ввести 21 G иглу в верхушке левого желудочка, со скосом иглы был обращен к центру камеры и медленно промойте систему кровообращения с 3 - 5 мл тканей фиксатора.
- Обрезать жир и тимус вокруг сердца.
- Снимите луNGS.
- Найдите дуги аорты с тремя ветвями и убрать жир вокруг слоев для лучшего воздействия.
- Продолжить рассечение аорты от дуги к основанию мембраны.
- Снимите печень и вытеснять ткани кишечника выставить нисходящей аорты. Проанализируйте дистальных аорты до ветвей почечной артерии.
- Нарежьте почечных артерий и продолжить разбор до подвздошной бифуркации.
- После того, как аорта свободен от большинства соединительной ткани, возвращают в верхнюю часть аорты и отрезать очень верхнюю часть трех ветвей от выше сердца аорты.
- Пил сердце вверх, отрезая, лежащие в основе жировых тканей для отделения сердце из тела.
- Держите сердце пинцетом и вытащить вверх, резки соединительной ткани, которая может все еще быть прикреплены, и продолжать двигаться к почкам и следовать до ног и СНиП на самой нижней точки.
- Закрепить аорты в 10% формалине в течение 1 часа с subseQuent PBS мыть в течение 1 часа. Кроме того, магазин аорты в 10% формалине O / N, промыть в PBS на следующий день и продолжить вскрытия.
- Место аорты в 10 см чашку Петри, содержащую PBS.
- Использование рассекает сферу, аккуратно удалите адвентициальные ткани от аорты.
- Когда аорты свободен от лишнего жира и ткани, отрезать нижние две трети сердце. Начать пилинга сердечной мышцы далеко в конце сердца, противоположной дуге аорты. Луковица аорты следует медленно появляются, который будет белым в окраске.
- Продолжить тщательного вскрытия с помощью двух щипцов до аорты луковицы свободны от сердца мышечной ткани.
- Поместите очищенный аорты в черную рассекает лоток и крышка с PBS.
- Закрепление из аорты
- Держите аорты покрытый PBS в течение закрепления.
- Положите аорты в анатомическое положение с луковицы аорты слева.
- Поместите временные флажки minutien в 5 местах, начиная с 1) начало аорты, 2) ниже третьегофилиал арки, 3) на полпути из нисходящей аорты 4) вблизи нижнего конца нисходящей аорты 5) выше филиала бедренной артерии.
- Использование дополнительных прекрасным весенним ножницы, разрезать левую сторону аорты, начиная с левой ветви бедренной артерии на всем пути до аорты ниже самой низкой филиала восходящей аорты.
- Вырезать из влево стороне низкой аорты лампочки в расщелину и продолжить вырезать достичь пересечение разреза вдоль вертикального разреза аорты.
- Сокращение через аорту горизонтально, чтобы достичь точки низкой филиала восходящей аорты
- Вырезать вверх по правой стороне выше самой высокой ветви аорты.
- Разрежьте каждый филиал, чтобы выставить свою внутреннюю поверхность.
- Снимите часть временных штифтов и заменить постоянных штифтов с целью сковав все аорту в анатомической локализации без складывания, растяжения аорты. Цель заключается в подвергайте внутреннюю поверхность аорты.
- Продолжить закрепления, пока все Внутренняя поверхность аорты не подвергается и четко видны сверху и без визуального междунарerference с контактов.
- Липидов Окрашивание и поражений Количественное
- Подготовьте Судан IV красящий раствор (5 мг / мл в 70% изопропанола). Все хорошо перемешать и отфильтровать для обеспечения кристаллы не присутствуют.
- Обложка возлагали аорты в Судане IV решения в течение 50 мин.
- Промыть 70% изопропанола для 1 - 5 мин. Аккуратно промойте аорты с ddH20 пока вода сходит аорты больше не красный.
- Крышка аорты с PBS. Захват изображения аорты с высоким разрешением камеры, подключенной к вскрытии микроскопом и сохранить как файлы цифровых изображений (в формате tif). Поместите линейку рядом с каждым изображением, чтобы помочь в калибровке.
- Использование программного обеспечения ImageJ чтобы определить площадь интиме и области поражений. Вручную проследить поверхность интимы определить область. Площадь поражения можно рассчитать, используя автоматизированную цвет порога. Это требует установки порога определить интенсивность цвета, что дискриминирует поражения от нормальных областей.
- Вычислить процентинтимы поверхность покрыта атеросклеротических поражений.
5 гистологических атеросклеротических поражений
- Заготавливают дуги аорты с сердечной ткани и погрузиться в октябре в одноразовом базовой формы.
- Собирают 5 мкм последовательные криосрезов каждые 50 мкм в синусе аорты и подвздошной артерии, использу криостат установлен на уровне -17 ° С и смонтировать срезах тканей на предметных стеклах. Магазин скользит при -20 ° С до дальнейшего использования.
- Для гистологических, пятно с гематоксилином и эозином, используя соответствующие процедуры.
6 Иммуногистохимический Характеристика атеросклеротических поражений.
В приведенных ниже рекомендациях изложена используемые протокол общего основе антител обычно для оценки атеросклеротических поражений в P. gingivalis -infected мышей. Этот протокол требует оптимизации для каждого антитела или реагента.
- Удалить слайды из морозильника и исправитьв течение 2 мин в ледяной фиксатора (ацетон или другой фиксатора).
- Разрешить слайды приехать в РТ и этикетка с сопротивляющейся карандаш с растворителем.
- Промыть слайды 3 раза в PBS для удаления тканей замораживания матрицы
- Блок активности эндогенной пероксидазы путем инкубации слайды в 0,3% H 2 O 2 решение в PBS в течение 10 мин.
- Промыть слайды 3 раза в PBS в течение 2 мин каждый раз.
- Блок неспецифическое связывание путем инкубации в блокирующем буфере (10% сывороткой кролика в PBS) в течение 30 мин при комнатной температуре.
- Развести первичных антител 1:50 в 10% сыворотки кролика.
- Нанесите разбавленный антитела к срезах тканей на слайде.
- Инкубировать в течение 1 часа при комнатной температуре.
- Промыть 3 раза скользит в PBS в течение 2 мин каждый.
- Развести против крысиного биотинилированного вторичного антитела 1: 100 в 10% сыворотки кролика.
- Применить к срезах тканей на слайде и выдержать в течение 30 минут при комнатной температуре.
- Промыть 3 раза скользит в PBS в течение 2 мин каждый.
- Подготовьте DAB раствора субстрата, добавив1 каплю хромогена DAB к каждому 1 мл буфера DAB.
- Слейте PBS с горок и применить раствор субстрата DAB. Разрешить слайды для инкубации в течение 5 мин или до желаемого интенсивность цвета достигается.
- Промывочный 3x в воде в течение 2 минут каждый.
- Счетчик пятно гематоксилином.
- Дегидрировать через 4 изменений алкоголя (95% 1 мин, 95% 1 мин, 100% 1 мин и 100% 5 мин).
- Ясно в 3 изменений ксилола.
- Покровное использовать монтажный решение и проанализировать качественно микроскопии. Для количественного анализа, как получить изображения, рассчитать окрашивания зона с ImageJ с использованием автоматизированной порог.
7 МРТ
- Подготовка животных для МРТ
- Обезболить мышей до экспериментов МРТ. Задайте начальную индукцию анестезии с помощью 4% испарившийся изофлуораном в течение 2-3 мин в индукционной камере. Поддержание анестезии в течение периода формирования изображения с помощью непрерывного потока 0,5 - 2% испаряется изофлуораном delivereд через настройку нос конуса или маску.
- После достижения хирургического плоскость анестезии (т.е. без ног отклика щепотка), поместите курсор в держатель животного с его носа, вставленной в носовом обтекателе. Есть несколько типов коммерчески доступных держателей животных, которые могут быть использованы, чтобы свести к минимуму потенциальный движение во время съемки. Мы используем специально созданных держатель с руст.
- Монитор дыхания и сердечного цикла и синхронизации с захвата изображений с использованием дыхания подушку (помещается на живот мыши), оснащенный небольшой системы мониторинга животного и селекции.
- Закрепите мышь и системы мониторинга на держатель животного с лабораторной пленкой.
- МРТ сбора данных
- Установите держатель животного с головой мыши первого в положении лежа на спине в 30 мм вертикальной зонда (Micro 2.5) поддерживается при 23 ° С и в вертикаль-родила 11,7 T МРТ сканера.
- Совместите держатель с центром тон РЧ катушку.
- Провести процесс прокладок с использованием одного последовательность импульсов.
- Использование редкая последовательность, приобретать разведчиков изображения вдоль трех ортогональных ориентаций создать осевые, корональной и сагиттальной изображения.
- Выполните низкого разрешения Магнитно-резонансная ангиография (МРА), используя эхо последовательность ungated 3D градиента со следующими параметрами: толщина плиты = 1,5 см; флип угол = 45 °; Время следования = 20 мс; время эхо = 2,2 мс; поле зрения = 1,5 × 1,5 × 1,5 см; матрица = 64 × 64 × 64; количество среднего = 1 Общее время сканирования: 2~3 мин. Цель этой проверки является обеспечение того, изображения получены в целевой области (безымянной артерии).
- Выполните высокое разрешение КМА безымянной артерии с эхо последовательности ungated 3D градиента, используя следующие параметры: толщину плиты = 1,5 см; флип угол = 45 °; Время следования = 20 мс; время эхо = 2,2 мс; поле зрения = 1,5 × 1,5 × 1,5 см; матрица = 128 &# 215; 128 × 128; количество среднего = 4 Общее время сканирования было ~ 25 мин.
- Получить непрерывные осевые образы 0.5mm безымянной артерии ниже подключичной бифуркации.
- МРТ анализ данных
- Выполнение работ по реконструкции и анализа изображений с помощью обработки изображений, связанный со сканером. Достижение 3D-реконструкция изображений MRA по максимальной интенсивности Projection.
- С помощью подключичной бифуркацию в качестве анатомической маркера для выравнивания данных, полученных из разных мышей или же мыши в различные моменты времени. Выбор целевого поперечного сечения подвздошной артерии в 0.3- до 0,5 мм на расстоянии ниже subclavianbifurcation.
- Определить и рассчитать просвета площадь выбранного сечения с ImageJ. Измерения должны быть выполнены в слепым методом с помощью двух независимых наблюдателей. Проверьте воспроизводимость измерений путем расчета межклассовых коэффициенты корреляции.
- Для продольных исследованиях с серийным ИМАГIng, нормализуют просвета область в области полости трубчатого органа, полученного на исходном уровне (самое первое может в исследовании) для каждой мыши. Экспресс результаты как изменения просвета площади с течением времени.
- Выполните соответствующие статистические исследования (т.е., студент Т-тест) для определения существенных различий между экспериментальными группами.
Результаты
Используя соответствующую модель мыши и пероральный прием инфекции, П. gingivalis вызывает хроническое воспаление и иммунопатологии на местном (полости рта) и системные сайтов (артерии) (рисунок 1).
У мышей, устные инфицирование P. gingivalis вызывает локальную воспалительную реакцию, что приводит в разрушение зуба, поддерживающий альвеолярной кости 8. P. gingivalis -infected мыши развивают ответ антител сыворотки до этого организма, которые преимущественно изотипом IgG 9. Результаты, показанные на рисунке 4 являются представитель эксперимента, в котором C57BL / 6 были инфицированы P.gingivalis три раза в двух дневных интервалах и пожертвовал 6 недель спустя для оценки альвеолярной потери костной microCT. Объемный анализ с использованием программного обеспечения Amira показывает, что P. мышей gingivalis -infected проявляют значительную потерю костной массы по сравнению с неинфицированных управления (рисунок 4А). Визуальный осмотр реконструированного геми-максилл иллюстрирует увеличение площади открытой поверхности молярных корней в инфицированных мышей по сравнению с контролем (фиг.4В и фиг.4С).
При атеросклерозе, подверженных АроЕ - / - мышей, P. gingivalis вызывает хроническое воспаление, что приводит в альвеолярной потери костной массы 12 и воспалительную отложение бляшек внутри аорты синус 15 и безымянной артерии 11. P. gingivalis индуцированной атеросклероза происходит уже через 24 часа после последнего инфекции и может быть предотвращено путем иммунизации до заражения 16. Прогрессивная воспаление в безымянной артерии P. gingivalis -infected мышей можно контролировать живой мыши по сериала в естественных условиях МРТ в различные моменты времени после заражения (Рисунок 5). лица измерений En Судана IV окрашенных аорты показывает, что П. gingivalisинфекция значительно увеличивает отложение липидов и поврежденной области на поверхности интимы (Рисунок 6). На момент жертвоприношения, гистологии и иммуногистохимии можно использовать для качественно или количественно охарактеризовать атеросклеротические поражения в контексте клеточного состава, выражения различных антигенов, и содержания липидов. Иммуногистохимический анализ аорты поражений синуса показывает повышенную инфильтрацию макрофагов и повышенной экспрессии рецепторов врожденного иммунитета Toll-подобный рецептор 2 (TLR2) в P. gingivalis -infected мыши (рисунок 7).

Рис.1 П. gingivalis -индуцированных хроническое воспаление в местных и системных сайтов. До заражения P. мышей gingivalis являются administe красный антибиотики вволю в питьевой воде в течение 10-14 дней с последующим двухдневным период антибиотик отдыха. Лечение антибиотиками подавляет коренные устные флору и облегчает колонизацию. Для индукции альвеолярного потери, мышей, инфицированных три раза в два-дневными интервалами и альвеолярная кость объем измеряется через 6 недель после инфекции. При оценке атеросклероз, атеросклероз, подверженных АроЕ - / - мышей, как правило, инфицированы 5 раз в неделю в течение 3 недель и пожертвовал 16-24 недель после заражения. Прогрессивное воспаление в подвздошной артерии живых мышей может быть измерена путем последовательного ин виво МРТ в различные моменты времени после инфицирования. Гистологии и иммуногистохимии может быть использован для окрашивания для липидов и воспалительных клеток в завершении эксперимента для проверки данных изображения. На момент жертвоприношения, альвеолярного потеря костной массы измеряется microCT и глобальная атеросклеротическая бремя оценивается в ФАС окрашивания целых аорты. https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/51556/51556fig1highres.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
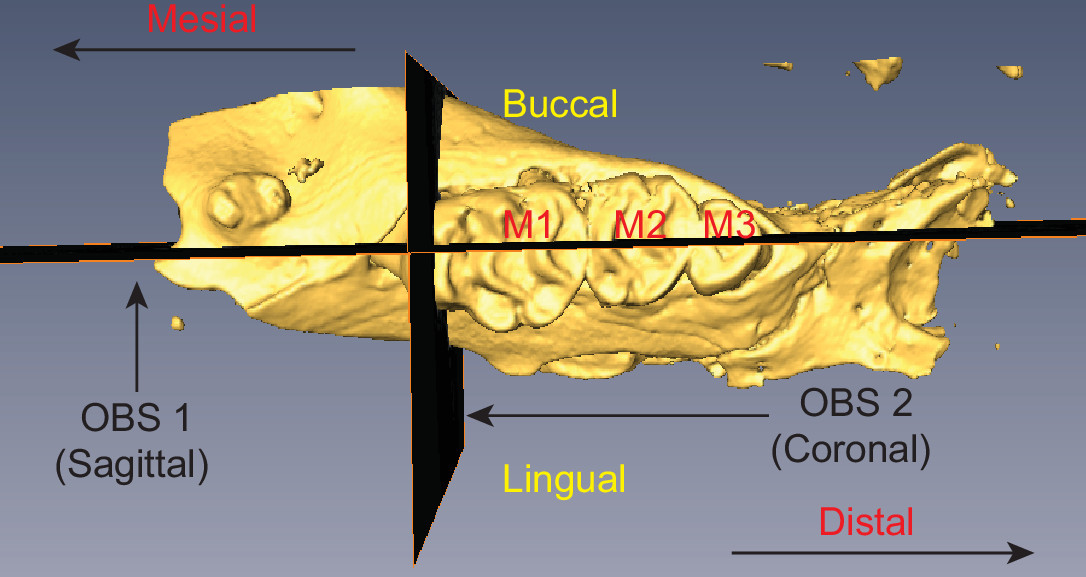
Рисунок 2 мышь полуизотактическую челюсть иллюстрирующая позиционирование OBS 1 и OBS 2 Три моляры помечены (M1-M3) и соответствующая анатомически терминология указывается. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3 Мышь полуизотактическую челюсть иллюстрирующая позиционирование OBS с 1 по 5.1556 / 51556fig3highres.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4 альвеолярного потеря костной массы, как измеряется microCT. Мужской C57BL / 6 перорально инфицированных P. gingivalis или транспортное средство в одиночку (неинфицированных) и альвеолярной объем кости оценивали по microCT 6 недель спустя, используя Amira. () альвеолярного объема кости в геми-челюстных костей от неинфицированных и P. gingivalis -infected C57BL / 6. Результаты представляют объем костной ткани над базовой плоскостью (120 мкм от CEJ). Данные выражены в виде объема костного SD от N = 8 мышей на группу. *** Р <0,001 по сравнению с неинфицированными управления. (В) и (С) представитель 3D реконструкции из геми-максилл из неинфицированных (B)и П. gingivalis -infected (C) мышей. Значительное снижение альвеолярного объема костной ткани можно увидеть в P. gingivalis -infected мышей по сравнению с неинфицированными. Стрелки указывают области, где видна потеря костной массы происходит в P. gingivalis -infected мышей (обратите внимание на увеличение площади открытой поверхности молярных корней). Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5 прогрессирующим воспалением в безымянной артерии после P. gingivalis инфекция, измеренная с помощью МРТ () представитель магнитного резонанса (МР) ангиограмма дуги аорты и крупных сосудов с АроЕ. -/ -. Мыши (B) Осевая МР изображение от желтой линии в компании безымянной артерии мыши, 0.3mm ниже ее бифуркации. Innominate артерии были обследованы по MRA в начале и в 12 и 16 недель после заражения. (C) временное изменение просвета области (мм 2) рассчитывали для отдельных мышей (п = 10-12 / группы). Неинфицированные АроЕ - / - (синий); П. gingivalis -infected АРОЕ - / -. (красный) Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
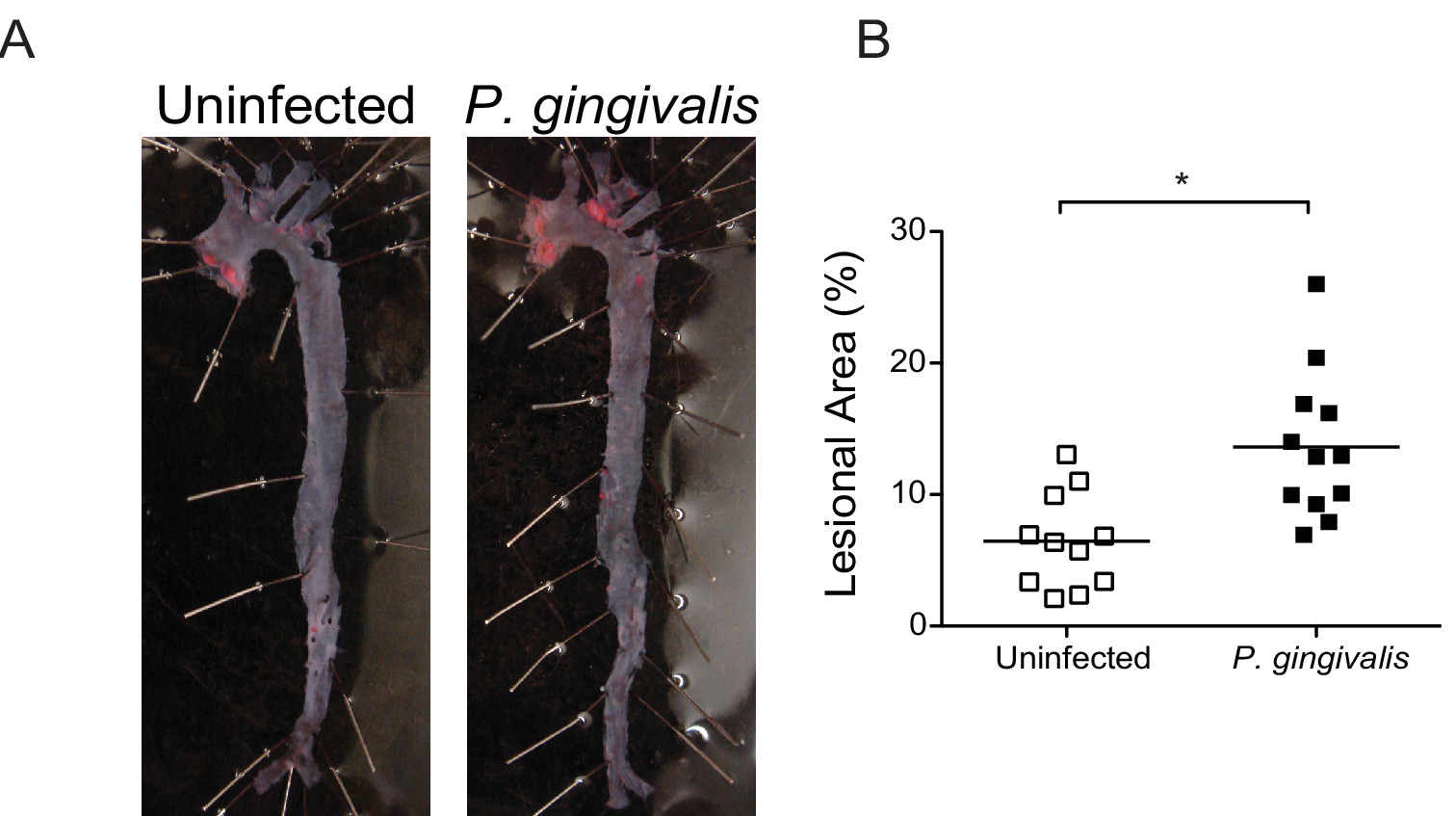
Рисунок определение 6 анфас рубцов области в целом аорты. () Судан IV окрашивание аорты анфас поражений 16 нед после инфицирования с P. gingivalis. (B) Количественная оценка содержания липидов в общем аорты неинфицированных (белые точки) и П. gingivalis -infected мышей (черные символы) (п = 10-13 / группа). Процент аорты занимают липидов была рассчитана с использованием ImageJ. * Р <0,05. Нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 7 Иммуногистохимический анализ аорты поражений пазухи Мужской АроЕ -. / - Мышей, получавших нормальную чау диеты были заражены P. gingivalis или неинфицированных и пожертвовал 16 недель после заражения. Криосрезы полученные из синуса аорты окрашивали антимыши F4 / 80 и TLR2. Шкала бар, 100 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
П. gingivalis устной инфекции модель представляет собой ценный инструмент для изучения возбудителя вызванной хроническим воспалением в местных и системных сайтов. Эта уникальная модель позволяет характеристику обоих хозяина и возбудителем конкретных механизмов, способствующих хронического воспаления и иммунопатологии. Кроме того, модель может быть использована для выявления новых терапевтических стратегий, включая иммунизацию и фармакологического вмешательства. Действия, описанные в данном протоколе описывают успешное применение этой модели и подробно методологии оценки инициирование, развитие и исход P. gingivalis -индуцированных хроническое воспаление.
Есть несколько важных аспектов, чтобы иметь в виду при использовании этого протокола изучить воспалительные потерю костной массы. Прежде всего, следует отметить, что по итогам инфекции P. gingivalis определяется тремя ключевыми факторами: 1) генетической восприимчивости к инфекциям 2) возбудителявирулентности (генетика патогена) и 3) в результате хост-патоген взаимодействие (взаимодействие двух геномов). Восприимчивость к P. gingivalis -индуцированных альвеолярного потеря костной массы определяется генетически у мышей, таким образом, необходимо соблюдать осторожность при выборе штамм мышей для изучения 17. Дифференциальные ответы принимающие среди инбредных линий мышей можно пользоваться для проведения вперед генетические экраны и охарактеризовать гены, участвующие в восприимчивы и сопротивления патогенов, вызванной хроническим воспалением. Кроме того, значительная неоднородность существует в способности различных P. gingivalis напрягается, чтобы побудить альвеолярной потери костной массы у мышей 18. Этот протокол использует мышей на C57BL / 6 фона из наличия трансгенных мышей и их восприимчивости к атеросклерозу. P. gingivalis штамм 381 индуцирует альвеолярного потерю костной массы и атеросклероза у мышей на C57BL / 6 фоне, и несколько бактериальные мутанты были разработаны с использованием Тхис штамм.
Мыши особенно устойчивы к атеросклерозу и развитие явных артериальных поражений требует использования генетически модифицированных мышиных моделях атеросклероза. Мы используем АроЕ - модель мыши, потому что это хорошо создана модель мыши атеросклероза, не требует подачу высоким содержанием жиров для формирования поражения, и повторяет многие аспекты человеческой болезни 19 - /. Тип диеты для кормления животных в ходе эксперимента является важной переменной. Для большинства нашей работы, мы кормим мышам нормальный чау диету, чтобы избежать вклад экзогенных липидов в интерпретации наших результатов. В предварительных исследованиях, мы обнаружили, что кормление мышам с высоким содержанием жира маски различия в анфас области очага поражения между неинфицированных и P. gingivalis -infected мышей в синусе аорты. Тем не менее, высоким содержанием жиров и P. gingivalis инфекция работа синергически, когда прогрессирование inflamция контролируется в Безымянная по МРТ или гистологии 11. У мышей, безымянной артерии имеет высокую степень прогрессии поражения, и поражения в этой экспресс артерии черты, характерные для клинической болезни у человека в том числе сосудов сужения, атрофических СМИ, периваскулярного воспаления и разрыва бляшки. Различия в клеточном составе поражений очевидны в различных анатомических областей. Макрофаги являются основными иммунные клетки проникают аорты поражений синуса, в то время как поражения артерий Innominate состоят из двух макрофагов и Т-клеток.
Экспериментальная продолжительность и время точка, в которой воспалительные конечные точки оцениваются дополнительные факторы, которые следует учитывать при оценке посвящение, прогрессирование и исход P. gingivalis -индуцированных атеросклероз. Мы ранее показали, что П. gingivalis -infected АРОЕ - / - мыши обнаруживают инфильтрацию макрофагов, повышенную экспрессию врожденных иммунных маркеров,й увеличена отложение зубного налета воспалительного уже в 24 часа после последнего инфекции в синусе аорты, и это может быть предотвращено путем иммунизации 16. В наших руках, воспаления и иммунопатологии увеличения с возрастом и очевидны до 24 недель после заражения. Тем не менее, решения, касающиеся продолжительности исследования в конечном счете, использование имеющегося гипотезы изучается, способ анализа и предварительных знаний о степени атеросклероза при определенных условиях окружающей среды.
Использование неинвазивных методов визуализации следить за прогрессивную воспаление в подвздошной артерии может быть использован, чтобы вести экспериментальную продолжительность. Серийный МРТ позволяет детальных исследований прогрессирования атеросклероза в том же животном, которые могут изображают сужение просвета артерии и малых судов, стеновых областях 20. В отличие от традиционных методов, таких как липидный окрашивание рассеченных сосудов, МРТ не требует эвтаназиии позволяет продольных исследований для оценки инициацию и прогрессирование атеросклероза. В сочетании с трансгенными мышами, бактериальных мутантов, или экспериментальных процедур, временная информация, предоставленная МРТ может использоваться для оценки эффекта принимающих генетики, факторов вирулентности патогена, и терапевтического вмешательства. В качестве дополнительного преимущества, гистологии и иммуногистохимии можно использовать для окрашивания для липидов и воспалительных клеток в завершении эксперимента для подтверждения данных, визуализации. Мы недавно использовали эти методы, чтобы продемонстрировать, что оральный инфекцию P. gingivalis ускоряет атеросклероз в безымянной arterties из АроЕ - / - мышей, что иммунизация обеспечивает защиту от прогрессирования бляшек, и коррелирует с уменьшением накопления липидов и воспалительных клеток 11.
Таким образом, этот протокол описывает шаги, необходимые для получения надежную модель патогенных вызванной хроническим воспалением, а такжекак методы, используемые для оценки воспаления в местных и системных сайтов. Помимо использования этой модели для изучения хозяина и возбудителем конкретные механизмы, участвующие в воспалительной потери костной массы и атеросклероза, он может быть адаптирован для изучения вклада патогена, вызванной хроническим воспалением к дополнительным моделей заболеваний. Это может быть достигнуто с помощью трансгенных мышиные модели болезни в том числе ревматоидный артрит, диабет и рак. Больше данных свидетельствует о том, что ряд хронических заболеваний неизвестной этиологии могут иметь инфекционных происхождение. Эти заболевания включают опухолевых, аутоиммунных, и воспалительные заболевания, и вместе скомпрометировать основных причин заболеваемости и смертности во всем мире. Таким образом, использование животных моделей для изучения роли патогенов в болезней обусловлено хроническим воспалением имеет потенциал для широкого терапевтического воздействия и улучшением диагностики.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Работа выполнена при поддержке Национального института аллергии и инфекционных заболеваний Грант P01 A1078894 к CAG
Материалы
| Name | Company | Catalog Number | Comments |
| Amira analysis software | Visualization Sciences Group | ||
| Anaerobic chamber DW Scientific Model MG500 | Microbiology International | ||
| BHI | Becton-Dickinson | 211059 | |
| Hemin | Sigma-Aldrich | 51280-5G | |
| Menadione (Vitamin K) | Sigma-Aldrich | M5625-25G | |
| Yeast Extract | Becton-Dickinson | 212750 | |
| Carboxymethyl cellulose (medium viscocity) | Sigma-Aldrich | C-4888 | |
| Sulfamethoxazole and trimethoprim oral suspension 200 mg/40 mg per 5 ml | Hi-Tech Pharmacal | NDC 50383-823-16 | |
| μCT 40 | Scanco | ||
| HistoChoice Tissue Fixative | Sigma-Aldrich | H2904 | |
| Sudan IV | Sigma-Aldrich | S4261-25G | |
| Vertical-bore 11.7T Avance spectrometer | Bruker | ||
| Paravision | Paravision | ||
| ImageJ | NIH | ||
| Rat anti-mouse F4/80 | Serotec | MCA497R | |
| Rat anti-mouse TLR2 | eBioscience | 13-9021-80 | |
| Leica S4 dissecting scope | Leica | ||
| Microm HM 550 cryostat | Microm |
Ссылки
- Nathan, C., Ding, A. Nonresolving Inflammation. Cell. 140 (6), 871-882 (2010).
- Karin, M., Lawrence, T., Nizet, V. Innate immunity gone awry: linking microbial infections to chronic inflammation and. 124, 823-835 (2006).
- Connor, S. M., Taylor, C. E., Hughes, J. M. Emerging infectious determinants of chronic diseases. Emerging Infectious Diseases. 12 (7), 1051-1057 (2006).
- Barth, K., Remick, D. G., Genco, C. A. Disruption of immune regulation by microbial pathogens and resulting chronic inflammation. Journal of Cellular Physiology. , (2012).
- Hayashi, C., Gudino, C. V., Gibson, F. C. 3rd, Genco, C. A. Review: Pathogen-induced inflammation at sites distant from oral infection: bacterial persistence and induction of cell-specific innate immune inflammatory pathways. Molecular Oral Microbiology. 25 (5), 305-316 (2010).
- Gibson, F. C. 3rd, Ukai, T., Genco, C. A. Engagement of specific innate immune signaling pathways during Porphyromonas gingivalis induced chronic inflammation and atherosclerosis. Frontiers in Bioscience: a Journal and Virtual Library. 13, 2041-2059 (2008).
- Pihlstrom, B. L., Michalowicz, B. S., Johnson, N. W. Periodontal diseases. Lancet. 366 (9499), 1809-1820 (2005).
- Baker, P. J., Evans, R. T., Roopenian, D. C. Oral infection with Porphyromonas gingivalis and induced alveolar bone loss in immunocompetent and severe combined immunodeficient mice. Archives of Oral Biology. 39 (12), 1035-1040 (1994).
- Baker, P. J., Carter, S., Dixon, M., Evans, R. T., Roopenian, D. C. Serum antibody response to oral infection precedes but does not prevent Porphyromonas gingivalis-induced alveolar bone loss in mice. Oral Microbiology and Immunology. 14 (3), 194-196 (1999).
- Gibson, F. C. 3rd, Hong, C., et al. Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice. Circulation. 109 (22), 2801-2806 (2004).
- Hayashi, C., Viereck, J., et al. Porphyromonas gingivalis accelerates inflammatory atherosclerosis in the innominate artery of ApoE deficient mice. Atherosclerosis. 215 (1), 52-59 (2011).
- Hayashi, C., Madrigal, A. G., et al. Pathogen-mediated inflammatory atherosclerosis is mediated in part via Toll-like receptor 2-induced inflammatory responses. Journal of Innate Immunity. 2 (4), 334-343 (2010).
- Hayashi, C., Papadopoulos, G., et al. Protective role for TLR4 signaling in atherosclerosis progression as revealed by infection with a common oral pathogen. Journal of Immunology (Baltimore, Md.: 1950). 189 (7), 3681-3688 (2012).
- Papadopoulos, G., Weinberg, E. O., et al. Macrophage-Specific TLR2 Signaling Mediates Pathogen-Induced TNF-Dependent Inflammatory Oral Bone Loss. The Journal of Immunology. , (2012).
- Gibson, F. C. 3rd, Hong , C., et al. Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice. Circulation. 109 (22), 2801-2806 (2004).
- Miyamoto, T., Yumoto, H., Takahashi, Y., Davey, M., Gibson, F. C. 3rd, Genco, C. A. Pathogen-accelerated atherosclerosis occurs early after exposure and can be prevented via immunization. Infection and Immunity. 74 (2), 1376-1380 (2006).
- Baker, P. J., Dixon, M., Roopenian, D. C. Genetic control of susceptibility to Porphyromonas gingivalis-induced alveolar bone loss in mice. Infection and Immunity. 68 (10), 5864-5868 (2000).
- Baker, P. J., Dixon, M., Evans, R. T., Roopenian, D. C. Heterogeneity of Porphyromonas gingivalis strains in the induction of alveolar bone loss in mice. Oral Microbiology and Immunology. 15 (1), 27-32 (2000).
- Daugherty, A. Mouse models of atherosclerosis. The American Journal of the Medical Sciences. 323 (1), 3-10 (2002).
- Weinreb, D. B., Aguinaldo, J. G. S., Feig, J. E., Fisher, E. A., Fayad, Z. A. Non-invasive MRI of mouse models of atherosclerosis. NMR in Biomedicine. 20 (3), 256-264 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены