Method Article
Un modello di topo per patogeni indotta infiammazione cronica a siti locali e sistemici
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Modelli animali hanno dimostrato di essere strumenti preziosi nella definizione di accoglienza e patogeni meccanismi specifici che contribuiscono allo sviluppo di infiammazione cronica. Qui si descrive un modello murino di infezione orale con il patogeno umano Porphyromonas gingivalis e le metodologie di dettaglio per valutare la progressione di infiammazione nei siti locali e sistemiche.
Abstract
L'infiammazione cronica è una delle principali cause di danni ai tessuti patologici e una caratteristica unificante di molte malattie croniche negli esseri umani compresi neoplastiche, autoimmuni e malattie infiammatorie croniche. Emergenti evidenze implica patogeno-indotta infiammazione cronica nello sviluppo e nella progressione delle malattie croniche con una grande varietà di manifestazioni cliniche. A causa della eziologia complessa e multifattoriale di malattia cronica, la progettazione di esperimenti per la prova della causalità e la creazione di legami meccanicistici è quasi impossibile negli esseri umani. Un vantaggio di utilizzare modelli animali è che entrambi i fattori genetici e ambientali che possono influenzare il decorso di una malattia particolare possono essere controllati. Pertanto, la progettazione di modelli animali rilevanti di infezione rappresenta un passo fondamentale nell'identificazione di accoglienza e patogeni meccanismi specifici che contribuiscono a infiammazione cronica.
Qui si descrive un modello murino di patogeno-indotta INFLA cronicammation a siti locali e sistemici dopo l'infezione con il patogeno orale Porphyromonas gingivalis, un batterio strettamente associato alla malattia parodontale umano. Infezione orale di specifico patogeno topi libero induce una risposta infiammatoria locale con conseguente distruzione del dente di sostegno dell'osso alveolare, un segno distintivo della malattia parodontale. In un modello murino di aterosclerosi consolidata, infezione da P. gingivalis accelera infiammatorio deposizione di placche all'interno del seno aortico e dell'arteria innominata, accompagnata dalla attivazione dell'endotelio vascolare, un aumento infiltrato di cellule immunitarie, ed elevata espressione di mediatori infiammatori all'interno lesioni. Siamo dettaglio le metodologie per la valutazione di infiammazione nei siti locali e sistemiche. L'uso di topi transgenici e mutanti batterici definiti rende questo modello particolarmente adatto per l'identificazione sia host e fattori microbici coinvolti nella iniziazione, progressione, e l'esito della malattia. Additionally, il modello può essere usato per individuare nuove strategie terapeutiche, tra cui la vaccinazione e di intervento farmacologico.
Introduzione
L'infiammazione cronica è una delle principali cause di danni ai tessuti patologici e una caratteristica unificante di molte malattie croniche negli esseri umani. Queste malattie includono neoplastiche, autoimmuni e malattie infiammatorie croniche 1. L'eziologia di molte malattie croniche è ancora chiaro, ma è inteso come complesso e multifattoriale, che coinvolge sia la predisposizione genetica e l'introduzione di fattori ambientali. Mentre i continuatori di infiammazione rimangono elusivi, i profili cellulari e molecolari di attivazione immunitaria si sovrappongono considerevolmente con quei modelli osservati in risposta dell'ospite ai patogeni 2.
Prove di montaggio implica infezione da agenti patogeni microbici nello sviluppo e progressione di infiammazione cronica e le sue diverse manifestazioni cliniche 2,3. Gli agenti patogeni possono indurre e sostenere l'infiammazione cronica direttamente dal sovvertire il sistema immunitario dell'ospite e infezioni persistenti 4. In assenza di persistenza batterica, infezione può precipitare infiammazione cronica da reazioni autoimmuni innescati da mimetismo molecolare di auto-antigeni, cambiamenti di auto-antigeni che li rendono immunogenico, o danni che rilascia antigeni ospitanti precedentemente mascherati. Raramente però hanno patogeni specifici state identificate come la causa universale di una particolare malattia cronica. Piuttosto, la maggior parte dei dati disponibili suggeriscono che i patogeni usano meccanismi distinti per suscitare l'infiammazione cronica con un ampio spettro di manifestazioni cliniche e gli esiti della malattia in soggetti geneticamente suscettibili 3. Così, una comprensione dettagliata dei meccanismi attraverso i quali patogeni specifici indurre l'infiammazione cronica può avere importanti implicazioni per la salute pubblica, nonché il trattamento e la prevenzione di molte malattie croniche.
Anche se gli ospiti e patogeni meccanismi specifici che contribuiscono alla preparazione e alla manutenzione di infiammazione cronica sonopoco conosciuti, i progressi nella modellazione di patogeno-indotta infiammazione cronica hanno iniziato ad approfondire la nostra comprensione di questi processi. Il P. gingivalis modello di infezione orale è un unico, modello ben caratterizzato topo di infiammazione cronica patogeno-indotta che permette l'analisi di host e di patogeni meccanismi specifici che contribuiscono a infiammazione cronica a livello locale (perdita di tessuto osseo orale) e siti sistemiche (aterosclerosi) 5,6.
P. gingivalis è un agente patogeno orale anaerobi Gram-negativi implicati nella malattia parodontale umano, una malattia infiammatoria cronica infezione-driven caratterizzata dalla distruzione di tessuti di sostegno del dente 7. Oltre alla patologia nel sito iniziale di infezione, prove accumulando implica P. gingivalis indotta infiammazione cronica nello sviluppo e nella progressione delle malattie sistemiche, tra cui l'aterosclerosi 5, una malattia caratterizzata da inflammatio cronican della parete del vaso arterioso. Infezione orale di specifico patogeno topi gratuito con P. gingivalis induce una risposta infiammatoria locale che si traduce in distruzione del dente di sostegno dell'osso alveolare 8. P. gingivalis può essere recuperato dalla bocca di topi infetti fino a 42 giorni dopo l'infezione 8 e topi sviluppano elevati livelli di titoli anticorpali sierici specifici dell'agente patogeno e 9. In un modello murino di aterosclerosi stabilita utilizzando Apolipoproteina-E - / - mice (ApoE - / -), l'infezione orale con P. gingivalis induce infiammazione cronica infiammatoria che spinge la placca deposizione all'interno del seno aortico 10 e l'arteria innominata 11. Infiammazione progressiva all'interno dell'arteria innominata di P. gingivalis -infected topi possono essere monitorati in animali vivi in vivo utilizzando la risonanza magnetica. Istologico, le lesioni arteriose da P. gingivalis -infected topi mostrano una maggiore accumulo di lipidi accompagnato da attivazione dell'endotelio vascolare, un aumento infiltrato di cellule immunitarie, ed elevata espressione di mediatori infiammatori 12. L'uso di questo modello in topi knockout ha chiarito il ruolo di componenti di segnalazione ospitanti e mediatori infiammatori, così come la cella interazioni specifiche che guidano P. gingivalis indotta immunopatologia 12 - 14. Inoltre, esperimenti utilizzando mutanti batterici definiti hanno individuato P. critico gingivalis virulenza fattori che contribuiscono a infiammazione cronica nei siti locali e sistemiche 15.
Questo articolo descrive le metodologie per la valutazione di P. gingivalis indotta infiammazione cronica nei siti locali e sistemiche. Forniamo un protocollo dettagliato per l'analisi di perdita di osso alveolare da microCT utilizzando il software Amira. Inoltre, definiamo l'utilità di serie in vivo vivo MRI animale per la valutazione della progressivainfiammazione all'interno della arteria anonima. Includiamo metodologie per la visualizzazione e la quantificazione della placca infiammatoria nelle lesioni arteriose, e descriviamo la loro caratterizzazione istologica. L'uso di topi transgenici e mutanti batterici definiti rende questo modello particolarmente adatto per l'identificazione sia host e fattori microbici coinvolti nella iniziazione, progressione, e l'esito della malattia. Inoltre, il modello può essere usato per individuare nuove strategie terapeutiche, tra cui la vaccinazione e di intervento farmacologico.
Protocollo
1. crescita e coltura di batteri
- Streak congelato scorte di P. gingivalis 381 su piastre di agar sangue anaerobici e incubare per 3 - 5 giorni in una camera anaerobica (10% H 2/10% di CO 2/80% N 2) a 37 ° C.
- Utilizzare gli organismi piastra coltivate per inoculare 5 ml colture liquide di Brain Heart Infusion brodo (BHI) integrata con estratto di lievito (0,5%), emina (10 mg / ml), e menadione (1 mg / ml). Dopo una crescita O / N, trasferire i 5 ml culture in 45 ml di BHI.
- Incubare i 50 ml colture liquide in anaerobiosi per un additional18 - 24 ore e la raccolta a metà alla fase log in ritardo. NOTA purezza della cultura dovrebbe sempre essere verificata da colorazione di Gram prima di introdurre i batteri in animali.
- Raccogliere i batteri mediante centrifugazione a 7000 xg per 10 min. Aspirare il surnatante e risospendere completamente il pellet di cellule batteriche in 5 ml di PBS utilizzando una pipetta sierologica. Aggiungi un ulteriore45 ml di PBS e centrifugare a 7000 xg per 10 min. Ripetere questa operazione due volte per un totale di tre lavaggi.
- Dopo l'ultimo lavaggio, risospendere il pellet cellulare in PBS tale che una diluizione 1:10 della cultura ha una densità ottica di 1,0 a 660 nm (OD 660 di 1 è equivalente a 10 9 UFC / ml). Pesare abbastanza carbossimetilcellulosa (Viscosità media) per ottenere un 2% w / v soluzione (ad esempio, 0,1 g per 5 ml di coltura). Aggiungere lentamente la carbossimetilcellulosa di sospensione batterica mentre vortex per evitare grumi.
2 Infezione orale
NOTA: Come illustrato nella figura 1, utilizzando il modello murino appropriato e regime di infezione orale, P. gingivalis induce infiammazione cronica e immunopatologia a livello locale (cavità orale) e siti sistemici (arterie).
- Somministrare sulfametossazolo (0,87 mg / ml) e trimetoprim (0,17 mg / ml) (Sulfatrim) per sei a 8-wk-old topi maschi a volontà nella loro acqua potabile per 2 settimane per ridurre la normale flora. Conservare la soluzione antibiotica in bottiglie di vetro ambra e proteggerlo dalla luce per prevenire il degrado.
- Per evitare la sedimentazione della soluzione antibiotica, scuotere le bottiglie, una volta o due volte al giorno (vale a dire, al mattino e nel tardo pomeriggio). Sostituire con una soluzione preparata di fresco ogni 3 - 5 giorni.
- Dopo due settimane, sostituire la soluzione di antibiotico con acqua potabile convenzionale. Consentire una 2-giorni di antibiotico periodo di riposo prima di infezione orale.
- Caricare il P. gingivalis sospensione / veicolo in una siringa da tubercolina da 1 ml con un ago di alimentazione collegato. Frenare manualmente il mouse afferrando la collottola sulla parte posteriore del collo. Assicurarsi che il grip è abbastanza solida per limitare la mobilità della testa del mouse.
- Infettare topi da applicazione topica di P. gingivalis sulla superficie vestibolare del mascellare. Posizionare l'alimentazione ago tale that è allineato con la superficie vestibolare dei molari superiori di destra e di espellere 50 ul di sospensione batterica. Disperdere la soluzione dolcemente lungo la gengiva per 1 min utilizzando la palla dell'ago di alimentazione.
- Lasciare il mouse per riposare per un periodo di 30 sec a 1 minuto prima di ripetere la procedura sul mascellare superiore sinistro. Topi di controllo ricevono il pretrattamento antibiotico e gavage orale con il solo veicolo (2% Carbossimetilcellulosa in PBS).
- Per esaminare patogeno-indotta infiammazione cronica a siti locali indotte perdita di osso alveolare infettando topi 3 volte a intervalli di 2 giorni. Sacrifica topi 6 settimane per la valutazione della perdita ossea da microCT.
- Per esaminare patogeno-indotta infiammazione cronica nei siti locali e sistemici, infettare aterosclerosi incline ApoE - / - mice 5 volte a settimana per 3 settimane.
NOTA: La progressione della malattia nel arteria anonima è controllato da seriale in vivo MRI. Topi Immagine a vari intervalli di tempo e di sacrificio 6-16 WKS tardir. Al momento del sacrificio, valutare carico aterosclerotico globale en analisi del volto e determinare la perdita di osso alveolare da microCT. Caratterizzare le lesioni aterosclerotiche da istologia e immunoistochimica.
3 micro-tomografia computerizzata (microCT)
- Preparazione dei campioni
- Sacrifica topi al punto di tempo desiderato dopo l'infezione. Euthanize topi da CO 2 asphyxation o con un altro metodo approvato dalla stabulario dell'istituzione.
NOTA: Raccogliere il sangue mediante puntura cardiaca, separare il siero e conservare a -80 ° C per l'analisi di anti-IgG P.gingivalis come descritto altrove 9. - Utilizzare un grosso paio di forbici decapitazione a grave alla testa del mouse alla base del cranio. Togliere la carne con un paio di pinze e posizionare il cranio in una provetta conica da 50 ml contenente 30 ml di paraformaldeide al 4% tamponata. Fissare il campione per 24-48 ore a 4 ° C.
- Dopo fissazione, Rinsposta il campione accuratamente con PBS.
- Crea biopsie blocchi mascellari.
- Conservare l'emi-mascellare in grado istologico del 70% EtOH a 4 ° C fino a valutazione da microCT.
- Sacrifica topi al punto di tempo desiderato dopo l'infezione. Euthanize topi da CO 2 asphyxation o con un altro metodo approvato dalla stabulario dell'istituzione.
- Acquisizione Immagine
- Eseguire acquisizioni di immagini utilizzando uno scanner da tavolo microCT. Impostare la sorgente di raggi X per una corrente di 114 μA ed una tensione di 70 kV. Caricare individuale emi-mascellare nel vaso di imaging e scansione ad una risoluzione di 12 micron in tutte e tre le dimensioni spaziali.
NOTA: caricare diverse emi-mascelle simultaneamente all'interno del vaso di imaging. - Eseguire una scansione preliminare a bassa risoluzione, che permette all'utente di delineare i confini per l'acquisizione delle immagini e limitare la scansione alla regione di interesse (ROI) utilizzando il sistema.
NOTA: L'intensità dello smalto rende la corona dei molari mascellari facilmente distinguibili. Utilizzando i molari come guida liberamente impostare i limiti di imaging per comprendere i tre molari e il bon alveolare circostantee. Questa funzione viene utilizzata anche per discriminare tra individuo emi-mascellare durante la scansione di campioni multipli all'interno della stessa nave. - Quando la scansione è completata, convertire i file di immagine RAW (.ISQ) in dicoms di alta qualità (.dcm).
- Eseguire acquisizioni di immagini utilizzando uno scanner da tavolo microCT. Impostare la sorgente di raggi X per una corrente di 114 μA ed una tensione di 70 kV. Caricare individuale emi-mascellare nel vaso di imaging e scansione ad una risoluzione di 12 micron in tutte e tre le dimensioni spaziali.
- Image Analysis
In questo protocollo, l'analisi delle immagini viene eseguita utilizzando una visualizzazione dei dati, elaborazione e software di analisi. In primo luogo, utilizzare punti di riferimento morfologici per creare un piano di misura migliore per la giunzione cementizia (CEJ). Quindi utilizzare il per trasformare l'emi-mascellare in un orientamento standard per la successiva misurazione del volume dell'osso alveolare.- Aprire il software e fare clic sull'icona "Open Data" che si trova nell'angolo in alto a sinistra del Pool. In alternativa, utilizzare File> Open Data.
- Selezionare la serie di immagini DICOM e fate clic su Carica. Viene visualizzata la finestra DICOM Loader. Fare clic su OK.
- Osservare i set di dati come icona verde in piscina. Si noti che cliccando sull'oggetto dati provoca supplementare, matonnellate da visualizzare nell'area pulsante nella parte superiore della piscina. Selezionando l'icona provoca anche alcune informazioni relative al record di dati da visualizzare nella Proprietà Area.
- Ogni icona nella piscina offre un menu a comparsa da cui è possibile selezionare diversi moduli. Attivare il menu a comparsa facendo clic sulla freccia bianca nell'angolo destro dell'icona dati. Sotto il modulo di visualizzazione, selezionare isosurface (Display> isosurface). L'icona isosurface apparirà nella zona della piscina. Quando selezionata, ulteriori impostazioni vengono visualizzate nella Proprietà Area.
- Impostare lo stile Draw a trasparente e la soglia di 2.000. Assicurarsi la compactify e downsampling pulsanti sono selezionate in Opzioni. In media, accertarsi x, y, z sono tutti impostati a 2 Fare clic su Applica per generare il isosurface.
NOTA: Osservare una ricostruzione in 3D trasparente della emi-mascellare nel visualizzatore 3D. Il vantaggio di utilizzare uno stile tiraggio trasparente per la ricostruzione delle immagini è che le radici dei molari possonoessere facilmente identificabili. Questo sarà importante quando mettere il campione in orientamento standard. - Selezionare l'icona dei dati verde e nella zona delle proprietà selezionare l'icona raccolto. Osservare una finestra che visualizza le dimensioni e le coordinate dei dati. Impostare questo da parte per ora. Si noti che un rettangolo di selezione appare nel visualizzatore 3D con linguette verdi ad ogni angolo.
- Selezionare il pulsante Interagisci nella barra degli strumenti spettatore. Modificare le dimensioni del riquadro di selezione facendo clic e trascinando gli angoli verdi. Assicurarsi che la scatola comprende la regione di interesse (ROI) ed elimina il maggior spazio morto e detriti possibile. Questo riduce la necessità di calcolo sul computer.
- Utilizzare il pulsante trackball nella barra degli strumenti visualizzatore per ruotare l'oggetto nel visualizzatore 3D assicurare il ROI è completamente racchiuso dal rettangolo di selezione. Al termine, fare clic su OK nella finestra di ritaglio accantonato nel passaggio 8.
- Selezionare l'icona dei dati e sotto il modulo display selezionare Oblique Slice (OBS). (Display> OBS)
- Selezionare l'OBS. Nell'area Proprietà, impostare il tipo di mappatura lineare, la gamma finestra dei dati da -200 a 10.000, e il campionamento a più fine. Ora selezionare Ruota in Opzioni. Osservare uno snodo di rotazione al centro della OBS.
- Selezionare il pulsante interagiscono nella barra degli strumenti visualizzatore e utilizzare le maniglie della levetta per regolare il piano di taglio della fetta. Creare un piano sagittale che corre parallelo alle radici dei denti e perpendicolare alla superficie occlusale dei denti. Il piano dovrebbe bisecare tre molari (M1-M3), come illustrato nella Figura 2.
- Spegnere ruotare e duplicare l'OBS (object> oggetto duplicato). Un nuovo OBS appare il nome OBS 2 Attivare rotazione avanti per OBS 2.
- Utilizzare l'handle di rotazione per riorientare OBS 2 in modo che sia perpendicolare con OBS 1 (vedi figura 2).
- Girare ruotare off per OBS 2 e 3 fette creare duplicati. Questi saranno citarne OBS 3, 4, e 5.
- Picking Punti per il Piano di Best Fit
NOTA: I passaggi 3.4.1-3.4.5 descrivono la posizione di 8 punti lungo la CEJ crea un piano di best fit. Scegli quattro dei punti da fette sagittali e gli altri quattro da fette coronali (vedi Figura 3). Quando la raccolta punti situati sulle fette sagittali in 3.4.6, può essere necessario regolare OBS 1.- Allineate OBS 1 con il centro della radice mesiale più di M1 nel piano sagittale. Allineate OBS 2 con il centro della radice mesiale più di M1 nel piano coronale.
- Allineare OBS 3 con il centro della radice bucco-distale della M1 nel piano coronale. Se necessario, regolare OBS 1 in modo che sia approssimativamente centrata con la radice bucco-distale della M1 nel piano sagittale quando si seleziona punti nel passaggio 20.
- Allineare OBS 4 con la biforcazione delle radici vestibolari dei M2. OBS 4 dovrebbe essere centrato tra le radici bucco-mesiali e distali di bucco-M2. Se necessario, regolare arguzia OBS 1 in modo che sia approssimativamente centratah la radice bucco-distale di M2 nel piano sagittale quando si seleziona punti nel passaggio 20
- Regolare OBS 5 in modo che corre lungo il centro di M3 nel piano coronale. Se necessario, regolare OBS 1 in modo che sia approssimativamente centrata con la radice più distale della M3 nel piano sagittale quando si seleziona punti nel passaggio 20.
- Duplicare uno qualsiasi dei dell'OBSS (OBS 6) e selezionare Adatta a punti nella finestra delle proprietà. L'adattamento ai punti alternare consente al ricercatore di scegliere 3 o più punti in 2D o 3D di oggetti all'interno del visualizzatore e poi calcola un piano di best fit. In questo caso, i dell'OBSS 2D descritte nei passaggi precedenti viene utilizzato per selezionare 8 punti lungo la CEJ.
- Nascondi OBS 6 dal visualizzatore 3D facendo clic sulla casella arancione nell'angolo destro dell'icona dati. Nascondere il isosurface dal visualizzatore 3D per rendere la CEJ visibile su tutte le sezioni 2D. Maiusc-clic e selezionare gli 8 punti lungo il CEJ come descritto sopra.
NOTA: Se il tasto Shift non è premuto durante la selezionepunti, un piano verranno automaticamente calcolate dopo i primi tre punti. - Dopo aver selezionato tutti gli 8 punti, fare OBS 6 visibile. Si noti che questa è una fetta assiale che corre circa parallelo al piano occlusale.
- Trasformazione e riorientamento NOTA: Il piano di best fit viene utilizzato per trasformare i dati in un orientamento standard per le misurazioni volumetriche successive.
- Fare clic su Icona Dati> Calcola> applyTransform. L'icona applyTransform appare nella zona della piscina. Fare clic sul quadrato bianco in un angolo dell'icona applyTransform, selezionare di riferimento, e fare clic su OBS 6.
- In Proprietà Area, selezionare standard per il metodo di interpolazione ed esteso per la modalità. Applicare la trasformazione.
- Crea un isosurface e OBS coronale per il nuovo file di dati. Ruotare i OBS in direzione assiale in modo che sia approssimativamente perpendicolare M1 (Figura 2). Utilizzare le cuspidi del molare e il occlusale curvatures come guida.
- Utilizzare questo piano per trasformare i dati come nei passaggi 3.5.1 e 3.5.2. Salvare il file di dati trasformati.
- Segmentazione e Bone Volume di misura
NOTA: Le seguenti procedure descrivono la segmentazione e la misurazione di osso alveolare. La fetta corrispondente al piano di misura migliore per la CEJ è identificato e un piano di riferimento viene scelto. Osso alveolare tra il CEJ e il piano di riferimento sulla faccia vestibolare dei molari è segmentata e misurato. La radice più mesiale della M1 e la radice più distale della M3 servono punti di riferimento come endpoint. Impostazione del piano di riferimento 15-20 fette di sotto della CEJ produce risultati ottimali. Inclusione di fette aggiuntive introduce variabilità che maschera le differenze di volume osseo tra i gruppi di trattamento.- Aprire l'Editor Segmentazione e creare una nuova etichetta per i dati trasformati.
- Creare un nuovo materiale e denominarlo osso alveolare.
- Sotto Zoom e Data Window, impostare i dati variano from -200 a 10.000.
- In Visualizzazione e mascheratura selezionare il mirino 2D, 3D MPR, 3D e rendering volumetrico icone. Impostare l'intervallo di dati da 2.500 a 8.000. Abilita mascheramento dei dati.
- Selezionare l'impostazione dalla barra degli strumenti di visualizzazione visualizzatore Quattro spettatori. Il display è suddiviso in quattro quadranti che consentono l'esame simultaneo di sagittale, coronale, e pile di immagini assiali, così come il volume 3D rendering.
- Utilizzare tutti i quattro quadranti per identificare l'ultima fetta in cui lo smalto è visibile sui volti buccali di M1 e M3. Questa posizione corrisponde al piano di misura migliore per la CEJ. Registrare il numero di slice assiale.
- Nel piano assiale, continuare 15-20 fette verso la cresta ossea alveolare. Questo rappresenta il piano di riferimento.
- Utilizzare qualsiasi combinazione di strumenti di segmentazione per selezionare osso alveolare sulla faccia vestibolare dei molari tra CEJ e il piano di riferimento. Utilizzare la radice più mesiale della M1 e la radice più distale di M3 come punti di riferimento endpoint.
- Al termine, aggiungere la selezione di osso alveolare sotto l'elenco dei materiali.
- Ritorno al pool di oggetti. Una nuova icona con l'estensione ".Labels" dovrebbe essere aggiunto l'icona dei dati immagine. Selezionare l'icona etichette e nel menu a discesa selezionare Materiali> MaterialStatistics.
- Nell'area di proprietà, selezionare Materiale e colpire applicare. Una tabella appare a visualizzare diversi parametri per ogni materiale della lista materiali. Registrare il volume di osso alveolare.
4. Valutazione di aterosclerosi
- Aortic Dissection
- Sacrifica il mouse CO 2 asfissia nel punto desiderato momento di post-infezione.
- Posizionare il mouse sul lato dorsale, nastro verso il basso e pulire il mouse con il 70% EtOH. Tagliare la pelle sul lato ventrale dal centro dell'addome appena sopra il processo xifoideo.
- Tagliare la pelle addominale fino a quando il processo xifoideo è visibile. Sollevare il processo xifoideo con una piccola pair di pinze, fanno tagli su entrambi i lati della gabbia toracica, e tagliare il diaframma. Poi fare due tagli verso il basso ai lati della gabbia toracica per esporre il cuore.
- Exsanguinate il mouse utilizzando una siringa da insulina 27 G collocato in all'apice del ventricolo destro. Durante la raccolta del sangue, ruotare periodicamente l'ago per evitare il blocco dell'apertura della parete ventricolare. Tipicamente, 0,8-1 ml di sangue possono essere ottenuti utilizzando questo metodo.
- sup> NOTA: Separare il siero e conservare a -80 ° C per l'analisi di anti-IgG P.gingivalis come descritto altrove 9
- Utilizzare le forbici per rimuovere l'atrio destro.
- Individuare il ventricolo sinistro sul lato posteriore del cuore. Introdurre un ago G 21 in all'apice del ventricolo sinistro, con il bisello dell'ago verso il centro della camera e lavare lentamente il sistema circolatorio con 3 - 5 ml di fissativo tessuto.
- Grasso Trim e del timo che circonda il cuore.
- Rimuovere la lungs.
- Individuare l'arco aortico con i tre rami e sgombrare il campo da strati di grasso che circondano per una migliore esposizione.
- Continua dissezione dell'aorta dall'arco alla base del diaframma.
- Rimuovere il fegato e spiazzare tessuto intestinale per esporre l'aorta discendente. Sezionare l'aorta distale fino ai rami dell'arteria renale.
- Tagliare le arterie renali e continuare la dissezione fino alla biforcazione ileale.
- Una volta che l'aorta è libera dalla maggior parte dei tessuti connettivi, tornare all'inizio dell'aorta e tagliare la porzione molto superiore dei tre rami fuori l'aorta sopra il cuore.
- Cuore Peel verso l'alto, snipping sottostanti tessuti grassi, al fine di separare il cuore dal corpo.
- Tenere il cuore con una pinza e tirare verso l'alto, il taglio del tessuto connettivo che possono ancora essere attaccato, e continuare fino ai reni e seguire giù per le gambe e tagliare nel punto più basso possibile.
- Fissare aorta in 10% formalina per 1 ora con un sucguente PBS lavare per 1 ora. In alternativa, negozio di aorta in 10% formalina O / N, lavare in PBS il giorno successivo e continuare con la dissezione.
- Luogo aorta in una capsula di Petri 10 centimetri contenente PBS.
- Utilizzando un ambito dissezione, rimuovere con attenzione il tessuto avventiziale dall'aorta.
- Quando aorta è libera di eccesso di grasso e di tessuto, tagliare parte inferiore due terzi del cuore. Inizia peeling muscolo cardiaco via alla fine del cuore opposto dell'arco aortico. Il bulbo dell'aorta dovrebbe apparire lentamente, che sarà in colorazione bianca.
- Continuare attenta dissezione utilizzando due pinze fino lampadine aortiche sono privi di tessuto muscolare cardiaco.
- Mettere aorta puliti in un vassoio dissezione bianco e coprire con PBS.
- Pinning di Aorta
- Tenere aorta coperto in PBS tutta pinning.
- Lay aorta in posizione anatomica con bulbi di aorta a sinistra.
- Posizionare i perni minutien temporanee a 5 posizioni a partire da 1) parte superiore di aorta, 2) al di sotto terzaramo di arco, 3) a metà della aorta discendente 4) vicino all'estremità inferiore della aorta discendente 5) sopra ramo dell'arteria femorale.
- Utilizzando le forbici a molla extra fini, tagliare lato sinistro della aorta, a partire ramo sinistro dell'arteria femorale tutta la strada fino a aorta al di sotto del più basso ramo ascendente dell'aorta.
- Taglia dal lato a sinistra del basso bulbo aortico alla fessura e continuare taglio per raggiungere intersezione di taglio lungo taglio verticale di aorta.
- Tagliare attraverso aorta orizzontale per raggiungere il punto più basso di ramo dell'aorta ascendente
- Tagliare verso l'alto sul lato destro sopra più alto ramo dell'aorta.
- Tagliare ogni ramo per esporre la sua superficie interna.
- Rimuovere alcuni dei perni temporanei e sostituire con i perni permanenti con l'obiettivo di pinning giù tutto aorta in posizione anatomica senza piegatura, stiramento di aorta. Obiettivo è quello di esporre la superficie interna dell'aorta.
- Continua appunta finché tutta la superficie interna dell'aorta è esposto e ben visibile dall'alto e priva di int visivaerference da perni.
- Lipid colorazione e Lesion Quantificazione
- Preparare la soluzione colorante Sudan IV (5 mg / ml nel 70% isopropanolo). Mescolare bene e filtrare per garantire che non sono presenti cristalli.
- Copertina aorta appuntato in soluzione IV Sudan per 50 min.
- Lavare con 70% di isopropanolo per 1 - 5 min. Lavare delicatamente aorta con ddH20 finché l'acqua venuta fuori l'aorta non è più rosso.
- Coprire aorta con PBS. Cattura immagini di aorta con una fotocamera ad alta risoluzione collegata ad un microscopio da dissezione e salvare file di immagini digitali (come .TIFF). Posizionare un righello accanto ad ogni immagine per facilitare la calibrazione.
- Utilizzare il software ImageJ per determinare l'area dell'intima e l'area delle lesioni. Tracciare manualmente la superficie intimale per determinare l'area. Area di lesione può essere calcolata utilizzando soglia automatica del colore. Ciò richiede l'impostazione di una soglia per definire una intensità del colore che discrimina le lesioni da aree normali.
- Calcolare la percentuale delsuperficie intimale coperta da lesioni aterosclerotiche.
5. istologica Valutazione della aterosclerotiche lesioni
- Raccolto arco aortico con tessuto cardiaco e immergersi in ottobre in uno stampo di base usa e getta.
- Raccogli 5 micron criosezioni seriali ogni 50 micron nel seno e innominata arteria aortica utilizzando un criostato impostato a -17 ° C e montare le sezioni di tessuto su vetrini da microscopio. Conservare scivola a -20 ° C fino a nuovo uso.
- Per la valutazione istologica, macchia con ematossilina e eosina utilizzando le procedure appropriate.
6 Caratterizzazione immunoistochimica delle lesioni aterosclerotiche.
Le seguenti procedure delineano un protocollo generale basato su anticorpi abitualmente utilizzati per valutare lesioni aterosclerotiche in P. gingivalis -infected topi. Questo protocollo richiede l'ottimizzazione per ogni anticorpo o reagente.
- Rimuovere i vetrini dal congelatore e fissareper 2 min in ghiaccio-freddo fissativo (acetone o altro fissativo).
- Lasciare i vetrini a venire a RT ed etichettare con una penna resistente ai solventi.
- Sciacquare i vetrini 3x in PBS per rimuovere la matrice di tessuto-congelamento
- Bloccare l'attività della perossidasi endogena incubando i vetrini a 0,3% H 2 O 2 soluzione in PBS per 10 min.
- Sciacquare i vetrini 3x in PBS per 2 minuti ogni volta.
- Blocca legame non specifico incubando in tampone di bloccaggio (siero di coniglio 10% in PBS) per 30 minuti a RT.
- Diluire l'anticorpo primario 1:50 in siero di coniglio 10%.
- Applicare l'anticorpo diluito per le sezioni di tessuto nella diapositiva.
- Incubare per 1 ora a temperatura ambiente.
- Sciacquare i vetrini 3x in PBS per 2 minuti ciascuna.
- Diluire anti-topo biotinilato anticorpo secondario 1: siero di coniglio 100 nel 10%.
- Applicare le sezioni di tessuto sul vetrino e incubare per 30 minuti a temperatura ambiente.
- Sciacquare i vetrini 3x in PBS per 2 minuti ciascuna.
- Preparare la soluzione di substrato DAB aggiungendo1 goccia di cromogeno DAB per ogni tampone DAB 1 ml.
- Scolare PBS dai vetrini e applicare la soluzione di substrato DAB. Lasciare i vetrini a incubare per 5 minuti o fino a quando l'intensità di colore desiderata.
- Lavare 3x in acqua per 2 minuti ciascuna.
- Macchia Contatore con ematossilina.
- Disidratare attraverso 4 cambi di alcool (95% 1 min, 95% 1 min, 100% 1 min e 100% 5 min).
- Pioggia in 3 cambi di xilene.
- Coprioggetto utilizzando soluzione di montaggio e analizzare qualitativamente mediante microscopia. Per l'analisi quantitativa, acquisire immagini e calcolare l'area colorazione con ImageJ utilizzando una soglia automatica.
7 MRI
- Preparazione degli animali per la risonanza magnetica
- Anestetizzare i topi prima di esperimenti di risonanza magnetica. Eseguire l'induzione iniziale di anestesia utilizzando 4% isofluorano vaporizzato per 2-3 minuti in una camera di induzione. Mantenere l'anestesia durante il periodo di imaging con un flusso continuo di 0,5 - 2% vaporizzato consegnato nel isofluoraned attraverso un setup cono o una maschera.
- Dopo aver raggiunto il piano di anestesia chirurgica (cioè, nessuna punta risposta pizzico), posizionare il mouse in una porta animale con il naso inserita in un cono di naso. Ci sono diversi tipi di detentori di animali disponibili in commercio che possono essere utilizzati per ridurre al minimo il potenziale di movimento durante l'imaging. Usiamo un supporto progettato su misura con una barra morso.
- Monitorare la respirazione e il ciclo cardiaco e la sincronizzazione con acquisizione delle immagini con un cuscino la respirazione (posto sull'addome del mouse) dotata di un piccolo sistema di monitoraggio degli animali e gating.
- Fissare il mouse e sistema di monitoraggio sul supporto animale con la pellicola di laboratorio.
- Acquisizione dati MRI
- Posizionare il supporto animale con la testa prima del topo in posizione supina in una sonda verticale 30 mm (Micro 2.5) mantenuto a 23 ° C e in verticale-Bore 11,7 T MRI scanner.
- Allineare il supporto con il centro di tegli Atd bobina.
- Condurre un processo spessoramento utilizzando una singola sequenza di impulsi.
- Utilizzando una sequenza RARE, acquisire immagini da ricognizione lungo tre orientamenti ortogonali per creare immagini assiali, coronali, sagittali e.
- Eseguire una bassa risoluzione angiografia a risonanza magnetica (MRA) utilizzando una sequenza echo ungated gradiente 3D con i seguenti parametri: spessore della soletta = 1,5 centimetri; flip angle = 45 °; tempo di ripetizione = 20 ms; tempo di eco = 2,2 ms; campo di vista = 1,5 × 1,5 × 1,5 cm matrix = 64 × 64 × 64; numero di media = 1 tempo di scansione totale: 2~3 min. Lo scopo di questa analisi è quello di garantire che le immagini sono acquisite in corrispondenza della zona bersaglio (l'arteria anonima).
- Eseguire un alta risoluzione MRA della arteria anonima con una sequenza echo ungated gradiente 3D utilizzando i seguenti parametri: spessore della soletta = 1,5 centimetri; flip angle = 45 °; tempo di ripetizione = 20 ms; tempo di eco = 2,2 ms; campo di vista = 1,5 × 1,5 × 1,5 cm matrix = 128 &# 215; 128 × 128; numero di media = 4 tempo di scansione totale era ~25 min.
- Ottenere immagini assiali continue dell'arteria innominata 0,5 millimetri al di sotto della biforcazione succlavia.
- Analisi dei dati MRI
- Eseguire la ricostruzione delle immagini e analisi utilizzando software di imaging associato con lo scanner. Raggiungere la ricostruzione 3D delle immagini MRA da Maximum Intensity Projection.
- Utilizzare la biforcazione succlavia come marker anatomico per allineare i dati acquisiti da diverse topi o lo stesso del mouse in diversi momenti. Scegli la sezione obiettivo della arteria anonima a 0.3- alla distanza di 0,5 mm al di sotto del subclavianbifurcation.
- Definire e calcolare l'area luminale della sezione trasversale scelti con ImageJ. Le misurazioni devono essere eseguite in cieco da due osservatori indipendenti. Verificare misura riproducibilità calcolando i coefficienti di correlazione interclasse.
- Per gli studi longitudinali con imag serialezione, normalizzare superficie luminale all'area del lume ottenute al basale (il primo barattolo nello studio) per ciascun topo. Esprimere i risultati come variazione dell'area luminale nel corso del tempo.
- Eseguire le analisi statistiche appropriate (ad esempio, test t di Student) per determinare differenze significative tra i gruppi sperimentali.
Risultati
Utilizzando il modello murino appropriato e regime di infezione orale, P. gingivalis induce infiammazione cronica e immunopatologia a livello locale (cavità orale) e siti sistemici (arterie) (Figura 1).
Nei topi, l'infezione orale con P. gingivalis induce una risposta infiammatoria locale che guida la distruzione del dente di sostegno dell'osso alveolare 8. P. gingivalis -infected topi sviluppano siero risposte anticorpali a questo organismo, che sono prevalentemente di isotipo IgG 9. I risultati mostrati nella Figura 4 sono rappresentativi di un esperimento in cui C57BL / 6 sono stati infettati con P.gingivalis per tre volte a intervalli di due giorni e sacrificati dopo 6 settimane per la valutazione della perdita di osso alveolare da microCT. Analisi volumetrica utilizzando il software Amira rivela che P. topi gingivalis -infected presentare una significativa perdita di massa ossea rispetto ai controlli non infetti (Figura 4A). Controllo visivo ricostruito emi-mascellare illustra un aumento della superficie esposta delle radici molari nei topi infettati rispetto ai controlli (Figura 4B e Figura 4C).
In aterosclerosi incline ApoE - / - mice, P. gingivalis induce infiammazione cronica che guida la perdita di osso alveolare 12 e infiammatorio della placca deposizione all'interno del seno aortico 15 e innominata arteria 11. P. gingivalis indotta aterosclerosi si verifica già nelle prime 24 ore dopo l'ultima infezione e può essere prevenuta con la vaccinazione prima infezione 16. Infiammazione progressiva nella arteria anonima di P. gingivalis -infected topi possono essere monitorati nei topi dal vivo da seriale in vivo MRI a vari punti di tempo post-infezione (Figura 5). En misurazioni faccia del Sudan IV aorte macchiate Dimostra che P. gingivalisinfezione aumenta significativamente la deposizione di lipidi e zona lesionale sulla superficie intimale (Figura 6). Al momento del sacrificio, istologia e l'immunoistochimica può essere utilizzato per caratterizzare qualitativamente o quantitativamente lesioni aterosclerotiche nel contesto della composizione cellulare, l'espressione di vari antigeni, e il contenuto lipidico. L'analisi immunoistochimica delle lesioni seno aortico rivela una maggiore infiltrazione di macrofagi e di elevata espressione del recettore immunitario Toll-like receptor innata 2 (TLR2) in P. gingivalis topi -infected (Figura 7).

Figura 1 P. gingivalis indotta infiammazione cronica a siti locali e sistemici. Prima di infezione da P. topi gingivalis sono administe rosso antibiotici ad libitum nella loro acqua potabile per 10-14 giorni, seguita da un due giorni di riposo antibiotico. Il trattamento antibiotico sopprime la flora orale indigena e facilita la colonizzazione. Per l'induzione di perdita alveolare, i topi sono infetti tre volte a intervalli di due giorni e il volume dell'osso alveolare è misurato 6 settimane dopo l'infezione. Nel valutare l'aterosclerosi, arteriosclerosi soggette ApoE - / - i topi sono in genere infettati 5 volte a settimana per 3 settimane e si sono sacrificati 16-24 settimane dopo l'infezione. Infiammazione progressiva all'interno dell'arteria innominata di topi vivi può essere misurata da seriale in vivo MRI a vari punti momento post-infezione. Istologia e immunoistochimica possono essere usate per colorare di lipidi e cellule infiammatorie a terminazione dell'esperimento per convalidare i dati di imaging. Al momento del sacrificio, perdita di osso alveolare è misurata da microCT e carico aterosclerotico globale è valutata en face colorazione di aorte interi. https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/51556/51556fig1highres.jpg "target =" _blank "> Clicca qui per visualizzare una versione più grande di questa figura.
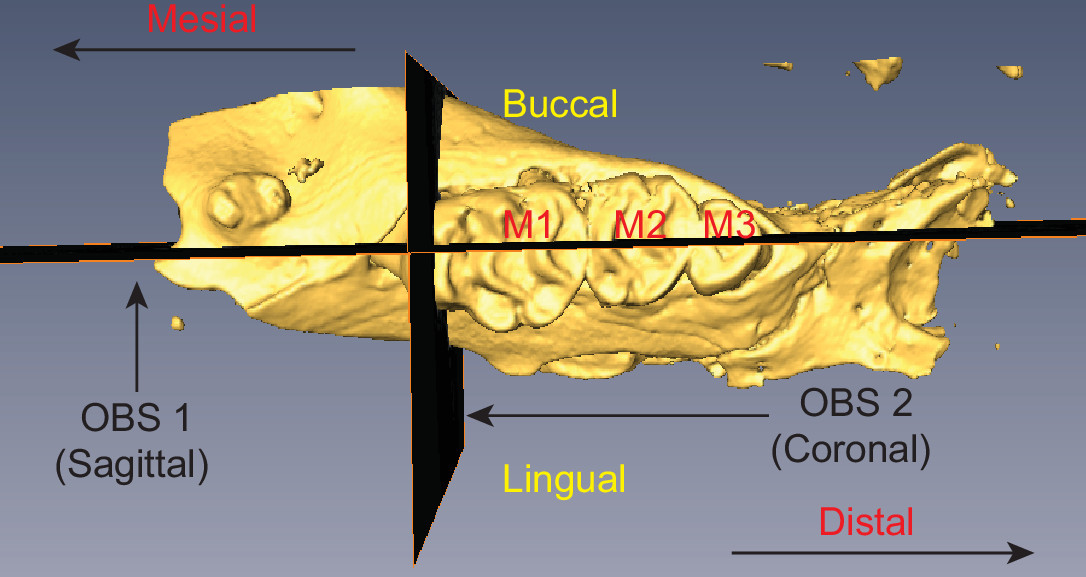
Figura 2 mouse emi-mascellare che illustra il posizionamento di OBS OBS 1 e 2 I tre molari sono etichettati (M1-M3) e la terminologia anatomicamente rilevanti è indicato. Cliccate qui per vedere una versione più grande di questa figura.

Figura 3 mouse emi-mascellare che illustra il posizionamento di OBS da 1 a 5.1556 / 51556fig3highres.jpg "target =" _blank "> Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 alveolare perdita ossea misurata dal microCT. Maschio C57BL / 6 sono stati infettati per via orale con P. gingivalis o solo veicolo (non infetto) e il volume dell'osso alveolare è stata valutata da microCT sei settimane più tardi con Amira. (A) il volume dell'osso alveolare in emi-mascellari da non infetto e P. gingivalis -infected C57BL / 6. I risultati rappresentano volume osseo sopra del piano di riferimento (120 micron dalla CEJ). I dati sono espressi come volume osseo SD da n = 8 topi per gruppo. *** P <0.001, rispetto ai controlli non infetti. (B) e (C) Rappresentante ricostruzioni 3D di emi-mascelle da non infetti (B)e P. gingivalis -infected (C) topi. Una significativa riduzione del volume dell'osso alveolare può essere visto in P. gingivalis -infected topi rispetto ai controlli non infetti. Frecce indicano le aree in cui si verifica la perdita ossea visibile in P. gingivalis topi -infected (notare l'aumento della superficie esposta delle radici dei molari). Cliccate qui per vedere una versione più grande di questa figura.

Figura 5 infiammazione progressiva all'interno dell'arteria innominata seguente P. infezione gingivalis come misurato da MRI (A) Rappresentante di Risonanza Magnetica (RM) angiografia dell'arco aortico e grandi navi di ApoE. -/ -. Mouse (B) assiale MR immagine dalla linea gialla in A della arteria anonima di un mouse, 0,3 millimetri di sotto della sua biforcazione. Arterie innominate sono stati ripresi da MRA al basale e dopo 12 e 16 settimane dopo l'infezione. (C) La variazione temporale nella zona del lume (mm 2) è stata calcolata per i topi individuale (n = 10-12 / gruppo). Non infetti ApoE - / - (blu); P. gingivalis -infected ApoE - / -. (rosso) Si prega di cliccare qui per vedere una versione più grande di questa figura.
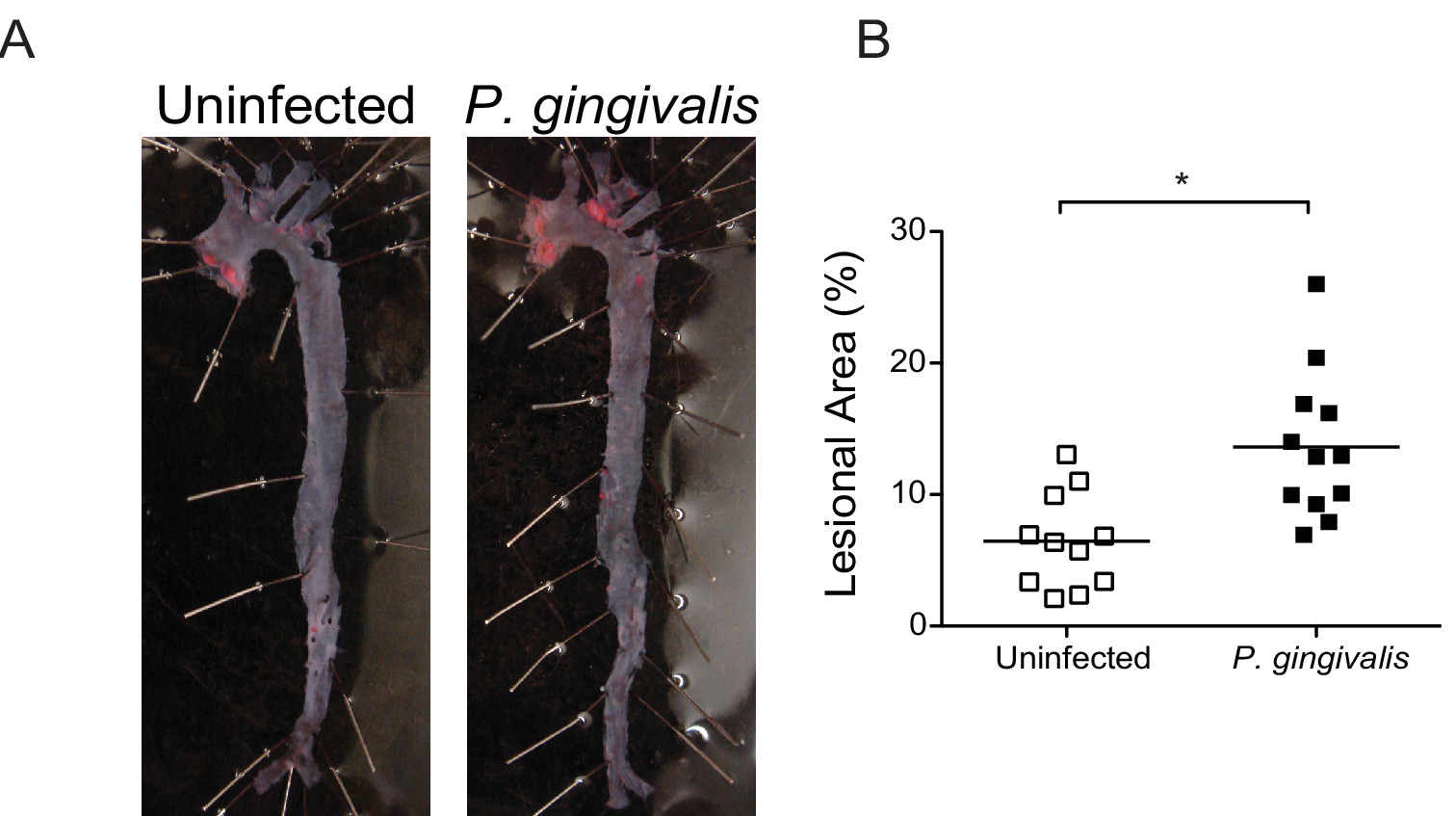
Figura determinazione 6. En volto dell'area lesionale in tutta aorta. (A) Sudan IV colorazione dell'aorta en lesioni facciali 16 sett post-infezione con P. gingivalis. (B) Quantificazione del contenuto di lipidi all'interno dell'aorta totale dei non infetti (simboli bianchi) e P. gingivalis topi -infected (simboli neri) (n = 10-13 / gruppo). Percentuale di aorta occupato da lipidi è stato calcolato utilizzando ImageJ. * P <0,05. Cliccate qui per vedere una versione più grande di questa figura.

Figura 7 immunoistochimica analisi delle lesioni seno aortico Maschile ApoE -. / - Topi nutriti con una dieta normale chow sono stati infettati con P. gingivalis o non infetto e sacrificati 16 settimane dopo l'infezione. Criosezioni ottenuti dai seni aortici sono stati colorati con anti-Mouse F4 / 80 e TLR2. Barra della scala, 100 micron. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Il P. gingivalis modello di infezione orale fornisce un valido strumento per lo studio del patogeno-indotta infiammazione cronica nei siti locali e sistemiche. Questo modello unico permette la caratterizzazione di entrambi i meccanismi specifici di accoglienza e patogeni che contribuiscono a infiammazione cronica e immunopatologia. Inoltre, il modello può essere usato per individuare nuove strategie terapeutiche, comprese le vaccinazioni e intervento farmacologico. La procedura descritta in questo protocollo descrivono l'uso di successo di questo modello e di dettaglio le metodologie per valutare l'iniziazione, progressione, e l'esito di P. gingivalis indotta infiammazione cronica.
Ci sono diversi aspetti critici da tenere a mente quando si utilizza questo protocollo per esaminare la perdita ossea infiammatoria. In primo luogo, va rilevato che l'esito di infezione da P. gingivalis è determinata da tre fattori chiave: 1) suscettibilità genetica dell'ospite all'infezione 2) patogenovirulenza (genetica del patogeno) e 3) l'interazione ospite-patogeno risultante (interazione dei due genomi). Suscettibilità alla P. gingivalis indotta perdita di osso alveolare è geneticamente determinata nei topi, quindi la cura deve essere presa quando si seleziona il ceppo di topi per lo studio 17. Risposta dell'ospite differenziali tra i ceppi inbred di topi possono essere sfruttate per condurre schermi avanti genetiche e caratterizzare i geni coinvolti nella sensibili e resistenza a patogeni indotta infiammazione cronica. Inoltre, esiste una notevole eterogeneità nella capacità di differente P. gingivalis sforza di indurre perdita ossea alveolare nei topi 18. Questo protocollo utilizza topi su sfondo C57BL / 6 a causa della disponibilità di topi transgenici e loro suscettibilità all'aterosclerosi. P. gingivalis ceppo 381 induce la perdita di osso alveolare e aterosclerosi nei topi sulla C57BL / 6 di sfondo, e alcuni mutanti batterici sono stati progettati utilizzando this ceppo.
I topi sono particolarmente resistenti alla aterosclerosi e lo sviluppo di lesioni arteriose palesi richiede l'uso di modelli murini geneticamente modificati di aterosclerosi. Usiamo il ApoE - modello murino, perché è il modello consolidato del mouse di aterosclerosi, non richiede alimentazione di dieta ricca di grassi per la formazione della lesione, e ricapitola molti aspetti della malattia umana 19 - /. Il tipo di dieta per alimentare gli animali durante il corso dell'esperimento è una variabile importante. Per la maggior parte del nostro lavoro, diamo da mangiare topi una dieta normale chow per evitare l'apporto di lipidi esogeni nella interpretazione dei nostri risultati. Negli studi preliminari, abbiamo scoperto che alimentando i topi a differenze maschere dieta ricca di grassi nella zona della lesione en faccia tra infetto e P. gingivalis -infected topi all'interno del seno aortico. Tuttavia, dieta ricca di grassi e P. gingivalis lavoro infezione sinergicamente quando la progressione di infiammazioni è monitorata nel innominata da RM o istologia 11. Nei topi, l'arteria anonima ha un alto grado di progressione della lesione, e le lesioni in questa arteria espressa tratti caratteristici della malattia clinica nell'uomo, tra cui restringimento nave, i media atrofiche, infiammazione perivascolare, e la rottura della placca. Distinzioni nella composizione cellulare delle lesioni sono evidenti in differenti siti anatomici. I macrofagi sono le cellule immunitarie primarie lesioni infiltranti seno aortico, mentre le lesioni dell'arteria innominata sono composti da entrambi i macrofagi e le cellule T.
Durata sperimentale e il punto di tempo in cui gli endpoint infiammatorie vengono valutati sono altri fattori da considerare nel valutare l'iniziazione, progressione, e l'esito di P. gingivalis indotta aterosclerosi. Abbiamo precedentemente dimostrato che P. gingivalis -infected ApoE - / - topi mostrano l'infiltrazione di macrofagi, elevata espressione di marcatori immunitario innato, unnd maggiore deposizione di placca infiammatoria già a partire 24h dopo l'ultima infezione all'interno del seno aortico e questo può essere prevenuta con la vaccinazione 16. Nelle nostre mani, l'infiammazione e immunopatologia aumento con l'età che avanza e sono evidenti fino a 24 settimane dopo l'infezione. Tuttavia, le decisioni riguardanti la durata dello studio in ultima analisi, si basano su ipotesi di fondo in fase di studio, la modalità di analisi e conoscenza preventiva della portata di aterosclerosi in condizioni ambientali specifiche.
L'utilizzo di tecniche di imaging non invasive per il monitoraggio progressiva infiammazione nella arteria anonima può essere usato per guidare la durata sperimentale. Serial MRI consente studi dettagliati di progressione dell'aterosclerosi nello stesso animale che può raffigurare il restringimento del lume arterioso e zone di parete piccolo vaso 20. In contrasto con i metodi tradizionali, come lipidi colorazione dei vasi sezionati, la RM non richiede l'eutanasiae permette studi longitudinali per valutare l'inizio e la progressione dell'aterosclerosi. In collaborazione con i topi transgenici, mutanti batterici, o trattamenti sperimentali, le informazioni temporali fornite da risonanza magnetica può essere utilizzato per valutare l'effetto della genetica host, fattori di virulenza degli agenti patogeni, e intervento terapeutico. Come ulteriore vantaggio, istologia ed immunoistochimica può essere utilizzato per colorare per lipidi e cellule infiammatorie alla cessazione della sperimentazione per validare dati di imaging. Recentemente abbiamo usato questi metodi per dimostrare che l'infezione orale con P. gingivalis accelera l'aterosclerosi nelle arterties innominate di ApoE - / - topi, che l'immunizzazione fornisce protezione da progressione della placca, e correla con diminuzioni l'accumulo di lipidi e cellule infiammatorie 11.
In sintesi, questo protocollo descrive le fasi necessarie per produrre un modello robusto di patogeno-indotta infiammazione cronica, come purei metodi utilizzati per valutare l'infiammazione nei siti locali e sistemiche. Oltre a utilizzare questo modello per esaminare accoglienza e patogeni specifici meccanismi coinvolti nella perdita ossea infiammatoria e l'aterosclerosi, che può essere adattato per studiare il contributo del patogeno-indotta infiammazione cronica di modelli di malattia aggiuntivi. Questo può essere realizzato utilizzando modelli transgenici murini di malattie tra cui l'artrite reumatoide, il diabete e il cancro. Emergenti evidenze indica che un certo numero di malattie croniche ad eziologia sconosciuta possono avere origini infettive. Queste malattie includono neoplastica, autoimmune, e la malattia infiammatoria, e insieme compromettono le principali cause di morbilità e mortalità in tutto il mondo. Pertanto, l'uso di modelli animali per esaminare il ruolo di agenti patogeni nelle malattie guidati da infiammazione cronica ha il potenziale per un ampio impatto terapeutico e diagnostica migliorate.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari in competizione.
Riconoscimenti
Questo lavoro è stato supportato dal National Institutes of Allergy e malattie infettive Concedere P01 A1078894 a CAG
Materiali
| Name | Company | Catalog Number | Comments |
| Amira analysis software | Visualization Sciences Group | ||
| Anaerobic chamber DW Scientific Model MG500 | Microbiology International | ||
| BHI | Becton-Dickinson | 211059 | |
| Hemin | Sigma-Aldrich | 51280-5G | |
| Menadione (Vitamin K) | Sigma-Aldrich | M5625-25G | |
| Yeast Extract | Becton-Dickinson | 212750 | |
| Carboxymethyl cellulose (medium viscocity) | Sigma-Aldrich | C-4888 | |
| Sulfamethoxazole and trimethoprim oral suspension 200 mg/40 mg per 5 ml | Hi-Tech Pharmacal | NDC 50383-823-16 | |
| μCT 40 | Scanco | ||
| HistoChoice Tissue Fixative | Sigma-Aldrich | H2904 | |
| Sudan IV | Sigma-Aldrich | S4261-25G | |
| Vertical-bore 11.7T Avance spectrometer | Bruker | ||
| Paravision | Paravision | ||
| ImageJ | NIH | ||
| Rat anti-mouse F4/80 | Serotec | MCA497R | |
| Rat anti-mouse TLR2 | eBioscience | 13-9021-80 | |
| Leica S4 dissecting scope | Leica | ||
| Microm HM 550 cryostat | Microm |
Riferimenti
- Nathan, C., Ding, A. Nonresolving Inflammation. Cell. 140 (6), 871-882 (2010).
- Karin, M., Lawrence, T., Nizet, V. Innate immunity gone awry: linking microbial infections to chronic inflammation and. 124, 823-835 (2006).
- Connor, S. M., Taylor, C. E., Hughes, J. M. Emerging infectious determinants of chronic diseases. Emerging Infectious Diseases. 12 (7), 1051-1057 (2006).
- Barth, K., Remick, D. G., Genco, C. A. Disruption of immune regulation by microbial pathogens and resulting chronic inflammation. Journal of Cellular Physiology. , (2012).
- Hayashi, C., Gudino, C. V., Gibson, F. C. 3rd, Genco, C. A. Review: Pathogen-induced inflammation at sites distant from oral infection: bacterial persistence and induction of cell-specific innate immune inflammatory pathways. Molecular Oral Microbiology. 25 (5), 305-316 (2010).
- Gibson, F. C. 3rd, Ukai, T., Genco, C. A. Engagement of specific innate immune signaling pathways during Porphyromonas gingivalis induced chronic inflammation and atherosclerosis. Frontiers in Bioscience: a Journal and Virtual Library. 13, 2041-2059 (2008).
- Pihlstrom, B. L., Michalowicz, B. S., Johnson, N. W. Periodontal diseases. Lancet. 366 (9499), 1809-1820 (2005).
- Baker, P. J., Evans, R. T., Roopenian, D. C. Oral infection with Porphyromonas gingivalis and induced alveolar bone loss in immunocompetent and severe combined immunodeficient mice. Archives of Oral Biology. 39 (12), 1035-1040 (1994).
- Baker, P. J., Carter, S., Dixon, M., Evans, R. T., Roopenian, D. C. Serum antibody response to oral infection precedes but does not prevent Porphyromonas gingivalis-induced alveolar bone loss in mice. Oral Microbiology and Immunology. 14 (3), 194-196 (1999).
- Gibson, F. C. 3rd, Hong, C., et al. Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice. Circulation. 109 (22), 2801-2806 (2004).
- Hayashi, C., Viereck, J., et al. Porphyromonas gingivalis accelerates inflammatory atherosclerosis in the innominate artery of ApoE deficient mice. Atherosclerosis. 215 (1), 52-59 (2011).
- Hayashi, C., Madrigal, A. G., et al. Pathogen-mediated inflammatory atherosclerosis is mediated in part via Toll-like receptor 2-induced inflammatory responses. Journal of Innate Immunity. 2 (4), 334-343 (2010).
- Hayashi, C., Papadopoulos, G., et al. Protective role for TLR4 signaling in atherosclerosis progression as revealed by infection with a common oral pathogen. Journal of Immunology (Baltimore, Md.: 1950). 189 (7), 3681-3688 (2012).
- Papadopoulos, G., Weinberg, E. O., et al. Macrophage-Specific TLR2 Signaling Mediates Pathogen-Induced TNF-Dependent Inflammatory Oral Bone Loss. The Journal of Immunology. , (2012).
- Gibson, F. C. 3rd, Hong , C., et al. Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice. Circulation. 109 (22), 2801-2806 (2004).
- Miyamoto, T., Yumoto, H., Takahashi, Y., Davey, M., Gibson, F. C. 3rd, Genco, C. A. Pathogen-accelerated atherosclerosis occurs early after exposure and can be prevented via immunization. Infection and Immunity. 74 (2), 1376-1380 (2006).
- Baker, P. J., Dixon, M., Roopenian, D. C. Genetic control of susceptibility to Porphyromonas gingivalis-induced alveolar bone loss in mice. Infection and Immunity. 68 (10), 5864-5868 (2000).
- Baker, P. J., Dixon, M., Evans, R. T., Roopenian, D. C. Heterogeneity of Porphyromonas gingivalis strains in the induction of alveolar bone loss in mice. Oral Microbiology and Immunology. 15 (1), 27-32 (2000).
- Daugherty, A. Mouse models of atherosclerosis. The American Journal of the Medical Sciences. 323 (1), 3-10 (2002).
- Weinreb, D. B., Aguinaldo, J. G. S., Feig, J. E., Fisher, E. A., Fayad, Z. A. Non-invasive MRI of mouse models of atherosclerosis. NMR in Biomedicine. 20 (3), 256-264 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon