Method Article
Un modèle de souris pour l'inflammation chronique induite par pathogène sur les sites locaux et systémiques
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les modèles animaux se sont révélés être des outils précieux dans la définition de mécanismes spécifiques hôtes et pathogènes qui contribuent au développement de l'inflammation chronique. Nous décrivons ici un modèle murin d'infection par voie orale avec l'agent pathogène humain Porphyromonas gingivalis et méthodologies de détail pour évaluer la progression de l'inflammation au niveau des sites locaux et systémiques.
Résumé
L'inflammation chronique est un facteur majeur de détérioration des tissus pathologiques et un élément unificateur de nombreuses maladies chroniques chez les humains, y compris néoplasique, auto-immunes et les maladies inflammatoires chroniques. De nouvelles preuves implique une inflammation chronique induite par un agent pathogène dans le développement et la progression des maladies chroniques avec une grande variété de manifestations cliniques. En raison de l'étiologie complexe et multifactorielle des maladies chroniques, la conception d'expériences pour la preuve de la causalité et l'établissement de liens mécanistes est presque impossible chez l'homme. Un avantage de l'utilisation de modèles animaux est que les deux facteurs génétiques et environnementaux qui peuvent influencer le cours d'une maladie particulière peuvent être contrôlés. Ainsi, la conception des modèles animaux pertinents de l'infection représente une étape clé dans l'identification des mécanismes spécifiques hôtes et pathogènes qui contribuent à l'inflammation chronique.
Nous décrivons ici un modèle de souris de infla chronique induite par un agent pathogènemmation les sites locaux et systémiques après l'infection par l'agent pathogène orale Porphyromonas gingivalis, une bactérie étroitement associé à la maladie parodontale humaine. L'infection orale de souris exemptes d'organismes pathogènes spécifiques induit une réponse inflammatoire locale résultant de la destruction de l'os alvéolaire dent de support, une caractéristique de la maladie parodontale. Dans un modèle de souris établie de l'athérosclérose, l'infection par P. gingivalis accélère le dépôt de plaque inflammatoire dans le sinus aortique et iliaque artère, accompagné de l'activation de l'endothélium vasculaire, une infiltration de cellules immunitaires accrue, et une expression élevée de médiateurs inflammatoires dans les lésions. Nous méthodologies de détail pour l'évaluation de l'inflammation dans les sites locaux et systémiques. L'utilisation de souris transgéniques et des mutants bactériens définis rend ce modèle particulièrement adapté pour identifier l'hôte et facteurs microbiens impliqués dans l'initiation, la progression et les résultats de la maladie. Certains prestatairesy, le modèle peut être utilisé pour le dépistage de nouvelles stratégies thérapeutiques, y compris la vaccination et une intervention pharmacologique.
Introduction
L'inflammation chronique est un facteur majeur de détérioration des tissus pathologiques et un élément unificateur de nombreuses maladies chroniques chez les humains. Ces maladies comprennent néoplasique, auto-immunes et les maladies inflammatoires chroniques 1. L'étiologie de nombreuses maladies chroniques reste incertain, mais on entend complexe et multifactorielle, impliquant à la fois une prédisposition génétique et l'introduction de facteurs environnementaux. Alors que les continuateurs de l'inflammation restent insaisissables, les profils cellulaires et moléculaires de l'activation immunitaire se chevauchent considérablement les tendances observées dans les réponses de l'hôte aux agents pathogènes 2.
Une accumulation de preuves implique une infection par des pathogènes microbiens dans le développement et la progression de l'inflammation chronique et la diversité de ses manifestations cliniques 2,3. Les agents pathogènes peuvent induire et maintenir une inflammation chronique directement par subvertir le système immunitaire de l'hôte et des infections persistantes 4. En l'absence de persistance microbienne, l'infection peut précipiter à partir de l'inflammation chronique des réactions auto-immunes déclenchées par mimétisme moléculaire à des auto-antigènes, les changements dans les auto-antigènes qui les rendent immunogène ou dommages qui libère des antigènes de l'hôte précédemment masquées. Rarement ont cependant pathogènes spécifiques été identifiées comme la cause universelle d'une maladie chronique particulière. Au contraire, la majorité des données disponibles indiquent que les agents pathogènes utilisent des mécanismes distincts pour provoquer une inflammation chronique avec un large spectre de manifestations cliniques et les résultats de la maladie chez l'hôte génétiquement sensibles 3. Ainsi, une compréhension détaillée des mécanismes par lesquels des agents pathogènes spécifiques induire une inflammation chronique peut avoir des implications importantes pour la santé publique, ainsi que le traitement et la prévention de nombreuses maladies chroniques.
Bien que les mécanismes spécifiques hôte et du pathogène contribuant à l'induction et le maintien de l'inflammation chronique sontmal comprises, les progrès de la modélisation de l'inflammation chronique induite par un agent pathogène ont commencé à approfondir notre compréhension de ces processus. Le P. gingivalis modèle d'infection par voie orale est un modèle de souris unique bien caractérisé de l'inflammation chronique induite par un agent pathogène qui permet l'analyse des mécanismes spécifiques hôte et du pathogène contribuant à l'inflammation chronique au niveau local (perte osseuse orale) et les sites systémiques (athérosclérose) 5,6.
P. gingivalis est un agent pathogène par voie orale anaérobie à Gram négatif impliquées dans la maladie parodontale humaine, une maladie inflammatoire chronique infection à moteur caractérisé par la destruction des tissus de la dent de support 7. En plus de la pathologie sur le site initial de l'infection, accumulation de preuves implique P. gingivalis induite par l'inflammation chronique dans le développement et la progression de maladies systémiques, y compris l'athérosclérose 5, caractérisé par une maladie chronique inflammation de la paroi du vaisseau artériel. L'infection orale des agents pathogènes spécifiques souris gratuit avec P. gingivalis induit une réponse inflammatoire locale qui se traduit par la destruction de la dent soutenir l'os alvéolaire 8. P. gingivalis peut être récupéré de la bouche des souris infectées jusqu'à 42 jours après l'infection et 8 souris développer des niveaux élevés d'anticorps dans le sérum des titres spécifiques de pathogènes 9. Dans un modèle de souris établies en utilisant de l'athérosclérose apolipoprotéine-E - / - souris (ApoE - / -), une infection orale avec P. gingivalis induit une inflammation chronique qui entraîne le dépôt de la plaque inflammatoire dans le sinus aortique 10 et l'artère iliaque 11. Inflammation progressive dans l'artère iliaque de P. gingivalis infectés par la souris peuvent être contrôlés d'animaux vivants à l'aide de l'IRM vivo. Histologiquement, les lésions artérielles de P. gingivalis infectés par souris présentent une accumulation accrue de lipides accompagnée par l'activation de l'endothélium vasculaire, une infiltration de cellules immunitaires accrue, et une expression élevée de 12 médiateurs inflammatoires. L'utilisation de ce modèle de souris knock-out a élucidé le rôle d'hôte composants de signalisation et de médiateurs de l'inflammation, ainsi que la cellule d'interactions spécifiques qui conduisent P. gingivalis induite par immunopathologie 12 - 14. En outre, des expériences utilisant des mutants bactériens définis ont identifié P. critique gingivalis facteurs de virulence de contribuer à l'inflammation chronique dans les sites locaux et systémiques 15.
Cet article détaille les méthodologies pour l'évaluation de P. gingivalis induite par une inflammation chronique des sites locaux et systémiques. Nous fournissons un protocole détaillé pour l'analyse de la perte d'os alvéolaire en utilisant le logiciel Amira microCT. En outre, nous définissons l'utilité de série in vivo en direct IRM des animaux pour l'évaluation de la progressiveinflammation dans l'artère iliaque. Nous incluons des méthodologies pour la visualisation et la quantification de la plaque inflammatoire dans les lésions artérielles, et décrivons leur caractérisation histologique. L'utilisation de souris transgéniques et des mutants bactériens définis rend ce modèle particulièrement adapté pour identifier l'hôte et facteurs microbiens impliqués dans l'initiation, la progression et les résultats de la maladie. En outre, le modèle peut être utilisé pour le dépistage de nouvelles stratégies thérapeutiques, y compris la vaccination et une intervention pharmacologique.
Protocole
1. Croissance et culture des bactéries
- Streak congelées stocks de P. gingivalis 381 sur des plaques de gélose au sang anaérobies et incuber pendant 3-5 jours dans une chambre anaérobie (10% de H 2/10% de CO 2 / N 2 à 80%) à 37 ° C.
- Utiliser les organismes de plaque développée pour inoculer 5 ml de cultures liquides de bouillon d'infusion cerveau-coeur (BHI) supplémenté avec de l'extrait de levure (0,5%), de l'hémine (10 ug / ml), et la ménadione (1 ug / ml). Après O / N croissance, transférer les cultures de 5 ml dans 45 ml de BHI.
- Incuber les cultures de 50 ml de liquide par voie anaérobie pour une additional18 - 24 h et la récolte à la mi à la phase logarithmique tardive. REMARQUE pureté de la culture doit toujours être vérifiée par coloration de Gram avant d'introduire des bactéries dans les animaux.
- Récolter les bactéries par centrifugation à 7000 xg pendant 10 min. Aspirer le surnageant et remettre le culot en profondeur de la cellule bactérienne dans 5 ml de PBS en utilisant une pipette sérologique. Ajouter un supplément de45 ml de PBS et on centrifuge à 7000 g pendant 10 min. Répéter cette étape deux fois pour un total de trois lavages.
- Après le dernier lavage, la remise en suspension du culot de cellules dans du PBS de telle sorte qu'une dilution 1:10 de la culture a une densité optique de 1,0 à 660 nm (DO 660 de un 1 est équivalent à 10 9 CFU / ml). Peser suffisamment de carboxyméthylcellulose (La viscosité de la moyenne) pour obtenir une solution à 2% p / v (par exemple 0,1 g pour 5 ml de culture). Ajouter lentement la carboxyméthylcellulose dans la suspension bactérienne pendant vortex, afin d'éviter l'agglutination.
2. Infection orale
NOTE: Comme le montre la figure 1, en utilisant le modèle de souris approprié et orale régime de l'infection, P. gingivalis induit une inflammation chronique et immunopathologie au (cavité buccale) locale et les sites systémiques (artères).
- Administrer sulfaméthoxazole (0,87 mg / ml) et du triméthoprime (0,17 mg / ml) (Sulfatrim) de six à huit semaines-o-Des souris mâles ld ad libitum dans l'eau de boisson pendant 2 semaines afin de réduire la flore normale. Conserver la solution antibiotique dans des bouteilles en verre ambré et le protéger de la lumière pour éviter la dégradation.
- Pour éviter la sédimentation de la solution antibiotique, secouer les bouteilles une fois ou deux fois par jour (c'est à dire, le matin et en fin d'après-midi). Remplacez-la par une solution fraîchement préparée tous les 3 - 5 jours.
- Après deux semaines, remplacer la solution d'antibiotique avec de l'eau de boisson conventionnel. Autoriser une période de repos antibiotique 2 jours avant l'infection par voie orale.
- Chargez le P. gingivalis / véhicule suspension dans une seringue à tuberculine de 1 ml avec une aiguille d'alimentation en annexe. Retenir la souris manuellement en saisissant la nuque à l'arrière de leur cou. Assurer la prise en main est assez ferme pour restreindre la mobilité de la tête de la souris.
- Infecter des souris par application topique de P. gingivalis à la surface buccale des maxillaires. Placez l'aiguille d'alimentation tels that est alignée avec la surface buccale des molaires supérieures droite et éjecter à 50 ul de suspension bactérienne. Disperser la solution doucement le long de la gencive pendant 1 min en utilisant la boule de l'aiguille d'alimentation.
- Laisser la souris se reposer pendant une période de 30 secondes à 1 minute avant de répéter la procédure sur le maxillaire gauche. Les souris témoins reçoivent le pré-traitement antibiotique et un gavage oral avec le véhicule seul (2% de carboxyméthylcellulose dans de la PBS).
- Pour étudier l'inflammation chronique induite par un agent pathogène à des sites locaux induits perte d'os alvéolaire en infectant des souris trois fois à intervalles de 2 jours. Sacrifice des souris 6 semaines plus tard pour l'évaluation de la perte osseuse par microCT.
- Pour examiner l'inflammation chronique induite par un agent pathogène sur les sites locaux et systémiques, infecter l'athérosclérose sujettes ApoE - / - souris 5 fois par semaine pendant 3 semaines.
REMARQUE: Progression de la maladie de l'artère iliaque est contrôlée par série IRM in vivo. souris de l'image à différents points dans le temps et sacrifier 6-16 wks finr. Au moment du sacrifice, évaluer la charge globale d'athérosclérose par en analyse de visage et de déterminer la perte osseuse alvéolaire par microtomographie. Caractériser les lésions d'athérosclérose par l'histologie et l'immunohistochimie.
3 Micro-tomographie par ordinateur (microCT)
- Préparation des échantillons
- Sacrifiez souris au point de temps souhaité après l'infection. Euthanasier les souris par le CO 2 asphyxation ou par une autre méthode approuvée par l'animalerie de l'institution.
REMARQUE: Recueillir le sang par ponction cardiaque, séparer le sérum, et conserver à -80 ° C pour l'analyse des anti-IgG P.gingivalis comme décrit par ailleurs 9. - Utilisez une grande paire de ciseaux de décapitation à la gravité de la tête de la souris à la base du crâne. Retirer la chair avec une paire de forceps et placer le crâne dans un tube conique de 50 ml contenant 30 ml de paraformaldéhyde à 4% tamponné. Fixer l'éprouvette pour les 24 - 48 h à 4 ° C.
- Après fixation, Lérinse l'échantillon soigneusement avec du PBS.
- Créer biopsies de blocs maxillaires.
- Stocker l'hémi-maxillaire dans le grade histologique EtOH à 70% à 4 ° C jusqu'à ce que l'évaluation par microtomographie.
- Sacrifiez souris au point de temps souhaité après l'infection. Euthanasier les souris par le CO 2 asphyxation ou par une autre méthode approuvée par l'animalerie de l'institution.
- Acquisition d'image
- Effectuer des acquisitions d'image en utilisant un scanner de bureau microCT. Réglez la source de rayons X à un courant de 114 pA et une tension de 70 kV. Chargez individu hémi-maxillaires dans le récipient d'imagerie et de numérisation avec une résolution de 12 um dans les trois dimensions spatiales.
REMARQUE: Chargez plusieurs hémi-maxillaires simultanément dans la cuve d'imagerie. - Effectuez un balayage à basse résolution préliminaire qui permet à l'utilisateur de tracer les limites d'acquisition d'images et restreindre le contrôle de la région d'intérêt (ROI) en utilisant le système.
REMARQUE: L'intensité de l'émail rend la couronne des molaires maxillaires faciles à distinguer. En utilisant les molaires comme un guide vaguement fixer les limites de l'imagerie pour englober les trois molaires et le bon alvéolaire entourante. Cette fonction est également utilisée pour distinguer entre l'individu hémi-maxillaires lors de la numérisation de plusieurs échantillons dans le même bateau. - Lorsque la numérisation est terminée, convertir les fichiers d'images brutes (.ISQ) dans dicoms de haute qualité (.dcm).
- Effectuer des acquisitions d'image en utilisant un scanner de bureau microCT. Réglez la source de rayons X à un courant de 114 pA et une tension de 70 kV. Chargez individu hémi-maxillaires dans le récipient d'imagerie et de numérisation avec une résolution de 12 um dans les trois dimensions spatiales.
- Analyse de l'image
Dans ce protocole, l'analyse d'images est effectuée en utilisant une visualisation des données, le traitement et le logiciel d'analyse. Tout d'abord, utiliser repères morphologiques pour créer un plan de meilleure solution pour la jonction émail-cément (CEJ). Ensuite, utilisez la pour transformer l'hémi-maxillaire dans une orientation standard pour l'évaluation subséquente du volume de l'os alvéolaire.- Ouvrez le logiciel et cliquez sur l'icône "Open Data" situé dans le coin supérieur gauche de la piscine. Vous pouvez également utiliser la commande Fichier> Open Data.
- Sélectionnez le DICOM l'image pile et cliquez sur Charger. La fenêtre DICOM Loader s'affiche. Cliquez sur OK.
- Respecter l'ensemble comme une icône verte dans la piscine données. Notez qu'en cliquant sur l'objet de données provoque supplémentaire, maistonnes à afficher dans la zone du bouton en haut de la piscine. En sélectionnant l'icône provoque également des informations sur l'enregistrement de données à afficher dans la zone Propriétés.
- Chaque icône dans la piscine offre un menu contextuel à partir de laquelle les différents modules peuvent être sélectionnés. Activez le menu contextuel en cliquant sur la flèche blanche dans le coin à droite de l'icône de données. Dans le cadre du module d'affichage, sélectionnez Isosurface (Affichage> Isosurface). Le Isosurface icône apparaît dans la zone de la piscine. Lorsqu'il est sélectionné, des réglages supplémentaires apparaissent dans la zone Propriétés.
- Définir le style de dessin pour la transparence et le seuil à 2000. Assurez-vous que la compactify et sous-échantillonner les boutons sont sélectionnés en vertu d'options. Sous moyenne, assurez-x, y, et z sont tous réglés sur 2 Cliquez sur Appliquer pour générer le isosurface.
REMARQUE: Observer une reconstitution 3D transparent de l'hémi-maxillaire dans la visionneuse 3D. L'avantage d'utiliser un style de dessin transparent pour la reconstruction de l'image est que les racines des molaires peutêtre facilement identifiés. Ce sera important lors de la mise de l'échantillon dans l'orientation standard. - Sélectionnez l'icône de données vert et dans la zone Propriétés, sélectionnez l'icône de la culture. Observez une fenêtre affichant les dimensions et les coordonnées des données. Mettre de côté pour l'instant. Notez qu'une zone de sélection apparaît dans la visionneuse 3D avec languettes vertes à chaque coin.
- Sélectionnez le bouton Interagissez avec la barre d'outils de la visionneuse. Modifier la taille de la zone de délimitation en cliquant et glissant sur les coins verts. Assurez-vous que la boîte englobe la région d'intérêt (ROI) et élimine autant d'espace mort et de débris que possible. Cela permettra de réduire la demande de calcul sur l'ordinateur.
- Utilisez le bouton de Trackball dans la barre d'outils de visualisation pour faire pivoter l'objet dans la visionneuse 3D assurer le retour sur investissement est complètement entourée par le cadre de sélection. Lorsque vous êtes satisfait, cliquez sur OK dans la fenêtre de recadrage mis de côté à l'étape 8.
- Sélectionnez l'icône des données et dans le cadre du module d'affichage sélectionner Oblique Slice (OBS). (Affichage> OBS)
- Sélectionnez l'OBS. Dans la zone Propriétés, définissez le type de cartographie en linéaire, la gamme de fenêtre de données de -200 à 10 000, et l'échantillonnage de plus belle. Maintenant, sélectionnez tourner sous options. Observez une bascule rotation dans le centre de la OBS.
- Sélectionnez le bouton interagissent dans la barre d'outils de visualisation et d'utiliser les poignées de la manette pour ajuster le plan de coupe de la tranche. Créer un plan sagittal qui est parallèle à la racine des dents et perpendiculaire à la surface occlusale de la dent. L'avion doit couper en deux les trois molaires (M1-M3), comme illustré sur la Figure 2.
- Éteignez rotation et dupliquer le OBS (object> objet en double). Une nouvelle OBS apparaît nommé OBS 2 Allumez rotation sur pour OBS 2.
- Utilisez la poignée de rotation pour réorienter OBS 2 afin qu'il soit perpendiculaire avec OBS 1 (voir la figure 2).
- Mettez tourner hors de OBS 2 et 3 tranches de créer en double. Ceux-ci seront nommer OBS 3, 4, et 5.
- Reprenant les points pour le Plan de Best Fit
REMARQUE: Les étapes 3.4.1-3.4.5 décrivent l'emplacement de 8 points le long de la CEJ crée un plan d'ajustement optimal. Choisissez quatre des points de sagittales et les quatre autres de coupes coronales (voir la figure 3). Lors de la cueillette des points situés sur les tranches sagittales en 3.4.6, il peut être nécessaire d'ajuster OBS 1.- Aligner une OBS avec le centre de la racine la plus mésiale de M1 dans le plan sagittal. Aligner OBS 2 avec l'axe de la racine la plus mésiale de M1 dans le plan coronal.
- Aligner OBS 3 avec l'axe de la racine bucco-distale de M1 dans le plan coronal. Si nécessaire, ajuster OBS 1 de sorte qu'il est à peu près centrée à la racine bucco-distale de M1 dans le plan sagittal lors de la sélection des points à l'étape 20.
- Alignez OBS 4 avec la furcation des racines vestibulaires de M2. OBS 4 doit être centré entre les racines bucco-mésiales et distales bucco-M2. Si nécessaire, réglez l'esprit OBS 1 de sorte qu'il est à peu près centréeh la racine bucco-distale de M2 dans le plan sagittal lors de la sélection des points à l'étape 20
- Réglez OBS 5 afin qu'il parcourt le centre de M3 dans le plan frontal. Si nécessaire, ajuster OBS 1 de sorte qu'il est à peu près centrée à la racine la plus distale de M3 dans le plan sagittal lors de la sélection des points à l'étape 20.
- Dupliquer une des OBS (OBS 6) et sélectionnez ajustement des points dans la fenêtre des propriétés. L'ajustement des points basculer permet au chercheur de prendre 3 points ou plus sur 2D ou 3D des objets dans la visionneuse, puis calcule un plan de meilleur ajustement. Dans ce cas, les OBS 2D décrites dans les étapes précédentes est utilisé pour sélectionner 8 points le long de la CEJ.
- Cacher OBS 6 de la visionneuse 3D en cliquant sur le bouton orange dans le coin à droite de l'icône de données. Masquer l'isosurface de la visionneuse 3D pour faire la CEJ visible sur toutes les tranches 2D. Maj-clic et sélectionner les 8 points le long de la CEJ comme décrit ci-dessus.
REMARQUE: Si la touche Maj n'est pas enfoncée lors de la sélectiondes points, un plan sera automatiquement calculés après les trois premiers points. - Après avoir sélectionné toutes les 8 points, faire OBS 6 visible. A noter que ceci est une coupe axiale qui s'étend à peu près parallèlement au plan d'occlusion.
- Transformation et de réorientation NOTE: Le plan de mise en place est utilisé pour transformer les données dans une orientation standard pour les mesures volumétriques suivantes.
- Cliquez icône Données> Calculer> ApplyTransform. L'icône de ApplyTransform apparaît dans la zone extérieure. Cliquez sur le carré blanc dans le coin de l'icône de ApplyTransform, sélectionnez référence, et cliquez sur OBS 6.
- Dans la zone Propriétés, sélectionnez standard pour la méthode d'interpolation et étendu pour le mode. Appliquer la transformation.
- Créer une isosurface et un OBS coronaire pour le nouveau fichier de données. Faire tourner les OBS dans la direction axiale de telle sorte qu'elle est à peu près perpendiculaire à M1 (voir figure 2). Utilisez les points de rebroussement de la molaire et l'occlusion curvatures comme un guide.
- Utilisez ce plan pour transformer les données comme dans les étapes 3.5.1 et 3.5.2. Enregistrez le fichier de données transformées.
- Segmentation et volume osseux mesure
REMARQUE: Les étapes suivantes décrivent la segmentation et la mesure de l'os alvéolaire. La tranche correspondant au plan d'ajustement optimal pour le CEJ est identifié et un plan de référence est choisie. L'os alvéolaire entre la jonction émail-cément et le plan de référence sur la face buccale des molaires est segmenté et mesurée. La racine la plus mésiale de M1 et la racine la plus distale de M3 servent comme points de repère finaux. Définition du plan de référence 15-20 tranches en dessous de la CEJ donne des résultats optimaux. L'inclusion de tranches supplémentaires introduit variabilité qui masque les différences de volume osseux entre les groupes de traitement.- Ouvrez l'éditeur de segmentation et de créer un nouveau label pour les données transformées.
- Créer un nouveau matériau et nommer l'os alvéolaire.
- Sous la fenêtre de zoom et de données, mis en plage de données vientm -200 à 10 000.
- Sous Affichage et masquage sélectionner le réticule 2D, 3D MPR et 3D rendu de volume icônes. Définissez la plage de données de 2500 à 8000. Activer le masquage de données.
- Sélectionnez l'affichage Quatre téléspectateurs réglage de la barre d'outils de la visionneuse. L'écran est divisé en quatre quadrants permettant l'examen simultané de sagittales, coronales et images axial piles, ainsi que le volume de rendu 3D.
- Utiliser les quatre quadrants d'identifier la dernière tranche, où l'émail est visible sur les faces vestibulaires des M1 et M3. Cet emplacement correspond au plan de meilleur ajustement pour la JAC. Notez le numéro de la tranche axiale.
- Dans le plan axial, continuer 15-20 tranches vers la crête de l'os alvéolaire. Il s'agit du plan de référence.
- Utilisez n'importe quelle combinaison d'outils de segmentation pour sélectionner l'os alvéolaire sur la face vestibulaire des molaires entre la JAC et le plan de référence. Utilisez la racine la plus mésiale de M1 et la racine la plus distale de M3 comme repères d'extrémité.
- Lorsque vous êtes satisfait, ajouter la sélection à Os alvéolaire dans la liste des matériaux.
- Retour à la piscine de l'objet. Une nouvelle icône avec l'extension ".Labels» devrait être ajouté à l'icône des données d'image. Sélectionnez l'icône étiquettes et dans le menu déroulant sélectionnez Matériaux> MaterialStatistics.
- Dans la zone Propriétés, sélectionnez Matériel et cliquez sur Appliquer. Un tableau apparaît avec plusieurs paramètres pour chaque matériau sur la liste des matériaux. Noter le volume de l'os alvéolaire.
4 Évaluation de l'athérosclérose
- Dissection aortique
- Sacrifier la souris par le CO 2 asphyxie au point de temps souhaité après l'infection.
- Placez la souris sur la face dorsale, bande vers le bas et essuyer la souris avec EtOH à 70%. Couper la peau sur la face ventrale du milieu de l'abdomen juste au-dessus du processus xiphoïde.
- Couper la peau de l'abdomen jusqu'à ce que le processus xiphoïde est visible. Soulevez le processus xiphoïde avec un petit pair de forceps, faire des coupes de chaque côté de la cage thoracique, et couper le diaphragme. Ensuite, faire deux coupes vers le bas de chaque côté de la cage thoracique à exposer le cœur.
- Exsangue la souris en utilisant une seringue à insuline 27 G placée dans l'apex du ventricule droit. Au cours de la collecte de sang, faire tourner périodiquement l'aiguille pour empêcher le blocage de l'ouverture par la paroi ventriculaire. Typiquement, 0,8 à 1 ml de sang peuvent être obtenues en utilisant cette méthode.
- sup> NOTE: Séparer le sérum et conserver à -80 ° C pour l'analyse des anti-IgG P.gingivalis comme décrits ailleurs 9
- Utilisez des ciseaux pour enlever l'oreillette droite.
- Localiser le ventricule gauche sur la face postérieure du cœur. Introduire une aiguille de 21 G dans la pointe du ventricule gauche, avec le biseau de l'aiguille tournée vers le centre de la chambre et vider lentement le système circulatoire avec 3-5 ml de fixateur de tissus.
- Graisse garniture et le thymus qui entoure le cœur.
- Retirez la luNGS.
- Localisez la crosse de l'aorte avec les trois branches et déblayer autour de couches de graisse pour une meilleure exposition.
- Continuer dissection de l'aorte de l'arc à la base de la membrane.
- Retirer le foie et le tissu intestinal déplacer pour exposer l'aorte descendante. Disséquer l'aorte distale vers les branches de l'artère rénale.
- Couper les artères rénales et poursuivre la dissection jusqu'à la bifurcation de l'iléon.
- Une fois que l'aorte est exempt de la plupart des tissus conjonctifs, revenir au sommet de l'aorte et couper la partie tout en haut des trois branches de l'aorte au-dessus du cœur.
- Coeur Peel vers le haut, coupant les tissus adipeux sous-jacentes afin de séparer le cœur de l'organisme.
- Maintenez le cœur avec une pince et tirer vers le haut, coupe du tissu conjonctif qui peuvent encore être fixée, et continuer vers les reins et suivre jusque dans les jambes et couper au point le plus bas possible.
- Fixer aorte en formol à 10% pendant 1 heure avec un subséquent PBS laver pendant 1 heure. Alternativement, magasin aorte en formol à 10% O / N, rincer dans du PBS le jour suivant, et à la dissection.
- La place aorte dans une boîte de Pétri de 10 cm contenant du PBS.
- En utilisant un microscope à dissection, retirez soigneusement le tissu adventice de l'aorte.
- Lorsque aorte est libre de l'excès de graisse et de tissu, coupez les deux tiers inférieurs de coeur. Lancer la distance de pelage du muscle cardiaque à la fin de la face de fond de la crosse de l'aorte. Le bulbe de l'aorte doit apparaître lentement, ce qui sera dans la coloration blanche.
- Continuer dissection minutieuse en utilisant deux pinces jusqu'à ce que les ampoules aortiques sont exempts de tissus du muscle cardiaque.
- Placez aorte nettoyés dans un bac de dissection noir et couvrir avec du PBS.
- Épingler de l'aorte
- Gardez aorte couvert de PBS tout au long de l'épinglage.
- Poser aorte en position anatomique avec des ampoules de l'aorte à gauche.
- Placez les repères de minuties temporaires à 5 emplacements à partir de 1) en haut de l'aorte, 2) ci-dessous troisièmebranche de voûte, 3) à mi-chemin de l'aorte descendante 4) près de l'extrémité inférieure de l'aorte descendante 5) ci-dessus branche de l'artère fémorale.
- Utilisation de beaux ciseaux à ressort supplémentaires, couper le côté gauche de l'aorte, à partir de la branche gauche de l'artère fémorale tout le chemin jusqu'à l'aorte au-dessous de la plus basse branche de l'aorte ascendante.
- Couper d'un côté vers la gauche de la plus faible ampoule aortique à la crevasse et continuer coupe pour atteindre intersection de coupe coupe verticale le long de l'aorte.
- Couper à travers l'aorte horizontale pour atteindre le point le plus bas de la branche de l'aorte ascendante
- Couper vers le haut sur le côté droit ci-dessus plus haute branche de l'aorte.
- Couper chaque branche d'exposer sa surface intérieure.
- Retirez une partie de broches temporaires et les remplacer par des broches permanents avec but de mettre le doigt sur tous aorte localisation anatomique sans pliage, l'étirement de l'aorte. L'objectif est d'exposer la surface interne de l'aorte.
- Continuer jusqu'à ce que tous épinglant surface interne de l'aorte est exposée et visible d'en haut et sans int visuelleerference des broches.
- Lipidique coloration et des lésions Quantification
- Préparer une solution de coloration Soudan IV (5 mg / ml dans 70% d'isopropanol). Bien mélanger et filtrer afin de s'assurer qu'aucun des cristaux sont présents.
- Couverture aorte épinglé dans une solution IV Soudan pendant 50 min.
- Laver avec de l'isopropanol à 70% pendant 1 - 5 min. Rincer délicatement aorte ddH20 que l'eau qui sort de la aorte n'est plus rouge.
- Couvrir aorte avec du PBS. Capturer des images de l'aorte avec une caméra à haute résolution ci-jointe à un microscope à dissection et d'enregistrer des fichiers d'image que numériques (.TIFF). Placez une règle à côté de chaque image pour aider à l'étalonnage.
- Utiliser le logiciel ImageJ pour déterminer la zone de l'intima et de la zone des lésions. Manuellement tracer la surface de l'intima à la zone déterminer. zone de la lésion peut être calculé à l'aide automatisée seuil de couleur. Cela nécessite la fixation d'un seuil pour définir une intensité de couleur qui discrimine les lésions de zones normales.
- Calculer le pourcentage de l'intimale surface couverte par les lésions athérosclérotiques.
5. évaluation histologique des lésions athéroscléreuses
- Récolter crosse de l'aorte avec le tissu cardiaque et plongez dans de l'OCT dans un moule de base disponible.
- Recueillir 5 um cryosections série tous les 50 um dans le sinus et innommé artère aorte à l'aide d'un cryostat fixé à -17 ° C et monter les coupes de tissus sur des lames de microscope. Magasin glisse à -20 ° C jusqu'à utilisation ultérieure.
- Pour l'évaluation histologique, la tache avec de l'hématoxyline et l'éosine en utilisant les procédures appropriées.
6 Caractérisation immunohistochimique de lésions athéroscléreuses.
Les étapes ci-dessous décrivent un protocole général à base d'anticorps sont couramment employées pour évaluer les lésions athéroscléreuses dans P. gingivalis infectés par des souris. Ce protocole nécessite une optimisation pour chaque anticorps ou réactif.
- Retirer les lames du congélateur et fixerpendant 2 min dans la glace-froid fixateur (acétone ou autre fixateur).
- Laisser les lames sont à la température ambiante et étiquette avec un crayon résistant aux solvants.
- Rincer les lames 3x dans du PBS pour éliminer la matrice du tissu au point de congélation
- Bloquer l'activité de la peroxydase endogène par incubation des lames dans 0,3% de H 2 O 2 en solution de PBS pendant 10 min.
- Rincer les lames dans du PBS 3x 2 min à chaque fois.
- Bloquer la liaison non spécifique par incubation dans du tampon de blocage (sérum de lapin à 10% dans du PBS) pendant 30 min à température ambiante.
- Diluer l'anticorps primaire à 1:50 du sérum de lapin à 10%.
- Appliquer l'anticorps dilué à les coupes de tissu sur la lame.
- Incuber pendant 1 heure à température ambiante.
- Rincer les lames dans du PBS pendant 3x 2 min chacun.
- Diluer anti-rat biotinylé anticorps secondaire de 1: 100 à 10% de sérum de lapin.
- Appliquer sur les coupes de tissu sur la lame et incuber pendant 30 min à température ambiante.
- Rincer les lames dans du PBS pendant 3x 2 min chacun.
- Préparer la solution de substrat DAB en ajoutantUne goutte de chromogène DAB pour chaque tampon de 1 ml de DAB.
- Egoutter les lames de PBS et appliquer la solution de substrat DAB. Laisser les lames incuber pendant 5 min ou jusqu'à ce que l'intensité de la couleur désirée est atteinte.
- Laver 3x dans l'eau pendant 2 min chacun.
- tache de compteur à l'hématoxyline.
- Déshydrater par 4 changements d'alcool (95% 1 min, 95% 1 min, 1 min 100% et 100% 5 min).
- Effacer dans 3 bains de xylène.
- Lamelle en utilisant une solution de montage et d'analyser qualitativement par microscopie. Pour l'analyse quantitative, d'acquérir des images et calculer la surface coloration avec ImageJ utilisant un seuil automatique.
7. IRM
- Préparation des animaux pour l'IRM
- Anesthésier les souris avant les expériences d'IRM. Effectuer l'induction initiale de l'anesthésie à l'aide de 4% isofluorane vaporisé pendant 2-3 min dans une chambre d'induction. Maintenir l'anesthésie pendant la période de formation d'image en utilisant un courant continu de 0,5 à 2% vaporisé delivere isofluoraned par une configuration de cône de nez ou d'un masque.
- Après avoir atteint le plan chirurgical de l'anesthésie (c'est à dire, pas de réponse de pincement de l'orteil), placez la souris dans un porte-animal avec son nez inséré dans un cône de nez. Il existe plusieurs types de détenteurs d'animaux disponibles dans le commerce qui peuvent être utilisés pour minimiser le mouvement potentiel lors de l'imagerie. Nous utilisons un support conçu sur mesure avec une barre de morsure.
- Surveiller la respiration et la révolution cardiaque et la synchronisation avec l'acquisition d'image en utilisant un coussin de respiration (placé sur l'abdomen de la souris) équipé d'un petit système de surveillance et de déclenchement animal.
- Fixer la souris et le système de surveillance sur le support de film avec des animaux de laboratoire.
- Acquisition de données IRM
- Placez le porte-animal avec la tête la première de la souris dans une position couchée dans une sonde verticale de 30 mm (Micro 2.5) maintenu à 23 ° C et à la verticale-alésage 11,7 T scanner IRM.
- Alignez le support avec le centre de til RF bobine.
- Mener un processus de calage à l'aide d'une séquence d'impulsions unique.
- En utilisant une séquence RARE, acquérir des images de scouts selon trois orientations orthogonales pour créer des images axiales, coronales et sagittales.
- Effectuer une faible résolution angiographie par résonance magnétique (ARM) en utilisant une séquence d'écho de gradient sans grille 3D avec les paramètres suivants: épaisseur de la dalle = 1,5 cm; angle de bascule = 45 °; temps de répétition = 20 ms; temps d'écho = 2.2 ms; champ de vision = 1,5 × 1,5 × 1,5 cm; matrice = 64 × 64 × 64; nombre de moyenne = 1 temps de cycle total: 2~3 min. Le but de cette analyse est de s'assurer que les images sont acquises à la région cible (l'artère iliaque).
- Effectuez une haute résolution MRA de l'artère iliaque avec une séquence d'écho de gradient sans grille 3D en utilisant les paramètres suivants: épaisseur de la dalle = 1,5 cm; angle de bascule = 45 °; temps de répétition = 20 ms; temps d'écho = 2.2 ms; champ de vision = 1,5 × 1,5 × 1,5 cm; matrice = 128 &# 215; 128 × 128; nombre de moyenne = 4 temps de balayage total était ~ 25 min.
- Obtenir des images axiales continues de l'artère iliaque de 0,5 mm en dessous de la bifurcation sous-clavière.
- L'analyse des données d'IRM
- Effectuer la reconstruction et l'analyse d'images en utilisant un logiciel d'imagerie associée avec le scanner. Atteindre la reconstruction 3D des images ARM par projection d'intensité maximale.
- Utilisation de la bifurcation sous-clavière comme un marqueur anatomique pour aligner les données acquises à partir de souris ou différents de la même souris à différents moments. Choisissez la section cible transversale de l'artère iliaque à 0,3 à 0,5 mm distance en dessous de la subclavianbifurcation.
- Définir et calculer la surface luminale de la section choisie avec ImageJ. Les mesures doivent être effectuées en aveugle par deux observateurs indépendants. Vérifiez la reproductibilité des mesures en calculant les coefficients de corrélation interclasses.
- Pour les études longitudinales avec imag sérietion, de normaliser la zone luminale de la zone de la lumière obtenue au niveau de référence (la première boîte dans l'étude) pour chaque souris. Exprimer les résultats que le changement dans la région luminale au fil du temps.
- Effectuer les analyses statistiques appropriées (c.-à-test t de Student) pour déterminer des différences significatives entre les groupes expérimentaux.
Résultats
En utilisant le modèle de la souris par voie orale appropriée et le régime de l'infection à P. gingivalis induit une inflammation chronique et immunopathologie au (cavité buccale) locale et les sites systémiques (artères) (figure 1).
Chez la souris, l'infection orale avec P. gingivalis induit une réponse inflammatoire locale qui entraîne la destruction de la dent soutenir l'os alvéolaire 8. P. gingivalis infectés par souris développent réponses des anticorps sériques à cet organisme qui sont principalement de l'isotype IgG 9. Les résultats présentés sur la figure 4 sont représentatives d'une expérience dans laquelle des souris C57BL / 6 ont été infectées par P.gingivalis trois fois à des intervalles de deux jours et 6 semaines plus tard sacrifiés pour l'évaluation de la perte d'os alvéolaire par microCT. Analyse volumétrique en utilisant le logiciel Amira révèle que P. Les souris gingivalis de présentent une perte osseuse significative par rapport aux témoins non infectés (figure 4A). L'inspection visuelle des reconstruite hémi-maxillaires illustre une augmentation de la surface exposée des racines des molaires chez la souris infectée par rapport aux témoins (figure 4B et la figure 4C).
Dans ApoE athérosclérose sujettes - souris, P. - / gingivalis induit une inflammation chronique qui entraîne la perte de l'os alvéolaire 12 et le dépôt de la plaque dentaire à l'intérieur de l'inflammation des sinus de l'aorte 15 et l'artère brachiocéphalique 11. P. gingivalis induite par l'athérosclérose se produit dès les premières 24 heures après la dernière infection et peuvent être évités par la vaccination avant l'infection 16. Inflammation progressive de l'artère iliaque de P. gingivalis infectés par la souris peuvent être surveillés chez les souris en direct par série en IRM in vivo à divers moments après l'infection (figure 5). Fr mesures face du Soudan IV aortes colorées démontre que P. gingivalisinfection augmente de manière significative le dépôt de lipides et de la zone lésionnelle sur la surface de l'intima (figure 6). Au moment du sacrifice, l'histologie et immunohistochimie peut être utilisée pour caractériser qualitativement ou quantitativement les lésions athéroscléreuses, dans le contexte de la composition cellulaire, l'expression de divers antigènes, et la teneur en lipides. L'analyse immunohistochimique des lésions sinus aortique révèle une augmentation infiltration macrophagique et une expression élevée du récepteur immunitaire récepteur Toll-like inné 2 (TLR2) dans P. gingivalis souris infectée par (figure 7).

Figure 1: P. gingivalis induite par une inflammation chronique des sites locaux et systémiques. Avant l'infection par P. souris gingivalis sont administe rouge antibiotiques ad libitum dans l'eau potable pendant 10-14 jours, suivie d'une période de repos antibiotique de deux jours. Le traitement antibiotique supprime la flore buccale autochtones et facilite la colonisation. Pour l'induction de la perte alvéolaire, les souris sont infectées par trois fois à des intervalles de deux jours et le volume de l'os alvéolaire est mesurée 6 semaines post-infection. Lors de l'évaluation de l'athérosclérose, l'athérosclérose sujettes ApoE - / - souris sont généralement infectées 5 fois par semaine pendant 3 semaines et sacrifiés 16-24 semaines après l'infection. Inflammation progressive dans l'artère iliaque de souris vivantes peut être mesurée par série en IRM in vivo à divers moments après l'infection. Histologie et immunohistochimie peuvent être utilisés pour colorer les lipides et les cellules inflammatoires à la fin de l'expérience, pour valider les données d'imagerie. Au moment du sacrifice, la perte osseuse alvéolaire est mesurée par microtomographie et le fardeau d'athérosclérose mondiale est évaluée par coloration en surface des aortes entières. https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/51556/51556fig1highres.jpg "target =" _blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
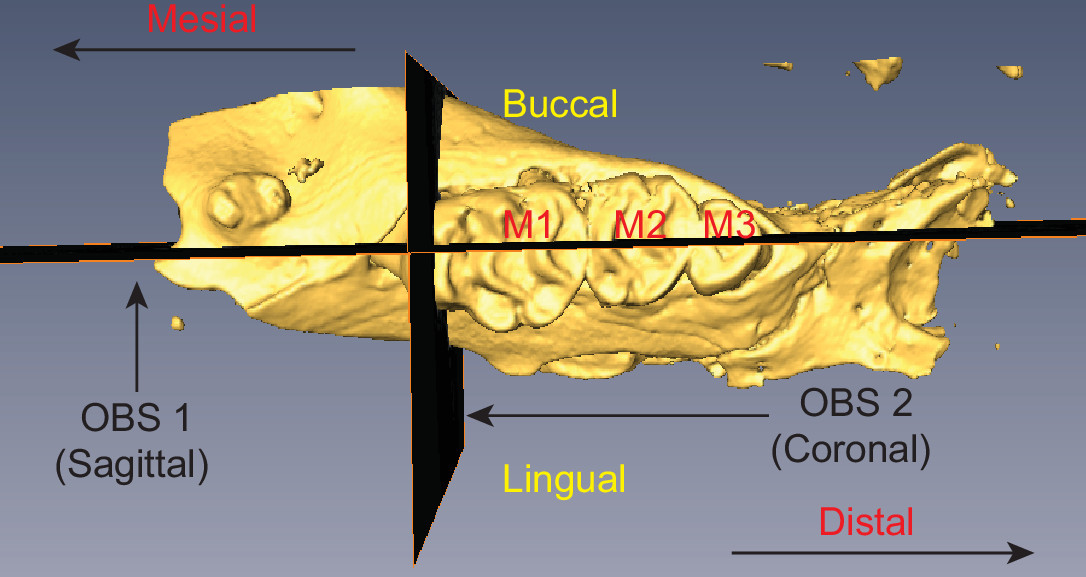
Figure 2 Souris hémi-maxillaire illustrant le positionnement de OBS 1 et 2 OBS Les trois molaires sont étiquetés (M1-M3) et la terminologie anatomique pertinente est indiqué. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3 souris hémi-maxillaire illustrant le positionnement de OBS 1 à 5.1556 / 51556fig3highres.jpg "target =" _blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4. perte d'os alvéolaire, telle que mesurée par microtomographie. C57BL Homme / 6 ont été infectées par voie orale avec P. gingivalis ou du véhicule (non infectés) et le volume de l'os alvéolaire a été évaluée par microCT 6 semaines plus tard à l'aide Amira. (A) le volume de l'os alvéolaire dans l'hémi-maxillaires de non infecté et P. gingivalis infectés par C57BL / 6. Les résultats représentent le volume osseux au-dessus du plan de référence (120 microns à partir de la jonction émail-cément). Les données sont exprimées comme le volume de l'os à partir de SD n = 8 souris par groupe. *** P <0,001, par rapport à des témoins non infectés. (B) et (C) représentant reconstructions 3D de l'hémi-maxillaires de non infecté (B)et P. gingivalis infectés par (C) chez la souris. Une diminution significative du volume osseux alvéolaire peut être vu dans P. gingivalis infectés par rapport à des souris témoins non infectés. Pointes de flèches indiquent les zones où la perte osseuse se produit visible dans P. souris infectées par gingivalis (note de l'augmentation de la surface exposée des racines des molaires). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5 progressiste inflammation dans l'artère iliaque suivant P. infection gingivalis, mesurée par IRM (A) par résonance magnétique représentant (MR) angiographie de crosse de l'aorte et des gros vaisseaux d'un ApoE. -/ -. Souris (B) Coupe axiale M. de la ligne jaune en A de l'artère iliaque d'une souris, 0,3 mm en dessous de sa bifurcation. Artères innommés ont été imagées par MRA au départ et à 12 et 16 semaines après l'infection. (C) L'évolution temporelle de la zone luminale (mm 2) a été calculé pour chaque souris (n = 10-12 / groupe). Uninfected ApoE - / - (bleu); P. gingivalis infectés par ApoE - / -. (rouge) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
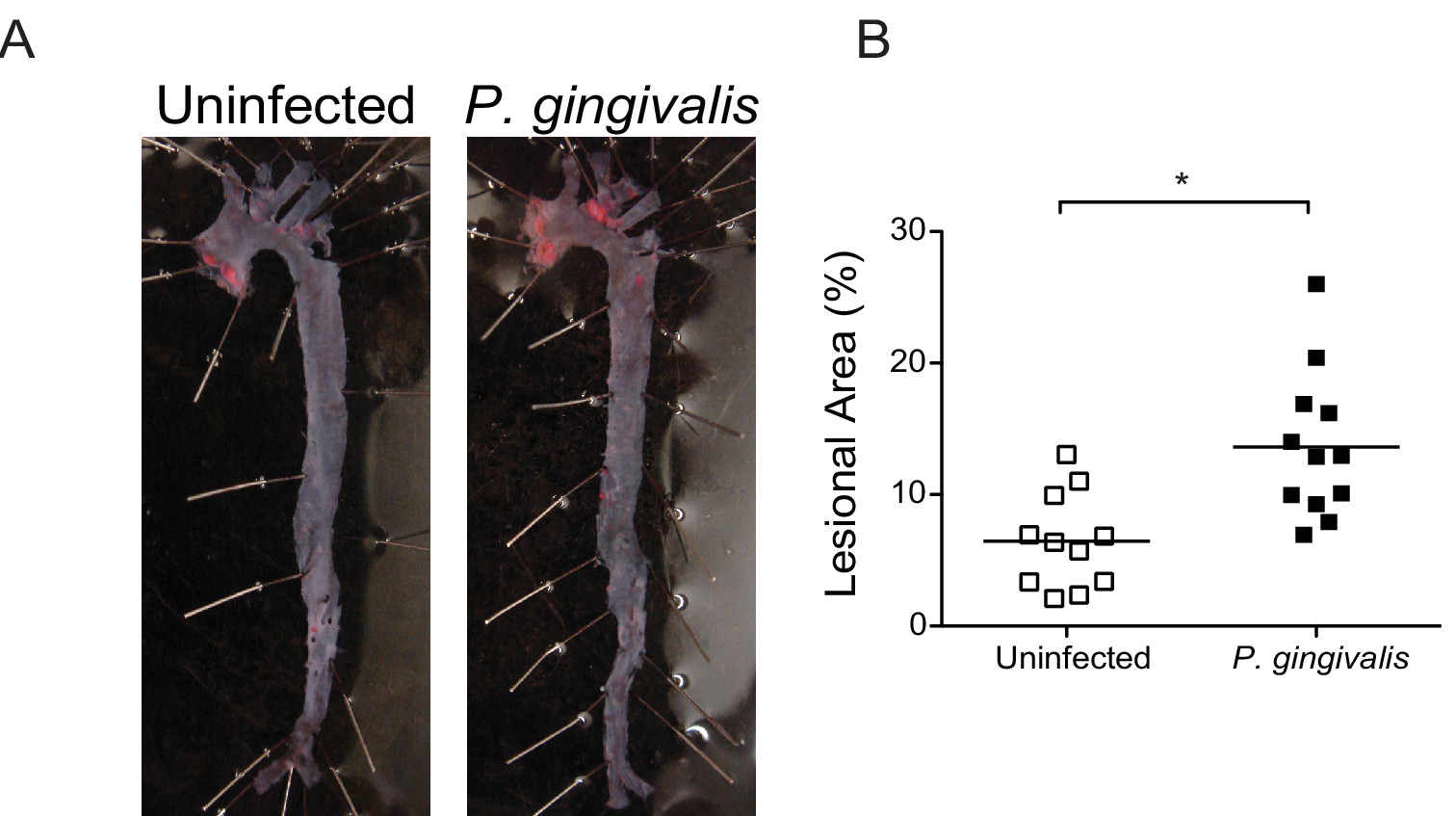
Figure 6 détermination En face de la zone lésionnelle dans l'ensemble aorte. (A) Soudan IV de la coloration de l'aorte en lésions du visage 16 semaines après l'infection avec P. gingivalis. (B) Quantification de la teneur en lipides dans l'aorte total de non infectées (symboles blancs) et P. gingivalis souris infectée par le (symboles noirs) (n = 10-13 / groupe). Pourcentage de l'aorte occupée par les lipides a été calculée en utilisant ImageJ. * P <0,05. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 7 L'analyse immunohistochimique des lésions sinus aortique Homme ApoE -. / - Souris nourris avec un régime alimentaire normal chow étaient infectés par P. gingivalis ou non infecté et sacrifiés 16 semaines après l'infection. Cryosections obtenus à partir des sinus aortiques ont été colorées avec anti-souris F4 / 80 et TLR2. La barre d'échelle, 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Le P. gingivalis modèle d'infection orale constitue un outil précieux pour l'étude de l'inflammation chronique induite par un agent pathogène sur les sites locaux et systémiques. Ce modèle unique permet la caractérisation de deux mécanismes spécifiques hôte et du pathogène contribuant à l'inflammation chronique et l'immunopathologie. En outre, le modèle peut être utilisé pour le dépistage de nouvelles stratégies thérapeutiques, y compris la vaccination et une intervention pharmacologique. Les étapes décrites dans ce protocole décrivent l'utilisation réussie de ce modèle et de détail des méthodologies pour évaluer l'initiation, la progression et les résultats de P. gingivalis induite par une inflammation chronique.
Il ya plusieurs aspects essentiels à garder à l'esprit lors de l'utilisation de ce protocole d'examiner inflammatoire perte osseuse. Tout d'abord, il convient de noter que le résultat d'une infection par P. gingivalis est déterminée par trois facteurs principaux: 1) la susceptibilité génétique de l'hôte à l'infection 2) pathogènevirulence (génétique de l'agent pathogène) et 3) l'interaction hôte-pathogène résultant (l'interaction de ces deux génomes). La sensibilité à P. gingivalis induite par la perte osseuse alvéolaire est génétiquement déterminée chez la souris, donc il faut être prudent lors de la sélection de la souche de souris pour l'étude 17. Réponses de l'hôte différentiel entre les souches consanguines de souris peuvent être mis à profit pour mener des écrans avant génétiques et caractériser les gènes impliqués dans la résistance et sensibles à l'inflammation chronique induite par un agent pathogène. En outre, il existe une hétérogénéité considérable de la capacité des différents P. gingivalis souches pour induire une perte de l'os alvéolaire chez des souris 18. Ce protocole utilise des souris sur la souris C57BL / 6 de fond en raison de la disponibilité des souris transgéniques et leur sensibilité à l'athérosclérose. P. souche gingivalis 381 induit une perte de l'os alvéolaire et de l'athérosclérose chez la souris sur le C57BL / 6 fond, et plusieurs mutants bactériens ont été conçus en utilisant this souche.
Les souris sont particulièrement résistants à l'athérosclérose et le développement de lésions artérielles manifestes nécessite l'utilisation de modèles de souris transgéniques de l'athérosclérose. Nous utilisons l'ApoE - modèle de la souris, car il est le modèle de la souris bien établie de l'athérosclérose, ne nécessite pas d'alimentation de régime riche en graisses pour la formation de lésions, et récapitule nombreux aspects de la maladie chez l'homme 19 - /. Le type de régime alimentaire pour nourrir les animaux pendant la durée de l'expérience est une variable importante. Pour la majorité de notre travail, nous nous nourrissons des souris un régime alimentaire normal chow pour éviter l'apport de lipides exogènes dans l'interprétation de nos résultats. Dans des études préliminaires, nous avons constaté que l'alimentation des souris un masque de régime riche en graisses différences de fr visage zone de lésion entre non infecté et P. gingivalis infectés par des souris dans le sinus aortique. Toutefois, un régime riche en graisses et P. gingivalis travail de l'infection en synergie lorsque la progression de l'inflammation est surveillée dans le innommé par IRM ou l'histologie 11. Chez la souris, l'artère iliaque a un haut degré de progression de la lésion, et des lésions dans cette artère expresse des traits caractéristiques de la maladie clinique chez l'homme, y compris le rétrécissement des vaisseaux, les médias atrophiques, inflammation périvasculaire, et la perturbation de la plaque. Distinctions dans la composition cellulaire des lésions sont visibles sur différents sites anatomiques. Les macrophages sont des cellules immunitaires primaires infiltrant les lésions du sinus aortique, alors que les lésions de l'artère iliaque sont composées de deux macrophages et les cellules T.
Durée expérimentale et le point de temps auquel paramètres inflammatoires sont évalués sont d'autres facteurs à prendre en considération lors de l'évaluation initiation, la progression et les résultats de P. gingivalis induite par l'athérosclérose. Nous avons déjà démontré que P. gingivalis infectés par ApoE - / - souris présentent l'infiltration des macrophages, une expression élevée de marqueurs immunitaires innées, unnd augmentation du dépôt de plaque inflammatoire aussi tôt que 24 heures après la dernière infection dans le sinus aortique et cela peut être évité par la vaccination 16. Dans notre augmentation mains, l'inflammation et l'immunopathologie avec l'avance en âge et sont évidents jusqu'à 24 semaines après l'infection. Toutefois, les décisions relatives à la durée de l'étude reposent en fin de compte sur l'hypothèse sous-jacente à l'étude, le mode d'analyse et de la connaissance préalable de l'étendue de l'athérosclérose dans des conditions environnementales particulières.
L'utilisation de techniques d'imagerie non invasives pour surveiller l'inflammation progressive dans l'artère iliaque peut être utilisé pour guider la durée expérimentale. L'IRM permet de série pour des études détaillées de la progression de l'athérosclérose chez le même animal que peut représenter le rétrécissement de la lumière artérielle et les petits vaisseaux zones de paroi 20. Contrairement aux méthodes traditionnelles, telles que la coloration des lipides vaisseaux disséqués, l'imagerie par résonance magnétique ne nécessite pas l'euthanasieet permet des études longitudinales pour évaluer l'initiation et la progression de l'athérosclérose. En conjonction avec les souris transgéniques, des mutants bactériens ou des traitements expérimentaux, l'information temporelle fournie par l'IRM peut être utilisée pour évaluer l'effet de la génétique de l'hôte, des facteurs de virulence de l'agent pathogène, et une intervention thérapeutique. Comme un avantage supplémentaire, l'histologie et l'immunohistochimie peut être utilisé pour colorer pour les lipides et des cellules inflammatoires à la fin de l'expérience pour valider les données d'imagerie. Nous avons récemment utilisé ces méthodes pour démontrer que l'infection orale avec P. gingivalis accélère l'athérosclérose chez les arterties innommés de ApoE - / - souris, que la vaccination offre une protection contre la progression de la plaque, et est corrélée à une diminution de l'accumulation de lipides et de cellules inflammatoires 11.
En résumé, ce protocole décrit les étapes nécessaires pour produire un modèle robuste de l'inflammation chronique induite par un agent pathogène, ainsique les méthodes utilisées pour évaluer l'inflammation dans les sites locaux et systémiques. Mis à part l'utilisation de ce modèle pour étudier les mécanismes spécifiques hôte et l'agent pathogène en cause de la perte osseuse et l'athérosclérose inflammatoire, il peut être adapté à l'étude de la contribution de l'inflammation chronique induite par un agent pathogène à d'autres modèles de maladie. Ceci peut être accompli en utilisant des modèles de souris transgéniques de la maladie, y compris la polyarthrite rhumatoïde, le diabète et le cancer. De nouvelles données indiquent qu'un certain nombre de maladies chroniques d'étiologie inconnue peuvent avoir des origines infectieuses. Ces maladies comprennent néoplasique, auto-immune, et la maladie inflammatoire, et ainsi compromettre les principales causes de morbidité et de mortalité dans le monde. Ainsi, l'utilisation de modèles animaux pour étudier le rôle des agents pathogènes dans les maladies entraînées par une inflammation chronique a le potentiel pour la large effet thérapeutique et de diagnostic améliorés.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Ce travail a été financé par les Instituts nationaux de l'allergie et des maladies infectieuses Grant P01 A1078894 à CAG
matériels
| Name | Company | Catalog Number | Comments |
| Amira analysis software | Visualization Sciences Group | ||
| Anaerobic chamber DW Scientific Model MG500 | Microbiology International | ||
| BHI | Becton-Dickinson | 211059 | |
| Hemin | Sigma-Aldrich | 51280-5G | |
| Menadione (Vitamin K) | Sigma-Aldrich | M5625-25G | |
| Yeast Extract | Becton-Dickinson | 212750 | |
| Carboxymethyl cellulose (medium viscocity) | Sigma-Aldrich | C-4888 | |
| Sulfamethoxazole and trimethoprim oral suspension 200 mg/40 mg per 5 ml | Hi-Tech Pharmacal | NDC 50383-823-16 | |
| μCT 40 | Scanco | ||
| HistoChoice Tissue Fixative | Sigma-Aldrich | H2904 | |
| Sudan IV | Sigma-Aldrich | S4261-25G | |
| Vertical-bore 11.7T Avance spectrometer | Bruker | ||
| Paravision | Paravision | ||
| ImageJ | NIH | ||
| Rat anti-mouse F4/80 | Serotec | MCA497R | |
| Rat anti-mouse TLR2 | eBioscience | 13-9021-80 | |
| Leica S4 dissecting scope | Leica | ||
| Microm HM 550 cryostat | Microm |
Références
- Nathan, C., Ding, A. Nonresolving Inflammation. Cell. 140 (6), 871-882 (2010).
- Karin, M., Lawrence, T., Nizet, V. Innate immunity gone awry: linking microbial infections to chronic inflammation and. 124, 823-835 (2006).
- Connor, S. M., Taylor, C. E., Hughes, J. M. Emerging infectious determinants of chronic diseases. Emerging Infectious Diseases. 12 (7), 1051-1057 (2006).
- Barth, K., Remick, D. G., Genco, C. A. Disruption of immune regulation by microbial pathogens and resulting chronic inflammation. Journal of Cellular Physiology. , (2012).
- Hayashi, C., Gudino, C. V., Gibson, F. C. 3rd, Genco, C. A. Review: Pathogen-induced inflammation at sites distant from oral infection: bacterial persistence and induction of cell-specific innate immune inflammatory pathways. Molecular Oral Microbiology. 25 (5), 305-316 (2010).
- Gibson, F. C. 3rd, Ukai, T., Genco, C. A. Engagement of specific innate immune signaling pathways during Porphyromonas gingivalis induced chronic inflammation and atherosclerosis. Frontiers in Bioscience: a Journal and Virtual Library. 13, 2041-2059 (2008).
- Pihlstrom, B. L., Michalowicz, B. S., Johnson, N. W. Periodontal diseases. Lancet. 366 (9499), 1809-1820 (2005).
- Baker, P. J., Evans, R. T., Roopenian, D. C. Oral infection with Porphyromonas gingivalis and induced alveolar bone loss in immunocompetent and severe combined immunodeficient mice. Archives of Oral Biology. 39 (12), 1035-1040 (1994).
- Baker, P. J., Carter, S., Dixon, M., Evans, R. T., Roopenian, D. C. Serum antibody response to oral infection precedes but does not prevent Porphyromonas gingivalis-induced alveolar bone loss in mice. Oral Microbiology and Immunology. 14 (3), 194-196 (1999).
- Gibson, F. C. 3rd, Hong, C., et al. Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice. Circulation. 109 (22), 2801-2806 (2004).
- Hayashi, C., Viereck, J., et al. Porphyromonas gingivalis accelerates inflammatory atherosclerosis in the innominate artery of ApoE deficient mice. Atherosclerosis. 215 (1), 52-59 (2011).
- Hayashi, C., Madrigal, A. G., et al. Pathogen-mediated inflammatory atherosclerosis is mediated in part via Toll-like receptor 2-induced inflammatory responses. Journal of Innate Immunity. 2 (4), 334-343 (2010).
- Hayashi, C., Papadopoulos, G., et al. Protective role for TLR4 signaling in atherosclerosis progression as revealed by infection with a common oral pathogen. Journal of Immunology (Baltimore, Md.: 1950). 189 (7), 3681-3688 (2012).
- Papadopoulos, G., Weinberg, E. O., et al. Macrophage-Specific TLR2 Signaling Mediates Pathogen-Induced TNF-Dependent Inflammatory Oral Bone Loss. The Journal of Immunology. , (2012).
- Gibson, F. C. 3rd, Hong , C., et al. Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice. Circulation. 109 (22), 2801-2806 (2004).
- Miyamoto, T., Yumoto, H., Takahashi, Y., Davey, M., Gibson, F. C. 3rd, Genco, C. A. Pathogen-accelerated atherosclerosis occurs early after exposure and can be prevented via immunization. Infection and Immunity. 74 (2), 1376-1380 (2006).
- Baker, P. J., Dixon, M., Roopenian, D. C. Genetic control of susceptibility to Porphyromonas gingivalis-induced alveolar bone loss in mice. Infection and Immunity. 68 (10), 5864-5868 (2000).
- Baker, P. J., Dixon, M., Evans, R. T., Roopenian, D. C. Heterogeneity of Porphyromonas gingivalis strains in the induction of alveolar bone loss in mice. Oral Microbiology and Immunology. 15 (1), 27-32 (2000).
- Daugherty, A. Mouse models of atherosclerosis. The American Journal of the Medical Sciences. 323 (1), 3-10 (2002).
- Weinreb, D. B., Aguinaldo, J. G. S., Feig, J. E., Fisher, E. A., Fayad, Z. A. Non-invasive MRI of mouse models of atherosclerosis. NMR in Biomedicine. 20 (3), 256-264 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon