Method Article
Um modelo de rato para induzida por patógeno inflamação crônica no local e sistêmica Sites
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os modelos animais provaram ser ferramentas valiosas para a definição de acolhimento e de patógenos mecanismos específicos que contribuem para o desenvolvimento da inflamação crônica. Aqui nós descrevemos um modelo do rato de infecção oral com o patógeno humano Porphyromonas gingivalis e metodologias detalhe para avaliar a progressão da inflamação em sites locais e sistêmicos.
Resumo
A inflamação crônica é um importante motor de danos no tecido patológico e uma característica unificadora de muitas doenças crônicas em seres humanos, incluindo neoplásicas, auto-imunes e doenças inflamatórias crônicas. Emergentes evidência implica inflamação crônica induzida por patógeno no desenvolvimento e progressão de doenças crônicas com uma grande variedade de manifestações clínicas. Devido à etiologia complexa e multifatorial da doença crônica, projetar experimentos para a prova do nexo de causalidade e do estabelecimento de relações mecanicistas é quase impossível em humanos. Uma vantagem da utilização de modelos animais, é que ambos os factores genéticos e ambientais que podem influenciar o curso de uma doença particular pode ser controlada. Assim, projetar modelos animais relevantes de infecção representa um passo fundamental na identificação de acolhimento e de patógenos mecanismos específicos que contribuem para a inflamação crônica.
Aqui nós descrevemos um modelo de mouse induzida por patógeno Infla crônicammation em sites locais e sistêmicos após a infecção com o patógeno Porphyromonas gingivalis via oral, uma bactéria estreitamente associada à doença periodontal humano. A infecção oral de agentes patogénicos específicos de ratos livre induz uma resposta inflamatória local, resultando na destruição de dente de apoio do osso alveolar, uma marca da doença periodontal. Em um modelo de camundongo estabelecido de aterosclerose, infecção com P. gingivalis acelera deposição de placas inflamatórias dentro da artéria inominada e sinus aórtico, acompanhado por activação do endotélio vascular, a um aumento da infiltração de células imunitárias, e a expressão elevada de mediadores inflamatórios em lesões. Nós metodologias detalhe para a avaliação da inflamação em sites locais e sistêmicos. O uso de camundongos transgênicos e bactérias mutantes definidos torna este modelo particularmente adequado para identificar tanto o hospedeiro e os fatores microbianos envolvidos na iniciação, progressão e evolução da doença. Adicionalmente podey, o modelo pode ser utilizado para o rastreio de novas estratégias terapêuticas, incluindo a vacinação e a intervenção farmacológica.
Introdução
A inflamação crônica é um importante motor de danos no tecido patológico e uma característica unificadora de muitas doenças crônicas em seres humanos. Estas doenças neoplásicas incluem, auto-imunes, doenças inflamatórias crónicas e um. A etiologia de muitas doenças crônicas ainda não está claro, mas entende-se complexa e multifatorial, envolvendo tanto a predisposição genética ea introdução de fatores ambientais. Enquanto os perpetuadores da inflamação permanecem ainda desconhecidos, os perfis celulares e moleculares da ativação imune sobrepõem consideravelmente com esses padrões observados na resposta do hospedeiro a patógenos 2.
Evidências crescentes implica a infecção por patógenos microbianos no desenvolvimento e na progressão da inflamação crônica e suas diversas manifestações clínicas 2,3. Patógenos podem induzir e manter a inflamação crônica diretamente por subverter o sistema imune do hospedeiro e infecções persistentes 4. Na ausência de persistência microbiana, a infecção pode precipitar a inflamação crônica de reações auto-imunes desencadeadas por mimetismo molecular para auto-antígenos, mudanças na auto-antígenos que os tornam imunogênica, ou dano que libera antígenos do hospedeiro previamente mascarados. Raramente no entanto ter patogénios específicos foram identificados como a causa de uma doença universal crónica particular. Em vez disso, a maioria dos dados disponíveis sugere que os patógenos usar mecanismos distintos para provocar inflamação crônica com um amplo espectro de manifestações clínicas e evolução das doenças no hospedeiro geneticamente suscetível 3. Assim, uma compreensão detalhada dos mecanismos pelos quais os patógenos específicos induzem a inflamação crônica pode ter implicações importantes para a saúde pública, bem como tratamento e prevenção de muitas doenças crônicas.
Embora os mecanismos específicos do hospedeiro e do patógeno que contribuem para a indução e manutenção da inflamação crónica estámal compreendida, os avanços na modelagem de inflamação crônica induzida por patógeno começaram a promover nossa compreensão desses processos. O P. gingivalis modelo de infecção oral é um rato modelo único, bem caracterizada de inflamação crônica induzida por patógeno que permite a análise de acolhimento e de patógenos mecanismos específicos que contribuem para a inflamação crônica no local (perda óssea bucal) e sítios sistêmicos (aterosclerose) 5,6.
P. gingivalis é, um agente patogénico bucal anaeróbio Gram-negativas implicadas na doença periodontal humano, uma doença inflamatória crónica impulsionado-infecção caracterizada pela destruição de tecidos de suporte dos dentes 7. Além de patologia no local inicial da infecção, evidências acumuladas implica P. gingivalis induzida por inflamação crônica no desenvolvimento e progressão de doenças sistêmicas, incluindo a aterosclerose 5, uma doença caracterizada por inflammatio crônican da parede do vaso arterial. A infecção oral de-patógeno específico camundongos livre com P. gingivalis induz uma resposta inflamatória local, que resulta na destruição de osso alveolar de suporte do dente 8. p gingivalis pode ser recuperado das bocas de camundongos infectados até 42 dias após a infecção e 8 ratos desenvolver altos níveis de anticorpos séricos títulos específicos do micróbio 9. Em um modelo de camundongo estabelecido de aterosclerose utilizando-apolipoproteína E - / - murganhos (ApoE - / -), a infecção com P. bucal gingivalis induz inflamação crônica que leva a deposição de placa inflamatória dentro do seio da aorta 10 e 11 da artéria inominada. Inflamação progressiva dentro da artéria inominada P. gingivalis infectados camundongos pode ser monitorado em animais vivos, usando ressonância magnética in vivo. Histologicamente, as lesões arteriais de P. gingivalis infectados camundongos apresentam maior acúmulo de lipídios acomnhado por activação do endotélio vascular, um aumento infiltrado de células imunitárias, e a expressão elevada de mediadores inflamatórios 12. A utilização deste modelo em ratinhos knockout elucidou o papel de elementos de sinalização de acolhimento e de mediadores inflamatórios, assim como a célula de interacções específicas que dirigem P. gingivalis induzida imunopatologia 12-14. Além disso, as experiências utilizando mutantes bacterianas definidas identificaram P. crítico gingivalis fatores de virulência que contribuem para a inflamação crônica em sites locais e sistêmicos 15.
Este artigo detalha metodologias para a avaliação de P. gingivalis induzida por inflamação crônica em sites locais e sistêmicos. Nós fornecer um protocolo detalhado para a análise de perda de osso alveolar por microCT usando software Amira. Além disso, definimos a utilidade da série in vivo MRI animal vivo para a avaliação da progressiva eminflamação dentro da artéria inominada. Nós incluem metodologias para a visualização e quantificação de placa inflamatória em lesões arteriais, e descrever sua caracterização histológica. O uso de camundongos transgênicos e bactérias mutantes definidos torna este modelo particularmente adequado para identificar tanto o hospedeiro e os fatores microbianos envolvidos na iniciação, progressão e evolução da doença. Além disso, o modelo pode ser utilizado para o rastreio de novas estratégias terapêuticas, incluindo a vacinação e a intervenção farmacológica.
Protocolo
1. Crescimento e cultivo de bactérias
- Streak congelado estoques de P. gingivalis 381 em placas de agar sangue anaeróbias e incubar durante 3 - 5 dias numa câmara de anaerobiose (10% de H 2/10% de CO 2/80% N 2) a 37 ° C.
- Usar os organismos cultivados de placa para inocular 5 ml de culturas líquidas de caldo de infusão de cérebro e coração (BHI) suplementado com extracto de levedura (0,5%), hemina (10 ug / ml), e menadiona (1 ug / ml). Após O crescimento / N, transferir os 5 ml culturas em 45 ml de BHI.
- Incubar as 50 ml culturas líquidas anaeróbia para um additional18 - 24 horas e colheita em meados de fase log tarde. NOTA pureza da cultura deve ser sempre verificada por coloração de Gram antes da introdução de bactérias em animais.
- Colher as bactérias por centrifugação a 7000 xg durante 10 min. Aspirar o sobrenadante e ressuspender cuidadosamente o sedimento de células de bactérias em 5 ml de PBS utilizando uma pipeta serológica. Adicionar um adicional45 ml de PBS e centrifugar a 7000 x g durante 10 min. Repetir este passo duas vezes para um total de três lavagens.
- Após a última lavagem, ressuspender o sedimento celular em PBS de tal modo que uma diluição de 1:10 da cultura tem uma densidade óptica de 1,0 a 660 nm (uma DO660 de 1 é equivalente a 10 9 CFU / ml). Pesar carboximetilcelulose suficiente (Viscosidade média) para obter uma solução a 2% w / v (por exemplo, 0,1 g por 5 ml de cultura). Adiciona-se lentamente a carboximetilcelulose com a suspensão bacteriana, enquanto vórtex, a fim de evitar a aglutinação.
2. Infecção Oral
NOTA: Como ilustrado na Figura 1, utilizando o modelo de ratinho apropriado e o regime de infecção oral, P. gingivalis induz inflamação crônica e imunopatologia no local (cavidade oral) e sítios sistêmicos (artérias).
- Administrar sulfametoxazol (0,87 mg / ml) e trimetoprim (0,17 mg / ml) (Sulfatrim) de seis a oito semanas de-ocamundongos machos ld ad libitum na água potável por 2 semanas para reduzir a flora normal. Manter a solução de antibióticos em frascos de vidro âmbar e proteger da luz para evitar a degradação.
- Para evitar a sedimentação da solução de antibióticos, as garrafas de apertar uma vez ou duas vezes ao dia (isto é, de manhã e à tarde). Substitua por uma solução recentemente preparada a cada 3-5 dias.
- Após duas semanas, substituir a solução de antibiótico com a água de beber convencional. Permitir um período de descanso antibiótico 2 dias antes da infecção oral.
- Coloque o P. gingivalis suspensão / veículo em uma seringa de 1 ml de tuberculina com uma agulha de alimentação conectado. Restringir manualmente o mouse agarrando a nuca na parte de trás do seu pescoço. Assegurar a aderência é firme o suficiente para restringir a mobilidade da cabeça do rato.
- Infectar ratos pela aplicação tópica de P. gingivalis na superfície vestibular da maxila. Posicione a agulha de alimentação, tais that está alinhada com a superfície vestibular dos molares superiores direito e ejetar 50 ul de suspensão bacteriana. Dispersa-se a solução suavemente ao longo da gengiva para 1 min, utilizando a bola da agulha de alimentação.
- Permitir o mouse para descansar por um período de 30 segundos a 1 minuto antes de repetir o procedimento em maxila esquerda. Os ratinhos de controlo recebem o pré-tratamento com antibióticos e de sonda oral com veículo (2% de carboximetilcelulose em PBS).
- Para examinar a inflamação crônica induzida por patógeno nos locais de perda óssea alveolar induzida por infectar camundongos 3 vezes em intervalos de 2 dias. Sacrifício murganhos 6 semanas mais tarde para avaliação de perda de massa óssea por microCT.
- Para examinar a inflamação crônica induzida por patógeno em sites locais e sistêmicos, infectar aterosclerose propensas ApoE - / - ratos, 5 vezes por semana durante 3 semanas.
NOTA: A progressão da doença na artéria inominada é monitorado por série in vivo MRI. Camundongos imagem em vários pontos no tempo e sacrifício 6-16 wks tarder. No momento do sacrifício, avaliar a carga aterosclerótica global en análise rosto e determinar a perda óssea alveolar por microCT. Caracterizar lesões ateroscleróticas por histologia e imuno-histoquímica.
3. Micro-tomografia computadorizada (microCT)
- Preparação de Amostras
- Sacrifício camundongos no pós-infecção ponto de tempo desejado. Eutanásia camundongos por CO 2 asphyxation ou por outro método aprovado pelo biotério da instituição.
NOTA: Coletar o sangue por punção cardíaca, o soro separado, e armazenar a -80 ° C para análise de anti-IgG P. gingivalis, como descrito em outros lugares 9. - Use um grande par de tesouras decapitação a grave a cabeça do rato na base do crânio. Retirar a carne, com um par de pinças e colocar o crânio em um tubo de 50 ml contendo 30 ml de paraformaldeído a 4% tamponada. Corrigir o espécime por 24-48 horas a 4 ° C.
- Após a fixação, RinsÊ O espécime cuidadosamente com PBS.
- Criar biópsias bloco maxilares.
- Guarde o hemi-maxila em grau histológico etanol 70% a 4 ° C até a avaliação por microCT.
- Sacrifício camundongos no pós-infecção ponto de tempo desejado. Eutanásia camundongos por CO 2 asphyxation ou por outro método aprovado pelo biotério da instituição.
- Aquisição de Imagem
- Realizar aquisições de imagem usando um scanner microCT desktop. Definir a fonte de raios-X para uma corrente de 114 uA e uma tensão de 70 kV. Coloque hemi-maxilas indivíduo dentro do vaso de imagens e digitalização com resolução de 12 um em todas as três dimensões espaciais.
NOTA: Coloque várias hemi-maxilas simultaneamente dentro do vaso de imagens. - Executar uma verificação de baixa resolução preliminar que permite ao usuário para delinear os limites para a aquisição de imagens e restringir a digitalização para a região de interesse (ROI), utilizando o sistema.
NOTA: A intensidade do esmalte faz a coroa dos molares superiores facilmente distinguíveis. Usando os molares como um guia livremente estabelecer os limites de imagem para abranger os três molares e do bon alveolar circundantee. Esta função também é usada para discriminar entre hemi-maxilas indivíduo ao digitalizar várias amostras dentro do mesmo navio. - Quando a digitalização estiver concluída, converter os arquivos de imagem RAW (.ISQ) em dicoms de alta qualidade (.dcm).
- Realizar aquisições de imagem usando um scanner microCT desktop. Definir a fonte de raios-X para uma corrente de 114 uA e uma tensão de 70 kV. Coloque hemi-maxilas indivíduo dentro do vaso de imagens e digitalização com resolução de 12 um em todas as três dimensões espaciais.
- Análise de Imagem
Neste protocolo, análise de imagem é feita usando uma visualização de dados, processamento e análise de software. Primeiro, use marcos morfológicas para criar um plano de melhor ajuste para a junção cemento (CEJ). Em seguida, use o de transformar o hemi-maxila em uma orientação padrão para mensuração subsequente de volume ósseo alveolar.- Abra o programa e clique no ícone "Open Data", localizado no canto superior esquerdo do Pool. Como alternativa, use File> Open Data.
- Selecione a imagem da pilha DICOM e clique em Load. Será exibida a janela DICOM Loader. Clique em OK.
- Observe o conjunto de dados como um ícone verde na piscina. Observe que, ao clicar sobre o objeto de dados faz com que adicional, mastoneladas para ser exibido na área de botão na parte superior da piscina. Selecionar o ícone também provoca algumas informações sobre o registro de dados a ser exibido na Área de Propriedades.
- Cada ícone na piscina oferece um menu a partir do qual os diferentes módulos podem ser selecionados. Ative o menu popup ao clicar na seta branca no canto direito do ícone de dados. De acordo com o módulo de visualização, selecione isosuperfície (Tela> isosuperfície). O Ícone isosuperfície aparecerá na área da piscina. Quando selecionada, aparecem definições adicionais na área de Propriedades.
- Defina o estilo Draw para transparente e o limite para 2000. Certifique-se o compactify e diminuir a resolução botões são selecionados em Opções. Sob Média, assegurar x, y, z e está tudo pronto para 2 Clique em Aplicar para gerar o isosurface.
NOTA: Observe uma reconstrução 3D transparente da hemi-maxila no visualizador em 3D. A vantagem de usar um estilo de sorteio transparente para a reconstrução da imagem é que as raízes dos molares podeser facilmente identificados. Isto será importante ao colocar a espécie em um padrão de orientação. - Selecione o ícone de dados verde e na área de Propriedades, selecione o ícone de corte. Observe uma janela mostrando as dimensões e coordenadas dos dados. Defina isso de lado por enquanto. Observe que uma caixa delimitadora aparece no visualizador 3D com abas verdes em cada canto.
- Selecione o botão na barra de ferramentas Interact espectador. Modificar o tamanho da caixa delimitadora, clicando e arrastando os cantos verdes. Verifique se a caixa abrange a região de interesse (ROI) e elimina o máximo de espaço morto e detritos possível. Isto irá reduzir a demanda de processamento do computador.
- Use o botão trackball na barra de ferramentas espectador para girar o objeto dentro do visualizador 3D garantir o retorno do investimento é completamente abrangido pela caixa delimitadora. Quando estiver satisfeito, clique em OK na janela de corte de lado na etapa 8.
- Selecione o ícone de dados e sob o módulo de visualização selecionar Oblique Slice (OBS). (Vídeo> OBS)
- Selecione o OBS. Na área de propriedades, defina o tipo de mapeamento a linear, a faixa de janela de dados de -200 a 10.000, e amostragem para melhor. Agora selecione girar em Opções. Observar uma alternância de rotação no centro da OBS.
- Selecione o botão de interação na barra de ferramentas visualizador e usar as alças da alternância para ajustar o plano de corte da fatia. Criar um plano sagital, que corre em paralelo com as raízes dos dentes e é perpendicular à superfície oclusal dos dentes. O plano deve bissetriz os três molares (M1-M3), como ilustrado na Figura 2.
- Desligue rotação e duplicar o OBS (object> objeto duplicado). Um novo OBS aparece com o nome OBS 2 Ligue rotação por OBS 2.
- Use a alça de rotação para reorientar OBS 2 de modo que fique perpendicular com OBS 1 (ver Figura 2).
- Ligue para rodar fora OBS 2 e criar 3 fatias duplicados. Estes serão citar OBS 3, 4, e 5.
- Pegando Pontos para o Plano da Melhor Ajuste
NOTA: Passos 3.4.1-3.4.5 descrever a localização de 8 pontos ao longo do CEJ cria um plano de melhor ajuste. Escolha quatro dos pontos de cortes sagitais e os outros quatro a partir de cortes coronais (ver Figura 3). Ao escolher os pontos situados em cortes sagitais em 3.4.6, pode ser necessário ajustar OBS 1.- Alinhar OBS 1 com o centro da raiz mesial mais de M1 no plano sagital. Alinhar OBS 2 com o centro da raiz mesial mais de M1 no plano coronal.
- Alinhar OBS 3 com o centro da raiz buco-distal de M1 no plano coronal. Se necessário, ajuste OBS 1 para que ele seja aproximadamente centrado com a raiz vestíbulo-distal de M1 no plano sagital ao selecionar pontos no Passo 20.
- Alinhe OBS 4 com a bifurcação das raízes vestibulares de M2. OBS 4 deve ser centrada entre as raízes vestíbulo-mesial e buco-distais do M2. Se necessário, ajuste sagacidade OBS 1 para que ele seja aproximadamente centradoh a raiz buco-distal M2 no plano sagital quando a selecção dos pontos no Passo 20
- Ajuste OBS 5 para que ele corre pelo centro do M3 no plano coronal. Se necessário, ajuste OBS 1 para que ele seja aproximadamente centrado com a raiz mais distal do M3 no plano sagital ao selecionar pontos no Passo 20.
- Duplicar qualquer um dos OBSS (OBS 6) e selecione o ajuste de pontos na janela de propriedades. O ajuste para alternar pontos permite ao pesquisador escolher 3 ou mais pontos em 2D ou 3D objetos dentro do espectador e, em seguida, calcula um plano de melhor ajuste. Neste caso, os OBSS 2D descritos nos passos anteriores, é utilizado para seleccionar 8 pontos ao longo do CEJ.
- Esconder OBS 6 do visualizador em 3D clicando na caixa de laranja no canto direito do ícone de dados. Ocultar o isosurface do visualizador em 3D para fazer o CEJ visível em todas as fatias 2D. Shift-clicar e selecionar os 8 pontos ao longo do CEJ como descrito acima.
NOTA: Se a tecla Shift não está pressionada ao selecionarpontos, um avião será automaticamente calculado após os primeiros três pontos. - Depois de selecionar todos os 8 pontos, faça OBS 6 visível. Note-se que esta é uma fatia axial que corre aproximadamente paralelo ao plano oclusal.
- Transformação e reorientação NOTA: O plano de melhor ajuste é utilizado para transformar os dados para um padrão de orientação para as medições volumétricas subsequentes.
- Clique em Ícone de Dados> Compute> ApplyTransform. O ícone ApplyTransform aparece na área da piscina. Clique no quadrado branco no canto do ícone ApplyTransform, selecione referência e clique em OBS 6.
- Na área Propriedades, selecione padrão para o método de interpolação e prorrogado por modo. Aplicar a transformação.
- Criar um isosurface e uma OBS coronal para o novo arquivo de dados. Rodar os OBS na direcção axial de tal modo que é aproximadamente perpendicular com M1 (mostrado na Figura 2). Use as cúspides do molar e oclusal curvatures como um guia.
- Utilize este plano para transformar os dados como nos passos 3.5.1 e 3.5.2. Salve o arquivo de dados transformados.
- Segmentação e volume ósseo Medição
NOTA: As etapas a seguir descrevem a segmentação e mensuração de osso alveolar. A fatia correspondente ao plano de melhor ajuste para o CEJ é identificado e um plano de referência é escolhido. Osso alveolar entre o CEJ eo plano de referência na face vestibular dos molares é segmentada e medidos. A raiz mais mesial de M1 ea raiz mais distal do M3 servem como marcos de endpoint. Definir o plano de referência 15-20 fatias abaixo do CEJ rende ótimos resultados. Inclusão de fatias adicionais apresenta variabilidade que mascara diferenças no volume de osso entre os grupos de tratamento.- Abra o Editor de Segmentação e criar um novo rótulo para os dados transformados.
- Criar um novo material e nomeá-la osso alveolar.
- Sob a janela de zoom e dados, defina o intervalo de dados from -200 a 10.000.
- Em Exibir e selecione o Masking 2D mira, MPR 3D e renderização de volume ícones 3D. Defina o intervalo de dados a partir de 2500 a 8000. Ativar mascaramento de dados.
- Selecione o Quatro espectadores indicação de acerto na barra de ferramentas espectador. O visor é dividido em quatro quadrantes, permitindo a análise simultânea de sagitais, coronais e pilhas de imagens axiais, bem como o volume 3D processado.
- Use todos os quatro quadrantes para identificar a última fatia, onde o esmalte é visível nos rostos vestibulares de M1 e M3. Esta localização corresponde ao plano de melhor ajuste para o CEJ. Registre o número fatia axial.
- No plano axial, continuar 15-20 fatias em direção à crista óssea alveolar. Isto representa o plano de referência.
- Use qualquer combinação de ferramentas de segmentação para selecionar osso alveolar na face vestibular dos molares entre o CEJ eo plano de referência. Use a raiz mais mesial de M1 ea raiz mais distal do M3 como marcos de endpoint.
- Quando estiver satisfeito, adicionar a selecção Óssea Alveolar na lista de materiais.
- Voltar para a piscina objeto. Um novo ícone com a extensão ".Labels" deve ser anexado ao ícone de dados de imagem. Selecione o ícone Marcadores e no menu drop selecionar Materiais> MaterialStatistics.
- Na área de propriedades, escolha de materiais e clique em Aplicar. A tabela é exibida com vários parâmetros para cada material na lista de materiais. Anote o volume de Osso Alveolar.
4 Avaliação de Aterosclerose
- Dissecção Aórtica
- Sacrifique o mouse por asfixia com CO2 no pós-infecção ponto de tempo desejado.
- Posicione o mouse no lado dorsal, fita para baixo e limpe mouse com etanol 70%. Cortar a pele, no lado ventral a partir do meio do abdómen de um pouco acima do processo xifóide.
- Cortar a pele abdominal até o processo xifóide é visível. Levante o processo xifóide com um pequeno pair de uma pinça, fazer cortes em cada lado da caixa torácica, e cortar o diafragma. Em seguida, faça dois cortes para baixo de cada lado da caixa torácica para expor o coração.
- Exsanguinate do rato utilizando uma seringa de insulina de 27 L colocado no vértice do ventrículo direito. Durante a coleta de sangue, gire a agulha periodicamente para evitar o bloqueio da abertura da parede ventricular. Tipicamente, 0,8-1 ml de sangue podem ser obtidas utilizando este método.
- sup> NOTA: Separe o soro e armazenar a -80 ° C para análise de anti-IgG P. gingivalis, como descrito em outros lugares 9
- Use uma tesoura para remover o átrio direito.
- Localizar o ventrículo esquerdo no lado posterior do coração. Introduzir uma agulha G 21, no vértice do ventrículo esquerdo, com o bisel da agulha voltada para o centro da câmara de descarga e lentamente o sistema circulatório com 3-5 ml de fixador de tecidos.
- Gordura da guarnição e do timo em torno do coração.
- Retire a luNGS.
- Localize o arco aórtico com os três poderes e limpar camadas de gordura em torno de uma melhor exposição.
- Continuar a dissecção da aorta a partir do arco para a base do diafragma.
- Remover o fígado e deslocar o tecido intestinal para expor a aorta descendente. Dissecar os aorta distais até os ramos da artéria renal.
- Corte as artérias renais e continuar a dissecção até a bifurcação ileal.
- Uma vez que a aorta é livre na maioria dos tecidos conjuntivos, voltar para o início da aorta e a porção de recorte muito superior dos três ramos fora da aorta acima do coração.
- Coração casca para cima, cortando o tecido adiposo subjacente, a fim de separar a partir do coração do corpo.
- Segure o coração com uma pinça e puxe para cima, cortando o tecido conjuntivo que pode ainda ser ligado, e continuar a descer para os rins e siga até as pernas e cortar no ponto mais baixo possível.
- Fix aorta em 10% de formalina durante 1 hora com uma subseqüente PBS lavar para 1hr. Alternativamente, loja aorta em formalina a 10% O / N, lavar em PBS no dia seguinte e continuar com dissecção.
- Coloque aorta para uma placa de Petri contendo 10 centímetros PBS.
- Usando um escopo dissecar, cuidadosamente remover o tecido adventícia da aorta.
- Quando aorta está livre do excesso de gordura e tecido, cortou dois terços inferiores do coração. Iniciar a descamação do músculo do coração de distância no fim do coração oposto do arco aórtico. O bulbo da aorta deve aparecer lentamente, o que vai ser branco na coloração.
- Continue dissecção cuidadosa usando duas pinças até lâmpadas de aorta são livres de tecido muscular do coração.
- Coloque aorta limpo em uma bandeja de dissecação preto e cubra com PBS.
- Fixando da Aorta
- Mantenha aorta coberta em PBS ao longo de fixação.
- Coloque aorta em posição anatômica com lâmpadas de aorta à esquerda.
- Coloque alfinetes minutien temporários em 5 locais a partir de 1) Início da aorta, 2) abaixo do terceiroramo de arco, 3) a meio caminho da aorta descendente 4) perto da extremidade inferior da aorta descendente, 5) acima ramo da artéria femoral.
- Com uma tesoura primavera finíssimos, retira-se do lado esquerdo da aorta, a partir de ramo esquerdo da artéria femoral todo o caminho até a aorta para abaixo galho mais baixo da aorta ascendente.
- Corte de um lado para a esquerda de menor lâmpada aórtica na fenda e continuar corte para chegar a interseção de corte ao longo de corte vertical da aorta.
- Atravessam aorta horizontal para alcançar o ponto de menor ramo da aorta ascendente
- Corte para cima no lado direito acima galho mais alto da aorta.
- Corte cada ramo para expor sua superfície interna.
- Retire um pouco de pinos temporários e substituir com pinos permanentes com objetivo de fixar para baixo tudo aorta na localização anatômica, sem dobrar, esticar da aorta. O objetivo é expor a superfície interna da aorta.
- Continuar até fixando toda a superfície interna da aorta é exposta e claramente visíveis a partir de cima e livre de int visuaiserference dos pinos.
- Lipid Coloração e Lesão Quantificação
- Preparar a solução de coloração por Sudan IV (5 mg / ml em 70% de isopropanol). Misture bem e filtrar para garantir que nenhum cristais estão presentes.
- Capa aorta preso em solução IV Sudão por 50 min.
- Lava-se com isopropanol a 70% para o 1 - 5 min. Gentilmente lavar aorta com ddH20 até que a água saindo da aorta não é mais vermelho.
- Cubra aorta com PBS. Capturar imagens de aorta com uma câmera de alta resolução acoplada a um microscópio de dissecação e salvar arquivos de imagem como digitais (.TIFF). Coloque uma régua ao lado de cada imagem para auxiliar na calibração.
- Use software ImageJ para determinar a área da íntima e área de lesões. Rastrear manualmente a superfície íntima para determinar a área. Área de lesão pode ser calculada utilizando thresholding cor automatizado. Isso requer o estabelecimento de um limite para definir a intensidade da cor que discrimina as lesões de áreas normais.
- Calcula-se a percentagem dosuperfície íntima coberta por lesões ateroscleróticas.
5. histológica Avaliação de lesões ateroscleróticas
- Colheita do arco aórtico com o tecido do coração e mergulhe em outubro em um molde de base descartável.
- Colete 5 m criosecções de série todos os 50 mm no seio e inominada artéria aorta utilizando um criostato fixado em -17 ° C e montar as secções de tecidos em lâminas de microscópio. Loja desliza a -20 ° C até à sua utilização.
- Para a avaliação histológica, mancha com hematoxilina e eosina utilizando os procedimentos adequados.
6. imunohistoquímica Caracterização de lesões ateroscleróticas.
Os passos abaixo descrevem um protocolo baseado em anticorpo geral rotineiramente empregadas para avaliar lesões ateroscleróticas em P. gingivalis ratinhos infectados. Este protocolo requer otimização para cada anticorpo ou reagente.
- Retirar as lâminas do congelador e corrigirdurante 2 min em gelo frio fixador (acetona ou outro fixador).
- Deixar as lâminas de vir a RT e etiqueta com uma caneta resistente a solventes.
- Enxaguar desliza 3x em PBS, para remover a matriz de congelamento de tecidos
- Bloquear a actividade da peroxidase endógena por incubação das lâminas em 0,3% de H 2 O 2 em PBS durante 10 min.
- Enxaguar desliza 3x em PBS durante 2 min de cada vez.
- Bloquear a ligação não específica por incubação em tampão (10% de soro de coelho em PBS) de bloqueio, durante 30 minutos à temperatura ambiente.
- Dilui-se o anticorpo primário a 1:50 em 10% de soro de coelho.
- Aplicar o anticorpo diluído para as secções de tecido no slide.
- Incubar durante 1 h à TA.
- Enxaguar desliza 3x em PBS, durante 2 min cada.
- Diluir anti-rato biotinilado anticorpo secundário 1: 100 em 10% de soro de coelho.
- Aplicar-se às secções do tecido da lâmina, e incubar durante 30 min à temperatura ambiente.
- Enxaguar desliza 3x em PBS, durante 2 min cada.
- Preparar a solução de substrato DAB adicionando1 gota de DAB a cada tampão de cromogénio DAB 1 ml.
- Escorra PBS das lâminas e aplicar a solução de substrato DAB. Deixar as lâminas a incubar durante 5 min ou até que a intensidade de cor desejada.
- Lavar 3x em água durante 2 minutos cada.
- Mancha Contador com hematoxilina.
- Desidratar através de 4 mudas de álcool (95% de 1 min, 95 min, 1% 100% 1% 100 min e 5 min).
- Limpar em 3 mudanças de xileno.
- Lamela utilizando solução de montagem e análise qualitativa por microscopia. Para a análise quantitativa, obter imagens e calcular a área coloração com ImageJ usando um limiar automatizado.
7 MRI
- Preparação de animais para MRI
- Anestesiar os camundongos antes dos experimentos de ressonância magnética. Realizar a indução inicial de anestesia utilizando 4% de isofluorano vaporizado durante 2-3 min em uma câmara de indução. Manter a anestesia durante o período de imagem usando um fluxo contínuo de 0,5 - 2% de isofluorano vaporizado delivered através de uma configuração nariz cone ou máscara.
- Depois de alcançar o plano cirúrgico de anestesia (ou seja, não toe resposta pitada), coloque o mouse em um suporte de animais com seu nariz inserido em um cone do nariz. Existem vários tipos de suportes de animais disponíveis comercialmente que podem ser utilizados para minimizar o movimento potencial durante o exame. Nós usamos um suporte personalizado projetado com uma barra de mordida.
- Monitore a respiração e ciclo cardíaco e sincronizar com a aquisição de imagens usando um travesseiro respiração (colocado no abdômen do mouse) equipado com um pequeno sistema de monitoramento e gating animal.
- Prenda o mouse e sistema de monitoramento no suporte do animal com filme de laboratório.
- Aquisição de dados de ressonância magnética
- Coloque o suporte do animal com a cabeça do rato pela primeira vez em decúbito dorsal em uma 30 milímetros sonda vertical (Micro 2.5) mantida a 23 ° C e na vertical deu 11,7 scanner de ressonância magnética T.
- Alinhe o suporte com o centro de tele bobina RF.
- Realizar um processo de calços usando uma única seqüência de pulsos.
- Usando uma seqüência RARE, adquirir imagens de escoteiros ao longo de três orientações ortogonais para criar imagens axiais, coronais e sagitais.
- Realize uma resolução baixa Angiografia por Ressonância Magnética (MRA), utilizando uma seqüência gradiente eco 3D ungated com os seguintes parâmetros: Laje de espessura = 1,5 cm; ângulo de inclinação = 45 °; tempo de repetição = 20 ms; tempo de eco = 2,2 ms; campo de visão = 1,5 x 1,5 x 1,5 cm; matrix = 64 × 64 × 64; número de média = 1 tempo de varredura total: 2~3 min. O objetivo desta verificação é garantir que as imagens são adquiridas na região do alvo (a artéria inominada).
- Realize uma MRA alta resolução da artéria inominada com uma seqüência gradiente eco 3D ungated usando os seguintes parâmetros: Laje espessura = 1,5 cm; ângulo de inclinação = 45 °; tempo de repetição = 20 ms; tempo de eco = 2,2 ms; campo de visão = 1,5 x 1,5 x 1,5 cm; matriz = 128 &# 215; 128 × 128; número de média = 4 tempo de varredura total foi de ~ 25 min.
- Obter imagens axiais contínuas do 0,5 milímetro da artéria inominada abaixo da bifurcação subclávia.
- A análise de dados de ressonância magnética
- Realize reconstrução e análise de imagem usando o software de imagem associado ao scanner. Alcançar a reconstrução 3D das imagens ARM por projeção de intensidade máxima.
- Utilizar a bifurcação subclávia como um marcador anatómica de alinhar os dados adquiridos a partir de murganhos ou diferentes do mesmo ratinho em diferentes pontos de tempo. Escolha a seção transversal alvo da artéria inominada em 0.3- a 0,5 mm de distância abaixo do subclavianbifurcation.
- Definir e calcular a área luminal da seção transversal escolhido com ImageJ. As medições devem ser realizadas de forma cega por dois observadores independentes. Verifique medição reprodutibilidade pelo cálculo de coeficientes de correlação interclasse.
- Para os estudos longitudinais com imag sérieção, normalizar a área luminal para a área da luz obtida na linha de base (a primeira lata no estudo) para cada rato. Expressar os resultados como a mudança na área da luz ao longo do tempo.
- Execute as análises estatísticas apropriadas (ie, teste t de Student) para determinar diferenças significativas entre os grupos experimentais.
Resultados
Utilizando o modelo de ratinho apropriado e o regime de infecção oral, P. gingivalis induz inflamação crônica e imunopatologia no local (cavidade oral) e sítios sistêmicos (artérias) (Figura 1).
Em ratos, infecção oral com P. gingivalis induz uma resposta inflamatória local que conduz à destruição do osso alveolar dente de apoio 8. p gingivalis infectados camundongos desenvolver respostas de anticorpos séricos para este organismo, que são predominantemente do isotipo IgG 9. Os resultados mostrados na Figura 4 são representativos de uma experiência em que murganhos C57BL / 6 foram infectados com P. gingivalis três vezes em intervalos de dois dias e sacrificados 6 semanas mais tarde, para a estimativa da perda de osso alveolar por microCT. Análise volumétrica usando software Amira revela que P. camundongos gingivalis infectado pelo exibem perda óssea significativa em comparação com os controles não infectados (Figura 4A). A inspecção visual de reconstruída hemi-maxilar, ilustra um aumento na área de superfície exposta das raízes molar em murganhos infectados, em comparação com os controlos (Figura 4B e figura 4C).
Na aterosclerose propensas ApoE - / - ratos, P. gingivalis induz inflamação crônica que leva a perda óssea alveolar 12 e deposição de placa inflamatória dentro do seio da aorta 15 e artéria inominada 11. P. gingivalis induzida por aterosclerose ocorre nas primeiras 24 horas após a última infecção e pode ser prevenida pela imunização antes da infecção 16. Inflamação progressiva na artéria inominada de P. gingivalis infectados camundongos pode ser monitorada em camundongos vivos por série no MRI vivo em vários pontos de tempo pós-infecção (Figura 5). en medições de face do Sudão IV aortas coradas demonstra que P. gingivalisinfecção aumenta significativamente a deposição de lípidos e a área lesionada na superfície da íntima (Figura 6). No momento do sacrifício, a histologia e imuno-histoquímica pode ser usada para qualitativa ou quantitativamente caracterização das lesões ateroscleróticas no contexto da composição celular, a expressão de vários antigénios, e lípidos. A análise imuno-histoquímica das lesões do seio da aorta revela aumento da infiltração de macrófagos e aumento da expressão do receptor Toll-like receptor imune inato 2 (TLR2) em P. gingivalis infectado com ratos (Figura 7).

Figura 1 P. gingivalis induzida por inflamação crônica em sites locais e sistêmicos. Antes de infecção com P. camundongos gingivalis são administe vermelho libitum antibióticos ad na sua água de beber, durante 10-14 dias, seguido por um período de repouso de dois dias de antibióticos. O tratamento com antibióticos elimina a flora bucal indígenas e facilita a colonização. Para a indução da perda alveolar, os ratinhos foram infectados por três vezes em intervalos de dois dias e ao volume de osso alveolar é efectuada 6 semanas após a infecção. Ao avaliar a aterosclerose, arteriosclerose propensas ApoE - / - murganhos são tipicamente infectadas 5 vezes por semana durante 3 semanas e sacrificaram-se 16-24 semanas pós-infecção. Inflamação progressiva no interior da artéria inominada de ratinhos vivos pode ser medido por ressonância magnética, em série in vivo em vários pontos de tempo após a infecção. A histologia e imunohistoquímica pode ser usado para manchar para lipídios e células inflamatórias no término do experimento para validar os dados de imagem. No momento do sacrifício, a perda de osso alveolar é medida por microCT e carga aterosclerótica mundial é avaliada por coloração en face da aorta inteiras. https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/51556/51556fig1highres.jpg "target =" _blank "> Clique aqui para ver uma versão maior desta figura.
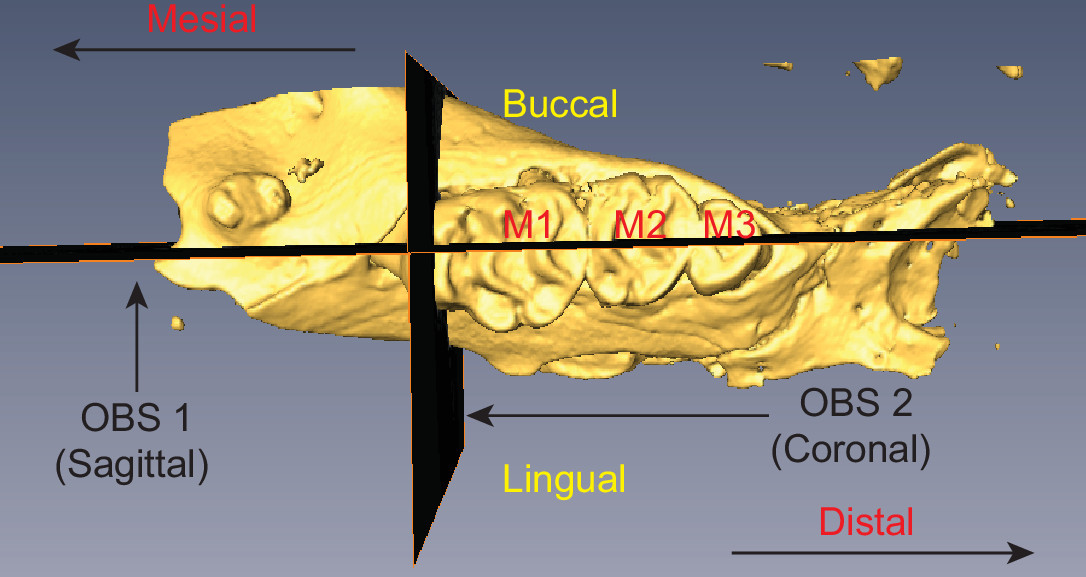
Figura 2 Rato hemi-maxila, ilustrando o posicionamento da OBS 1 e 2 OBS Os três molares são rotulados (M1-M3) e terminologia anatômica relevante é indicado. Clique aqui para ver uma versão maior desta figura.

Figura 3 Rato hemi-maxilar superior que ilustra o posicionamento da OBS 1 a 5.1556 / "target =" _blank "51556fig3highres.jpg> Por favor, clique aqui para ver uma versão maior desta figura.

Figura 4 a perda óssea alveolar como medido por microCT. C57BL Homem / 6 foram infectados oralmente com P. gingivalis ou veículo (não infectado) e volume ósseo alveolar foi avaliada por microCT 6 semanas mais tarde usando Amira. (A) o volume ósseo alveolar em hemi-maxilas de não infectado e P. gingivalis infectados C57BL / 6. Os resultados representam o volume de osso acima do plano de referência (120 microns do CEJ). Os dados são expressos como volume ósseo SD a partir de n = 8 ratinhos por grupo. *** P <0,001, comparado com os controlos não infectados. (B) e (C) reconstruções representativas 3D de hemi-maxilas de não infectados (B)e P. gingivalis infectados (C) ratos. Um decréscimo significativo do volume ósseo alveolar pode ser visto em P. gingivalis infectados camundongos quando comparados aos controles não infectados. As setas indicam regiões em que ocorre perda óssea visível em P. gingivalis camundongos infectados por (nota o aumento da área de superfície exposta das raízes molares). Clique aqui para ver uma versão maior desta figura.

Figura 5 inflamação progressiva dentro da artéria inominada seguinte P. infecção gingivalis medida pelo MRI (A) Ressonância Magnética Representante (MR) angiografia do arco aórtico e grandes navios de ApoE. -/ -. Rato (B) Imagem axial MR a partir da linha amarela em um da artéria inominada de um rato, 0,3 milímetros abaixo da sua bifurcação. Artérias inominada foram fotografadas pela MRA no início e aos 12 e 16 semanas após a infecção. (C) A mudança temporal na área luminal (mm 2) foi calculado para ratos indivíduo (n = 10-12 / grupo). Não infectado ApoE - / - (azul); P. gingivalis infectados ApoE - / -. (vermelho) Clique aqui para ver uma versão maior desta figura.
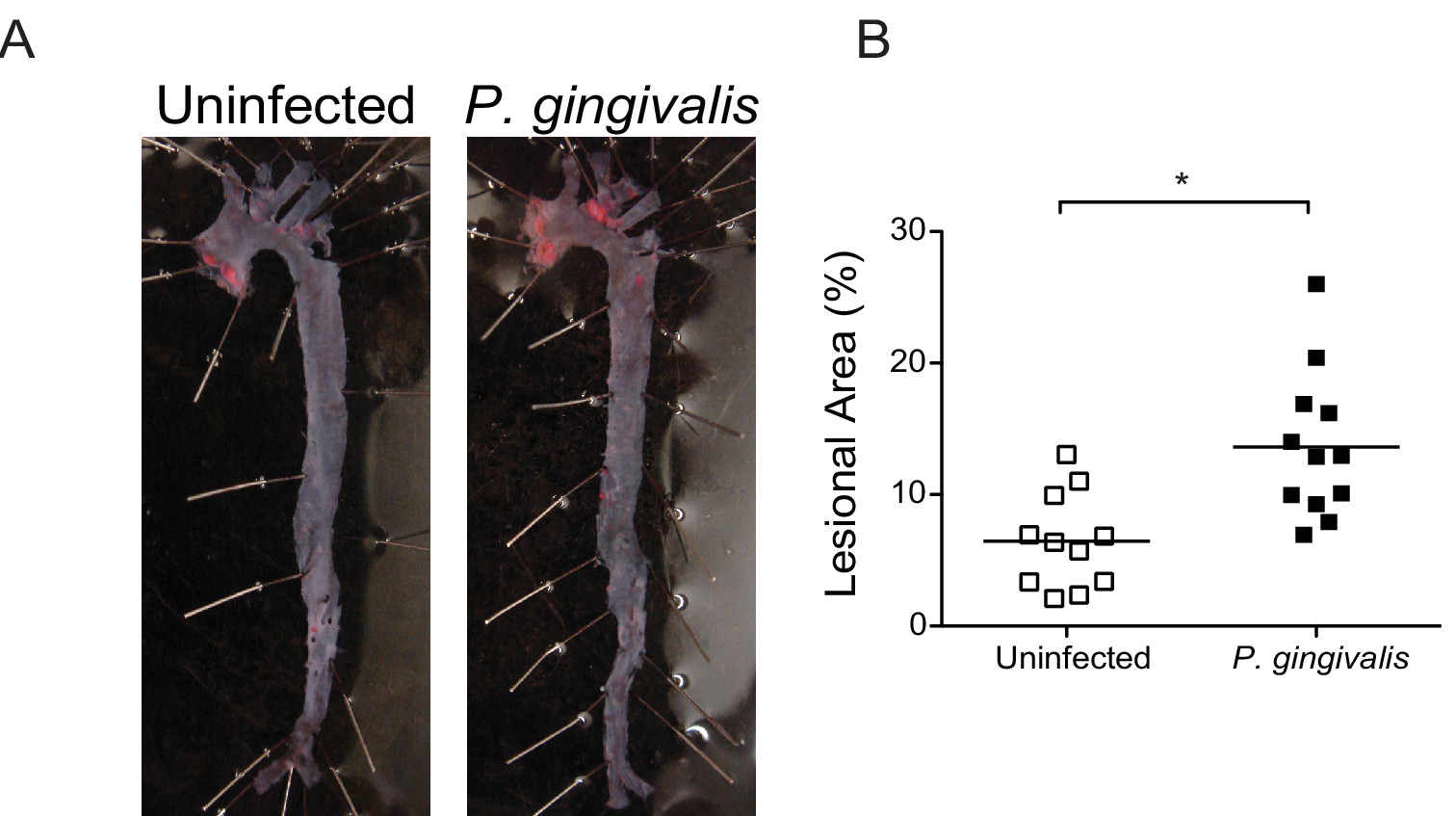
Figura 6 Determinação En face da área lesionada em toda a aorta. (A) coloração do Sudão IV aorta en lesões na face 16 semanas após a infecção com P. gingivalis. (B) Quantificação do teor de lipídios dentro da aorta total de (símbolos brancos) não infectados e P. gingivalis infectado com ratinhos (símbolos pretos) (n = 10-13 / grupo). Percentual de aorta ocupada por lipídeos foi calculado usando ImageJ. * P <0,05. Clique aqui para ver uma versão maior desta figura.

Figura 7 Análise imunohistoquímica de lesões seio aórtico Masculino ApoE -. / - Ratos alimentados com uma dieta normal de comida foram infectados com P. gingivalis ou não infectados e sacrificados 16 semanas após a infecção. Criosecções obtidos a partir do seio aórtico foram marcadas com anti-rato F4 / 80 e TLR2. Barra de escala, 100 mm. Clique aqui para ver uma versão maior desta figura.
Discussão
O P. gingivalis modelo infecção oral proporciona uma ferramenta valiosa para o estudo da inflamação crônica induzida por patógeno em sites locais e sistêmicos. Este modelo único permite a caracterização de ambos os mecanismos específicos de acolhimento e de patógenos que contribuem para a inflamação crônica e imunopatologia. Além disso, o modelo pode ser utilizado para o rastreio de novas estratégias terapêuticas, incluindo a imunização e a intervenção farmacológica. Os passos descritos neste protocolo descrever o sucesso do uso deste modelo e detalhe metodologias para avaliar a iniciação, progressão e evolução de P. gingivalis induzida por inflamação crônica.
Há vários aspectos críticos para manter em mente quando se utiliza este protocolo para analisar a perda óssea inflamatória. Em primeiro lugar, deve notar-se que o resultado da infecção com P. gingivalis é determinado por três fatores principais: 1) a susceptibilidade genética do hospedeiro à infecção 2) patógenovirulência (genética do agente patogénico) e 3) a interacção hospedeiro-patogénio resultante (interacção dos dois genomas). Suscetibilidade a P. gingivalis induzida perda óssea alveolar é geneticamente determinada em camundongos, assim, os cuidados devem ser tomados ao selecionar a linhagem de camundongos para o estudo 17. Respostas do hospedeiro diferenciais entre as estirpes puras de ratos pode ser aproveitado para realizar telas frente genéticos e caracterizar genes envolvidos na resistência e suscetíveis à inflamação crônica induzida por patógeno. Além disso, existe uma heterogeneidade considerável na capacidade dos diferentes p gingivalis esforça para induzir a perda óssea alveolar em camundongos 18. Este protocolo utiliza ratinhos no fundo por causa da disponibilidade de ratinhos transgénicos e a sua susceptibilidade à aterosclerose C57BL / 6. P gingivalis tensão 381 induz à perda óssea alveolar e aterosclerose em camundongos na C57BL / 6 fundo, e várias bactérias mutantes foram projetados usando this estirpe.
Os ratos são particularmente resistentes à aterosclerose e o desenvolvimento de lesões arteriais evidentes requer a utilização de modelos de rato geneticamente modificadas de aterosclerose. Usamos a ApoE - modelo de ratinho uma vez que é um modelo de ratinho bem estabelecido de aterosclerose, não exige alimentação de dieta rica em gorduras para a formação da lesão, e recapitula muitos aspectos da doença humana 19 - /. O tipo de dieta para alimentar os animais durante o curso da experiência é uma variável importante. Para a maioria de nosso trabalho, alimentar ratos com uma dieta normal de comida para evitar a contribuição de lipídios exógenos na interpretação de nossos resultados. Em estudos preliminares, descobrimos que alimentando ratos Máscaras dieta rica em gordura diferenças en área de lesão rosto entre infectado e P. gingivalis infectados camundongos dentro do seio da aorta. No entanto, a dieta de alta gordura e P. trabalho infecção gingivalis sinergicamente quando a progressão de inflammação é acompanhada no inominada por ressonância magnética ou histologia 11. Em ratinhos, a artéria inominada tem um elevado grau de progressão da lesão, e lesões na artéria expressa esta apresenta características de doença clínica em seres humanos, incluindo estreitamento dos vasos, meios atróficas, inflamação perivascular, e ruptura da placa. As distinções na composição celular das lesões são evidentes em diferentes sítios anatômicos. Os macrófagos são as células imunes primárias infiltrando lesões do seio da aorta, enquanto lesões da artéria inominada são compostos de ambos os macrófagos e células T.
Duração Experimental eo momento em que endpoints inflamatórios são avaliados são fatores adicionais a serem considerados quando se avalia a iniciação, progressão e evolução de P. gingivalis induzida por aterosclerose. Nós já demonstraram que P. gingivalis infectados ApoE - / - ratos apresentam infiltração de macrófagos, aumento da expressão de marcadores da imunidade inata, umnd o aumento da deposição de placas inflamatórias tão cedo quanto 24 horas após a última infecção dentro da cavidade aórtica e isto pode ser evitado por imunização 16. No nosso aumento mãos, inflamação e imunopatologia com o avanço da idade e são evidentes até 24 semanas pós-infecção. No entanto, as decisões relativas à duração do estudo que confiar na hipótese subjacente a ser estudado, o modo de análise e conhecimento prévio da extensão da aterosclerose, sob condições ambientais específicas.
O uso de técnicas de imagem não invasivos para monitorizar a inflamação progressiva da artéria inominada pode ser utilizado para orientar a duração experimental. Serial MRI permite estudos detalhados de progressão da aterosclerose no mesmo animal que pode retratam o estreitamento do lúmen arterial e áreas de pequenos vasos de parede 20. Em contraste com os métodos tradicionais, tais como a coloração com lípido de vasos dissecados, RM não necessita eutanásiae permite estudos longitudinais para avaliar a iniciação e progressão da aterosclerose. Em conjunção com ratinhos transgénicos, bactérias mutantes, ou tratamentos experimentais, as informações temporais fornecidas por ressonância magnética pode ser utilizada para avaliar o efeito da genética do hospedeiro, factores de virulência de patógenos e intervenção terapêutica. Como um benefício adicional, histologia e imuno-histoquímica pode ser usado para manchar para lipídios e células inflamatórias no término do experimento para validar os dados de imagem. Nós recentemente utilizado estes métodos para demonstrar que a infecção oral com P. gingivalis acelera aterosclerose nas arterties inominada ApoE - / - ratos, que a imunização fornece proteção contra a progressão da placa, e se correlaciona com a diminuição do acúmulo de lipídios e células inflamatórias 11.
Em resumo, este protocolo descreve os passos necessários para produzir um modelo robusto de inflamação crônica induzida por patógeno, bemcomo os métodos utilizados para avaliar a inflamação em sites locais e sistêmicos. Além de utilizar este modelo para examinar hospedeiras e organismos patogénicos mecanismos específicos envolvidos na perda óssea inflamatória e aterosclerose, que pode ser adaptado para estudar a contribuição da inflamação crónica induzida pelo patógeno modelos de doenças adicionais. Isto pode ser conseguido utilizando os modelos de ratos transgénicos de doença incluindo a artrite reumatóide, diabetes e cancro. Emergentes evidências indicam que uma série de doenças crônicas de etiologia desconhecida podem ter origens infecciosas. Estas doenças neoplásicas incluem, auto-imunes, e doenças inflamatórias, e em conjunto comprometer as principais causas de morbilidade e mortalidade em todo o mundo. Assim, a utilização de modelos animais para examinar o papel de agentes patogénicos das doenças accionados por inflamação crónica tem o potencial para grande impacto terapêutico e de diagnóstico melhoradas.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi financiado pelo Instituto Nacional de Alergia e Doenças Infecciosas Grant P01 A1078894 para CAG
Materiais
| Name | Company | Catalog Number | Comments |
| Amira analysis software | Visualization Sciences Group | ||
| Anaerobic chamber DW Scientific Model MG500 | Microbiology International | ||
| BHI | Becton-Dickinson | 211059 | |
| Hemin | Sigma-Aldrich | 51280-5G | |
| Menadione (Vitamin K) | Sigma-Aldrich | M5625-25G | |
| Yeast Extract | Becton-Dickinson | 212750 | |
| Carboxymethyl cellulose (medium viscocity) | Sigma-Aldrich | C-4888 | |
| Sulfamethoxazole and trimethoprim oral suspension 200 mg/40 mg per 5 ml | Hi-Tech Pharmacal | NDC 50383-823-16 | |
| μCT 40 | Scanco | ||
| HistoChoice Tissue Fixative | Sigma-Aldrich | H2904 | |
| Sudan IV | Sigma-Aldrich | S4261-25G | |
| Vertical-bore 11.7T Avance spectrometer | Bruker | ||
| Paravision | Paravision | ||
| ImageJ | NIH | ||
| Rat anti-mouse F4/80 | Serotec | MCA497R | |
| Rat anti-mouse TLR2 | eBioscience | 13-9021-80 | |
| Leica S4 dissecting scope | Leica | ||
| Microm HM 550 cryostat | Microm |
Referências
- Nathan, C., Ding, A. Nonresolving Inflammation. Cell. 140 (6), 871-882 (2010).
- Karin, M., Lawrence, T., Nizet, V. Innate immunity gone awry: linking microbial infections to chronic inflammation and. 124, 823-835 (2006).
- Connor, S. M., Taylor, C. E., Hughes, J. M. Emerging infectious determinants of chronic diseases. Emerging Infectious Diseases. 12 (7), 1051-1057 (2006).
- Barth, K., Remick, D. G., Genco, C. A. Disruption of immune regulation by microbial pathogens and resulting chronic inflammation. Journal of Cellular Physiology. , (2012).
- Hayashi, C., Gudino, C. V., Gibson, F. C. 3rd, Genco, C. A. Review: Pathogen-induced inflammation at sites distant from oral infection: bacterial persistence and induction of cell-specific innate immune inflammatory pathways. Molecular Oral Microbiology. 25 (5), 305-316 (2010).
- Gibson, F. C. 3rd, Ukai, T., Genco, C. A. Engagement of specific innate immune signaling pathways during Porphyromonas gingivalis induced chronic inflammation and atherosclerosis. Frontiers in Bioscience: a Journal and Virtual Library. 13, 2041-2059 (2008).
- Pihlstrom, B. L., Michalowicz, B. S., Johnson, N. W. Periodontal diseases. Lancet. 366 (9499), 1809-1820 (2005).
- Baker, P. J., Evans, R. T., Roopenian, D. C. Oral infection with Porphyromonas gingivalis and induced alveolar bone loss in immunocompetent and severe combined immunodeficient mice. Archives of Oral Biology. 39 (12), 1035-1040 (1994).
- Baker, P. J., Carter, S., Dixon, M., Evans, R. T., Roopenian, D. C. Serum antibody response to oral infection precedes but does not prevent Porphyromonas gingivalis-induced alveolar bone loss in mice. Oral Microbiology and Immunology. 14 (3), 194-196 (1999).
- Gibson, F. C. 3rd, Hong, C., et al. Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice. Circulation. 109 (22), 2801-2806 (2004).
- Hayashi, C., Viereck, J., et al. Porphyromonas gingivalis accelerates inflammatory atherosclerosis in the innominate artery of ApoE deficient mice. Atherosclerosis. 215 (1), 52-59 (2011).
- Hayashi, C., Madrigal, A. G., et al. Pathogen-mediated inflammatory atherosclerosis is mediated in part via Toll-like receptor 2-induced inflammatory responses. Journal of Innate Immunity. 2 (4), 334-343 (2010).
- Hayashi, C., Papadopoulos, G., et al. Protective role for TLR4 signaling in atherosclerosis progression as revealed by infection with a common oral pathogen. Journal of Immunology (Baltimore, Md.: 1950). 189 (7), 3681-3688 (2012).
- Papadopoulos, G., Weinberg, E. O., et al. Macrophage-Specific TLR2 Signaling Mediates Pathogen-Induced TNF-Dependent Inflammatory Oral Bone Loss. The Journal of Immunology. , (2012).
- Gibson, F. C. 3rd, Hong , C., et al. Innate immune recognition of invasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice. Circulation. 109 (22), 2801-2806 (2004).
- Miyamoto, T., Yumoto, H., Takahashi, Y., Davey, M., Gibson, F. C. 3rd, Genco, C. A. Pathogen-accelerated atherosclerosis occurs early after exposure and can be prevented via immunization. Infection and Immunity. 74 (2), 1376-1380 (2006).
- Baker, P. J., Dixon, M., Roopenian, D. C. Genetic control of susceptibility to Porphyromonas gingivalis-induced alveolar bone loss in mice. Infection and Immunity. 68 (10), 5864-5868 (2000).
- Baker, P. J., Dixon, M., Evans, R. T., Roopenian, D. C. Heterogeneity of Porphyromonas gingivalis strains in the induction of alveolar bone loss in mice. Oral Microbiology and Immunology. 15 (1), 27-32 (2000).
- Daugherty, A. Mouse models of atherosclerosis. The American Journal of the Medical Sciences. 323 (1), 3-10 (2002).
- Weinreb, D. B., Aguinaldo, J. G. S., Feig, J. E., Fisher, E. A., Fayad, Z. A. Non-invasive MRI of mouse models of atherosclerosis. NMR in Biomedicine. 20 (3), 256-264 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados