Method Article
Способ генерации легких нейтрофилия Использование аэрозольного липосахарид
В этой статье
Резюме
Мы опишем метод индукции нейтрофилов воспаление легких на вызов аэрозольного липополисахарида распылением, для моделирования острого повреждения легких. Кроме того, основные хирургические методы для выделения легких, интубации трахеи и бронхоальвеолярного лаважа, также описаны.
Аннотация
Острое повреждение легких (ALI) является серьезным заболеванием, которое характеризуется альвеолярной нейтрофилез с ограниченными возможностями лечения и высокой смертностью. Экспериментальные модели ALI являются ключевыми в повышении нашего понимания патогенеза заболевания. Липополисахарид (LPS), полученный из грамположительных бактерий вызывает нейтрофильный воспаление в дыхательных путях и легких паренхимы мышей. Эффективное легочной доставки соединений, таких как ЛПС, однако, трудно достичь. В подходе, описанном здесь, легочная доставка на мышах достигается вызов аэрозольных синегнойной палочки ЛПС. Растворенный ЛПС аэрозоля с помощью распылителя, подключенного к сжатому воздуху. Мыши подвергались воздействию непрерывного потока аэрозоля LPS в коробке из оргстекла в течение 10 мин, а затем 2 мин после кондиционирования аэрозоль был прекращен. Интубация трахеи и последующее бронхоальвеолярного лаважа, а затем формалина перфузии был следующий выполнены, что позволяет характеристике стерильной рulmonary воспаление. Аэрозольный LPS генерирует воспаление легких характеризуется альвеолярной нейтрофилез, обнаруженных в бронхоальвеолярного лаважа и гистологических. Этот метод может быть создана за небольшую плату с нескольких приборов, и требует минимальной подготовки и опыта. Система экспозиции таким образом, может быть выполнена на регулярной основе на любой лаборатории, с потенциалом для повышения нашего понимания легких патологии.
Введение
Липополисахарид (ЛПС) является клеточной стенки компонент грамотрицательных бактерий 1. Вызов ЛПС хорошо документированы модель острого повреждения легких, синдром характеризуется острым нейтрофилов воспаления и отека 2. Кроме того, легочная нейтрофилия также отличительной чертой хронической обструктивной болезни легких (ХОБЛ) 3, и ЛПС у человека был использован для моделирования ХОБЛ обострений 4. Таким образом, экспериментальные модели воздействия ЛПС клинически значимых и ценных инструментов, чтобы понять патологии человека.
Целью легочной доставки аэрозольных ЛПС, описанных здесь, чтобы генерировать нейтрофильный воспалительную реакцию в проводящей и дыхательных путей, без системного вовлечения. Несколько методик ЛПС были описаны ранее. Внутривенной инъекции LPS является наиболее широко используется способ введения. Хотя этот метод является легко доступным, тОн первичной повреждение к эндотелию, со средним разрушения легочный эпителий следующей миграции нейтрофилов в легкие. Внутривенного введения также вызывает системное воспаление 2, который может осложнить клинической картины на животных моделях. Системное воспаление в отличие не наблюдается с администрацией внутри трахеи. Этот метод, однако, является трудоемким и требует анестетиков, а также значительное подготовку 5, 6. Кроме того, легочной осаждения этого способа введения зависит от дыхания 7. Таким образом, осаждение легких зависит от глубины анестезии, необходимых для можно наблюдать внутри трахеи и введение переменной осаждения в дыхательных путях. В отличие от этого, в легкие с аэрозольными LPS требуется минимальное обучение, и может быть легко достигнуто на большом количестве животных с небольшим или без изменения между индивидами 5, 8.Недавнее исследование подтверждает, что аэрозоль доставка превосходит внутри трахеи маршрута с учетом осаждения, и что более актуальной дозы ЛПС вызвать нейтрофильный воспаление с этой моделью 8.
Предыдущие исследования показали, что вызов в виде аэрозоля Psuedomonas палочки LPS генерирует заметное воспалительной реакции в просвете дыхательных путей и паренхимы легких, в том числе альвеолярных пространств 9, 10. Воспаление характеризуется преобладанием нейтрофилов и наличие отека легких, и, таким образом, может быть использована для решения патогенеза острого повреждения легких и получить дополнительные знания о механизмах, способствующих патологии болезни.
протокол
Исследования на животных были одобрены этики защиты животных комитета северной части Стокгольма. Экспериментальные процедуры были выполнены в соответствии со шведским законодательством.
1. Создание ЛПС аэрозолей
- Растворите 0,5 г очищенного П. палочки ЛПС в 50 мл стерильного физиологического раствора при легком помешивании и проверить растворения. Развести 1 мл растворенных LPS в 9 мл стерильного физиологического раствора до конечной концентрации 1 мг / мл. Защищать от света с алюминиевой фольгой и хранят при -20 ° С.
- Оттепель растворенные LPS в темноте при комнатной температуре и сразу же смешать перед использованием.
- В проветриваемом II уровня биологической капот, вставьте красный вход в распылитель, и подключить распылитель к сжатого воздуха в помещении с помощью трубки, предоставленной (схема рассмотрения изложением экспериментальных устройств на рисунке 1) производитель.
ВНИМАНИЕ: соответствующие средства индивидуальной защиты, в том числе половина лицевой части многоразовой respiratили сажевых фильтров, защитных очков, перчаток и защитной одежды должна использоваться в ходе экспозиции.

Рисунок 1:. Схематическое представление экспериментальных устройств, используемых для генерирования аэрозоля на входе в распылитель соединен с подачей воздуха. Выход распылителя подключен к первому расходомера через 15,9 мм трубки и воздушного фильтра, и подача воздуха регулируется до 5,0 л / мин при давлении 2 кбар. Розетка следующем подключении к коробке из оргстекла оснащена сменными крышками и 5 мм отверстия, чтобы предотвратить нарастание давления.
- Подключение выходное отверстие распылителя к массовому расходомеру через воздушный фильтр. Подключите массовый расходомер к электрической сети.
- Отрегулируйте подачу воздуха 5 л / мин, с оставшимся на 1,0-2,0 бар давления.
- Снимите массовый расходомер иотсоедините подачу воздуха.
- Подключите выход распылителя к 15,9 мм трубки, которая раздваивается и подключается к две коробки из плексигласа с размерами: 150 х 163 х 205 мм, оснащенные сменными крышками. Каждая коробка должна иметь 5 мм отверстие в боковой противоположные входное отверстие, чтобы предотвратить нарастание давления.
- Поместите до 5 мышей в каждой коробке из оргстекла и закрыть крышками.
- Откройте распылитель и заполнить вкладыш, по крайней мере, 4 мл ЛПС, растворенных в стерильном физиологическом растворе или один носитель (стерильный физиологический раствор; объем не должен превышать 8 мл). Снова подключите вход для подачи воздуха.
- Разрешить аэрозоль течь в закрытых коробках из плексигласа в течение 10 мин. Монитор животных непрерывно. Убедитесь, что подача воздуха остается жестко прикреплена к входному отверстию распылителя.
- Отключите подачу воздуха. С крышки закрыты, пусть животные остаются в коробках из оргстекла в течение 2 мин.
- Откройте крышки и позволяют аэрозоль для разгона, и вернуть животных к Тон клеток. Если животные появляются мокрые, поместите клетки на грелку, установленным в слабом огне, чтобы предотвратить переохлаждение.
- Монитор животных непрерывно в течение первых 30 мин, а затем каждые 2 ч в течение первых 6 часов. Животные должны проявлять нормальную дыхательную рисунок и деятельность во время и после процедуры распыления.
2. БАЛ (BAL)
- В экспериментальной конечной точки, глубоко обезболить животных изофлураном к следствию, как это рекомендовано ветеринарных работников вашей организации. Зажмите заднюю лапу, чтобы проверить на вывод рефлекса обеспечения достаточной глубины анестезии для проведения серьезной операции. Спрей вниз мех животных с 70% этанола.
- Откройте живот с помощью ножниц и разорвать аорту, чтобы обескровить животное. Место кусок ткани на животе, чтобы впитать кровь.
- Follwing эвтаназию, использовать один передне-задней срез ножницами, чтобыразоблачить грудной клетки. Поднимите грудную клетку от переднего конца грудины и использовать ножницы, чтобы проколоть мембрану в самый брюшной точки, не врезаясь в любой доля легкого. Откройте грудную клетку, делая два надреза в передне-заднем направлении (конференц ниже челюсти).
- Осторожно потяните за исключением грудной клетки с помощью щипцов, и сократить трахеи ниже гортани.
- Поднимите трахею с помощью пинцета и удалить легкие, сокращая связки, соединяющие доли в грудной полости, и осторожно потянув на жировой и сердечной ткани.
- Вставьте полиэтиленовую трубку (внутренний диаметр: 0,58 мм; Внешний диаметр: 0,965 мм) в трахею и закрепите трубку со строкой шелковой нитью.
- Галстук на многолепестковым (четыре долей правого легкого) с шелковой нитью.
- Вставка 23 иглы в полиэтиленовую трубку и медленно вводят 250 мкл охлажденного льдом стерильный PBS в одной доли с 1 мл шприца.
- Осторожно нажмите легкиеВ 30 раз и собирают жидкость через шприц. Повторите процедуру с 200 мкл PBS (приблизительно 300 мкл PBS, должны быть извлечены из одной доли от общего объема впрыскиваемого 450 мкл).
- Держите БАЛ (БАЛ) на льду, или перечислить Бал клетки немедленно. Количество клеток с heamocytometer, используя раствор Turk для окрашивания клеток 11. Рассчитать общее количество клеток путем умножения количества клеток с коэффициент разбавления окрашивающего раствора и объема внутри рассчитывали области heamocytometer.
- Подготовка дифференциальных кровяных клеток из cytocentrifuged клеток, как описано в другом месте 11.
3. фиксации формалином легочной ткани для гистологического оценки
- Снимите многолепестковым и оснастки заморозить на сухом льду. Хранить при -80 ° С.
- Подключению 60 мл шприц с поршнем удалены на металлической опорной стойке. Заполните шприц с 10% формалинвысота 20 см выше лабораторном столе, представляющих 20 см с постоянным давлением.
- Подключение 23 иглы, прикрепленный к трахее в шприц 60 мл с помощью пластиковой трубкой с клапаном для регулирования потока формалина.
- Вдувать в доле легкого с формалином в течение 5 мин. Отключите иглу и снимите его вместе с полиэтиленовой трубе от трахеи, потянув на шелковой нити, чтобы закрыть трахеи и сохранить давление в легких.
- Погрузитесь доли легкого в формалине и исправить течение 24 часов при 4 ° С.
- Промыть фиксированной ткани в три раза, по крайней мере, 20 мин с 70% -ным этанолом и обезвоживают с помощью ксилола следующей схеме (1 час каждый):
- 3x 70% этанола
- 3x 95% этанола
- 3x 100% этанола
- 3x ксилол
- 1x (жидкость) парафина
- Вставить обезвоженной ткани в парафин, разрезать на 4-5 мкм секций и краситель гематоксилином и эозином, чтобы позволить для гистологического оценки.
Результаты
Вызов аэрозольного P. палочки ЛПС, как правило, дает выраженный воспалительный ответ в просвете дыхательных путей и альвеол пространства, характеризующиеся преобладанием нейтрофилов на обоих ранних и поздних временных точках.
Аэрозольный LPS индуцирует легочную нейтрофилию
C57BL / 6by и BALB / с мышей воздействию аэрозоля P. палочки LPS или в одиночку транспортных средств и нейтрофилы были перечислены в БАЛ. Общее число клеток в БАЛ C57BL / 6by мышей, подвергнутых действию аэрозоля, генерируемого с транспортного средства, как правило, только около или ниже 200000 клеток и клетки состоят из 95-100% мононуклеарных клеток, и только несколько лимфоцитов (0,5-5%), и Нет нейтрофилов в БАЛ (Фиг.2А-С). Мыши заражали аэрозольного LPS проявляют повышенный общее количество клеток в БАЛ, обычно> 500 000 клеток после 6 часов. Ячейка инфильтраты остается высоким после 24 ч. Сотовая профиль в БАЛ смещается в сторону арredominance нейтрофилов (80-95%) после LPS воздействия (рис 2B и C).
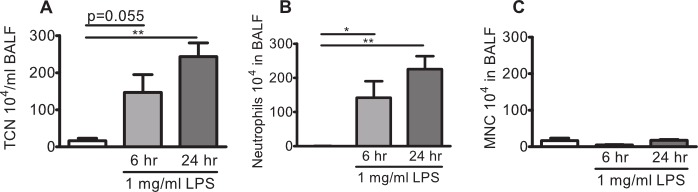
Рисунок 2: легочная. Нейтрофилия в C57BL / 6by мышей заражали 1 мг / мл ЛПС аэрозольного C57BL / 6by мышей подвергали воздействию 1 мг / мл аэрозоль P. палочки ЛПС или носитель (солевой раствор, белая полоса) в покое в течение 10 мин. Бронхоальвеолярного лаважа (BAL) проводили после 6 ч или 24 ч, а лейкоциты были перечислены в БАЛ (БАЛ). (А) Общее количество клеток (ТКС), (В) нейтрофилы, и (с) мононуклеарные клетки (МНК) в БАЛ. Значительные различия были проанализированы с помощью ип-парные т-тесты. N = 3-4 * указывает р <0,05, ** указывает р <0,01.
Сравнима увеличение воспалительных клеток в БАЛ наблюдается в ЛПС заражали линии BALB / C мышей (3А ). Кроме того, процент нейтрофилов и мононуклеарных клеток в БАЛ после инъекции ЛПС сравнима по C57BL / 6 и BALB / C мышей (фигура 3В и С).

Рисунок 3:. Легких нейтрофилия в линии BALB / C мышей, зараженных 1 мг / мл ЛПС аэрозольного линии BALB / C мышей подвергали воздействию 1 мг / мл аэрозоль P. палочки ЛПС или носитель (солевой раствор, белая полоса) в покое в течение 10 мин. Бронхоальвеолярного лаважа (BAL) проводили после 6 ч или 24 ч, а лейкоциты были перечислены в БАЛ (БАЛ). (А) Общее количество клеток (ТКС), (В) нейтрофилы, и (с) мононуклеарные клетки (МНК) в БАЛ. Значительные различия были проанализированы с помощью ип-парные т-тесты. N = 3 ** указывает р <0,01, *** указывает р <0,001.
Аналогичная воспалительный профиль клеток д легких нейтрофилия наблюдается при распылении 5 мг / мл ЛПС (фиг.4А-С) и интраназального доставки ЛПС, как сообщалось ранее 12,13.
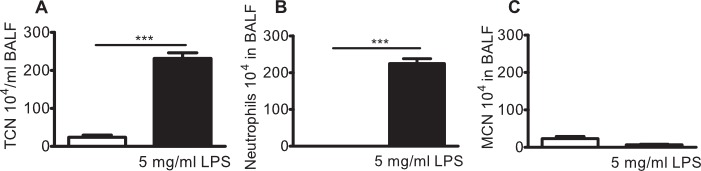
Рисунок 4:. Легких нейтрофилия в линии BALB / C мышей, зараженных 5 мг / мл ЛПС аэрозольного линии BALB / C мышей подвергали воздействию 5 мг / мл аэрозоль P. палочки ЛПС или носитель (солевой раствор, белая полоса) в покое в течение 10 мин. Бронхоальвеолярного лаважа (BAL) проводили после 24 ч и лейкоциты были перечислены в БАЛ (БАЛ). (A) Общее количество клеток (ТКС), (б) нейтрофилов, и (С) мононуклеарные клетки (МНК) в БАЛ. Значительные различия были проанализированы с помощью ип-парные т-тесты. N = 3 ***, указывает р <0,001.
Легочная локализация нейтрофилов в LPS-вызов
ontent "> Нейтрофилы наблюдаются в эпителиальных подслизистой, а также пространств, окружающих проводящие дыхательные пути и кровеносные сосуды LPS-зараженных мышей (рисунок 5). Рассеянные нейтрофилы также обнаружены в паренхиме и альвеолярной области.
Рис. 5: легочная локализация нейтрофилов в ЛПС-зараженных мышей гематоксилином и эозином окрашивание фиксированных формалином легочной ткани из (А) C57BL / 6by мышей, подвергнутых воздействию только наполнитель или (В) 1 мг / мл ЛПС аэрозольные забивали через 6 ч или (C) 24 ч. Стрелка указывает нейтрофилов. Бар показывает 200 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Концция нейтрофилов хемоаттрактантов в БАЛ
Общее содержание белка в БАЛ LPS-зараженных мышей увеличивается по сравнению с мышей, подвергнутых воздействию солевого раствора (рис 6). Кроме того, выражение нейтрофилов хемоаттрактанты хемокина (СХС мотив) лиганда (CXCL) 1 и CXCL2 увеличены в LPS-зараженных мышей 10 (фиг.7А и В).

Рис. 6: Повышение общей концентрации белка в жидкости бронхоальвеолярного лаважа (БАЛ) ЛПС-возможностями C57BL / 6by мышей Общее содержание белка в БАЛ из мышей, зараженных в 1 мг / мл ЛПС, или аэрозольных подверженных транспортного средства (физиологический раствор, белая полоса) в одиночку было измеряют спектрофотометрически. Значительные различия были проанализированы с помощью ип-парные т-тесты. N = 3-4, ** указывает р <0,01.

Рисунок 7: Я ncreased экспрессию CXCL1 и CXCL2 в жидкости бронхоальвеолярного лаважа (БАЛ) ЛПС-зараженных мышей Выражение (А) CXCL1 и (б) CXCL2 в БАЛ мышей, зараженных в 1 мг / мл ЛПС, или аэрозольных воздействию транспортного средства. (физиологический раствор, белая полоса) в одиночку количественно ELISA. Значительные различия были проанализированы с помощью ип-парные т-тесты. N = 3.
Обсуждение
Аэрозольный LPS генерирует воспалительную реакцию в дыхательных путях, характеризуется нейтрофилов в эпителиальных подслизистой, пробелы, окружающие проводящие дыхательные пути, а также альвеолярных пространств. Это, вместе с увеличением общего содержания белка в БАЛ, указателем утечки плазмы, представитель патологии острого повреждения легких. Как ЛПС вызывает стерильный воспаление, реакция не зависит от адаптивного иммунного ответа, и существуют ограничения на отношение к бактериальных инфекций. Методика может, однако, быть использованы, чтобы рассекать воспалительных механизмов за счет исключения адаптивного иммунного ответа.
Хотя методика проста и легко адаптировать, чтобы ответить на различные научные вопросы, выбор распылитель и трубку имеет решающее значение. Отложение ЛПС и в результате нейтрофилез, должны быть проверены с входными отверстиями, распылители и трубопроводов, кроме того, что описано здесь. Кроме того, как реже мыши улДожди могут отображаться различные ответы на ЛПС, оптимальные дозы ЛПС должны быть определены для каждого штамма. Кроме того, нейтрофильный воспаление генерируется аэрозольных LPS сравнима с воспаления, вызванного интраназального доставки ЛПС, как это наблюдалось в других 12, 13. Хотя интраназальное введение легко выполняется, методика требует анестетиков и потенциально может ввести микробной флоры полости носа к легким, так как носовая полость не является стерильной и метод требует большого объема транспортного средства.
В дополнение к отношение к острого повреждения легких, методика может быть дополнительно разработаны, чтобы включать в себя множество проблем с аэрозольных ЛПС. Методология может быть, таким образом, используется для изучения патогенетические механизмы при хроническом воспалении ХОБЛ, что связано с сохраняющейся нейтрофилию 14, вместе с повторяющиеся бактериальных инфекций или постоянного микробной колонизации 15. Таким образом, существует особое значение для нейтрофилов воспаления LPS-зараженных мышей к бактериальным инфекциям, связанных с обострением ХОБЛ, которые являются центральными для прогрессирования заболевания 16, 17.
Вызов с аэрозольными ЛПС может быть установлен за небольшую плату с нескольких приборов и требует минимальной подготовки. Кроме того, этот метод, таким образом, может быть выполнена обычно в большом масштабе в любой лаборатории, практически без вариации между индивидуумами, и, таким образом, превосходит другие маршруты доставки в легкие.
Раскрытие информации
Авраам Рус получил преподаватель плату от Boehringer Ingelheim, грантов на поездки из AstraZeneca R & D и исследовательский грант от AstraZeneca R & D. Магнус Норд полный рабочий день сотрудник AstraZeneca R & D и получил гранты на исследования от AstraZeneca R & D. Йохан Грюневальд и Туве Берг являются со-исследователи по несвязанной исследовательского проекта, финансируемого AstraZeneca R & D.
Благодарности
Мы хотели бы поблагодарить Керстин Thim (AstraZeneca, Лунд, Швеция), Бенита Dahlberg и д-р Андерс Эклунд (Каролинского института, Стокгольм, Швеция), а также д-р Мартин Stampfli (Макмастер университет, Гамильтон, Онтарио, Канада) за умелую помощь и консультации экспертов.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of the material/equipment | Company | Catalog number | Comments/Description |
| Purified Pseudomonas aeruginosa LPS | Sigma-Aldrich | Harmful. Recomended purification. LPS purified from other bactria may be used. | |
| Pari LC sprint star nebulizer | PARI Respiratory Equipment Inc. | 023G1250 | |
| TSI mass flowmeter 4040 | TSI | 4040 | Alternative product from supplier may be used. |
| Saint-Gobain 15.9 mm Tygon tube | Sigma-Aldrich | Z685704 | Recomended brand. |
| Plexiglas boxes with removable lids | Custom built | N/A | 150 x 163 x 205 mm (a 2 mm hole on the side). |
| 3M Half Facepiece Reusable Respirator | 3M | 7503 | Recomended brand. |
| 3M Advanced Particulate Filters (P100) | 3M | 2291 | Recomended brand. |
| Sissors | VWR | 233-1104 | Preferred scissors may be used. |
| Forceps | VWR | 232-1313 | Preferred forceps may be used. |
| Intramedic PE50 polyethylene tube | BD | 427411 | Recomended brand. |
| Ethicon 2-0 Perma-hand silk tread | VWR | 95056-992 | Recomended brand. |
| 26 ½ gage needle | Alternative suppliers exist. | ||
| 1 mL BD slip-tip syringe, non-sterile | BD | 301025 | Alternative suppliers exist. |
| 60 mL BD Luer-Lok syringe, non-sterile, polypropolene | BD | 301035 | Alternative suppliers exist. |
| Fluka Hematoxylin-Eosin | Sigma-Aldrich | 3972 | Alternative suppliers exist. |
| Türk's solution | Merck Millipore | 109277 | |
| Table top centrifuge | Alternative manufacturers exist. | ||
| Cytospin 4 cytocentrifuge | Thermo Scientific | A78300003 | Alternative centrifuge can be used. |
| HEMA-3 stat pack | Fisher Scientific | 23-123-869 | Alternative staining kits exists. |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | Alternative suppliers exist. |
Ссылки
- King, J. D., Kocincova, D., Westman, E. L., Lam, J. S. Review: Lipopolysaccharide biosynthesis in Pseudomonas aeruginosa. Innate Immun. 15, 261-312 (2009).
- Grommes, J., Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol Med. 17, 293-307 (2011).
- Pesci, A., et al. Inflammatory cells and mediators in bronchial lavage of patients with chronic obstructive pulmonary disease. Eur Respir J. 12, 380-386 (1998).
- Hoogerwerf, J. J., et al. Lung Inflammation Induced by Lipoteichoic Acid or Lipopolysaccharide in Humans. Am. J. Respir. Crit. Care Med. 178, 34-41 (2008).
- Scheuchenzuber, W. J., Eskew, M. L., Zarkower, A. Comparative humoral responses to Escherichia coli and sheep red blood cell antigens introduced via the respiratory tract. Exp Lung Res. 13, 97-112 (1987).
- Asti, C., et al. Lipopolysaccharide-induced lung injury in mice. I. Concomitant evaluation of inflammatory cells and haemorrhagic lung damage. Pulm Pharmacol Ther. 13, 61-69 (2000).
- Brand, P., et al. Total deposition of therapeutic particles during spontaneous and controlled inhalations. Journal of pharmaceutical sciences. 89, 724-731 (2000).
- Liu, F., Li, W., Pauluhn, J., Trubel, H., Wang, C. Lipopolysaccharide-induced acute lung injury in rats: comparative assessment of intratracheal instillation and aerosol inhalation. Toxicology. 304, 158-166 (2013).
- Skerrett, S. J., et al. Role of the type 1 TNF receptor in lung inflammation after inhalation of endotoxin or Pseudomonas aeruginosa. American Journal of Physiology - Lung Cellular and Molecular Physiology. 276, L715-L727 (1999).
- Roos, A. B., et al. Lung epithelial-C/EBPbeta contributes to LPS-induced inflammation and its suppression by formoterol. Biochem Biophys Res Commun. 423, 134-139 (2012).
- Didon, L., et al. Lung epithelial CCAAT/enhancer-binding protein-beta is necessary for the integrity of inflammatory responses to cigarette smoke. Am J Respir Crit Care Med. 184, 233-242 (2011).
- Silverpil, E., et al. Negative feedback on IL-23 exerted by IL-17A during pulmonary inflammation. Innate Immunity. 19, 479-492 (2013).
- Mercer, P. F., et al. Proteinase-Activated Receptor-1, CCL2 and CCL7 Regulate Acute Neutrophilic Lung Inflammation. American Journal of Respiratory Cell and Molecular Biology. , (2013).
- Korkmaz, B., Horwitz, M. S., Jenne, D. E., Gauthier, F. . Neutrophil Elastase, Proteinase 3, and Cathepsin G as Therapeutic Targets in Human Diseases. Pharmacological Reviews. 62, 726-759 (2010).
- Bafadhel, M., et al. Acute Exacerbations of COPD: Identification of Biological Clusters and Their Biomarkers. Am. J. Respir. Crit. Care Med. , 201104-200597 (2011).
- Hurst, J. R., Perera, W. R., Wilkinson, T. M. A., Donaldson, G. C., Donaldson, G. C., Wedzicha, G. C. Systemic and Upper and Lower Airway Inflammation at Exacerbation of Chronic Obstructive Pulmonary. Am. J. Respir. Crit. Care Med. 173, 71-78 (2006).
- Rabe, K. F., et al. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease: GOLD Executive Summary. Am. J. Respir. Crit. Care Med. 176, 532-555 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены