Method Article
Un metodo per generare polmonare Neutrofilia Uso inalato Lipopolisaccaride
In questo articolo
Riepilogo
Descriviamo un metodo per indurre l'infiammazione polmonare neutrofila dalla sfida di lipopolysaccharide aerosol per nebulizzazione, per modellare danno polmonare acuto. Inoltre, sono anche descritti tecniche chirurgiche di base per l'isolamento del polmone, l'intubazione tracheale e lavaggio broncoalveolare.
Abstract
Danno polmonare acuto (ALI) è una grave malattia caratterizzata da neutrofilia alveolare, con opzioni di trattamento limitate e alta mortalità. Modelli sperimentali di ALI sono fondamentali nel migliorare la nostra comprensione della patogenesi della malattia. Lipopolisaccaride (LPS) derivato da batteri Gram-positivi induce infiammazione neutrofila delle vie aeree e del parenchima polmonare dei topi. Consegna polmonare efficiente di composti quali LPS è tuttavia difficile da raggiungere. Nell'approccio qui descritto, consegna polmonare nei topi si ottiene sfida di aerosol di Pseudomonas aeruginosa LPS. Disciolto LPS era aerosol da un nebulizzatore collegato ad aria compressa. I topi sono stati esposti a un flusso continuo di LPS aerosol in una scatola plexiglas per 10 minuti, seguito da 2 minuti condizionata, dopo l'aerosol è stato interrotto. L'intubazione tracheale e successivo lavaggio broncoalveolare, seguita da perfusione formalina è stata eseguita successiva, che consente caratterizzazione del p steriliinfiammazione ulmonary. Inalato LPS genera una infiammazione polmonare caratterizzata da neutrofilia alveolare, rilevata in lavaggio broncoalveolare e da una valutazione istologica. Questa tecnica può essere impostato ad un piccolo costo con pochi elettrodomestici, e richiede un minimo di formazione e competenza. Il sistema di esposizione può quindi essere eseguita di routine in qualsiasi laboratorio, con la possibilità di migliorare la nostra comprensione della patologia polmonare.
Introduzione
Lipopolisaccaride (LPS) è un componente della parete cellulare di batteri gram negativi 1. Sfida a LPS è un modello ben documentato di danno polmonare acuto, una sindrome caratterizzata da infiammazione neutrofila acuta e l'edema 2. Inoltre, neutrofilia polmonare è anche un segno distintivo della broncopneumopatia cronica ostruttiva (BPCO) 3, e LPS sfida negli esseri umani è stato utilizzato per modellare riacutizzazioni della BPCO 4. Così, modelli sperimentali di esposizione LPS sono clinicamente rilevanti e preziosi strumenti per comprendere la patologia umana.
L'obiettivo della consegna polmonare di LPS aerosol qui descritte è quello di generare una risposta infiammatoria neutrofili nella conduzione e vie respiratorie, senza coinvolgimento sistemico. Diverse tecniche di LPS sfida sono stati descritti in precedenza. Iniezione intra-venosa di LPS è il percorso più comunemente usato di somministrazione. Sebbene questa tecnica è facilmente accessibile, tche danno primario è all'endotelio, distruzione secondaria dell'epitelio polmonare conseguente migrazione dei neutrofili al polmone. Somministrazione intra-venosa induce anche l'infiammazione sistemica 2, che può complicare il quadro clinico in modelli animali. Infiammazione sistemica è in contrasto non osservati con la somministrazione intra-tracheale. Questa tecnica, tuttavia, è laborioso e richiede anestetici e notevole formazione 5, 6. Inoltre, la deposizione polmonare da questa via di somministrazione dipende respirazione 7. Così, la deposizione polmonare è influenzato dalla profondità dell'anestesia necessari per la somministrazione intra tracheale e la deposizione nelle vie aeree variabili possono essere osservate. Al contrario, la consegna polmonare con LPS aerosol richiede un addestramento minimo, e può essere facilmente realizzata su un gran numero di animali con poca o nessuna variazione tra individui 5, 8.Un recente studio conferma che la consegna aerosol è superiore al percorso intra-tracheale in materia di deposito, e che dosi più rilevanti di LPS induce infiammazione neutrofila con questo modello 8.
Studi precedenti hanno dimostrato che sfida per aereosol Psuedomonas aeruginosa LPS genera una risposta infiammatoria marcato nel lume delle vie aeree e del parenchima polmonare, inclusi gli spazi alveolari 9, 10. L'infiammazione è caratterizzata da una predominanza di neutrofili e presenza di edema polmonare, e può quindi essere utilizzato per affrontare patogenesi del danno polmonare acuto e acquisire ulteriori conoscenze dei meccanismi che contribuiscono alla patologia malattia.
Protocollo
Gli studi su animali sono state approvate dal comitato etico del benessere degli animali del nord di Stoccolma. Le procedure sperimentali sono state eseguite in conformità con il diritto svedese.
1. Creazione di un LPS Aerosol
- Sciogliere 0,5 g purificato P. aeruginosa LPS in 50 ml di soluzione fisiologica sterile e scuotendo con cautela e verificare la dissoluzione. Diluire 1 ml LPS disciolti in 9 ml salina sterile ad una concentrazione finale di 1 mg / ml. Proteggere dalla luce con un foglio di alluminio e conservare a -20 ° C.
- Scongelare LPS solubilizzate al buio a temperatura ambiente e mescolare bene immediatamente prima dell'uso.
- In una cappa rischio biologico ventilata livello II, inserire un ingresso rosso in un nebulizzatore, e collegare il nebulizzatore ad aria ambiente pressurizzata attraverso il tubo fornito dal (regime revisione presentando i dispositivi sperimentali in figura 1) produttore.
ATTENZIONE: attrezzature protettive adeguate, tra cui un mezzo facciale respirat riutilizzabileo con filtri antiparticolato, occhiali, guanti e indumenti protettivi dovrebbero essere utilizzati nel corso dell'esposizione.

Figura 1:. Rappresentazione schematica dei dispositivi sperimentali utilizzati per generare un aerosol L'ingresso del nebulizzatore è collegato ad un'alimentazione di aria. L'uscita del nebulizzatore viene collegato a un flussometro attraverso un tubo di 15,9 millimetri e un filtro dell'aria, e la fornitura di aria viene regolato a 5,0 L / m 2 a pressione kbar. L'uscita è vicino collegato a una scatola in plexiglas dotato di coperchi rimovibili e fori da 5 mm per evitare l'accumulo di pressione.
- Collegare l'uscita del nebulizzatore ad un flussimetro di massa tramite un filtro dell'aria. Collegare il flussimetro di massa ad un'alimentazione elettrica.
- Regolare l'alimentazione di aria a 5 l / min, con una pressione rimanendo a 1,0-2,0 bar.
- Rimuovere il misuratore di portata e di massascollegare l'alimentazione dell'aria.
- Collegare l'uscita del nebulizzatore ad un tubo 15,9 millimetri, che si biforca e si collega a due scatole plexiglas con le dimensioni: 150 x 163 x 205 mm, provvista di coperchi amovibili. Ogni scatola dovrebbe avere un foro 5 mm sul lato opposti l'ingresso, per evitare l'accumulo di pressione.
- Luogo fino a 5 topi in ogni scatola di plexiglas e chiudere le palpebre.
- Aprire il nebulizzatore e riempire l'inserto con almeno 4 ml LPS disciolti in soluzione fisiologica sterile o solo veicolo (soluzione fisiologica sterile, il volume non dovrebbe superare 8 ml). Ri-collegare l'ingresso per l'aria di alimentazione.
- Consentire l'aerosol di fluire nelle caselle plexiglas chiuso per 10 min. Monitorare gli animali continua. Assicurarsi che l'alimentazione dell'aria rimane saldamente assicurato all'ingresso del nebulizzatore.
- Staccare l'alimentazione dell'aria. Con i coperchi chiuso, lasciare che gli animali rimangono nelle caselle plexiglas per 2 min.
- Aprire i coperchi e consentire l'aerosol a disperdere, e restituire agli animali di tlui gabbie. Se gli animali appaiono bagnati, posizionare le gabbie su una piastra elettrica impostato su fuoco basso, per evitare l'ipotermia.
- Monitorare gli animali in continuo per i primi 30 minuti, e successivamente ogni 2 ore per le prime 6 ore. Gli animali devono presentare alterazioni della respirazione normale e l'attività durante e dopo la procedura di nebulizzazione.
2. lavaggio broncoalveolare (BAL)
- Al punto finale sperimentale, profondamente anestetizzare gli animali con isoflurano ad effetto come raccomandato dal personale veterinario del proprio istituto. Pizzica la zampa posteriore per controllare un riflesso di ritiro per garantire una sufficiente profondità dell'anestesia per condurre interventi di chirurgia maggiore. Spray giù la pelliccia degli animali con il 70% di etanolo.
- Aprire l'addome con le forbici, e tagliare l'aorta per Exsanguinate l'animale. Posizionare un pezzo di tessuto sopra l'addome per assorbire il sangue.
- Follwing eutanasia, utilizzare un unico taglio antero-posteriore delle forbici peresporre il torace. Sollevare la gabbia toracica dalla punta anteriore dello sterno e usare le forbici per forare il diaframma nel punto più ventrale, senza intaccare alcun lobo polmonare. Aprire la gabbia toracica, facendo due tagli in direzione antero-posteriore (riunioni sotto la mascella).
- Tirare delicatamente a parte la gabbia toracica con pinze, e tagliare la trachea sotto la laringe.
- Sollevare la trachea con le pinze e rimuovere i polmoni tagliando i legamenti che collegano i lobi alla cavità toracica, e tirando delicatamente dal adiposo e tessuto cardiaco.
- Inserire un tubo di polietilene (diametro interno: 0,58 millimetri; diametro esterno: 0,965 millimetri) nella trachea e fissare il tubo con una stringa di filo di seta.
- Legare il multilobe (i quattro lobi del polmone destro) con filo di seta.
- Inserire un ago calibro 23 nel tubo di polietilene e iniettare lentamente 250 ml di ghiaccio freddo PBS sterile nel singolo lobo con una siringa da 1 ml.
- Toccare con attenzione i polmoni30 volte e raccogliere il liquido attraverso la siringa. Ripetere la procedura con 200 microlitri di PBS (circa 300 ml PBS deve essere recuperato dal singolo lobo dal volume totale iniettato 450 ml).
- Tenere il liquido di lavaggio broncoalveolare (BAL) su ghiaccio, o elencare immediatamente le cellule BAL. Contare le cellule con un heamocytometer, usando la soluzione Turk per colorare le cellule 11. Calcolare il numero totale di cellule moltiplicando il numero di cellule con il fattore di diluizione della soluzione colorante e il volume nel campo conteggiato del heamocytometer.
- Preparare la conta cellulare differenziata dalle cellule cytocentrifuged come descritto altrove 11.
3. formalina Fissazione di tessuto polmonare per la valutazione istologica
- Rimuovere il multilobe e snap-freeze in ghiaccio secco. Conservare a -80 ° C.
- Montare una siringa da 60 ml con lo stantuffo rimosso su un cavalletto di sostegno metallico. Riempire la siringa con il 10% di formalina perl'altezza di 20 cm sopra il banco di laboratorio, in rappresentanza di 20 cm di pressione costante.
- Collegare l'ago calibro 23 fissata alla trachea alla siringa 60 ml con un tubo di plastica con una valvola per controllare il flusso di formalina.
- Insufflare il lobo polmonare con formalina per 5 min. Scollegare l'ago e rimuoverlo insieme al tubo di polietilene dalla trachea tirando sul filo di seta per chiudere la trachea e mantenere la pressione nel polmone.
- Immergere il lobo polmonare in formalina e fissare per 24 ore a 4 ° C.
- Lavare il tessuto fissato tre volte per almeno 20 min con 70% di etanolo, e disidratare a xilene attraverso il seguente schema (1 ora ciascuno):
- 3x 70% di etanolo
- 3x 95% di etanolo
- 3x 100% di etanolo
- 3x xilene
- 1x (liquido) paraffina
- Tessuto Incorpora disidratati in paraffina, tagliato a 4-5 micron sezioni, e macchia con ematossilina e eosina per consentire la valutazione istologica.
Risultati
Sfida di aerosol P. aeruginosa LPS solito produce una risposta infiammatoria marcata nel lume delle vie aeree e lo spazio alveolare, caratterizzato da una predominanza di neutrofili in entrambi i punti temporali precoce e tardiva.
Inalato LPS induce neutrofilia polmonare
C57BL / 6BY e BALB / c topi sono stati esposti ad aerosol P. aeruginosa LPS o solo veicolo e neutrofili sono stati enumerati in BALF. Il numero totale di cellule in BALF di C57BL / topi 6BY esposti ad aerosol generato con il veicolo è soltanto tipicamente intorno o sotto 200.000 cellule e le cellule sono costituiti da cellule mononucleate 95-100%, con pochi linfociti (0,5-5%), e non neutrofili nel BALF (Figura 2A-C). Topi sfidato con aerosol mostra LPS un aumento del numero di cellule totale in BALF, tipicamente> 500.000 cellule dopo 6 ore. Il infiltrati cellulare rimane alta dopo 24 ore. Il profilo cellulare in BALF si sposta verso apredominance di neutrofili (80-95%) a seguito di esposizione LPS (Figura 2B e C).
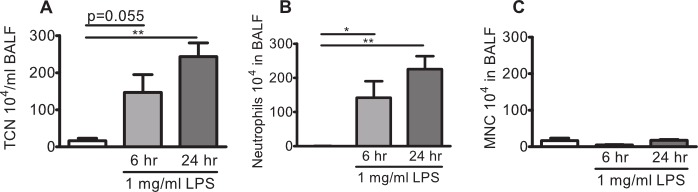
Figura 2:. Neutrofilia polmonare in C57BL / topi 6BY sfidato con 1 mg / ml LPS aerosol C57BL / topi 6BY sono stati esposti a 1 mg / ml aerosol P. aeruginosa LPS o veicolo (soluzione salina, bar bianco) da solo per 10 minuti. Il lavaggio broncoalveolare (BAL) è stata eseguita dopo 6 ore o 24 ore e leucociti venivano registrati negli BAL (BALF). (A) Numero totale di cellule (TCN), (B) neutrofili, e (C), le cellule mononucleate (MNC) in BALF. Differenze significative sono state analizzate utilizzando t-test non-accoppiato. n = 3-4, * indica p <0.05, ** indica p <0.01.
Un analogo aumento cellule infiammatorie nel BALF si osserva in LPS-sfidato BALB / c topi (Figura 3A ). Inoltre, la percentuale di neutrofili e cellule mononucleari nel BALF dopo LPS sfida è paragonabile in C57BL / 6 e topi BALB / c (Figura 3B e C).

Figura 3:. Neutrofilia polmonare in topi BALB / c sfidato con 1 mg / ml LPS aerosol topi BALB / c sono stati esposti a 1 mg / ml aerosol P. aeruginosa LPS o veicolo (soluzione salina, bar bianco) da solo per 10 minuti. Il lavaggio broncoalveolare (BAL) è stata eseguita dopo 6 ore o 24 ore e leucociti venivano registrati negli BAL (BALF). (A) Numero totale di cellule (TCN), (B) neutrofili, e (C), le cellule mononucleate (MNC) in BALF. Differenze significative sono state analizzate utilizzando t-test non-accoppiato. n = 3, indica ** p <0.01, indica *** p <0.001.
Simile infiammatoria profilo cellulare un d neutrofilia polmonare è osservata con nebulizzazione di 5 mg / ml LPS (Figura 4A-C) e consegna intranasale di LPS, come precedentemente riportato 12,13.
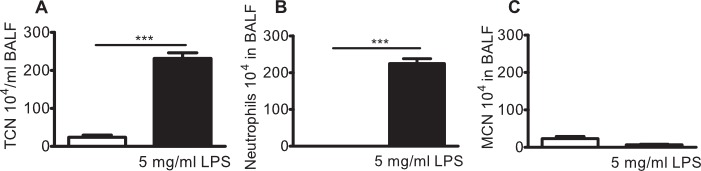
Figura 4:. Neutrofilia polmonare in topi BALB / c sfidati con 5 mg / ml LPS aerosol topi BALB / c sono stati esposti a 5 mg / ml aerosol P. aeruginosa LPS o veicolo (soluzione salina, bar bianco) da solo per 10 minuti. Il lavaggio broncoalveolare (BAL) è stata eseguita dopo 24 ore e leucociti venivano registrati negli BAL (BALF). (A) numero di cellule totale (TCN), (B) neutrofili, e (C), le cellule mononucleate (MNC) in BALF. Differenze significative sono state analizzate utilizzando t-test non-accoppiato. n = 3, indica *** p <0.001.
La localizzazione polmonare di neutrofili in LPS-sfidato
ONTENUTO "> I neutrofili sono osservati nella sottomucosa epiteliale, così come gli spazi che circondano le vie aeree di conduzione e vasi sanguigni dei topi LPS-sfidati (Figura 5). neutrofili dispersi sono anche rilevate nel parenchima e regione alveolare.
Figura 5:. Localizzazione polmonare di neutrofili nei topi LPS-sfidati ematossilina e eosina di tessuto polmonare fissato in formalina da (A) C57BL / topi 6BY esposti a solo veicolo o (B) 1 mg / LPS aerosol ml sacrificati dopo 6 ore o (C) 24 ore. La freccia indica una neutrofili. La barra indica 200 micron. Clicca qui per vedere una versione più grande di questa figura.
Conczione di chemoattractants neutrofili in BALF
Il contenuto totale di proteine nella BALF di topi LPS-sfidati è aumentato rispetto a topi esposti a soluzione salina (Figura 6). Inoltre, l'espressione della chemoattractants neutrofili chemochine (CXC motif) ligandi (CXCL) 1 e CXCL2 sono aumentati in LPS-sfidato topi 10 (Figura 7A e B).

Figura 6:. Aumento della concentrazione di proteine totali nel liquido di lavaggio broncoalveolare (BAL) di LPS-sfidati C57BL / mice 6BY contenuto proteico totale in BALF di topi sfidati a 1 mg / ml LPS aerosol o esposti al veicolo (soluzione salina, bar bianco) solo era misurata con analisi spettrofotometrica. Differenze significative sono state analizzate utilizzando t-test non-accoppiato. n = 3-4, ** indica p <0.01.

Figura 7: I ncreased espressione di CXCL1 e CXCL2 in lavaggio broncoalveolare fluido (BALF) di topi LPS-sfidato espressione di (A) CXCL1 e (B) CXCL2 in BALF di topi sfidato a 1 mg / ml LPS aerosol o esposto a veicolo. (saline, bar bianco) da solo quantificata mediante ELISA. Differenze significative sono state analizzate utilizzando t-test non-accoppiato. n = 3.
Discussione
Inalato LPS genera una risposta infiammatoria nelle vie aeree, caratterizzata dai neutrofili nella sottomucosa epiteliale, spazi circostanti vie aeree di conduzione, nonché gli spazi alveolari. Questo è, unitamente alla maggiore contenuto proteico totale BALF, indicative di perdite plasma, rappresentativo della patologia del danno polmonare acuto. Come LPS induce una infiammazione sterili, la reazione è indipendente della risposta immunitaria adattativa, e ci sono limitazioni alla rilevanza alle infezioni batteriche. La tecnica può tuttavia essere utilizzato per analizzare meccanismi infiammatori escludendo risposte immunitarie adattative.
Anche se il metodo è semplice e facilmente adattabile a diverse domande rispondere scientifiche, la scelta del nebulizzatore e il tubo è critica. La deposizione di LPS e neutrofilia risultante deve essere validato con insenature, nebulizzatori e tubi diversi da quanto descritto qui. Inoltre, come meno comuni del mouse stpiogge possono mostrare diverse risposte a LPS, dosi ottimali di LPS dovrebbero essere determinati per ogni ceppo. Inoltre, l'infiammazione neutrofila generato con LPS aerosol è comparabile con l'infiammazione indotta da consegna intranasale di LPS, come osservato da altri 12, 13. Sebbene la somministrazione intranasale è eseguita facilmente, la metodologia richiede anestetici e potrebbe potenzialmente introdurre la flora microbica della cavità nasale per i polmoni, come la cavità nasale non è sterile e la tecnica richiede un grande volume di veicolo.
Oltre alla rilevanza di danno polmonare acuto, la tecnica può essere ulteriormente sviluppato per includere più sfide con LPS aerosol. Il metodo può quindi essere utilizzato per studiare i meccanismi patogenetici nella infiammazione cronica della BPCO, che è associato con persistenti neutrofilia 14, insieme con infezioni batteriche ricorrenti o colonizzazione microbica permanente 15. Quindi, vi è una particolare rilevanza per l'infiammazione neutrofila di topi LPS-sfidati alle infezioni batteriche associate a riacutizzazioni di BPCO, che sono centrali per la progressione della malattia 16, 17.
Sfida con LPS aerosol può essere impostato ad un piccolo costo con pochi elettrodomestici e richiede una formazione minima. Inoltre, la tecnica può quindi essere regolarmente eseguita su larga scala in qualsiasi laboratorio, con poca o nessuna variazione tra individui e quindi è superiore alle altre vie di consegna polmonare.
Divulgazioni
Abraham Roos ha ricevuto i diritti docente da Boehringer Ingelheim, borse viaggio da AstraZeneca R & S e di un assegno di ricerca da AstraZeneca R & S. Magnus Nord è un dipendente a tempo pieno di AstraZeneca R & S e ha ricevuto assegni di ricerca da AstraZeneca R & S. Johan Grunewald e Tove Berg sono co-ricercatori su un progetto di ricerca finanziato dalla correlato AstraZeneca R & S.
Riconoscimenti
Vorremmo ringraziare Kerstin Thim (AstraZeneca, Lund, Svezia), Benita Dahlberg e Dr. Anders Eklund (Karolinska Institutet, Stoccolma, Svezia) e Dr. Martin Stampfli (McMaster University, Hamilton, ON, Canada) per l'assistenza abile e la consulenza di esperti.
Materiali
| Name | Company | Catalog Number | Comments |
| Name of the material/equipment | Company | Catalog number | Comments/Description |
| Purified Pseudomonas aeruginosa LPS | Sigma-Aldrich | Harmful. Recomended purification. LPS purified from other bactria may be used. | |
| Pari LC sprint star nebulizer | PARI Respiratory Equipment Inc. | 023G1250 | |
| TSI mass flowmeter 4040 | TSI | 4040 | Alternative product from supplier may be used. |
| Saint-Gobain 15.9 mm Tygon tube | Sigma-Aldrich | Z685704 | Recomended brand. |
| Plexiglas boxes with removable lids | Custom built | N/A | 150 x 163 x 205 mm (a 2 mm hole on the side). |
| 3M Half Facepiece Reusable Respirator | 3M | 7503 | Recomended brand. |
| 3M Advanced Particulate Filters (P100) | 3M | 2291 | Recomended brand. |
| Sissors | VWR | 233-1104 | Preferred scissors may be used. |
| Forceps | VWR | 232-1313 | Preferred forceps may be used. |
| Intramedic PE50 polyethylene tube | BD | 427411 | Recomended brand. |
| Ethicon 2-0 Perma-hand silk tread | VWR | 95056-992 | Recomended brand. |
| 26 ½ gage needle | Alternative suppliers exist. | ||
| 1 mL BD slip-tip syringe, non-sterile | BD | 301025 | Alternative suppliers exist. |
| 60 mL BD Luer-Lok syringe, non-sterile, polypropolene | BD | 301035 | Alternative suppliers exist. |
| Fluka Hematoxylin-Eosin | Sigma-Aldrich | 3972 | Alternative suppliers exist. |
| Türk's solution | Merck Millipore | 109277 | |
| Table top centrifuge | Alternative manufacturers exist. | ||
| Cytospin 4 cytocentrifuge | Thermo Scientific | A78300003 | Alternative centrifuge can be used. |
| HEMA-3 stat pack | Fisher Scientific | 23-123-869 | Alternative staining kits exists. |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | Alternative suppliers exist. |
Riferimenti
- King, J. D., Kocincova, D., Westman, E. L., Lam, J. S. Review: Lipopolysaccharide biosynthesis in Pseudomonas aeruginosa. Innate Immun. 15, 261-312 (2009).
- Grommes, J., Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol Med. 17, 293-307 (2011).
- Pesci, A., et al. Inflammatory cells and mediators in bronchial lavage of patients with chronic obstructive pulmonary disease. Eur Respir J. 12, 380-386 (1998).
- Hoogerwerf, J. J., et al. Lung Inflammation Induced by Lipoteichoic Acid or Lipopolysaccharide in Humans. Am. J. Respir. Crit. Care Med. 178, 34-41 (2008).
- Scheuchenzuber, W. J., Eskew, M. L., Zarkower, A. Comparative humoral responses to Escherichia coli and sheep red blood cell antigens introduced via the respiratory tract. Exp Lung Res. 13, 97-112 (1987).
- Asti, C., et al. Lipopolysaccharide-induced lung injury in mice. I. Concomitant evaluation of inflammatory cells and haemorrhagic lung damage. Pulm Pharmacol Ther. 13, 61-69 (2000).
- Brand, P., et al. Total deposition of therapeutic particles during spontaneous and controlled inhalations. Journal of pharmaceutical sciences. 89, 724-731 (2000).
- Liu, F., Li, W., Pauluhn, J., Trubel, H., Wang, C. Lipopolysaccharide-induced acute lung injury in rats: comparative assessment of intratracheal instillation and aerosol inhalation. Toxicology. 304, 158-166 (2013).
- Skerrett, S. J., et al. Role of the type 1 TNF receptor in lung inflammation after inhalation of endotoxin or Pseudomonas aeruginosa. American Journal of Physiology - Lung Cellular and Molecular Physiology. 276, L715-L727 (1999).
- Roos, A. B., et al. Lung epithelial-C/EBPbeta contributes to LPS-induced inflammation and its suppression by formoterol. Biochem Biophys Res Commun. 423, 134-139 (2012).
- Didon, L., et al. Lung epithelial CCAAT/enhancer-binding protein-beta is necessary for the integrity of inflammatory responses to cigarette smoke. Am J Respir Crit Care Med. 184, 233-242 (2011).
- Silverpil, E., et al. Negative feedback on IL-23 exerted by IL-17A during pulmonary inflammation. Innate Immunity. 19, 479-492 (2013).
- Mercer, P. F., et al. Proteinase-Activated Receptor-1, CCL2 and CCL7 Regulate Acute Neutrophilic Lung Inflammation. American Journal of Respiratory Cell and Molecular Biology. , (2013).
- Korkmaz, B., Horwitz, M. S., Jenne, D. E., Gauthier, F. . Neutrophil Elastase, Proteinase 3, and Cathepsin G as Therapeutic Targets in Human Diseases. Pharmacological Reviews. 62, 726-759 (2010).
- Bafadhel, M., et al. Acute Exacerbations of COPD: Identification of Biological Clusters and Their Biomarkers. Am. J. Respir. Crit. Care Med. , 201104-200597 (2011).
- Hurst, J. R., Perera, W. R., Wilkinson, T. M. A., Donaldson, G. C., Donaldson, G. C., Wedzicha, G. C. Systemic and Upper and Lower Airway Inflammation at Exacerbation of Chronic Obstructive Pulmonary. Am. J. Respir. Crit. Care Med. 173, 71-78 (2006).
- Rabe, K. F., et al. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease: GOLD Executive Summary. Am. J. Respir. Crit. Care Med. 176, 532-555 (2007).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon