Method Article
Un método para generar pulmonar Neutrofilia Usando aerosol lipopolisacárido
En este artículo
Resumen
Se describe un método para inducir la inflamación pulmonar neutrofílica por desafío para el lipopolisacárido de aerosol por nebulización, para modelar la lesión pulmonar aguda. Además, también se describen técnicas quirúrgicas básicas para la separación de pulmón, la intubación traqueal y lavado broncoalveolar.
Resumen
La lesión pulmonar aguda (ALI) es una enfermedad grave caracterizada por neutrofilia alveolar, con opciones de tratamiento limitadas y una elevada mortalidad. Los modelos experimentales de ALI son clave para mejorar nuestra comprensión de la patogénesis de la enfermedad. El lipopolisacárido (LPS) derivadas de bacterias gram positivas induce la inflamación neutrofílica en las vías respiratorias y parénquima pulmonar de los ratones. La administración pulmonar eficiente de compuestos tales como LPS es, sin embargo, difícil de lograr. En el método descrito aquí, la administración pulmonar en ratones se logra mediante desafío para aerosol Pseudomonas aeruginosa LPS. Disuelto LPS fue aerosol mediante un nebulizador conectado a aire comprimido. Los ratones fueron expuestos a un flujo continuo de LPS aerosol en una caja de plexiglás durante 10 min, seguido de 2 min acondicionado después se suspendió el aerosol. La intubación traqueal y posterior lavado broncoalveolar, seguido de una perfusión de formalina se realizaron siguiente, que permite la caracterización de la p estérilinflamación ulmonary. Aerosol LPS genera una inflamación pulmonar que se caracteriza por neutrofilia alveolar, detectado en el lavado broncoalveolar y por evaluación histológica. Esta técnica se puede configurar en un pequeño coste con unos aparatos, y requiere una formación mínima y experiencia. El sistema de exposición de este modo se puede realizar de forma rutinaria en un laboratorio, con el potencial de mejorar nuestra comprensión de la patología pulmonar.
Introducción
El lipopolisacárido (LPS) es un componente de la pared celular de las bacterias gram negativas 1. Desafío a LPS es un modelo bien documentado de la lesión pulmonar aguda, un síndrome caracterizado por la inflamación neutrofílica aguda y edema 2. Además, neutrofilia pulmonar es también una característica de la enfermedad pulmonar obstructiva crónica (EPOC) 3, y el desafío LPS en los seres humanos se ha utilizado para modelar las exacerbaciones de EPOC 4. Así, los modelos experimentales de la exposición LPS son clínicamente relevantes y herramientas valiosas para entender la patología humana.
El objetivo de la administración pulmonar de aerosol LPS descritas aquí es generar una respuesta inflamatoria neutrofílica en la realización y vías respiratorias, sin afectación sistémica. Varias técnicas de exposición a LPS se han descrito anteriormente. Inyección intra-venosa de LPS es la ruta más común de administración. Aunque esta técnica es fácilmente accesible, tél daño primario es al endotelio, con la destrucción secundaria del epitelio pulmonar después de la migración de neutrófilos al pulmón. Administración intra-venosa también induce la inflamación sistémica 2, lo que puede complicar el cuadro clínico en modelos animales. La inflamación sistémica está en contraste no observado con la administración intra-traqueal. Esta técnica, sin embargo, es una labor intensiva y requiere anestésicos así como una considerable formación 5, 6. Además, la deposición pulmonar por esta vía de administración depende de la respiración 7. Por lo tanto, la deposición pulmonar se ve afectada por la profundidad de la anestesia necesaria para se pueden observar la administración traqueal intra y deposición variable en las vías respiratorias. En contraste, la administración pulmonar con LPS en aerosol requiere una formación mínima, y se puede lograr fácilmente en un gran número de animales con poca o ninguna variación entre individuos 5, 8.Un estudio reciente confirma que la administración en aerosol es superior a la ruta intra-traqueal con respecto a la deposición, y que las dosis más relevantes de LPS induce la inflamación neutrofílica con este modelo 8.
Estudios anteriores han demostrado que desafío para aerosol Pseudomonas aeruginosa LPS genera una respuesta inflamatoria marcada en el lumen de la vía aérea y parénquima pulmonar, incluyendo los espacios alveolares 9, 10. La inflamación se caracteriza por el predominio de neutrófilos y la presencia de edema pulmonar, y por lo tanto se puede utilizar para hacer frente a la patogénesis de la lesión pulmonar aguda y adquirir un mayor conocimiento de los mecanismos que contribuyen a la patología de la enfermedad.
Protocolo
Los estudios con animales fueron aprobados por el comité de ética de bienestar animal Estocolmo norte. Los procedimientos experimentales se realizaron en cumplimiento de la legislación sueca.
1. Generación de un Aerosol LPS
- Disolver 0,5 g purificado P. aeruginosa LPS en 50 ml de solución salina estéril con agitación suave y verificar la disolución. Diluir 1 ml disueltos LPS en 9 ml de solución salina estéril, a una concentración final de 1 mg / ml. Proteger de la luz con papel de aluminio y se almacena a -20 ° C.
- Descongelar LPS solubilizados en la oscuridad a temperatura ambiente y mezclar bien inmediatamente antes del uso.
- En un nivel II campana de bioseguridad ventilado, insertar una entrada de rojo en un nebulizador, y conectar el nebulizador al aire ambiente presurizado a través de la tubería proporcionada por el (esquema de revisión la presentación de los dispositivos experimentales en la Figura 1) fabricante.
PRECAUCIÓN: el equipo de protección personal adecuado, incluyendo una media pieza facial respirat reutilizableo con filtros de partículas, gafas, guantes y ropa de protección debe utilizarse durante el transcurso de la exposición.

Figura 1:. Presentación esquemática de los dispositivos experimentales utilizados para la generación de un aerosol La entrada del nebulizador está conectado a un suministro de aire. La salida del nebulizador se conecta primero a un medidor de flujo a través de un tubo de 15,9 mm y un filtro de aire, y el suministro de aire se ajusta a 5,0 L / m en 2 kbar de presión. La salida está al lado conectado a una caja de plexiglás equipado con tapas removibles y 5 agujeros mm para evitar la acumulación de presión.
- Conectar la salida del nebulizador para un medidor de flujo de masa a través de un filtro de aire. Conectar el medidor de flujo de masa a un suministro eléctrico.
- Ajuste el suministro de aire a 5 L / min, con una presión restante en 1,0-2,0 bar.
- Retire el medidor de flujo de masa ydesconecte el suministro de aire.
- Conectar la salida del nebulizador a un tubo de 15,9 mm, que se bifurca y se conecta a dos cajas de plexiglás con las dimensiones: 150 x 163 x 205 mm, equipados con tapas removibles. Cada caja debe tener un agujero de 5 mm en el lado opuesto a la entrada, para evitar la acumulación de presión.
- Coloque un máximo de 5 ratones en cada caja de plexiglás y cerrar los párpados.
- Abra el nebulizador y llenar el inserto con al menos 4 ml de LPS disuelto en solución salina o vehículo estéril solo (solución salina estéril; el volumen no debe superar los 8 ml). Vuelva a conectar la entrada de suministro de aire.
- Permitir que el aerosol fluya hacia las cajas de plexiglás cerrados durante 10 min. Supervise a los animales de forma continua. Asegúrese de que el suministro de aire se mantiene firmemente asegurada a la entrada del nebulizador.
- Desconecte el suministro de aire. Con los párpados cerrados, dejar que los animales permanecen en las cajas de plexiglás durante 2 min.
- Abra las tapas y permitir el aerosol para dispersar, y devolver los animales a tél jaulas. Si los animales aparecen en húmedo, coloque las jaulas en una almohadilla térmica a baja temperatura, para evitar la hipotermia.
- Supervise a los animales de forma continua durante los primeros 30 minutos, y posteriormente cada 2 h durante las primeras 6 horas. Los animales deben exhibir patrón respiratorio normal y la actividad durante y después del procedimiento de nebulización.
2. lavado broncoalveolar (BAL)
- En el punto final experimental, profundamente anestesiar a los animales con isoflurano a efecto según lo recomendado por el personal veterinario de la institución. Apriete la pata posterior para verificar el reflejo de retirada para garantizar la suficiente profundidad de la anestesia para llevar a cabo una cirugía mayor. Pulverizar abajo de la piel de los animales con etanol al 70%.
- Abra el abdomen con unas tijeras, y apartarán de la aorta para Exsanguinate animal. Coloque un pedazo de tejido sobre el abdomen para absorber la sangre.
- Follwing eutanasia, utilice un solo corte anterior-posterior de las tijeras paraexponer el tórax. Levante la caja torácica por el extremo anterior del esternón y usar las tijeras para perforar el diafragma en el punto ventral más, sin cortar en cualquier lóbulo pulmonar. Abra la caja torácica haciendo dos cortes en la dirección antero-posterior (reuniones por debajo de la mandíbula).
- Tire suavemente aparte de las costillas con unas pinzas, y cortar la tráquea por debajo de la laringe.
- Levantar la tráquea con las pinzas y quitar los pulmones mediante la reducción de los ligamentos que conectan los lóbulos a la cavidad torácica, y tirando suavemente por el tejido adiposo y cardíaco.
- Insertar un tubo de polietileno (diámetro interno: 0,58 mm; diámetro exterior: 0.965 mm) en la tráquea y asegurar el tubo con una cadena de hilo de seda.
- Ate la multilobular (los cuatro lóbulos del pulmón derecho) con hilo de seda.
- Inserte una aguja de calibre 23 en el tubo de polietileno e inyectar lentamente 250 l de PBS estéril fría en el lóbulo individual con una jeringa de 1 ml.
- Golpee suavemente los pulmones30 veces y recoger el líquido a través de la jeringa. Repetir el procedimiento con 200 l de PBS (aproximadamente 300 l de PBS debería ser recuperado de la solo lóbulo del volumen total inyectado de 450 l).
- Mantenga el líquido de lavado broncoalveolar (BALF) en hielo, o enumerar las células BAL inmediatamente. Contar las células con un heamocytometer, utilizando la solución de Turk para teñir las células 11. Calcular el número total de células multiplicando el número de células con el factor de dilución de la solución de tinción y el volumen dentro del campo de contado de la heamocytometer.
- Preparar los recuentos de células diferenciales a partir de células citocentrifugadas como se describe en otra parte 11.
3. La formalina Fijación de tejido pulmonar para la evaluación histológica
- Retire la multilobular y complemento de congelación en hielo seco. Almacenar a -80 ° C.
- Montar una jeringa de 60 ml con el émbolo retirado en un soporte de apoyo de metal. Llene la jeringa con formol al 10% parala altura de 20 cm por encima de la mesa de laboratorio, que representan a 20 cm de presión constante.
- Conectar la aguja de calibre 23 fijada a la tráquea a la jeringa 60 ml a través de un tubo de plástico con una válvula para controlar el flujo de formalina.
- Insuflar el lóbulo pulmonar con formalina durante 5 min. Desconectar y retirar la aguja junto con el tubo de polietileno de la tráquea mientras tira del hilo de seda para cerrar la tráquea y retener la presión en el pulmón.
- Sumerja el lóbulo pulmonar en formalina y fijar durante 24 horas a 4 ° C.
- Lavar el tejido fijado tres veces durante al menos 20 min con etanol al 70%, y deshidratar a xileno a través de la siguiente régimen (1 hr cada uno):
- 3x 70% de etanol
- 3x 95% de etanol
- 3x 100% de etanol
- 3x xileno
- 1x (líquido) de parafina
- Incrustar el tejido se deshidrataron en parafina, se cortaron en secciones de 4-5 micras, y mancha con hematoxilina y eosina para permitir la evaluación histológica.
Resultados
Desafío a aerosol P. aeruginosa LPS por lo general produce una marcada respuesta inflamatoria en el lumen de las vías respiratorias y el espacio alveolar, que se caracteriza por el predominio de neutrófilos en ambos puntos temporales tempranos y tardíos.
Aerosol LPS induce neutrofilia pulmonar
Ratones C57BL / 6BY y BALB / c fueron expuestas a aerosol P. aeruginosa LPS o vehículo solo y neutrófilos se enumeran en BALF. El número total de células en BALF de ratones C57BL / 6BY expuestos a un aerosol generado con vehículo solamente es típicamente alrededor o por debajo de 200.000 células y las células consisten en 95-100% de células mononucleares, con sólo unos pocos linfocitos (0,5-5%), y no hay neutrófilos en la BALF (Figura 2A-C). Ratones desafiado con aerosol exposición LPS un aumento del número total de células en BALF, típicamente> 500.000 células después de 6 horas. El infiltrado celular sigue siendo alta después de 24 horas. El perfil celular en BALF se desplaza hacia apredominance de neutrófilos (80-95%) después de la exposición LPS (Figura 2B y C).
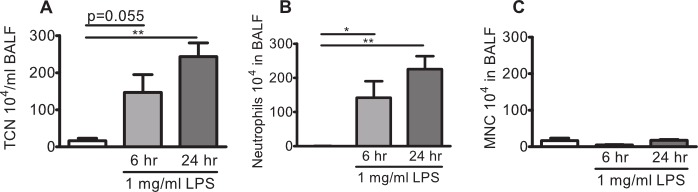
Figura 2:. Neutrofilia pulmonar en ratones C57BL / 6BY desafiados con 1 mg / ml LPS en aerosol ratones C57BL / 6BY se expusieron a 1 mg / ml en aerosol P. aeruginosa LPS o vehículo (solución salina, barra blanca) por sí sola durante 10 min. El lavado broncoalveolar (BAL) se realizó después de 6 horas o 24 horas y los leucocitos se enumeraron en el fluido BAL (BALF). (A) Número total de células neutrófilos (TCN), (B) y (C) células mononucleares (MNC) en BALF. Se analizaron las diferencias significativas mediante pruebas t un-emparejado. n = 3-4, * indica p <0,05, ** indica p <0,01.
Un aumento comparable en las células inflamatorias en BALF se observa en desafiado con LPS ratones BALB / c (Figura 3A ). Además, el porcentaje de neutrófilos y células mononucleares en BALF después de la estimulación LPS es comparable en ratones C57BL / 6 y ratones BALB / c (Figura 3B y C).

Figura 3:. Neutrofilia pulmonar en ratones BALB / c inoculados con 1 mg / ml LPS en aerosol ratones BALB / c fueron expuestas a 1 mg / ml en aerosol P. aeruginosa LPS o vehículo (solución salina, barra blanca) por sí sola durante 10 min. El lavado broncoalveolar (BAL) se realizó después de 6 horas o 24 horas y los leucocitos se enumeraron en el fluido BAL (BALF). (A) Número total de células neutrófilos (TCN), (B) y (C) células mononucleares (MNC) en BALF. Se analizaron las diferencias significativas mediante pruebas t un-emparejado. n = 3, ** indica p <0,01, *** indica p <0,001.
Perfil de células inflamatorias similares una d neutrofilia pulmonar se observa con la nebulización de 5 mg / ml de LPS (Figura 4A-C) y por la administración intranasal de LPS, como se informó anteriormente 12,13.
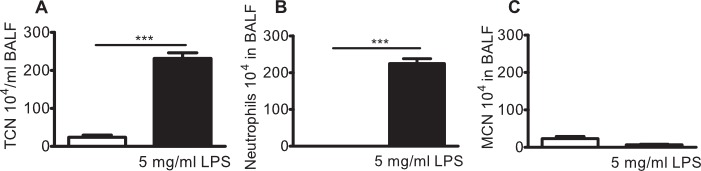
Figura 4:. Neutrofilia pulmonar en ratones BALB / c inoculados con 5 mg / ml de LPS en aerosol ratones BALB / c fueron expuestos a 5 mg / ml en aerosol P. aeruginosa LPS o vehículo (solución salina, barra blanca) por sí sola durante 10 min. El lavado broncoalveolar (BAL) se realizó después de 24 horas y se enumeraron los leucocitos en el líquido BAL (BALF). (A) el número de células total (TCN), (b) los neutrófilos, y (C) las células mononucleares (MNC) en BALF. Se analizaron las diferencias significativas mediante pruebas t un-emparejado. n = 3, *** indica p <0,001.
Localización pulmonar de neutrófilos en desafiados con LPS
ontenido "> Los neutrófilos se observan en la submucosa epitelial, así como los espacios que rodean las vías respiratorias de conducción y los vasos sanguíneos de ratones estimulados con LPS (Figura 5). neutrófilos dispersos también se detectan en el parénquima y la región alveolar.
Figura 5:. Localización pulmonar de neutrófilos en ratones estimulados con LPS hematoxilina y eosina tinción del tejido pulmonar fijado con formalina a partir de (A) ratones C57BL / 6BY expuestas a vehículo solo o (B) 1 mg / ml LPS en aerosol se sacrificó después de 6 h o (C) 24 h. La flecha indica un neutrófilo. Bar indica 200 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Concentración de quimioatrayentes de neutrófilos en BALF
El contenido total de proteína en el BALF de ratones estimulados con LPS se aumentó en comparación con los ratones expuestos a solución salina (Figura 6). Además, la expresión de la quimioatrayentes de neutrófilos quimiocinas (CXC motivo) ligandos (CXCL) 1 y CXCL2 se incrementan en desafiado con LPS los ratones 10 (Figura 7A y B).

Figura 6:. Aumento de la concentración de proteína total en el fluido de lavado broncoalveolar (BALF) de ratones C57BL / 6BY desafiados por LPS contenido de proteína total en BALF de ratones expuestos a 1 mg / ml LPS en aerosol o expuestas al vehículo (solución salina, barra blanca) por sí sola era medido por análisis espectrofotométrico. Se analizaron las diferencias significativas mediante pruebas t un-emparejado. n = 3-4, ** indica p <0,01.

Figura 7: I ncreased expresión de CXCL1 y CXCL2 en el lavado broncoalveolar (BALF) de ratones estimulados por LPS expresión de (A) CXCL1 y (B) CXCL2 en BALF de ratones desafiados a 1 mg / ml de LPS en aerosol o expuesto al vehículo. (solución salina, barra blanca) sola cuantificado por ELISA. Se analizaron las diferencias significativas mediante pruebas t un-emparejado. n = 3.
Discusión
Aerosol LPS genera una respuesta inflamatoria en las vías respiratorias, que se caracteriza por los neutrófilos en la submucosa epitelial, espacios que rodean las vías respiratorias conductoras, así como los espacios alveolares. Esto es, junto con el aumento del contenido de proteína total en BALF, indicativo de pérdida de plasma, representante de la patología de la lesión pulmonar aguda. Como LPS induce una inflamación estéril, la reacción es independiente de la respuesta inmune adaptativa, y hay limitaciones a la relevancia a las infecciones bacterianas. La técnica puede, sin embargo, se utiliza para diseccionar los mecanismos inflamatorios mediante la exclusión de la respuesta inmune adaptativa.
Aunque la metodología es simple y fácilmente adaptado para responder a diferentes cuestiones científicas, la elección del nebulizador y el tubo es crítica. La deposición de LPS y neutrofilia resultante debe ser validado con ensenadas, nebulizadores y tubos distintos de lo que se describe aquí. Además, el ratón como menos común stLas lluvias pueden mostrar diferentes respuestas a LPS, las dosis óptimas de LPS se deben determinar para cada cepa. Además, la inflamación neutrofílica generado con LPS en forma de aerosol es comparable con la inflamación inducida por la administración intranasal de LPS, según lo observado por otros 12, 13. Aunque la administración intranasal se lleva a cabo fácilmente, la metodología requiere anestésicos y potencialmente podría introducir la flora microbiana de la cavidad nasal a los pulmones, como la cavidad nasal no es estéril y la técnica requiere un gran volumen de vehículo.
Además de la importancia de la lesión pulmonar aguda, la técnica puede desarrollarse aún más para incluir múltiples desafíos con LPS en aerosol. La metodología puede así ser usado para estudiar mecanismos patogénicos en la inflamación crónica de la EPOC, que se asocia con la persistencia de neutrofilia 14, junto con las infecciones bacterianas recurrentes o colonización microbiana permanente 15. Por lo tanto, hay una relevancia particular para la inflamación neutrofílica de ratones estimulados con LPS a las infecciones bacterianas asociadas con exacerbaciones de la EPOC, que son fundamentales para la progresión de la enfermedad 16, 17.
Desafío con LPS en aerosol se puede configurar en un pequeño coste con unos aparatos y requiere una formación mínima. Además, la técnica de este modo se puede realizar de forma rutinaria a gran escala en un laboratorio, con poca o ninguna variación entre individuos y es por tanto superior a otras rutas de administración pulmonar.
Divulgaciones
Abraham Roos ha recibido una cuota profesor de Boehringer Ingelheim, becas de viaje de AstraZeneca I + D y una beca de investigación de AstraZeneca I + D. Magnus Nord es un empleado a tiempo completo de AstraZeneca I + D y ha recibido becas de investigación de AstraZeneca I + D. Johan Grunewald y Tove Berg son co-investigadores en un proyecto de investigación relacionado financiado por AstraZeneca I + D.
Agradecimientos
Nos gustaría dar las gracias a Kerstin Thim (AstraZeneca, Lund, Suecia), Benita Dahlberg y el Dr. Anders Eklund (Instituto Karolinska, Estocolmo, Suecia), así como el Dr. Martin Stampfli (Universidad McMaster, Hamilton, ON, Canadá) para la asistencia hábil y el asesoramiento de expertos.
Materiales
| Name | Company | Catalog Number | Comments |
| Name of the material/equipment | Company | Catalog number | Comments/Description |
| Purified Pseudomonas aeruginosa LPS | Sigma-Aldrich | Harmful. Recomended purification. LPS purified from other bactria may be used. | |
| Pari LC sprint star nebulizer | PARI Respiratory Equipment Inc. | 023G1250 | |
| TSI mass flowmeter 4040 | TSI | 4040 | Alternative product from supplier may be used. |
| Saint-Gobain 15.9 mm Tygon tube | Sigma-Aldrich | Z685704 | Recomended brand. |
| Plexiglas boxes with removable lids | Custom built | N/A | 150 x 163 x 205 mm (a 2 mm hole on the side). |
| 3M Half Facepiece Reusable Respirator | 3M | 7503 | Recomended brand. |
| 3M Advanced Particulate Filters (P100) | 3M | 2291 | Recomended brand. |
| Sissors | VWR | 233-1104 | Preferred scissors may be used. |
| Forceps | VWR | 232-1313 | Preferred forceps may be used. |
| Intramedic PE50 polyethylene tube | BD | 427411 | Recomended brand. |
| Ethicon 2-0 Perma-hand silk tread | VWR | 95056-992 | Recomended brand. |
| 26 ½ gage needle | Alternative suppliers exist. | ||
| 1 mL BD slip-tip syringe, non-sterile | BD | 301025 | Alternative suppliers exist. |
| 60 mL BD Luer-Lok syringe, non-sterile, polypropolene | BD | 301035 | Alternative suppliers exist. |
| Fluka Hematoxylin-Eosin | Sigma-Aldrich | 3972 | Alternative suppliers exist. |
| Türk's solution | Merck Millipore | 109277 | |
| Table top centrifuge | Alternative manufacturers exist. | ||
| Cytospin 4 cytocentrifuge | Thermo Scientific | A78300003 | Alternative centrifuge can be used. |
| HEMA-3 stat pack | Fisher Scientific | 23-123-869 | Alternative staining kits exists. |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | Alternative suppliers exist. |
Referencias
- King, J. D., Kocincova, D., Westman, E. L., Lam, J. S. Review: Lipopolysaccharide biosynthesis in Pseudomonas aeruginosa. Innate Immun. 15, 261-312 (2009).
- Grommes, J., Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol Med. 17, 293-307 (2011).
- Pesci, A., et al. Inflammatory cells and mediators in bronchial lavage of patients with chronic obstructive pulmonary disease. Eur Respir J. 12, 380-386 (1998).
- Hoogerwerf, J. J., et al. Lung Inflammation Induced by Lipoteichoic Acid or Lipopolysaccharide in Humans. Am. J. Respir. Crit. Care Med. 178, 34-41 (2008).
- Scheuchenzuber, W. J., Eskew, M. L., Zarkower, A. Comparative humoral responses to Escherichia coli and sheep red blood cell antigens introduced via the respiratory tract. Exp Lung Res. 13, 97-112 (1987).
- Asti, C., et al. Lipopolysaccharide-induced lung injury in mice. I. Concomitant evaluation of inflammatory cells and haemorrhagic lung damage. Pulm Pharmacol Ther. 13, 61-69 (2000).
- Brand, P., et al. Total deposition of therapeutic particles during spontaneous and controlled inhalations. Journal of pharmaceutical sciences. 89, 724-731 (2000).
- Liu, F., Li, W., Pauluhn, J., Trubel, H., Wang, C. Lipopolysaccharide-induced acute lung injury in rats: comparative assessment of intratracheal instillation and aerosol inhalation. Toxicology. 304, 158-166 (2013).
- Skerrett, S. J., et al. Role of the type 1 TNF receptor in lung inflammation after inhalation of endotoxin or Pseudomonas aeruginosa. American Journal of Physiology - Lung Cellular and Molecular Physiology. 276, L715-L727 (1999).
- Roos, A. B., et al. Lung epithelial-C/EBPbeta contributes to LPS-induced inflammation and its suppression by formoterol. Biochem Biophys Res Commun. 423, 134-139 (2012).
- Didon, L., et al. Lung epithelial CCAAT/enhancer-binding protein-beta is necessary for the integrity of inflammatory responses to cigarette smoke. Am J Respir Crit Care Med. 184, 233-242 (2011).
- Silverpil, E., et al. Negative feedback on IL-23 exerted by IL-17A during pulmonary inflammation. Innate Immunity. 19, 479-492 (2013).
- Mercer, P. F., et al. Proteinase-Activated Receptor-1, CCL2 and CCL7 Regulate Acute Neutrophilic Lung Inflammation. American Journal of Respiratory Cell and Molecular Biology. , (2013).
- Korkmaz, B., Horwitz, M. S., Jenne, D. E., Gauthier, F. . Neutrophil Elastase, Proteinase 3, and Cathepsin G as Therapeutic Targets in Human Diseases. Pharmacological Reviews. 62, 726-759 (2010).
- Bafadhel, M., et al. Acute Exacerbations of COPD: Identification of Biological Clusters and Their Biomarkers. Am. J. Respir. Crit. Care Med. , 201104-200597 (2011).
- Hurst, J. R., Perera, W. R., Wilkinson, T. M. A., Donaldson, G. C., Donaldson, G. C., Wedzicha, G. C. Systemic and Upper and Lower Airway Inflammation at Exacerbation of Chronic Obstructive Pulmonary. Am. J. Respir. Crit. Care Med. 173, 71-78 (2006).
- Rabe, K. F., et al. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease: GOLD Executive Summary. Am. J. Respir. Crit. Care Med. 176, 532-555 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados