Method Article
Une méthode pour générer pulmonaire Neutrophilie Utilisation Aerosolized lipopolysaccharide
Dans cet article
Résumé
Nous décrivons une méthode pour induire une inflammation pulmonaire neutrophile par défi pour lipopolysaccharide aérosol par nébulisation, pour modéliser une lésion pulmonaire aiguë. En outre, des techniques chirurgicales de base pour l'isolement du poumon, l'intubation endotrachéale et lavage broncho-alvéolaire sont également décrits.
Résumé
Lésion pulmonaire aiguë (ALI) est une maladie grave caractérisée par neutrophilie alvéolaire, avec des options de traitement limitées et une mortalité élevée. Des modèles expérimentaux de ALI sont clé dans l'amélioration de notre compréhension de la pathogenèse de la maladie. Le lipopolysaccharide (LPS) provenant de bactéries à gram positif induit une inflammation neutrophile dans les voies respiratoires et du parenchyme pulmonaire de la souris. Délivrance pulmonaire efficace des composés tels que le LPS est toutefois difficile à réaliser. Dans l'approche décrite ici, l'administration pulmonaire chez la souris est réalisé par défi pour aérosol Pseudomonas aeruginosa LPS. LPS a été dissous en aérosol par un nébuliseur relié à air comprimé. Les souris ont été exposées à un flux continu d'aérosol de LPS dans une boîte en plexiglas pendant 10 minutes, puis 2 min après le conditionnement aérosol a été abandonnée. L'intubation endotrachéale et lavage broncho-alvéolaire subséquente, suivi par une perfusion de formol a été prochain effectuées, ce qui permet la caractérisation de la p stérileulmonary inflammation. LPS en aérosol génère une inflammation pulmonaire alvéolaire caractérisé par neutrophilie, détecté dans le lavage broncho-alvéolaire et par évaluation histologique. Cette technique peut être mis en place à un faible coût avec quelques appareils, et exige une formation et une expertise minimale. Le système d'exposition peut donc être effectuée systématiquement dans tout laboratoire, avec le potentiel d'améliorer notre compréhension de la pathologie pulmonaire.
Introduction
Le lipopolysaccharide (LPS) est un composant de la paroi cellulaire de bactéries à Gram négatif 1. Défi au LPS est un modèle bien documenté de lésion pulmonaire aiguë, un syndrome caractérisé par une inflammation neutrophile aiguë et un oedème 2. En outre, neutrophilie pulmonaire est également une caractéristique de la maladie pulmonaire obstructive chronique (MPOC) 3, et le défi LPS chez l'homme a été utilisé pour modéliser exacerbations de la MPOC 4. Ainsi, les modèles expérimentaux d'exposition LPS sont des outils pertinents et utiles pour comprendre la pathologie humaine cliniquement.
L'objectif de l'administration pulmonaire de LPS aérosol décrits ici est de générer une réponse inflammatoire neutrophile dans la conduite et les voies respiratoires, sans atteinte systémique. Plusieurs techniques de LPS ont été décrits précédemment. L'injection intra-veineuse de LPS est la voie d'administration la plus couramment utilisée. Bien que cette technique est facilement accessible, til dommages primaires est à l'endothélium, la destruction secondaire de l'épithélium pulmonaire après la migration des neutrophiles dans les poumons. L'administration intra-veineuse provoque également une inflammation systémique deux, ce qui peut compliquer le tableau clinique chez des modèles animaux. L'inflammation systémique est en revanche pas observé avec l'administration intra-trachéale. Cette technique, cependant, est beaucoup de travail et nécessite anesthésiques ainsi que la formation considérable 5, 6. En outre, le dépôt pulmonaire par cette voie d'administration dépend de la respiration 7. Ainsi, le dépôt pulmonaire est affectée par la profondeur de l'anesthésie nécessaires pour l'administration intra trachéale et le dépôt dans les voies aériennes variables peuvent être observées. En revanche, l'administration pulmonaire avec du LPS en aérosol nécessite une formation minimale, et peut facilement être réalisée sur un grand nombre d'animaux avec peu ou pas de variation entre les individus 5, 8.Une étude récente confirme que l'administration par aérosol est supérieure à la voie intra-trachéale à l'égard de dépôt, et que des doses plus pertinentes de LPS induit une inflammation neutrophile 8 avec ce modèle.
Des études antérieures ont démontré que défi pour aérosol Pseudomonas aeruginosa LPS génère une réponse inflammatoire marquée dans la lumière des voies respiratoires et du parenchyme pulmonaire, y compris les espaces alvéolaires 9, 10. L'inflammation est caractérisée par une prédominance de neutrophiles et la présence d'un œdème pulmonaire, et peut ainsi être utilisée pour traiter pathogenèse de la lésion pulmonaire aiguë et obtenir en outre la connaissance des mécanismes qui contribuent à la pathologie de la maladie.
Protocole
Les études chez l'animal ont été approuvés par le comité d'éthique de bien-être animal du Nord de Stockholm. Les procédures expérimentales ont été effectuées en conformité avec la législation suédoise.
1. Génération d'un aérosol LPS
- Dissoudre 0,5 g purifiée P. aeruginosa LPS dans 50 ml de solution saline stérile avec agitation douce et vérifier dissolution. Diluer 1 ml de LPS en solution dans 9 ml de solution saline stérile, à une concentration finale de 1 mg / ml. Protéger de la lumière avec une feuille d'aluminium et conserver à -20 ° C.
- Décongeler LPS solubilisées dans l'obscurité à la température ambiante et bien mélanger immédiatement avant utilisation.
- Dans un ventilé niveau II Biohazard capot, insérer une entrée rouge dans un nébuliseur, et connectez le nébuliseur à l'air ambiant sous pression via la tubulure fournie par le (régime d'examen présentant les dispositifs expérimentaux dans la figure 1) du fabricant.
ATTENTION: l'équipement de protection individuelle approprié, y compris une demi-pièce faciale respirat réutilisableou de filtres à particules, lunettes, gants et vêtements de protection doit être utilisé au cours de l'exposition.

Figure 1:. Présentation schématique des dispositifs expérimentaux utilisés pour générer un aérosol de l'entrée du nébuliseur est relié à une alimentation en air. La sortie du nébuliseur est relié à un premier compteur de débit par l'intermédiaire d'un tube de 15,9 mm et un filtre à air, et l'alimentation en air est ajusté à 5,0 L / m à une pression de 2 kbar. La sortie est à côté connecté à une boîte en plexiglas équipée avec des couvercles amovibles et 5 trous de mm pour éviter l'accumulation de pression.
- Raccorder la sortie du nébuliseur pour un débitmètre de masse par l'intermédiaire d'un filtre à air. Connectez le débitmètre massique à une alimentation électrique.
- Réglez l'alimentation en air à 5 L / min, avec une pression en restant à 1,0-2,0 bar.
- Retirez le débitmètre massique etdébrancher l'alimentation en air.
- Raccorder la sortie du nébuliseur pour un tube de 15,9 mm, ce qui bifurque et se connecte à deux boîtes en plexiglas de dimensions: 150 x 163 x 205 mm, munis de couvercles amovibles. Chaque boîte doit avoir un trou de 5 mm dans le côté opposé de l'entrée, pour éviter l'accumulation de pression.
- Placez jusqu'à 5 souris dans chaque boîte de plexiglas et fermer les couvercles.
- Ouvrir le nébuliseur et remplir l'insert avec au moins 4 ml de LPS en solution dans du sérum physiologique stérile ou le véhicule seul (solution saline stérile, le volume ne doit pas dépasser 8 ml). Re-connecter l'entrée de l'alimentation en air.
- Laisser l'aérosol se écouler dans les boîtes en plexiglas fermées pendant 10 min. Surveiller en continu les animaux. Assurez-vous que l'alimentation en air reste solidement attaché à l'entrée du nébuliseur.
- Débranchez l'alimentation en air. Avec les couvercles fermés, laisser les animaux restent dans les boîtes en plexiglas pendant 2 min.
- Ouvrez les couvercles et permettre l'aérosol de se disperser, et de renvoyer les animaux à tes cages. Si les animaux semblent humide, placer les cages sur un coussin chauffant à basse température, pour éviter l'hypothermie.
- Surveiller les animaux en continu pendant les 30 premières minutes, et ensuite tous les 2 h pour le 6 premières heures. Les animaux doivent présenter motif respiratoire normale et l'activité pendant et après la procédure de nébulisation.
2. lavage broncho-alvéolaire (LBA)
- Au point de fin expérimentale, profondément anesthésier les animaux avec de l'isoflurane à effet tel que recommandé par le personnel vétérinaire de votre institution. Pincez la patte arrière pour vérifier un réflexe de retrait pour assurer une profondeur suffisante de l'anesthésie pour mener une intervention chirurgicale majeure. Arroser la fourrure des animaux avec 70% d'éthanol.
- Ouvrez l'abdomen avec des ciseaux, et de rompre l'aorte pour être exsangue l'animal. Placez un morceau de tissu sur l'abdomen pour absorber le sang.
- Follwing l'euthanasie, utiliser une seule coupe des ciseaux antéro-postérieur àexposer le thorax. Soulevez la cage thoracique par l'extrémité antérieure du sternum et utiliser les ciseaux pour percer la membrane au point ventrale plus, sans couper dans toute lobe pulmonaire. Ouvrez la cage thoracique en faisant deux entailles dans le sens antéro-postérieur (réunion en dessous de la mâchoire).
- Tirez doucement en dehors de la cage thoracique en utilisant une pince, et couper la trachée sous le larynx.
- Soulevez la trachée avec la pince et retirer les poumons en coupant les ligaments reliant les lobes de la cavité thoracique, et en tirant doucement par le tissu adipeux et cardiaque.
- Insérez un tube de polyéthylène (diamètre intérieur: 0,58 mm; diamètre extérieur: 0,965 mm) dans la trachée et fixer le tube avec une chaîne de fil de soie.
- Nouez le multilobe (les quatre lobes du poumon droit) avec du fil de soie.
- Insérer une aiguille de calibre 23 dans le tube de polyéthylène et injecter lentement 250 ul de glacé PBS stérile dans le lobe unique avec une seringue de 1 ml.
- Enfoncer délicatement les poumons30 heures et recueillir le liquide à travers la seringue. Répéter la procédure avec 200 ul de PBS (environ 300 ul de PBS doit être récupéré à partir du lobe unique à partir du volume injecté de total de 450 ul).
- Gardez le liquide de lavage broncho-alvéolaire (BALF) sur la glace, ou énumérer les cellules BAL immédiatement. Compter les cellules avec un heamocytometer, en utilisant une solution Turk pour colorer les cellules 11. Calculer le nombre total de cellules en multipliant le nombre de cellules avec le facteur de dilution de la solution de coloration et le volume dans le domaine de la heamocytometer compté.
- Préparer numérations cellulaires différentielles à partir de cellules cytocentrifuged comme décrit par ailleurs 11.
3. La fixation au formol des tissus pulmonaires pour l'évaluation histologique
- Retirez le multilobe et enclenchez-gel sur glace sèche. Stocker à -80 ° C.
- Monter une seringue de 60 ml avec le piston retiré sur un stand de support métallique. Remplir la seringue avec 10% de formol àla hauteur de 20 cm au-dessus du banc de laboratoire, soit 20 cm de pression constante.
- Connecter l'aiguille de calibre 23 fixée à la trachée de la seringue de 60 ml par l'intermédiaire d'un tube en plastique avec une vanne pour commander l'écoulement de la formaline.
- Insuffler le lobe du poumon avec de la formaline pendant 5 min. Déconnecter l'aiguille et la retirer avec le tube de polyéthylène à partir de la trachée tout en tirant sur le fil de soie pour fermer la trachée et de conserver la pression dans le poumon.
- Immerger le lobe du poumon dans le formol et fixer pendant 24 heures à 4 ° C.
- Laver le tissu fixé à trois reprises pendant au moins 20 min avec 70% d'éthanol, et déshydrater au xylène par le schéma suivant (1 h chacun):
- 3x éthanol à 70%
- 3x éthanol à 95%
- 3x éthanol à 100%
- 3x xylène
- 1x (liquide) de paraffine
- Incluez tissus déshydratés dans de la paraffine, coupés en sections 4-5 pm, et les taches avec de l'hématoxyline et de l'éosine pour permettre une évaluation histologique.
Résultats
Défi d'aérosol P. aeruginosa LPS donne généralement une réponse inflammatoire marqué dans la lumière des voies aériennes et de l'espace alvéolaire, caractérisé par une prédominance de neutrophiles aux deux points de temps précoces et tardifs.
Aérosol LPS induit neutrophilie pulmonaire
Souris C57BL / 6BY et BALB / c ont été exposées à des aérosols P. aeruginosa LPS ou du véhicule et les neutrophiles ont été dénombrées dans BALF. Le nombre total de cellules dans BALF de souris C57BL / à 6BY exposées à un aérosol généré avec le véhicule seul est typiquement de l'ordre ou inférieur à 200 000 cellules et les cellules se composent de cellules mononucléaires de 95 à 100%, avec seulement quelques lymphocytes (0,5-5%), et aucun neutrophiles dans le BALF (Figure 2A-C). Souris contesté avec aérosol exposition LPS un nombre total de cellules augmenté dans BALF, typiquement> 500 000 cellules après 6 h. Le infiltrats de cellules reste élevé après 24 h. Le profil cellulaire dans BALF est décalé vers apredominance de neutrophiles (80-95%) après une exposition de LPS (figure 2B et C).
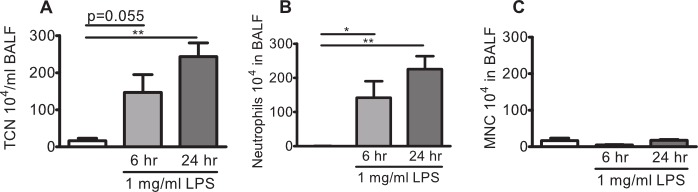
Figure 2:. Neutrophilie pulmonaire chez la souris C57BL / 6BY / souris provoquées avec 6BY 1 mg / ml de LPS en aérosol de souris C57BL ont été exposés à 1 mg / ml en aérosol P. aeruginosa LPS ou le véhicule (solution saline, barre blanche) seul pendant 10 min. Lavage broncho-alvéolaire (LBA) a été réalisée après 6 h ou 24 h et les leucocytes ont été dénombrés dans le BAL fluide (BALF). (A) Total du nombre de cellules (TCN), (B) les neutrophiles, et (C) des cellules mononucléaires (MNC) dans BALF. Des différences significatives ont été analysées à l'aide de tests t-ONU jumelé. n = 3-4, * indique p <0,05, ** indique p <0,01.
Une augmentation comparable dans les cellules inflammatoires dans BALF est observée chez les souris BALB / c par LPS contestée (figure 3A ). En outre, le pourcentage des polynucléaires neutrophiles et des cellules mononucléaires dans BALF après LPS est comparable chez les souris C57BL / 6 et des souris BALB / c (figure 3B et C).

Figure 3:. Neutrophilie pulmonaire à souris BALB / c provoqués avec 1 mg / ml de LPS en aérosol souris BALB / c ont été exposées à 1 mg / ml en aérosol P. aeruginosa LPS ou le véhicule (solution saline, barre blanche) seul pendant 10 min. Lavage broncho-alvéolaire (LBA) a été réalisée après 6 h ou 24 h et les leucocytes ont été dénombrés dans le BAL fluide (BALF). (A) Total du nombre de cellules (TCN), (B) les neutrophiles, et (C) des cellules mononucléaires (MNC) dans BALF. Des différences significatives ont été analysées à l'aide de tests t-ONU jumelé. n = 3, ** indique p <0,01, *** indique p <0,001.
Similaire profil inflammatoire cellulaire un d neutrophilie pulmonaire est observée avec la nébulisation de 5 mg / ml de LPS (figure 4A-C) et par administration intranasale de LPS, comme indiqué précédemment 12,13.
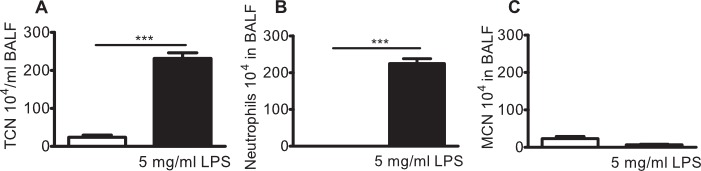
Figure 4:. Neutrophilie pulmonaire à souris BALB / c provoquées avec 5 mg / ml de LPS en aérosol souris BALB / c ont été exposées à 5 mg / ml en aérosol P. aeruginosa LPS ou le véhicule (solution saline, barre blanche) seul pendant 10 min. Lavage broncho-alvéolaire (LBA) a été réalisée après 24 heures et les leucocytes ont été dénombrés dans le BAL fluide (BALF). (A) nombre total de cellules (TCN), (B) les neutrophiles, et (C) des cellules mononucléaires (MNC) dans BALF. Des différences significatives ont été analysées à l'aide de tests t-ONU jumelé. n = 3, *** indique p <0,001.
Localisation pulmonaire de neutrophiles en LPS contesté
ontenu "> Les neutrophiles sont observés dans la sous-muqueuse épithéliale, ainsi que des espaces entourant les voies aériennes de conduction et les vaisseaux sanguins de souris LPS-contestées (figure 5). neutrophiles dispersées sont également détectés dans le parenchyme et la région alvéolaire.
Figure 5:. Localisation pulmonaire des neutrophiles chez la souris LPS contestées hématoxyline et éosine de tissu pulmonaire fixés au formol à partir de (A) Des souris C57BL / souris 6BY exposés au véhicule seul ou (B) 1 mg / LPS en aérosol ml sacrifiés après 6 h ou (C) de 24 h. La flèche indique un neutrophiles. Bar indique 200 um. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Concentration de chimioattractifs de neutrophiles dans BALF
La teneur totale en protéines dans le BALF de souris LPS-contestées est augmentée par rapport à des souris exposées à une solution saline (figure 6). En outre, l'expression de la chimiokine chimiotactiques des polynucléaires neutrophiles (motif CXC) ligands (CXCL) et une CXCL2 sont augmentées chez les souris contestée LPS 10 (Figure 7A et B).

Figure 6:. Augmentation de la concentration de protéines totales dans liquide de lavage bronchoalvéolaire (BALF) de souris C57BL / 6BY LPS-contestées teneur en protéines totale dans BALF de souris contestées à 1 mg / ml LPS aérosol ou exposés à véhicule (solution saline, barre blanche) était seul mesuré par analyse spectrophotométrique. Des différences significatives ont été analysées à l'aide de tests t-ONU jumelé. n = 3-4, ** indique p <0,01.

Figure 7: Je ncreased expression de CXCL1 et CXCL2 en liquide de lavage bronchoalvéolaire (BALF) de souris LPS-contestées expression de (A) CXCL1 et (B) CXCL2 dans BALF de souris au défi de 1 mg / ml LPS aérosol ou exposés au véhicule. (solution saline, barre blanche) seul quantifiée par ELISA. Des différences significatives ont été analysées à l'aide de tests t-ONU jumelé. n = 3.
Discussion
LPS en aérosol génère une réponse inflammatoire dans les voies respiratoires, caractérisé par des neutrophiles dans la muqueuse epitheliale, les espaces entourant les voies respiratoires conductrices, ainsi que les espaces alvéolaires. Ce est, avec la teneur en protéines totales ont augmenté dans BALF, indicatif de fuite plasmatique, représentant de la pathologie de la lésion pulmonaire aiguë. Comme LPS induit une inflammation stérile, la réaction est indépendante de la réponse immunitaire adaptative, et il existe des limites à la pertinence d'infections bactériennes. La technique peut cependant être utilisé pour disséquer les mécanismes inflammatoires en excluant les réponses immunitaires adaptatives.
Bien que la méthode est simple et facilement adaptable pour répondre à diverses questions scientifiques, le choix du nébuliseur et le tube est critique. Le dépôt de LPS et neutrophilie résultant doit être validée avec des entrées, nébuliseurs et les tubes autres que ce qui est décrit ici. En outre, la souris comme moins commune stpluies peut afficher des réponses différentes à LPS, les doses optimales de LPS doivent être déterminées pour chaque souche. En outre, l'inflammation neutrophile aérosol généré par le LPS est comparable à l'inflammation induite par l'administration intranasale de LPS, tel qu'observé par d'autres 12, 13. Bien que l'administration intranasale est réalisé facilement, la méthode nécessite anesthésiques et pourrait introduire la flore microbienne de la cavité nasale dans les poumons, comme la cavité nasale ne est pas stérile et la technique nécessite un grand volume de véhicule.
En plus de la pertinence d'une lésion pulmonaire aiguë, la technique peut être développée pour inclure plusieurs défis avec LPS aérosol. La méthode peut ainsi être utilisée pour étudier les mécanismes pathogènes dans l'inflammation chronique de la COPD, qui est associée à la persistance de neutrophilie 14, ainsi que les infections bactériennes récurrentes ou la colonisation microbienne permanent 15. Ainsi, il ya un intérêt particulier pour l'inflammation neutrophile de souris LPS-contestées aux infections bactériennes associées aux exacerbations de la MPOC, qui sont au cœur de la progression de la maladie 16, 17.
Challenge LPS aérosol peut être mis en place à un faible coût avec quelques appareils et nécessite une formation minimale. En outre, la technique peut donc être effectuée en routine à grande échelle, à ne importe quel laboratoire, avec peu ou pas de variation entre les individus et ne est donc supérieure à d'autres voies d'administration par voie pulmonaire.
Déclarations de divulgation
Abraham Roos a reçu des honoraires de conférencier de Boehringer Ingelheim, bourses de voyage d'AstraZeneca R & D et une subvention d'AstraZeneca R & D recherche. Magnus Nord est un employé à temps plein d'AstraZeneca R & D et a reçu des subventions de recherche d'AstraZeneca R & D. Johan Grunewald et Tove Berg sont co-chercheurs sur un projet de recherche indépendant financé par AstraZeneca R & D.
Remerciements
Nous tenons à remercier Kerstin Thim (AstraZeneca, Lund, Suède), Benita Dahlberg et le Dr Anders Eklund (Karolinska Institutet, Stockholm, Suède) ainsi que le Dr Martin Stampfli (Université McMaster, Hamilton, ON, Canada) à l'aide habile et des conseils d'experts.
matériels
| Name | Company | Catalog Number | Comments |
| Purified Pseudomonas aeruginosa LPS | Sigma-Aldrich | Harmful. Recomended purification. LPS purified from other bactria may be used. | |
| Pari LC sprint star nebulizer | PARI Respiratory Equipment Inc. | 023G1250 | |
| TSI mass flowmeter 4040 | TSI | 4040 | Alternative product from supplier may be used. |
| Saint-Gobain 15.9 mm Tygon tube | Sigma-Aldrich | Z685704 | Recomended brand. |
| Plexiglas boxes with removable lids | Custom built | N/A | 150 x 163 x 205 mm (a 2 mm hole on the side). |
| 3M Half Facepiece Reusable Respirator | 3M | 7503 | Recomended brand. |
| 3M Advanced Particulate Filters (P100) | 3M | 2291 | Recomended brand. |
| Scissors | VWR | 233-1104 | Preferred scissors may be used. |
| Forceps | VWR | 232-1313 | Preferred forceps may be used. |
| Intramedic PE50 polyethylene tube | BD | 427411 | Recomended brand. |
| Ethicon 2-0 Perma-hand silk tread | VWR | 95056-992 | Recomended brand. |
| 26 ½ gage needle | Alternative suppliers exist. | ||
| 1 ml BD slip-tip syringe, non-sterile |  BD BD | 301205 | Alternative suppliers exist. |
| 60 ml BD Luer-Lok syringe, non-sterile, polypropolene | BD | 301035 | Alternative suppliers exist. |
| Fluka Hematoxylin-Eosin | Sigma-Aldrich | 3972 | Alternative suppliers exist. |
| Türk's solution | Merck Millipore | 109277 | |
| Table top centrifuge | Alternative manufacturers exist. | ||
| Cytospin 4 cytocentrifuge | Thermo Scientific | A78300003 | Alternative centrifuge can be used. |
| HEMA-3 stat pack | Fisher Scientific | 23-123-869 | Alternative staining kits exists. |
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | Alternative suppliers exist. |
Références
- King, J. D., Kocincova, D., Westman, E. L., Lam, J. S. Review: Lipopolysaccharide biosynthesis in Pseudomonas aeruginosa. Innate Immun. 15, 261-312 (2009).
- Grommes, J., Soehnlein, O. Contribution of neutrophils to acute lung injury. Mol Med. 17, 293-307 (2011).
- Pesci, A., et al. Inflammatory cells and mediators in bronchial lavage of patients with chronic obstructive pulmonary disease. Eur Respir J. 12, 380-386 (1998).
- Hoogerwerf, J. J., et al. Lung Inflammation Induced by Lipoteichoic Acid or Lipopolysaccharide in Humans. Am. J. Respir. Crit. Care Med. 178, 34-41 (2008).
- Scheuchenzuber, W. J., Eskew, M. L., Zarkower, A. Comparative humoral responses to Escherichia coli and sheep red blood cell antigens introduced via the respiratory tract. Exp Lung Res. 13, 97-112 (1987).
- Asti, C., et al. Lipopolysaccharide-induced lung injury in mice. I. Concomitant evaluation of inflammatory cells and haemorrhagic lung damage. Pulm Pharmacol Ther. 13, 61-69 (2000).
- Brand, P., et al. Total deposition of therapeutic particles during spontaneous and controlled inhalations. Journal of pharmaceutical sciences. 89, 724-731 (2000).
- Liu, F., Li, W., Pauluhn, J., Trubel, H., Wang, C. Lipopolysaccharide-induced acute lung injury in rats: comparative assessment of intratracheal instillation and aerosol inhalation. Toxicology. 304, 158-166 (2013).
- Skerrett, S. J., et al. Role of the type 1 TNF receptor in lung inflammation after inhalation of endotoxin or Pseudomonas aeruginosa. American Journal of Physiology - Lung Cellular and Molecular Physiology. 276, L715-L727 (1999).
- Roos, A. B., et al. Lung epithelial-C/EBPbeta contributes to LPS-induced inflammation and its suppression by formoterol. Biochem Biophys Res Commun. 423, 134-139 (2012).
- Didon, L., et al. Lung epithelial CCAAT/enhancer-binding protein-beta is necessary for the integrity of inflammatory responses to cigarette smoke. Am J Respir Crit Care Med. 184, 233-242 (2011).
- Silverpil, E., et al. Negative feedback on IL-23 exerted by IL-17A during pulmonary inflammation. Innate Immunity. 19, 479-492 (2013).
- Mercer, P. F., et al. Proteinase-Activated Receptor-1, CCL2 and CCL7 Regulate Acute Neutrophilic Lung Inflammation. American Journal of Respiratory Cell and Molecular Biology. , (2013).
- Korkmaz, B., Horwitz, M. S., Jenne, D. E., Gauthier, F. Neutrophil Elastase, Proteinase 3, and Cathepsin G as Therapeutic Targets in Human Diseases. Pharmacological Reviews. 62, 726-759 (2010).
- Bafadhel, M., et al. Acute Exacerbations of COPD: Identification of Biological Clusters and Their Biomarkers. Am. J. Respir. Crit. Care Med. , 201104-200597 (2011).
- Hurst, J. R., Perera, W. R., Wilkinson, T. M. A., Donaldson, G. C., Donaldson, G. C., Wedzicha, G. C. Systemic and Upper and Lower Airway Inflammation at Exacerbation of Chronic Obstructive Pulmonary. Am. J. Respir. Crit. Care Med. 173, 71-78 (2006).
- Rabe, K. F., et al. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease: GOLD Executive Summary. Am. J. Respir. Crit. Care Med. 176, 532-555 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon