Method Article
Сплит-и-бассейн Синтез и свойства пептида третичный амид библиотеки
В этой статье
Резюме
Пептидные третичные амиды (ПТС) представляют собой надсемейство пептидомиметиков, которые включают, но не ограничиваются ими пептидами, пептоиды и N-метилированных пептидов. Здесь мы опишем синтетический метод, который сочетает в себе как сплит-и-бассейн и стратегии суб-мономера для синтеза одной шарик один-соединение библиотеку ПТС.
Аннотация
Пептидомиметики большие источники белка лигандов. Олигомерный природа этих соединений позволяет получить доступ к большой синтетические библиотеки на твердой фазе с использованием комбинаторной химии. Одним из наиболее хорошо изученных классов пептидомиметиков является пептоиды. Пептоиды легко синтезировать и было показано, что протеолиз устойчивых клеток и проницаемого. За последние десять лет, многие полезные белковые лиганды были определены через скрининга пептоидной библиотек. Тем не менее, большинство из лигандов, определенными по пептоидной библиотек не отображаются высокое сродство, за редким исключением. Это может быть обусловлено, в частности, с отсутствием хиральных центров и конформационных ограничений в пептоидной молекул. В последнее время мы описали новый путь синтеза для доступа пептидные третичные амиды (ПТС). ПТС представляют собой суперсемейство пептидомиметиков, которые включают, но не ограничиваются ими пептидами, пептоиды и N-метилированных пептидов. С боковых цепей на обоих α-углерода и основных атомов азота цепь,конформация этих молекул значительно сдерживается стерических препятствий и аллильном 1,3 деформации. (Рис. 1) Наше исследование показывает, что эти молекулы PTA которые хорошо структурированы в растворе и может быть использован для идентификации белковых лигандов. Мы считаем, что эти молекулы могут быть будущий источник высоким сродством белковых лигандов. Здесь мы опишем метод синтеза сочетающего в себе мощь как сплит-и-бассейном и стратегий суб-мономера для синтеза образец один-шарик один-соединение (OBOC) библиотеки ПТС.
Введение
Пептидомиметики являются соединения, которые имитируют структуру природных пептидов. Они предназначены, чтобы сохранить биологическую активность, преодолевая некоторые из проблем, связанных с природными пептидами, в том числе проницаемости клеток и устойчивости к протеолизу 1-3. В связи с олигомерной природы этих соединений, большие синтетические библиотеки могут быть легко доступны через мономерных или суб-путей синтеза мономерных 4-7. Одним из наиболее изученных классов пептидомиметиков является Пептоиды. Пептоиды являются олигомеры N-алкилированных глицинов, которые могут быть синтезированы легко использует стратегию, суб-мономера 8, 9. Много полезных белковых лигандов были успешно идентифицированы из скрининга больших синтетических пептоидной библиотеки против белковых мишеней 1, 10-14. Тем не менее, "хиты", выявленные с пептоидной библиотек редко архив очень высокое сродство к белковым мишеням 1,10-14,22. Один маДжор разница между пептоиды и природных пептидов в том, что большинство пептоиды правило, не имеют способность образовывать вторичную структуру из-за отсутствия хиральных центров и конформационных ограничений. Для того, чтобы решить эту проблему, несколько стратегий были разработаны в течение последнего десятилетия, в значительной степени ориентируясь на модификации боковых цепей, содержащихся на основных атомов цепи азота 15-22. В последнее время мы разработали новый синтетический путь, чтобы представить природные боковые цепи аминокислот на пептоидной позвоночника создать пептидных третичные амиды 23.
Пептидные третичные амиды (ПТС) являются супер семья пептидомиметиков, которые включают, но не ограничиваются ими пептидов (R 2 = H), пептоиды (R 1 = H) и N-метилированных пептидов (R 1 ≠ H, R 2 = Me) . (См. рисунок 1) Наша синтетический путь нанимает природных аминокислот в качестве источника хиральности и боковых цепей на45;-углерод, и коммерчески доступные первичные амины, чтобы обеспечить N-замещения. Таким образом, большая химическая пространство, чем у простых пептидов, пептоиды или N-метилированных пептидов могут быть изучены. Спектры кругового дихроизма показали, что молекулы ПТА высоко структурированы в растворе. Характеристика одного из PTA-белковых комплексов четко показывает, что конформационные ограничения PTA требуются для связывания. В последнее время мы также обнаружили, что некоторые молекулы ПТА обладают улучшенной проницаемости клеток, чем их пептоидной и пептидных аналогов. Мы считаем, что эти ПТА библиотеки могут быть хорошим источником высоким сродством лигандов для белками-мишенями. В этой статье мы обсудим синтез образца один шарик один-соединение (OBOC) ПТА библиотеки в деталях, а также некоторые улучшения условий для муфт и расщепления этих соединений.
протокол
1. Основы Сплит-и-бассейн синтеза
Для того чтобы эффективно генерировать большое количество соединений на твердой фазе, синтез сплит-и-бассейн часто используется в качестве общей стратегии. Как показано на рисунке 4, TentaGel шарики сначала раскол на три части. Каждая часть взаимодействует с другом реагента, генерации первого остатка на бусины. После первой реакции, все три порции объедин ют вместе, смешивают, а затем снова разделить на три части. Каждая часть будет снова реагируют с другом реагента, генерации второго остатка на бусины. После двух этапов сплит-и бассейн, девять соединения генерируются.
В синтезе суб-мономера, гранулы сначала делят на несколько частей в реакцию с различными бром кислот в присутствии конденсирующего реагента. После промывки растворителем, все шарики будут объединены вместе и смешивают, а затем снова разделить на несколько частей в реакцию с разнымипервичные амины. После аминирования, все шарики объединены вместе и тщательно промывают, завершив полный мономера на каждом борту. Этот процесс может быть повторен до достижения желаемого разнообразие.
2. Подготовка бромангидрид от природных аминокислот
В синтезе суб-мономера, синтез каждого мономера делится на два отдельных этапа: 1. Взаимодействие бромангидрид и 2 аминирования с первичных аминов (рис. 2).. Для синтеза пептидной третичного амида, бромиды хиральной кислотой с боковых цепей на альфа-углерод будет получен из природных аминокислот. Здесь мы описываем способ трансформации природной аминокислоты в соответствующий бромид кислоты с высокой точностью стерео. Мы используем аланин в качестве примера; другие аминокислоты, включая серин, треонин, аспарагиновую кислоту, глутаминовую кислоту, аспарагин, глутамин, глицин, валин, изолейцин, фенилаланин также могут быть преобразованы в бром кислот под аналогичным кондинс. Обратите внимание, что некоторые из аминокислот с функциональными группами, такие как фенол, гуанидина и амина, должны быть защищены перед преобразованием. Установка реакции показана на рисунке 3.
Меры предосторожности: Для следующие реакции с участием HBr, Nano 2 и других агрессивных / токсичных химических веществ, надлежащее оборудование для обеспечения безопасности, как защитные очки, халате и химически устойчивые защитные перчатки необходимы. Все реакции должны быть выполнены в вытяжном шкафу опытным химиком.
- Добавить 370 мл воды в 630 мл 48%-ного раствора HBr с получением 1 л, 30%-ный раствор HBr. Добавить 500 мл этиленгликоля в 1 л ванны контейнера; добавить сухой лед, чтобы поддерживать температуру при -10 ° С. Внимание: 48%-ный раствор HBr сильно кислой и коррозию, соблюдайте осторожность. Прочитайте паспорт безопасности перед использованием.
- Добавить D-Аланин (8,9 г, 0,1 моль) и KBr (11,9 г, 0,1 моль) в 250 мл трехгорлую круглодонную колбу с магнитной мешалкой. Добавить 100 мл и 30% HBr, полученного в тон предыдущий шаг. Поместите колбу в баню гликоля этилена, полученного на стадии 2.1, и поддерживать температуру при -10 ° С. Bubble аргон через длинной иглой из нижней части колбы в течение 10 мин, как показано на рисунке 3. Раствор перемешивают с помощью магнитной мешалки при 300 оборотах в минуту.
- Растворить NaNO 2 (8,28 г, 0,12 моль) в 100 мл химическом стакане с 20 мл воды. Добавить раствор в уравновешивающей давление капельной воронкой и герметизации капельную воронку с перегородкой. Медленно поверните на клапане капельную воронку и пусть решение NaNO 2 падение в колбу. Управление клапаном для регулирования скорости капель примерно 2 капли в секунду. Продолжайте перемешивание при 300 оборотах в минуту и поддерживать аргон восходящей со дна колбы. Колбу следует иметь в этиленгликоле бане при -10 ° С, пока все NaNO 2 не добавляется. Внимание: Этот шаг генерирует тепло и газ во время добавления NaNO 2 решения. Капель ставка должна быть тщательно конконтролируемых и вся система должна быть открыта через выход аргона.
- Продолжайте размешивать в течение еще 3 часа, и пусть температура согреться от -10 ° С до комнатной температуры. Полученный раствор должно быть ясно, светло-желтый; если цвет слишком темный, применить вакуум, чтобы удалить лишние оксидов азота и возможное Br 2, образующейся в процессе реакции.
- Извлечение продукта из раствора с 3-кратным 35 мл диэтилового эфира с использованием экстрагента воронку. Комбинат органической фазы и промойте его насыщенным раствором соли. Органическую фазу можно также промывают небольшим количеством NaHCO 3 до промывания солевым раствором, чтобы удалить цвет, если это темно. Органическую фазу сушат над Na 2 SO 4 в течение 6 часов.
- Отфильтровать Na 2 SO 4 и выпаривают растворитель в вакууме, сырой продукт должны быть получены ясно до бледно-желтого масла. Сырой продукт может быть дополнительно очищен путем перегонки при 115 ° С, 3 мм рт.ст., иликолонка с силикагелем смесью 3:1 гексан: этилацетат.
- Чистый продукт получают в виде прозрачного масла, 6,6 г (выход 74%), плотность = 1,69 г / мл, [α] D 20 = +24 ° (метанол), 1 H ЯМР (400 МГц, CDCl 3) δ 4,41 (д, J = 7,0 Гц, 1H), 1,86 (д, J = 7,0 Гц, 3H). В случае (S)-2-бромпропановой кислоты-D 4 (полученного из D 4-L-аланин), чистый продукт получают в виде прозрачного масла, выход 78%, плотность = 1,72 г / мл, [α] D 20 = -19 ° (метанол). 1 H-ЯМР, никакого существенного сигнал H не наблюдается. ESI-MS - [M-1] - = 155,1 (ожидается 154,97). Для (S)-2-бром-4-метилпентановой кислоты (полученного из L-лейцина с использованием той же процедуры) чистый продукт получают в виде прозрачного масла, выход 89%, [α] D 20 = +37 ° (метанол), 1Н ЯМР (400 МГц, CDCl 3) δ 4,30 (т, J = 7,7 Гц, 1H), 1,94 (дд, J = 10,8, 3,9 Гц, 2H), 1,81 (тт, J = 13,2, 6,5 Гц, 1H), 0,96 (дд, J = 18,2, 6,6 Гц, 7Н). В случае (S)-2-бром-3-Phenylpropanoic кислоты (полученного из L-фенилаланина с использованием той же процедуры) чистый продукт получают в виде бледно-желтого масла, выход 72%, [α] D 20 = +17 ° (метанол), 1 H ЯМР (400 МГц, CDCl 3) δ 7,38 - 7,19 (м, 5Н), 4,42 (дд, J = 8,1, 7,3 Гц, 1H), 3,47 (дд, J = 14,2, 8,2 Гц, 1H), 3,25 (дд, J = 14,2, 7,2 Гц, 1H).
3. Изотопный Маркировка аланин Использование трансаминаз
В комбинаторной библиотеки синтеза, особенно в синтезе сплит-и-пула одного борта одного соединения (OBOC) библиотек, количество соединения, которое может быть получено из каждого шарика относительно мала. (Обычно от 1 до 10 пмоль нмоль). Кроме того, масс-спектрометрия широко используется для идентификации и характеризации конечного соединения в связи с его высокой чувствительности. Для того чтобы использовать масс-спектрометрии для определения абсолютной стереохимии при хиральных центрах конечных продуктов PTA, энантиомеры бром кислоты должно быть Исотоpically помечены перед использованием. Здесь мы опишем метод использования трансаминазу и D 2 O, чтобы этикетки L-аланин.
- Растворить L-аланина (300 мг, 3,36 ммоль) с 10 мл D 2 O в 50 мл полиэтиленовую трубку. Добавить α-кетоглутарата (10 мг, 0,068 ммоль) в качестве со-подложке. Разминка трубку до 37 ° С и отрегулируйте PD в 8,5-8,7 использованием soution 1 М NaOD. Примечание: PD определяется тест-полосок рН. Традиционный метр электро рН оснащен стеклянным электродом селективного для H + может дать неправильный зачитал для D +.
- Добавить аланин трансаминазы (0,1 мг, ЕС 2.6.1.2 от сердца свиньи, Roche Diagnostics, Индианаполис) ПФ 8,5 - 8,7, 37 ° С раствор, приготовленный из предыдущего шага. Положите трубку в 37 ° С инкубатор и инкубировать его на ночь с легким встряхиванием, предпочтительнее от 10 до 30 мин.
- После инкубации в течение ночи, взять 0,5 мл раствора D 2 O и проверить ход реакции с помощью 1 Н-ЯМР. Все протонные сигналыlanine, δ 3,76 (д, J = 7,2 Гц, 1H), 1,46 (д, J = 7,3 Гц, 3Н), 1 H ЯМР 400 МГц, должны быть существенно подавлена в результате дейтерировании. Более 98% протона должен быть заменен на дейтерий, как описано выше 23. Примечание: D 2 O может быть частично восстановлена путем перегонки если реакцию проводят в больших масштабах (> 200 мл D 2 O). Как правило, от 60% до 80% D 2 O может быть дистиллированной из раствора.
- Замораживание вышеуказанного раствора с жидким азотом и лиофилизации его с помощью лиофилизатора, чтобы получить белый дейтерированного L-аланин порошок.
4. Синтез пептоидной компоновщика области
Область линкер не требуется для синтеза библиотеки PTA. Однако для того, чтобы избежать высокий фон в нижнем диапазоне молекулярных веса (100-600) от MALDI масс-спектроскопии и улучшить ионизацию соединений, пептоидной линкер с несколькими полярных остатков часто используется. Это пептоидной линкег могут быть синтезированы с помощью стандартных пептоидной процедуры синтеза. Здесь мы будем синтезировать пентамера из N-метоксиэтил глицина в качестве линкера (как показано на рисунке 5).
- Выпуклость 90 мкм шарики TentaGel с ОЗУ линкер (1 г, 0,27 ммоль / г) в 10 мл ДМФ в течение 3 ч в 12 мл шприц реакторе с мягким встряхивании.
- Слить DMF из реактора и добавляют 10 мл 20% раствора пиперидина DMF для снятия защиты с Fmoc группу из амидный линкер Rink. Встряхнуть бусы с 20%-ным раствором пиперидина в течение 30 мин. Промыть DMF 5x, чтобы удалить все пиперидина.
- Потратьте несколько бусы из шприца и проверить его с помощью теста хлоранил. Бусы должны становится темно-коричневой (тест хлоранил положительным для первичного амина), если Fmoc успешно снимают.
- Подготовьте следующие решения: 1. 20 мл, 2 М бромуксусная раствора кислоты / DMF; 2 20 мл, 2 М раствор DIC / DMF.; 3. 10 мл, 1 М methoxylethylamine / решение DMF.
- Добавить 5 мл 2 М бромуксусную решения кислота / DMF кшарики, слегка встряхнуть. Затем добавляют 5 мл 2 М DIC / ДМФ решения шариков; запечатать шприц с поршнем и положил его на шейкере. Встряхнуть в течение 10 мин.
- Вымойте бисером с DMF тщательно. Добавить 2 мл 1 М раствора метоксиэтиламин / DMF, приготовленные из шага 4.4 с гранулами. Уплотнение шприца с поршнем и встряхивают его на шейкере в течение 30 мин.
- Вымойте бисером с DMF 5x. Проверьте несколько бусин с тестом хлоранил, если положительные (бисер синеет), то переходите к следующему шагу. В противном случае, повторите шаг 4,6.
- Повторите шаги 4,5 до 4,7, 4x для завершения пентамер.
. 5 Сплит-и-бассейн Синтез ОТА библиотеки с (R) - и (S)-2-бромпропионовой Кислоты
Здесь мы описываем синтез небольшой ОТА библиотеки с теоретической разнообразия 9261 соединений с использованием 1 г шариков из стадии 4.8. Обратите внимание, что TentaGel шарик 90 мкм содержит приблизительно 2,9 млн. бусы на грамм; Поэтому избыточностьбиблиотека будет 2,9 х 10 6/9261 = 312 экземпляров. Мы используем бромуксусную кислоту, (R)-2-бромпропановой и изотопный надписью (S)-2-бромпропановой кислотно-D 4, как кислоты и 7 различных аминов (А1 ~ А7, см. рисунок 5 для деталей) для аминирования. Шприц реакторы и вакуумный коллектор будет использоваться для выполнения синтеза.
- Добавьте 10 мл дихлорметана 1:01: DMF к шприцу с шагом 4,8; использовать 1000 мкл пипетки с усеченной кончика пипетки разделить все 1 г бусы равномерно на три 5 мл шприцев реакторов. Обозначить их как B (бромуксусной кислоты), R ((R)-2-бромпропановой) и S ((S)-2-бромпропановой кислоты-D 4). Вымойте все 3 шприцы с DCM 3x, и мыть шприцы меченные R и S безводным ТГФ 3x, мыть шприц с надписью с B с DMF 3x.
- Шприц R и S. BTC связь бромпропановой кислоты.
- Подготовка свежий раствор BTC / ТГФ. Добавитьpproximately 200 мг БТД во флакон в вытяжном шкафу, запечатать его с крышкой. Взвешивают количество BTC во флаконе. Рассчитать количество растворителя, необходимое и безводный ТГФ добавить во флакон, чтобы сделать 20 мг / мл раствора BTC / ТГФ.
- Подготовьте бром кислот / БТД смесь. Добавить (R)-2-бромпропановой кислоты (89 мкл, 0,95 ммоль) и (S)-2-бромпропановой кислоты-D 4 (89 мкл, 0,95 ммоль) в двух небольших флаконах по отдельности. Для каждого флакона, добавляют 5 мл вышеуказанного раствора 20 мг / мл BTC / ТГФ. Запечатайте два флакона и поместить их в -20 ° C морозильник на 20 мин.
- Добавить 1125 мкл, 2:01 ТГФ / DIPEA (750 мкл ТГФ, 375 мкл DIPEA, 2,2 ммоль) в шприц R и S отдельно. Смешайте бисер с кончика пипетки. Пусть они сидят в течение 5 мин.
- Возьмем два охлаждением бром кислоты / BTC смеси из стадии 5.2.2, добавить 2,4,6-триметилпиридин (356 мкл, 2,7 ммоль) в каждой ампулы. Белые осадки сразу же образуют. Примените соответствующую подвеску непосредственнок подщелачивают шариков (шприц R и S на шаге 5.2.3) как можно скорее, а затем положить их на шейкере, чтобы пожать под 120 оборотов в минуту в течение 2 часов.
Примечание: Решение в шприце реакторов должна быть бледно-желтовато подвеска в течение всего хода реакции. Темный цвет является показателем избыточного тепла, выделяющегося во время начальной добавлением раствора хлорида кислоты. Это может быть решена путем дальнейшего охлаждения или разбавить бром кислоты / BTC смеси.
- Шприц B. Муфта бромуксусной кислоты с ДВС
- Подготовьте свежий 20 мл, 2 М раствор бромуксусной кислоты / DMF. Подготовить 20 мл, раствор 2 М DIC / DMF.
- Добавить 2 мл 2 М бромуксусную решения кислота / DMF в шприц B, слегка встряхнуть. Добавить 2 мл раствора 2 М DIC / DMF в шприц B, слегка встряхнуть.
- Положите шприц B на том же шейкере как шприц R и S , Встряхните его в течение 2 часов. Следует отметить, что реакция сочетания бромуксусной кислоты / DIC делается в течение 30 мин; длительное время реакции для удобства синтеза сплит-и-бассейна.
- Через 2 часа, принимать шприц R, S и В из шейкера. Вымойте все три шприцы тщательно DCM 5x. Затем промыть водой с DMF 5x. Обратите внимание, что шприц R и S не может быть промывают ДМФ, прежде чем промывают DCM или ТГФ в первую очередь.
- Бассейн все бусы из шприцев R, S и В в один 12 мл реактора шприца. Вымойте все шарики с DMF 5x.
- Добавьте 10 мл дихлорметана 1:01: DMF к шприцу; использовать 1000 мкл пипетки с усеченной кончика пипетки разделить все шарики равномерно на 7 отдельных 2 мл шприцев, обозначить их как A1-A7.
- Аминирования. Подготовка 10 мл, 2 м первичные решения амин / DMF для каждого из 7 аминов, перечисленных на рисунке 5. Добавить 5 мл EACч раствор амина в соответствующий шприц A1-A7. Выдержите все 7 шприцы в инкубаторе 60 ° C при встряхивании в течение ночи.
- После инкубации, мыть все бусинки тщательно DMF. Возьмите несколько шариков из каждого шприца и проверить с помощью теста хлоранил. Если шарики станут зелеными (положительный) в течение 3 мин, перейдите к следующему шагу. Если отрицательный, повторите шаг 5,7 для отрицательных шприцев.
- Повторите шаги 5,1 до 5,8 2x для завершения тример. Необязательный шаг: После каждого цикла, мы рекомендуем, чтобы проверить качество синтеза помощью масс-спектроскопии, как описано ниже. Все 9261 соединений в настоящее время синтезированы на TentaGel бисера как библиотеки OBOC.
- Масс-спектроскопические подтверждение ПТС.
ПТС очень структурированные олигомеры и обладают многими общими чертами N-метилированных пептидов. Одна из общих проблем твердофазного синтеза N-метилированных пептидов является кислота деградация во ТФК декольте. Для подавления деградации кислоты, расщепление молекул, таких как циклоспорин оттвердый носитель часто проводится при низкой температуре. Мы сравнили различные Раскалывание условия для расщепления различных молекул PTA от твердого носителя. Мы обнаружили, что, как правило, низкой температуры и снижение концентрации TFA может эффективно подавлять ухудшение кислоты и обеспечить более чистые соединения.- Подготовка 10 мл 1:01 TFA / DCM раствора в 15 мл пробирку. Закройте трубку и положил его в -20 ° C морозильник на 20 мин.
- Вымойте бисером, которые должны быть расщеплены с DCM 5x. Встряхнуть бисером в DCM в течение 15 мин и мыть шарики снова DCM 5x.
- Слейте DCM из шприца. С помощью светового микроскопа и пипетки с усеченной наконечником для передачи каждого отдельного шарик в 96-луночный планшет, одного борта на лунку.
- Накройте 96 лунками с покровным. Поместите пластины в -20 ° C морозильнике в течение 15 мин.
- Возьмем охлажденный раствор 1:01 TFA / DCM с шага 5.10.1 и добавить 20 мкл в каждую лунку, содержащую шарик. Положите покровное назад и пут 96-луночный планшет на шейкере в -20 ° C холодильник.
- Встряхнуть в течение 20 мин. Возьмите тарелку 96-а, и снимите крышку скольжения. Сушить TFA / DCM из каждой лунки путем продувки воздуха или аргона над ней. Если более 10 шарики дрова, SpeedVac может быть использован, чтобы высушить TFA / DCM от всей пластине. Следует отметить, что в этой точке, не все из соединений отщепляется шарики, но расщепляется соединения должно быть более чем достаточно для выполнения анализа масс-спектрометрии.
- Добавить 20 мкл 6:04 АКС: Н 2 О распустить расщепленные соединений из каждой лунки. Пятно 0,6 мкл каждого раствора соединения вместе с 0,6 мкл CHCA MALDI матрицы на MALDI пластины.
- С помощью MALDI масс-спектрометрии для определения молекулярной массы и последовательность (MS / MS) каждого соединения.
6. Хлоранил Тест
- Подготовьте следующие реагенты свежий для каждого теста. Раствор А: 2% Хлоранил (CAS: 118-75-2) в ДМФ. РешениеB: 2% ацетальдегида (CAS: 75-07-0) в ДМФ.
- Смешайте 100 мкл раствора А с 100 мкл раствора В до испытания в 1,5 мл трубки; падение бусины в и осторожно встряхните. Если шарики синим в течение 5 мин, это указывает на наличие вторичного амина на поверхности гранул. Первичные амины дают темно-коричневый цвет, а не синеет.
Результаты
Здесь мы показываем, три представительства MALDI спектры от PTA тримера с линкера. Как показано на фиг.6А, когда расщепляется при комнатной температуре с использованием 50%-ного раствора TFA / DCM, значительное ухудшение наблюдается. На рисунке 6A, пик 593 и 484 соответствуют линкера и ОТА тримера соответственно, показывают, что вся молекула была успешно синтезировали на шарик, но разрушаются во время расщепления. Когда расщепляется в условиях низкой температуры, как описано выше, количество TFA-индуцированного деградацией значительно подавляется, как показано на фиг.6В. Механизм такого расщепления было описано в предыдущих литературе 24, и считается, чтобы пройти через промежуточный оксазолидин. PTA молекулы могут быть секвенированы с помощью MS / MS и структуры фрагментации аналогична пептидов и пептоиды, как показано на фиг.6С. Молекулы ПТА синтезированные с (S)-2-бромпропановой кислотно-D 4 в целом гив широкий пик на МС и МС / МС спектров за счет наличия неполных дейтерировании продуктов, таких как (S)-2-бромпропановой кислоты-D 3 (фиг. 7А и 7В). Это может быть использовано как указание на присутствие хирального центра R (перевернутый из S в течение аминированием) в течение процедуры секвенирования. Мы также обнаружили, что молекулы PTA имеют тенденцию к образованию более чем sodiated аддукты пептоидной / пептида, поэтому низкий вода натрия (например, деионизированной воды) и пластик являются предпочтительными устройство (рис. 7С). Другой побочный продукт, который можно было наблюдать в синтезе ОТА является акриламид образуется из ликвидации бромида в течение аминирования (рис. 7в). После того, как акриламид образуется последовательность прекращается. Это может быть решена путем снижения концентрации первичного амина до 1 м, чтобы уменьшить основности раствора. Мы рекомендуем выполнять испытание хлоранила после каждого шага ацилирования и с помощью масс-спектрометрыoscopy за проверку продукта после каждого шага аминирования для обеспечения качества библиотеки.
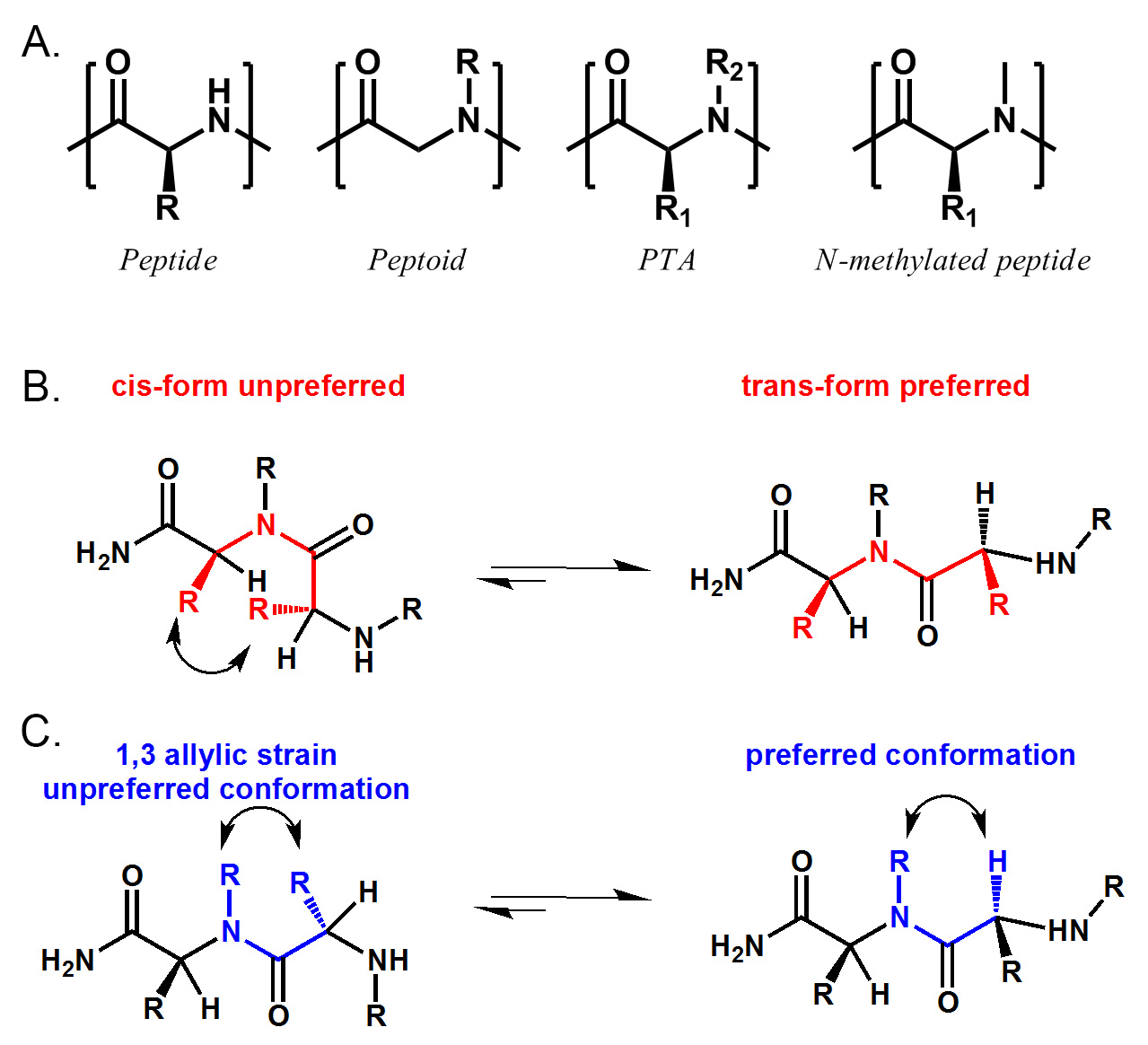
Рисунок 1. Структурная сравнение пептидной, пептоидной, ОТА и N-метилированного пептида. PTA включает пептид (R 2 = H), пептоидной (R 1 = H) и N-метилированный пептид (R 1 ≠ H, R 2 = Me) . Б) ПТА предпочитает транс конформацию амидной связи в связи с стерических препятствий между двумя α-боковой цепи. C) ПТА также имеет предпочтительный конформацию из-за 1,3 аллильном деформации между N-заменителя и α-боковой цепи. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
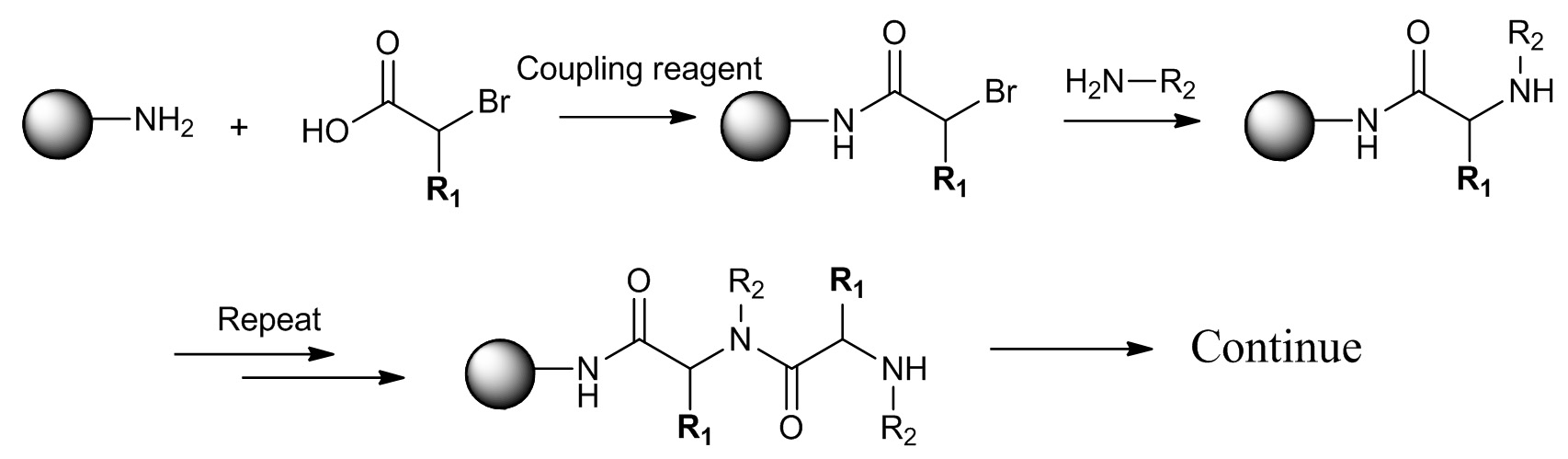
Рисунок 2. Синтез Sub-мономер пептоидной (R 1 = H) и PTA (R 1 ≠ H). Первый шаг кислота ацилирование амина. Второй этап представляет собой аминирования с первичными аминами. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
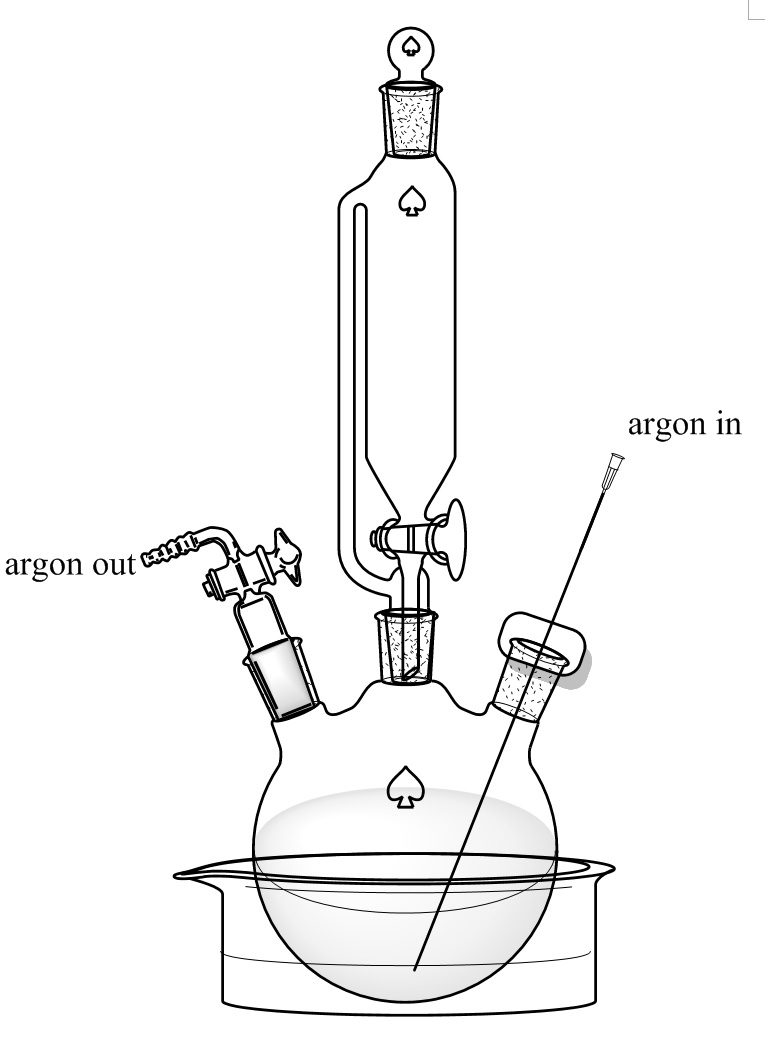
Рисунок 3. Настройка реакции. 250 мл трехгорлую круглодонную колбу помещают в сухой лед / этиленгликоля ванной. Средний шеи связан с давлением 150 мл капельной воронкой с уравновешенным. Левая и правая шеи уплотнены с адаптером управления потоком и мембраной шIth длинной иглой, что позволяет аргон поток пройти. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
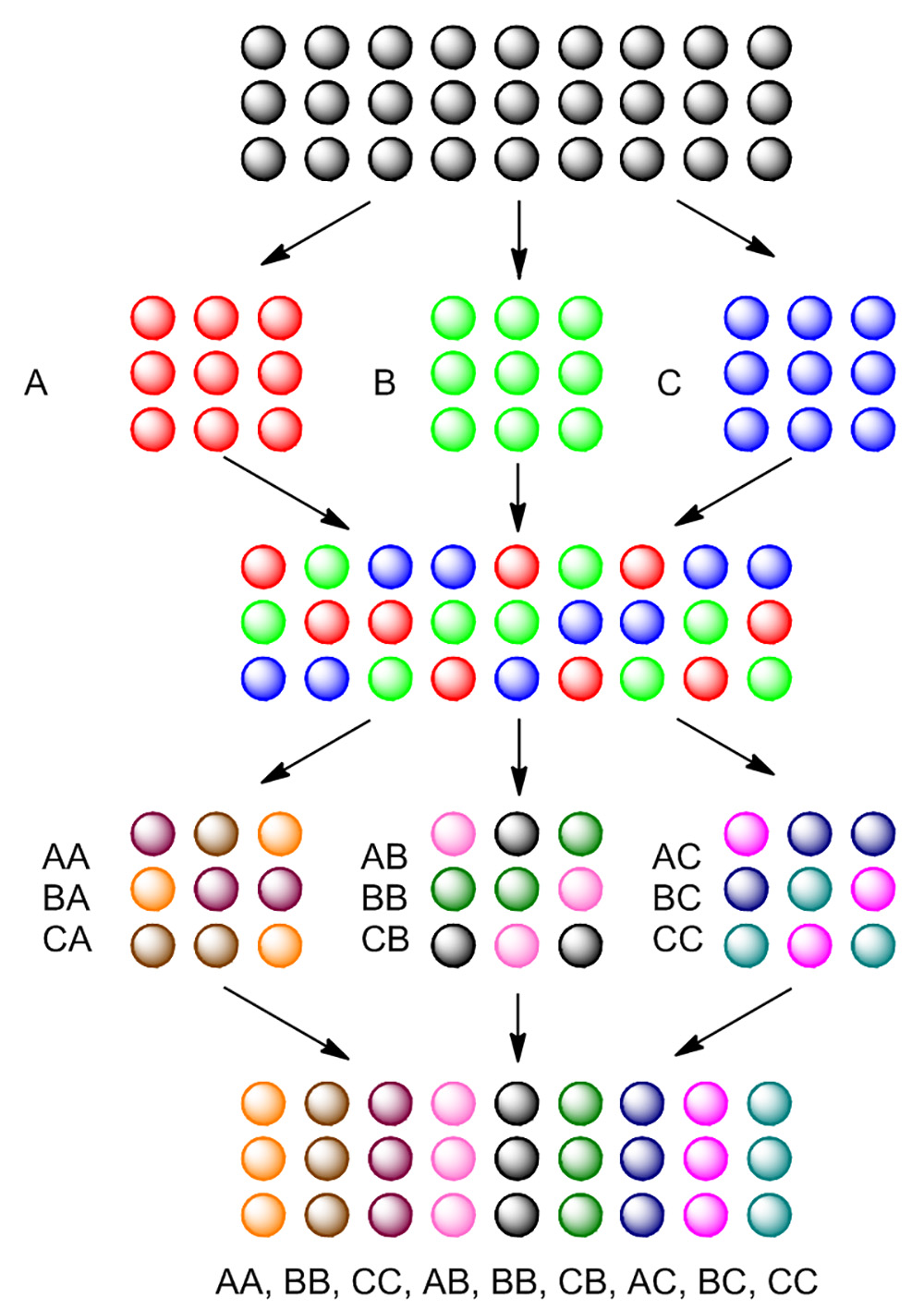
Рисунок 4. Основы синтеза сплит-и бассейн. Пустые шарики разделен на три части, обрабатывали отдельно с реагентом A, B и C. После первой реакции, все три части шариков, собирают вместе и перемешивают. Объединенные шарики снова разделить на три порции, и снова обрабатывали таким же реагента для каждого отдельного участка. После второй реакции, 9 различных соединений синтезируются. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5. Библиотека Обзор структуры. Три ПТС синтезируются после пентамер пептоидной линкера. Теоретическая разнообразие, 3 3 X 7 3 = 9261. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
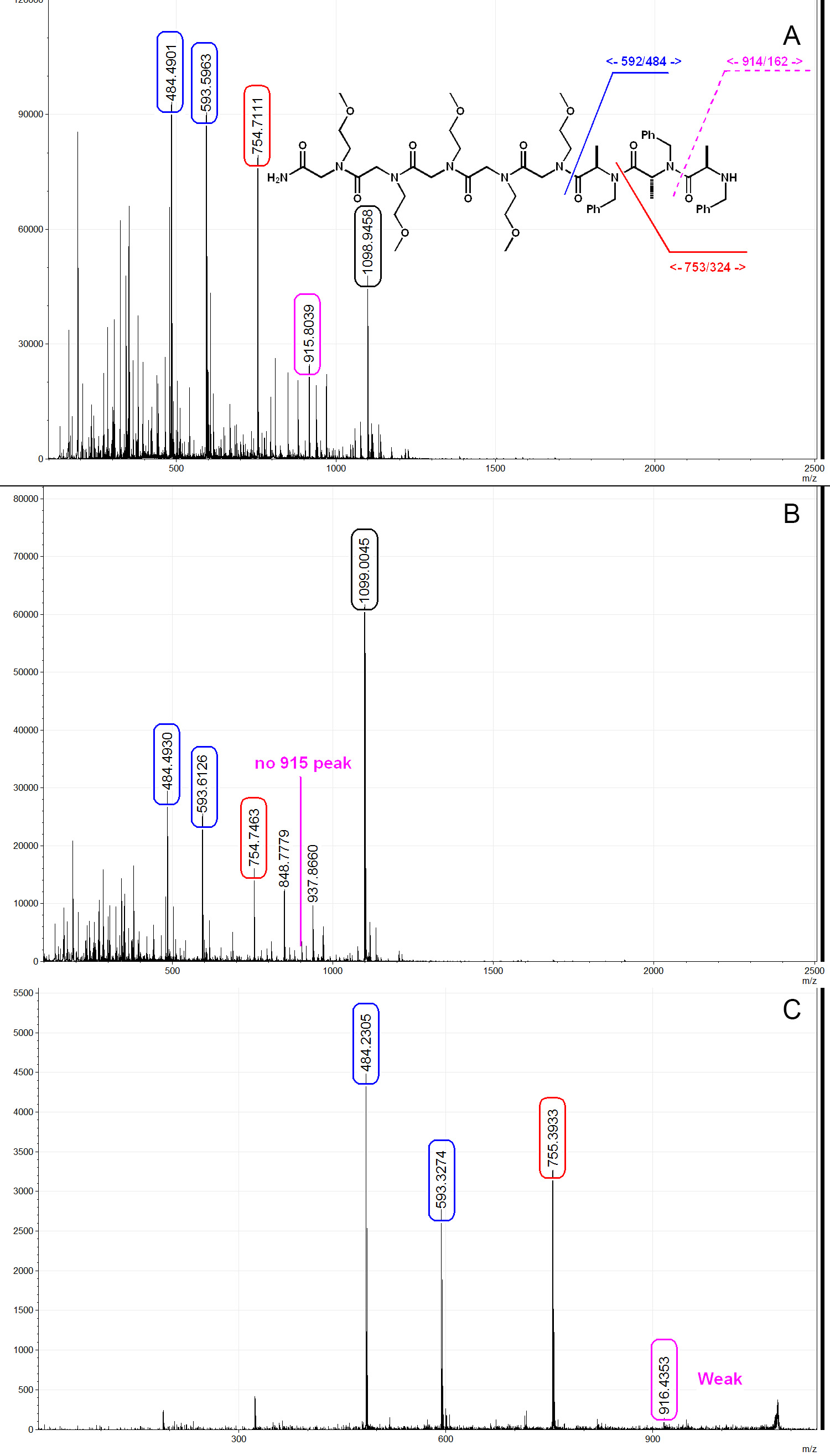
Рисунок 6. Типичный MALDI масс-спектры с ОТА тримера.) Trimer ПТА расщепляется на 50% TFA / DCM при комнатной температуре. PTA структура, как показано, [M +1] + = 1077, [M + Na] + = 1,098.9, PTA фрагментация от TFA расщепления можно ясно видеть на спектре. B) Trimer расщепленииред на 50% TFA / DCM согласно оптимизированным состоянии, как описано в данном документе. Деградация ТФК-побудить кислоты сильно подавлена. C) MS / MS спектр ОТА тримера. Слабый y7 наблюдается (916) сигнал, это типичное поведение фрагментации для ПТС. Спектры проанализированы и порожденная mMass 32. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 7. MALDI спектры синтеза ОТА с изотопным помечены мономера и типичный побочных продуктов. А) сравнение MS спектры молекул PTA синтезированных синий: (R)-2-бромпропановой [М +1] + = 760 [M + Na] + = 787 [M + K] + = 803 и красный: (S) - 2-бромпропановой кислоты-D 4 [М +1] + = 764 [M + Na] + = 783 [M + K] + = 799. B) MS / MS структуры фрагментации двух молекул, показанных на А). Обратите внимание, что в связи с наличием D 1, D 2 и D 3 специй (неполное дейтерирование аланин), молекулы, синтезированные (S)-2-бромпропановой кислотно-D 4 как правило, дают более широкие пики С) Красный:. Спектра PTA димера синтезированы и расщепляется под оптимизированной состоянии. Синий:. ПТА Димер синтезируются с 2 М раствора метоксиэтиламина и расщепляется в нормальном фильтрованной воды Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Пептидные третичные амиды (ПТС) представляют собой суперсемейство пептидомиметических олигомеров. Помимо хорошо изученных пептидов, пептоиды и N-метилированных пептидов, большая часть соединений в этой семье остается недостаточно изученной, Majorly из-за отсутствия синтетического метода иметь доступ к общему N-алкилированные пептиды. Здесь мы описываем эффективный метод синтеза хиральных АРУ с строительные блоки, полученные из аминокислот. Ранее мы уже сообщали использовать новый суб-мономера маршрут к синтеза библиотек молекул PTA 23. Мы показали, что ПТС очень структурированные олигомеры, которые обладают конформационные сдерживает через позвоночника. При проведении испытания в естественных условиях, молекулы ПТА показали улучшенную проницаемость клеток и, следовательно, более высокой активностью 25. Однако, наряду со всеми преимуществами, ПТС также поставляются с некоторых синтетических проблем, Majorly от ацилирования вторичных аминов в затрудненных положениях. Α-боковой цепи, которая обеспечивает конформационноеограничение также приносит пространственное затруднение для следующего стадии присоединения. Для того чтобы преодолеть эти синтетические проблемы, мы провели обширное исследование оптимизации и определяется БТД как лучший связующего реагента для этой реакции 23.
Ключевой стадией синтеза, маршрута BTC облегчается ацилирование вторичного амина. Во время этого процесса, BTC позволяет поколение хлорангидридом на месте 26,27. Большинство других соединительные реагенты, которые образуют либо активные сложные эфиры или ангидриды кислот в качестве промежуточных удалось обеспечить чистой ацилирование для непрерывного синтеза ОТА. Существование предыдущих единиц ПТА значительно ухудшает эффективность связывания следующего блока ОТА из-за пространственных затруднений. Таким образом, для синтеза нескольких ПТС, высоко активного промежуточного с небольшим уходящую группу, весьма предпочтительно. Среди всех условиях сочетания, что мы тестировали, на месте генерируется хлорангидрида по БТД работает бест в наших руках. Тем не менее, даже с хлоридами высоко активной кислотой, мы рекомендуем, чтобы избежать высокой стерические затрудненные амины, такие как α-разветвленных первичных аминов в библиотеке синтеза, если не проверены заранее. Ароматические амины, такие как ANILE часто приводит к неполному замещения и, таким образом, также следует избегать. Во время стадии БТД связи, решение всегда должен быть бледно-желтого до оранжевого цвета; темного цвета раствор является показателем перегрева и может привести к снижению урожайности и повышенному образованию побочных продуктов. Это обычно может быть решена путем дальнейшего охлаждения раствора BTC, уменьшить размер реакции и быструю передачу активированного раствора BTC / кислоты. Кроме того BTC, N-этоксикарбонил-2-этокси-1 ,2-дигидрохинолин (EEDQ) является еще одним связывающий реагент, который хорошо работает в синтезе ОТА. Ключевым промежуточным продуктом является смешанным ангидридом угольной с относительно небольшим уходящую группу. В случае ЭЭДХ, 3 эквивалента ЭЭДХ растворяют вместе с кислотой в DCM и затем арприменении к шариков при комнатной температуре. Реакцию обычно делается в течение 2 ч при умеренном встр хивании. Эта реакция релизы CO 2 в процессе реакции; Поэтому реакционная система не должна быть закрыта.
Другим ключевым шагом является расщепление и характеристика молекул ПТА. Отличительной картина фрагментации MS / MS наблюдается при виртуализации молекулы ПТА через MALDI-MS/MS (рис. 6). Он состоит с малой интенсивностью последнего у иона (показан на фиолетовый в фиг.6С и повышенной интенсивности y6, Y5, Y4, B2, B3 ионов). Аналогичные модели были наблюдается с N-метилированного пептида фрагментации в предыдущем докладе 28. В связи с увеличением устойчивости промежуточного оксазолидина, N-метилированных пептиды, как правило, дают сильный B ионов 28. Более того, хорошо известно, что N-метилированный пептид являются кислотно-лабильную как во время расщепления TFA и MALDI масс-спектроскопии 24,28, 29. Механистический исследование показало, что за счет конформационной ограничением на позвоночник, атом кислорода карбонильной предыдущего остатка часто в непосредственной близости от карбонильной группы в сайте расщепления, тем самым способствуя образованию оксазолидина Промежуточное соединение 29. По причинам, указанным выше, оба ПТС и N-метилированных пептиды должны быть расщеплены из твердых подложках при низкой температуре с использованием контролируемых концентраций TFA 26, 30. По нашему опыту, наиболее удобный метод расщепления для отдельных остатков ПТА происходит при -20 ° С с заранее охлажденного, -20 ° С раствору 50% ТФУ / DCM. Эта процедура значительно подавляет образование кислоты деградированных продуктов.
После освоения этой техники, библиотека с ОТА мономера, полученного из других природных аминокислот, таких как лейцин, фенилаланин, глутамина, и т.д., могут быть синтезированы, а также. Высокое качество библиотека ПТА могут быть подвергнуты скринингу AGainst различные цели белка, используя наши ранее опубликованные протоколы 31 по-шарик скрининга. Хит соединения, идентифицированные из скрининга могут быть охарактеризованы масс-спектроскопии и повторно синтезирован для дальнейшего тестирования с использованием протокола, описанного выше.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Авторы хотели бы поблагодарить доктора Jumpei Моримото и д-р Тодд Доран для ценную помощь. Эта работа была поддержана контрактом от NHLBI (NO1-HV-00242).
Материалы
| Name | Company | Catalog Number | Comments |
| 2,4,6 trimethylpyridine | ACROS | 161950010 | CAS:108-75-8 |
| 2-morpholinoethanamine | Sigma-Aldrich | 06680 | CAS:2038-03-1 |
| 48% HBr water solution | ALFA AESAR | AA14036AT | CAS:10035-10-6 |
| Acetaldehyde | Sigma-Aldrich | 402788 | CAS:75-07-0 |
| Acetonitrile | Fisher | SR015AA-19PS | CAS:75-05-8 |
| Anhydrous tetrahydrofuran (THF) | EMD | EM-TX0277-6 | CAS:109-99-9 |
| Benzylamine | Sigma-Aldrich | 185701 | CAS:100-46-9 |
| bis(Trichloromethyl) carbonate (BTC) | ACROS | 258950050 | CAS:32315-10-9 |
| Bromoacetic acid | ACROS | 106570010 | CAS:79-08-3 |
| Chloranil | Sigma-Aldrich | 23290 | CAS:118-75-2 |
| Cyclohexanemethylamine | Sigma-Aldrich | 101842 | CAS:3218-02-8 |
| D2O | Cambridge Isotope | DLM-4-99.8-1000 | CAS:7789-20-0 |
| D-Alanine | Anaspec | 61387-100 | CAS:338-69-2 |
| Dichloromethane (DCM) | Fisher | BJ-NS300-20 | CAS:75-09-2 |
| Dimethylformamide (DMF) | Fisher | BJ-076-4 | CAS:68-12-2 |
| Ethylene glycol | Oakwood | 44710 | CAS:107-21-1 |
| Isopentylamine | Sigma-Aldrich | W321907 | CAS:107-85-7 |
| KBr | ACROS | 424070025 | CAS:7758-02-3 |
| L-Alanine | Anaspec | 61385-100 | CAS:56-41-7 |
| 3-Methoxypropylamine | Sigma-Aldrich | M25007 | CAS:5332-73-0 |
| 2-Methoxyethylamine | Sigma-Aldrich | 143693 | CAS:109-85-3 |
| N-(3-Aminopropyl)-2-pyrrolidinone | Sigma-Aldrich | 136565 | CAS:7663-77-6 |
| N,N'-Diisopropylcarbodiimide (DIC) | ACROS | 115211000 | CAS:693-13-0 |
| N,N-Diisopropylethylamine (DIPEA) | Sigma-Aldrich | D125806 | CAS:7087-68-5 |
| NaNO2 | ACROS | 424340010 | CAS:7631-99-4 |
| NAOD 40% solution in water | ACROS | 200058-506 | CAS:7732-18-5 |
| Piperidine | ALFA AESAR | A12442-AE | CAS:110-89-4 |
| Piperonylamine | Sigma-Aldrich | P49503 | CAS:2620-50-0 |
| Propylamine | Sigma-Aldrich | 240958 | CAS:107-10-8 |
| Trifluoroacetic acid | Sigma-Aldrich | 299537 | CAS:76-05-1 |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | 39468 | CAS:28166-41-8 |
| α-Ketoglutarate | ALFA AESAR | AAA10256-22 | CAS:328-50-7 |
| Tentagel Resin with RINK linker | Rapp-Polymere | S30023 | |
| Alanine transaminase | Roche | 10105589001 | AKA: Glutamate-Pyruvate Transaminase (GPT) |
| Incubator | New Brunswick Scientific | Innova44 | |
| NMR | Bruker | 400 MHz | |
| MALDI mass spectrometer | Applied Biosystems | 4800 MALDI-TOF/TOF | |
| Lyophilizer | SP Scientific | VirTis benchtop K | |
| Syringe reactor | INTAVIS | Reaction Column | 3 ml, 5 ml, 10 ml, 20 ml |
| Vacuum manifold | Promega | A7231 | Vac-Man |
Ссылки
- Xiao, X., Yu, P., Lim, H. -S., Sikder, D., Kodadek, T. Design and Synthesis of a Cell-Permeable Synthetic Transcription Factor Mimic. Journal of Combinatorial Chemistry. 9, 592-600 (2007).
- Miller, S. M., et al. Proteolytic Studies of Homologous Peptide and N-Substituted Glycine Peptoid Oligomers. Bioorganic & Medicinal Chemistry Letters. 4, 2657-2662 (1994).
- Grauer, A., Konig, B. Peptidomimetics - A Versatile Route to Biologically Active Compounds. European Journal of Organic Chemistry. 30, 5099-5111 (2009).
- Zuckermann, R. N., Kerr, J. M., Kent, S. B. H., Moos, W. H. Efficient method for the preparation of peptoids [oligo(N-substituted glycines)] by submonomer solid-phase synthesis. Journal of the American Chemical Society. 114, 10646-10647 (1992).
- Figliozzi, G. M., Goldsmith, R., Ng, S. C., Banville, S. C., Zuckermann, R. N. Synthesis of N-substituted glycine peptoid libraries. Methods in Enzymology. 267, 437-447 (1996).
- Seebach, D., et al. beta-peptides: Synthesis by Arndt-Eistert homologation with concomitant peptide coupling. Structure determination by NMR and CD spectroscopy and by X-ray crystallography. Helical secondary structure of a beta-hexapeptide in solution and its stability towards pepsin. Helv Chim Acta. 79, 913-941 (1996).
- Lam, K. S., et al. A New Type of Synthetic Peptide Library for Identifying Ligand-Binding Activity. Nature. 354, 82-84 (1991).
- Simon, R. J., et al. Peptoids - a Modular Approach to Drug Discovery. Proceedings of the National Academy of Sciences of the United States of America. 89, 9367-9371 (1992).
- Burkoth, T. S., et al. Toward the synthesis of artificial proteins: the discovery of an amphiphilic helical peptoid assembly. Chem Biol. 9, 647-654 (2002).
- Alluri, P. G., Reddy, M. M., Bachhawat-Sikder, K., Olivos, H. J., Kodadek, T. Isolation of protein ligands from large peptoid libraries. Journal of the American Chemical Society. 125, 13995-14004 (2003).
- Lim, H. S., Archer, C. T., Kodadek, T. Identification of a peptoid inhibitor of the proteasome 19S regulatory particle. Journal of the American Chemical Society. 129, 7750-7751 (2007).
- Wrenn, S. J., Weisinger, R. M., Halpin, D. R., Harbury, P. B. Synthetic ligands discovered by in vitro selection. Journal of the American Chemical Society. 129, 13137-13143 (2007).
- Aina, O. H., Marik, J., Liu, R. W., Lau, D. H., Lam, K. S. Identification of novel targeting peptides for human ovarian cancer cells using "one-bead one-compound" combinatorial libraries. Mol Cancer Ther. 4, 806-813 (2005).
- Udugamasooriya, D. G., Dineen, S. P., Brekken, R. A., Kodadek, T. A Peptoid “Antibody Surrogate” That Antagonizes VEGF Receptor 2 Activity. Journal of the American Chemical Society. 130, 5744-5752 (2008).
- Shah, N. H., et al. Oligo( N-aryl glycines): A New Twist on Structured Peptoids. Journal of the American Chemical Society. 130, 16622-16632 (2008).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proceedings of the National Academy of Sciences of the United States of America. 105, 2794-2799 (2008).
- Paul, B., et al. N-Naphthyl Peptoid Foldamers Exhibiting Atropisomerism. Organic Letters. 14, 926-929 (2012).
- Crapster, J. A., Guzei, I. A., Blackwell, H. E. A peptoid ribbon secondary structure. Angewandte Chemie. 52, 5079-5084 (2013).
- Gorske, B. C., Stringer, J. R., Bastian, B. L., Fowler, S. A., Blackwell, H. E. New strategies for the design of folded peptoids revealed by a survey of noncovalent interactions in model systems. J Am Chem Soc. 131, 16555-16567 (2009).
- Stringer, J. R., Crapster, J. A., Guzei, I. A., Blackwell, H. E. Extraordinarily robust polyproline type I peptoid helices generated via the incorporation of alpha-chiral aromatic N-1-naphthylethyl side chains. J Am Chem Soc. 133, 15559-15567 (2011).
- Huang, K., et al. A threaded loop conformation adopted by a family of peptoid nonamers. Journal of the American Chemical Society. 128, 1733-1738 (2006).
- Lee, J. H., Kim, H. S., Lim, H. S. Design and Facile Solid-Phase Synthesis of Conformationally Constrained Bicyclic Peptoids. Organic Letters. 13, 5012-5015 (2011).
- Gao, Y., Kodadek, T. Synthesis and Screening of Stereochemically Diverse Combinatorial Libraries of Peptide Tertiary Amides. Chem Biol. 20, 360-369 (2013).
- Urban, J., Vaisar, T., Shen, R., Lee, M. S. Lability of N-alkylated peptides towards TFA cleavage. Int J Pept Protein Res. 47, 182-189 (1996).
- Rzuczek, S. G., Gao, Y., Tang, Z., Thornton, C. A., Kodadek, T., Disney, M. D. Features of Modularly Assembled Compounds That Impart Bioactivity Against an RNA Target. ACS Chemical Biology. 8 (10), 2312-2321 (2013).
- Thern, B., Rudolph, J., Jung, G. Triphosgene as highly efficient reagent for the solid-phase coupling of N-alkylated amino acids—total synthesis of cyclosporin O. Tetrahedron Letters. 43, 5013-5016 (2002).
- Sleebs, M. M., Scanlon, D., Karas, J., Maharani, R., Hughes, A. B. Total Synthesis of the Antifungal Depsipeptide Petriellin A. J Org Chem. 76, 6686-6693 (2011).
- Vaisar, T., Urban, J. Gas-phase fragmentation of protonated mono-N-methylated peptides. Analogy with solution-phase acid-catalyzed hydrolysis. Journal of Mass Spectrometry. 33, 505-524 (1998).
- Creighton, C. J., Romoff, T. T., Bu, J. H., Goodman, M. Mechanistic studies of an unusual amide bond scission. Journal of the American Chemical Society. 121, 6786-6791 (1999).
- Sewald, N., Sewald, N. Efficient, racemization-free peptide coupling of N-alkyl amino acids by using amino acid chlorides generated in situ--total syntheses of the cyclopeptides cyclosporin O and omphalotin A. Angewandte Chemie (International ed. in English). 41, 4661-4663 (2002).
- Astle, J. M., et al. Seamless Bead to Microarray Screening: Rapid Identification of the Highest Affinity Protein Ligands from Large Combinatorial Libraries. Chem Biol. 17, 38-45 (2010).
- Strohalm, M., Kavan, D., Novak, P., Volny, M., Havlicek, V. mMass 3: a cross-platform software environment for precise analysis of mass spectrometric data. Anal Chem. 82, 4648-4651 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены