Method Article
분할 및 풀 합성 펩타이드 급 아미드 도서관의 특성
요약
펩타이드 차 아미드 (학부모 교사 협의회)를 포함하지만, 펩티드, peptoids 및 N-메틸화 펩티드에 국한되지 않습니다 펩티 도미 메틱의 슈퍼 패밀리입니다. 여기에서 우리는 학부모 교사 협의회의 한 구슬 한 화합물 라이브러리를 합성하는 분할과 풀과 하위 단량체 전략을 결합 합성 방법을 설명합니다.
초록
펩티 단백질 리간드의 좋은 소스입니다. 이들 화합물의 올리고머 자연 조합 화학을 사용하여 고체 상태에 큰 합성 라이브러리에 액세스하는 가능하게한다. 펩티 도미 메틱의 가장 잘 공부 클래스 중 하나는 peptoids입니다. Peptoids는 합성하기 쉽고 단백질 분해를 방지하고 세포 투과성 것으로 표시되었습니다. 지난 10 년간 많은 유용한 단백질의 리간드는 펩 토이 드 라이브러리의 검사를 통해 확인되었습니다. 그러나, 펩 토이 드 라이브러리에서 확인 된 리간드의 대부분은 드문 예외를 제외하고, 높은 선호도를 표시하지 않습니다. 이것은 펩 토이 드 분자 내에 키랄 중심과 구조적 제약의 부족 때문에, 부분적으로 기인 할 수있다. 최근에, 우리는 펩타이드 차 아미드 (학부모 교사 협의회)에 액세스 할 수있는 새로운 합성 경로를 설명했다. 학부모 교사 협의회는 포함하지만, 펩티드, peptoids 및 N-메틸화 펩티드에 국한되지 않습니다 펩티 도미 메틱의 슈퍼 패밀리입니다. α-탄소 및 주쇄에 질소 원자를 모두에 측쇄와,이러한 분자의 형태는 크게 sterical 방해하고 알릴 1,3 변형에 의해 제한됩니다. (도 1) 우리의 연구는 이러한 PTA 분자 높게 용액으로 구성되는 단백질 리간드를 식별하기 위해 사용될 수 있음을 시사한다. 우리는이 분자가 높은 친 화성 단백질의 리간드의 미래 원천이 될 수 있다고 생각합니다. 여기에서 우리는 샘플 학부모 교사 협의회의 1 구슬 한 화합물 (OBOC) 라이브러리를 합성하는 분할과 풀과 하위 단량체 전략 모두의 힘을 결합하는 합성 방법을 설명합니다.
서문
펩티 천연 펩티드의 구조를 모방하는 화합물이다. 이들은 단백질 분해 1-3 대 세포 투과성과 안정성을 포함한 천연 펩티드와 관련된 몇 가지 문제를 극복하면서 생리 활성을 유지하도록 설계된다. 때문에 이들 화합물의 올리고머 성격, 큰 합성 라이브러리는 쉽게 단량체 또는 하위 단량체 합성 경로 4-7를 통해 액세스 할 수 있습니다. 펩티 도미 메틱의 가장 공부 클래스 중 하나는 peptoids입니다. Peptoids는 서브 단량체 전략 (8, 9)를 이용하여 용이하게 합성 할 수있는 N-알킬화 글리신의 올리고머이다. 많은 유용한 단백질의 리간드가 성공적으로 단백질 표적 1, 10 ~ 14에 대한 큰 합성 펩 토이 드 라이브러리를 스크리닝에서 확인되었습니다. 그럼에도 불구하고, 펩 토이 드 라이브러리에서 확인 된 "히트"거의 단백질 표적 1,10-14,22으로 매우 높은 친화력을 보관하지 않습니다. 한 엄마조 peptoids 천연 펩티드 간의 차이 peptoids의 대부분은 일반적으로 인해 키랄 중심과 구조적 제약 부족 이차 구조를 형성하는 능력이 부족하다는 것이다. 이 문제를 해결하기 위해, 여러 전략은 크게 주쇄 질소 원자 15-22에 함유 측쇄의 변형 예에 초점을 지난 10 년에 걸쳐 개발되었다. 최근에는 펩티드 급 아미드 (23)를 생성하는 펩 토이 드 골격 상 천연 아미노산 측쇄를 도입하는 신규 합성 루트를 개발했다.
펩타이드 차 아미드 (학부모 교사 협의회)를 포함하지만 펩티드 (R 2 = H), peptoids (R 1 = H) 및 N-메틸화 펩티드에 국한되지 않습니다 펩티 도미 메틱의 최고 가족입니다 (R 1 ≠ H는, R 2 나를 =) . 우리의 합성 경로는 자연에 키랄성 (chirality)와 사이드 체인의 소스로 아미노산을 발생 채택하여 (그림 1 참조)45, 탄소, 및 N-치환을 제공하는 상용 급 아민. 따라서, 간단한 펩티드 peptoids 또는 N-메틸화 펩티드보다 큰 화학 공간 탐구 할 수있다. 원 편광 이색 스펙트럼은 PTA 분자가 높은 솔루션으로 구성되어 나타났습니다. PTA-단백질 복합체의 하나의 특성은 명확하게 PTA의 구조적 제약 조건이 바인딩에 필요한 것을 보여줍니다. 최근에, 우리는 또한 PTA 분자 중 일부는 자신의 펩 토이 드 펩타이드에 비해 개선 된 세포 투과성을 가지고 것을 발견했습니다. 우리는이 PTA 라이브러리 단백질 표적에 대한 높은 친 화성 리간드의 좋은 원천이 될 수 있다고 생각합니다. 이 논문에서, 우리는 샘플 이들 화합물의 결합 및 분해에 대한 몇 가지 개선 조건과 함께 세부 사항에 하나의 구슬 한 화합물 (OBOC) PTA 라이브러리의 합성을 설명합니다.
프로토콜
1. 분할 및 풀 합성의 기초
효율적 고상 다수의 화합물을 생성하기 위해서, 분할 및 풀 합성은 종종 일반적인 전략으로서 채용된다. 도 4에 도시 된 바와 같이, tentagel 비즈는 세 부분으로 우선 분할이다. 각 부분은 비드의 첫번째 잔기를 생성, 다른 시약과 반응시킨다. 첫 번째 반응 후, 세 가지 부분은 함께 풀링 혼합 한 다음 세 부분으로 다시 분할됩니다. 각 부분은 다시 비즈에 제 잔류 물을 생성하는 다른 시약과 반응 할 것이다. 두 개의 분할 및 풀 단계 후, 아홉 화합물이 생성된다.
서브 단량체 합성, 비드 제 커플 링제의 존재하에 브로 다른 아미노산과 반응 몇개의 부분으로 분할된다. 용매로 세척 한 후, 모든 구슬은 또 다른 반응하는 여러 부분으로 나누어, 함께 혼합 풀링됩니다주 아민. 아 민화 후, 모든 구슬 함께 풀링 각 구슬에 대한 전체 단량체를 완료, 철저하게 세척. 원하는 다이버 시티에 도달 될 때까지이 프로세스는 반복 될 수있다.
천연 아미노산의 산 브로마이드 2. 준비
.. 산 브로마이드와 주 아민이 아 민화 (그림 2)의 1 커플 링 : 서브 단량체 합성, 각 단량체의 합성은 두 개의 단계로 나누어 져 있습니다. 펩티드 급 아미드를 합성하기 위해서는, 알파 탄소 상 측쇄를 가진 키랄 산 브로마이드는 천연 아미노산으로부터 제조 될 것이다. 여기에서 우리는 높은 스테레오 충실도와 상응하는 산 브로마이드에 천연 아미노산을 변환하는 방법을 설명합니다. 우리는 예로서 알라닌을 사용; 세린, 트레오닌, 아스파르트 산, 글루탐산, 아스파라긴, 글루타민, 글리신, 발린, 이소 로이신 등 다른 아미노산은 페닐알라닌 또한 유사한 컨디셔닝 시스템 하에서 브로 류로 변형 될 수있다NS. 페놀, 구아니딘과 같은 아민 관능기를 가진 아미노산의 일부가 변형하기 전에 보호되어야 할 필요가 있음을 주목해라. 반응 셋업은도 3에 도시된다.
안전주의 사항 : HBr로 나노 2 및 다른 부식성 / 독성 화학 물질, 안전 고글, 실험실 코트, 및 내 화학성 장갑 등 적절한 안전 장비를 포함하는 다음과 같은 반응이 필요하십시오. 모든 반응은 경험이 화학자에 의해 흄 후드에서 수행해야합니다.
- 1 L, 30 %의 HBr 용액을 제조 630 ㎖의 48 %의 HBr 용액에 370 ml의 물을 추가. 1 L 욕 용기에 500 ㎖의 에틸렌 글리콜을 추가; -10 ° C에서 온도를 유지하기 위해 드라이 아이스를 추가 주의 : 48 %의 HBr 솔루션은 취급에주의, 강한 산성 부식성이다. 사용하기 전에 MSDS를 읽으십시오.
- 자기 교반 막대와 함께 250 ㎖의 3 구 둥근 바닥 플라스크에 D-알라닌 (8.9 g, 0.1 몰) 및 KBr을 (11.9 g, 0.1 몰)을 추가합니다. 100 ml의 t에서 제조 30 % HBr로 추가그 이전 단계. 2.1 단계에서 제조 된 에틸렌 글리콜 조에서 플라스크를 넣고 -10 ℃에서 온도를 유지 도 3에 도시 된 바와 같이 10 분 동안 플라스크의 바닥에서 긴 바늘을 통해 버블 아르곤. 300 rpm으로 자기 교반 막대로 저어.
- 20 ㎖의 물을 100 ㎖ 비이커 나노 미터 (8.28 g, 0.12 몰)을 녹인다. 떨어지는 깔때기 동점 골을 압력에 솔루션을 추가하고 격막과 적하 깔때기를 밀봉. 천천히 적하 로트의 밸브를 켜고 나노 2 용액을 플라스크에 드롭 할 수 있습니다. 초 당 약 2 방울로 떨어지는 속도를 조절하기 위해 밸브를 제어 할 수 있습니다. 300 rpm에서 교반을 유지하고 플라스크의 바닥에서 기포 아르곤을 유지합니다. 모두에 NaNO 2가 추가 될 때까지 플라스크는 -10 ° C에서 에틸렌 글리콜 욕조에 보관해야합니다. 주의 :이 단계 나노이 용액의 첨가 동안 고온의 가스를 생성한다. 떨어지는 속도는 사기꾼 신중해야으로 통제하고 전체 시스템은 아르곤 출구를 통해 열려 있어야합니다.
- 더 많은 시간 동안 교반 유지하고 온도가 실내 온도에 -10 ° C에서 따뜻하게 할 수 있습니다. 생성 된 용액은 담황색 명확해야한다; 색상이 너무 어두운 경우에, 과량의 질소 산화물과 반응 중에 생성 수의 Br2를 제거하기 위해 진공을 적용한다.
- 추출 깔때기를 사용하여 3 배 35 ml의 디 에틸 에테르로 솔루션에서 제품의 압축을 풉니 다. 유기상을 합하고, 포화 식염수로 씻어. 유기상은 또한 종래 어두울 경우 색을 제거 염수로 세척에 탄산 수소 나트륨을 소량으로 세척 할 수있다. SO 4 ~ 6 시간 동안 나 2 위에 유기 상을 건조.
- SO 4 나 2를 필터링하고 진공 상태에서 용매를 증발, 조 생성물을 황색 오일을 엷은 명확로 얻을 수 있어야합니다. 조 생성물을 추가의 115 ° C에서 증류에 의해 정제 할 수 있고, 3mm 수은 또는함으로써3:1로 실리카 칼럼 : 에틸 아세테이트.
- 순수한 제품은 투명한 오일, 6.6 g (수율 74 %), 밀도 = 1.69 g / ㎖, [α] D20 = +24 ° (메탄올), 4.41 (Q δ 1 H NMR (400 MHz의,을 CDCl3)로 얻어진다 J = 7.0 Hz에서, 1H), 1.86 (d, J = 7.0 Hz에서, 3H). 의 (S) -2 - bromopropanoic 경우 (d 4-L-알라닌으로부터 제조) 산 - D 4, 순수한 생성물을 투명한 오일로서 수득 하였다, 수율 78 %, 밀도 = 1.72 g / ㎖, [α] D20 = -19 ° (메탄올). 1 H NMR, 큰 H 신호는 관찰되지 않는다. ESI-MS - [M-1] - = 155.1는 (154.97 예상). 용 (S) -2 - 브로 모 -4 - 메틸 펜 순수한 생성물은, 수율 89 %, 투명 오일로서 [α] D20 = +37 ° (메탄올), 1 H를 수득한다 (동일한 절차를 사용하여 L-로이신로부터 제조) 산 NMR δ 4.30 (400 MHz의,을 CDCl3) (t, J = 7.7 Hz에서, 1H), 1.94 (일, J = 10.8, 3.9 Hz에서, 2H), 1.81 (TT, J = 13.2, 6.5 Hz에서, 1H), 0.96 (일, J = 18.2, 6.6 Hz에서, 7H). (S) -2 - 브로 모 -3 -의 Phe의 경우nylpropanoic 폰산 (동일한 절차를 사용하여 L-페닐알라닌으로부터 제조) 순수한 생성물을 담황색 오일로서 수득 하였다, 수율 72 %, [α] D20 = +17 ° (메탄올), 1 H NMR (400 MHz의을 CDCl3) δ 7.38 - 7.19 (m, 5H), 4.42 (일, J = 8.1, 7.3 Hz에서, 1H), 3.47 (일, J = 14.2, 8.2 Hz에서, 1H), 3.25 (일, J = 14.2, 7.2 Hz에서, 1H).
트랜스 아미나 제를 사용하여 알라닌 3. 동위 원소 라벨링
조합 라이브러리 합성, 특히 한 비드 한 화합물 (OBOC) 라이브러리의 분할 및 풀 합성 각 비드로부터 얻을 수있다 화합물의 양은 상대적으로 작다. (일반적으로 1 pmol의 nmol의 10 행). 또한, 질량 스펙트럼에서 널리 인해 고감도로 최종 화합물의 동정 및 특성화에 사용된다. PTA 최종 제품의 키랄 중심에서의 절대 입체 화학을 결정하기 위하여 질량 분석계를 사용하기 위해, 브로 모 산 거울상 이성질체 동위 원소이어야pically 사용하기 전에 레이블. 여기에서 우리는 레이블 L-알라닌 트랜스 아미나 제 및 D 2 O를 사용하는 방법에 대해 설명합니다.
- 50 ml의 폴리에틸렌 튜브에서 D 2 O 10 mL로 L-알라닌 (300 ㎎, 3.36 밀리몰)을 녹인다. 공동 기질로 α-케토 글루 타르 산 (10 ㎎, 0.068 밀리몰)를 추가합니다. 37 ° C에 튜브를 따뜻하게하고 1 M NaOD의 soution를 사용하여 8.5-8.7에 PD를 조정합니다. 참고 : PD가 산도 테스트 스트립에 의해 결정된다. 기존의 전기 pH 미터는 H +에 대한 선택적 유리 전극을 갖춘 것은 줄 수 잘못 D의 +에 대한 판독.에게
- 8.7 이전 단계에서 준비 37 ° C의 솔루션을 - PD 8.5 (돼지 심장, 로슈 진단, 인디애나 폴리스, 인디애나에서 0.1 ㎎, EC 2.6.1.2) 알라닌 트랜스 아미나 제를 추가합니다. 37 ° C의 배양기에서 튜브를 넣고 약한 흔들림과 함께 하룻밤을 품어 10 ~ 30 RPM이 바람직하다.
- 하룻밤 배양 한 후, D 2 O 용액 0.5 mL를 취하여 1 H-NMR에 의해 반응의 진행 상황을 확인합니다. 모든 양성자 신호lanine는 3.76 δ (Q, J는 = 7.2 Hz에서, 1H), 1.46 (d, J = 7.3 Hz에서, 3H), 1 H NMR 400 MHz의, 크게 인해 중수소로 억제해야한다. 앞서 설명한 바와 같이 23 양성자의 98 % 이상이 중수소로 교환해야한다. 주 : D 2 반응물 대규모 행하면 O 부분적 (> 200 ㎖의 D 2 O) 증류에 의해 회수 할 수있다. 일반적으로, D 2 O의 80 % 내지 60 %의 용액으로부터 증류 될 수있다.
- 액체 질소로 상기 용액을 동결하고 백색 중수 소화 L-알라닌 분말을 수득 동결 건조기를 사용하여 냉동 건조.
펩 토이 드 링커 지역의 4. 합성
링커 영역은 PTA 라이브러리 합성에 필요하지 않습니다. 그러나, MALDI 질량 분광법의 저 분자량 범위 (100-600)에서 하이 백을 피하고 화합물의 이온화를 개선하기 위해, 다 극성 잔기와 펩 토이 링커가 종종 사용된다. 이 린 펩 토이 드KER 표준 펩 토이 합성 과정을 통해 합성 할 수있다. (그림 5 참조) 여기서 우리는 링커로 N-메 톡시 에틸 글리신의 펜타 머를 합성한다.
- 가벼운 흔들림과 함께 12 ML의 주사기 반응기에서 3 시간 동안 10 ㎖ DMF에 RAM 링커 이하 (1 g, 0.27 밀리몰 / g) 90 μm의 Tentagel 비즈 스웰.
- 반응기에서 DMF를 배출하고 스케이트장 아미드 링커에서 고체상 합성 그룹을 탈 보호하기 위해 10 ㎖의 20 % 피 페리 딘 DMF 솔루션을 추가합니다. 30 분 동안 20 % 피 페리 딘 용액으로 비드를 흔들어. 모든 피 페리 딘을 제거하기 위해 DMF 배 씻으시오.
- 주사기에서 몇 가지 구슬을 가지고 클로 라닐 테스트로 테스트합니다. 고체상 합성이 성공적으로 탈 경우 비즈 다크 브라운 (차 아민에 대한 긍정적 인 클로 라닐 테스트)을 설정해야합니다.
- . 다음과 같은 솔루션을 준비 : 1 20 ㎖, 2 M 브로 모 산 / DMF 용액; 2 20 ㎖, 2 M DIC / DMF 솔루션을 제공합니다.; 3. 10 ㎖, 1 M methoxylethylamine / DMF 솔루션입니다.
- 2 M 브로 모 산 / DMF 용액 5 ㎖를 추가구슬이 부드럽게 흔들어. 그런 다음 5를 추가 구슬 2 M DIC / DMF 용액 ML; 플런저와 주사기를 밀봉 통에 넣어. 10 분 동안 흔들어.
- 철저하게 DMF와 구슬을 씻으십시오. 비즈 단계 4.4에서 준비 1 M 메 톡시 / DMF 용액 2 ㎖를 추가합니다. 플런저와 주사기를 밀봉하고 30 분 동안 진탕 흔들어.
- DMF 배에 구슬을 씻으십시오. 양의 (구슬 푸른 색) 경우, 클로 라닐 테스트와 몇 가지 구슬을 확인, 다음 단계를 계속합니다. 그렇지 않으면, 단계 4.6를 반복합니다.
- 반복 4.7 4.5 단계, 펜타을 완료하기 위해 4 배.
. (R)와 PTA 라이브러리 플리트 앤 풀 합성 - 및 (S) -2 - 브로 모 산
여기에서 우리는 단계 4.8에서 구슬의 1g을 사용하여 9,261 화합물의 이론적 다양성 작은 PTA 라이브러리의 합성을 설명합니다. 90 μm의 tentagel 구슬 그램 당 약 290 만 비즈가 포함되어 있습니다; 따라서의 중복라이브러리는 2.9 × 10 6 / 9,261 = 312 복사 될 것입니다. 우리는 아 민화에 대한 (자세한 내용은 그림 5 참조, A1 ~ A7) 산, 그리고 7 개의 다른 아민 (S) 표시 브로 모 아세트산, (R) -2 - bromopropanoic 및 동위 원소-2-bromopropanoic 산 D 4를 사용합니다. 주사기 반응기 및 진공 매니 폴드 합성을 수행하는 데 사용될 것이다.
- 단계 4.8에서 주사기에 DMF; 1:1 DCM 10 ㎖를 추가 세 5 ML의 주사기 원자로에 균등하게 1g 구슬을 분할 절단 피펫 팁으로 1,000 μL 피펫을 사용합니다. ((S) -2 - 카복실산 bromopropanoic D-4) B (브로 모 아세트산), R ((R) -2 - bromopropanoic) 및 S로 레이블. DCM 배와 3 주사기를 세척하고, 무수 THF 배와 R과 S로 표지 주사기를 씻어 DMF 배와 B로 표시된 주사기를 씻어.
- 주사기 R과 S. bromopropanoic 산의 BTC 커플 링.
- 신선한 BTC / THF 용액을 준비합니다. 추가pproximately 흄 후드에서 유리 병에 BTC 200 ㎎을, 캡으로 밀봉. 바이알 BTC의 양을 단다. 필요한 용매의 양을 계산하여 20 ㎎ / ㎖ BTC / THF 용액을 만들기 위해 유리 병에 무수 THF를 추가한다.
- 브로 모 산 / BTC 혼합물을 준비합니다. (R) -2 - bromopropanoic 산 (89 μL, 0.95 밀리몰)을 추가하고 (S)-2-bromopropanoic 별도이 작은 튜브의 산 - D 4 (89 μL, 0.95 밀리몰). 각각의 병에, 위의 20 ㎎ / ㎖ BTC / THF 용액 5 ㎖를 추가합니다. 두 개의 유리 병을 밀봉하고 20 분 -20 ° C의 냉동고에 넣어.
- 개별적으로 R과 S를 주사기 1,125 μL 2:1 THF / DIPEA (750 μL의 THF, 375 μL의 DIPEA, 2.2 밀리몰)를 추가합니다. 피펫 팁으로 구슬을 섞는다. 그 5 분 동안 앉아 보자.
- 두 단계 5.2.2에서 브로 모 산 / BTC 혼합물을 냉각 가지고 각각의 유리 병에 2,4,6 - 트리메틸 (356 μL, 2.7 밀리몰)를 추가합니다. 백색 침전물이 즉시 형성된다. 직접 해당 서스펜션을 적용합니다가능한 한 빨리 다음 2 시간 동안 120 rpm으로 진탕하는 통에 넣어 염기 화 비즈 (단계 5.2.3에서 주사기 R과 S)에.
참고 : 주사기 반응기에서 반응 용액의 전체 과정 동안 담황색 현탁액이어야한다. 어두운 색은 산 클로라이드 용액의 초기 첨가 중에 과도한 열 방출의 표시이다. 이는 상기 냉각에 의해 해결 또는 브로 산 / BTC 혼합물을 희석 할 수있다.
- 주사기 B. DIC와 브로 모 아세트산 커플
- 신선한 20 ㎖, 2 M 브로 모 산 / DMF 용액을 준비합니다. 20 ㎖, 2 M DIC / DMF 용액을 준비합니다.
- 2 M 브로 모 산 / DMF 용액 ㎖를 B 주사기 2를 추가, 부드럽게 흔들어. 2 M DIC / DMF 용액 ㎖를 B 주사기 2를 추가, 부드럽게 흔들어.
- 주사기 R 및 S와 같은 통에 주사기 B를 넣고 , 2 시간 동안 흔들어. 브로 모 아세트산 / DIC의 커플 링 반응은 30 분 내에 완료 참고; 장기간의 반응 시간은 분할 및 풀 합성의 편의를위한 것입니다.
- 2 시간 후, 쉐이커에서 주사기 R, S와 B를 가지고. DCM 배 충분히 세 주사기를 씻으십시오. 그런 DMF 배, 세척. 그 주사기 R과 S가 처음 DCM 또는 THF로 세척하기 전에 DMF로 세척 할 수 없습니다.
- 풀 주사기 R, S와 B의 모든 구슬 한 12 ML의 주사기 반응기에. DMF 배에 모든 구슬을 씻으십시오.
- 주사기에 DMF; 1:1 DCM 10 ㎖를 추가 7 각각 2 ㎖ 주사기에 균등하게 구슬을 분할 A1-A7로 라벨을 절단 피펫 팁으로 1,000 μL 피펫을 사용합니다.
- 아미 노화. 10 ㎖, 그림 5에 나와있는 7 아민 각각에 대한 2 차 아민 M / DMF 솔루션을 준비합니다. EAC의 5 ML을 추가해당 주사기 A1-A7에 H 아민 솔루션입니다. 밤새 떨고와 60 ° C 배양기에있는 7 주사기를 품어.
- 배양 후, DMF로 충분히 모든 구슬을 씻는다. 각 주사기에서 구슬의 몇 가지를 가지고 클로 라닐 테스트 확인하십시오. 구슬이 3 분 안에 녹색 (양)를 설정 한 경우, 다음 단계를 진행합니다. 음의 경우, 부정적인 주사기 단계 5.7를 반복합니다.
- 반복 트리머를 완료하기 위해 5.1 배 ~ 5.8 단계를 반복합니다. 선택 단계 : 각 사이클 후, 우리는 아래에 설명 된대로 질량 분석에 의해 합성의 품질을 확인하는 것이 좋습니다. 전체 9,261 화합물은 지금 OBOC 라이브러리와 tentagel 비즈에서 합성된다.
- 학부모 교사 협의회의 질량 분광 확인.
학부모 교사 협의회는 고도로 구조화 된 올리고머이며, N-메틸화 펩티드의 많은 일반적인 기능을 가지고있다. N-메틸화 펩타이드의 고체상 합성의 일반적인 문제 중 하나는 TFA 절단 도중 산 분해이다. 산 분해, 사이클로스포린과 같은 분자의 분열에서을 억제하려면고체 담체는 종종 저온 하에서 수행된다. 우리는 고체 지지체에서 다른 PTA 분자를 쪼개기위한 다양한 클 리빙 조건을 비교했다. 우리는 일반적으로 낮은 온도 감소 TFA 농도가 효과적으로 산성 저하를 억제하고 순수한 화합물을 제공 할 수 있다는 것을 발견 할 수 있었다.- 10 ㎖를 15 ㎖의 튜브 1:1 TFA / DCM 솔루션을 준비합니다. 튜브를 밀봉하고 20 분 동안 -20 ° C 냉동고에 넣어.
- DCM 배로 절단 할 필요가있는 구슬을 씻으십시오. 15 분 동안 DCM의 구슬을 흔들어 DCM 배 다시 구슬을 씻는다.
- 주사기에서 DCM을 배출. 물론 당 96 - 웰 플레이트, 하나의 구슬에 각각의 구슬을 전송 잘린 끝으로 광학 현미경과 피펫을 사용합니다.
- 커버 슬립과 함께 96 - 웰 플레이트를 커버. 15 분 -20 ° C 냉동고에 접시를 넣어.
- 단계 5.10.1에서 냉각 1시 1분 TFA / DCM 솔루션을 가지고 구슬이 들어있는 각 웰에 20 μl를 추가합니다. 뒤로 우레탄 커버 슬립을 넣어T -20 ° C 냉장고에있는 통에 96 - 웰 플레이트.
- 20 분 동안 흔들어. 중 96 - 웰 플레이트를 타고 커버 슬립을 벗겨. 불어 건조 위에 공기 또는 아르곤을 불어 각 우물에서 TFA / DCM을. 10 개 이상의 비드를 절단 한 경우를 Speedvac 전체 플레이트로부터 TFA / DCM을 건조하는데 사용될 수있다. 이 시점에서, 모든 화합물이 비드를 절단되지만, 절단 된 화합물은 질량 분광 분석을 수행 충분해야합니다.
- H 2 O 솔루션을 각 우물에서 절단 된 화합물을 용해 : 20 μL 6시 4분 ACN을 추가합니다. 함께 MALDI 접시에 0.6 ㎕의 CHCA MALDI 매트릭스 각 화합물 용액의 0.6 μl를 스팟.
- 각 화합물의 분자량과 순서 (MS / MS)를 결정하기 위해 MALDI 질량 분석기를 사용합니다.
6. 클로 라닐 테스트
- 각 시험에 대한 다음과 같은 시약은 신선한 준비합니다. 솔루션 : 2 % 클로 라닐 (CAS : 118-75-2) DMF에. 해결B : 2 % 아세트 알데히드 (CAS : 75-07-0) DMF에.
- 1.5 ML 튜브에서 테스트하기 전에 솔루션 B의 100 μL와 솔루션 100 μl를 혼합; 에 구슬을 떨어 뜨려 가볍게 흔들어. 구슬이 5 분 안에 푸른 색 경우, 구슬의 표면에 차 아민의 존재를 나타냅니다. 주 아민 대신 파란색을 돌려 어두운 갈색 색상을 제공합니다.
결과
여기에서 우리는 링커와 PTA 트리머에서 세 대표 MALDI 스펙트럼을 보여줍니다. 도 6a에 도시 된 바와 같이 50 % TFA / DCM 용액을 사용하여 실온하에 절단 될 때, 상당한 저하가 관찰된다. 그림 6a에, 593 피크와 484은 전체 분자가 성공적으로 구슬에 합성하지만 분열하는 동안 저하 된 것을 보여 각각 링커와 PTA 트리머에 해당합니다. 전술 한 바와 같이, 저온 조건에서 절단하면도 6b에 도시 된 바와 같이, TFA 유도 열화 량은 크게 억제된다. 이러한 분열의 메커니즘은 이전 문헌 24에 기재되어 있으며, 이는 옥사 졸리 딘 중간 통과 여겨진다. PTA 분자는 MS / MS에 의해 서열화 될 수 있고,도 6c에 도시 된 바와 같이 단편화 패턴은, 펩티드 및 peptoids 유사하다. 와 (S)-2-bromopropanoic 일반적으로 산 - D 4 g 합성 PTA 분자때문에 이러한 -2 - bromopropanoic (S) 등의 산 D 3 불완전 중수소 제품 (도 7a 및도 7b)의 존재에 MS 및 MS / MS 스펙트럼에 넓은 피크를 필자. 이 순서의 절차를 수행하는 동안 (아미 노화하는 동안 S에서 반전) R의 키랄 센터의 존재의 표시로 사용 될 수 있습니다. 우리는 또한 PTA 분자 따라서 낮은 나트륨 물 (예 dionized 물 등) 및 성형 장치는 (도 7c) 바람직하고, 펩 토이 / 펩티드보다 sodiated 부가 물을 형성하는 경향이 발견. 부산물 PTA 합성에서 관찰 될 수있는 또 다른 아 민화 동안 브로마이드의 제거 (그림 7C)에서 형성되는 아크릴 아미드이다. 아크릴 아미드가 형성되면, 시퀀스가 종료된다. 이것은 용액의 염기도를 줄이기 위해 1 M 행 차 아민의 농도를 낮춤으로써 해결 될 수있다. 우리는 각 실화 단계 이후 클로 라닐 테스트를 수행 대량 spectr를 사용하는 것이 좋습니다라이브러리의 품질을 보장하기 위해 각 민화 단계 후에 상품을 확인 oscopy.
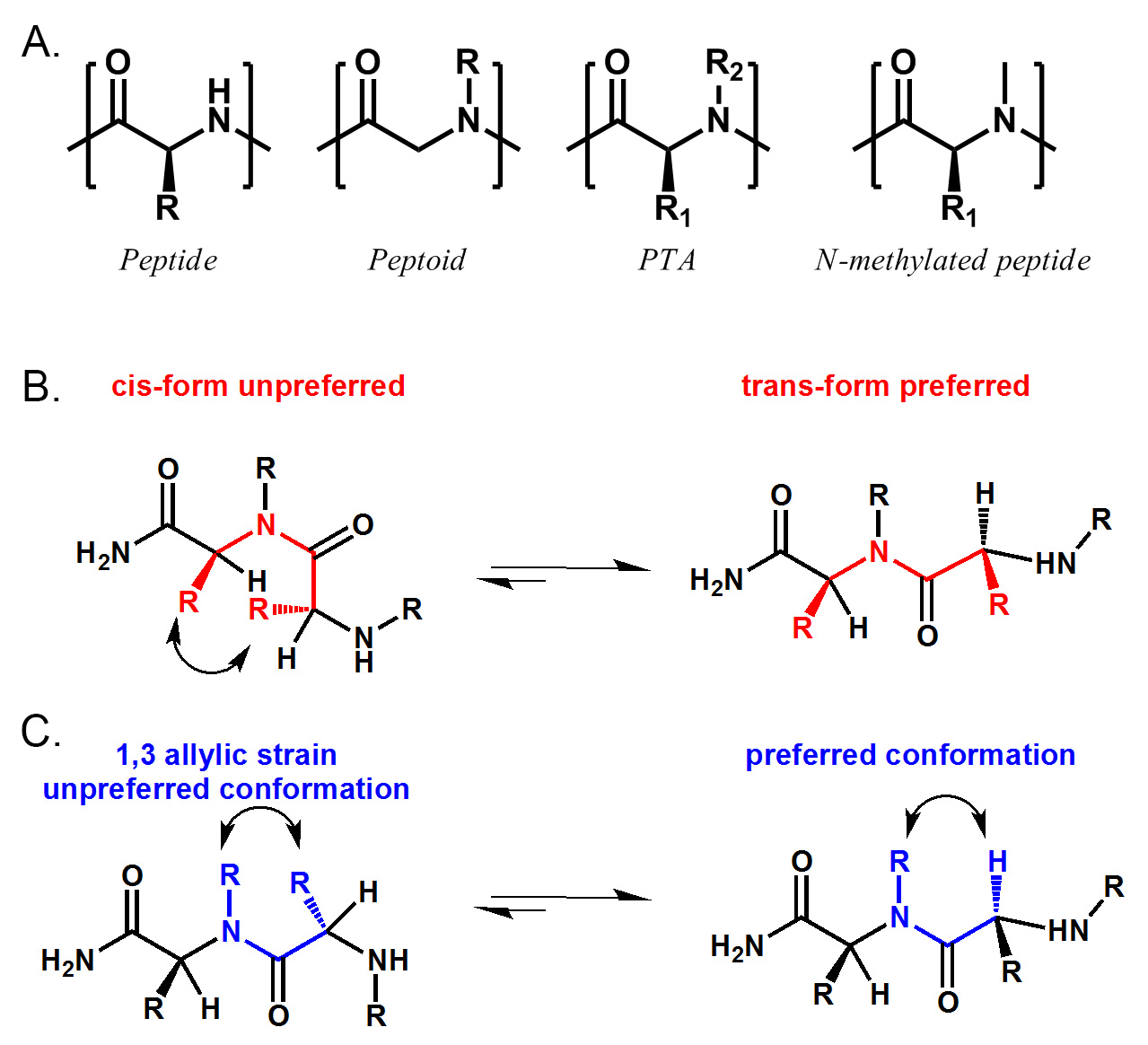
펩티드, 펩 토이 드, PTA 및 N-메틸화 펩타이드의 그림 1. 구조 비교. PTA 펩타이드 (R 2 = H)를 포함, 펩 토이 드 (R 1 = H) 및 N-메틸화 펩타이드 (R 1 ≠ H, R 2가 나를 =) . B) PTA 인해 두 개의 α-사이드 체인 사이의 sterical 방해에 트랜스 아미드 결합의 형태를 선호한다. C) PTA가 인해 N-대체 및 α-사이드 체인 사이에 1,3 알릴 긴장을 선호하는 형태가 있습니다. 여기를 클릭하십시오 이 그림의 더 큰 버전을 볼 수 있습니다.
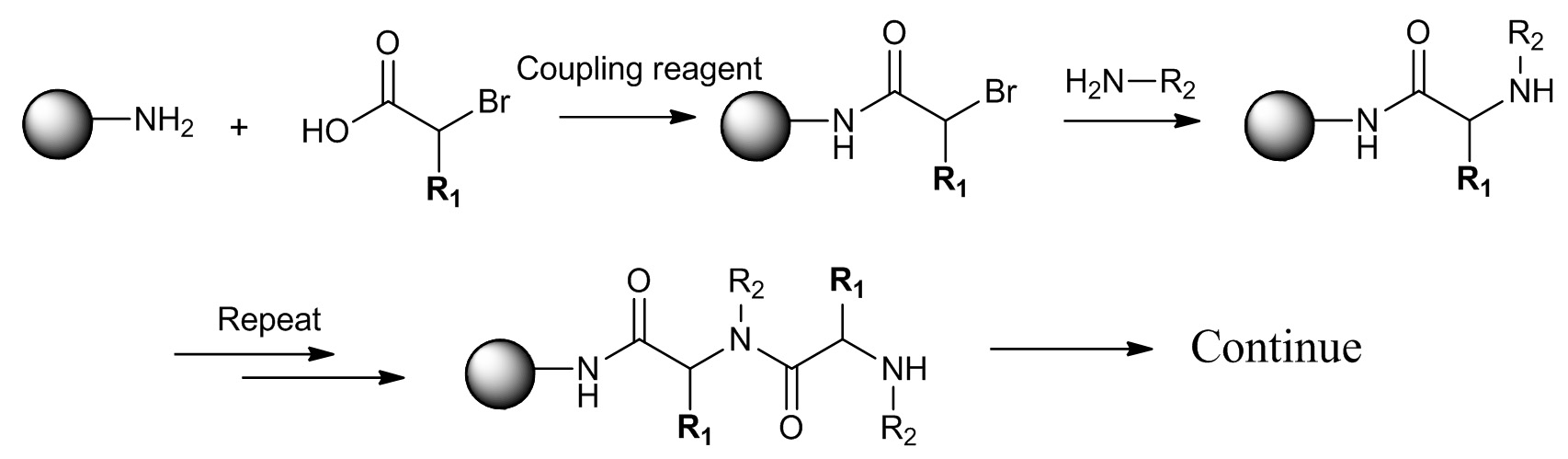
펩 토이 드의 그림 2. 하위 단량체 합성 (R 1 = H) 및 PTA (R ≠ 1 H). 첫 번째 단계는 아민의 산 실화이다. 두 번째 단계는 주 아민과 아 민화입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
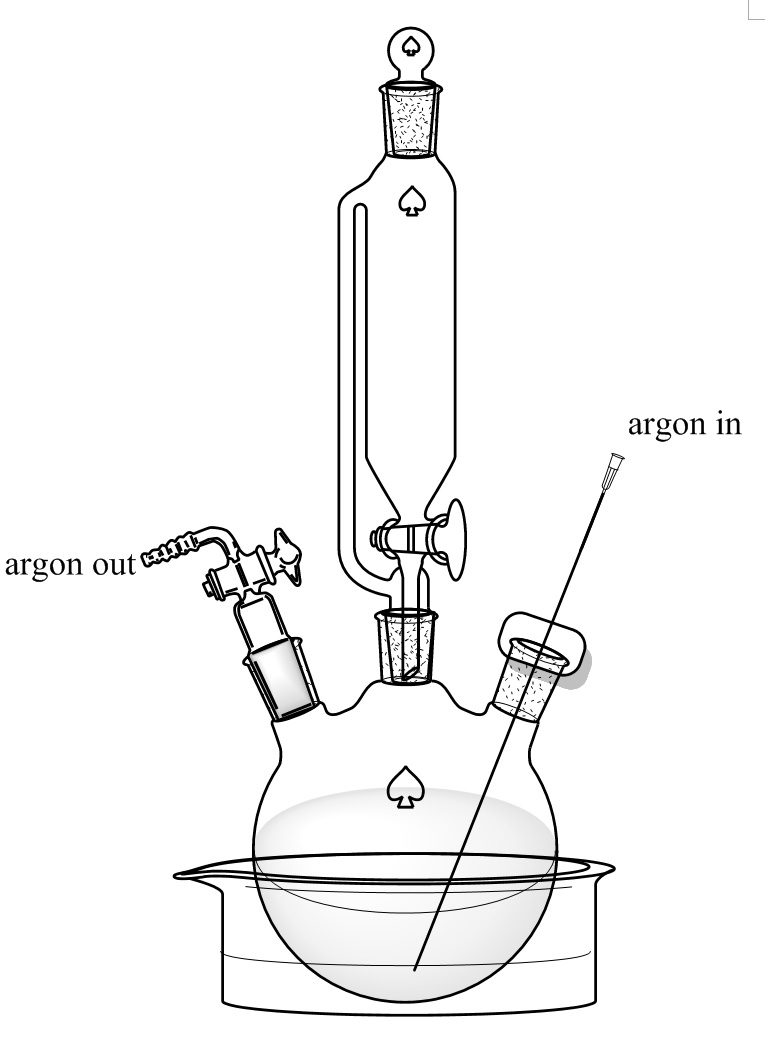
도 3. 반응 셋업은. 250 ㎖의 3 구 둥근 바닥 플라스크를 드라이 아이스 / 에틸렌 글리콜 욕에 넣을. 중간 넥 적하 깔때기 등화 150ml의 압력으로 접속된다. 좌우의 목은 흐름 제어 어댑터 및 격막으로 밀봉된다 w아르곤의 흐름이 통과 할 수있는 긴 바늘 i 번째. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
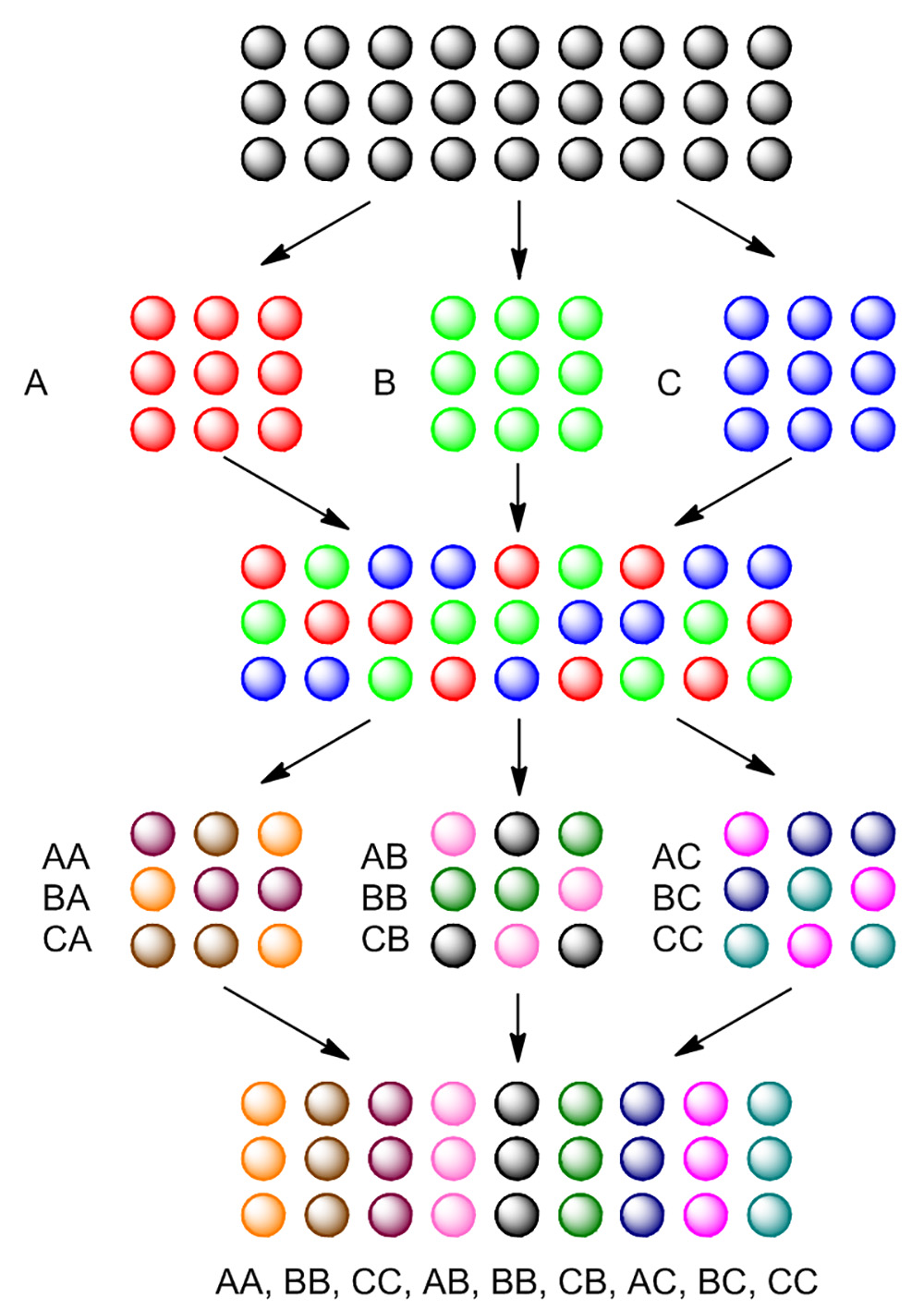
그림 4. 분할 및 풀 합성의 기초. 빈 구슬이 반응과 별개로 세 개의 부분에 분할, B와 C의 첫 번째 반응 후, 구슬의 세 부분은 서로 혼합 풀링됩니다. 풀링 된 구슬은 세 부분으로 다시 분할하고 다시 각각의 부분에 대해 같은 반응으로 처리됩니다. 두 번째 반응 후, 9 개의 다른 화합물이 합성된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. 라이브러리 구조 개요. 세 학부모 교사 협의회는 펜타 머 펩 토이 드 링커 후 합성된다. 이론적 다양성, 3 X 7 3 = 9,261. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
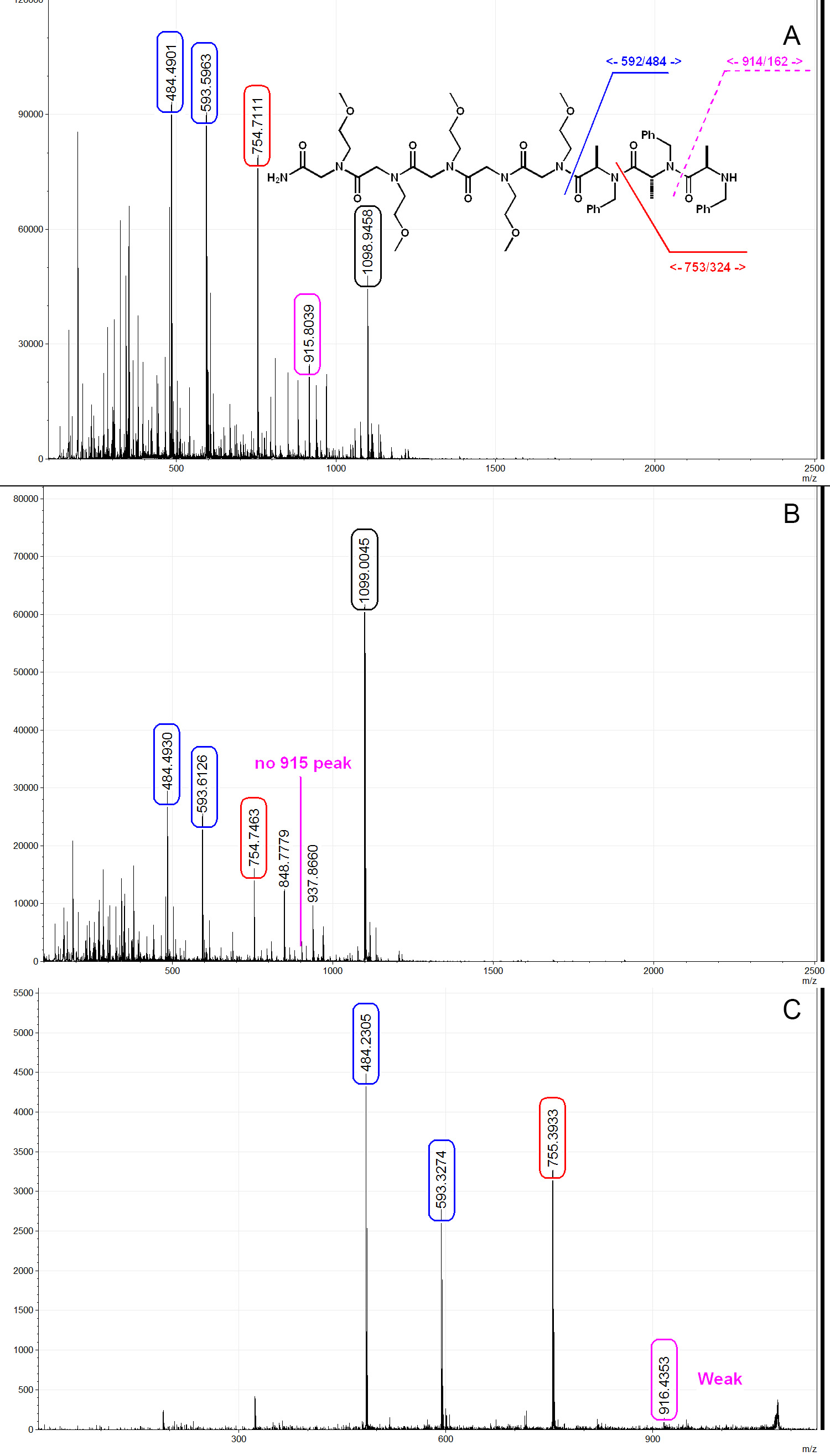
그림 6..) 트라이 머 PTA는 실온에서 50 % TFA / DCM에 의해 절단 PTA 트리머의 전형적인 MALDI 질량 스펙트럼. 같이 PTA 구조, [M +1] + = 1,077, [M + 나] + = 1,098.9, TFA 분열에서 PTA 조각화 명확 스펙트럼. B) 트라이 머 cleav에서 볼 수 있습니다종이의 설명에 따라 최적화 된 조건에서 50 % TFA / DCM에 의해 에드. TFA-유도 산 저하는 크게 PTA 트리머. C) MS / MS 스펙트럼을 억제한다. 약 Y7 (916) 신호가 관찰되어,이 학부모 교사 협의회의 일반적인 조각 동작입니다. 스펙트럼 분석 및 mMass (32)에 의해 생성 된. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

동위 원소 표지 된 단량체 및 부산물 전형적인와 PTA의 합성 그림 7. MALDI 스펙트럼. 파란색으로 합성 PTA 분자 A) MS 스펙트럼 비교 : (R) -2 - bromopropanoic [M +1] + = 760 [M + 나] + = 787 [M + K] + = 803 레드 (S) - 2 bromopropanoic 산 D 4 [M +1] + = 764 [M + 나] + = 783 [M + K] + = 799. B)에 도시 된 두 분자의 MS / MS 단편화 패턴). . PTA의 스펙트럼 : 인해 D 1, D 2와 D 3 향신료 (알라닌 불완전 중수소),로 (S)-2-bromopropanoic 산 D 4 합성 분자의 존재로 일반적으로 C) 레드 넓은 피크를 제공합니다 이량 체 합성 및 최적화 된 상태에서 절단. 블루 :. PTA 이합체는 2 M 메 톡시 에틸 아민 용액을 합성하고 정상 여과 물에 절단 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
펩타이드 차 아미드 (학부모 교사 협의회)는 펩티 올리고머의 슈퍼 패밀리입니다. 잘 공부 펩타이드, peptoids 및 N-메틸화 펩티드 게다가,이 가족 내에서 화합물의 큰 부분은 할 majorly 때문에 일반적으로 N-알킬화 펩타이드 액세스 할 수있는 합성 방법의 부족으로 understudied 아르 남아있다. 여기에서 우리는 아미노산에서 파생 된 키랄 빌딩 블록과 학부모 교사 협의회를 합성하는 효율적인 방법을 설명합니다. 이전에, 우리는 PTA 분자 (23)의 합성 라이브러리에 새 하위 단량체 경로를 사용하는 것으로보고있다. 우리는 학부모 교사 협의회의 백본을 통해 구조적 제지을 가지고 고도로 구조화 된 올리고머 것으로 나타났습니다. 생체 내에서 시험 할 때 PTA 분자는 개선 된 세포 투과성 따라서 향상된 활성을 보여 주었다 (25). 그러나 함께 모든 장점과 함께, 학부모 교사 협의회는 할 majorly 방해 된 위치에서 2 급 아민의 실화에서 일부 합성 문제와. 구조적 제공하는 α-사이드 체인제한은 다음 커플 링 단계의 입체 장애를 가져온다. 이러한 합성 과제를 극복하기 위해, 우리는 광범위한 최적화 연구를 수행하고이 반응을 (23)에 대한 유용한 커플 링제로서 BTC를 결정.
합성 경로의 중요한 단계는 BTC가 차 아민의 아 실화를 촉진된다. 이 과정은 BTC 시츄 26,27에서 산 클로라이드의 생성을 가능하게한다. 중간 활성 에스테르 또는 산 무수물 중 하나를 형성하는 대부분의 다른 커플 링 시약, 연속 PTA 합성을위한 깨끗한 실화를 제공하지 못했습니다. 이전 PTA 단위의 존재는 매우 입체 장해로 인해 다음과 같은 PTA 유닛의 결합 효율을 손상시킨다. 따라서, 여러 회의 혈관 확장술, 작은 방치 그룹과 고 활성 중간체의 합성에 대해 강하게 선호된다. BTC는 BES 작동에 의해 우리가 테스트 한 모든 커플 링 조건 중, 현장에서 산 염화물을 생성우리의 손에 t. 그러나, 고 활성 산 염화물, 우리는 사전에 테스트를하지 않는 등의 라이브러리 합성에 α-분기 주 아민이 높은 sterical 장애 아민을 방지하는 것이 좋습니다. 같은 노파 등의 방향족 아민은 종종 불완전 대체 선수로 이어질 따라서도 피해야한다. BTC 커플 링 단계 동안, 용액을 항상 오렌지 색에 담황색이어야한다; 어두운 색의 솔루션은 과열의 표시이며, 낮은 수율 및 부산물의 증가 형성 될 수 있습니다. 이것은 일반적 BTC 용액의 추가 냉각에 의해 해결 될 수 있으며, 반응의 크기와 활성 BTC / 산 용액의 빠른 전송을 감소시킨다. BTC 외에, N-에 톡시 카르 보닐 -2 -에 톡시 -1,2 - 디 하이드로 퀴놀린 (EEDQ)는 PTA 합성에서 잘 작동 다른 커플 링제이다. 핵심 중간체는 비교적 작은 방치 그룹과 혼합 탄산 무수물이다. EEDQ의 경우, EEDQ 3 당량이어서 DCM에서 산 및 AP와 함께 녹이고실온에서 비즈 부지런히. 반응은 일반적으로 가벼운 흔들림과 함께 2 시간 내에서 수행된다. 이 반응은 반응 동안 CO 2 릴리스; 따라서 반응 시스템은 폐쇄 할 수 없습니다.
또 다른 중요한 단계는 절단 및 PTA 분자의 특성이다. MALDI-MS/MS (그림 6)를 통해 PTA 분자를 시퀀싱 할 때 특유의 MS / MS 단편화 패턴이 관찰되었다. 그것은 (그림 6c에 보라색에 도시 및 Y6, Y5, Y4, B2, B3 이온의 증가 강도) 마지막 Y 이온의 낮은 강도로 구성되어 있습니다. 유사한 패턴은 이전 보고서 28 N-메틸화 펩타이드 조각에서 관찰되었다. 때문에 중간 옥사 졸리의 증가 된 안정성으로, N-메틸화 펩티드는 강한 이온 B 28을주는 경향이있다. 게다가, 그것은 또한, N-메틸화 펩티드 TFA 절단 및 MALDI 질량 분광법 24 둘 중에 산에 불안정한 것으로 알려져28, 29. 역학적 연구에 의한 주쇄에 구조적 제한으로, 선행 잔기의 카르 보닐 산소 원자 따라서 중간체 29 옥사 졸리의 형성을 촉진, 절단 부위에서 카르보닐기 근접있는 종종임을 보여 주었다. 상기 이유로, 두 회의 혈관 확장술 및 N-메틸화 펩타이드는 TFA (26), (30)의 제어 된 농도를 이용하여 저온에서 고체 지지체로부터 분해 될 필요가있다. 우리의 경험에 의하면, 개인의 PTA 잔류을위한 가장 편리한 절단 방법은 50 % TFA / DCM의 사전 냉각, -20 ° C 솔루션으로 -20 ° C에서 발생한다. 이 절차는 크게 저하 산성 제품의 형성을 억제한다.
이 기술을 습득 한 후, 등등 로이신, 페닐 알라닌, 글루타민, 다른 천연 아미노산으로부터 유도 PTA 단량체와 라이브러리뿐만 아니라 합성 할 수있다. 고품질 PTA 라이브러리 AG를 스크리닝 할 수있다우리는 이전에 출판에 구슬 심사 프로토콜 31을 사용하여 다양한 단백질 표적을 ainst. 스크리닝에서 확인 된 화합물 적중은 질량 분광법에 의해 특징 및 전술 한 프로토콜을 사용하여 추가 시험을 위해 재 합성 될 수있다.
공개
저자는 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
감사의 말
저자는 가치있는 도움 박사 Jumpei 모리모토 박사 토드 도란에게 감사의 말씀을 전합니다. 이 작품은 NHLBI (NO1-HV-00242)에서 계약에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 2,4,6 trimethylpyridine | ACROS | 161950010 | CAS:108-75-8 |
| 2-morpholinoethanamine | Sigma-Aldrich | 06680 | CAS:2038-03-1 |
| 48% HBr water solution | ALFA AESAR | AA14036AT | CAS:10035-10-6 |
| Acetaldehyde | Sigma-Aldrich | 402788 | CAS:75-07-0 |
| Acetonitrile | Fisher | SR015AA-19PS | CAS:75-05-8 |
| Anhydrous tetrahydrofuran (THF) | EMD | EM-TX0277-6 | CAS:109-99-9 |
| Benzylamine | Sigma-Aldrich | 185701 | CAS:100-46-9 |
| bis(Trichloromethyl) carbonate (BTC) | ACROS | 258950050 | CAS:32315-10-9 |
| Bromoacetic acid | ACROS | 106570010 | CAS:79-08-3 |
| Chloranil | Sigma-Aldrich | 23290 | CAS:118-75-2 |
| Cyclohexanemethylamine | Sigma-Aldrich | 101842 | CAS:3218-02-8 |
| D2O | Cambridge Isotope | DLM-4-99.8-1000 | CAS:7789-20-0 |
| D-Alanine | Anaspec | 61387-100 | CAS:338-69-2 |
| Dichloromethane (DCM) | Fisher | BJ-NS300-20 | CAS:75-09-2 |
| Dimethylformamide (DMF) | Fisher | BJ-076-4 | CAS:68-12-2 |
| Ethylene glycol | Oakwood | 44710 | CAS:107-21-1 |
| Isopentylamine | Sigma-Aldrich | W321907 | CAS:107-85-7 |
| KBr | ACROS | 424070025 | CAS:7758-02-3 |
| L-Alanine | Anaspec | 61385-100 | CAS:56-41-7 |
| 3-Methoxypropylamine | Sigma-Aldrich | M25007 | CAS:5332-73-0 |
| 2-Methoxyethylamine | Sigma-Aldrich | 143693 | CAS:109-85-3 |
| N-(3-Aminopropyl)-2-pyrrolidinone | Sigma-Aldrich | 136565 | CAS:7663-77-6 |
| N,N'-Diisopropylcarbodiimide (DIC) | ACROS | 115211000 | CAS:693-13-0 |
| N,N-Diisopropylethylamine (DIPEA) | Sigma-Aldrich | D125806 | CAS:7087-68-5 |
| NaNO2 | ACROS | 424340010 | CAS:7631-99-4 |
| NAOD 40% solution in water | ACROS | 200058-506 | CAS:7732-18-5 |
| Piperidine | ALFA AESAR | A12442-AE | CAS:110-89-4 |
| Piperonylamine | Sigma-Aldrich | P49503 | CAS:2620-50-0 |
| Propylamine | Sigma-Aldrich | 240958 | CAS:107-10-8 |
| Trifluoroacetic acid | Sigma-Aldrich | 299537 | CAS:76-05-1 |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | 39468 | CAS:28166-41-8 |
| α-Ketoglutarate | ALFA AESAR | AAA10256-22 | CAS:328-50-7 |
| Tentagel Resin with RINK linker | Rapp-Polymere | S30023 | |
| Alanine transaminase | Roche | 10105589001 | AKA: Glutamate-Pyruvate Transaminase (GPT) |
| Incubator | New Brunswick Scientific | Innova44 | |
| NMR | Bruker | 400 MHz | |
| MALDI mass spectrometer | Applied Biosystems | 4800 MALDI-TOF/TOF | |
| Lyophilizer | SP Scientific | VirTis benchtop K | |
| Syringe reactor | INTAVIS | Reaction Column | 3 ml, 5 ml, 10 ml, 20 ml |
| Vacuum manifold | Promega | A7231 | Vac-Man |
참고문헌
- Xiao, X., Yu, P., Lim, H. -. S., Sikder, D., Kodadek, T. Design and Synthesis of a Cell-Permeable Synthetic Transcription Factor Mimic. Journal of Combinatorial Chemistry. 9, 592-600 (2007).
- Miller, S. M., et al. Proteolytic Studies of Homologous Peptide and N-Substituted Glycine Peptoid Oligomers. Bioorganic & Medicinal Chemistry Letters. 4, 2657-2662 (1994).
- Grauer, A., Konig, B. Peptidomimetics - A Versatile Route to Biologically Active Compounds. European Journal of Organic Chemistry. 30, 5099-5111 (2009).
- Zuckermann, R. N., Kerr, J. M., Kent, S. B. H., Moos, W. H. Efficient method for the preparation of peptoids [oligo(N-substituted glycines)] by submonomer solid-phase synthesis. Journal of the American Chemical Society. 114, 10646-10647 (1992).
- Figliozzi, G. M., Goldsmith, R., Ng, S. C., Banville, S. C., Zuckermann, R. N. Synthesis of N-substituted glycine peptoid libraries. Methods in Enzymology. 267, 437-447 (1996).
- Seebach, D., et al. beta-peptides: Synthesis by Arndt-Eistert homologation with concomitant peptide coupling. Structure determination by NMR and CD spectroscopy and by X-ray crystallography. Helical secondary structure of a beta-hexapeptide in solution and its stability towards pepsin. Helv Chim Acta. 79, 913-941 (1996).
- Lam, K. S., et al. A New Type of Synthetic Peptide Library for Identifying Ligand-Binding Activity. Nature. 354, 82-84 (1991).
- Simon, R. J., et al. Peptoids - a Modular Approach to Drug Discovery. Proceedings of the National Academy of Sciences of the United States of America. 89, 9367-9371 (1992).
- Burkoth, T. S., et al. Toward the synthesis of artificial proteins: the discovery of an amphiphilic helical peptoid assembly. Chem Biol. 9, 647-654 (2002).
- Alluri, P. G., Reddy, M. M., Bachhawat-Sikder, K., Olivos, H. J., Kodadek, T. Isolation of protein ligands from large peptoid libraries. Journal of the American Chemical Society. 125, 13995-14004 (2003).
- Lim, H. S., Archer, C. T., Kodadek, T. Identification of a peptoid inhibitor of the proteasome 19S regulatory particle. Journal of the American Chemical Society. 129, 7750-7751 (2007).
- Wrenn, S. J., Weisinger, R. M., Halpin, D. R., Harbury, P. B. Synthetic ligands discovered by in vitro selection. Journal of the American Chemical Society. 129, 13137-13143 (2007).
- Aina, O. H., Marik, J., Liu, R. W., Lau, D. H., Lam, K. S. Identification of novel targeting peptides for human ovarian cancer cells using "one-bead one-compound" combinatorial libraries. Mol Cancer Ther. 4, 806-813 (2005).
- Udugamasooriya, D. G., Dineen, S. P., Brekken, R. A., Kodadek, T. A Peptoid “Antibody Surrogate” That Antagonizes VEGF Receptor 2 Activity. Journal of the American Chemical Society. 130, 5744-5752 (2008).
- Shah, N. H., et al. Oligo( N-aryl glycines): A New Twist on Structured Peptoids. Journal of the American Chemical Society. 130, 16622-16632 (2008).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proceedings of the National Academy of Sciences of the United States of America. 105, 2794-2799 (2008).
- Paul, B., et al. N-Naphthyl Peptoid Foldamers Exhibiting Atropisomerism. Organic Letters. 14, 926-929 (2012).
- Crapster, J. A., Guzei, I. A., Blackwell, H. E. A peptoid ribbon secondary structure. Angewandte Chemie. 52, 5079-5084 (2013).
- Gorske, B. C., Stringer, J. R., Bastian, B. L., Fowler, S. A., Blackwell, H. E. New strategies for the design of folded peptoids revealed by a survey of noncovalent interactions in model systems. J Am Chem Soc. 131, 16555-16567 (2009).
- Stringer, J. R., Crapster, J. A., Guzei, I. A., Blackwell, H. E. Extraordinarily robust polyproline type I peptoid helices generated via the incorporation of alpha-chiral aromatic N-1-naphthylethyl side chains. J Am Chem Soc. 133, 15559-15567 (2011).
- Huang, K., et al. A threaded loop conformation adopted by a family of peptoid nonamers. Journal of the American Chemical Society. 128, 1733-1738 (2006).
- Lee, J. H., Kim, H. S., Lim, H. S. Design and Facile Solid-Phase Synthesis of Conformationally Constrained Bicyclic Peptoids. Organic Letters. 13, 5012-5015 (2011).
- Gao, Y., Kodadek, T. Synthesis and Screening of Stereochemically Diverse Combinatorial Libraries of Peptide Tertiary Amides. Chem Biol. 20, 360-369 (2013).
- Urban, J., Vaisar, T., Shen, R., Lee, M. S. Lability of N-alkylated peptides towards TFA cleavage. Int J Pept Protein Res. 47, 182-189 (1996).
- Rzuczek, S. G., Gao, Y., Tang, Z., Thornton, C. A., Kodadek, T., Disney, M. D. Features of Modularly Assembled Compounds That Impart Bioactivity Against an RNA Target. ACS Chemical Biology. 8 (10), 2312-2321 (2013).
- Thern, B., Rudolph, J., Jung, G. Triphosgene as highly efficient reagent for the solid-phase coupling of N-alkylated amino acids—total synthesis of cyclosporin O. Tetrahedron Letters. 43, 5013-5016 (2002).
- Sleebs, M. M., Scanlon, D., Karas, J., Maharani, R., Hughes, A. B. Total Synthesis of the Antifungal Depsipeptide Petriellin A. J Org Chem. 76, 6686-6693 (2011).
- Vaisar, T., Urban, J. Gas-phase fragmentation of protonated mono-N-methylated peptides. Analogy with solution-phase acid-catalyzed hydrolysis. Journal of Mass Spectrometry. 33, 505-524 (1998).
- Creighton, C. J., Romoff, T. T., Bu, J. H., Goodman, M. Mechanistic studies of an unusual amide bond scission. Journal of the American Chemical Society. 121, 6786-6791 (1999).
- Sewald, N., Sewald, N. Efficient, racemization-free peptide coupling of N-alkyl amino acids by using amino acid chlorides generated in situ--total syntheses of the cyclopeptides cyclosporin O and omphalotin A. Angewandte Chemie (International ed. in English). 41, 4661-4663 (2002).
- Astle, J. M., et al. Seamless Bead to Microarray Screening: Rapid Identification of the Highest Affinity Protein Ligands from Large Combinatorial Libraries. Chem Biol. 17, 38-45 (2010).
- Strohalm, M., Kavan, D., Novak, P., Volny, M., Havlicek, V. mMass 3: a cross-platform software environment for precise analysis of mass spectrometric data. Anal Chem. 82, 4648-4651 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유