Method Article
Split-and-Pool-Synthese und Charakterisierung von Peptid-Amid-Tertiär-Bibliothek
In diesem Artikel
Zusammenfassung
Peptid tertiäre Amide (PTA) sind eine Superfamilie von Peptidmimetika umfassen, sind aber nicht auf Peptide, Peptoide und N-methylierten Peptide beschränkt. Hier beschreiben wir eine Synthesemethode, die sowohl Split-and-Pool-und Sub-Monomer-Strategien kombiniert, um eine ein-Bead-one-Verbindung Bibliothek von PTAs synthetisieren.
Zusammenfassung
Peptidmimetica sind große Quellen von Protein-Liganden. Die oligomeren Natur dieser Verbindungen ermöglicht uns, große Kunstbibliotheken an fester Phase mit Hilfe kombinatorischen Chemie zugreifen. Eine der am besten untersuchten Klassen von Peptidomimetics ist Peptoiden. Peptoide sind leicht zu synthetisieren und haben gezeigt, dass die Proteolyse fest und zelldurchlässig sein. Im Laufe des letzten Jahrzehnts haben viele nützliche Protein-Liganden durch Screening von Peptoids Bibliotheken identifiziert worden. Allerdings sind die meisten der von Peptoids Bibliotheken identifizierten Liganden mit hoher Affinität nicht angezeigt werden, mit wenigen Ausnahmen. Dies kann daran liegen, zum Teil auf den Mangel an chirale Zentren und Konformationseinschränkungen in Peptoid-Molekülen. Kürzlich haben wir einen neuen Syntheseweg zu Peptid tertiäre Amide (PTA) zugreifen. PTA sind eine Superfamilie von Peptidmimetika umfassen, sind aber nicht auf Peptide, Peptoide und N-methylierten Peptide beschränkt. Mit Seitenketten sowohl α-Kohlenstoff-Hauptkette Stickstoffatome enthält,die Konformation dieser Moleküle stark durch sterische Hinderung und allylische 1,3-Stamm beschränkt. (Fig. 1) Unsere Studie legt nahe, dass diese PTA-Moleküle in Lösung stark strukturiert und kann verwendet werden, um Protein-Liganden zu identifizieren. Wir glauben, dass diese Moleküle eine zukünftige Quelle von hochaffinen Proteinliganden sein. Hier beschreiben wir die Synthesemethode die Kombination der Leistung der beiden Split-and-Pool-und Sub-Monomer-Strategien, um eine Probe einer Perlen ein-Verbindung (OBOC) Bibliothek der PTAs synthetisieren.
Einleitung
Peptidmimetika sind Verbindungen, die die Struktur von natürlichen Peptiden nachzuahmen. Sie sind für die biologische Aktivität behalten, während Überwindung einiger der Probleme mit natürlichen Peptiden, einschließlich der Zelldurchlässigkeit und Beständigkeit gegen Proteolyse 1-3 verbunden. Aufgrund der Natur dieser oligomeren Verbindungen können große Bibliotheken leicht durch synthetische monomere oder Unter monomeren Synthesewege 4-7 zugegriffen werden. Eine der am besten untersuchten Klassen von Peptidomimetics ist Peptoiden. Peptoide sind Oligomere von N-alkylierten Glycine, die leicht mit einer Unter Monomer-Strategie 8, 9 synthetisiert werden können. Viele nützliche Protein-Liganden wurden erfolgreich von Screening großer Bibliotheken synthetischer Peptoids gegen Protein-Targets 1, 10-14 identifiziert. Dennoch, "Hits" aus Peptoids Bibliotheken identifiziert archivieren selten sehr hohe Affinität zu Protein-Targets 1,10-14,22. Ein major Differenz zwischen Peptoide und natürliche Peptide ist, dass die meisten der Peptoide allgemeinen nicht die Fähigkeit, Sekundärstruktur aufgrund des Mangels an chirale Zentren und Konformationseinschränkungen bilden. Um dieses Problem zu lösen, wurden mehrere Strategien in den letzten zehn Jahren entwickelt, die sich stark auf die Änderung der in der Hauptkette Stickstoffatome enthalten 15-22 Seitenketten. Kürzlich haben wir einen neuen Syntheseweg für natürliche Aminosäureseitenketten an einer Peptoid-Hauptkette einzuführen, um Peptid tertiäre Amide 23 zu schaffen entwickelt.
Peptid tertiäre Amide (PTA) sind eine Superfamilie von Peptidmimetika umfassen, sind aber nicht auf Peptide (R 2 = H), Peptoide (R 1 = H) und N-methylierten Peptide beschränkt (R 1 ≠ H, R 2 = Me) . (Siehe Fig. 1) Die Syntheseroute beschäftigt natürlich vorkommenden Aminosäuren als Quelle der Chiralität und Seitenketten an die45;-Kohlenstoff, und im Handel erhältlich primären Aminen zu N-Substitutionen bereitzustellen. Daher kann eine größere chemische Raum als der einfache Peptide, Peptoide oder N-methylierten Peptide untersucht werden. CD-Spektren haben gezeigt, dass PTA-Moleküle in Lösung sehr strukturiert. Charakterisierung eines der PTA-Protein-Komplexen zeigt deutlich, dass die Konformationseinschränkungen PTA zur Bindung erforderlich ist. Kürzlich haben wir auch entdeckt, dass einige der PTA-Moleküle besitzen eine verbesserte Zelldurchlässigkeit als ihre Gegenstücke und Peptid-Peptoid. Wir glauben, dass diese PTA-Bibliotheken können eine gute Quelle für hochaffine Liganden für Zielproteine sein. In diesem Papier werden wir die Synthese einer Probe ein-Bead-one-Verbindung (OBOC) PTA-Bibliothek in Details zusammen mit einigen verbesserten Bedingungen für die Kupplung und die Spaltung dieser Verbindungen zu diskutieren.
Protokoll
1. Grundlagen der Split-and-Pool-Synthese
Um eine große Anzahl von Verbindungen an fester Phase effizient zu erzeugen, wird Split-and-Pool-Synthese oft als eine allgemeine Strategie beschäftigt. Wie in Fig. 4 gezeigt, sind TentaGel Perlen zuerst in drei Teile aufgeteilt. Jeder Abschnitt ist mit einem anderen Reagens, Erzeugen des ersten Rückstandes an Perlen. Nach der ersten Reaktion werden alle drei Abschnitte miteinander vereinigt, gemischt und dann wieder aufgeteilt in drei Abschnitte. Jeder Teil wird wieder mit einem anderen Reagenz reagieren, Erzeugen des zweiten Rückstand an Perlen. Nach zwei Split-and-Pool-Schritten werden neun Verbindungen erzeugt.
In Submonomer Synthese werden Perlen zuerst in mehrere Abschnitte unterteilt ist, mit verschiedenen Säuren Brom in Gegenwart eines Kupplungsmittels reagieren. Nach dem Waschen mit Lösungsmittel, werden alle Perlen zusammen und gemischt zusammengelegt werden, dann wieder in mehrere Abschnitte unterteilt, um mit verschiedenen reagierenprimäre Amine. Nach Aminierung sind alle Perlen zusammen gesammelt und gründlich gewaschen und einen vollen Monomers auf jeder Perle. Dieser Vorgang kann wiederholt, bis gewünschte Vielfalt erreicht wird.
2. Herstellung von Säure Bromide aus natürlichen Aminosäuren
. 1. Kupplung der Säure-bromid und 2 Aminierung mit primären Aminen (Abbildung 2):. In Submonomer-Synthese wird die Synthese von jedem Monomer in zwei Schritte unterteilt. Um ein Peptid zu synthetisieren tertiäres Amid wird chiralen Säure-bromide mit Seitenketten, die am alpha-Kohlenstoff aus natürlichen Aminosäuren hergestellt werden. Hier beschreiben wir das Verfahren zur Transformation einer natürlichen Aminosäure in das entsprechende Säure-Bromid mit hoher Stereoklangtreue. Wir verwenden Alanin als Beispiel; andere Aminosäuren wie Serin, Threonin, Asparaginsäure, Glutaminsäure, Asparagin, Glutamin, Glycin, Valin, Isoleucin, Phenylalanin kann auch in Brom unter ähnlichen Säuren umgewandelt werden conditions. Beachten Sie, dass einige der Aminosäuren mit funktionellen Gruppen, wie Phenol-, Guanidin-und Amin müssen vor der Transformation zu schützen. Der Reaktionsansatz wird in Abbildung 3 gezeigt.
Sicherheitshinweis: Für die folgenden Reaktionen mit HBr, NaNO 2 und andere ätzende / toxische Chemikalien, geeignete Sicherheitsausrüstung wie Schutzbrille, Kittel und chemikalienbeständige Handschuhe benötigt werden. Alle Reaktionen sollten in einem Abzug von erfahrenen Chemiker durchgeführt werden.
- In 370 ml Wasser in 630 ml 48% HBr-Lösung, um eine 1 L, 30% HBr-Lösung herzustellen. Gib 500 ml Ethylenglykol in einen 1 l Badbehälter; Hinzufügen von Trockeneis, um die Temperatur bei -10 º C zu halten Achtung: 48% HBr-Lösung stark sauer und ätzend, mit Vorsicht handhaben. Lesen Sie das Sicherheitsdatenblatt vor dem Gebrauch.
- Hinzufügen D-Alanin (8,9 g, 0,1 mol) und KBr (11,9 g, 0,1 mol) in einen 250 ml-Dreihalsrundkolben mit einem magnetischen Rührstab. 100 ml, und die 30% HBr in t vorbereiteter vorherigen Schritt. Setzen Sie den Kolben in der Ethylenglykol-Bad in Schritt 2.1 vorbereitet und halten die Temperatur bei -10 ° C Blasen Argon durch eine lange Nadel aus dem Boden des Kolbens für 10 Minuten, wie in Fig. 3 gezeigt. Rührt die Lösung mit dem Magnetrührer bei 300 UpM.
- Auflösen NaNO 2 (8,28 g, 0,12 mol) in einem 100 ml Becherglas mit 20 ml Wasser. Zugeben der Lösung in die Druckausgleichstropftrichter und dichten den Tropftrichter mit einem Septum. Drehen Sie langsam auf das Ventil des Tropftrichter und lassen Sie die NaNO 2-Lösung fallen in den Kolben. Steuern Sie das Ventil, um die Tropfrate auf ca. 2 Tropfen pro Sekunde einstellen. Halten Sie das Rühren bei 300 UpM und halten das Einleiten von Argon aus dem Boden des Kolbens. Der Kolben sollte in Ethylenglycol-Bad bei -10 ° C aufbewahrt werden, bis alle NaNO 2 zugegeben. Achtung: Dieser Schritt erzeugt Wärme und Gas während der Zugabe von NaNO 2-Lösung. Tropfrate sollten sorgfältig congesteuert und das ganze System sollte durch die Argon Auslaß offen sein.
- Halten Sie das Rühren für weitere 3 Stunden und lassen die Temperatur erwärmen von -10 ° C bis Raumtemperatur. Die resultierende Lösung sollte klar bis hellgelb sein; wenn die Farbe zu dunkel, Vakuum, um die überschüssige Stickoxide und mögliche Br 2 während der Reaktion erzeugte entfernen.
- Extrahieren Sie das Produkt aus der Lösung mit 3x 35 ml Diethylether mit einem extra Trichter. Kombinieren der organischen Phase und waschen Sie es mit gesättigter Salzlösung. Die organische Phase kann auch mit einer kleinen Menge von NaHCO 3 vor dem Waschen mit Salzlösung, um die Farbe zu entfernen, wenn es dunkel ist, gewaschen werden. Trocknen der organischen Phase über Na 2 SO 4 für 6 Stunden.
- Filtern Sie die Na 2 SO 4 und dampft das Lösungsmittel unter Vakuum sollte Rohprodukt als klar, hellgelbes Öl erhalten werden. Rohprodukt kann durch Destillation bei 115 º C, 3 mm Hg, oder reinigSilica-Säule mit 3.01 Hexan: Ethylacetat.
- Reines Produkt als klares Öl, 6,6 g (Ausbeute 74%), Dichte = 1,69 g / ml, [α] D20 = +24 ° (Methanol), 1 H-NMR (400 MHz, CDCl 3) δ 4.41 (q erhalten, J = 7,0 Hz, 1H), 1,86 (d, J = 7,0 Hz, 3H). Im Fall von (S)-2-Brompropansäure-d 4 (von 4 d-L-Alanin), ist reine Produkt als klares Öl erhalten, Ausbeute 78%, Dichte = 1,72 g / ml, [α] D20 = -19 (Methanol). 1 H NMR ° wird keine signifikante H-Signal beobachtet. ESI-MS - [M-1] - = 155,1 (erwartet 154.97). Für (S)-2-Brom-4-Methylpentansäure (von L-Leucin unter Verwendung der gleichen Prozedur) reines Produkt als klares Öl erhalten, Ausbeute 89%, [α] D20 = +37 ° (Methanol), 1 H NMR (400 MHz, CDCl 3) δ 4,30 (t, J = 7,7 Hz, 1H), 1,94 (dd, J = 10,8, 3,9 Hz, 2H), 1,81 (tt, J = 13,2, 6,5 Hz, 1H), 0,96 (dd, J = 18.2, 6.6 Hz, 7H). Im Falle von (S)-2-Brom-3-phenylpropanoic Säure (von L-Phenylalanin mit dem gleichen Verfahren hergestellt) reines Produkt als hellgelbes Öl, Ausbeute 72%, [α] D20 = 17 (Methanol), 1 H-NMR (400 MHz, CDCl 3) δ 7,38 ° - 7.19 (m, 5H), 4.42 (dd, J = 8.1, 7.3 Hz, 1H), 3,47 (dd, J = 14.2, 8.2 Hz, 1H), 3.25 (dd, J = 14.2, 7.2 Hz, 1H).
3. Isotopenmarkierung von Alanin-Transaminase Mit
In kombinatorischen Bibliotheksynthese, insbesondere in der Split-and-Pool-Synthese von einem Wulst ein Verbindung (OBOC) Bibliotheken, ist die Menge der Verbindung, die von jedem Wulst erhalten werden kann relativ klein ist. (Typischerweise 1 pmol bis 10 nmol). Zusätzlich ist die Massenspektrometrie häufig für die Identifizierung und Charakterisierung der Endverbindung aufgrund seiner hohen Empfindlichkeit verwendet. Um Massenspektrometrie verwenden, um die absolute Stereochemie an den chiralen Zentren der letzten PTA-Produkte zu ermitteln, sollte Brom-Enantiomere isoto seinpically vor Gebrauch gekennzeichnet. Hier beschreiben wir das Verfahren der Verwendung Transaminase und D 2 O Etikett L-Alanin.
- Auflösen L-Alanin (300 mg, 3,36 mmol) mit 10 ml D 2 O in einem 50 ml-Polyethylenrohr. In α-Ketoglutarat (10 mg, 0,068 mmol) als Co-Substrat. Wärmen Sie das Rohr auf 37 ° C und stellen Sie die PD 8,5-8,7 unter Verwendung einer 1 M NaOD Lösungshilfe. Hinweis: PD wird durch pH-Teststreifen bestimmt. Traditionelle elektro pH-Meter mit Glaselektrode selektiv für H + ausgestattet ist, kann geben nicht korrekt ausgelesen für D +.
- In Alanin-Transaminase (0,1 mg, EC 2.6.1.2 aus Schweineherz, Roche Diagnostics, Indianapolis, IN) mit dem pD 8,5-8,7, 37 aus dem vorherigen Schritt vorbereitet ° C-Lösung. Setzen Sie das Rohr in einem 37 ° C-Inkubator und Inkubation über Nacht mit leichten Schütteln, bevorzugt 10 bis 30 Umdrehungen pro Minute.
- Nach Inkubation über Nacht, nehmen Sie 0,5 ml der D 2 O-Lösung und überprüfen Sie die Reaktionsfortschritt durch 1 H-NMR. Alle Protonen-Signale einerlanine, δ 3,76 (q, J = 7.2 Hz, 1H), 1,46 (d, J = 7,3 Hz, 3H), 1 H-NMR 400 MHz, sollte stark durch Deuterierung unterdrückt werden. Mehr als 98% der Protonen sollte Deuterium, wie zuvor beschrieben, 23 ausgetauscht werden. Hinweis: D 2 O teilweise durch Destillation zurückgewonnen, wenn die Reaktion in großem Maßstab durchgeführt werden kann (> 200 ml D 2 O). Normalerweise können 60% bis 80% D 2 O aus der Lösung destilliert werden.
- Einfrieren der obigen Lösung mit flüssigem Stickstoff gefriertrocknen und mit einem Lyophilisator auf weißem deuteriertes L-Alanin-Pulver zu erhalten.
4. Synthese von Peptoid Linker Region
Die Linkerregion wird für PTA Bibliothekssynthese benötigt. Jedoch um den hohen Hintergrund im unteren Molekulargewichtsbereich (100-600) von MALDI-Massenspektroskopie zu vermeiden und die Ionisierung der Verbindungen zu verbessern, ein Peptoid-Linker mit mehreren polaren Resten wird oft verwendet. Diese Peptoid linker können über Standard-Peptoids Syntheseverfahren hergestellt werden. Hier werden wir ein Pentamer von N-Methoxyethyl-Glycin als Linker synthetisiert (wie in Fig. 5 gezeigt).
- Quellen 90 um Tentagel Perlen mit RAM-Linker (1 g, 0,27 mmol / g) in 10 ml DMF 3 h in einem 12-ml-Spritze mit einem milden Reaktor Schütteln.
- Lassen Sie das DMF aus dem Reaktor und 10 ml 20% Piperidin DMF-Lösung, um die Fmoc-Gruppe von der Rink-Amid-Linker entschützen. Schütteln Sie die Perlen mit 20% Piperidin-Lösung für 30 min. Waschen mit DMF 5x alle Piperidin zu entfernen.
- Nehmen Sie sich ein paar Perlen aus der Spritze und testen Sie es mit Chloranil-Test. Perlen sollten dunkelbraun (Chloranil-Test positiv für primäre Amin) wenden, wenn fmoc erfolgreich entschützt wird.
- Bereiten Sie die folgenden Lösungen:. 1 20 ml, 2 M Bromessigsäure / DMF-Lösung; 2 20 ml, 2 M DIC / DMF-Lösung. 3. 10 ml, 1 M methoxylethylamine / DMF-Lösung.
- 5 ml 2 M Bromessigsäure / DMF-Lösungdie Perlen, leicht schütteln. Anschließend werden 5 ml 2 M DIC / DMF-Lösung zu den Perlen; versiegeln Sie die Spritze mit dem Kolben und legte es auf den Shaker. Schütteln für 10 min.
- Gründlich waschen die Perlen mit DMF. 2 ml 1 M Methoxyethylamin / DMF-Lösung aus Schritt 4.4 in den Kügelchen hergestellt. Verschließen Sie die Spritze mit dem Kolben und schütteln Sie auf dem Schüttler für 30 min.
- Mit DMF 5x Waschen Sie die Perlen. Überprüfen Sie ein paar Perlen mit Chloranil-Test, wenn positiv (Perlen blau), dann mit dem nächsten Schritt fort. Andernfalls wiederholen Sie Schritt 4.6.
- Wiederholen Sie die Schritte 4,5-4,7, 4x um die Pentamer abzuschließen.
. 5 Split-and-Pool-Synthese von PTA-Bibliothek mit (R) - und (S)-2-Brompropionsäure Acids
Hier beschreiben wir die Synthese eines kleinen PTA Bibliothek eine theoretische Diversität von 9.261 Verbindungen unter Verwendung des 1 g Kügelchen aus Schritt 4.8. Beachten Sie, dass ein 90 um Tentagel Wulst enthält etwa 2,9 Millionen Perlen pro Gramm; daher die Redundanzdie Bibliothek 2,9 x 10 6/9261 = 312 Kopien sein. Wir werden Bromessigsäure, (R)-2-und Isotopen-markierten bromopropanoic (S)-2-Brompropansäure-d 4 als die Säuren und 7 verschiedene Amine (A1 ~ A7, siehe Abbildung 5 für Details) für Aminierung. Spritze Reaktoren und ein Vakuumverteiler wird verwendet, um die Synthese durchzuführen.
- 10 ml von 1:1 DCM: DMF auf die Spritze aus Schritt 4,8; verwenden einen 1000 ul Pipette mit einer abgeschnittenen Pipettenspitze, um alle 1 g Perlen gleichmäßig in drei Reaktoren 5 ml Spritze aufgespalten. Beschriften als B (Bromessigsäure), R ((R)-2-bromopropanoic) und S ((S)-2-Brompropansäure-d 4). Mit DCM 3x Waschen Sie alle drei Spritzen, Spritzen und waschen mit R und S mit wasserfreiem THF 3x beschriftet, waschen Spritze mit B 3x mit DMF gekennzeichnet.
- Spritze R-und S. BTC Kopplung Brompropansäure.
- Eine frische BTC / THF-Lösung. Hinzufügentwa 200 mg BTC in das Fläschchen in einem Abzug, verschließen Sie diese mit der Kappe. Wiegen Sie die Menge der BTC in der Ampulle. Berechnen Sie die Menge an Lösungsmittel benötigt, und fügen wasserfreiem THF in das Fläschchen, um eine 20 mg / ml BTC / THF-Lösung zu machen.
- Bereiten Sie das Brom Säuren / BTC-Mischung. Hinzufügen (R)-2-Brompropansäure (89 &mgr; l, 0,95 mmol) und (S)-2-Brompropansäure-d 4 (89 &mgr; l, 0,95 mmol) in zwei kleine Fläschchen getrennt. Um jedem Fläschchen 5 ml des über 20 mg / ml BTC / THF-Lösung. Seal die zwei Fläschchen und steckte sie in -20 ° C Gefrierschrank für 20 min.
- In 1125 ul, 2:1 THF / DIPEA (750 ul THF, 375 ul DIPEA, 2.2 mmol) R-und S getrennt Spritze. Mischen Sie die Perlen mit der Pipettenspitze. Lassen Sie sie für 5 min zu sitzen.
- Nehmen Sie die beiden abgekühlt Brom Säuren / BTC Mischungen aus Schritt 5.2.2, fügen 2,4,6-Trimethylpyridin (356 ul, 2,7 mmol) zu jedem Fläschchen. Weiß Niederschläge sofort bilden. Tragen Sie die entsprechenden Aufhängung direktzu den basisch-Perlen (Spritze R und S in Schritt 5.2.3) so bald wie möglich und sie dann auf einem Schüttler unter 120 rpm für 2 h schütteln.
Hinweis: Die Lösung in den Reaktoren Spritze sollte eine blasse gelbliche Suspension während des gesamten Verlaufs der Reaktion sein. Ein dunkler Farbe ist ein Anzeichen für übermäßige Wärme während der anfänglichen Zugabe der Säurechloridlösung freigesetzt. Dies kann durch weitere Abkühlung gelöst werden oder verdünnte Säuren die Brom / BTC-Mischung.
- Spritze B. Bromessigsäure Kupplung mit DIC
- Bereiten Sie eine frische 20 ml, 2 M Bromessigsäure / DMF-Lösung. Bereiten Sie eine 20 ml, 2 M DIC / DMF-Lösung.
- 2 ml 2 M Bromessigsäure / DMF Lösung B Spritze, leicht schütteln. 2 ml 2 M DIC / DMF-Lösung zu B-Spritze, leicht schütteln.
- Setzen Spritze B auf derselben Rüttler Spritze R und S , Schütteln Sie sie für 2 Stunden. Beachten Sie, dass die Kopplungsreaktion Bromessigsäure / DIC wird innerhalb von 30 Minuten durchgeführt; längere Reaktionszeit für die Bequemlichkeit des Split-and-Pool-Synthese.
- Nach 2 Stunden, nehmen Spritze R, S und B aus dem Shaker. Waschen Sie alle drei Spritzen gründlich mit DCM 5x. Dann waschen mit DMF 5x. Beachten Sie, dass Spritze R und S kann mit DMF, bevor sie mit DCM oder THF zuerst gewaschen werden.
- Pool alle Perlen aus Spritzen R, S und B in eine 12 ml Spritze Reaktor. Waschen Sie alle Perlen mit DMF 5x.
- 10 ml von 1:1 DCM: DMF auf die Spritze; verwenden einen 1000 ul Pipette mit einer abgeschnittenen Pipettenspitze, alle Perlen gleichmäßig in 7 Einzel 2 ml Spritzen aufgeteilt, beschriften Sie als A1-A7.
- Aminierung. Vorbereitung 10 ml, 2 M primären Amin / DMF-Lösungen für jeden der 7 Amine in Fig. 5 aufgeführt. 5 ml EACh Aminlösung in die entsprechende Spritze A1-A7. Inkubieren Alle 7 Spritzen in einer 60 ° C-Inkubator mit Schütteln über Nacht.
- Nach der Inkubation, Waschen alle Perlen gründlich mit DMF. Nehmen Sie ein paar Perlen aus der Spritze und überprüfen Sie mit Chloranil-Test. Wenn die Perlen grün (positiv) innerhalb von 3 min, gehen Sie mit dem nächsten Schritt. Wenn negativ, wiederholen Sie Schritt 5.7 für die negativen Spritzen.
- Wiederholen Sie die Schritte 5.1 bis 5.8 2x die Trimer abzuschließen. Optionaler Schritt: Nach jedem Zyklus, empfehlen wir, die Synthesequalität durch Massenspektroskopie zu überprüfen, wie unten beschrieben. Alle 9261 Verbindungen werden nun auf Tentagel Perlen als OBOC Bibliothek synthetisiert.
- Massenspektroskopische Bestätigung der PTAs.
PTAs sind sehr strukturiert Oligomere und besitzen viele gemeinsame Merkmale der N-methylierten Peptiden. Eines der häufigsten Probleme der Festphasensynthese von N-methylierten Peptide ist der Säureabbau während der TFA-Spaltung. Um Säureabbau, Spaltung von Molekülen wie Cyclosporin aus unterdrückenfesten Träger wird häufig bei niedrigen Temperaturen durchgeführt. Wir verglichen verschiedenen Spaltungsbedingungen für die Spaltung von verschiedenen PTA-Moleküle von dem festen Träger. Wir fanden, daß im allgemeinen niedrige Temperatur und vermindertem TFA Konzentration effektiv zu unterdrücken Säureabbau und bieten reiner Verbindungen.- Bereiten Sie 10 ml 01.01 TFA / DCM-Lösung in einem 15-ml-Tube. Verschließen Sie den Schlauch und steckte es in einen -20 ° C Gefrierschrank für 20 min.
- Die Perlen, die mit DCM 5x gespalten werden müssen waschen. Schütteln Sie die Perlen in DCM für 15 Minuten und waschen Sie die Perlen wieder mit DCM 5x.
- Lassen Sie das DCM aus der Spritze. Verwenden Sie ein Lichtmikroskop und eine Pipette mit abgeschnittenen Spitze, jede einzelne Perle in eine 96-Well-Platte, eine Perle pro Vertiefung übertragen.
- Decken Sie die 96-Well-Platte mit einem Deckglas. Legen Sie die Platte in einem -20 ° C Gefrierschrank für 15 min.
- Nehmen Sie die gekühlt 01.01 TFA / DCM-Lösung aus Schritt 5.10.1 und fügen Sie 20 ul zu jedem der Brunnen, die eine Perle enthält. Legen Sie das Deckglas hin und put der 96-Well-Platte auf einem Schüttler in der -20 ° C Kühlschrank.
- Schütteln für 20 min. Nehmen Sie die 96-Well-Platte heraus und ziehen Sie das Deckglas. Föhnen Sie das TFA / DCM aus jeder Vertiefung durch Einblasen von Luft oder Argon über sie. Wenn mehr als 10 Kügelchen abgespalten werden, kann ein Speedvac des TFA / DCM aus der gesamten Platte trocken verwendet werden. Man beachte, dass zu diesem Zeitpunkt nicht alle Verbindungen von den Kügelchen abgespalten, aber die gespaltenen Verbindungen sollen mehr als genug, um die Massenspektroskopie-Analyse durchzuführen.
- In 20 ul 6.04 ACN: H 2 O-Lösung, um die abgespaltenen Verbindungen von jedem gut lösen. Finde 0,6 ul jeder Verbindungslösung zusammen mit 0,6 ul CHCA MALDI-Matrix auf der MALDI-Platte.
- Verwenden von MALDI-Massenspektrometrie, um das Molekulargewicht und die Sequenz (MS / MS) der jeweiligen Verbindung zu bestimmen.
6. Chloranil-Test
- Bereiten Sie die folgenden Reagenzien frisch für jeden Test. Lösung A: 2% Chloranil (CAS: 118-75-2) in DMF. LösungB: 2% Acetaldehyd (CAS: 75-07-0) in DMF.
- Mischungs 100 ul der Lösung A mit 100 ul der Lösung B vor dem Test in einem 1,5 ml Röhrchen; fallen die Perlen in und schütteln. Wenn die Perlen blau innerhalb von 5 min, zeigt dies das Vorhandensein von sekundären Amins auf der Oberfläche der Kügelchen. Primäre Amine geben eine dunkelbraune Farbe, anstatt sich blau.
Ergebnisse
Hier zeigen wir drei repräsentative MALDI-Spektren von einer PTA-Trimer mit Linker. Wie in 6A gezeigt ist, bei der Verwendung von 50% TFA / DCM-Lösung bei Raumtemperatur abgespalten, wird ein signifikanter Abbau beobachtet. In 6A, Peak 593 und 484 entsprechen dem Linker und dem PTA-Trimer sind, zeigen, daß das gesamte Molekül wurde am Wulst synthetisiert, aber während der Spaltung abgebaut. Wenn unter niedrigen Temperaturbedingungen, wie oben beschrieben, gespalten, wird die Menge an TFA induzierten Abbau stark unterdrückt, wie in 6B gezeigt. Der Mechanismus einer solchen Spaltung ist in früheren Literaturstellen 24 beschrieben worden, und es wird angenommen, dass durch einen Oxazolidin-Zwischen gehen. PTA-Moleküle können durch MS / MS sequenziert werden und das Fragmentierungsmuster ist ähnlich dem von Peptiden und Peptoiden, wie in Fig. 6C gezeigt. PTA-Moleküle synthetisiert mit (S)-2-Brompropansäure-d 4 allgemein give breiter Peak auf MS und MS / MS-Spektren aufgrund der Anwesenheit unvollständiger Deuterierung Produkte wie (S)-2-Brompropansäure-d 3 (Fig. 7A und 7B). Dies kann als Hinweis auf die Anwesenheit des chiralen Zentrums R (von S während der Aminierung invertiert) während Sequenzierungsverfahren verwendet werden. Wir fanden auch, dass die PTA-Moleküle haben eine Tendenz zu mehr sodiated Addukte als Peptoids / Peptid bilden daher niedrige Natrium-Wasser (wie entionisiertes Wasser) und Kunststoffgerät werden bevorzugt (7C). Ein weiteres Nebenprodukt, das in PTA-Synthese beobachtet werden könnte, ist die sich aus der Eliminierung von Bromid während Aminierung (Fig. 7C) ausgebildet ist Acrylamid. Nachdem das Acrylamid gebildet wird, wird die Sequenz beendet. Dies kann durch Erniedrigung der Konzentration des primären Amins bis 1 M, um die Basizität der Lösung reduzieren gelöst werden. Wir empfehlen die Durchführung der Chloranil-Test nach jeder Acylierungsschritt und Verwendung von Massen spectroscopy um das Produkt nach jeder Aminierungsschritt überprüfen, um die Qualität der Bibliothek zu gewährleisten.
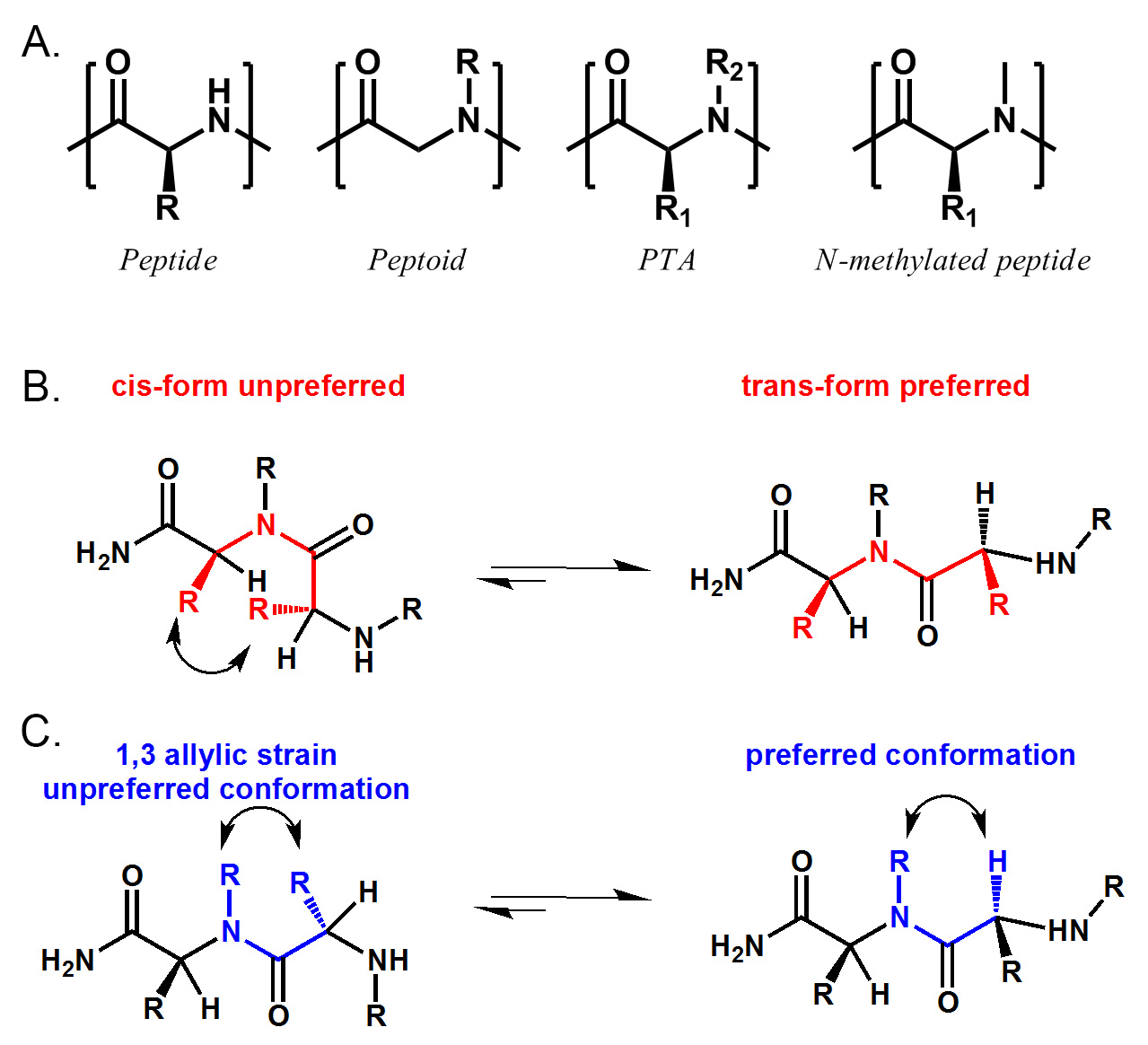
1. Struktur Vergleich von Peptid, Peptoid, PTA und N-methylierte Peptid. PTA umfasst Peptid (R 2 = H), Peptoid (R 1 = H) und N-methylierte Peptid (R 1 ≠ H, R 2 = Me) . B) PTA bevorzugt trans-Amidbindung Konformation aufgrund der sterischen Hinderung zwischen zwei α-Seitenkette. C) PTA hat auch eine bevorzugte Konformation durch 1,3 Allylspannung zwischen N-Ersatz-und α-Seitenkette. Bitte klicken Sie hier, um sehen Sie eine größere Version dieser Figur.
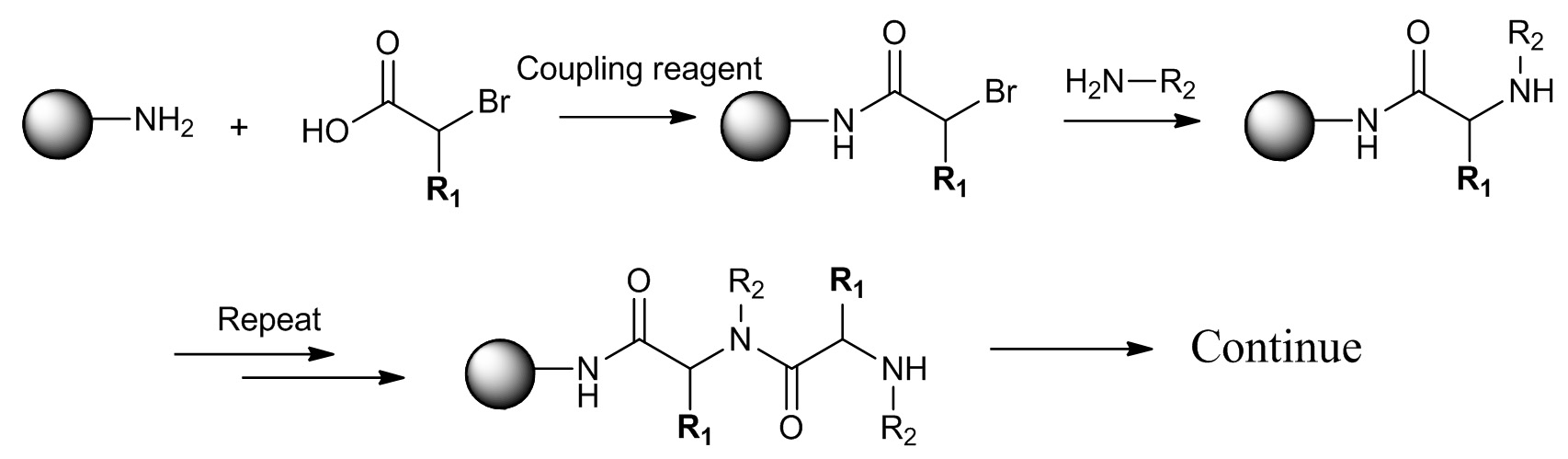
Abbildung 2. Sub-Monomer-Synthese von Peptoids (R 1 = H) und PTA (R 1 ≠ H). Erster Schritt ist die Säure Acylierung des Amins. Zweiter Schritt ist Aminierung mit primären Aminen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
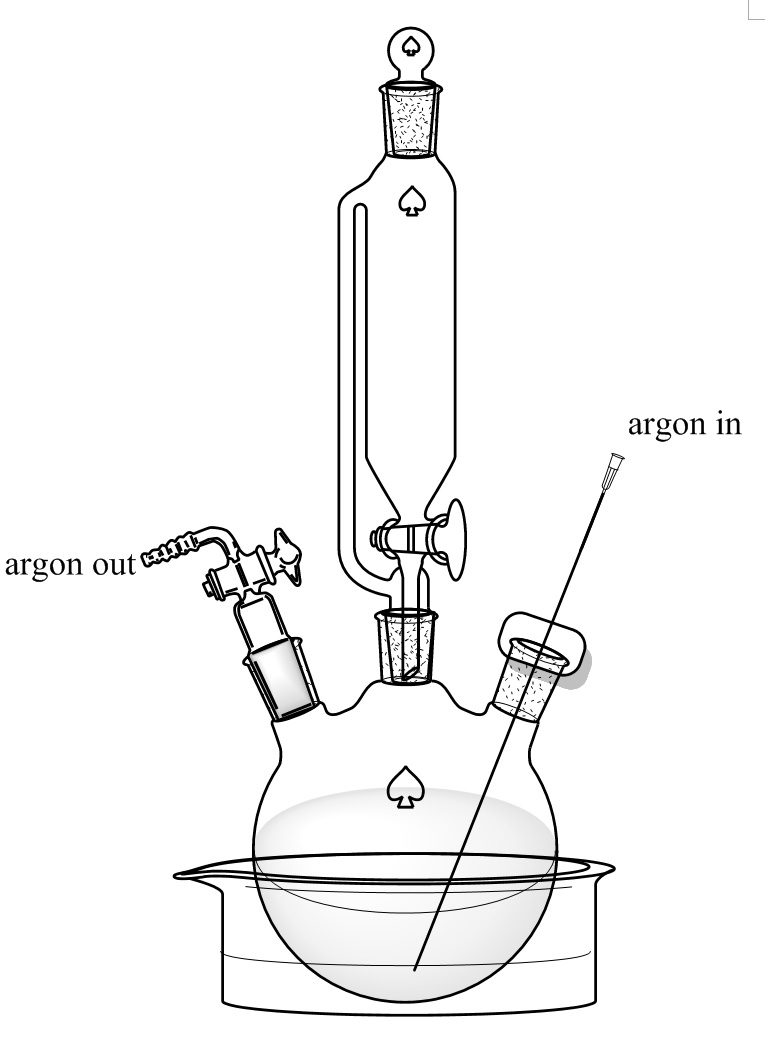
Abbildung 3. Reaction Setup. Ein 250-ml-Dreihalskolben wird in einem Trockeneis / Ethylenglykol Bad gegeben. Der mittlere Hals ist mit einem 150 ml-Druckausgleichstropftrichter verbunden. Die linken und rechten Hälse werden mit einem Strömungssteuerteil und einem Septum verschlossen wit einer langen Nadel, die Argon-Strom durchlässt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
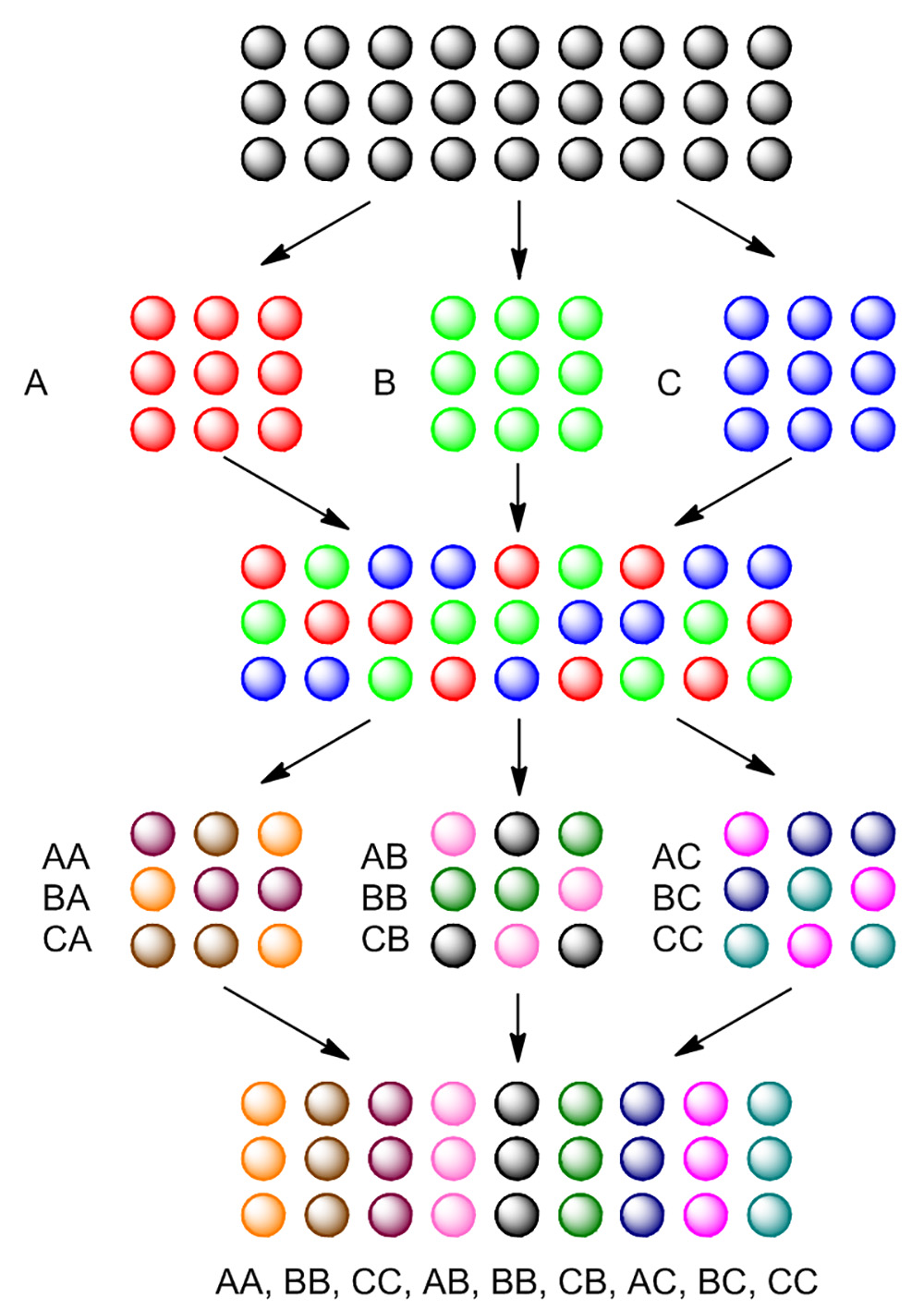
Abbildung 4. Grundlagen der Split-and-Pool-Synthese. Blank Perlen sind in drei Teile, die separat mit Reaktanden A behandelt aufgeteilt, B und C. Nach der ersten Reaktion, alle drei Teile der Perlen werden zusammen gemischt und gebündelt. Pooled Perlen sind wieder in drei Teile aufgespalten und wieder mit dem gleichen Reaktionspartner für jeden einzelnen Teil behandelt. Nach der zweiten Reaktion, 9 verschiedene Verbindungen synthetisiert werden. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5. Lokalisieren Übersicht. Drei PTAs sind nach dem Pentamer Peptoids Linker synthetisiert. Theoretische Vielfalt, 3 X 3 7 3 = 9261. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
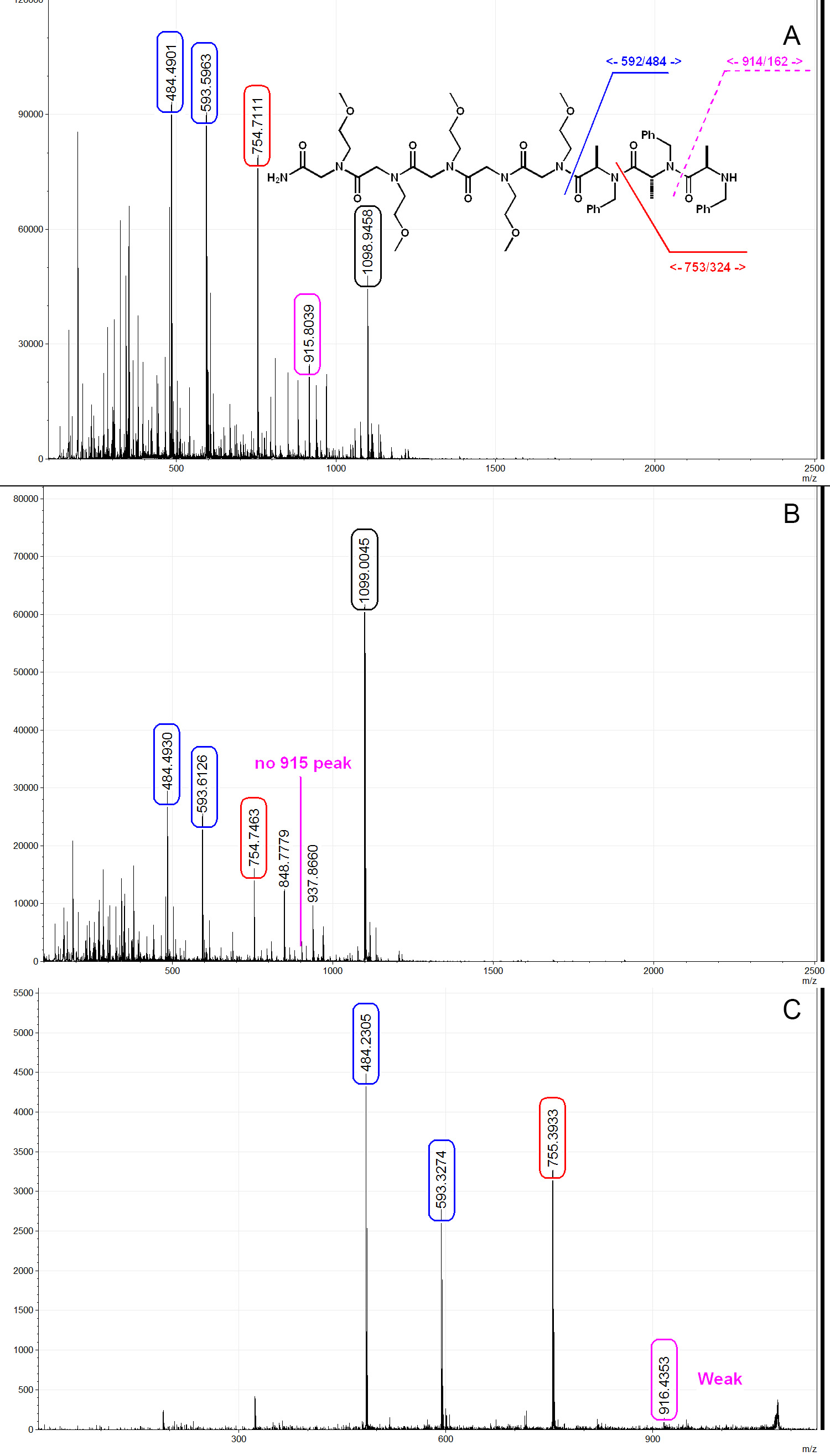
Abbildung 6. Typische MALDI-Massenspektren einer PTA-Trimer. A) Trimer PTA von 50% TFA / DCM bei Raumtemperatur abgespalten. PTA Struktur wie gezeigt, [M +1] + = 1077, [M + Na] + = 1,098.9, PTA Fragmentierung von TFA-Spaltung deutlich auf das Spektrum. B) Trimer Spaltung gesehen werdenum 50% TFA / DCM unter optimierten Bedingungen wie in der Papier-ed beschrieben. Säureabbau TFA-induzieren stark. C) MS / MS-Spektrum des PTA Trimer unterdrückt. Schwache y7 (916)-Signal beobachtet wird, ist dies ein typisches Verhalten für PTAs Fragmentierung. Spectra analysiert und durch mMass 32 erzeugt. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Figur 7. MALDI Spektren von PTA-Synthese mit Isotopen markierte Monomer und typische Nebenprodukte. A) MS-Spektren Vergleich der PTA-Moleküle durch blaue synthetisiert: (R)-2-bromopropanoic [M +1] + = 760 [M + Na] + = 787 [M + K] + = 803 und rot: (S) - 2-Brompropansäure-d 4 [M +1] + = 764 [M + Na] + = 783 [M + K] + = 799. B) MS / MS-Fragmentierungsmuster der beiden in A gezeigten Moleküle). Man beachte, dass aufgrund der Gegenwart von d 1, d 2 und d 3 Gewürze (unvollständige Deuterierung von Alanin), Moleküle, die durch (S)-2-Brompropansäure-d 4 synthetisiert ergeben im allgemeinen breiteren Peaks C). Rot: Spektrum einer PTA Dimer synthetisiert und unter optimierten Zustand abgespalten. Blau:. PTA-Dimer mit 2 M Methoxyethylamin Lösung synthetisiert und in normalen gefiltertes Wasser gespalten Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Peptide tertiäre Amide (PTA) sind eine Superfamilie von Peptidomimetikum Oligomere. Neben den gut untersuchten Peptide, Peptoide und N-methylierten Peptide, bleibt ein großer Teil der Verbindungen innerhalb dieser Familie under, majorly aufgrund des Fehlens von Syntheseverfahren, allgemeine N-alkylierte Peptide zuzugreifen. Hier beschreiben wir eine effiziente Methode, um PTAs mit chiraler Bausteine von Aminosäuren abgeleitete synthetisieren. Zuvor haben wir berichtet, dass eine neue Unter Monomer Syntheseroute zu Bibliotheken von PTA-Moleküle 23 zu verwenden. Wir haben gezeigt, dass PTAs sind sehr strukturiert Oligomere, die durch Konformationsänderungen hemmt das Rückgrat besitzen. Wenn in vivo getestet, zeigte PTA Moleküle verbesserte Zelldurchlässigkeit und damit eine verbesserte Aktivität 25. Doch neben mit allen Vorteilen, PTAs auch mit einigen synthetischen Herausforderungen kommen, majorly von der Acylierung von sekundären Aminen bei gehinderten Positionen. Die α-Seitenkette, die konformative bietetEinschränkung bringt auch sterische Hinderung für die folgenden Kupplungsschritt. Um diese Herausforderungen zu meistern synthetischen, eine umfangreiche Optimierungsstudie durchgeführt und festgestellt, wir BTC als die beste Kupplungsreagenz für diese Reaktion 23.
Der Schlüsselschritt der Syntheseroute ist BTC erleichtert Acylierung des sekundären Amins. Dabei BTC ermöglicht die Erzeugung eines Säurechlorids in situ 26,27. Die meisten anderen Kupplungsreagenzien, die entweder aktive Ester oder Säureanhydride als Zwischenprodukte bilden, nicht zu sauber Acylierung zur kontinuierlichen Synthese PTA bieten. Die Existenz der vorhergehenden PTA Einheiten stark beeinträchtigt die Kopplungseffizienz des folgenden PTA Einheit aufgrund sterischer Hinderung. Daher wird für die Synthese von mehreren PTA, hochaktives Zwischenprodukt mit einer geringen Austrittsgruppe ist stärker bevorzugt. Unter all den Kopplungsbedingungen, die wir getestet haben, in situ Säurechlorid von BTC arbeitet die best in unserer Hand. Auch mit den sehr aktiven Säurechloride, empfehlen wir jedoch zu hoch sterischen gehinderten Aminen wie α-verzweigte primäre Amine in der Bibliothek zu vermeiden, es sei denn, Synthese im Voraus getestet. Aromatische Amine, wie anile oft unvollständig Substitution führen und sollte daher vermieden werden. Während der BTC Kopplungsschritt sollte die Lösung immer eine hellgelbe bis orangefarbene Farbe; eine dunkler gefärbte Lösung ist ein Anzeichen einer Überhitzung und kann in geringerer Ausbeute und erhöhte Bildung von Nebenprodukten führen. Dies kann in der Regel durch weitere Abkühlung der BTC-Lösung gelöst werden, reduzieren Sie die Größe des Reaktions und schnellere Übertragung von aktivierten BTC / Säure-Lösung. Neben BTC, N-Ethoxycarbonyl-2-ethoxy-1 ,2-dihydrochinolin (EEDQ) ein weiteres Kupplungsmittels, das gut in PTA-Synthese. Das Schlüssel-Zwischenprodukt ist eine gemischte Kohlensäure mit einer relativ kleinen Austrittsgruppe. Im Fall von EEDQ, 3 Äquivalent EEDQ zusammen mit der Säure in DCM gelöst und dann apführt an die Perlen bei Raumtemperatur. Die Reaktion wird in der Regel innerhalb von 2 Stunden mit leichten Schütteln getan. Diese Reaktion setzt CO 2 während der Reaktion; Daher sollte das Reaktionssystem nicht geschlossen werden.
Ein weiterer wichtiger Schritt ist die Spaltung und die Charakterisierung von Molekülen PTA. Eine Besonderheit MS / MS-Fragmentierungsmuster wurde bei der Sequenzierung PTA-Moleküle über MALDI-MS/MS (Abbildung 6) beobachtet. Es besteht eine geringe Intensität der letzte y-Ion (in violett in Fig. 6C gezeigt und erhöhte Intensität y6, y5, y4, b2, b3 Ionen). Analoge Muster sind von N-methylierten Peptidfragmentierung im vorherigen Bericht 28 beobachtet worden. Aufgrund der erhöhten Stabilität des Zwischen Oxazolidin, N-methylierten Peptide sind in der Regel starke B-Ionen 28 geben. Darüber hinaus ist es bekannt, dass N-methylierte Peptid säurelabile sowohl während TFA-Spaltung und MALDI-Massenspektroskopie 24,28, 29. Mechanistische Studie hat gezeigt, dass aufgrund der konformationellen Beschränkung auf das Rückgrat, das Carbonyl-Sauerstoffatom der vorstehenden Rest oft in der Nähe von der Carbonylgruppe an der Spaltungsstelle, damit die Förderung der Bildung der Oxazolidin-Zwischen 29. Aus den oben genannten Gründen, beide PTAs und N-methylierte Peptide müssen aus festen Trägern bei niedriger Temperatur mit kontrollierten Konzentrationen von TFA 26, 30 abgespalten werden. Nach unserer Erfahrung ist die bequemste Methode zur Abspaltung einzelner PTA Reste erfolgt bei -20 ° C mit einem vorgekühlten, -20 ° C-Lösung von 50% TFA / DCM. Dieses Verfahren stark unterdrückt die Bildung von Säureabbauprodukte.
Nach Beherrschung dieser Technik kann Bibliothek PTA Monomer aus anderen natürlichen Aminosäuren, wie Leucin, Phenylalanin, Glutamin usw. abgeleitet und synthetisiert werden. Eine hohe Qualität PTA Bibliothek gescreent werden against verschiedene Protein-Targets mit unserer bereits veröffentlichten On-Bead-Screening-Protokolle 31. Hit Verbindungen aus dem Screening identifiziert durch Massenspektroskopie charakterisiert und für weitere Tests unter Verwendung des oben beschriebenen Protokolls neu synthetisiert werden.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen konkurrieren.
Danksagungen
Die Autoren danken Herrn Dr. Jumpei Morimoto und Dr. Todd Doran für wertvolle Unterstützung danken. Diese Arbeit wurde durch einen Vertrag von der NHLBI (NO1-HV-00242) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 2,4,6 trimethylpyridine | ACROS | 161950010 | CAS:108-75-8 |
| 2-morpholinoethanamine | Sigma-Aldrich | 06680 | CAS:2038-03-1 |
| 48% HBr water solution | ALFA AESAR | AA14036AT | CAS:10035-10-6 |
| Acetaldehyde | Sigma-Aldrich | 402788 | CAS:75-07-0 |
| Acetonitrile | Fisher | SR015AA-19PS | CAS:75-05-8 |
| Anhydrous tetrahydrofuran (THF) | EMD | EM-TX0277-6 | CAS:109-99-9 |
| Benzylamine | Sigma-Aldrich | 185701 | CAS:100-46-9 |
| bis(Trichloromethyl) carbonate (BTC) | ACROS | 258950050 | CAS:32315-10-9 |
| Bromoacetic acid | ACROS | 106570010 | CAS:79-08-3 |
| Chloranil | Sigma-Aldrich | 23290 | CAS:118-75-2 |
| Cyclohexanemethylamine | Sigma-Aldrich | 101842 | CAS:3218-02-8 |
| D2O | Cambridge Isotope | DLM-4-99.8-1000 | CAS:7789-20-0 |
| D-Alanine | Anaspec | 61387-100 | CAS:338-69-2 |
| Dichloromethane (DCM) | Fisher | BJ-NS300-20 | CAS:75-09-2 |
| Dimethylformamide (DMF) | Fisher | BJ-076-4 | CAS:68-12-2 |
| Ethylene glycol | Oakwood | 44710 | CAS:107-21-1 |
| Isopentylamine | Sigma-Aldrich | W321907 | CAS:107-85-7 |
| KBr | ACROS | 424070025 | CAS:7758-02-3 |
| L-Alanine | Anaspec | 61385-100 | CAS:56-41-7 |
| 3-Methoxypropylamine | Sigma-Aldrich | M25007 | CAS:5332-73-0 |
| 2-Methoxyethylamine | Sigma-Aldrich | 143693 | CAS:109-85-3 |
| N-(3-Aminopropyl)-2-pyrrolidinone | Sigma-Aldrich | 136565 | CAS:7663-77-6 |
| N,N'-Diisopropylcarbodiimide (DIC) | ACROS | 115211000 | CAS:693-13-0 |
| N,N-Diisopropylethylamine (DIPEA) | Sigma-Aldrich | D125806 | CAS:7087-68-5 |
| NaNO2 | ACROS | 424340010 | CAS:7631-99-4 |
| NAOD 40% solution in water | ACROS | 200058-506 | CAS:7732-18-5 |
| Piperidine | ALFA AESAR | A12442-AE | CAS:110-89-4 |
| Piperonylamine | Sigma-Aldrich | P49503 | CAS:2620-50-0 |
| Propylamine | Sigma-Aldrich | 240958 | CAS:107-10-8 |
| Trifluoroacetic acid | Sigma-Aldrich | 299537 | CAS:76-05-1 |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | 39468 | CAS:28166-41-8 |
| α-Ketoglutarate | ALFA AESAR | AAA10256-22 | CAS:328-50-7 |
| Tentagel Resin with RINK linker | Rapp-Polymere | S30023 | |
| Alanine transaminase | Roche | 10105589001 | AKA: Glutamate-Pyruvate Transaminase (GPT) |
| Incubator | New Brunswick Scientific | Innova44 | |
| NMR | Bruker | 400 MHz | |
| MALDI mass spectrometer | Applied Biosystems | 4800 MALDI-TOF/TOF | |
| Lyophilizer | SP Scientific | VirTis benchtop K | |
| Syringe reactor | INTAVIS | Reaction Column | 3 ml, 5 ml, 10 ml, 20 ml |
| Vacuum manifold | Promega | A7231 | Vac-Man |
Referenzen
- Xiao, X., Yu, P., Lim, H. -. S., Sikder, D., Kodadek, T. Design and Synthesis of a Cell-Permeable Synthetic Transcription Factor Mimic. Journal of Combinatorial Chemistry. 9, 592-600 (2007).
- Miller, S. M., et al. Proteolytic Studies of Homologous Peptide and N-Substituted Glycine Peptoid Oligomers. Bioorganic & Medicinal Chemistry Letters. 4, 2657-2662 (1994).
- Grauer, A., Konig, B. Peptidomimetics - A Versatile Route to Biologically Active Compounds. European Journal of Organic Chemistry. 30, 5099-5111 (2009).
- Zuckermann, R. N., Kerr, J. M., Kent, S. B. H., Moos, W. H. Efficient method for the preparation of peptoids [oligo(N-substituted glycines)] by submonomer solid-phase synthesis. Journal of the American Chemical Society. 114, 10646-10647 (1992).
- Figliozzi, G. M., Goldsmith, R., Ng, S. C., Banville, S. C., Zuckermann, R. N. Synthesis of N-substituted glycine peptoid libraries. Methods in Enzymology. 267, 437-447 (1996).
- Seebach, D., et al. beta-peptides: Synthesis by Arndt-Eistert homologation with concomitant peptide coupling. Structure determination by NMR and CD spectroscopy and by X-ray crystallography. Helical secondary structure of a beta-hexapeptide in solution and its stability towards pepsin. Helv Chim Acta. 79, 913-941 (1996).
- Lam, K. S., et al. A New Type of Synthetic Peptide Library for Identifying Ligand-Binding Activity. Nature. 354, 82-84 (1991).
- Simon, R. J., et al. Peptoids - a Modular Approach to Drug Discovery. Proceedings of the National Academy of Sciences of the United States of America. 89, 9367-9371 (1992).
- Burkoth, T. S., et al. Toward the synthesis of artificial proteins: the discovery of an amphiphilic helical peptoid assembly. Chem Biol. 9, 647-654 (2002).
- Alluri, P. G., Reddy, M. M., Bachhawat-Sikder, K., Olivos, H. J., Kodadek, T. Isolation of protein ligands from large peptoid libraries. Journal of the American Chemical Society. 125, 13995-14004 (2003).
- Lim, H. S., Archer, C. T., Kodadek, T. Identification of a peptoid inhibitor of the proteasome 19S regulatory particle. Journal of the American Chemical Society. 129, 7750-7751 (2007).
- Wrenn, S. J., Weisinger, R. M., Halpin, D. R., Harbury, P. B. Synthetic ligands discovered by in vitro selection. Journal of the American Chemical Society. 129, 13137-13143 (2007).
- Aina, O. H., Marik, J., Liu, R. W., Lau, D. H., Lam, K. S. Identification of novel targeting peptides for human ovarian cancer cells using "one-bead one-compound" combinatorial libraries. Mol Cancer Ther. 4, 806-813 (2005).
- Udugamasooriya, D. G., Dineen, S. P., Brekken, R. A., Kodadek, T. A Peptoid “Antibody Surrogate” That Antagonizes VEGF Receptor 2 Activity. Journal of the American Chemical Society. 130, 5744-5752 (2008).
- Shah, N. H., et al. Oligo( N-aryl glycines): A New Twist on Structured Peptoids. Journal of the American Chemical Society. 130, 16622-16632 (2008).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proceedings of the National Academy of Sciences of the United States of America. 105, 2794-2799 (2008).
- Paul, B., et al. N-Naphthyl Peptoid Foldamers Exhibiting Atropisomerism. Organic Letters. 14, 926-929 (2012).
- Crapster, J. A., Guzei, I. A., Blackwell, H. E. A peptoid ribbon secondary structure. Angewandte Chemie. 52, 5079-5084 (2013).
- Gorske, B. C., Stringer, J. R., Bastian, B. L., Fowler, S. A., Blackwell, H. E. New strategies for the design of folded peptoids revealed by a survey of noncovalent interactions in model systems. J Am Chem Soc. 131, 16555-16567 (2009).
- Stringer, J. R., Crapster, J. A., Guzei, I. A., Blackwell, H. E. Extraordinarily robust polyproline type I peptoid helices generated via the incorporation of alpha-chiral aromatic N-1-naphthylethyl side chains. J Am Chem Soc. 133, 15559-15567 (2011).
- Huang, K., et al. A threaded loop conformation adopted by a family of peptoid nonamers. Journal of the American Chemical Society. 128, 1733-1738 (2006).
- Lee, J. H., Kim, H. S., Lim, H. S. Design and Facile Solid-Phase Synthesis of Conformationally Constrained Bicyclic Peptoids. Organic Letters. 13, 5012-5015 (2011).
- Gao, Y., Kodadek, T. Synthesis and Screening of Stereochemically Diverse Combinatorial Libraries of Peptide Tertiary Amides. Chem Biol. 20, 360-369 (2013).
- Urban, J., Vaisar, T., Shen, R., Lee, M. S. Lability of N-alkylated peptides towards TFA cleavage. Int J Pept Protein Res. 47, 182-189 (1996).
- Rzuczek, S. G., Gao, Y., Tang, Z., Thornton, C. A., Kodadek, T., Disney, M. D. Features of Modularly Assembled Compounds That Impart Bioactivity Against an RNA Target. ACS Chemical Biology. 8 (10), 2312-2321 (2013).
- Thern, B., Rudolph, J., Jung, G. Triphosgene as highly efficient reagent for the solid-phase coupling of N-alkylated amino acids—total synthesis of cyclosporin O. Tetrahedron Letters. 43, 5013-5016 (2002).
- Sleebs, M. M., Scanlon, D., Karas, J., Maharani, R., Hughes, A. B. Total Synthesis of the Antifungal Depsipeptide Petriellin A. J Org Chem. 76, 6686-6693 (2011).
- Vaisar, T., Urban, J. Gas-phase fragmentation of protonated mono-N-methylated peptides. Analogy with solution-phase acid-catalyzed hydrolysis. Journal of Mass Spectrometry. 33, 505-524 (1998).
- Creighton, C. J., Romoff, T. T., Bu, J. H., Goodman, M. Mechanistic studies of an unusual amide bond scission. Journal of the American Chemical Society. 121, 6786-6791 (1999).
- Sewald, N., Sewald, N. Efficient, racemization-free peptide coupling of N-alkyl amino acids by using amino acid chlorides generated in situ--total syntheses of the cyclopeptides cyclosporin O and omphalotin A. Angewandte Chemie (International ed. in English). 41, 4661-4663 (2002).
- Astle, J. M., et al. Seamless Bead to Microarray Screening: Rapid Identification of the Highest Affinity Protein Ligands from Large Combinatorial Libraries. Chem Biol. 17, 38-45 (2010).
- Strohalm, M., Kavan, D., Novak, P., Volny, M., Havlicek, V. mMass 3: a cross-platform software environment for precise analysis of mass spectrometric data. Anal Chem. 82, 4648-4651 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten