Method Article
Síntesis Split-y-piscina y caracterización del péptido Terciario Amida Biblioteca
En este artículo
Resumen
Amidas terciarias péptido (PTA) son una superfamilia de peptidomiméticos que incluyen pero no se limitan a péptidos, peptoides y péptidos N-metilado. Aquí se describe un método de síntesis que combina estrategias de sub-monómero división y piscina y para sintetizar un solo grano de la biblioteca de un compuesto de las PTA.
Resumen
Peptidomiméticos son una gran fuente de proteínas ligandos. La naturaleza oligomérica de estos compuestos nos permite acceder a las grandes bibliotecas sintéticos en fase sólida mediante el uso de la química combinatoria. Una de las clases más estudiados de peptidomiméticos es peptoides. Los peptoides son fáciles de sintetizar y han demostrado ser resistentes a la proteolisis-y-permeable a las células. Durante la última década, muchos ligandos proteicos útiles han sido identificados a través de la selección de bibliotecas de peptoides. Sin embargo, la mayoría de los ligandos identificados a partir de las bibliotecas de peptoides Excluir alta afinidad, salvo raras excepciones. Esto puede ser debido, en parte, a la falta de centros quirales y restricciones conformacionales en moléculas de peptoides. Recientemente, hemos descrito una nueva ruta sintética para acceder amidas terciarias de péptidos (ACP). PTA son una superfamilia de peptidomiméticos que incluyen pero no se limitan a péptidos, peptoides y péptidos N-metilado. Con cadenas laterales en ambos principales átomos de nitrógeno de la cadena α-carbono y,la conformación de estas moléculas se ven limitados en gran medida por impedimento estérico y alílico 1,3 cepa. (Figura 1) Nuestro estudio sugiere que estas moléculas PTA están altamente estructurados en solución y pueden ser utilizados para identificar ligandos de proteínas. Creemos que estas moléculas pueden ser una futura fuente de ligandos de proteínas de alta afinidad. A continuación se describe el método sintético que combina el poder de ambos estrategias sub-monómero división y piscina y para sintetizar una muestra de una perla de un compuesto (OBOC) Biblioteca de los ACP.
Introducción
Los peptidomiméticos son compuestos que imitan la estructura de los péptidos naturales. Están diseñados para retener la bioactividad, mientras que superar algunos de los problemas asociados con los péptidos naturales, incluyendo la permeabilidad celular y estabilidad frente a la proteolisis 1-3. Debido a la naturaleza oligomérica de estos compuestos, grandes bibliotecas sintéticas se puede acceder fácilmente a través de rutas sintéticas monoméricos o sub-monoméricos 4-7. Una de las clases más estudiados de peptidomiméticos es peptoides. Los peptoides son oligómeros de glicinas N-alquilados que se pueden sintetizar fácilmente usando una estrategia de sub-monómero 8, 9. Muchos ligandos proteicos útiles se han identificado con éxito a partir de la selección de grandes bibliotecas de peptoides sintética contra objetivos proteicos 1, 10-14. No obstante, "hits" identificados a partir de las bibliotecas de peptoides raramente archivo muy alta afinidad hacia dianas proteicas 1,10-14,22. Una major diferencia entre peptoides y péptidos naturales es que la mayoría de los peptoides generalmente carecen de la capacidad de formar una estructura secundaria debido a la falta de centros quirales y restricciones conformacionales. Para resolver este problema, se han desarrollado múltiples estrategias en la última década, en gran parte se centra en la modificación de las cadenas laterales contenidos en las principales cadena de átomos de nitrógeno de 15-22. Recientemente, hemos desarrollado una nueva ruta sintética para introducir cadenas laterales de aminoácidos naturales en una cadena principal de peptoide para crear péptidos amidas terciarias 23.
Amidas terciarias péptido (PTA) son una superfamilia de peptidomiméticos que incluyen pero no se limitan a péptidos (R2 = H), peptoides (R1 = H) y los péptidos N-metilado (R ≠ 1 H, R2 = Me) . (Ver Figura 1) Nuestra ruta sintética emplea aminoácidos de origen natural como la fuente de quiralidad y con unas cadenas en el45;-carbono, y aminas primarias disponibles en el mercado para proporcionar N-sustituciones. Por lo tanto, un espacio químico mayor que el de los péptidos simples, peptoides o péptidos N-metilado puede ser explorado. Los espectros de dicroísmo circular han demostrado que las moléculas de la PTA están altamente estructurados de solución. Caracterización de uno de los complejos proteína-PTA muestra claramente que se requieren las restricciones conformacionales de la PTA para la unión. Recientemente, también hemos descubierto que algunas de las moléculas de la PTA poseen una mejor permeabilidad de la célula que sus contrapartes de peptoides y péptidos. Creemos que estas bibliotecas PTA pueden ser una buena fuente de ligandos de alta afinidad para dianas proteicas. En este artículo, vamos a discutir la síntesis de una muestra de una perla de un compuesto (OBOC) Biblioteca de PTA en los detalles, junto con algunas condiciones mejoradas para el acoplamiento y la escisión de estos compuestos.
Protocolo
1. Fundamentos de Split-y-piscina Síntesis
Con el fin de generar eficientemente un gran número de compuestos en fase sólida, la síntesis de división y la piscina se emplea a menudo como una estrategia general. Como se muestra en la Figura 4, TentaGel perlas son primero se dividió en tres porciones. Cada porción se hace reaccionar con un reactivo diferente, generando el primer residuo sobre perlas. Después de la primera reacción, todas las tres porciones se combinaron juntos, se mezclan, y después se dividieron de nuevo en tres porciones. Cada porción volverá a reaccionar con un reactivo diferente, generando el segundo residuo sobre perlas. Después de dos pasos división y la piscina, se generan nueve compuestos.
En la síntesis de sub-monómero, perlas se dividan primero en varias porciones para reaccionar con diferentes ácidos bromo en presencia de reactivo de acoplamiento. Después de lavar con disolvente, todas las perlas se agruparon juntos y se mezclan, a continuación, de nuevo dividido en varias porciones para reaccionar con diferenteaminas primarias. Después de aminación, todas las cuentas se agruparon y se lavan a fondo, completando un monómero completa en cada cuenta. Este proceso se puede repetir hasta que se alcanza la diversidad deseada.
2. Preparación de ácido Bromuro de aminoácidos naturales
En la síntesis de sub-monómero, la síntesis de cada monómero se divide en dos etapas separadas:. 1 de acoplamiento de bromuro de ácido y 2 aminación con aminas primarias (Figura 2).. Con el fin de sintetizar una amida terciaria péptido, bromuros de ácido quiral con cadenas laterales en el carbono alfa se preparan a partir de los aminoácidos naturales. A continuación se describe el método de transformación de un aminoácido natural en el bromuro de ácido correspondiente con una alta fidelidad estéreo. Utilizamos alanina como un ejemplo; otros aminoácidos que incluyen serina, treonina, ácido aspártico, ácido glutámico, asparagina, glutamina, glicina, valina, isoleucina, fenilalanina también se pueden transformar en ácidos bromo bajo conditio similaresns. Tenga en cuenta que algunos de los aminoácidos con grupos funcionales como fenol, guanidina y amina necesitan ser protegidos antes de la transformación. La configuración de reacción se muestra en la Figura 3.
Precauciones de seguridad: Para que se necesitan los siguientes reacciones que involucran HBr, NaNO2 y otros productos químicos corrosivos / tóxicos, equipo de seguridad adecuado, como gafas de seguridad, bata de laboratorio y guantes resistentes a productos químicos. Todas las reacciones se deben realizar en una campana extractora por el químico experto.
- Añadir 370 ml de agua en 630 ml de solución de HBr al 48% para preparar un 1 L, solución de HBr al 30%. Añadir 500 ml de etilenglicol en un recipiente de baño de 1 L; agregue hielo seco para mantener la temperatura a -10 ° C. Precaución: solución de HBr al 48% es muy ácido y corrosivo, manejar con cuidado. Lea la MSDS antes de usar.
- Añadir D-alanina (8,9 g, 0,1 mol) y KBr (11,9 g, 0,1 moles) a un ml de tres bocas matraz de fondo redondo de 250 con una barra de agitación magnética. Añadir 100 ml, y el HBr al 30% preparado en tque paso anterior. Poner el matraz en el baño de glicol de etileno preparado en el paso 2.1 y mantener la temperatura a -10 ° C. Burbuja de argón a través de una aguja larga de la parte inferior del matraz durante 10 min como se muestra en la Figura 3. Agitar la solución con la barra de agitación magnética a 300 rpm.
- Disolver NaNO2 (8,28 g, 0,12 mol) en un vaso de precipitados de 100 ml con 20 ml de agua. Añadir la solución en el embudo de goteo de igualación de presión y sellar el embudo de goteo con un septo. Gire lentamente la válvula del embudo de goteo y se dejó que la solución de NaNO2 gota en el matraz. Controlar la válvula para ajustar el índice de goteo a aproximadamente 2 gotas por segundo. Mantener la agitación a 300 rpm y mantener el burbujeo de argón desde el fondo del matraz. El matraz se debe mantener en el baño de etileno glicol a -10 ° C hasta que se añade todo de NaNO 2. Precaución: Este paso genera calor y de gas durante la adición de la solución de NaNO 2. Tasa de goteo debe ser cuidadosamente estafatrolled y todo el sistema debe ser abierto a través de la toma de corriente de argón.
- Mantener la agitación durante 3 horas más y dejó que la temperatura de calentamiento de -10 ° C a la temperatura ambiente. La solución resultante debe ser transparente a amarillo claro; si el color es demasiado oscuro, aplicar vacío para eliminar los óxidos de nitrógeno en exceso y posible Br 2 generado durante la reacción.
- Se extrae el producto de la solución con 3x 35 ml de dietil éter utilizando un embudo de extracción. Combinar la fase orgánica y se lava con salmuera saturada. La fase orgánica también se puede lavar con una pequeña cantidad de NaHCO3 antes de lavar con salmuera para eliminar el color si es de noche. Se seca la fase orgánica sobre Na 2 SO 4 durante 6 horas.
- Filtrar el Na 2 SO 4 y se evapora el disolvente a vacío, el producto crudo se debe obtener tan claro para aceite amarillo pálido. El producto bruto puede purificarse adicionalmente por destilación a 115 ° C, 3 mm Hg, o porcolumna de sílice con 3:1 de hexano: acetato de etilo.
- El producto puro se obtuvo en forma de aceite claro, 6,6 g (rendimiento 74%), densidad = 1,69 g / ml, [α] D20 = 24 ° (metanol), 1 H RMN (400 MHz, CDCl3) δ 4,41 (q, J = 7,0 Hz, 1H), 1,86 (d, J = 7,0 Hz, 3H). En el caso de (S)-2-bromopropanoico ácido d-4 (preparado a partir de 4 D-L-alanina), producto puro se obtuvo en forma de aceite transparente, rendimiento 78%, densidad = 1,72 g / ml, [α] D20 = -19 ° (metanol). 1 H RMN, no se observa ninguna señal de H significativa. ESI-MS - [M-1] - = 155,1 (154,97 espera). Para (S)-4-metilpentanoico 2-bromo-ácido (preparado a partir de L-leucina utilizando el mismo procedimiento) de producto puro se obtuvo en forma de aceite transparente, rendimiento 89%, [α] D20 = 37 ° (metanol), 1 H RMN (400 MHz, CDCl3) δ 4,30 (t, J = 7,7 Hz, 1H), 1,94 (dd, J = 10,8, 3,9 Hz, 2H), 1,81 (tt, J = 13,2, 6,5 Hz, 1H), 0,96 (dd, J = 18,2, 6,6 Hz, 7H). En el caso de (S)-2-bromo-3-Pheácido nylpropanoic (preparado a partir de L-fenilalanina utilizando el mismo procedimiento) de producto puro se obtuvo en forma de aceite de color amarillo pálido, rendimiento 72%, [α] D20 = 17 ° (metanol), 1 H RMN (400 MHz, CDCl3) δ 7,38 - 7,19 (m, 5H), 4,42 (dd, J = 8,1, 7,3 Hz, 1H), 3,47 (dd, J = 14,2, 8,2 Hz, 1H), 3,25 (dd, J = 14,2, 7,2 Hz, 1H).
3. Marcaje isotópico de alanina transaminasa Uso
En la síntesis de biblioteca combinatoria, especialmente en la síntesis de división-y-piscina de una perla un compuesto (OBOC) bibliotecas, la cantidad de compuesto que se puede obtener a partir de cada perla es relativamente pequeña. (Típicamente 1 pmol a 10 nmol). Además, la espectrometría de masas se utiliza ampliamente para la identificación y caracterización del compuesto final debido a su alta sensibilidad. Con el fin de utilizar la espectrometría de masas para determinar la estereoquímica absoluta en los centros quirales de los productos finales de la PTA, enantiómeros de ácido bromo deben ser IsotoPically etiqueta antes de usar. A continuación se describe el procedimiento de uso de las transaminasas y D 2 O a la etiqueta L-alanina.
- Disolver-L-alanina (300 mg, 3,36 mmol) con 10 ml de D2O en un tubo de polietileno de 50 ml. Añadir α-cetoglutarato (10 mg, 0,068 mmol) como co-sustrato. Caliente el tubo a 37 ° C y ajustar el pD a 8.5 a 8.7 utilizando un soution 1 M NaOD. Nota: PD es determinada por las tiras de prueba de pH. Tradicional metros electro pH equipado con electrodo de vidrio selectivo para H + puede dar incorrecta leer para D +.
- Añadir transaminasa alanina (0,1 mg, EC 2.6.1.2 del corazón de cerdo, Roche Diagnostics, Indianapolis, IN) a la DP 8.5 a 8.7, 37 ° C la solución preparada en el paso anterior. Poner el tubo en un 37 ° C incubadora y se incuba durante la noche con agitación suave, se prefiere de 10 a 30 rpm.
- Después de la incubación durante toda la noche, tomar 0,5 ml de la solución D O 2 y comprobar el progreso de la reacción por 1H-RMN. Todas las señales de protones de unlanina, δ 3,76 (q, J = 7,2 Hz, 1H), 1,46 (d, J = 7,3 Hz, 3H), 1 H RMN 400 MHz, debe ser suprimida en gran medida debido a la deuteración. Más de 98% del protón debe ser intercambiado a deuterio como se ha descrito previamente 23. Nota: D 2 O pueden ser parcialmente recuperada por destilación, si la reacción se lleva a cabo en gran escala (> 200 ml D 2 O). Normalmente, 60% a 80% de D2O puede ser destilada de la solución.
- Congelar la solución anterior con nitrógeno líquido y liofilizar utilizando un liofilizador para obtener blanco deuterado polvo de L-alanina.
4. Síntesis de peptoide vinculador Región
La región de engarce no es necesaria para la síntesis de la biblioteca de PTA. Sin embargo, con el fin de evitar el alto fondo en el intervalo de peso molecular inferior (100-600) de la espectroscopia de masas MALDI y para mejorar la ionización de los compuestos, se utiliza a menudo un enlazador peptoide con múltiples residuos polares. Esta peptoide linker puede sintetizarse mediante el procedimiento de síntesis peptoide estándar. Aquí vamos a sintetizar un pentámero de glicina N-metoxietilo como el enlazador (como se muestra en la Figura 5).
- Swell 90 micras perlas TentaGel con enlazador de RAM (1 g, 0,27 mmol / g) en 10 ml de DMF durante 3 h en un reactor de jeringa de 12 ml con agitación suave.
- Vaciar el DMF del reactor y añadir solución de DMF de piperidina 10 ml de 20% para desproteger el grupo Fmoc de la amida de Rink enlazador. Agitar las perlas con la solución de piperidina al 20% durante 30 min. Lavar con DMF 5x para eliminar todo piperidina.
- Tómese unos granos fuera de la jeringa y probarlo con la prueba de cloranilo. Cuentas deben dar vuelta a marrón oscuro (ensayo de cloranilo positivo para amina primaria) si fmoc se desprotege con éxito.
- Preparar las siguientes soluciones: 1. 20 ml, solución 2 M de ácido bromoacético / DMF; 2 20 ml, solución 2 M DIC / DMF.; 3. 10 ml, 1 M de solución de methoxylethylamine / DMF.
- Añadir 5 ml de solución 2 M de ácido bromoacético / DMF paralas perlas, sacuden suavemente. A continuación, añadir 5 ml de solución 2 M de DIC / DMF a las perlas; sellar la jeringa con el émbolo y lo puso en la coctelera. Agitar durante 10 min.
- Lavar las perlas con DMF a fondo. Añadir 2 ml de solución 1 M metoxietilamina / DMF preparados a partir de paso 4,4 a las perlas. Selle la jeringa con el émbolo y agite en el agitador durante 30 min.
- Lave las perlas con DMF 5x. Revise algunas cuentas con la prueba de cloranilo, si positivas (perlas se vuelven azules), y luego continuar con el siguiente paso. De lo contrario, repita el paso 4.6.
- Repita los pasos 4.5 hasta 4.7, 4 veces para completar el pentámero.
. 5 Split-and-pool Síntesis de la Biblioteca de la PTA con (R) - y (S)-2-bromo-propiónico Ácidos
Aquí se describe la síntesis de una pequeña biblioteca PTA con una diversidad teórica de 9.261 compuestos utilizando el 1 g de cuentas desde el paso 4.8. Tenga en cuenta que un cordón TentaGel 90 micras contiene aproximadamente 2,9 millones de cuentas por gramo; Por lo tanto, la redundancia dela biblioteca será de 2,9 x 10 6/9261 = 312 copias. Vamos a utilizar ácido bromoacético, (R)-2-bromopropanoico y la etiqueta isotópica (S)-2-bromopropanoico ácido d-4 como los ácidos, y 7 aminas diferentes (A1 ~ A7, véase la Figura 5 para los detalles) para la aminación. Reactores de jeringa y un colector de vacío se utilizan para realizar la síntesis.
- Añadir 10 ml de 1:1 de DCM: DMF para la jeringa de la etapa 4.8; utilizar una pipeta de 1.000 l con una pipeta de punta truncada para dividir todos los cordones 1 g uniformemente en tres reactores 5 ml jeringa. Etiqueta como B (ácido bromoacético), R ((R)-2-bromopropanoico) y S ((S)-2-bromopropanoico ácido d-4). Lave todas las 3 jeringas con DCM 3x, y lavar las jeringas marcadas con R y S con THF anhidro 3x, lavar la jeringa marcada con B con DMF 3x.
- Jeringa R y S. Acoplamiento BTC de ácido bromopropanoico.
- Prepare una solución BTC / THF fresco. Añadir unaproximadamente 200 mg de BTC en el vial en una campana extractora, selle con la tapa. Pesar la cantidad de BTC en el vial. Calcular la cantidad de disolvente necesario y añadir THF anhidro en el vial para hacer una solución de 20 mg / ml de BTC / THF.
- Preparar los ácidos bromo / mezcla BTC. Añadir (R)-2-bromopropanoico ácido (89 l, 0,95 mmol) y (S)-2-bromopropanoico ácido d-4 (89 l, 0,95 mmol) en dos pequeños viales por separado. Para cada vial, añadir 5 ml de la solución de 20 mg / ml de BTC / THF anteriormente. Selle los dos viales y ponerlos en -20 ° C congelador durante 20 min.
- Añadir 1125 l, 02:01 THF / DIPEA (750 l de THF, 375 l de DIPEA, 2,2 mmoles) a la jeringa R y S por separado. Mezcle los gránulos con la punta de la pipeta. Deje que repose durante 5 min.
- Tomar los dos enfrió ácidos bromo / mezclas BTC desde el paso 5.2.2, añadir 2,4,6-trimetilpiridina (356 l, 2,7 mmol) para cada uno viales. Precipitados blancos formarán inmediatamente. Aplicar la suspensión correspondiente directamentea las perlas se basificó (jeringa R y S en el paso 5.2.3) tan pronto como sea posible y luego ponerlos en un agitador a temblar por debajo de 120 rpm durante 2 horas.
Nota: La solución de los reactores de la jeringa debe ser una suspensión amarillenta pálida durante todo el curso de la reacción. Un color más oscuro es una indicación de exceso de calor liberado durante la adición inicial de la solución de cloruro de ácido. Esto puede ser resuelto por un enfriamiento adicional o diluir los ácidos bromo / mezcla de BTC.
- Jeringa B. Acoplamiento de ácido bromoacético con CID
- Preparar un fresco 20 ml, solución de ácido bromoacético 2 M / DMF. Preparar una solución de 20 ml, 2 M DIC / DMF.
- Añadir 2 ml de solución 2 M de ácido bromoacético / DMF para la jeringa B, agite suavemente. Añadir 2 ml de solución 2 M DIC / DMF para la jeringa B, agite suavemente.
- Ponga la jeringa B en la misma coctelera como jeringa R y S , Agitar durante 2 horas. Tenga en cuenta que la reacción de acoplamiento de ácido bromoacético / DIC se realiza dentro de 30 min; tiempo de reacción prolongado es para la conveniencia de la síntesis de división y de la piscina.
- Después de 2 horas, tome la jeringa R, S y B de la coctelera. Lave los tres jeringas completamente con DCM 5x. Entonces lavar con DMF 5x. Tenga en cuenta que la jeringa R y S no pueden ser lavados con DMF antes de ser lavada con DCM o THF primero.
- Piscina todos los granos de las jeringas R, S y B en un reactor de jeringa 12 ml. Lave todas las cuentas con DMF 5x.
- Añadir 10 ml de 1:1 de DCM: DMF para la jeringa; utilizar una pipeta de 1.000 l con una pipeta de punta truncada para dividir todas las perlas en forma pareja en 7 individuales 2 ml jeringas, etiquetarlos como A1-A7.
- Aminación. Preparar 10 ml, 2 soluciones de amina / DMF primarios M para cada uno de los 7 aminas enumeradas en la Figura 5. Añadir 5 ml de EACh solución de amina a la jeringa correspondiente A1-A7. Incubar todas las 7 jeringas en una incubadora de 60 ° C con agitación durante la noche.
- Después de la incubación, lavar todas las cuentas a fondo con DMF. Tome algunas de cuentas de cada jeringa y comprobar con la prueba de cloranilo. Si las cuentas se vuelven verdes (positivo) a menos de 3 min, continúe con el próximo paso. Si es negativo, repita el paso 5.7 para las jeringas negativos.
- Repita los pasos 5.1 a 5.8 2x para completar el trimer. Paso opcional: Después de cada ciclo, se recomienda comprobar la calidad de la síntesis mediante espectroscopía de masas tal como se describe a continuación. Todos los 9.261 compuestos están sintetizados en la perla TentaGel como biblioteca OBOC.
- Misa de confirmación espectroscópica de los ACP.
PTA son oligómeros altamente estructurados y poseen muchas características comunes de los péptidos N-metilados. Uno de los problemas comunes de síntesis en fase sólida de los péptidos N-metilado es la degradación de ácido durante la separación con TFA. Para suprimir la degradación del ácido, la escisión de moléculas como la ciclosporina desdesoporte sólido se lleva a cabo a menudo en condiciones de baja temperatura. Se compararon diversas condiciones de escisión para escindir moléculas diferentes PTA del soporte sólido. Hemos encontrado que, en general, baja temperatura y reducción de la concentración de TFA podrían reprimir eficazmente la degradación del ácido y proporcionar compuestos puros.- Preparar 10 ml de solución 01:01 de TFA / DCM en un tubo de 15 ml. Selle el tubo y lo puso en un congelador de -20 ° C durante 20 min.
- Lavar las perlas que necesitan ser escindido con DCM 5x. Agitar las perlas en DCM durante 15 min y lavar las perlas de nuevo con DCM 5x.
- Escurrir el DCM de la jeringa. Utilice un microscopio de luz y una pipeta con la punta truncada para transferir cada cuenta individuo en una placa de 96 pocillos, una perla por pocillo.
- Cubrir la placa de 96 pocillos con un cubre. Poner la placa en un congelador de -20 ° C durante 15 min.
- Tome el 01:01 solución de TFA / DCM enfriado desde el paso 5.10.1 y añadir 20 l a cada uno de los pocillos que contiene un cordón. Coloque la hoja de la cubierta hacia atrás y put la placa de 96 pocillos en un agitador en el -20 ° C nevera.
- Agitar durante 20 min. Tome la placa de 96 pocillos y retire la hoja de la cubierta. Seque el TFA / DCM de cada pocillo soplando aire o argón sobre él. Si se escinden más de 10 granos, un SpeedVac se puede utilizar para secar el TFA / DCM de toda la placa. Tenga en cuenta que en este punto, no todos los compuestos se escinden de los granos, pero los compuestos escindidos debería ser más que suficiente para llevar a cabo el análisis de espectroscopia de masas.
- Añadir 20 l 6:04 de ACN: H2O solución para disolver los compuestos escindidos de cada pocillo. Puntual 0,6 l de cada solución de compuesto junto con 0,6 l de matriz CHCA MALDI en la placa de MALDI.
- Utilice la espectrometría de masas MALDI para determinar el peso molecular y la secuencia (MS / MS) de cada compuesto.
6. Ensayo de cloranilo
- Preparar los siguientes reactivos frescos para cada prueba. Solución A: 2% cloranilo (CAS: 118-75-2) en DMF. SoluciónB: 2% acetaldehído (CAS: 75-07-0) en DMF.
- Mezclar 100 l de la solución A con 100 l de solución B antes de la prueba en un tubo de 1,5 ml; soltar los granos y agite suavemente. Si las perlas se vuelven azules dentro de 5 min, que indica la presencia de amina secundaria en la superficie de las perlas. Las aminas primarias dan un color marrón oscuro en lugar de azul girando.
Resultados
Aquí mostramos tres espectros MALDI representativas de un trímero PTA con enlazador. Como se muestra en la Figura 6A, cuando se escinde en condiciones de temperatura ambiente con solución de TFA / DCM al 50%, se observa una degradación significativa. En la figura 6A, el pico 593 y 484 se corresponden con el enlazador y el trímero PTA respectivamente, muestran que la molécula se sintetiza con éxito en grano pero degradó durante la segmentación. Cuando escindido bajo condiciones de baja temperatura como se describió anteriormente, la cantidad de degradación inducida por TFA se suprime en gran medida, como se muestra en la Figura 6B. El mecanismo de dicha escisión ha sido descrita en la literatura anteriores 24, y se cree que ir a través de un intermedio de oxazolidina. Moléculas PTA pueden ser secuenciados por MS / MS y el patrón de fragmentación es similar a la de péptidos y peptoides, como se muestra en la Figura 6C. PTA moléculas sintetizadas con (S)-2-bromopropanoico ácido d-4 generalmente give pico más ancho en MS y MS / MS espectros debido a la presencia de productos de deuteración incompletos, tales como (S)-2-bromopropanoico ácido d-3 (Figuras 7A y 7B). Esto podría ser utilizado como una indicación de la presencia del centro de I quiral (invertida de S durante aminación) durante el procedimiento de secuenciación. También se encontró que las moléculas de la PTA tienen una tendencia a formar aductos más sodiated que péptido peptoide /, por lo tanto, el agua baja en sodio (como agua desionizada) y un aparato de plástico se prefieren (Figura 7C). Otro producto que se pudo observar en la síntesis de PTA es la acrilamida formada a partir de la eliminación de bromuro durante aminación (Figura 7C). Una vez que se forma la acrilamida, la secuencia se termina. Esto se puede resolver mediante la reducción de la concentración de la amina primaria a 1 M con el fin de reducir la basicidad de la solución. Se recomienda realizar la prueba de cloranilo después de cada etapa de acilación y utilizando spectr masaoscopy para comprobar el producto después de cada etapa de aminación para asegurar la calidad de la biblioteca.
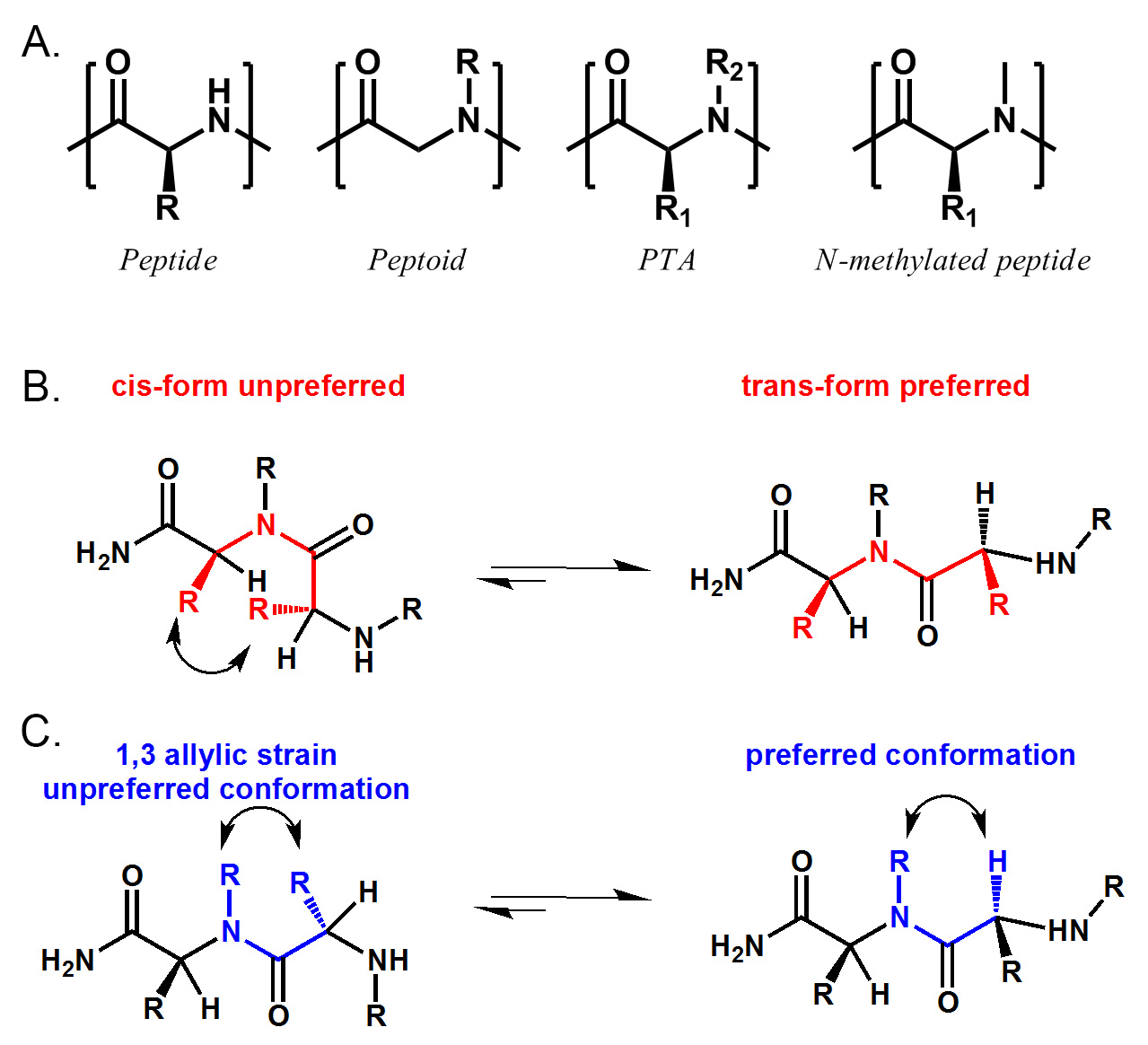
Figura 1. Estructural comparación de péptido, peptoide, PTA y péptido N-metilado. PTA incluye péptido (R2 = H), peptoide (R1 = H) y el péptido N-metilado (R ≠ 1 H, R2 = Me) . B) PTA prefiere trans conformación enlace amida debido al impedimento estérico entre dos cadena lateral α. C) PTA también tiene una conformación preferida por 1,3 cepa alílico entre N-sustitución y cadena lateral α. Haga clic aquí para ver una versión más grande de esta figura.
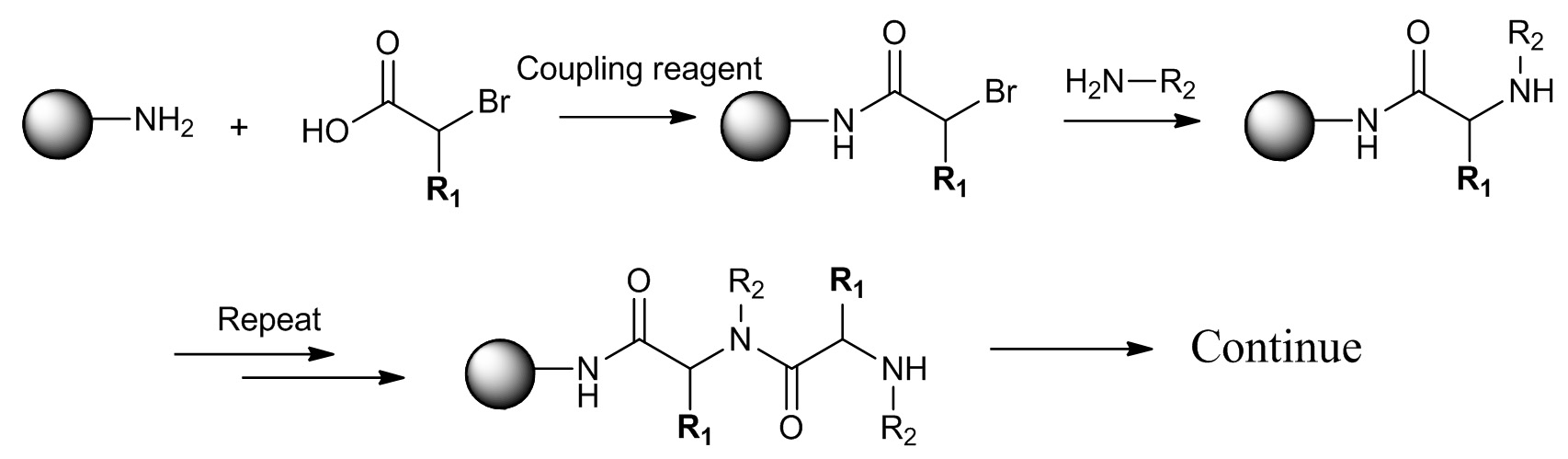
Figura 2. Síntesis Sub-monómero de peptoide (R 1 = H) y la PTA (R ≠ 1 H). El primer paso es la acilación de ácido de la amina. El segundo paso es la aminación con aminas primarias. Haga clic aquí para ver una versión más grande de esta figura.
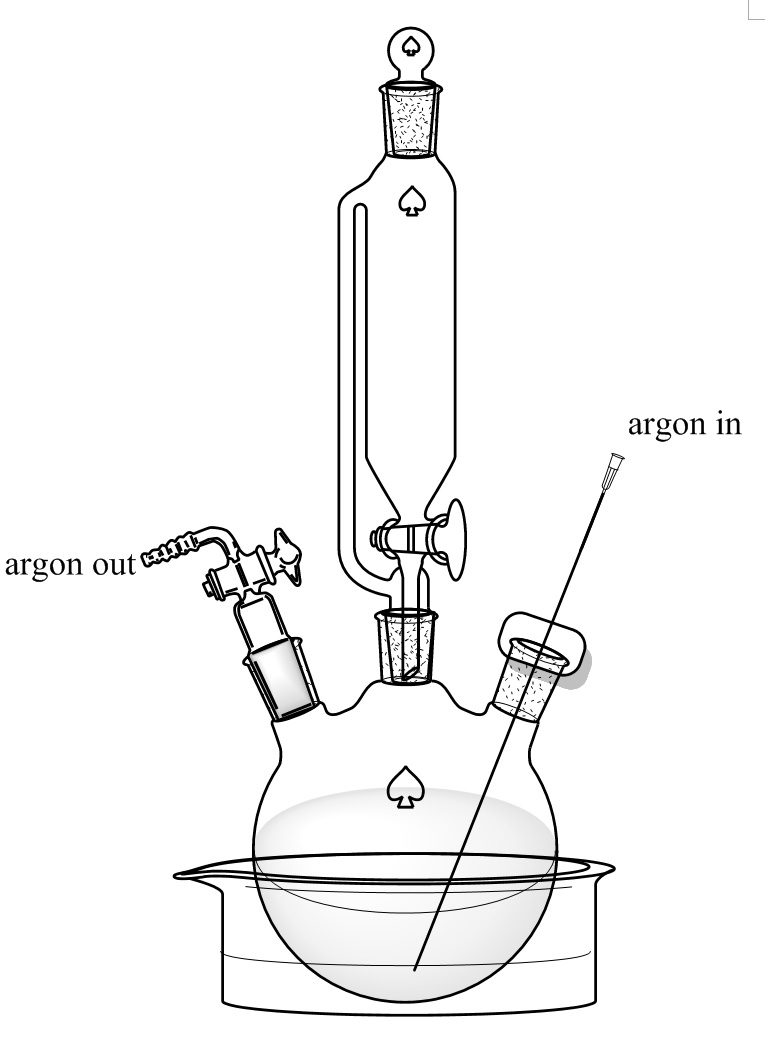
Figura 3. Configuración reacción. Un ml de tres bocas matraz de fondo redondo de 250 se puso en un baño de hielo / etileno glicol baño seco. El cuello medio está conectado con una presión de 150 ml de igualación de embudo de goteo. Los cuellos izquierdo y derecho están sellados con un adaptador de control de flujo y un tabique Won una aguja larga que permite el flujo de argón atraviese. Haga clic aquí para ver una versión más grande de esta figura.
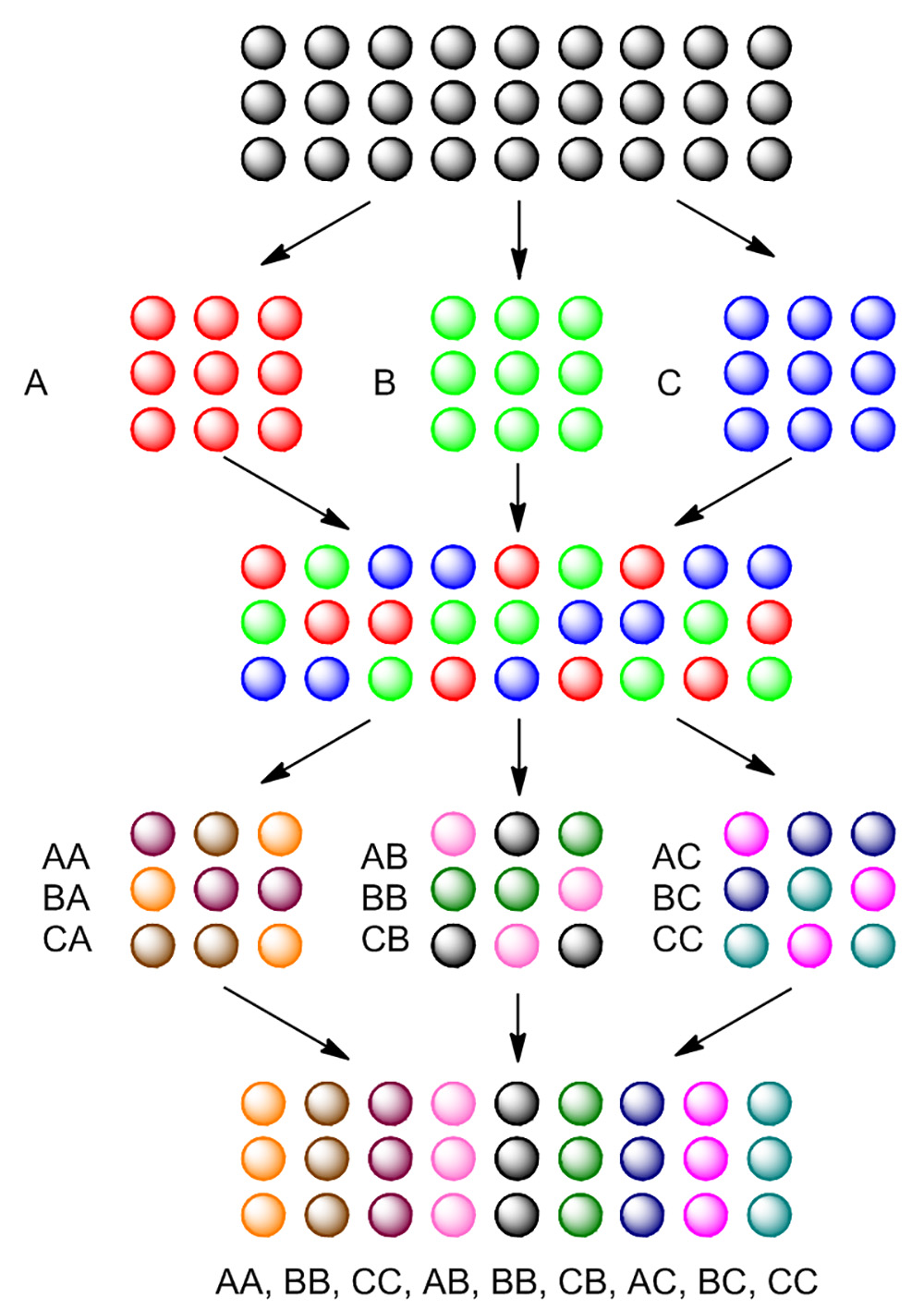
Figura 4. Fundamentos de la síntesis de división y piscina. Perlas en blanco se dividieron en tres porciones, tratados por separado con el reactivo A, B y C. Después de la primera reacción, las tres porciones de granos se agrupan juntos y se mezclan. Perlas combinados se dividen de nuevo en tres porciones y se trata de nuevo con el mismo reactivo para cada porción individual. Después de la segunda reacción, 9 diferentes compuestos se sintetizan. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Resumen árbol de. Tres PTA se sintetizan después de que el enlazador peptoide pentamer. Diversidad teórica, 3 3 X 7 3 = 9261. Haga clic aquí para ver una versión más grande de esta figura.
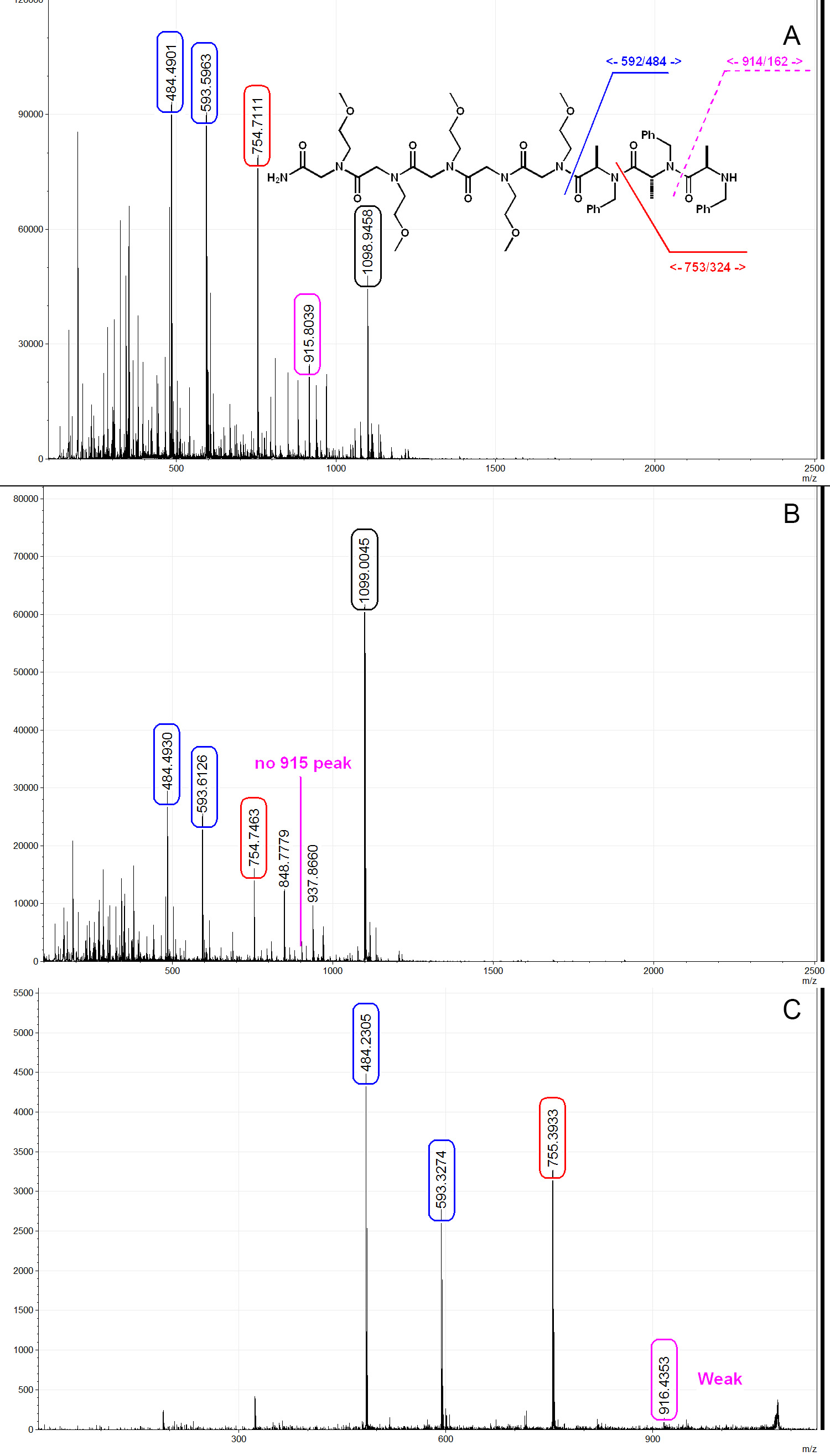
Figura 6. Típica espectros de masas MALDI de un trímero de PTA. Una) Trimer PTA escindido por 50% de TFA / DCM a temperatura ambiente. Estructura de la PTA como se muestra, [M +1] + = 1077, [M + Na] + = 1,098.9, la fragmentación de la PTA de separación con TFA se puede ver claramente en el espectro. B) Trimer escisióned en un 50% de TFA / DCM bajo condiciones optimizadas como se describe en el documento. TFA-inducir la degradación de ácido se suprime en gran medida. C) espectro MS / MS del trímero de PTA. Y7 débil se observa (916) de la señal, este es un comportamiento típico de fragmentación PTA. Spectra analizada y generada por mMass 32. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7. Espectros de MALDI de la síntesis de ATP con la etiqueta isotópica típica de monómero y subproductos. A) Comparación de los espectros de MS de moléculas PTA sintetizados por el azul: (R)-2-bromopropanoico [M +1] + = 760 [M + Na] + = 787 [M + K] + = 803 y rojo: (S) - 2-bromopropanoico ácido d-4 [M +1] + = 764 [M + Na] + = 783 [M + K] + = 799. B) patrones de fragmentación MS / MS de las dos moléculas que se muestran en A). Tenga en cuenta que debido a la presencia de d 1, d 2 d 3 y especias (deuteración incompleta de alanina), moléculas sintetizadas por (S)-2-bromopropanoico ácido d-4 generalmente dan picos más anchos C) Rojo:. Espectro de una PTA dímero sintetizado y escindido bajo condiciones optimizado. Azul:. Dímero PTA sintetiza con una solución 2 M metoxietilamina y se escindió en agua filtrada normales Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Amidas terciarias de péptidos (ACP) son una superfamilia de oligómeros peptidomiméticas. Además de los péptidos bien estudiadas, peptoides y péptidos N-metilado, una gran parte de compuestos dentro de esta familia sigue siendo poco estudiada, mayormente debido a la falta de método sintético para acceder a los péptidos N-alquiladas generales. Aquí se describe un método eficiente para sintetizar las PTA con bloques de construcción quirales derivados de aminoácidos. Anteriormente, hemos informado a usar una nueva ruta sub-monómero a las bibliotecas de la síntesis de las moléculas de la PTA 23. Hemos demostrado que los ACP son oligómeros altamente estructurados que poseen refrena conformacionales a través de la columna vertebral. Cuando se ensaya in vivo, las moléculas de la PTA mostraron mejora la permeabilidad celular y por lo tanto la mejora de la actividad 25. Sin embargo, junto con todas las ventajas, las PTA también vienen con algunos problemas sintéticos, mayormente de la acilación de aminas secundarias en las posiciones impedidos. La cadena lateral α que proporciona conformacionalrestricción también aporta impedimento estérico para la siguiente etapa de acoplamiento. Con el fin de superar estos desafíos sintéticos, se realizó un extenso estudio de optimización y se determinó BTC como el mejor reactivo de acoplamiento para esta reacción 23.
El paso clave de la ruta sintética es BTC facilitó acilación de la amina secundaria. Durante este proceso, la CTB permite la generación de un cloruro de ácido in situ 26,27. La mayoría de los otros reactivos de acoplamiento, que forman o bien ésteres activos o anhídridos de ácidos como productos intermedios no facilitaron acilación limpia para la síntesis de PTA continua. La existencia de unidades de la PTA anteriores perjudica en gran medida la eficiencia de acoplamiento de la siguiente unidad de la PTA debido al impedimento estérico. Por lo tanto, para la síntesis de múltiples PTA, un altamente activo intermedio con un pequeño grupo saliente es fuertemente preferido. Entre todas las condiciones de acoplamiento que hemos probado, generado in situ cloruro de ácido por BTC funciona el BESt en nuestra mano. Sin embargo, incluso con los cloruros de ácido altamente activos, se recomienda para evitar aminas impedidas altamente estéricos tales como aminas primarias α-ramificado en la síntesis de la biblioteca a menos probado con antelación. Aminas aromáticas tales como Anile a menudo conducen a la sustitución incompleta y por lo tanto también se deben evitar. Durante la etapa de acoplamiento BTC, la solución debe ser siempre un color amarillo pálido a naranja; una solución de color más oscuro es una indicación de sobrecalentamiento y puede resultar en un menor rendimiento y una mayor formación de subproductos. En general, esto puede ser resuelto por un enfriamiento adicional de la solución de BTC, reducir el tamaño de la reacción y la transferencia más rápida de la solución de BTC / ácido activado. Además de BTC, N-etoxicarbonil-2-etoxi-1 ,2-dihidroquinolina (EEDQ) es otro reactivo de acoplamiento que funciona bien en la síntesis de la PTA. El intermedio clave es un anhídrido carbónico mezclado con un relativamente pequeño grupo saliente. En el caso de EEDQ, 3 equivalentes de EEDQ se disuelve junto con el ácido en DCM y luego APbandas de capas a las perlas a temperatura ambiente. La reacción se realiza normalmente dentro de 2 horas con agitación suave. Esta reacción libera CO 2 durante la reacción; Por lo tanto, el sistema de reacción no debe ser cerrado.
Otro paso clave es la escisión y la caracterización de las moléculas de PTA. Un patrón de fragmentación MS / MS distintivo se ha observado cuando la secuenciación de moléculas a través de la PTA MALDI-MS/MS (Figura 6). Consta con una baja intensidad de la última de iones y (en púrpura en la Figura 6C y aumento de la intensidad de y6, y5, y4, b2, b3 iones). Patrones análogos se han observado desde la fragmentación del péptido N-metilado en el informe anterior 28. Debido a la mayor estabilidad de la oxazolidina intermedia, péptidos N-metilado tienden a dar iones b fuertes 28. Por otra parte, es bien sabido que el péptido N-metilado son lábil en medio ácido durante tanto de escisión de TFA y espectroscopia de masas MALDI 24,28, 29. Estudio de los mecanismos ha demostrado que debido a la restricción conformacional en la columna vertebral, el átomo de oxígeno del carbonilo del residuo anterior es a menudo en la proximidad del grupo carbonilo en el sitio de escisión, promoviendo así la formación de la oxazolidina intermedia 29. Por las razones mencionadas anteriormente, tanto los ACP y los péptidos N-metilados necesitan ser escindido de soportes sólidos a baja temperatura utilizando concentraciones controladas de TFA 26, 30. En nuestra experiencia, el método de escisión más conveniente para los residuos de PTA individuales se produce a -20 ° C con una solución pre-enfriada, -20 ° C de 50% de TFA / DCM. Este procedimiento suprime en gran medida la formación de productos degradados de ácido.
Después de dominar esta técnica, biblioteca con monómero PTA derivado de otros aminoácidos naturales tales como leucina, fenilalanina, glutamina, etc se puede sintetizar también. Una biblioteca PTA de alta calidad se puede apantallar against diversas dianas proteicas utilizando nuestros publicados previamente los protocolos de detección en grano-31. Hit compuestos identificados a partir de la proyección puede ser caracterizado mediante espectroscopía de masas y resintetizado para una mayor prueba utilizando el protocolo descrito anteriormente.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Los autores desean agradecer al Dr. Jumpei Morimoto y el Dr. Todd Doran de valiosa ayuda. Este trabajo fue apoyado por un contrato del NHLBI (NO1-HV-00242).
Materiales
| Name | Company | Catalog Number | Comments |
| 2,4,6 trimethylpyridine | ACROS | 161950010 | CAS:108-75-8 |
| 2-morpholinoethanamine | Sigma-Aldrich | 06680 | CAS:2038-03-1 |
| 48% HBr water solution | ALFA AESAR | AA14036AT | CAS:10035-10-6 |
| Acetaldehyde | Sigma-Aldrich | 402788 | CAS:75-07-0 |
| Acetonitrile | Fisher | SR015AA-19PS | CAS:75-05-8 |
| Anhydrous tetrahydrofuran (THF) | EMD | EM-TX0277-6 | CAS:109-99-9 |
| Benzylamine | Sigma-Aldrich | 185701 | CAS:100-46-9 |
| bis(Trichloromethyl) carbonate (BTC) | ACROS | 258950050 | CAS:32315-10-9 |
| Bromoacetic acid | ACROS | 106570010 | CAS:79-08-3 |
| Chloranil | Sigma-Aldrich | 23290 | CAS:118-75-2 |
| Cyclohexanemethylamine | Sigma-Aldrich | 101842 | CAS:3218-02-8 |
| D2O | Cambridge Isotope | DLM-4-99.8-1000 | CAS:7789-20-0 |
| D-Alanine | Anaspec | 61387-100 | CAS:338-69-2 |
| Dichloromethane (DCM) | Fisher | BJ-NS300-20 | CAS:75-09-2 |
| Dimethylformamide (DMF) | Fisher | BJ-076-4 | CAS:68-12-2 |
| Ethylene glycol | Oakwood | 44710 | CAS:107-21-1 |
| Isopentylamine | Sigma-Aldrich | W321907 | CAS:107-85-7 |
| KBr | ACROS | 424070025 | CAS:7758-02-3 |
| L-Alanine | Anaspec | 61385-100 | CAS:56-41-7 |
| 3-Methoxypropylamine | Sigma-Aldrich | M25007 | CAS:5332-73-0 |
| 2-Methoxyethylamine | Sigma-Aldrich | 143693 | CAS:109-85-3 |
| N-(3-Aminopropyl)-2-pyrrolidinone | Sigma-Aldrich | 136565 | CAS:7663-77-6 |
| N,N'-Diisopropylcarbodiimide (DIC) | ACROS | 115211000 | CAS:693-13-0 |
| N,N-Diisopropylethylamine (DIPEA) | Sigma-Aldrich | D125806 | CAS:7087-68-5 |
| NaNO2 | ACROS | 424340010 | CAS:7631-99-4 |
| NAOD 40% solution in water | ACROS | 200058-506 | CAS:7732-18-5 |
| Piperidine | ALFA AESAR | A12442-AE | CAS:110-89-4 |
| Piperonylamine | Sigma-Aldrich | P49503 | CAS:2620-50-0 |
| Propylamine | Sigma-Aldrich | 240958 | CAS:107-10-8 |
| Trifluoroacetic acid | Sigma-Aldrich | 299537 | CAS:76-05-1 |
| α-Cyano-4-hydroxycinnamic acid | Sigma-Aldrich | 39468 | CAS:28166-41-8 |
| α-Ketoglutarate | ALFA AESAR | AAA10256-22 | CAS:328-50-7 |
| Tentagel Resin with RINK linker | Rapp-Polymere | S30023 | |
| Alanine transaminase | Roche | 10105589001 | AKA: Glutamate-Pyruvate Transaminase (GPT) |
| Incubator | New Brunswick Scientific | Innova44 | |
| NMR | Bruker | 400 MHz | |
| MALDI mass spectrometer | Applied Biosystems | 4800 MALDI-TOF/TOF | |
| Lyophilizer | SP Scientific | VirTis benchtop K | |
| Syringe reactor | INTAVIS | Reaction Column | 3 ml, 5 ml, 10 ml, 20 ml |
| Vacuum manifold | Promega | A7231 | Vac-Man |
Referencias
- Xiao, X., Yu, P., Lim, H. -. S., Sikder, D., Kodadek, T. Design and Synthesis of a Cell-Permeable Synthetic Transcription Factor Mimic. Journal of Combinatorial Chemistry. 9, 592-600 (2007).
- Miller, S. M., et al. Proteolytic Studies of Homologous Peptide and N-Substituted Glycine Peptoid Oligomers. Bioorganic & Medicinal Chemistry Letters. 4, 2657-2662 (1994).
- Grauer, A., Konig, B. Peptidomimetics - A Versatile Route to Biologically Active Compounds. European Journal of Organic Chemistry. 30, 5099-5111 (2009).
- Zuckermann, R. N., Kerr, J. M., Kent, S. B. H., Moos, W. H. Efficient method for the preparation of peptoids [oligo(N-substituted glycines)] by submonomer solid-phase synthesis. Journal of the American Chemical Society. 114, 10646-10647 (1992).
- Figliozzi, G. M., Goldsmith, R., Ng, S. C., Banville, S. C., Zuckermann, R. N. Synthesis of N-substituted glycine peptoid libraries. Methods in Enzymology. 267, 437-447 (1996).
- Seebach, D., et al. beta-peptides: Synthesis by Arndt-Eistert homologation with concomitant peptide coupling. Structure determination by NMR and CD spectroscopy and by X-ray crystallography. Helical secondary structure of a beta-hexapeptide in solution and its stability towards pepsin. Helv Chim Acta. 79, 913-941 (1996).
- Lam, K. S., et al. A New Type of Synthetic Peptide Library for Identifying Ligand-Binding Activity. Nature. 354, 82-84 (1991).
- Simon, R. J., et al. Peptoids - a Modular Approach to Drug Discovery. Proceedings of the National Academy of Sciences of the United States of America. 89, 9367-9371 (1992).
- Burkoth, T. S., et al. Toward the synthesis of artificial proteins: the discovery of an amphiphilic helical peptoid assembly. Chem Biol. 9, 647-654 (2002).
- Alluri, P. G., Reddy, M. M., Bachhawat-Sikder, K., Olivos, H. J., Kodadek, T. Isolation of protein ligands from large peptoid libraries. Journal of the American Chemical Society. 125, 13995-14004 (2003).
- Lim, H. S., Archer, C. T., Kodadek, T. Identification of a peptoid inhibitor of the proteasome 19S regulatory particle. Journal of the American Chemical Society. 129, 7750-7751 (2007).
- Wrenn, S. J., Weisinger, R. M., Halpin, D. R., Harbury, P. B. Synthetic ligands discovered by in vitro selection. Journal of the American Chemical Society. 129, 13137-13143 (2007).
- Aina, O. H., Marik, J., Liu, R. W., Lau, D. H., Lam, K. S. Identification of novel targeting peptides for human ovarian cancer cells using "one-bead one-compound" combinatorial libraries. Mol Cancer Ther. 4, 806-813 (2005).
- Udugamasooriya, D. G., Dineen, S. P., Brekken, R. A., Kodadek, T. A Peptoid “Antibody Surrogate” That Antagonizes VEGF Receptor 2 Activity. Journal of the American Chemical Society. 130, 5744-5752 (2008).
- Shah, N. H., et al. Oligo( N-aryl glycines): A New Twist on Structured Peptoids. Journal of the American Chemical Society. 130, 16622-16632 (2008).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proceedings of the National Academy of Sciences of the United States of America. 105, 2794-2799 (2008).
- Paul, B., et al. N-Naphthyl Peptoid Foldamers Exhibiting Atropisomerism. Organic Letters. 14, 926-929 (2012).
- Crapster, J. A., Guzei, I. A., Blackwell, H. E. A peptoid ribbon secondary structure. Angewandte Chemie. 52, 5079-5084 (2013).
- Gorske, B. C., Stringer, J. R., Bastian, B. L., Fowler, S. A., Blackwell, H. E. New strategies for the design of folded peptoids revealed by a survey of noncovalent interactions in model systems. J Am Chem Soc. 131, 16555-16567 (2009).
- Stringer, J. R., Crapster, J. A., Guzei, I. A., Blackwell, H. E. Extraordinarily robust polyproline type I peptoid helices generated via the incorporation of alpha-chiral aromatic N-1-naphthylethyl side chains. J Am Chem Soc. 133, 15559-15567 (2011).
- Huang, K., et al. A threaded loop conformation adopted by a family of peptoid nonamers. Journal of the American Chemical Society. 128, 1733-1738 (2006).
- Lee, J. H., Kim, H. S., Lim, H. S. Design and Facile Solid-Phase Synthesis of Conformationally Constrained Bicyclic Peptoids. Organic Letters. 13, 5012-5015 (2011).
- Gao, Y., Kodadek, T. Synthesis and Screening of Stereochemically Diverse Combinatorial Libraries of Peptide Tertiary Amides. Chem Biol. 20, 360-369 (2013).
- Urban, J., Vaisar, T., Shen, R., Lee, M. S. Lability of N-alkylated peptides towards TFA cleavage. Int J Pept Protein Res. 47, 182-189 (1996).
- Rzuczek, S. G., Gao, Y., Tang, Z., Thornton, C. A., Kodadek, T., Disney, M. D. Features of Modularly Assembled Compounds That Impart Bioactivity Against an RNA Target. ACS Chemical Biology. 8 (10), 2312-2321 (2013).
- Thern, B., Rudolph, J., Jung, G. Triphosgene as highly efficient reagent for the solid-phase coupling of N-alkylated amino acids—total synthesis of cyclosporin O. Tetrahedron Letters. 43, 5013-5016 (2002).
- Sleebs, M. M., Scanlon, D., Karas, J., Maharani, R., Hughes, A. B. Total Synthesis of the Antifungal Depsipeptide Petriellin A. J Org Chem. 76, 6686-6693 (2011).
- Vaisar, T., Urban, J. Gas-phase fragmentation of protonated mono-N-methylated peptides. Analogy with solution-phase acid-catalyzed hydrolysis. Journal of Mass Spectrometry. 33, 505-524 (1998).
- Creighton, C. J., Romoff, T. T., Bu, J. H., Goodman, M. Mechanistic studies of an unusual amide bond scission. Journal of the American Chemical Society. 121, 6786-6791 (1999).
- Sewald, N., Sewald, N. Efficient, racemization-free peptide coupling of N-alkyl amino acids by using amino acid chlorides generated in situ--total syntheses of the cyclopeptides cyclosporin O and omphalotin A. Angewandte Chemie (International ed. in English). 41, 4661-4663 (2002).
- Astle, J. M., et al. Seamless Bead to Microarray Screening: Rapid Identification of the Highest Affinity Protein Ligands from Large Combinatorial Libraries. Chem Biol. 17, 38-45 (2010).
- Strohalm, M., Kavan, D., Novak, P., Volny, M., Havlicek, V. mMass 3: a cross-platform software environment for precise analysis of mass spectrometric data. Anal Chem. 82, 4648-4651 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados