Method Article
Подготовка гидрокси-PAAM Гидрогели расцепления последствий механотрансдукции сцен
В этой статье
Резюме
Мы представляем новый полиакриламидного гидрогеля, называемый гидрокси-PAAM, что позволяет прямое связывание белков ЕСМ с минимальными затратами или экспертизы. Сочетание гидрокси-PAAM гидрогели с микроконтактная печать облегчает независимый контроль многих киев естественного микроокружения клеток для изучения клеточного mechanostransduction.
Аннотация
В настоящее время хорошо известно, что многие клеточные функции регулируются взаимодействия клеток с физико-химическими и механическими киев их внеклеточного матрикса (ECM) среды. Эукариотические клетки постоянно ощущать свою локальную микросреду через поверхностные механосенсоров преобразовывать физические изменения ECM в биохимических сигналов, и интегрировать эти сигналы для достижения конкретных изменений в экспрессии генов. Интересно, что физико-химические и механические параметры ЭСУД может пару друг с другом, чтобы регулировать судьбы клеток. Поэтому, ключ к пониманию механотрансдукции является разделение относительный вклад ECM киев на клеточных функций.
Здесь мы представляем подробный протокол эксперимента, чтобы быстро и легко создавать биологически активные гидрогели для самостоятельного тюнинга механотрансдукции киев в пробирке. Мы химически модифицированные полиакриламидные гидрогели (PAAM) преодолеть их внутренне не-adhesив свойства от включения гидроксильные-функционализированных мономеров акриламида в процессе полимеризации. Мы получили новый PAAM гидрогель, который называется гидрокси-PAAM, который позволяет иммобилизацию любого желаемого характера белков ЕСМ. Сочетание гидрокси-PAAM гидрогелей с микроконтактной печати позволяет независимо управлять морфологию отдельных клеток, матрица жесткости, характер и плотность белков ЕСМ. Мы предоставляем простой и быстрый метод, который может быть установлен в любой лаборатории биологии для изучения в пробирке процессов клеточной механотрансдукции. Мы проверки этого романа двумерный платформу путем проведения экспериментов на эндотелиальных клетках, которые демонстрируют механическое соединение между ECM жесткости и ядра.
Введение
Многие аспекты местной сотовой микроокружения (например, жесткость, размер пор, природа белков, или плотность клеток-лиганд) обеспечивают координатное множество регулирующих сигналов, которые контролируют клеточные процессы, такие как подвижность, клеточной пролиферации, дифференцировки и экспрессии генов. Модификации физико-химических свойств внеклеточной среде может быть воспринята клеток и вызывает различные физиологические последствия, в том числе деформации клеточной поляризации, миграции, и дифференциации. Остается неясным, однако, как клетки перевести ECM изменения в клеточных биохимических сигналов. Поэтому большое значение для инженера контролируется в пробирке микросреды, которые могут воспроизводить взаимодействия между клетками и их микросреды для изучения механотрансдукции пути. Для решения этой проблемы, мы недавно ввели новый способ 1, под названием гидрокси-PAAM гидрогели, легко генерировать два-копейкиnsional мягкие матрицы, которые позволяют независимо управлять важные сигналы механотрансдукции: матрица жесткости, геометрия клеток и удержания, природа белка и плотности клеток-лиганд.
ECM направляет клеточные процессы через градиентов в морфогенов (хемотаксиса), клейкие белки (haptotaxis) и жесткость (durotaxis). За последние несколько десятилетий, расширенный в платформах пробирке были разработаны, чтобы изолировать эти внеклеточные сигналы для того, чтобы дразнить, как клетки способны перевести биохимические и биофизические особенности в физиологических процессов 2-5. Электронно-лучевое 6, 7 фотолитографии, фотохимическое иммобилизации 8, или методы с помощью плазмы 9 были разработаны, чтобы направить рост живых клеток на micropatterned субстратов. Хотя эти методы были получены важные результаты, большинство из них не позволяют различить индивидуального влияния различных сигналов на поведение клетоки они требуют технических средств, что несколько лабораторий могут себе позволить. Среди этих методов, микроконтактная печати (μCP), стала надежной и доступным методом для создания клеточных-клей микро-острова 10. Совсем недавно, обширные усилия 11-14 были сделаны в разработке μCP на гидрогели с перестраиваемой жесткости для того, чтобы воспроизвести широкий спектр жесткости наблюдаемых в живых тканях. Среди этих работ, полиакриламид (PAAM) стала популярной 15 и уже является одним из наиболее часто используемых матриц на основе полимеров для сотовых биомеханики анализов.
PAAM поверхности, как правило, функционализированные с гетеробифункциональным сшивающим агентом N-сульфосукцинимидил-6-[4'-азидо-2'-nitrophenylamido] (сульфо-SANPAH) и ECM белки, связанного с поверхностью с помощью УФ активации сульфо-нитрофенил SANPAH азидные группы 16. Другой метод состоит в связи гидразина к белкам, которые были сильно окисленногоперйодатом 17. Хинд и его коллеги ввели технику рисунка биомиметических гидрогелевые поверхностей с белком и пептидов, которая требует фотополимеризации в присутствии acroyl-стрептавидин мономера 18. Совсем недавно, Tseng и соавт. Сообщали новый метод micropatterning 19 на основе глубокого УФ-облучения PAAM через оптическую маску кварцевого, которое требует, чтобы инкубировать активированные PA гели с 1-этил-3- [3-диметиламинопропил-] карбодиимида (EDC) и N-гидроксисукцинимида (NHS) водные растворы до добавить белок. Несмотря на способность этих методов для создания однородных и воспроизводимых белки micropatterns, большинство из них страдают основные ограничения: долго синтеза процессов (например, диализ, лиофилизации и т.д.), дорогие химические соединения (например, гиалуроновая кислота, сульфо-SANPAH) или глубокий УФ облучения. Кроме того, эти методы не позволяют независимую модуляцию подложки жесткости, micropatternгеометрии, ЕСМ белковой природы, а плотность клеток-лиганд.
Принимая эти ограничения во внимание, мы разработали новый и простой основе акриламида подход, позволяющий иммобилизации различных белков и биомолекул на мягких гидрогелей и разрешает независимую настройку механотрансдукции киев для того, чтобы расшифровать их роль в клеточных функций. Вместо того чтобы рассматривать PAAM гидрогели с резкими химических соединений, введем коммерческую акриламида мономера с гидроксильных групп во время полимеризации PAAM. Эта простая операция преодолевает внутреннюю антиадгезивной свойство PAAM гидрогели без любых других технических требований.
Наличие гидроксильных групп приводит к высоким сродством гидрокси-PAAM гидрогелей для белков и биомолекул, которые образуют водородные связи взаимодействия. В сочетании с μCP, гидрокси-PAAM гидрогели способствующих быстрому поколение двумерной платформы культуры с независимым контролемна матрицы жесткости, типа белков ЕСМ, плотность клеток-лиганд и ограниченном клейкости, которые предусмотренном быть мощной платформой для изучения механотрансдукции.
Цель этого протокола заключается в предоставлении необходимой информации для легко сделать гидроксильные-PAAM гидрогели без экспертизы в области материаловедения. Конечной целью является, чтобы обеспечить средства для исследователей спросить физиологически соответствующие вопросы на клеточном и тканевом уровнях, что может привести к лучшему пониманию механотрансдукции путей, участвующих в патофизиологических механизмов.
протокол
1 Активация поверхности стекла покровные
- Место стеклянные круглые покровные (диаметр 25 мм) в чашке Петри и мазка 0,1 М NaOH раствора на нем в течение 5 мин (химическая вытяжного шкафа рекомендуется).
- Снимите решение NaOH и полностью погрузиться покровные стерильной DDH 2 O в течение 20 мин, мягко покачиваясь на качалке пластины в стерильной капот культуры.
- Слейте стерильной DDH 2 O и повторите шаг 1,2.
- Удалить покровные стерильными пинцетом и поместить их в новом чашку Петри с активированным лицевой стороной вверх.
- Сухие покровные под постоянный поток высокочистого азота.
- В стерильной капот культуры, намазать тонкий слой 3- (триметоксисилил) пропил акрилат (92%) на активированном стороне покровного стекла в течение 1 часа.
- Широко мыть покровные стекла с 3 стирок стерильной DDH 2 O и погружают их в стерильной DDH 2 O в новом чашке Петри.
- Нажмите чашки Петрипарафильмом и поместить его на качающуюся пластину при легком помешивании в течение 10 мин.
- Удалить покровные из DDh 2 O стерильными пинцетом с тонкими советы и поместить их в новом чашку Петри с активированным лицевой стороной вверх.
- Хранить при комнатной температуре в сухом месте с алюминиевой фольгой, чтобы избежать пыли от прилипания к покровные.
2 Получение гидрокси-PAAM Гидрогели
- Подготовка вес 65 мг N-гидроксиэтил акриламида (НЕА) в 1,5 мл пробирку Эппендорфа. Важно подготовить свежий раствор HEA.
- Добавьте 1 мл 50 мМ HEPES буфера АЭМ и смешать не используя Вортекс до полного растворения УВО.
- Добавить 400 мкл 40% м / м в HEPES раствора акриламида и требуемого объема 2% в / в HEPES бис-акриламида решения (см таблицу 1) для достижения желаемого гидрогеля жесткость. Регулировка 50 мМ HEPES до конечного объема 5 мл.
- Смешайте раствор, используя Вортекс и Дега этов вакуумной камере в течение 20 мин с целью снижения концентрации кислорода в растворе, который предотвращает полимеризацию гидрокси-PAAM.
- Под стерильной капот, фильтровать дегазированной раствора с размером пор фильтра 0,2 мкм с целью стерилизации его.
- Активируйте круговые покровные стекла (диаметром 22 мм) в уборщицей УФ / озоном во 7 мин.
- Подготовьте 100 мкл 10% раствора персульфата аммония (APS), то есть 10 мг APS в 100 мкл DDH 2 O. Важно, чтобы приготовить свежий раствор APS.
- Добавить 2,5 мкл тетраметилендиамина (TEMED) и 25 мкл раствора APS в стерилизованной гидрокси-PAAM раствора (этап 2.5), чтобы инициировать полимеризацию. Смешайте раствор на 3 последовательных pipettings без введения пузырьков, в стерильных условиях.
- Под стерильных капот, поместите каплю 25 мкл раствора гидрокси-PAAM на 25 мм покровным (доступную с шага 1,9) и сразу же разместить 22 мм глзадница покровное (подготовлен на этапе 2,5) на вершине капли выжать решение гидрокси-PAAM. Сосредоточьте 22 мм покровного стекла с стерильных пинцетов и сгладить любые пузыри.
- Разрешить гидрокси-PAAM гидрогели для полимеризации при комнатной температуре в течение 15 мин. Invert вручную оставшийся раствор гидрокси-PAAM в пробирку Эппендорфа, чтобы следовать за завершение процесса полимеризации.
- Полностью погрузиться покровные стерильной DDH 2 O и осторожно отделить 22 мм покровные стекла путем введения край лезвия бритвы между 22 мм покровные стекла и слой гидрогеля гидрокси-PAAM.
- Вымойте гидроксильные-PAAM гидрогели стерильной PBS (3 обмены PBS) и пусть гели полностью погружены в стерильную PBS для поддержания гидратации.
- Храните гидроксильные-PAAM гидрогели в стерильной PBS при 4 ° С в течение 3 дней.
3 Полидиметилсилоксан (PDMS) Microstamp Изготовление
ПРИМЕЧАНИЕ: изготовление мастер кремния требуется до ГНАРТ PDMS microstamp изготовление. Это микротехнологий из мастер кремния может быть сделано путем литографии, который требует специального оборудования и обучение. Сотрудничество с нанофабрикацию объекта предлагается изготовить мастер кремния. Кроме того, связаться с компанией, что изготавливает на заказ мастерами микроструктурированный кремния по требованию. Важно отметить, что изготовление мастер кремния необходимо только сделать один раз. Действительно, микроструктурированные кремния мастера можно использовать бесконечно производить эластомерных марок.
- Смесь ПДМС и отвердитель в соотношении 10: 1 в пластиковом стакане, и тщательно перемешать с помощью пипетки в течение 10 мин.
- Дегазации смеси PDMS под вакуумом, чтобы удалить пузырьки воздуха, которые были сформированы в ходе стадии 3.1.
- Поместите микроструктурированного мастер кремния в чашку Петри и литой толстый слой 10 мм дегазированной смеси PDMS на нем без образования пузырьков.
- Пусть вылечить PDMS течение 2 ч при 60 ° С впечь.
- В среде без пыли, отрывной PDMS слоев и акцизные 1 см 2 microstamps с помощью скальпеля.
- Использование щипцов, место PDMS microstamps картины вверх в чашке Петри.
4. Micropatterning гидрокси-PAAM Гидрогели
- Место PDMS microstamps в этанол / вода (50/50) решение и обрабатывают ультразвуком в течение 15 мин.
- Высушите марки с потоком токе азота и поместите их картины вверх в уборщицей УФ / озону (λ <200 нм) в течение 7 мин.
- Под стерильной капот, место 150-мкл каплей раствора желаемого белка (например, 100 мкг / мл ламинина в PBS или 25 мкг / мл фибронектина в PBS) на микроструктурированных поверхности 1 см 2 PDMS штамп.
- Дополнительно: Изменение концентрации раствора белка для модуляции плотности клеток-лиганд.
- Распространение белкового раствора через штамп поверхности, перемещая его с помощью стерильного наконечника пипетки к каждому углузнач.
- Оставьте белкового раствора с целью адсорбции на штамп PDMS в течение 60 мин в стерильной крышкой. Выключите лампы, чтобы избежать повреждения белка.
- Под стерильных капот, передать покровные покрытием гидрокси-PAAM (доступных с шага 2,13) в чашку Петри.
- Удалить избыток PBS с поверхности гидрокси-PAAM субстратов с низкой потоке азота в стерильных условиях. Остановите процедуру, как только не наблюдается никаких признаков стоячей воды на поверхности геля. Гель не должны быть тщательно сушат на данном этапе.
- Сухой тщательно структурированная поверхность из PDMS печать с устойчивым потоком высокочистого азота.
- Возьмитесь печать белка покрытием с тканью щипцов перевязочных и поместить структурированную поверхность в контакте с высушенной поверхности гидрогеля. Применение коротких точки давления с наконечником пинцетом на верхней части штампа PDMS, чтобы обеспечить хороший контакт между штампа microfeatures и поверхностью гидрогеля.
- Оставьте PDMS штамп гоэлектронной гидрогель поверхности в течение 1 часа при комнатной температуре.
- Аккуратно снимите PDMS марки из гидрокси-PAAM гидрогели с Пинцет хирургический гардеробными и следуйте шаг 4,1 к чистой печать.
- Вымойте экстенсивно выбитые гидроксильные-PAAM гидрогели на 3 обмена PBS (рН = 7,4) в стерильных условиях в течение 10 мин на бирже.
- Дополнительно: Дополнительные micropatterns других белков ЕСМ могут быть добавлены к гидрокси-PAAM поверхности, выполнив действия от 4,5 до 4,11.
- Пассивации ненапечатанной зоны с стерильного раствора БСА в дозе 5 мг / мл в PBS в течение ночи при 4 ° С при осторожном перемешивании в качалке на пластине.
- Промыть 3 экстенсивно обмена PBS (рН 7,4) в стерильных условиях в течение 10 мин на бирже. На данном этапе, штампованные гидрокси-PAAM гидрогели можно хранить при температуре 4 ° С до одной недели.
5 Сотовый Нанесение на Micropatterned гидроксильных PAAM Гидрогели
- Выдержите покровные в клеточных сред в течение 30-45 мин до покрытия слоктей.
- Промыть прилипшие клетки культивировали в 75 см 2 колбу культуры стерильным PBS при 37 ° С и отделить его с 3 мл трипсина-ЭДТА или Accutase в течение 10 мин.
- Передача желаемое количество подогретого полного соответствующей среде роста для клеточной линии в колбу, содержащую отдельные клетки и центрифуги клеточной суспензии в течение 3 минут при 650 х г.
- Удалить супернатант с помощью микропипетки и ресуспендирования клеток в полной культуральной среде при 15-20,000 клеток / мл.
- Добавить 4 мл клеточной раствора до micropatterned покровное (полученного на стадии 5.1) и помещают покровное клеток, покрытых в культуральной инкубаторе при температуре 37 ° С и 5% влажности в течение 1-2 часов.
- Аспирируйте аккуратно неприкрепленные клетки и заменить культуральной среды. Возвращение прилагаемые клеток в инкубатор, и пусть они распространяются полностью (3-6 ч, в зависимости от типа клеток).
Результаты
1А представляет сополимеризации акриламида (ААМ) и бис-акриламид (бис-ААМ) с N-hydroxyethylacrylamide (HEA) мономеры, содержащие первичный гидроксил, образованный путем радикальной полимеризации случайного гидрофильный сеть полиакриламида со встроенными гидроксильных групп (гидрокси-PAAM) . В этом протоколе, вес 65 мг HEA должны быть разбавлены в объеме 1 мл HEPES. Зная, что плотность АЭМ примерно равен единице, мы предполагаем, что получим рабочий объем 1065 мкл (АЭМ + HEPES). Как показано в таблице 1, добавление общего числа 1065 мкл до 400 мкл ААМ и 50 мкл bisAAm приводит к объема 1515 мкл. Поэтому объем 3485 мкл HEPES необходима для регулировки раствора до конечного объема 5 мл. Как указано на стадии 2.6, поверхность 22 мм покровным стеклом должен быть активирован в течение 7 мин в УФ / озоном, чтобы удалить его, не вызываялибо ущерб поверхности гидрогеля. Действительно, поверхность стекла становится более гидрофильной после УФ / озонирование и может быть поэтому легко удалить, погрузив всю систему в воде. Кроме того, лечение УФ / Озон предотвращает химическое загрязнение 22 мм покровным, который находится в непосредственном контакте с поверхностью гидрогеля. Эта методика позволяет получить плоскую круглую поверхность полиакриламида (22 мм в диаметре), связанный с покровным стеклом (25 мм в диаметре).
Как представлено на рисунке 1b, micropatterns белков могут быть созданы на поверхности гидрокси-PAAM гидрогели по микроконтактной печати. В этой экспериментальной процедуры, облучение УФ / озона позволит снизить временно внутреннюю гидрофобность марок PDMS путем формирования силанольных групп на поверхности. Действительно, нм линии 185 вырабатывает озон из молекулярного кислорода в то время как нм линии 254 преобразует озон к атомарного кислорода. Это реактивный вид нападает на силоксановых баckbone из PDMS, чтобы сформировать богатый диоксида кремния, как слой кислорода SiOx и Si-OH поверхностные группы. Окисленной поверхности PDMS, как известно, чтобы восстановить свою гидрофобность в несколько часов после воздействия воздуха за счет миграции низкомолекулярных несшитых полимерных цепей с объемной фазе на поверхность. Эта стратегия помогает распространению раствора белка на поверхности штампа PDMS.
Одним из ключевых преимуществ этого метода является то, чтобы модулировать независимо друг от друга матрицу жесткости (рисунок 2А), micropattern геометрию (фиг.2В), клетки-лиганд плотности (фиг.2С), и белковой природы (Фигуры 3A и 3B). Как показано на рисунке 2А, гидрокси-PAAM гидрогели показать линейную зависимость модулей упругости от концентрации поперечных связей от нескольких кПа до нескольких десятков кПа, что позволяет прекрасный воспроизводство жесткости сотовой микросреды. Рисунок 2B представляет эпифлуоресцентной изображения ламинина (LM) прямоугольные micropatterns, осажденные на гидрокси-PAAM гидрогелей трех различных жесткостей (2,5, 15 и 40 кПа), демонстрирующие явно независимую настройку micropattern геометрии и матрицы жесткости. фиг.2С показывает, что клетки -лигандом плотности можно модулировать путем изменения концентрации раствора белка, используемого для инкубации PDMS штампов. Рисунок 3 представляет собой изображение флуоресценции коллагеновых линий штампованных по ламинина и фибронектина линий с помощью последовательных микроконтактной печатные.
Это интересно для читателей, чтобы отметить, что различные размеры и формы micropatterns были штампованные эффективно, независимо гидрогеля жесткость. Мы воспроизвели успешно microfeatures белков с острыми краями (например, треугольники и звезды) и прямой (например, линии), или изогнутыми (например, кружки) форм, демонстрируя, что нет MajoR ограничений сложности рисунка. Для эксперимента одной клетки, площадь поверхности micropattern была между 400 и 2500 мкм 2, то более низкое значение, соответствующее пределу одной жизнеспособности клеток. Как и многие другие методы Микропечать основе, главным ограничением метода, представленного касается его пространственное разрешение. О жесткости гидрогели (E> 10 кПа), пространственное разрешение составляет около микрометра и, главным образом, определяется решением штампа, в то время как на «мягких» гидрогели, предел разрешения становится частично определяется деформации поверхности, которые могут возникнуть во время белка-переносчика.
Токсичность гидрокси-PAAM гидрогелей была исследована путем количественного определения жизнеспособности первичных эндотелиальных клеток покрытие для 1, 2, и 3-х дней в культуре на однородно покрытием и микротекстом мягких гидрогелей гидрокси-PAAM (рис 4а). Около 80% HUVECs высевают на micropatterned мягких гидрогелей гидрокси-PAAM поддерживаетсяих жизнеспособность в течение трех дней, демонстрируя биосовместимость гидрокси-PAAM гидрогели для клеточной культуры. Интересно, что подобное жизнеспособность была получена в лаборатории с первичных корковых нейронных клеток. Кроме того, первичные эндотелиальные клетки пролиферируют больше на "жесткие" (500 кПа) по сравнению с «мягких» (25 кПа) подложки (фиг.4В), что указывает, что этот способ обеспечивает соответствующую микросреду для изучения клеточную пролиферацию в широком диапазоне жесткости .
Чтобы отделить эффект подложки жесткостью и распространение область на механотрансдукции, первичные эндотелиальные клетки (HUVECs) высевали на прямоугольных FN покрытием micropatterns (постоянная площадь 1200 мкм 2), нанесенного на гидроксифункциональными PAAM гидрогели трех различных жесткости (2,5, 8,5, и 25 кПа). Тогда, HUVECs окрашивали на нитей актина, винкулина и ДНК, следуя стандартной процедуре иммуноцитохимии, используемый для мамыLian клетки высевали на стеклянных подложках. На мягких субстратов, HUVECs обладают низкой плотности волокна актина и закругленную ядро, в то время как на жестких подложках, актиновые волокна вытягивается и толще и ядро деформируется (фиг.5). Изменения в жесткости подложки при постоянном распространения области модулируют напряжение и распределение актина стрессовых волокон, что приводит к модернизации ядра. Это наблюдение предполагает механическое соединение между матрицы жесткости, цитоскелета и ядра.
| Передаточное число ААм / bisAAm | ААм 40% (мкл) | Масса АЭМ растворить в 1 мл HEPES (мг) | бис ААм (2%) (Мкл) | HEPES (мкл) | Модуль Юнга (10 3 Па) |
| 0,2 / 50 0,5 / 50 1/50 2/50 3/50 | 400 400 400 400 400 | 65 65 65 65 65 | 50 125 250 500 750 | 3485 3410 3285 3035 2785 | ~ 1.4 ~ 3.6 ~ 8.7 ~ 17.2 ~ 25 |
Таблица 1 Подготовка гидрокси-PAAM гидрогели с различными жесткости. Решения Рабочие подготовить гидроксильные-PAAM гидрогели с конечной жесткости в диапазоне от 1,4 до 25 кПа.
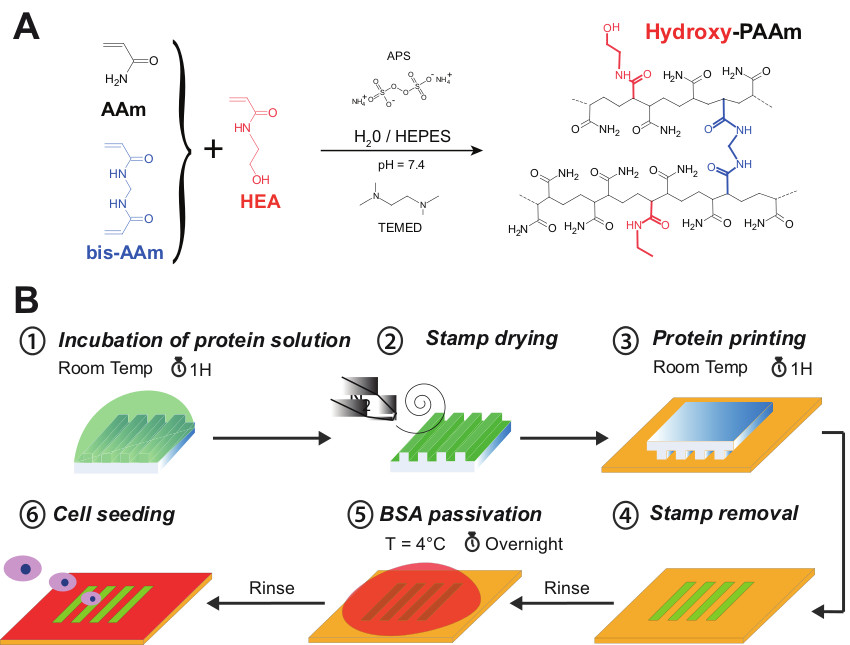
Рисунок 1 (А) акриламид (ААМ, в черном), N, N'-метилен (бис-ААм, в синем) и N-hydroxyethylacrylamide (АЭМ, красным цветом) смешивают вместе, чтобы сформировать гидрокси PAAM гидрогели. (B) Схематическое представление различных этапах процедуры micropatterning на гидрокси-PAAM гидрогели. Раствор белка сначала инкубировали в течение 1 часа на структуру лицом microstamp (Шаг 1). Поверхность гидрогель осторожно сушат в потоке азота (Шаг 2). Microstamp затем помещают в официальный контакт с поверхностью гидрокси-PAAM в течение 1 ч (шаг 3 #). После последовательных промывок микротекстом поверхность пассивируется со стерильным раствором БСА, нанесенного O / N при 4 ° С (Шаг 5), чтобы блокировать ненапечатанной области. Наконец, микротекстом гидрокси-PAAM поверхность промывают несколько раз стерильным PBS и готов к посева клеток (шаг # 6). Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
1010 / 51010fig2highres.jpg "ширина =" 500 "/>
Рисунок 2 (А) Эволюция жесткости гидрокси-PAAM гидрогелей линейно коррелирует с количеством бис-ААМ сшивающего агента (красная линия является линейной регрессии с R 2 = 0995). (B) флуоресценции изображения прямоугольная ламинином микро-функции штампованные на гидрокси-PAAM гидрогели различных жесткости (Е = 2,5, 15, и 40 кПа). Шкала баров соответствуют (А) 65 мкм, (б) 80 мкм, и (C) 50 мкм. (С) Параллельные линии 15 мкм шириной виде Л.М. градиента на гидрогеля 25 кПа гидрокси-PAAM, как указано в эволюции из профиля интенсивности флуоресценции. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
н "SRC =" / файлы / ftp_upload / 51010 / 51010fig3highres.jpg "ширина =" 500 "/>
Рисунок 3 (А) Иммунофлуоресцентное образ Фибронектин (в красном) и Ламинин (в зеленых) полос скрещенных под углом 90 °. (B) Multilabeling фибронектина (в красном), ЛАМИНИНА (зеленым) и коллагена (синим цветом) полосами микротекста Впоследствии на 25 кПа гидрогель PAAM подложки. Шкала баров соответствуют 30 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
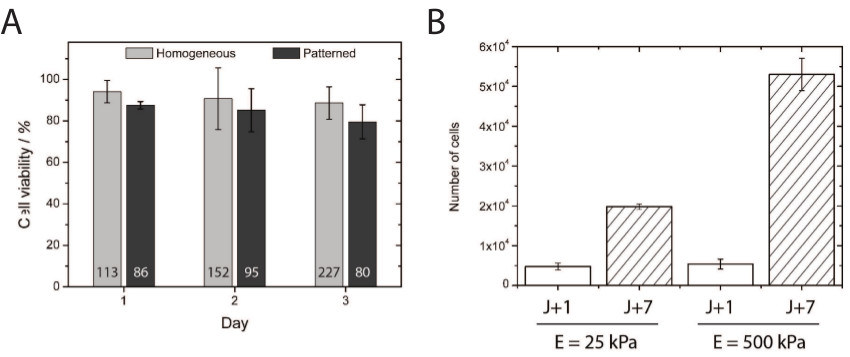
Рисунок 4 (А) Количественное определение жизнеспособности клеток продемонстрировал отличную выживаемость клеток через 24, 48 и 72 ч после высевали на покрытые однородно и micropatterned гидрокси-PAAM поверхностей. Номер, указанный вДно каждой строке соответствует общему числу подсчитанных клеток для анализа жизнеспособности. (В) Количественное определение пролиферации HUVECs на 25 и 500 кПа подложки равномерно покрытых после 1 (белые столбцы) и 7 (хешированных бары) дней культуры. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5 Флуоресцентные изображения иммуноокрашиванию первичных эндотелиальных клеток, культивируемые на прямоугольных FN покрытием micropatterns, которые были нанесены на гидрокси-PAAM гидрогели 2,5 кПа, 8,5 кПа, и 25 кПа (слева направо). Актиновый стресс волокна (в зеленый ) окрашивали Alexa Fluor 488 фаллоидином, координационных спаек (в красном) окрашивали polyclo мышинал первичного антитела и помечены красным-флуоресцентный IgG вторичного антитела и ДНК окрашивали в синий с DAPI. Масштабные бары соответствуют 17 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Многие в пробирке наблюдений в современной клеточной биологии были выполнены на жестких покровные стекла, часто покрытых тонким слоем ECM белков или синтетических пептидов, содержащих последовательность RGD. Однако такие основные культуры субстраты не резюмировать всю сложность физико ЕСМ и, таким образом, не обеспечивают точную модель для изучения клеточных процессов механотрансдукции. Для решения этой проблемы, мы предлагаем простой альтернативой функционализировать двумерные гидрогели с любом желаемом количестве и характере белков ЕСМ. Этот метод позволяет независимо управлять важных сигналов механотрансдукции, таких как матрицы жесткости, клеточной морфологии и удержания или плотности клеток-лиганда. Кроме того, гидрокси-PAAM гидрогели преодолеть одно из величайших ограничений текущих методов функционализации, которая является неспособность иммобилизации и контролировать пространственное распределение более одного ECM белка. В связи с высоким сродством гидроXY-PAAM гидрогелей для биомолекул, можно контролировать пространственное распределение различных белков ЕСМ на той же поверхности, независимо от матрицы жесткости, при использовании последовательных microprintings, которые не требуют никакого дополнительного оборудования.
Мы предлагаем процедуру роман, основанный на включении гидроксильных групп в акриламида гидрогели преодолеть свои внутренне не-адгезионные свойства при минимальных требованиях в стоимости или экспертизы. По сравнению с существующими методами для рисунка белки на гидрогели, гидрокси-PAAM метод позволяет избежать использования жестких токсичных химических веществ (например, гидразин гидрата), дорогих фотореакционноспособных сшивателей (например, Sulfo-SANPAH) и зависимость от власти УФ-лампы и позиционирования на функционализировать мягкие гидрогели. Гидрокси-PAAM гидрогели остаются стабильными и активными в течение нескольких недель, может быть массового производства, легко микротекстом и их высокое сродство к биомолекул позволяет исследовать синергетические эффектысопряженные ECM белки на клеточных функций. Кроме того, гидрокси-PAAM гидрогели могут быть использованы, чтобы количественно исследовать количество сократительных сил, действующих со стороны клеток на их окружающей микросреды. Действительно, мы показали ранее 1,20, что флуоресцентные шарики могут быть легко встроен в гидрокси-PAAM гидрогели, чтобы использовать сотовый тяги силовой микроскопии (TFM) для измерения поля смещений и оценивать полученный тяги поле, действующее на эукариотических клетках покрытием на двумерные micropatterns.
Как и многие другие методы Микропечать основе, основным ограничением гидроксильных-PAAM гидрогели касается пространственное разрешение белковых microfeatures. О жесткости гидрогели (E> 10 кПа), пространственное разрешение составляет около микрометра и, главным образом, определяется решением штампа, в зависимости от метода литографии, используемой для изготовления кремния формы. На мягких гидрогелей, пространственное разрешение становится частично определяется гоПоверхность деформации е при передаче белок, который становится основным ограничение, чтобы достичь микрометра пространственное разрешение. Представленный здесь подход в настоящее время ограничивается двумерных поверхностей. Однако этот метод отличается высокой масштабируемостью и дальнейшие исследования в настоящее время в нашей лаборатории, чтобы продлить этот метод для трехмерных структур.
Мы надеемся, что гидрокси-PAAM гидрогели могут помочь расшифровать ключевые механизмы сложных клеточных и тканевых процессов, которые тесно связаны с физико-химическими свойствами клеточной микросреды 21,22, в том числе эмбрионального развития, воспалительных реакций, заживления ран, рост аксонов, взрослой ткани гомеостаз и патогенез заболеваний, таких как фиброз и рак.
Раскрытие информации
No conflicts of interest declared.
Благодарности
This work was supported by the Belgian National Foundation for Scientific Research (F.R.S.-FNRS) through “MIS Confocal Microscopy”, “Crédit aux Chercheurs” grants and the “Nanomotility FRFC project” (no. 2.4622.11). T.G. doctoral fellowship is supported by the Foundation for Training in Industrial and Agricultural Research (FRIA). The authors gratefully acknowledge Sylvain Desprez for mechanical characterization and Géraldine Circelli for confocal imaging.
Материалы
| Name | Company | Catalog Number | Comments |
| UV/Ozone Photoreactor | Ultra-Violet Products | Model PR-100 | |
| Rocking plate | IKAcWerke | Model KS 130 Basic | |
| Vortexer | Scientific Industries | Model Vortex Genie2 | |
| Vacuum degassing chamber | Applied Vacuum Engineering | DP- 8-KIT | |
| Parafilm | Sigma-Aldrich | P7793-1EA | |
| Stainless steel forceps with fine tip | Sigma-Aldrich | Z225304-1EA | |
| Dressing tissue forceps | Sigma-Aldrich | F4392-1EA | |
| Petri dishes in polystyrene | Sigma-Aldrich | P5731-500EA | |
| Aluminium foil, thickness 0.5 mm | Sigma-Aldrich | 266574-3.4G | |
| Isopore membrane filter (0,2 µm pore size) | Millipore | GTTP Filter code | |
| Round glass coverslip (22 mm diameter) | Neuvitro | GG-22 | |
| Round glass coverslip (25 mm diameter) | Neuvitro | GG-25 | |
| Variable volume micropipette | Sigma-Aldrich | Z114820 | |
| Protein microcentrifuge tubes | Sigma-Aldrich | Z666505-100EA | |
| Scalpel handles | Sigma-Aldrich | S2896-1EA | |
| Scalpel blades | Sigma-Aldrich | S2771-100EA | |
| Cell culture flasks (75 cm2) | Sigma-Aldrich | CLS430641 | |
| Ultrasonic bath tray, solid (stainless steel) | Sigma-Aldrich | Z613983-1EA | |
| Name of the Reagent | Company | Catalogue Number | Comments |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Acrylamide (powder) | Sigma-Aldrich | A3553 | |
| N,N’-Methylenebis(acrylamide) | Sigma-Aldrich | 146072 | |
| N-Hydroxyethylacrylamide | Sigma-Aldrich | 697931 | |
| N,N,N’,N’-Tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Amonium PerSulfate (APS) | Sigma-Aldrich | A3678 | |
| 3-(Trimetoxysilyl)propyle acrylate | Sigma-Aldrich | 1805 | |
| Human Plasma Fibronectin | Millipore | FC010 | |
| Laminin from EHS | Sigma-Aldrich | L2020 | |
| Sodium hydroxyde | Sigma-Aldrich | 221465-25G | |
| Double-distilled water (ddH2O) | |||
| Endothelial cell growth medium | Cells Applications | 211K-500 | |
| Human Umbilical Vein Endothelial Cells (HUVEC) | Invitrogen | C-003-5C | |
| Accutase | PAA laboratories | L11-007 | |
| HEPES buffer solution 1M in H20 | Sigma-Aldrich | 83264-500ML-F | |
| Antibiotics-antimycotics | PAA laboratories | P11-002 | |
| Phosphate Buffer Saline solution | PAA laboratories | H15-002 | |
| Alexa Fluor 488 Phaloidin | Molecular Probes | A12379 | |
| Anti-vinculin antibody produced in mouse | Sigma-Aldrich | V9131 | |
| Goat anti-mouse antibody-tetramethylrhodamine | Molecular Probes | T-2762 | |
| Anti-Fibronectin | Sigma-Aldrich | F3648 | |
| (rabbit) | |||
| Streptavidin | Sigma-Aldrich | 41469 | |
| Anti-Laminin antibody | Sigma-Aldrich | L9393 | |
| (rabbit) | |||
| Anti-rabbit IgG-FITC | Sigma-Aldrich | F7512 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924-100ML | |
| Absolute ethanol | Sigma-Aldrich | 459844-2.5L |
Ссылки
- Grevesse, T., Versaevel, M., Circelli, G., Desprez, S., Gabriele, S. A simple route to functionalize polyacrylamide gels for the independent tuning of mechanotransduction cues. Lab Chip. 13 (5), 777-780 (2013).
- Gabriele, S., Benoliel, A. M., Bongrand, P., Théodoly, O. Microfluidic investigation reveals distinct roles for actin cytoskeleton and myosin II activity in capillary leukocyte trafficking. Biophys. J. 96 (10), 4308-4318 (2009).
- Atmanli, A., Domian, I. J. Generation of aligned functional myocardial tissue through microcontact printing. J. Vis. Exp. (73), e50288 (2013).
- Gabriele, S., Versaevel, M., Preira, P., Théodoly, O. A simple microfluidic method to select, isolate, and manipulate single-cells in mechanical and biochemical assays. Lab Chip. 10 (11), 1459-1467 (2010).
- Le Berre, M., Aubertin, J., Piel, M. Fine control of nuclear confinement identifies a threshold deformation leading to lamina rupture and induction of specific genes. Integr. Biol. 4 (11), 1406-1414 (2012).
- Rundqvist, J., et al. High fidelity functional patterns of an extracellular matrix protein by electron beam-based inactivation. J. Am. Chem. Soc. 129 (59), 59-67 (2006).
- Sorribas, H., Padeste, C., Tiefenauer, L. Photolithographic generation of proteins micropatterns for neuron culture applications. Biomaterials. 23 (3), 893-900 (2002).
- Holden, M. A., Cremer, P. S. Light activated patterning of dye-labeled molecules on surfaces. J. Am. Chem. Soc. 125 (27), 8074-8075 (2003).
- Cheng, Q., Li, S., Komvopoulos, K. Plasma-assisted surface chemical patterning for single-cell culture. Biomaterials. 30 (25), 4203-4210 (2009).
- Kumar, A., Whitesides, G. M. Features of gold having micrometer to centimeter dimensions can be formed through a combination of stamping with an elastomeric stamp and an alkanethiol "ink" followed by chemical etching. Appl. Phys. Lett. 63 (14), 2002-2004 (1993).
- Tseng, Q., et al. New micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11, 2231-2240 (2011).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS ONE. 7, e51499 (2012).
- Herrick, W. G., Nguyen, T. V., Sleiman, M., McRae, S., Emrick, T. S., Peyton, S. R. PEG-Phosphorylcholine hydrogels as tunable and versatile platforms for mechanobiology. Biomacromolecules. 14, 2294-2304 (2013).
- Versaevel, M., Grevesse, T., Riaz, M., Lantoine, J., Gabriele, S. Micropatterning hydroxy-PAAm hydrogels and sylgard 184 silicone elastomers with tunable elastic moduli. Methods in Cell Biology. 121, 33-48 (2014).
- Kandow, C. E., Georges, P. C., Janmey, P. A., Beningo, K. A. Polyacrylamide hydrogels for cell mechanics: steps towards optimization and alternative uses. Methods Cell Biol. 83, 29-46 (2007).
- Hemphill, M. A., et al. A possible role for integrin signaling in diffuse axonal injury. PLoS ONE. 6 (7), e22899 (2011).
- Damljanovic, V., Lagerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamide substrates for cell mechanotransduction assays. BioTechniques. 39 (6), 847-851 (2005).
- Hynd, M. R., Frampton, J. P., Dowell-Mesfin, N., Turner, J. N., Shain, W. Directed cell growth on protein-functionalized hydrogel surfaces. Journal of Neuroscience Methods. 162, 255-263 (2007).
- Tseng, Q., et al. new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11 (13), 2231-2240 (2011).
- Versaevel, M., Grevesse, T., Gabriele, S. Spatial coordination between cell and nuclear shape within micropatterned endothelial cells. Nat. Commun. 3, 671 (2012).
- Versaevel, M., Grevesse, T., Riaz, M., Gabriele, S. Cell Confinement: Putting the squeeze on the nucleus. Soft Matter. 9, 6665-6676 (2013).
- Trappman, B., Chen, C. S. How cells sense extracellular matrix stiffness: a material's perspective. Current Opinion in Biotechnology. 24, 1-6 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены