Method Article
メカノキューの影響をデカップリングするためのヒドロキシのPAAmハイドロゲルの調製
要約
私たちは、最小限のコストや専門知識を持つECMタンパク質の直接結合を可能にするヒドロキシPAAmを呼ばれる新しいポリアクリルアミドハイドロゲルを、提示します。マイクロコンタクトプリント法でヒドロキシ - のPAAmハイドロゲルの組み合わせは、細胞のmechanostransductionを研究するための天然の細胞の微小環境の多くの手がかりを独立して制御を容易にします。
要約
現在では、多くの細胞機能は、それらの細胞外マトリックス(ECM)環境の物理化学的および機械的な手がかりを用いた細胞の相互作用によって調節されることが確立されている。真核細胞は、常に、遺伝子発現の特定の変化を達成するために、生化学的シグナルにECMの物理的変化を形質導入し、これらの信号を統合するために、表面mechanosensorsを通じて局所微小環境を感知する。興味深いことに、互いにECM缶のカップルの物理化学的及び機械的パラメータは、細胞の運命を調節する。そのため、メカノを理解する鍵は、細胞機能上のECM手がかりの相対的な寄与を分離することです。
ここでは、迅速かつ容易にin vitroでのメカノ手がかりから独立チューニングのための生物学的に関連するヒドロゲルを生成するために、詳細な実験プロトコルを提示します。私たちは化学的に修飾されたポリアクリルアミドハイドロゲル(PAAmを)は、それらの本質的に非adhesを克服するために重合中にヒドロキシル官能アクリルアミドモノマーを組み込むことによって特性をアイブ。私たちは、ECMタンパク質の任意の所望の性質の固定化を可能にするヒドロキシPAAmを呼ばれる小説のPAAmハイドロゲルを、取得した。マイクロコンタクトプリンティング、ヒドロキシ-PAAmをヒドロゲルの組み合わせは、独立して、単一細胞の形態、マトリックス剛性、性質およびECMタンパク質の濃度を制御することを可能にする。私たちは、in vitro細胞メカノ過程で勉強するすべての生物学の実験室で設定することができ、簡単で迅速な方法を提供する。今後は、ECMの剛性と核との間の機械的結合を実証する内皮細胞上の実験を行うことにより、この新規二次元のプラットフォームを検証します。
概要
局所的な細胞微小環境( 例えば 、剛性、細孔径、タンパク質の性質、または細胞リガンド密度)の多くの局面は、運動性、細胞増殖、分化、および遺伝子発現のような細胞プロセスを制御する調節手がかりの座標セットを提供する。細胞外環境の物理化学的特性の改変は、細胞によって認識されると細胞の分極の変形、移動、および分化を含む、異なる生理学的結果を引き起こすことができる。これは、細胞が細胞の生化学的シグナルにECMの変更を変換する方法が、依然として不明である。したがって、主要な重要性メカノ経路を研究するための細胞とそれらの微小環境との間の相互作用を再現できるin vitroでの微小環境を制御操作することである。この問題に対処するために、容易に二ダイムを生成するために、ヒドロキシ-PAAmをヒドロゲルと呼ばれる新規な方法1を 、最近導入されている独立して重要なメカノキューを制御することが可能とnsionalソフト行列:行列のこわばり、セルの形状と閉じ込め、タンパク質の性質および細胞リガンド密度。
ECMはモルフォゲン(走化性)における勾配、接着性タンパク質(走触性)、および剛性(durotaxis)を介して細胞プロセスを指示します。過去数十年にわたり、in vitroでのプラットフォームの高度は、細胞が生理学的プロセス2-5に生化学的および生物物理学的特徴を翻訳することができますどのように引き出すために、これらの細胞外の合図を分離するために開発されてきた。電子ビーム6、フォトリソグラフィー7、光化学固定化8、またはプラズマ支援技法9は、マイクロパターン化基体上の生きている細胞の増殖を導くために開発されてきた。これらの技術は重要な結果が得られているが、それらのほとんどが細胞挙動に対する異なる手がかりの個別の影響の間の識別を許可しない彼らはいくつかの研究室は余裕ができるという技術的設備を必要とします。これらの技術の中でも、マイクロコンタクトプリント(μCP)は、細胞接着性ミクロの島10を作成するために、堅牢でアクセス可能な方法として浮上している。より最近では、多大な努力11-14は、生体組織において観察された剛性の広い範囲を再現するために調整可能な剛性を有するヒドロゲルでμCPの開発がなされてきた。これらの作品の中では、ポリアクリルアミド(PAAmを) を15普及し、すでに細胞バイオメカニクスアッセイのための最も一般的に使用されるポリマーベースのマトリックスの1つになっています。
PAAmを表面は一般的にN-スルホスクシンイミジル-6 - [4'-アジド-2'-nitrophenylamido](スルホ-SANPAH)およびECMタンパク質は、スルホ-SANPAHニトロフェニルのUV活性化により表面に結合されているヘテロ二官能性架橋剤で官能化されアジド基16。別の技術は深刻な酸化されたタンパク質に結合ヒドラジンから成るヨウ素酸17。ハインドらはアクロイル-ストレプトアビジンモノマー18の存在下での光重合を必要とするタンパク質およびペプチドと生体模倣ハイドロゲルの表面をパターン化するための技術を導入した。より最近では、ツェンらは、1 -エチル-3 - [3 -ジメチルアミノプロピル]カルボジイミド塩酸塩(EDC)で活性化PAゲルをインキュベートするために必要な光学石英マスクを通してのPAAmのディープUV露光に基づいて新しい微細方法19を報告しているタンパク質を追加する前とN-ヒドロキシスクシンイミド(NHS)水溶液。長い合成方法( 例えば 、透析、凍結乾燥など)、高価な化学化合物( 例えば 、ヒアルロン酸、スルホ-SANPAH)または深UV:均質で再現性のあるタンパク質の微細パターンを作成するためにこれらの技術の能力にもかかわらず、それらのほとんどは、主要な制限を被る照射。また、これらの技術は、基板の剛性の独立した変調、微細パターンを許可しないジオメトリ、ECMタンパク質の性質、および細胞 - リガンド密度。
考慮にこれらの制限を考えると、私たちはソフトハイドロゲル上のタンパク質および生体分子の多様性の固定化を可能にし、細胞機能に及ぼす役割を解読するために、メカノキューとは独立してチューニングを可能にする新規かつシンプルなアクリルアミドベースのアプローチを開発しました。代わりに過酷な化学的化合物とのPAAmヒドロゲルの治療は、PAAmを重合中のヒドロキシル基を有する市販のアクリルアミドモノマーを導入する。この単純な操作は、他の技術的な要件なしのPAAmハイドロゲルの固有抗接着性を克服する。
水酸基の存在は水素結合相互作用を形成するタンパク質および生体分子のためのヒドロキシ-PAAmをヒドロゲルの高い親和性をもたらす。 μCPと組み合わせて、ヒドロキシ-PAAmをヒドロゲルは、独立した制御を備えた二次元培養プラットフォームの迅速な生成を可能にするメカノを研究するための強力なプラットフォームであると想定されているマトリックスの剛性、ECMタンパク質の種類、細胞リガンド密度と閉じ込められた接着性、オン。
このプロトコルの目的は、容易に材料科学の専門知識を持たない任意のヒドロキシPAAmをヒドロゲルを作製するために必要な情報を提供することにある。研究者は病態生理学的メカニズムに関与してメカノ経路のより良い理解につながる可能性が細胞および組織レベルでの生理学的に関連する質問をするための究極の目標は、手段を提供することである。
プロトコル
1ガラスカバースリップの表面を活性化
- ペトリ皿とスミア(推奨化学ヒュームフード)で5分間、その上に、0.1MのNaOH溶液中でガラスの円形カバースリップ(直径25mm)。
- NaOH溶液を外し、静かに無菌培養フード内で揺動板に揺動しながら、完全に20分間、無菌のddH 2 Oでカバースリップを浸す。
- 無菌のddH 2 Oを排出し、ステップ1.2を繰り返します。
- 無菌ピンセットでカバーガラスを取り外して、活性化した顔を上にして新しいペトリ皿に配置します。
- 高純度窒素ガスの定常流の下で乾燥したカバースリップ。
- 無菌培養フードでは、1時間カバースリップの活性化された側の3-(トリメトキシシリル)プロピルアクリレート(92%)の薄層を汚す。
- 広範囲に無菌のddH 2 Oを3回洗浄したカバーガラスを洗浄し、新しいシャーレに無菌のddH 2 Oでそれらを浸す。
- ペトリ皿をタップそしてパラフィルムで10分間穏やかに攪拌しながらロッカープレートの上に置きます。
- 細かいヒントを、滅菌ピンセットでのddH 2 Oからのカバーガラスを取り外して、活性化した顔を上にして新しいペトリ皿に配置します。
- カバーガラスに付着するほこりを避けるために、アルミホイルで乾燥した場所に、室温で保管してください。
ヒドロキシのPAAmハイドロゲルの調製
- 1.5mlのエッペンドルフチューブ中のN-ヒドロキシエチルアクリルアミド(HEA)65mgの重量を準備します。それは、新鮮なHEA溶液を調製することが重要です。
- HEAに50mMのHEPES緩衝液1mlを加え、完全に溶解するまでのHEAボルテックスを使って混ぜる。
- 希望ヒドロゲルの剛性に到達するために( 表1参照)のHEPESアクリルアミド溶液およびHEPESビスアクリルアミド溶液中のw / wの2%の必要な数量のw / wの40%の400を添加する。最終容量5mlに50 mMのHEPESで調整する。
- ボルテックスと脱ガスを使用して溶液を混ぜるヒドロキシ-PAAmを重合を防止し、溶液内の酸素濃度を減少させるために20分間真空チャンバー内。
- 無菌フード下では、それを滅菌するために、0.2μmの孔径のフィルターと脱気溶液を濾過。
- 7分間のUV /オゾンクリーナー円形カバーガラス(直径22mm)をアクティブにします。
- 10%硫酸アンモニウム(APS)溶液100μlを準備し、それを100μlのddH 2 O中に10mgのAPSですこれは、新鮮なAPS溶液を調製することが重要である。
- 重合を開始し滅菌ヒドロキシのPAAm溶液(ステップ2.5)にテトラメチレンジアミン2.5μlの(TEMED)とAPS溶液25μlを追加します。無菌条件下で、気泡を導入せずに3連続したピペッティングにより溶液を混ぜる。
- 無菌フード下では、(ステップ1.9から入手可能)25mmのカバースリップ上のヒドロキシのPAAm溶液25μl滴を配置し、すぐに22ミリメートルGLを置くヒドロキシ-PAAmをソリューションを絞る液滴の上に(ステップ2.5に調製した)お尻のカバースリップ。無菌ピンセットで22ミリメートルのガラス製カバースリップを中央にして気泡を滑らかに。
- ヒドロキシのPAAmハイドロゲルは、室温で15分間重合させた。重合プロセスの完了を追跡する手動エッペンドルフチューブ内の残りのヒドロキシのPAAm水溶液を反転させる。
- 完全無菌のddH 2 Oでカバーガラスを浸すと、慎重に22ミリメートルのガラス製カバースリップおよびヒドロキシのPAAmハイドロゲル層との間にカミソリの刃のエッジを導入することにより、22ミリメートルのカバーガラスを分離する。
- 滅菌PBS(PBSの3取引所)とヒドロキシのPAAmハイドロゲルを洗浄し、ゲルが完全に水分補給を維持するために、無菌PBS中に浸漬してみましょう。
- 最大3日間4℃で滅菌PBS中のヒドロキシ-PAAmをヒドロゲルに保管してください。
3ポリジメチルシロキサン(PDMS)Microstamp製作
注:シリコンマスターの製造は、駅の前に必要とされるPDMSのmicrostamp製造を室温。シリコンマスターのこの微細加工は、特殊な装置や訓練を必要リソグラフィ技術によって行うことができる。ナノ加工施設とのコラボレーションは、シリコンマスターを製作することをお勧めします。代わりに、オンデマンドでカスタムメイドの微細構造のシリコンマスターを製作する会社に連絡してください。これは、シリコンマスターの製造は一度だけ実行される必要があることに留意することが重要である。実際に、微細構造のシリコンマスターが、エラストマースタンプを生成するために無期限に使用することができる。
- 10にPDMSと硬化剤を混合する:プラスチックビーカー中に1の比率で10分間、ピペットを用いて完全に混合する。
- ステップ3.1の間に形成された気泡を除去するために真空下でPDMS混合物を脱気。
- シャーレ内の微細構造のシリコンマスターを配置し、気泡を形成することなく、その上に脱気したPDMS混合物の10 mmの厚さの層をキャスト。
- で、60℃で2時間、PDMSを治すLETオーブン。
- ほこりのない環境では、剥離PDMS層と物品税メスで1cm 2の microstamps。
- 鉗子を使用して、場所PDMSをペトリ皿にパターンアップmicrostamps。
4。マイクロパターニングヒドロキシ - のPAAmハイドロゲル
- 15分間のエタノール/水(50:50)溶液中超音波処理中に置きのPDMS microstampsを。
- 窒素流流でスタンプを乾燥させ、それらを7分間UV /オゾンクリーナーパターンアップ(λ<200 nm)を配置します。
- 無菌フード下で、1cmの2 PDMSスタンプの微細構造表面上に所望のタンパク質溶液( 例えば 、100μg/ mlのラミニンPBS中または25 / mlのフィブロネクチンPBS中)の150μlのドロップを置きます。
- オプション:細胞 - リガンド密度を調節するために、タンパク質溶液の濃度を変更します。
- の各コーナーに向かってピペットの先端を無菌でそれを移動させることによって、スタンプ表面を横切るタンパク質溶液を広げるスタンプ。
- 無菌フード下で60分間PDMSスタンプに吸着するタンパク質溶液のままにしておきます。タンパク質損傷を避けるため、ランプをオフにします。
- 無菌フード下では、ペトリ皿に(ステップ2.13から入手可能)、ヒドロキシPAAmをコーティングしたカバースリップを転送します。
- 無菌条件下での低窒素流でヒドロキシ-PAAmを基材の表面から過剰のPBSを削除します。とすぐにゲル表面に水を立っての証拠が観察されないように手続きを停止します。ゲルは、この段階で完全に乾燥してはならない。
- 乾燥は、慎重にPDMSの構造化表面は、高純度窒素ガスの定常流でスタンプ。
- ドレッシング組織鉗子を用いたタンパク質でコーティングされたスタンプをつかみ、乾燥したハイドロゲル表面に接触して構造化した表面に置きます。スタンプマイクロ構造およびヒドロゲル表面との間の良好な接触を確保するためにPDMSスタンプの上にピンセットの先端で簡単な圧力ポイントを適用します。
- 目の上のPDMSスタンプのままに室温で1時間の電子化ヒドロゲル表面。
- 静かにドレッシング組織鉗子でヒドロキシ - のPAAmハイドロゲルからPDMSスタンプを削除して、スタンプをきれいにするステップ4.1に従ってください。
- 為替当たり10分間、無菌状態でのPBS 3の交換液(pH = 7.4)によって広く刻印ヒドロキシPAAmをハイドロゲルを洗ってください。
- オプション:他のECMタンパク質のさらなる微細パターンは、ステップ4.11〜4.5に従うことによってヒドロキシPAAmを表面に添加することができる。
- ロッキングプレート上穏やかな撹拌下、4℃で1夜の間に、PBS中5mg / mlのBSAの無菌溶液で不動態化非印刷ゾーン。
- 交換につき10分間滅菌条件下でのPBS 3の交換液(pH = 7.4)で広く洗浄します。この段階では、スタンプさヒドロキシ-PAAmをヒドロゲルは、一週間まで4℃で保存することができる。
マイクロパターンヒドロキシPAAmをヒドロゲル上の5の細胞沈着
- めっき前cに30〜45分間、細胞培地中でカバースリップをインキュベートのエル。
- 37℃で滅菌したPBSで75cm 2の培養フラスコで培養接着細胞を洗浄し、トリプシン-EDTAまたは10分間ACCUTASE 3mlで、それを取り外してください。
- 650のx gで3分間、細胞懸濁液を遠心分離した細胞を含むフラスコにあなたの細胞株についての予め温めた完全増殖培地に適切な所望の量を転送する。
- マイクロピペットで上清を除去し、15-20,000細胞/ mlで完全培地中で細胞を懸濁します。
- (ステップ5.1から得られた)マイクロパターン化カバースリップに細胞溶液4mlを加え、37℃で培養インキュベーター中で細胞に覆われたカバースリップを置き、1〜2時間、5%の湿度。
- 吸引し優しく付着していない細胞と培養液を交換してください。インキュベーターに付着した細胞を戻し、それらを(細胞型に応じて、3〜6時間)完全に広げてみましょう。
結果
図1Aは、ランダムラジカル重合によって埋め込 まヒドロキシル基(水酸基のPAAm)、ポリアクリルアミドの親水性ネットワークを形成された一次ヒドロキシル基を含むN-ヒドロキシエチル(HEA)モノマーとアクリルアミドの共重合(AAM)を提示し、ビスアクリルアミド(ビス-AAmと) 。このプロトコルでは、HEAの重量65 mgのHEPESの1ミリリットルの容量で希釈しなければならない。 HEAの密度は1にほぼ等しいことを知って、私たちは1065液(HEA + HEPES)の作業容量を取得することを前提としています。 表1に示したように、AAmと400μlのとbisAAm50μlのに1065μlの総付加は、1515μlの容量につながる。したがってHEPESの3,485μlの容量を5mlの最終容量に対する解決策を調整するために必要とされる。ステップ2.6に示すように、22ミリメートルのカバーガラスの表面を生じさせることなく、それを除去するために、UV /オゾンでの7分の間に活性化されなければならないヒドロゲル表面への損害。実際に、ガラス表面は、UV /オゾン処理した後に、より親水性になるので、容易に水にシステム全体を浸漬することによって除去することができる。さらに、UV /オゾン処理は、ヒドロゲルの表面と直接接触している22ミリメートルカバースリップの化学的汚染を防止する。この技術は許可カバーガラス(直径25mm)に結合している平坦な円形のポリアクリルアミド表面(直径22ミリメートル)を得た。
図1Bに示されるように、タンパク質のマイクロパターンは、マイクロコンタクト印刷によりヒドロキシ-PAAmをヒドロゲルの表面上に作成することができる。この実験手順において、UV /オゾン暴露、表面にシラノール基を形成することによって一時的にPDMSスタンプの固有の疎水性を減少させるために可能にする。 254nmのラインが原子状酸素にオゾンを変換しながら、実際には、185 nmのラインは、分子状酸素からオゾンを生成します。この反応種のシロキサンBAを攻撃PDMSのckboneは、酸素リッチのSiOxシリカ様の層とSi-OH表面基を形成する。酸化されたPDMS表面は、表面にバルク相からの低分子量非架橋ポリマー鎖の移動を空気に暴露した後数時間内にその疎水性を回復することが知られている。この戦略は、PDMSスタンプの表面上にタンパク質溶液の広がりを助ける。
この方法の主要な利点の一つは、独立して、マトリックスの剛性( 図2A)、微小パターン形状( 図2B)、細胞-リガンド密度( 図2C)、およびタンパク質の性質( 図3Aおよび3B)を変調することである。 図2Aに示されているように、ヒドロキシ-PAAmをヒドロゲルは、細胞の微小環境の剛性の微細な再現を可能にする、数十キロパスカル〜数キロパスカルから架橋剤濃度に対する弾性率の線形依存性を示す。 図2B 明らかに微細パターンジオメトリおよびマトリックス剛性の独立したチューニングを実証、ラミニンの落射蛍光像(LM)は、3つの異なる剛性(2.5、15、および40キロパスカル)のヒドロキシのPAAmハイドロゲル上に堆積された長方形の微細パターンを提示します。 図2Cは、セルことを示しています-リガンド密度は、PDMSスタンプをインキュベートするために使用されるタンパク質溶液の濃度を変えることによって調節することができる。 図3シーケンシャルマイクロコンタクト印刷物を用いて、ラミニンおよびフィブロネクチンの行に刻印コラーゲンラインの蛍光画像を示す。
読者は微細パターンのさまざまなサイズおよび形状にかかわらず、ヒドロゲルの剛性を効率的に刻印されていることに注意することは興味深い。私たちは、魔女が存在しないことを実証し、成功した鋭いエッジ( 例えば 、三角形や星)とストレート( 例えば 、線)、または湾曲した( 例えば 、円)の形状を有するタンパク質の微小特徴を再現していますパターンの複雑さへのrを制限。単一細胞実験のため、微細パターンの表面積は400と2,500μm2で、単一の細胞生存度の限界に対応する低い値の間であった。他の多くのマイクロプリンティングに基づく方法として、提示された方法の主な制限は、その空間分解能に関する。 「ソフト」ヒドロゲルに、解像度の限界が部分的に中に発生する表面変形によって決定になるのに対し、硬いヒドロゲル(E> 10キロパスカル)には、空間分解能がマイクロメートルの周りであり、主に、スタンプの決議によって決定タンパク質導入。
ヒドロキシ-PAAmをヒドロゲルの毒性が均一にコーティングされた培養において1、2、3日間平板培養初代内皮細胞の生存率およびmicroprintedソフトヒドロキシ-PAAmをヒドロゲル( 図4A)を定量することによって調べた。 HUVECの約80%が維持さマイクロパターンソフトヒドロキシ-PAAmをハイドロゲル上にプレーヒドロキシのPAAmの生体適合性を実証する3日間のそれらの生存能力は、細胞培養のためのヒドロゲル。興味深いことに、同様の生存率は、初代皮質神経細胞での研究室で得られた。また、一次内皮細胞は、この方法が剛性の広い範囲にわたって細胞増殖を研究するための適切な微小環境を提供することを示し、「ソフト」(25 kPa)の基板( 図4B)と比較し(500 kPa)の「硬い」の詳細を増殖。
メカノ上の基板の剛性の影響および拡散領域を分離するために、一次内皮細胞(HUVEC)は、長方形、FNでコーティングされた微細パターン上に播種した三つの異なる剛性(2.5、8.5のヒドロキシのPAAmハイドロゲル上に堆積(1,200平方μm の定数領域)、そして25キロパスカル)。乳房のために使用されるにつれて、HUVECを、標準的な免疫細胞化学的手順に従うことによってアクチンフィラメント、ビンキュリン及びDNAについて染色したリアン細胞を、ガラス基板上にプレーティングした。より剛性の基板上に、アクチン繊維がまっすぐと厚く、核変形( 図5)であるのに対し、柔らかい基板上に、HUVECを、低アクチン繊維密度と丸みを帯びた核を示す。一定の拡散面積の基板の剛性の変化は、核の再形成をもたらすアクチンストレスファイバーの張力および分布を調節する。この観察は、マトリックス剛性、細胞骨格、核との間の機械的な結合を示唆している。
| ファイナルAAmと/ bisAAm比 | AAmと40%(μL) | HEAの重量は1ミリリットルHEPES(mg)の中で溶解する | ビスAAmと(2%) (μL) | HEPES(μL) | ヤング率 (10 3 Pa)の |
| 0.2 / 50 0.5 / 50 50分の1 2/50 3/50 | 400 400 400 400 400 | 65 65 65 65 65 | 50 125 250 500 750 | 3,485 3410 3,285 3035 2785 | 〜1.4 〜3.6 〜8.7 〜17.2 〜25 |
ヒドロキシのPAAmの表の調製は、さまざまな剛性を有するヒドロゲル。ワーキングソリューションは、1.4〜25キロパスカルの範囲の最終剛性ヒドロキシPAAmをヒドロゲルを調製した。
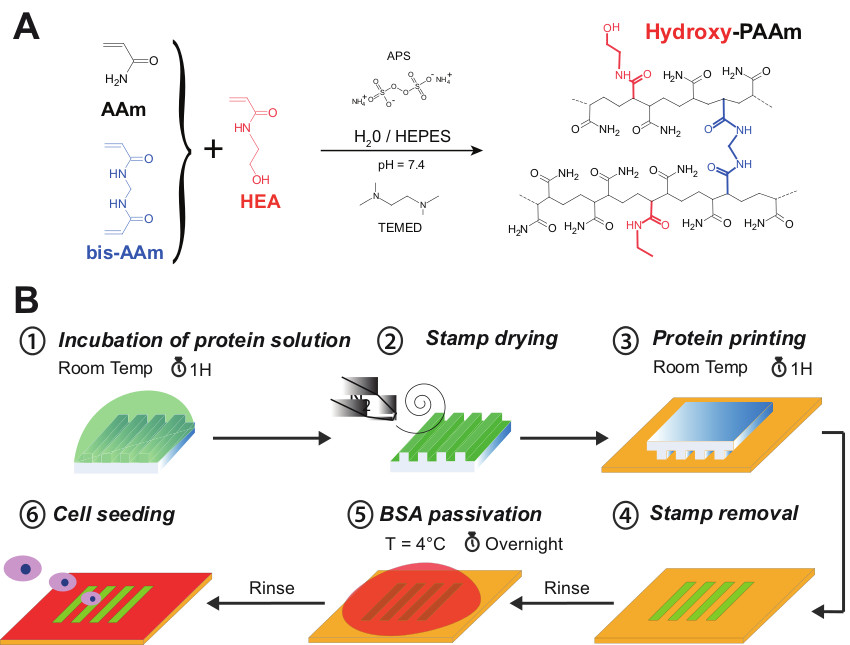
図1は、(A)アクリルアミド(AAmと、黒色)、N、N'-メチレンビスアクリルアミド(青ビス-AAmと、)及びN-ヒドロキシエチル(HEAは、赤)ヒドロキシを形成するために一緒に混合した PAAmをハイドロゲル。(B)ヒドロキシ-PAAmをヒドロゲル上の微細手順の異なるステップの概略図。タンパク質の溶液は、最初microstamp(ステップ#1)の構造面の1時間の間インキュベートする。ヒドロゲル表面を穏やかに窒素流(ステップ#2)で乾燥させる。 microstampその後、1時間(ステップ#3)の間にヒドロキシPAAmを表面との正式な接触して配置される。連続洗浄した後、microprinted表面を滅菌BSA溶液で不動態化される(ステップ#5)非印刷領域をブロックするために、4℃でO / Nに堆積。最後に、microprintedヒドロキシ-PAAmを表面が滅菌PBSで数回洗浄し、細胞播種(ステップ#6)。のための準備ができているこの図の拡大版をご覧になるにはこちらをクリックしてください。
1010 / 51010fig2highres.jpg "幅=" 500 "/>
図2(A)ヒドロキシ-PAAmをヒドロゲルの剛性の進化は、直線(赤線は、R 2 = 0995との線形回帰である)ビス-AAmと架橋剤の量と相関している。の(B)蛍光画像異なる剛性(E = 2.5、15、40キロパスカル)のヒドロキシのPAAmハイドロゲルに刻印長方形のラミニンマイクロ特徴。スケールバーは、(A)は 65μmで、(B)は80μm、及び(C)に対応し50μmである。(C)が15μm幅のフォーム25キロパスカルヒドロキシのPAAmハイドロゲル上のLM勾配の平行線、進化によって示されるように蛍光強度プロファイルの。 この図の拡大版をご覧になるにはこちらをクリックしてください。
nは "SRC =" /ファイル/ ftp_upload / 51010 / 51010fig3highres.jpg "幅=" 500 "/>
90°で交差ストライプ(緑色)、図3(A)免疫蛍光フィブロネクチンの画像(赤)とラミニン(B)(赤)フィブロネクチン、ラミニン(緑色)とストライプ(青)コラーゲンのMultilabeling microprintedその後25キロパスカルヒドロゲルのPAAm基板上に。スケールバーは30μmで対応している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
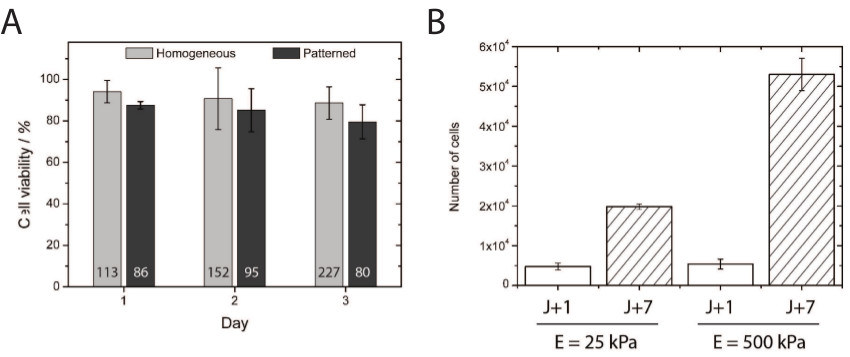
図4(A)細胞生存率の定量を均一に被覆し、マイクロパターンヒドロキシ-PAAmを表面上に播種された後に優れた電池24における生存、48、及び72時間を示した。数は、で示される1(白バー)および7(ハッシュ化されたバー)の後に25〜500キロパスカルに均一にコーティングされた基板上の各バーの下部に生存率アッセイのために計数した細胞の総数に対応している。(B)HUVECの増殖の定量培養日数。 この図の拡大版をご覧になるにはこちらをクリックしてください。

緑の中で図5蛍光2.5キロパスカル、8.5キロパスカルのヒドロキシのPAAmハイドロゲル上に堆積させた長方形のFNでコーティングされた微細パターン、上で培養し、免疫染色初代内皮細胞の画像、及び25(左から右へ)キロパスカル。アクチンストレスファイバー( )アレクサフルオロ488ファロイジンで染色した、()赤で接着斑は、マウスpolycloで染色したNAL一次抗体および赤色蛍光IgG二次抗体とDNAで標識をDAPIで青く染色した。スケールバーは17μmで 対応している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
現代の細胞生物学のin vitroでの観察の多くは、多くの場合、ECMタンパク質またはRGD配列を含む合成ペプチドの薄層で被覆された硬質ガラス製カバースリップ上で行われている。しかし、そのような基本的な培養基質は、細胞のメカノプロセスを研究するための正確なモデルを提供しないので、ECMの全体の物理化学の複雑さを再現していません。この問題に取り組むために、任意の所望の量およびECMタンパク質の性質二次元ヒドロゲルを官能化するための単純な代替案を提案する。この方法は、このようなマトリックスのこわばり、細胞形態および閉じ込めまたは細胞リガンド密度として、重要なメカノ合図を独立して制御することができます。また、ヒドロキシ-PAAmをヒドロゲルに固定化し、複数のECMタンパク質の空間分布を制御することができないことであり、現在の官能化法の最大の限界の一つを克服する。水力発電の高親和のためにXY-PAAmを生体分子のためのヒドロゲル、人はどんな補助装置を必要としないシーケンシャルmicroprintingsを使用することによって、関係なく、マトリックスの剛性を同一面上にさまざまなECMタンパク質の空間分布を制御することができます。
私たちは、コストや専門知識は最小限の要件に、それらの本質的に非接着性を克服するためにアクリルアミドハイドロゲル内のヒドロキシル基の取り込みに基づく新たな手順を提案する。ハイドロゲル上のタンパク質をパターニングするための既存の技術と比較して、ヒドロキシ-PAAmを法は過酷な有毒化学物質( 例えば 、ヒドラジン水和物)の使用を避け、高価な光反応性架橋剤( 例えば 、スルホ-SANPAH)とのUVランプパワーおよび位置決めに依存してソフトハイドロゲルを官能。ヒドロキシ-PAAmをヒドロゲルは、数週間安定で活性のままで大量生産することができ、容易にmicroprintedおよび生体分子に対する高い親和性の相乗効果を調べることを可能にする細胞機能上の共役ECMタンパク質。また、ヒドロキシ-PAAmをヒドロゲルを定量的にその周囲の微小環境における細胞によって及ぼされる収縮力の量を調査するために使用することができる。実際、本発明者らは、蛍光ビーズが容易に変位場を測定するために、細胞牽引力顕微鏡(TFM)を使用するために、ヒドロキシ-PAAmをヒドロゲルに埋め込 むことができることが以前1,20に示され、上で平板培養真核細胞によって及ぼされる結果として生じる牽引力場を推定している二次元微細。
他の多くのマイクロプリンティングに基づく方法として、ヒドロキシ-PAAmをヒドロゲルの主な制限は、タンパク質微小特徴の空間分解能に関する。堅いヒドロゲル(E> 10 kPa)の上に、空間分解能はマイクロメートル程度であると、主にシリコンモールドを製造するために使用されるリソグラフィ技術に依存して、スタンプの分解能によって決定。柔らかくヒドロゲルでは、空間分解能は、部分的に目で決定さになるマイクロ空間分解能を達成するための主な制限となったタンパク質の転送、中に電子の表面変形。ここで紹介するアプローチは、現在、二次元の基板に限定されている。しかし、この方法は、高度にスケーラブルであり、更なる研究は、三次元構造には、この方法を拡張するために私たちの研究室では、現在進行中である。
私たちは、胚発生、炎症反応、創傷治癒、神経突起伸長、成体組織を含む、ヒドロキシ-PAAmをヒドロゲルは、細胞の微小環境21,22の物理化学的特性と密接に関連している複雑な細胞および組織のプロセスの重要なメカニズムを解読するのに役立つことを願っていますホメオスタシス、ならびに線維症および癌などの疾患の病因。
開示事項
No conflicts of interest declared.
謝辞
This work was supported by the Belgian National Foundation for Scientific Research (F.R.S.-FNRS) through “MIS Confocal Microscopy”, “Crédit aux Chercheurs” grants and the “Nanomotility FRFC project” (no. 2.4622.11). T.G. doctoral fellowship is supported by the Foundation for Training in Industrial and Agricultural Research (FRIA). The authors gratefully acknowledge Sylvain Desprez for mechanical characterization and Géraldine Circelli for confocal imaging.
資料
| Name | Company | Catalog Number | Comments |
| UV/Ozone Photoreactor | Ultra-Violet Products | Model PR-100 | |
| Rocking plate | IKAcWerke | Model KS 130 Basic | |
| Vortexer | Scientific Industries | Model Vortex Genie2 | |
| Vacuum degassing chamber | Applied Vacuum Engineering | DP- 8-KIT | |
| Parafilm | Sigma-Aldrich | P7793-1EA | |
| Stainless steel forceps with fine tip | Sigma-Aldrich | Z225304-1EA | |
| Dressing tissue forceps | Sigma-Aldrich | F4392-1EA | |
| Petri dishes in polystyrene | Sigma-Aldrich | P5731-500EA | |
| Aluminium foil, thickness 0.5 mm | Sigma-Aldrich | 266574-3.4G | |
| Isopore membrane filter (0,2 µm pore size) | Millipore | GTTP Filter code | |
| Round glass coverslip (22 mm diameter) | Neuvitro | GG-22 | |
| Round glass coverslip (25 mm diameter) | Neuvitro | GG-25 | |
| Variable volume micropipette | Sigma-Aldrich | Z114820 | |
| Protein microcentrifuge tubes | Sigma-Aldrich | Z666505-100EA | |
| Scalpel handles | Sigma-Aldrich | S2896-1EA | |
| Scalpel blades | Sigma-Aldrich | S2771-100EA | |
| Cell culture flasks (75 cm2) | Sigma-Aldrich | CLS430641 | |
| Ultrasonic bath tray, solid (stainless steel) | Sigma-Aldrich | Z613983-1EA | |
| Name of the Reagent | Company | Catalogue Number | Comments |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Acrylamide (powder) | Sigma-Aldrich | A3553 | |
| N,N’-Methylenebis(acrylamide) | Sigma-Aldrich | 146072 | |
| N-Hydroxyethylacrylamide | Sigma-Aldrich | 697931 | |
| N,N,N’,N’-Tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Amonium PerSulfate (APS) | Sigma-Aldrich | A3678 | |
| 3-(Trimetoxysilyl)propyle acrylate | Sigma-Aldrich | 1805 | |
| Human Plasma Fibronectin | Millipore | FC010 | |
| Laminin from EHS | Sigma-Aldrich | L2020 | |
| Sodium hydroxyde | Sigma-Aldrich | 221465-25G | |
| Double-distilled water (ddH2O) | |||
| Endothelial cell growth medium | Cells Applications | 211K-500 | |
| Human Umbilical Vein Endothelial Cells (HUVEC) | Invitrogen | C-003-5C | |
| Accutase | PAA laboratories | L11-007 | |
| HEPES buffer solution 1M in H20 | Sigma-Aldrich | 83264-500ML-F | |
| Antibiotics-antimycotics | PAA laboratories | P11-002 | |
| Phosphate Buffer Saline solution | PAA laboratories | H15-002 | |
| Alexa Fluor 488 Phaloidin | Molecular Probes | A12379 | |
| Anti-vinculin antibody produced in mouse | Sigma-Aldrich | V9131 | |
| Goat anti-mouse antibody-tetramethylrhodamine | Molecular Probes | T-2762 | |
| Anti-Fibronectin | Sigma-Aldrich | F3648 | |
| (rabbit) | |||
| Streptavidin | Sigma-Aldrich | 41469 | |
| Anti-Laminin antibody | Sigma-Aldrich | L9393 | |
| (rabbit) | |||
| Anti-rabbit IgG-FITC | Sigma-Aldrich | F7512 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924-100ML | |
| Absolute ethanol | Sigma-Aldrich | 459844-2.5L |
参考文献
- Grevesse, T., Versaevel, M., Circelli, G., Desprez, S., Gabriele, S. A simple route to functionalize polyacrylamide gels for the independent tuning of mechanotransduction cues. Lab Chip. 13 (5), 777-780 (2013).
- Gabriele, S., Benoliel, A. M., Bongrand, P., Théodoly, O. Microfluidic investigation reveals distinct roles for actin cytoskeleton and myosin II activity in capillary leukocyte trafficking. Biophys. J. 96 (10), 4308-4318 (2009).
- Atmanli, A., Domian, I. J. Generation of aligned functional myocardial tissue through microcontact printing. J. Vis. Exp. (73), e50288 (2013).
- Gabriele, S., Versaevel, M., Preira, P., Théodoly, O. A simple microfluidic method to select, isolate, and manipulate single-cells in mechanical and biochemical assays. Lab Chip. 10 (11), 1459-1467 (2010).
- Le Berre, M., Aubertin, J., Piel, M. Fine control of nuclear confinement identifies a threshold deformation leading to lamina rupture and induction of specific genes. Integr. Biol. 4 (11), 1406-1414 (2012).
- Rundqvist, J., et al. High fidelity functional patterns of an extracellular matrix protein by electron beam-based inactivation. J. Am. Chem. Soc. 129 (59), 59-67 (2006).
- Sorribas, H., Padeste, C., Tiefenauer, L. Photolithographic generation of proteins micropatterns for neuron culture applications. Biomaterials. 23 (3), 893-900 (2002).
- Holden, M. A., Cremer, P. S. Light activated patterning of dye-labeled molecules on surfaces. J. Am. Chem. Soc. 125 (27), 8074-8075 (2003).
- Cheng, Q., Li, S., Komvopoulos, K. Plasma-assisted surface chemical patterning for single-cell culture. Biomaterials. 30 (25), 4203-4210 (2009).
- Kumar, A., Whitesides, G. M. Features of gold having micrometer to centimeter dimensions can be formed through a combination of stamping with an elastomeric stamp and an alkanethiol "ink" followed by chemical etching. Appl. Phys. Lett. 63 (14), 2002-2004 (1993).
- Tseng, Q., et al. New micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11, 2231-2240 (2011).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS ONE. 7, e51499 (2012).
- Herrick, W. G., Nguyen, T. V., Sleiman, M., McRae, S., Emrick, T. S., Peyton, S. R. PEG-Phosphorylcholine hydrogels as tunable and versatile platforms for mechanobiology. Biomacromolecules. 14, 2294-2304 (2013).
- Versaevel, M., Grevesse, T., Riaz, M., Lantoine, J., Gabriele, S. Micropatterning hydroxy-PAAm hydrogels and sylgard 184 silicone elastomers with tunable elastic moduli. Methods in Cell Biology. 121, 33-48 (2014).
- Kandow, C. E., Georges, P. C., Janmey, P. A., Beningo, K. A. Polyacrylamide hydrogels for cell mechanics: steps towards optimization and alternative uses. Methods Cell Biol. 83, 29-46 (2007).
- Hemphill, M. A., et al. A possible role for integrin signaling in diffuse axonal injury. PLoS ONE. 6 (7), e22899 (2011).
- Damljanovic, V., Lagerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamide substrates for cell mechanotransduction assays. BioTechniques. 39 (6), 847-851 (2005).
- Hynd, M. R., Frampton, J. P., Dowell-Mesfin, N., Turner, J. N., Shain, W. Directed cell growth on protein-functionalized hydrogel surfaces. Journal of Neuroscience Methods. 162, 255-263 (2007).
- Tseng, Q., et al. new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11 (13), 2231-2240 (2011).
- Versaevel, M., Grevesse, T., Gabriele, S. Spatial coordination between cell and nuclear shape within micropatterned endothelial cells. Nat. Commun. 3, 671 (2012).
- Versaevel, M., Grevesse, T., Riaz, M., Gabriele, S. Cell Confinement: Putting the squeeze on the nucleus. Soft Matter. 9, 6665-6676 (2013).
- Trappman, B., Chen, C. S. How cells sense extracellular matrix stiffness: a material's perspective. Current Opinion in Biotechnology. 24, 1-6 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved