Method Article
Préparation des hydroxy-PAAm hydrogels pour découplage des effets de la mécanotransduction Cues
Dans cet article
Résumé
Nous présentons une nouvelle hydrogel de polyacrylamide, appelé hydroxy-PAAm, qui permet une liaison directe de protéines de la MEC avec un coût ou une expertise minimale. La combinaison de l'hydroxy-PAAm hydrogels avec l'impression microcontact facilite le contrôle indépendant de nombreux indices du microenvironnement cellulaire naturel pour l'étude mechanostransduction cellulaire.
Résumé
Il est maintenant bien établi que de nombreuses fonctions cellulaires sont régis par des interactions de cellules avec des indices physico-chimiques et mécaniques de leur matrice extracellulaire (MEC) environnement. Les cellules eucaryotes détectent constamment leur micro-environnement local à travers les mécanorécepteurs de surface pour transduire les changements physiques de l'ECM en signaux biochimiques, et à intégrer ces signaux pour obtenir des modifications spécifiques de l'expression génique. Fait intéressant, les paramètres physico-chimiques et mécaniques de l'ECM peut se coupler avec l'autre pour réguler le destin des cellules. Par conséquent, une clé pour comprendre la mécanotransduction est de dissocier la contribution relative de l'ECM indices sur les fonctions cellulaires.
Nous présentons ici un protocole expérimental détaillé pour générer rapidement et facilement des hydrogels biologiquement pertinentes pour le réglage indépendant de mécano indices in vitro. Nous hydrogels de polyacrylamide chimiquement modifiées (paam) à surmonter leurs intrinsèquement non-ADHESive propriétés par l'incorporation de monomères d'acrylamide fonctionnalisé par des groupes hydroxy au cours de la polymérisation. Nous avons obtenu un roman PAAm hydrogel, appelé hydroxy-PAAm, qui permet l'immobilisation de toute nature souhaitée de protéines de la MEC. La combinaison de l'hydroxy-PAAm hydrogels avec l'impression par microcontact permet de contrôler de façon indépendante la morphologie des cellules individuelles, la rigidité de la matrice, la nature et la densité de protéines de la MEC. Nous fournissons une méthode simple et rapide qui peut être mis en place dans tous les laboratoires de biologie pour étudier dans les processus de mécanotransduction cellulaire in vitro. Nous validons cette nouvelle plate-forme à deux dimensions en menant des expériences sur les cellules endothéliales qui démontrent un couplage mécanique entre la rigidité de l'ECM et le noyau.
Introduction
De nombreux aspects du microenvironnement cellulaire local (par exemple, la rigidité, la taille des pores, la nature des protéines, ou la densité cellulaire-ligand) fournir un ensemble de coordonnées de signaux de régulation qui contrôlent les processus cellulaires tels que la motilité, la prolifération cellulaire, la différenciation et l'expression des gènes. Modifications des propriétés physico-chimiques du milieu extracellulaire peuvent être perçus par les cellules et provoquent différentes conséquences physiologiques, y compris la déformation de la polarisation cellulaire, la migration et la différenciation. On ne sait pas, cependant, comment les cellules se traduisent modifications ECM en signaux biochimiques cellulaires. Il est donc d'une importance majeure à l'ingénieur contrôlée dans des micro-environnements in vitro qui peuvent reproduire les interactions entre les cellules et leur microenvironnement pour étudier les voies d'mécano. Pour résoudre ce problème, nous avons récemment mis en place une nouvelle méthode 1, appelé hydrogels-paam hydroxy, de générer facilement des deux sounsional matrices souples qui permettent de contrôler de manière indépendante des signaux mécano importantes: la rigidité de la matrice, la géométrie de la cellule et de confinement, de la nature de la protéine et de la densité cellulaire-ligand.
ECM dirige les processus cellulaires à travers des gradients de morphogènes (chimiotaxie), des protéines adhésives (haptotaxis), et la rigidité (durotaxis). Au cours des dernières décennies, avancée dans les plates-formes in vitro ont été mis au point pour isoler ces signaux extracellulaires afin de démêler la façon dont les cellules sont capables de traduire les caractéristiques biochimiques et biophysiques dans les processus physiologiques 2-5. Faisceau d'électrons 6, 7 photolithographie, l'immobilisation photochimique 8 ou techniques assistés par plasma 9 ont été élaborés pour orienter la croissance de cellules vivantes sur des substrats microélectrodes. Bien que ces techniques ont donné des résultats importants, la plupart d'entre eux ne permettent pas de discrimination entre l'influence individuelle des différents indices sur le comportement des celluleset ils nécessitent des installations techniques que peu de laboratoires peuvent se permettre. Parmi ces techniques, microcontact impression (uCP), a émergé comme une méthode robuste et accessible pour créer des micro-îles de cellules-adhésif 10. Plus récemment, des efforts considérables 11-14 ont été faits pour développer uCP d'hydrogels avec rigidités accordables afin de reproduire la vaste gamme de rigidités observées dans les tissus vivants. Parmi ces œuvres, le polyacrylamide (PAAm) est devenu populaire 15 et est déjà l'une des matrices les base de polymères les plus couramment utilisés pour la biomécanique de cellules tests.
Paam surfaces fonctionnalisées sont communément avec l'agent de réticulation hétérobifonctionnel N-sulfosuccinimidyle-6-protéines [4'-azido-2'-nitrophenylamido] (sulfo-SANPAH) et ECM sont reliés à la surface par activation d'UV de la nitrophényl sulfo-SANPAH groupes azide 16. Une autre technique consiste à couplage de l'hydrazine à des protéines qui ont été fortement oxydéesavec du periodate 17. Hynd et ses collaborateurs ont introduit une technique de structuration des surfaces d'hydrogel biomimétiques avec la protéine et des peptides exige que la photopolymérisation en présence d'un monomère d'acroyl-18 streptavidine. Plus récemment, Tseng et al. Ont rapporté une nouvelle méthode de micromodelage 19 sur la base de l'exposition aux UV profond de PAAm à travers un masque de quartz optique qui oblige à incuber gels PA activés avec [3-diméthylaminopropyl] carbodiimide chlorhydrate de 1-éthyl-3 (EDC) et le N-hydroxysuccinimide (NHS) des solutions d'eau avant d'ajouter la protéine. Malgré la capacité de ces techniques pour créer homogènes et reproductibles protéines micropatterns, la plupart d'entre eux souffrent des limites importantes: processus de longue de synthèse (par exemple, la dialyse, la lyophilisation, etc), des composés chimiques coûteux (par exemple, l'acide hyaluronique, sulfo-SANPAH) de profondeur UV ou irradiation. De plus, ces techniques ne permettent pas de modulation indépendante de la rigidité du substrat, motif finla géométrie, la protéine ECM nature et de la densité cellulaire-ligand.
Compte tenu de ces limitations en compte, nous avons développé une approche à base d'acrylamide roman et simple qui permet l'immobilisation d'une variété de protéines et de biomolécules sur des hydrogels mous et permet le réglage indépendant de mécano repères pour décrypter leur rôle sur les fonctions cellulaires. Au lieu de traiter hydrogels paam avec des composés chimiques agressifs, nous introduisons un monomère d'acrylamide commercial avec des groupes hydroxyles lors de la polymérisation PAAm. Cette simple opération permet de surmonter la propriété anti-adhésive intrinsèque d'hydrogels paam sans autres exigences techniques.
La présence de groupes hydroxyles conduit à une forte affinité d'hydrogels hydroxy-Paam pour des protéines et des biomolécules qui forment des interactions de liaison hydrogène. En combinaison avec uCP, hydrogels-paam hydroxy permettent une production rapide de deux dimensions plate-forme de culture avec un contrôle indépendantsur la matrice de rigidité, le type de protéines de la MEC, la densité cellulaire-ligand et l'adhérence limitée, qui sont prévu pour être une plate-forme puissante pour étudier la mécanotransduction.
Le but de ce protocole est de fournir les informations nécessaires pour faire facilement des hydrogels-paam hydroxy sans aucune expertise en sciences des matériaux. Le but ultime est de fournir un moyen pour les chercheurs de poser des questions physiologiquement pertinents aux niveaux cellulaires et tissulaires qui peuvent conduire à une meilleure compréhension des voies de mécanotransduction impliqués dans les mécanismes physiopathologiques.
Protocole
1 Activation de la surface de verre Lamelles
- Lieu lamelles de verre circulaires (diamètre 25 mm) dans une boîte de Pétri et frottis de 0,1 M NaOH solution sur elle pendant 5 min (hotte pour émanations chimiques recommandé).
- Retirer la solution de NaOH et une immersion totale lamelles avec le trou DDH 2 O stérile pendant 20 minutes tout en balançant doucement sur une plaque à bascule dans une hotte de culture stérile.
- Égoutter stérile ddH 2 O et répéter l'étape 1.2.
- Retirez les lamelles avec des pincettes stériles et les placer dans une nouvelle boîte de Pétri avec le visage activée vers le haut.
- Lamelles sec sous un flux constant de haute pureté de l'azote gazeux.
- Dans une hotte de culture stérile, appliquer une mince couche de l'acrylate de 3 (triméthoxysilyl) propyle (92%) sur le côté actif de la lamelle couvre-objet pendant 1 heure.
- Laver abondamment lamelles de verre avec 3 lavages de ddH stérile 2 O et les plonger dans le trou DDH 2 O stérile dans une nouvelle boîte de Pétri.
- Appuyez sur la boîte de Pétriavec du parafilm et placer sur une plaque à bascule sous agitation douce pendant 10 min.
- Retirez les lamelles de ddH 2 O avec des pincettes stériles avec pointes fines et placez-les dans une nouvelle boîte de Pétri avec le visage activée vers le haut.
- Stocker à température ambiante dans un endroit sec avec du papier d'aluminium pour éviter la poussière de coller aux lamelles.
2 Préparation de l'hydroxy-paam hydrogels
- Préparer un poids de 65 mg de N-hydroxyéthyl acrylamide (HEA) dans un tube Eppendorf de 1,5 ml. Il est important de préparer une solution fraîche de HEA.
- Ajouter 1 ml de tampon HEPES 50 mM à HEA et mélanger à l'aide d'un vortex jusqu'à la dissolution complète de HEA.
- Ajouter 400 ul de 40% en poids / poids dans une solution de HEPES acrylamide et le volume requis de 2% p / p dans de l'HEPES solution de bis-acrylamide (voir tableau 1) pour atteindre la rigidité désirée de l'hydrogel. Ajuster avec 50 mM de HEPES à un volume final de 5 ml.
- Mélanger la solution avec un vortex et dégazerdans une chambre à vide pendant 20 minutes afin de réduire la concentration d'oxygène au sein de la solution, ce qui empêche la polymérisation hydroxy-PAAm.
- Sous une hotte stérile, filtrer la solution dégazée avec un filtre de 0,2 um de taille de pores, afin de la stériliser.
- Activer lamelles de verre circulaires (diamètre 22 mm) dans un produit UV / ozone pendant 7 min.
- Préparer 100 pi de persulfate d'ammonium (APS) solution à 10%, soit 10 mg APS dans 100 ul ddH 2 O. Il est important de préparer une solution fraîche de l'APS.
- Ajouter 2,5 pi de la tétraméthylènediamine (TEMED) et 25 ul de solution à l'APS-hydroxy PAAm solution stérilisée (étape 2.5) pour initier la polymérisation. Mélanger la solution par 3 pipettages successives sans introduction de bulles, dans des conditions stériles.
- Sous une hotte stérile, déposer une goutte de 25 ul de la solution hydroxy-PAAm sur une lamelle de 25 mm (disponible à partir de l'étape 1.9) et placer immédiatement un 22 mm glcul lamelle (préparé à l'étape 2.5) sur le dessus de la gouttelette de serrer la solution hydroxy-PAAm. Centrer la lamelle de verre de 22 mm avec des pincettes stériles et lisser les bulles.
- Permettre aux hydrogels-hydroxy Paam à polymériser à température ambiante pendant 15 min. Inverser manuellement la solution restante hydroxy-PAAm dans le tube Eppendorf de suivre la fin du processus de polymérisation.
- Immerger complètement stérile avec des lamelles couvre-trou DDH 2 O et on sépare soigneusement les 22 lamelles couvre-objet en verre mm en introduisant le bord d'une lame de rasoir entre les lamelles 22 mm de verre et la couche d'hydrogel hydroxy-PAAm.
- Lavez-hydrogels paam hydroxy avec du PBS stérile (3 échanges de PBS) et de laisser les gels totalement immergés dans du PBS stérile pour maintenir l'hydratation.
- Rangez-hydrogels paam hydroxy dans du PBS stérile à 4 ° C pendant 3 jours.
3. polydiméthylsiloxane (PDMS) Microstamp Fabrication
NOTE: La fabrication d'un maître de silicium est nécessaire avant de staTA PDMS fabrication microstamp. Cette microfabrication d'un maître de silicium peut être fait par des techniques de lithographie, ce qui nécessite un équipement et une formation spécialisée. Collaborations avec un centre de nanofabrication sont encouragés à fabriquer le maître de silicium. Vous pouvez également contacter une entreprise qui fabrique des maîtres de silicium microstructuré sur mesure à la demande. Il est important de noter que la fabrication du maître de silicium doit seulement être effectuée une fois. En effet, les maîtres de silicium microstructurées peuvent être utilisés indéfiniment pour produire des timbres élastomères.
- Mélange PDMS et l'agent de durcissement dans un rapport de 10: 1 dans un bêcher en matière plastique et homogénéiser à l'aide d'une pipette pendant 10 minutes.
- Dégazer le mélange PDMS sous vide pour éliminer les bulles d'air qui ont été formés lors de l'étape 3.1.
- Placez le maître de silicium microstructuré dans une boîte de Pétri et jeter une couche épaisse de 10 mm de mélange PDMS dégazé sur elle sans formation de bulles.
- Laisser sécher les PDMS pendant 2 heures à 60 ° C dans unfour.
- Dans un environnement exempt de poussière, peel-off de la couche de PDMS et accises 1 cm 2 microstamps avec un scalpel.
- En utilisant des pinces, le lieu PDMS microstamps motif dans une boîte de Pétri.
4. micromodelage hydroxy-paam hydrogels
- La place PDMS microstamps dans un mélange éthanol / eau (50/50) et de solution de traitement par ultrasons pendant 15 min.
- Sécher les timbres avec un courant d'écoulement d'azote et les mettre en place dans le modèle d'un nettoyeur UV / ozone (λ <200 nm) pendant 7 min.
- Sous une hotte stérile, déposer une goutte de 150 pl d'une solution de protéine souhaitée (par exemple, 100 pg / ml de laminine dans du PBS ou 25 pg / ml de fibronectine dans du PBS) sur la surface microstructurée de 1 cm 2 PDMS cachet.
- Facultatif: modifier la concentration de la solution de protéine à moduler la densité cellulaire-ligand.
- Répartir la solution de protéine à travers la surface de tampon en le déplaçant avec une pointe d'une pipette stérile de l'un vers l'angle dele timbre.
- Laisser la solution de protéine à adsorber sur le timbre de PDMS 60 min sous une hotte stérile. Éteindre les lampes pour éviter d'endommager des protéines.
- Sous une hotte stérile, transférer des lamelles recouvertes hydroxy-paam (disponibles à partir de l'étape 2.13) dans une boîte de Pétri.
- Enlever l'excès de PBS de la surface de substrats hydroxy-paam avec un flux d'azote faible dans des conditions stériles. Arrêter la procédure dès que aucune preuve de l'eau stagnante sur la surface du gel est observé. Le gel ne doit pas être complètement séchée à ce stade.
- Sécher soigneusement la surface structurée du PDMS timbre avec un flux constant de haute pureté de l'azote gazeux.
- Saisir le poinçon revêtu de protéine avec une pince de tissu de chambre et placer la surface structurée en contact avec la surface de l'hydrogel séché. Appliquer brefs points de pression avec le bout de pinces sur le dessus du timbre de PDMS pour assurer un bon contact entre microcaractéristiques de timbre et la surface de l'hydrogel.
- Laissez le timbre de PDMS sur ee surface d'hydrogel pendant 1 heure à température ambiante.
- Retirez délicatement PDMS timbres de hydrogels hydroxy-paam avec une pince de tissus d'habillage et de suivre l'étape 4.1 pour nettoyer le timbre.
- Laver abondamment les hydrogels-paam hydroxy estampillés par 3 échanges de PBS (pH = 7,4) dans des conditions stériles pendant 10 minutes par l'échange.
- Micropatterns supplémentaires optionnels: d'autres protéines de la MEC peut être ajouté à la surface hydroxy-PAAm en suivant les étapes 4.5 à 4.11.
- Des zones non-imprimées passiver avec une solution stérile de BSA à 5 mg / ml dans du PBS pendant une nuit à 4 ° C sous une agitation douce sur un plateau à bascule.
- Laver abondamment par 3 échanges de PBS (pH = 7,4) dans des conditions stériles pendant 10 minutes par l'échange. A ce stade, les hydrogels Paam-hydroxy embouties peuvent être stockés à 4 ° C jusqu'à une semaine.
5. cellulaire dépôt sur microélectrodes hydroxy-paam hydrogels
- Incuber lamelles dans les médias de la cellule pendant 30-45 min avant le placage caunes.
- Laver les cellules adhérentes en culture dans un flacon de 75 cm 2 de culture avec de la PBS stérile à 37 ° C et la détacher avec 3 ml de trypsine-EDTA ou Accutase pendant 10 min.
- Transférer la quantité désirée de milieu complet de croissance approprié préchauffé à votre lignée de cellules dans le flacon contenant les cellules détachées et centrifuger la suspension de cellules pendant 3 minutes à 650 x g.
- Retirer le surnageant avec une micropipette et remettre en suspension les cellules dans du milieu de culture complet à 15-20,000 cellules / ml.
- Ajouter 4 ml de la solution de cellules à une lamelle microélectrodes (obtenu à l'étape 5.1) et placer la lamelle couvre-objet couvert de cellules dans un incubateur de culture à 37 ° C et 5% d'humidité pendant 1-2 heures.
- Aspirer délicatement les cellules seules et remplacer le milieu de culture. Remettre les cellules fixées à l'incubateur et de les laisser entièrement répartis (3-6 heures, en fonction du type de cellule).
Résultats
La figure 1A présente la co-polymérisation de l'acrylamide (AAM) et de bisacrylamide (bis-AAM) avec du N-hydroxyethylacrylamide (HEA) des monomères contenant un groupe hydroxyle primaire formé par polymérisation radicalaire aléatoire d'un réseau hydrophile de polyacrylamide avec des groupes hydroxyle incorporés (hydroxy-PAAm) . Dans ce protocole, un poids de 65 mg de HEA doit être dilué dans un volume de 1 ml d'HEPES. Sachant que la densité de HEA est à peu près égal à un, nous supposons que nous obtenons un volume de travail de 1065 pi (HEA + HEPES). Comme présenté dans le tableau 1, l'addition totale de 1 065 ul à 400 ul de AAm et 50 ul de bisAAm conduit à un volume de 1 515 pi. Par conséquent, un volume de 3485 ul d'HEPES est nécessaire pour ajuster la solution à un volume final de 5 ml. Comme indiqué dans l'étape 2.6, la surface de la lamelle de verre de 22 mm doit être activée pendant 7 minutes dans un UV / ozone dans le but de le retirer sans causerdes dommages à la surface de l'hydrogel. En effet, la surface du verre devient plus hydrophile après le traitement UV / ozone et peut donc être facilement enlevé en immergeant l'ensemble du système dans l'eau. En outre, le traitement UV / ozone d'empêcher la contamination chimique de la lamelle couvre-objet de 22 mm, qui est en contact direct avec la surface de l'hydrogel. Cette technique permet d'obtenir une surface plane et circulaire de polyacrylamide (22 mm de diamètre) lié à une lamelle de verre (25 mm de diamètre).
Comme présenté sur la figure 1B, micropatterns de protéines peuvent être créées sur la surface d'hydrogels hydroxy-Paam par impression par microcontact. Dans ce mode opératoire expérimental, l'exposition aux UV / ozone permettent de réduire temporairement le caractère hydrophobe intrinsèque des timbres PDMS en formant des groupes silanol à la surface. En effet, la ligne de 185 nm produit de l'ozone à partir d'oxygène moléculaire pendant que la ligne de 254 nm convertit l'ozone en oxygène atomique. Cette espèce réactive attaque les ba siloxaneckbone de PDMS pour former riche couche de silice comme SiOx oxygène et des groupes de surface Si-OH. La surface du PDMS oxydé est connu de récupérer son hydrophobicité en quelques heures après l'exposition à l'air en raison de la migration de poids moléculaire des chaînes polymères non réticulés bas de la phase brute à la surface. Cette stratégie permet l'étalement de la solution de protéine sur la surface du tampon de PDMS.
L'un des principaux avantages de cette méthode consiste à moduler de façon indépendante la rigidité de la matrice (Figure 2A), la géométrie motif fin (figure 2B), la densité cellulaire-ligand (figure 2C), et la nature des protéines (figures 3A et 3B). Comme le montre la Figure 2A, les hydrogels Paam-hydroxy montrent une dépendance linéaire de modules d'élasticité à la concentration de réticulation de quelques kPa à plusieurs dizaines de kPa, ce qui permet une reproduction précise de la rigidité du microenvironnement cellulaire. Figure 2B présente des images épifluorescence de la laminine (LM) micropatterns rectangulaires déposés sur des hydrogels-Paam hydroxy de trois rigidités différentes (2,5, 15 et 40 kPa), ce qui démontre clairement le réglage indépendant de la géométrie motif fin et la rigidité de la matrice. figure 2C montre que la cellule -ligand densité peut être modulée en faisant varier la concentration de la solution de protéine utilisée pour incuber timbres PDMS. figure 3 présente une image de fluorescence de lignes de collagène estampés à travers la laminine et de la fibronectine à l'aide de lignes de microcontacts impressions successives.
Il est intéressant pour les lecteurs à noter que les différentes tailles et formes de micropatterns ont été marqués de manière efficace, quelle que soit la rigidité d'hydrogel. Nous avons reproduit avec succès microcaractéristiques de protéines avec des arêtes vives (par exemple, des triangles et des étoiles) et droit (par exemple, les lignes) ou courbes (par exemple, cercles) des formes, ce qui démontre qu'il n'y a pas major limitation de la complexité du modèle. Pour l'expérience d'une seule cellule, la zone de surface avec motif était comprise entre 400 et 2500 um 2, la valeur inférieure correspondant à la limite de la viabilité d'une cellule unique. Comme beaucoup d'autres méthodes basées sur microlettres, la principale limitation de la méthode présentée concerne sa résolution spatiale. Sur hydrogels rigides (E> 10 kPa), la résolution spatiale est de l'ordre du micromètre et principalement déterminée par la résolution de l'empreinte, tandis que sur les hydrogels "douces", la limite de résolution devient en partie déterminée par la déformation de la surface qui peut se produire au cours de la le transfert de la protéine.
La toxicité des hydrogels hydroxy-Paam a été étudiée par la quantification de la viabilité des cellules endotheliales primaires plaqué pour 1, 2, et 3 jours en culture sur revêtu de façon homogène et hydrogels mous hydroxy-Paam microprinted (figure 4A). Environ 80% des HUVEC plaqué sur hydrogels hydroxy-paam microélectrodes souples maintenusleur viabilité pendant trois jours, ce qui démontre la biocompatibilité de PAAm-hydroxy hydrogels pour la culture cellulaire. Fait intéressant, la viabilité similaire a été obtenu dans notre laboratoire avec des cellules neuronales corticales primaires. En outre, les cellules endothéliales primaires prolifèrent plus sur "raide" (500 kPa) par rapport à (25 kPa) substrats «douces» (figure 4B), ce qui indique que cette méthode fournit un microenvironnement approprié pour étudier la prolifération cellulaire dans un large éventail de rigidités .
Pour découpler l'effet de la rigidité du substrat et zone d'épandage sur la mécanotransduction, les cellules endothéliales primaires (HUVEC) ont été étalées sur micropatterns FN revêtu rectangulaires (périmètre constant de 1 200 um 2) déposée sur hydrogels-paam hydroxy de trois raideurs différentes (2,5, 8,5, et 25 kPa). Ensuite, HUVEC ont été colorées pour les filaments d'actine, vinculine et l'ADN en suivant une procédure d'immunohistochimie standard, tel qu'il est utilisé pour mamanlian cellules étalées sur des substrats de verre. Sur les substrats les plus doux, les HUVEC présentent faible densité de fibres d'actine et un noyau arrondi, tandis que sur des substrats rigides, des fibres d'actine sont plus épais et plus droit et le noyau déformé (figure 5). Les variations de la rigidité du substrat dans la zone d'étalement constante modulent la tension et la distribution des fibres de stress d'actine, ce qui se traduit dans le remodelage du noyau. Cette observation suggère un couplage mécanique entre la rigidité de la matrice, cytosquelette, et le noyau.
| Rapport de démultiplication finale AAm / bisAAm | AAm 40% (pi) | Poids de HEA se dissoudre dans 1 ml de HEPES (mg) | AAm bis (2%) (Ul) | HEPES (pi) | Le module d'Young (10 3 Pa) |
| 0,2 / 50 0,5 / 50 1/50 2/50 3/50 | 400 400 400 400 400 | 65 65 65 65 65 | 50 125 250 500 750 | 3485 3410 3285 3035 2785 | ~ 1.4 ~ 3,6 ~ 8.7 ~ 17.2 ~ 25 |
Tableau 1 Préparation de l'hydroxy-PAAm hydrogels avec diverses rigidités. Solutions de travail pour préparer les hydrogels-paam hydroxy avec une rigidité finale allant de 1,4 à 25 kPa.
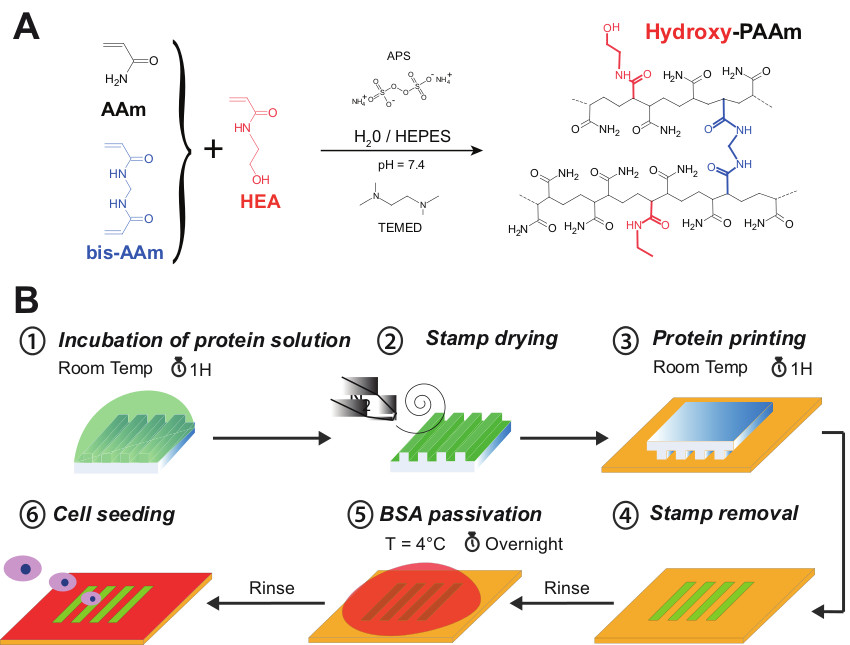
Figure 1: (A) l'acrylamide (AAM, en noir), le N, N'-méthylène-bis-(bis-AAM, en bleu) et de N-hydroxyethylacrylamide (HEA, en rouge) ont été mélangés ensemble pour former un hydroxy Hydrogels paam. (B) de Représentation schématique des différentes étapes de la procédure de micromodelage sur hydrogels hydroxy-paam. Une solution de protéine est d'abord mis en incubation pendant 1 heure sur la face de la structure d'un microstamp (étape 1). La surface de l'hydrogel est séchée doucement avec un courant d'azote (de l'étape n ° 2). Le microstamp est ensuite mis en contact formel avec la surface hydroxy-PAAm pendant 1 heure (étape 3 #). Après des lavages successifs, la surface microprinted est passive avec une solution de BSA stérile déposé O / N à 4 ° C (étape 5) pour bloquer les zones non imprimées. Enfin, l'hydroxy-PAAm surface microprinted est lavé plusieurs fois avec du PBS stérile et est prêt pour l'ensemencement des cellules (étape n ° 6). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
1010 / 51010fig2highres.jpg "width =" 500 "/>
Figure 2 (A) L'évolution de la rigidité d'hydrogels-paam hydroxy est linéairement corrélée à la quantité de bis-AAm agent de réticulation (la ligne rouge est une régression linéaire avec R 2 = 0,995). Images (B) de fluorescence de laminine rectangulaire micro-reliefs estampés sur hydrogels hydroxy-Paam de raideurs différentes (E = 2,5, 15 et 40 kPa). Les barres d'échelle correspondent à (A) de 65 pm, (B) de 80 um, et (C) de 50 um. (C) des lignes parallèles de 15 um sous forme largeur d'un gradient de LM sur un hydrogel 25 kPa hydroxy-PAAm, comme l'indique l'évolution du profil d'intensité de fluorescence. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
n "src =" / files / ftp_upload / 51010 / 51010fig3highres.jpg "width =" 500 "/>
Figure 3 images (A) par immunofluorescence de la fibronectine (en rouge) et la laminine (en vert) bandes croisées à 90 °. (B) Multilabeling de fibronectine (en rouge), la laminine (en vert) et le collagène (en bleu) rayures microprinted par la suite sur un substrat 25 kPa PAAm hydrogel. Les barres d'échelle correspondent à 30 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
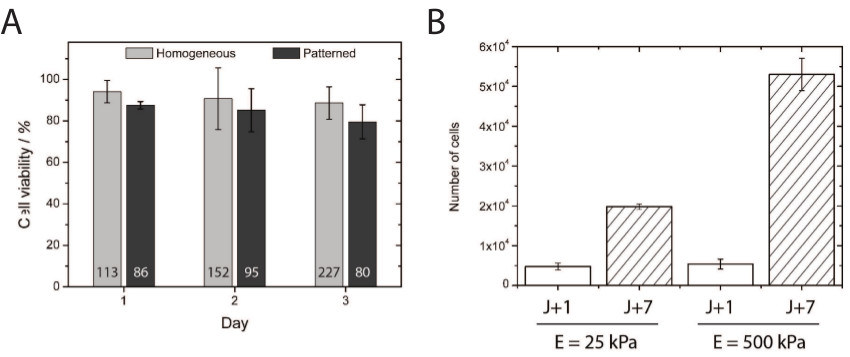
Figure 4 (A) La quantification de la viabilité cellulaire a démontré une excellente survie des cellules à 24, 48, et 72 heures après avoir été plaqué sur de façon homogène et recouvert microélectrodes surfaces hydroxy-paam. Le nombre indiqué àle fond de chaque barre correspond au nombre total de cellules comptées pour le dosage de la viabilité. (B) Quantification de HUVEC prolifération de 25 et 500 substrats kPa homogène revêtues après 1 (barres blanches) et 7 (barres hachurées) jours de culture. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5 images fluorescentes de cellules endothéliales primaires immunocolorées cultivées sur micropatterns FN enduit rectangulaire, qui ont été déposés sur des hydrogels hydroxy-paam de 2,5 kPa, 8,5 kPa et 25 kPa (de gauche à droite). Les fibres de stress d'actine (en vert ) ont été colorées avec de la phalloïdine Alexa Fluor 488, les adhésions focales (en rouge) ont été colorées avec un polyclo de sourisanticorps primaire nal et marqué avec un anticorps secondaire IgG-rouge fluorescent et l'ADN a été coloré en bleu avec du DAPI. Les barres d'échelle correspondent à 17 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Plusieurs observations in vitro dans des cellules en biologie moderne ont été réalisées sur des lamelles de verre rigide, souvent recouvertes d'une fine couche de protéines de la MEC ou des peptides synthétiques contenant la séquence RGD. Cependant, ces substrats de culture de base ne récapitulent toute la complexité physico-chimique de l'ECM et n'offrent donc pas un modèle précis pour étudier les processus de mécano-cellulaires. Pour résoudre ce problème, nous proposons une alternative simple pour fonctionnaliser des hydrogels à deux dimensions avec une quantité désirée et la nature des protéines de la MEC. Ce procédé permet un contrôle indépendant de signaux de mécano importants, tels que la rigidité de la matrice, la morphologie cellulaire et l'isolement ou la densité cellulaire-ligand. En outre, les hydrogels hydroxy-Paam surmonter l'un des principaux limitations des méthodes de fonctionnalisation de courant, ce qui est l'incapacité à immobiliser et à contrôler la distribution spatiale de plus d'une protéine d'ECM. En raison de la forte affinité de l'hydroxy-PAAm hydrogels de biomolécules, on peut contrôler la distribution spatiale des différentes protéines de la MEC sur la même surface, quel que soit la rigidité de la matrice, en utilisant microprintings séquentiels, qui ne nécessitent pas d'équipement supplémentaire.
Nous proposons un procédé selon l'invention basé sur l'incorporation de groupes hydroxyles à l'intérieur des hydrogels d'acrylamide à surmonter leurs propriétés intrinsèquement non adhésives avec des exigences minimales en coût ou expertise. En comparaison avec les techniques existantes pour la structuration des protéines sur des hydrogels, le procédé hydroxy-PAAm évite l'utilisation de produits chimiques toxiques (par exemple, l'hydrate d'hydrazine), des agents de réticulation photo-réactifs coûteux (par exemple, le sulfo-SANPAH) et la dépendance de la puissance de la lampe UV et le positionnement d' fonctionnaliser hydrogels mous. Hydrogels hydroxy-paam restent stables et actif depuis plusieurs semaines, peuvent être produites en masse, facilement microprinted et leur forte affinité pour biomolécules permet d'étudier les effets synergiques deprotéines de la MEC conjugués sur les fonctions cellulaires. En outre, les hydrogels hydroxy-Paam peuvent être utilisés pour étudier de façon quantitative la quantité des forces de contraction exercées par les cellules sur leur micro-environnement qui l'entoure. En effet, nous avons montré précédemment 1,20 que des billes fluorescentes peuvent être facilement intégrés dans les hydrogels hydroxy-paam, afin d'utiliser la microscopie à force de traction de la cellule (TFM) pour mesurer le champ de déplacement et d'estimer le champ de traction résultant exercée par des cellules eucaryotes étalées sur micropatterns bidimensionnelles.
Comme de nombreuses autres méthodes basées sur micro-impression, la limitation principale des hydrogels Paam-hydroxy concerne la résolution spatiale de microcaractéristiques de protéines. Sur hydrogels rigides (E> 10 kPa), la résolution spatiale est de l'ordre d'un micromètre et principalement déterminée par la résolution de l'empreinte, selon la technique de lithographie utilisée pour la fabrication du moule de silicium. Sur hydrogels plus doux, la résolution spatiale devient en partie déterminé par ee surface déformation pendant le transfert de la protéine, qui devient la principale limitation pour atteindre une résolution spatiale de micromètre. L'approche présentée ici est actuellement limitée à des substrats en deux dimensions. Cependant, cette méthode est très évolutive et d'autres études sont actuellement en cours dans notre laboratoire d'étendre cette méthode à des structures tridimensionnelles.
Nous espérons que les hydrogels hydroxy-paam peuvent aider à déchiffrer les mécanismes clés du processus cellulaires et tissulaires complexes qui sont intimement liés aux propriétés physico-chimiques du microenvironnement cellulaire 21,22, y compris le développement embryonnaire, des réponses inflammatoires, la cicatrisation, la croissance des neurites, tissu adulte homéostasie, et la pathogenèse de maladies telles que la fibrose et le cancer.
Déclarations de divulgation
No conflicts of interest declared.
Remerciements
This work was supported by the Belgian National Foundation for Scientific Research (F.R.S.-FNRS) through “MIS Confocal Microscopy”, “Crédit aux Chercheurs” grants and the “Nanomotility FRFC project” (no. 2.4622.11). T.G. doctoral fellowship is supported by the Foundation for Training in Industrial and Agricultural Research (FRIA). The authors gratefully acknowledge Sylvain Desprez for mechanical characterization and Géraldine Circelli for confocal imaging.
matériels
| Name | Company | Catalog Number | Comments |
| UV/Ozone Photoreactor | Ultra-Violet Products | Model PR-100 | |
| Rocking plate | IKAcWerke | Model KS 130 Basic | |
| Vortexer | Scientific Industries | Model Vortex Genie2 | |
| Vacuum degassing chamber | Applied Vacuum Engineering | DP- 8-KIT | |
| Parafilm | Sigma-Aldrich | P7793-1EA | |
| Stainless steel forceps with fine tip | Sigma-Aldrich | Z225304-1EA | |
| Dressing tissue forceps | Sigma-Aldrich | F4392-1EA | |
| Petri dishes in polystyrene | Sigma-Aldrich | P5731-500EA | |
| Aluminium foil, thickness 0.5 mm | Sigma-Aldrich | 266574-3.4G | |
| Isopore membrane filter (0,2 µm pore size) | Millipore | GTTP Filter code | |
| Round glass coverslip (22 mm diameter) | Neuvitro | GG-22 | |
| Round glass coverslip (25 mm diameter) | Neuvitro | GG-25 | |
| Variable volume micropipette | Sigma-Aldrich | Z114820 | |
| Protein microcentrifuge tubes | Sigma-Aldrich | Z666505-100EA | |
| Scalpel handles | Sigma-Aldrich | S2896-1EA | |
| Scalpel blades | Sigma-Aldrich | S2771-100EA | |
| Cell culture flasks (75 cm2) | Sigma-Aldrich | CLS430641 | |
| Ultrasonic bath tray, solid (stainless steel) | Sigma-Aldrich | Z613983-1EA | |
| Name of the Reagent | Company | Catalogue Number | Comments |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Acrylamide (powder) | Sigma-Aldrich | A3553 | |
| N,N’-Methylenebis(acrylamide) | Sigma-Aldrich | 146072 | |
| N-Hydroxyethylacrylamide | Sigma-Aldrich | 697931 | |
| N,N,N’,N’-Tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Amonium PerSulfate (APS) | Sigma-Aldrich | A3678 | |
| 3-(Trimetoxysilyl)propyle acrylate | Sigma-Aldrich | 1805 | |
| Human Plasma Fibronectin | Millipore | FC010 | |
| Laminin from EHS | Sigma-Aldrich | L2020 | |
| Sodium hydroxyde | Sigma-Aldrich | 221465-25G | |
| Double-distilled water (ddH2O) | |||
| Endothelial cell growth medium | Cells Applications | 211K-500 | |
| Human Umbilical Vein Endothelial Cells (HUVEC) | Invitrogen | C-003-5C | |
| Accutase | PAA laboratories | L11-007 | |
| HEPES buffer solution 1M in H20 | Sigma-Aldrich | 83264-500ML-F | |
| Antibiotics-antimycotics | PAA laboratories | P11-002 | |
| Phosphate Buffer Saline solution | PAA laboratories | H15-002 | |
| Alexa Fluor 488 Phaloidin | Molecular Probes | A12379 | |
| Anti-vinculin antibody produced in mouse | Sigma-Aldrich | V9131 | |
| Goat anti-mouse antibody-tetramethylrhodamine | Molecular Probes | T-2762 | |
| Anti-Fibronectin | Sigma-Aldrich | F3648 | |
| (rabbit) | |||
| Streptavidin | Sigma-Aldrich | 41469 | |
| Anti-Laminin antibody | Sigma-Aldrich | L9393 | |
| (rabbit) | |||
| Anti-rabbit IgG-FITC | Sigma-Aldrich | F7512 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924-100ML | |
| Absolute ethanol | Sigma-Aldrich | 459844-2.5L |
Références
- Grevesse, T., Versaevel, M., Circelli, G., Desprez, S., Gabriele, S. A simple route to functionalize polyacrylamide gels for the independent tuning of mechanotransduction cues. Lab Chip. 13 (5), 777-780 (2013).
- Gabriele, S., Benoliel, A. M., Bongrand, P., Théodoly, O. Microfluidic investigation reveals distinct roles for actin cytoskeleton and myosin II activity in capillary leukocyte trafficking. Biophys. J. 96 (10), 4308-4318 (2009).
- Atmanli, A., Domian, I. J. Generation of aligned functional myocardial tissue through microcontact printing. J. Vis. Exp. (73), e50288 (2013).
- Gabriele, S., Versaevel, M., Preira, P., Théodoly, O. A simple microfluidic method to select, isolate, and manipulate single-cells in mechanical and biochemical assays. Lab Chip. 10 (11), 1459-1467 (2010).
- Le Berre, M., Aubertin, J., Piel, M. Fine control of nuclear confinement identifies a threshold deformation leading to lamina rupture and induction of specific genes. Integr. Biol. 4 (11), 1406-1414 (2012).
- Rundqvist, J., et al. High fidelity functional patterns of an extracellular matrix protein by electron beam-based inactivation. J. Am. Chem. Soc. 129 (59), 59-67 (2006).
- Sorribas, H., Padeste, C., Tiefenauer, L. Photolithographic generation of proteins micropatterns for neuron culture applications. Biomaterials. 23 (3), 893-900 (2002).
- Holden, M. A., Cremer, P. S. Light activated patterning of dye-labeled molecules on surfaces. J. Am. Chem. Soc. 125 (27), 8074-8075 (2003).
- Cheng, Q., Li, S., Komvopoulos, K. Plasma-assisted surface chemical patterning for single-cell culture. Biomaterials. 30 (25), 4203-4210 (2009).
- Kumar, A., Whitesides, G. M. Features of gold having micrometer to centimeter dimensions can be formed through a combination of stamping with an elastomeric stamp and an alkanethiol "ink" followed by chemical etching. Appl. Phys. Lett. 63 (14), 2002-2004 (1993).
- Tseng, Q., et al. New micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11, 2231-2240 (2011).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS ONE. 7, e51499 (2012).
- Herrick, W. G., Nguyen, T. V., Sleiman, M., McRae, S., Emrick, T. S., Peyton, S. R. PEG-Phosphorylcholine hydrogels as tunable and versatile platforms for mechanobiology. Biomacromolecules. 14, 2294-2304 (2013).
- Versaevel, M., Grevesse, T., Riaz, M., Lantoine, J., Gabriele, S. Micropatterning hydroxy-PAAm hydrogels and sylgard 184 silicone elastomers with tunable elastic moduli. Methods in Cell Biology. 121, 33-48 (2014).
- Kandow, C. E., Georges, P. C., Janmey, P. A., Beningo, K. A. Polyacrylamide hydrogels for cell mechanics: steps towards optimization and alternative uses. Methods Cell Biol. 83, 29-46 (2007).
- Hemphill, M. A., et al. A possible role for integrin signaling in diffuse axonal injury. PLoS ONE. 6 (7), e22899 (2011).
- Damljanovic, V., Lagerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamide substrates for cell mechanotransduction assays. BioTechniques. 39 (6), 847-851 (2005).
- Hynd, M. R., Frampton, J. P., Dowell-Mesfin, N., Turner, J. N., Shain, W. Directed cell growth on protein-functionalized hydrogel surfaces. Journal of Neuroscience Methods. 162, 255-263 (2007).
- Tseng, Q., et al. new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11 (13), 2231-2240 (2011).
- Versaevel, M., Grevesse, T., Gabriele, S. Spatial coordination between cell and nuclear shape within micropatterned endothelial cells. Nat. Commun. 3, 671 (2012).
- Versaevel, M., Grevesse, T., Riaz, M., Gabriele, S. Cell Confinement: Putting the squeeze on the nucleus. Soft Matter. 9, 6665-6676 (2013).
- Trappman, B., Chen, C. S. How cells sense extracellular matrix stiffness: a material's perspective. Current Opinion in Biotechnology. 24, 1-6 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon