Method Article
Preparación de hidroxi-Paam hidrogeles para desacoplar los efectos de mecanotransducción Cues
En este artículo
Resumen
Presentamos un nuevo hidrogel de poliacrilamida, llamado hidroxi-Paam, que permite una unión directa de las proteínas ECM con costo o experiencia mínima. La combinación de hidroxi-Paam hidrogeles con impresión por microcontacto facilita el control independiente de muchas señales del microambiente celular natural para el estudio de mechanostransduction celular.
Resumen
Ahora está bien establecido que muchas funciones celulares están reguladas por interacciones de las células con señales fisicoquímicas y mecánicas de su matriz extracelular (ECM) medio ambiente. Las células eucariotas constantemente perciben su microambiente local a través mechanosensors superficie para transducir cambios físicos de la ECM en señales bioquímicas, e integrar estas señales para lograr cambios específicos en la expresión génica. Curiosamente, los parámetros físico-químicas y mecánicas de la pareja ECM puede uno con el otro para regular el destino celular. Por lo tanto, la clave para entender mecanotransducción es disociar la contribución relativa de las señales de ECM en las funciones celulares.
Aquí se presenta un protocolo experimental detallado para generar rápida y fácilmente hidrogeles biológicamente relevantes para la puesta a punto independiente de señales mechanotransduction in vitro. Nosotros, los hidrogeles de poliacrilamida modificados químicamente (PAAM) para superar sus intrínsecamente no ADHESive propiedades mediante la incorporación de monómeros de acrilamida hidroxilo funcionalizado durante la polimerización. Obtuvimos una novela Paam hidrogel, llamado hidroxi-Paam, que permite la inmovilización de cualquier naturaleza deseada de las proteínas ECM. La combinación de hidroxi-Paam hidrogeles con impresión por microcontacto permite controlar independientemente la morfología de las células individuales, la rigidez de la matriz, la naturaleza y la densidad de las proteínas ECM. Proporcionamos un método simple y rápido que se puede establecer en cada laboratorio de biología para estudiar en los procesos mechanotransduction celular in vitro. Estamos validar esta nueva plataforma de dos dimensiones mediante la realización de experimentos en células endoteliales que demuestran un acoplamiento mecánico entre la rigidez del ECM y el núcleo.
Introducción
Muchos aspectos de la microambiente celular local (por ejemplo, rigidez, tamaño de poro, la naturaleza de las proteínas, o la densidad de células ligando) proporcionan un conjunto de coordenadas de las señales reguladoras que controlan los procesos celulares, tales como la motilidad, la proliferación celular, la diferenciación y la expresión génica. Las modificaciones de las propiedades fisicoquímicas del medio ambiente extracelular pueden ser percibidos por las células y causan diferentes consecuencias fisiológicas, incluyendo la deformación de la polarización celular, la migración, y diferenciación. No queda claro, sin embargo, cómo las células se traducen modificaciones ECM en señales bioquímicas celulares. Por lo tanto, de gran importancia para diseñar controlada en microambientes in vitro que pueden reproducir las interacciones entre las células y su microambiente para el estudio de las vías de mechanotransduction es. Para abordar este problema, hemos introducido recientemente un nuevo método 1, llamado hidrogeles-Paam hidroxi, para generar fácilmente de dos moneda de diez centavosmatrices nsional suaves que permiten controlar de forma independiente importantes señales mechanotransduction: matriz de rigidez, geometría celular y de confinamiento, la naturaleza de la proteína y la densidad de células ligando.
ECM dirige los procesos celulares a través de gradientes en morfógenos (quimiotaxis), proteínas adhesivas (Haptotaxis) y rigidez (durotaxis). En los últimos decenios, avanzada en plataformas in vitro han sido desarrollados para aislar estas señales extracelulares con el fin de desentrañar cómo las células son capaces de traducir las características bioquímicas y biofísicas en los procesos fisiológicos 2-5. Se han desarrollado por haz de electrones 6, 7 fotolitografía, la inmovilización fotoquímica 8, o técnicas de plasma asistida 9 para dirigir el crecimiento de las células vivas sobre sustratos micropatterned. Aunque estas técnicas han dado resultados importantes, la mayoría de ellos no permiten la discriminación entre la influencia individual de diferentes señales en el comportamiento celulary requieren instalaciones técnicas que pocos laboratorios pueden permitirse. Entre estas técnicas, la impresión por microcontacto (μCP), ha surgido como un método robusto y accesible para crear micro-islas de células adhesivo 10. Más recientemente, grandes esfuerzos 11-14 se han hecho para desarrollar μCP en hidrogeles con rigideces sintonizables con el fin de reproducir la amplia gama de rigideces observadas en los tejidos vivos. Entre estas obras, la poliacrilamida (PAAM) se ha hecho popular el 15 y ya es una de las matrices a base de polímeros más utilizados para los ensayos de biomecánica celulares.
Superficies Paam son comúnmente funcionalizado con el agente de reticulación heterobifuncional sulfosuccinimidil proteínas-N-6-[4 '-azido-2'-nitrophenylamido] (sulfo-SANPAH) y ECM están unidos a la superficie por la activación de UV de la sulfo-nitrofenil SANPAH grupos azida 16. Otra técnica consiste en hidrazina de acoplamiento a las proteínas que han sido severamente oxidadascon peryodato 17. Hynd y colaboradores introdujeron una técnica para modelando superficies de hidrogel biomiméticos con proteínas y péptidos que requiere fotopolimerización en presencia de un monómero de acriloílo estreptavidina 18. Más recientemente, Tseng et al. Han informado de un nuevo método micropatterning 19 basado en la exposición UV profunda de PAAM a través de una máscara de cuarzo óptico que requiere incubar PA geles activados con 1-etil-3-[3-dimetilaminopropil] carbodiimida (EDC) y N-hidroxisuccinimida (NHS) soluciones de agua antes de añadir la proteína. A pesar de la capacidad de estas técnicas para crear homogéneos y reproducibles micropatrones proteínas, la mayoría de ellos sufren limitaciones importantes: los procesos de síntesis larga (por ejemplo, diálisis, liofilización, etc), compuestos químicos caros (por ejemplo, ácido hialurónico, sulfo-SANPAH) de profundidad o UV irradiación. Además, estas técnicas no permiten la modulación independiente de la rigidez del sustrato, micropatróngeometría, ECM proteína naturaleza, y la densidad de células ligando.
Teniendo en cuenta estas limitaciones, hemos desarrollado un enfoque basado en acrilamida novedoso y simple que permite la inmovilización de una variedad de proteínas y biomoléculas en hidrogeles blandos y permite la sintonización independiente de señales mechanotransduction el fin de descifrar su papel en las funciones celulares. En lugar de tratar hidrogeles Paam con compuestos químicos agresivos, se introduce un monómero de acrilamida comercial con grupos hidroxilo durante la polimerización Paam. Esta sencilla operación supera la propiedad anti-adhesivo intrínseca de hidrogeles Paam sin otros requisitos técnicos.
La presencia de grupos hidroxilo conduce a una alta afinidad de los hidrogeles-hidroxi Paam para las proteínas y biomoléculas que forman interacciones de enlaces de hidrógeno. En combinación con μCP, hidrogeles-hidroxi Paam permiten una rápida generación de plataforma de la cultura de dos dimensiones con un control independienteen la rigidez de la matriz, el tipo de proteínas ECM, la densidad de células ligando y adhesividad confinado, que se imaginó ser una plataforma poderosa para el estudio mecanotransducción.
El objetivo de este protocolo es proporcionar la información necesaria para hacer fácilmente hidrogeles Paam hidroxi sin ninguna experiencia en la ciencia de materiales. El objetivo final es proporcionar un medio para que los investigadores hacen preguntas fisiológicamente relevantes a nivel celular y de tejidos que pueden conducir a una mejor comprensión de las vías mechanotransduction involucradas en mecanismos fisiopatológicos.
Protocolo
1. activar la superficie del cubreobjetos de vidrio
- Lugar cubreobjetos de vidrio circulares (25 mm de diámetro) en una placa de Petri y frotis solución 0,1 M de NaOH en él durante 5 min (campana química recomendada).
- Eliminar la solución de NaOH y sumergirse plenamente cubreobjetos con ddH 2 O estéril durante 20 minutos mientras se balancea suavemente sobre una placa oscilante en una campana de cultivo estéril.
- Escurrir estéril ddH2O y repita el paso 1.2.
- Quitar los cubreobjetos con unas pinzas estériles y colocarlos en una nueva placa de Petri con la cara activado para arriba.
- Cubreobjetos seco bajo un flujo constante de gas nitrógeno de alta pureza.
- En una campana de cultivo estéril, frotis de una capa fina de acrilato de 3 (trimetoxisilil) propil (92%) en el lado activada del cubreobjetos durante 1 h.
- Lavar extensivamente cubreobjetos de vidrio con 3 lavados de ddH 2 O estéril y sumergirlos en ddH 2 O estéril en una nueva placa de Petri.
- Toque en la placa de Petricon Parafilm y colocarlo en una placa del balancín con agitación suave durante 10 minutos.
- Quitar los cubreobjetos de ddH2O con pinzas estériles con puntas finas y colocarlas en una nueva placa de Petri con la cara activado para arriba.
- Almacenar a temperatura ambiente en un lugar seco con papel de aluminio para evitar que el polvo se pegue a los cubreobjetos.
2 Preparación de hidrogeles hidroxi-Paam
- Preparar un peso de 65 mg de acrilamida N-hidroxietilo (HEA) en un tubo Eppendorf de 1,5 ml. Es importante para preparar una solución HEA fresco.
- Añadir 1 ml de 50 mM de tampón HEPES a HEA y mezclar usando un agitador de vórtice hasta la disolución completa de la HEA.
- Añadir 400 l de 40% w / w en HEPES solución de acrilamida y el volumen requerido de 2% w / w en HEPES solución de bis-acrilamida (véase la Tabla 1) para llegar a la rigidez de hidrogel deseada. Ajuste con HEPES 50 mM a un volumen final de 5 ml.
- Mezclar la solución con un vórtice y desgasificar iten una cámara de vacío durante 20 min con el fin de reducir la concentración de oxígeno dentro de la solución, lo que impide la polimerización hidroxi-PAAM.
- Bajo una campana estéril, filtrar la solución desgasificada con un filtro de tamaño de poro 0,2 micras con el fin de esterilizarlo.
- Activar cubreobjetos de vidrio circulares (22 mm de diámetro) en un limpiador UV / ozono durante 7 min.
- Preparar 100 l de solución de persulfato de amonio al 10% (APS), es decir 10 mg de APS en 100 l ddH 2 O. Es importante preparar una solución de APS fresco.
- Añadir 2,5 l de tetrametilendiamina (TEMED) y 25 l de solución de APS a la solución esterilizada hidroxi-Paam (paso 2.5) para iniciar la polimerización. Mezclar la solución por 3 pipeteados sucesivos sin la introducción de burbujas, en condiciones estériles.
- Bajo una campana estéril, coloque una gota de 25 l de la solución de hidroxi-Paam sobre un cubreobjetos de 25 mm (disponible desde el paso 1.9) e inmediatamente colocar un gl 22 mmcubreobjetos culo (preparado en el paso 2.5) en la parte superior de la gotita para exprimir la solución hidroxi-PAAM. Centre el cubreobjetos de vidrio de 22 mm con pinzas estériles y suavizar las burbujas.
- Permitir hidrogeles-hidroxi Paam para polimerizar a temperatura ambiente durante 15 min. Invertir manualmente la solución hidroxi-Paam restante en el tubo de Eppendorf a seguir la finalización del proceso de polimerización.
- Sumerja totalmente con cubreobjetos estéril ddH 2 O y separar cuidadosamente los cubreobjetos de 22 mm de vidrio mediante la introducción del borde de una hoja de afeitar entre los 22 mm cubreobjetos de vidrio y la capa de hidrogel hidroxi-PAAM.
- Lave hidrogeles Paam hidroxi con PBS estéril (3 intercambios de PBS) y dejar que los geles totalmente inmersos en PBS estéril para mantener la hidratación.
- Guarde hidrogeles Paam hidroxi en PBS estéril a 4 ° C hasta por 3 días.
3. polidimetilsiloxano (PDMS) Microstamp Fabrication
NOTA: La fabricación de un maestro de silicio se requiere antes de stata los PDMS fabricación microstamp. Esta microfabricación de un maestro de silicio se puede hacer mediante técnicas litográficas, lo que requiere equipo especializado y la formación. Se anima Colaboraciones con una instalación de nanofabricación para fabricar el maestro de silicio. Como alternativa, póngase en contacto con una empresa que fabrica maestros silicio microestructurada a medida bajo demanda. Es importante señalar que la fabricación del maestro de silicio sólo necesita hacerse una vez. De hecho, los maestros de silicio microestructuradas pueden utilizarse indefinidamente para producir sellos elastoméricos.
- Mezcla de PDMS y el agente de curado en una proporción de 10: 1 en un vaso de precipitados de plástico y mezclar bien con una pipeta durante 10 min.
- Desgasificar la mezcla de PDMS al vacío para eliminar las burbujas de aire que se formaron durante la etapa 3.1.
- Coloque el maestro de silicio microestructurada en una placa de Petri y emitir una capa gruesa de 10 mm de mezcla desgasificada PDMS en él sin que se formen burbujas.
- Dejar curar el PDMS durante 2 horas a 60 ° C en unhorno.
- En un entorno libre de polvo, de despegar de la capa de PDMS y los impuestos especiales 1 cm 2 microstamps con un bisturí.
- El uso de pinzas, lugar PDMS microstamps patrón-en una placa de Petri.
4. micropatterning hidroxi-Paam hidrogeles
- Coloque PDMS microstamps en una mezcla de etanol / agua (50/50) solución y se somete a ultrasonidos durante 15 min.
- Secar los sellos con una corriente de flujo de nitrógeno y colocarlos patrón-en un limpiador UV / Ozono (λ <200 nm) durante 7 min.
- Bajo una campana estéril, colocar una gota de 150 l de una solución de proteína deseada (por ejemplo, 100 mg / ml de laminina en PBS o 25 mg / ml de fibronectina en PBS) sobre la superficie microestructurada de un 1 cm-2 PDMS sello.
- Opcional: Modificar la concentración de la solución de proteína para modular la densidad de células ligando.
- Corre la solución de proteína a través de la superficie del sello moviéndolo con una punta estéril de una pipeta de una hacia la esquina deel sello.
- Deje la solución de proteína para adsorber en el sello PDMS durante 60 minutos bajo una campana estéril. Apague las lámparas para evitar daño a las proteínas.
- Bajo una campana estéril, transferir hidroxi-Paam cubreobjetos recubiertos (disponibles desde el paso 2,13) en una placa de Petri.
- Eliminar el exceso de PBS de la superficie de sustratos hidroxi-Paam con una corriente de nitrógeno bajo en condiciones estériles. Detener el procedimiento tan pronto como se observó ninguna evidencia de agua estancada en la superficie del gel. El gel no debe ser secado a fondo en esta etapa.
- Seca cuidadosamente la superficie estructurada de los PDMS sello con un flujo constante de gas nitrógeno de alta pureza.
- Sujete el sello recubierto de proteína con pinzas de tejidos vestidores y coloque la superficie estructurada en contacto con la superficie del hidrogel seco. Aplicar puntos de presión breves con la punta de las pinzas en la parte superior del sello PDMS para asegurar un buen contacto entre microfeatures sello y de la superficie del hidrogel.
- Deje el sello PDMS en el thsuperficie del hidrogel e durante 1 hora a RT.
- Retire con cuidado PDMS sellos de hidrogeles hidroxi-Paam con pinzas de tejidos vestidores y seguir el paso 4.1 para limpiar el sello.
- Lavar ampliamente los hidrogeles-hidroxi Paam sellados por 3 intercambios de PBS (pH = 7,4) en condiciones estériles durante 10 min por intercambio.
- Opcionales: micropatrones adicionales de otras proteínas ECM se pueden añadir a la superficie hidroxi-Paam siguiendo los pasos 4.5 a 4.11.
- Zonas no impresas pasivar con una solución estéril de BSA a 5 mg / ml en PBS durante una noche a 4 ° C bajo una agitación suave en un plato oscilante.
- Lavar ampliamente por 3 intercambios de PBS (pH = 7,4) en condiciones estériles durante 10 min por intercambio. En esta etapa, los hidrogeles-hidroxi Paam estampadas se pueden almacenar a 4 ° C durante hasta una semana.
5. deposición de células en micropatterned hidroxi-Paam hidrogeles
- Incubar cubreobjetos en medio celular durante 30-45 minutos antes de chapado cells.
- Lavar las células adherentes cultivadas en un 75 cm 2 frasco de cultivo con PBS estéril a 37 ° C y separarlo con 3 ml de tripsina-EDTA o accutase de 10 min.
- Transferir la cantidad deseada de pre-calentado completa medio de crecimiento apropiado para su línea de células en el matraz que contiene las células desprendidas y centrifugar la suspensión celular durante 3 minutos a 650 x g.
- Eliminar el sobrenadante con una micropipeta y resuspender las células en medio de cultivo completo en 15-20.000 células / ml.
- Añadir 4 ml de la solución de células a un cubreobjetos microestructurada (obtenido del Paso 5.1) y colocar el cubreobjetos de células-cubierto en un incubador de cultivo a 37 ° C y 5% de humedad durante 1-2 horas.
- Aspirar suavemente las células no unidas y reemplazar el medio de cultivo. Devolver las células unidas a la incubadora y dejar que se extienden completamente (3-6 horas, dependiendo del tipo de célula).
Resultados
La Figura 1A presenta la co-polimerización de acrilamida (AAM) y bisacrilamida (bis-AAM) con N-hydroxyethylacrylamide (HEA) monómeros que contienen un hidroxilo primario formado por polimerización radicalar al azar una red hidrofílica de poliacrilamida con grupos hidroxilo incorporados (hidroxi-PAAM) . En este protocolo, un peso 65 mg de HEA se debe diluir en un volumen de 1 ml de HEPES. Sabiendo que la densidad de la HEA es aproximadamente igual a uno, se supone que se obtiene un volumen de trabajo de 1.065 l (HEA + HEPES). Tal como se presenta en la Tabla 1, la adición total de 1065 l a 400 l de AAM y 50 l de bisAAm conduce a un volumen de 1515 l. Por lo tanto se necesita un volumen de 3485 l de HEPES para ajustar la solución a un volumen final de 5 ml. Como se indica en la etapa 2.6, la superficie del cubreobjetos de vidrio de 22 mm se debe activar durante 7 min en un UV / ozono a fin de eliminar sin causarcualquier daño a la superficie del hidrogel. De hecho, la superficie de vidrio se vuelve más hidrófilo después de la UV / tratamiento con ozono y por lo tanto se puede quitar fácilmente mediante la inmersión de todo el sistema en el agua. Además, el tratamiento UV / ozono evita la contaminación química de la cubreobjetos de 22 mm, que está en contacto directo con la superficie del hidrogel. Esta técnica permite obtener una superficie plana circular de poliacrilamida (22 mm de diámetro) unido a un cubreobjetos de vidrio (25 mm de diámetro).
Tal como se presenta en la Figura 1B, micropatrones de proteínas se pueden crear en la superficie de los hidrogeles hidroxi-Paam por impresión por microcontacto. En este procedimiento experimental, la exposición UV / ozono permiten reducir temporalmente la hidrofobicidad intrínseca de los sellos PDMS mediante la formación de grupos silanol en la superficie. De hecho, la línea de 185 nm produce ozono a partir del oxígeno molecular, mientras que la línea de 254 nm convierte el ozono a oxígeno atómico. Esta especie reactiva ataca a los ba siloxanockbone de PDMS para formar capa rica en sílice como SiOx oxígeno y grupos superficiales Si-OH. La superficie de PDMS oxidado se conoce para recuperar su hidrofobicidad en sólo unas horas después de la exposición al aire debido a la migración de bajo peso molecular sin reticular cadenas poliméricas de la fase en masa a la superficie. Esta estrategia ayuda a la difusión de la solución de proteína en la superficie del sello PDMS.
Una de las ventajas clave de este método es para modular de forma independiente la rigidez de la matriz (Figura 2A), la geometría micropatrón (Figura 2B), la densidad de células ligando (Figura 2C), y la naturaleza de proteína (Figuras 3A y 3B). Como se muestra en la Figura 2A, los hidrogeles-hidroxi Paam muestran una dependencia lineal de módulos elásticos sobre la concentración de reticulante de pocos kPa a varias docenas kPa, permitiendo fina reproducción de la rigidez del microambiente celular. Figura 2B presenta imágenes epifluorescentes de laminina (LM) micropatrones rectangulares depositadas sobre hidrogeles-Paam hidroxi de tres rigideces diferentes (2,5, 15, y 40 kPa), lo que demuestra claramente la sintonización independiente de la geometría micropatrón y la rigidez de la matriz. Figura 2C muestra que la célula -ligand densidad puede modularse mediante la variación de la concentración de la solución de proteína usado para incubar sellos PDMS. Figura 3 presenta una imagen de fluorescencia de las líneas estampadas de colágeno a través de líneas de laminina y la fibronectina mediante el uso de impresiones por microcontacto secuenciales.
Es interesante para los lectores a que tomen nota de que varios tamaños y formas de micropatrones han sellado de manera eficiente, sin tener en cuenta la rigidez de hidrogel. Hemos reproducido con éxito microfeatures de proteínas con bordes afilados (por ejemplo, triángulos y estrellas) y recto (por ejemplo, líneas), o curvas (por ejemplo, círculos) formas, lo que demuestra que no hay major limitación a la complejidad patrón. Para solo experimento celular, el área de superficie micropatrón fue entre 400 y 2.500 m 2, el menor valor correspondiente al límite de la viabilidad de células individuales. Como muchos otros métodos basados en la microimpresión, la principal limitación del método presentado se refiere a su resolución espacial. En hidrogeles tiesos (E> 10 kPa), la resolución espacial es de alrededor de un micrómetro y principalmente determinado por la resolución del sello, mientras que en los hidrogeles "blandos", el límite de la resolución se convierte en parte determinada por la deformación de la superficie que pueda ocurrir durante la la transferencia de la proteína.
La toxicidad de los hidrogeles hidroxi-Paam se investigó mediante la cuantificación de la viabilidad de células endoteliales primarias niquelado para 1, 2, y 3 días en cultivo en homogéneamente recubierto y hidrogeles hidroxi-Paam suaves microimpresas (Figura 4A). Alrededor del 80% de las HUVEC en placas sobre micropatterned hidrogeles hidroxi-Paam suaves mantenidossu viabilidad durante tres días, demostrando la biocompatibilidad de hidroxi-Paam hidrogeles para cultivo celular. Curiosamente, la viabilidad similar se obtuvo en nuestro laboratorio con células de neuronas corticales primarias. Además, las células endoteliales primarias proliferan más en "rígido" (500 kPa) en comparación con (25 kPa) sustratos "blandos" (Figura 4B), lo que indica que este método proporciona un microambiente apropiado para el estudio de la proliferación celular a través de una amplia gama de rigideces .
Para desacoplar el efecto de la rigidez del sustrato y el área de extensión mechanotransduction, células endoteliales primarias (HUVEC) se sembraron en micropatrones FN recubiertos rectangulares (área constante de 1,200 m 2) depositado sobre hidrogeles-Paam hidroxi de tres rigideces diferentes (2,5, 8,5, y 25 kPa). Entonces, HUVECs se tiñeron para los filamentos de actina, vinculina y el ADN siguiendo un procedimiento estándar de inmunocitoquímica, como se usa para mamálian células sembradas en placas sobre sustratos de vidrio. En los sustratos más suaves, HUVECs exhiben baja densidad de fibras de actina y un núcleo redondeado, mientras que en sustratos rígidos, fibras de actina son más rectos y más grueso y el núcleo deformado (Figura 5). Cambios en la rigidez del sustrato en área de extensión constante modulan la tensión y la distribución de las fibras de estrés de actina, lo que resulta en la remodelación del núcleo. Esta observación sugiere un acoplamiento mecánico entre la rigidez de la matriz, citoesqueleto, y el núcleo.
| Relación final AAm / bisAAm | AAm 40% (l) | Peso de HEA para disolver en 1 ml de HEPES (mg) | AAm bis (2%) (L) | HEPES (l) | Módulo de Young (10 3 Pa) |
| 0,2 / 50 0,5 / 50 1/50 2/50 3/50 | 400 400 400 400 400 | 65 65 65 65 65 | 50 125 250 500 750 | 3485 3410 3285 3035 2785 | 1,4 ~ ~ 3.6 ~ 8.7 ~ 17.2 ~ 25 |
Tabla 1 Preparación de hidroxi-Paam hidrogeles con diversas rigideces. Soluciones de trabajo para preparar hidrogeles Paam hidroxi con rigidez definitiva que van desde 1,4 hasta 25 kPa.
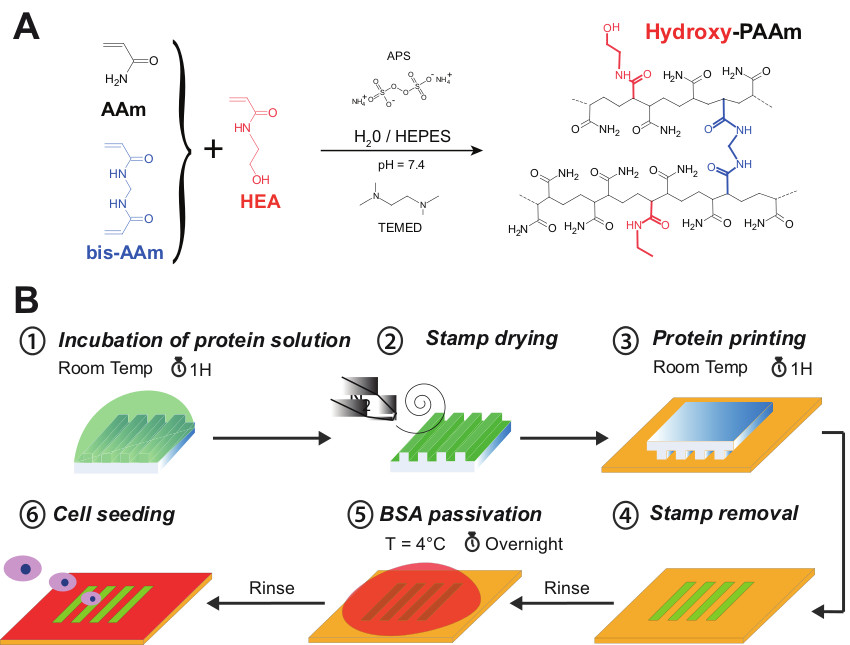
Figura 1. (A) acrilamida (AAm, en negro), N, N'-metilenbisacrilamida (bis-AAM, en azul) y N-hydroxyethylacrylamide (HEA, en rojo) se mezclaron juntos para formar hidroxi Hidrogeles PAAM. (B) Representación esquemática de los diferentes pasos del procedimiento micropatterning en hidrogeles hidroxi-PAAM. Una solución de proteína se incubó primero durante 1 hr en la cara estructura de un microstamp (paso # 1). La superficie del hidrogel se seca suavemente con un flujo de nitrógeno (paso # 2). El microstamp se coloca entonces en contacto formal con la superficie hidroxi-Paam durante 1 hora (paso 3). Después de sucesivos lavados, la superficie microimpreso se pasiva con una solución de BSA estéril depositado O / N a 4 ° C (paso # 5) para bloquear las áreas no impresas. Por último, la superficie hidroxi-Paam microimpreso se lava varias veces con PBS estéril y está listo para la siembra de células (paso # 6). Haga clic aquí para ver una versión más grande de esta figura.
1010 / 51010fig2highres.jpg "width =" 500 "/>
Figura 2. (A) La evolución de la rigidez de hidrogeles-hidroxi Paam se correlaciona linealmente con la cantidad de bis-AAM reticulante (la línea roja es una regresión lineal con R 2 = 0,995). Imágenes (B) de fluorescencia laminina rectangular micro-características estampadas en hidrogeles hidroxi-Paam de diferentes rigideces (e = 2,5, 15, y 40 kPa). Las barras de escala corresponden a (A) 65 m, (B) 80 m, y (C) 50 m. (C) Las líneas paralelas de 15 micras de ancho forma un gradiente LM en un hidrogel de 25 kPa hidroxi-Paam, como se indica por la evolución del perfil de intensidad de fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
n "src =" / files / ftp_upload / 51010 / 51010fig3highres.jpg "width =" 500 "/>
Figura 3. imagen (A) La inmunofluorescencia de fibronectina (en rojo) y laminina (en verde) rayas cruzadas en 90 °. (B) Multilabeling de fibronectina (en rojo), laminina (en verde) y colágeno (en azul) rayas microimpreso posteriormente sobre un sustrato 25 kPa hidrogel Paam. Las barras de escala corresponden a 30 micras. Haga clic aquí para ver una versión más grande de esta figura.
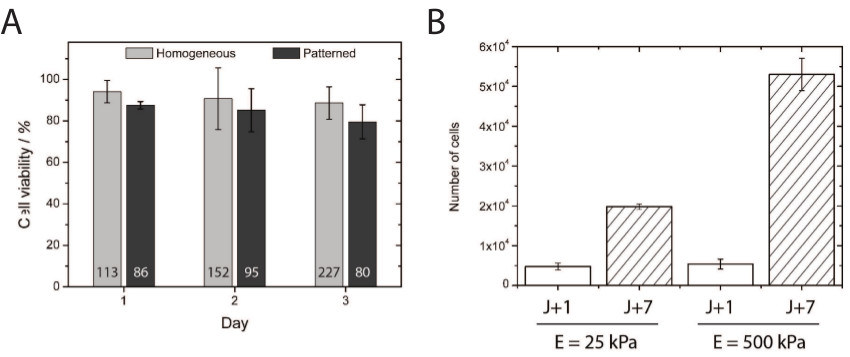
Figura 4. (A) La cuantificación de la viabilidad celular demostró una excelente supervivencia de las células a las 24, 48, y 72 horas después de haber sido chapada en-recubierto homogéneamente y micropatterned superficies hidroxi-PAAM. El número indica enla parte inferior de cada barra corresponde al número total de células contadas para el ensayo de viabilidad. (B) Cuantificación de la proliferación de HUVEC en 25 y 500 kPa sustratos revestidos homogéneamente-después de 1 (barras blancas) y 7 (barras hash) días de cultivo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. imágenes fluorescentes de células endoteliales primarias immunostained cultivadas en micropatrones FN recubiertos rectangulares, que se depositaron sobre hidrogeles hidroxi-Paam de 2,5 kPa, 8,5 kPa y 25 kPa (de izquierda a derecha). Las fibras de estrés de actina (en verde ) se tiñeron con Alexa Fluor 488 phalloidin, adhesiones focales (en rojo) se tiñeron con un polyclo ratónnal anticuerpo primario y marcado con un anticuerpo secundario IgG-rojo fluorescente y el ADN se tiñeron en azul con DAPI. Las barras de escala corresponden a 17 micras. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Muchos en observaciones in vitro de la biología celular moderna se han realizado en cubreobjetos de vidrio rígidas, a menudo recubiertos con una fina capa de proteínas ECM o péptidos sintéticos que contienen la secuencia RGD. Sin embargo, dichos sustratos de cultivo básicas no recapitulan toda la complejidad fisicoquímica del ECM y por lo tanto no proporcionan un modelo preciso para estudiar procesos celulares mechanotransduction. Para hacer frente a este problema, proponemos una alternativa simple para funcionalizar hidrogeles bidimensionales con cualquier cantidad y la naturaleza de las proteínas ECM deseada. Este método permite el control independiente de las señales mechanotransduction importantes, tales como la rigidez de la matriz, la morfología celular y el confinamiento o la densidad celular-ligando. Además, los hidrogeles hidroxi-Paam superar una de las mayores limitaciones de los métodos de funcionalización actual, que es la incapacidad para inmovilizar y para controlar la distribución espacial de más de una proteína del ECM. Debido a la alta afinidad de hidroxy-Paam hidrogeles para biomoléculas, se puede controlar la distribución espacial de varias proteínas de la MEC en la misma superficie, sin tener en cuenta la rigidez de la matriz, mediante el uso de microprintings secuenciales, que no requiere ningún equipo adicional.
Se propone un nuevo procedimiento basado en la incorporación de grupos hidroxilo dentro de los hidrogeles de acrilamida para superar sus propiedades intrínsecamente no adhesivas con requisitos mínimos en el costo o la experiencia. En comparación con las técnicas existentes para modelando las proteínas en hidrogeles, el método hidroxi-Paam evita el uso de productos químicos agresivos tóxicos (por ejemplo, hidrato de hidrazina), reticulantes fotorreactivos caros (por ejemplo, sulfo-SANPAH) y la dependencia de la potencia de la lámpara UV y el posicionamiento a funcionalizar hidrogeles blandos. Hidrogeles hidroxi-Paam permanecen estables y activas durante varias semanas, se pueden producir en masa, fácilmente microimpresas y su alta afinidad por las biomoléculas permite investigar los efectos sinérgicos deproteínas ECM conjugados en las funciones celulares. Además, los hidrogeles hidroxi-Paam se pueden utilizar para investigar cuantitativamente la cantidad de las fuerzas ejercidas por las células contráctiles en su microambiente circundante. De hecho, ya hemos demostrado que 1,20 perlas fluorescentes pueden ser fácilmente incorporados en los hidrogeles hidroxi-Paam, con el fin de utilizar la microscopía de fuerza de tracción celular (TFM) para medir el campo de desplazamientos y estimar el campo de tracción resultante ejercida por las células eucariotas chapada en micropatrones de dos dimensiones.
Como muchos otros métodos basados en la microimpresión, la principal limitación de hidrogeles-Paam hidroxi se refiere a la resolución espacial de microfeatures de proteínas. En hidrogeles rígidos (E> 10 kPa), la resolución espacial es de alrededor de un micrómetro y determinada principalmente por la resolución del sello, dependiendo de la técnica de litografía usado para fabricar el molde de silicio. En hidrogeles más suaves, la resolución espacial se convierte en parte determinada por ªdeformación de la superficie e durante la transferencia de la proteína, que se convierte en la principal limitación para llegar a una resolución espacial micrométrica. El enfoque que aquí se presenta se limita actualmente a los sustratos bidimensionales. Sin embargo este método es altamente escalable y más estudios están actualmente en curso en nuestro laboratorio para extender este método a estructuras tridimensionales.
Esperamos que los hidrogeles hidroxi-Paam pueden ayudar a descifrar los mecanismos clave de complejos procesos celulares y tisulares que están íntimamente relacionadas con las propiedades fisicoquímicas del microambiente celular 21,22, incluyendo el desarrollo embrionario, la respuesta inflamatoria, la cicatrización de heridas, el crecimiento de neuritas, tejido adulto homeostasis, y la patogénesis de enfermedades tales como la fibrosis y el cáncer.
Divulgaciones
No conflicts of interest declared.
Agradecimientos
This work was supported by the Belgian National Foundation for Scientific Research (F.R.S.-FNRS) through “MIS Confocal Microscopy”, “Crédit aux Chercheurs” grants and the “Nanomotility FRFC project” (no. 2.4622.11). T.G. doctoral fellowship is supported by the Foundation for Training in Industrial and Agricultural Research (FRIA). The authors gratefully acknowledge Sylvain Desprez for mechanical characterization and Géraldine Circelli for confocal imaging.
Materiales
| Name | Company | Catalog Number | Comments |
| UV/Ozone Photoreactor | Ultra-Violet Products | Model PR-100 | |
| Rocking plate | IKAcWerke | Model KS 130 Basic | |
| Vortexer | Scientific Industries | Model Vortex Genie2 | |
| Vacuum degassing chamber | Applied Vacuum Engineering | DP- 8-KIT | |
| Parafilm | Sigma-Aldrich | P7793-1EA | |
| Stainless steel forceps with fine tip | Sigma-Aldrich | Z225304-1EA | |
| Dressing tissue forceps | Sigma-Aldrich | F4392-1EA | |
| Petri dishes in polystyrene | Sigma-Aldrich | P5731-500EA | |
| Aluminium foil, thickness 0.5 mm | Sigma-Aldrich | 266574-3.4G | |
| Isopore membrane filter (0,2 µm pore size) | Millipore | GTTP Filter code | |
| Round glass coverslip (22 mm diameter) | Neuvitro | GG-22 | |
| Round glass coverslip (25 mm diameter) | Neuvitro | GG-25 | |
| Variable volume micropipette | Sigma-Aldrich | Z114820 | |
| Protein microcentrifuge tubes | Sigma-Aldrich | Z666505-100EA | |
| Scalpel handles | Sigma-Aldrich | S2896-1EA | |
| Scalpel blades | Sigma-Aldrich | S2771-100EA | |
| Cell culture flasks (75 cm2) | Sigma-Aldrich | CLS430641 | |
| Ultrasonic bath tray, solid (stainless steel) | Sigma-Aldrich | Z613983-1EA | |
| Name of the Reagent | Company | Catalogue Number | Comments |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Acrylamide (powder) | Sigma-Aldrich | A3553 | |
| N,N’-Methylenebis(acrylamide) | Sigma-Aldrich | 146072 | |
| N-Hydroxyethylacrylamide | Sigma-Aldrich | 697931 | |
| N,N,N’,N’-Tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Amonium PerSulfate (APS) | Sigma-Aldrich | A3678 | |
| 3-(Trimetoxysilyl)propyle acrylate | Sigma-Aldrich | 1805 | |
| Human Plasma Fibronectin | Millipore | FC010 | |
| Laminin from EHS | Sigma-Aldrich | L2020 | |
| Sodium hydroxyde | Sigma-Aldrich | 221465-25G | |
| Double-distilled water (ddH2O) | |||
| Endothelial cell growth medium | Cells Applications | 211K-500 | |
| Human Umbilical Vein Endothelial Cells (HUVEC) | Invitrogen | C-003-5C | |
| Accutase | PAA laboratories | L11-007 | |
| HEPES buffer solution 1M in H20 | Sigma-Aldrich | 83264-500ML-F | |
| Antibiotics-antimycotics | PAA laboratories | P11-002 | |
| Phosphate Buffer Saline solution | PAA laboratories | H15-002 | |
| Alexa Fluor 488 Phaloidin | Molecular Probes | A12379 | |
| Anti-vinculin antibody produced in mouse | Sigma-Aldrich | V9131 | |
| Goat anti-mouse antibody-tetramethylrhodamine | Molecular Probes | T-2762 | |
| Anti-Fibronectin | Sigma-Aldrich | F3648 | |
| (rabbit) | |||
| Streptavidin | Sigma-Aldrich | 41469 | |
| Anti-Laminin antibody | Sigma-Aldrich | L9393 | |
| (rabbit) | |||
| Anti-rabbit IgG-FITC | Sigma-Aldrich | F7512 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924-100ML | |
| Absolute ethanol | Sigma-Aldrich | 459844-2.5L |
Referencias
- Grevesse, T., Versaevel, M., Circelli, G., Desprez, S., Gabriele, S. A simple route to functionalize polyacrylamide gels for the independent tuning of mechanotransduction cues. Lab Chip. 13 (5), 777-780 (2013).
- Gabriele, S., Benoliel, A. M., Bongrand, P., Théodoly, O. Microfluidic investigation reveals distinct roles for actin cytoskeleton and myosin II activity in capillary leukocyte trafficking. Biophys. J. 96 (10), 4308-4318 (2009).
- Atmanli, A., Domian, I. J. Generation of aligned functional myocardial tissue through microcontact printing. J. Vis. Exp. (73), e50288 (2013).
- Gabriele, S., Versaevel, M., Preira, P., Théodoly, O. A simple microfluidic method to select, isolate, and manipulate single-cells in mechanical and biochemical assays. Lab Chip. 10 (11), 1459-1467 (2010).
- Le Berre, M., Aubertin, J., Piel, M. Fine control of nuclear confinement identifies a threshold deformation leading to lamina rupture and induction of specific genes. Integr. Biol. 4 (11), 1406-1414 (2012).
- Rundqvist, J., et al. High fidelity functional patterns of an extracellular matrix protein by electron beam-based inactivation. J. Am. Chem. Soc. 129 (59), 59-67 (2006).
- Sorribas, H., Padeste, C., Tiefenauer, L. Photolithographic generation of proteins micropatterns for neuron culture applications. Biomaterials. 23 (3), 893-900 (2002).
- Holden, M. A., Cremer, P. S. Light activated patterning of dye-labeled molecules on surfaces. J. Am. Chem. Soc. 125 (27), 8074-8075 (2003).
- Cheng, Q., Li, S., Komvopoulos, K. Plasma-assisted surface chemical patterning for single-cell culture. Biomaterials. 30 (25), 4203-4210 (2009).
- Kumar, A., Whitesides, G. M. Features of gold having micrometer to centimeter dimensions can be formed through a combination of stamping with an elastomeric stamp and an alkanethiol "ink" followed by chemical etching. Appl. Phys. Lett. 63 (14), 2002-2004 (1993).
- Tseng, Q., et al. New micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11, 2231-2240 (2011).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS ONE. 7, e51499 (2012).
- Herrick, W. G., Nguyen, T. V., Sleiman, M., McRae, S., Emrick, T. S., Peyton, S. R. PEG-Phosphorylcholine hydrogels as tunable and versatile platforms for mechanobiology. Biomacromolecules. 14, 2294-2304 (2013).
- Versaevel, M., Grevesse, T., Riaz, M., Lantoine, J., Gabriele, S. Micropatterning hydroxy-PAAm hydrogels and sylgard 184 silicone elastomers with tunable elastic moduli. Methods in Cell Biology. 121, 33-48 (2014).
- Kandow, C. E., Georges, P. C., Janmey, P. A., Beningo, K. A. Polyacrylamide hydrogels for cell mechanics: steps towards optimization and alternative uses. Methods Cell Biol. 83, 29-46 (2007).
- Hemphill, M. A., et al. A possible role for integrin signaling in diffuse axonal injury. PLoS ONE. 6 (7), e22899 (2011).
- Damljanovic, V., Lagerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamide substrates for cell mechanotransduction assays. BioTechniques. 39 (6), 847-851 (2005).
- Hynd, M. R., Frampton, J. P., Dowell-Mesfin, N., Turner, J. N., Shain, W. Directed cell growth on protein-functionalized hydrogel surfaces. Journal of Neuroscience Methods. 162, 255-263 (2007).
- Tseng, Q., et al. new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11 (13), 2231-2240 (2011).
- Versaevel, M., Grevesse, T., Gabriele, S. Spatial coordination between cell and nuclear shape within micropatterned endothelial cells. Nat. Commun. 3, 671 (2012).
- Versaevel, M., Grevesse, T., Riaz, M., Gabriele, S. Cell Confinement: Putting the squeeze on the nucleus. Soft Matter. 9, 6665-6676 (2013).
- Trappman, B., Chen, C. S. How cells sense extracellular matrix stiffness: a material's perspective. Current Opinion in Biotechnology. 24, 1-6 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados