Method Article
Herstellung von Hydroxy-PAAm Hydrogele zur Entkopplung der Auswirkungen von Mechanotransduction Cues
In diesem Artikel
Zusammenfassung
Wir präsentieren ein neues Polyacrylamid-Hydrogel, genannt Hydroxy-PAAm, die mit minimalen Kosten oder Know-how eine direkte Bindung von ECM-Proteine ermöglicht. Die Kombination von Hydroxy-PAAm Hydrogele mit Mikrokontaktdruck erleichtert eine unabhängige Steuerung der vielen Hinweise des natürlichen Zellmikroumgebung für die Untersuchung zellulärer mechanostransduction.
Zusammenfassung
Es ist nun gut bekannt, daß viele zelluläre Funktionen durch Wechselwirkungen von Zellen mit physikalisch-chemischen und mechanischen Signale der extrazellulären Matrix (ECM)-Umgebung reguliert. Eukaryotischen Zellen spüren ständig ihre lokalen Mikroumgebung durch Oberflächen Mechanosensoren zu körperlichen Veränderungen von ECM in biochemische Signale transduzieren, und integrieren diese Signale an bestimmten Veränderungen in der Genexpression zu erzielen. Interessant ist, physikalisch-chemischen und mechanischen Parameter des ECM Paar miteinander, um das Schicksal der Zelle regulieren. Daher ist ein Schlüssel zum Verständnis Mechanotransduktion um den relativen Beitrag der ECM Hinweise auf zelluläre Funktionen zu entkoppeln.
Hier präsentieren wir Ihnen ein detailliertes Versuchsprotokoll, um schnell und einfach erzeugen biologisch relevanten Hydrogele für die unabhängige Abstimmung der Mechanotransduktion Cues in vitro. Wir chemisch modifiziertes Polyacrylamid-Hydrogele (PAAm), um ihre nicht-eigen ADHES überwindenive Eigenschaften durch Einbau Hydroxyl-funktionalisierten Acrylamid-Monomeren während der Polymerisation. Wir erhalten eine neue PAAm Hydrogel genannt Hydroxy-PAAm, die Immobilisierung von jeder gewünschten Art von ECM-Proteinen erlaubt. Die Kombination von Hydroxy-PAAm Hydrogele mit Mikrokontaktdrucken ermöglicht, unabhängig die Morphologie der einzelnen Zellen, die Matrix Steifigkeit, die Art und die Dichte der extrazellulären Matrixproteinen. Wir bieten eine einfache und schnelle Methode, die in jedem Biologielabor eingestellt werden können, in-vitro-Zell Mechanotransduktion Prozesse zu untersuchen. Wir validieren diesem Roman zweidimensionale Plattform durch die Durchführung von Experimenten auf Endothelzellen, die eine mechanische Kopplung zwischen ECM Steifigkeit und den Zellkern zu demonstrieren.
Einleitung
Viele Aspekte der zellulären Mikroumgebung lokalen (zB Steifigkeit, Porengröße, Art der Proteine oder Zell-Ligandendichte) eine regulatorische Hinweise, die zelluläre Prozesse wie Motilität, Zellproliferation, Differenzierung und Genexpression steuern koordinieren. Modifikationen der physikalisch-chemischen Eigenschaften der extrazellulären Umgebung durch Zellen wahrgenommen werden und zu unterschiedlichen physiologischen Auswirkungen, einschließlich Verformung der Zellpolarisation, Migration und Differenzierung. Es bleibt jedoch unklar, wie die Zellen zu übersetzen ECM Änderungen in zelluläre biochemische Signale. Es ist daher von großer Bedeutung, um in vitro Mikroumgebungen, die die Interaktionen zwischen Zellen und ihrer Mikroumgebung für die Untersuchung Mechanotransduktion Wege reproduzieren gesteuert Ingenieur. Um dieses Problem anzugehen, haben wir vor kurzem eine neuartige Methode 1, genannt Hydroxy-PAAm Hydrogele, auf einfache Weise zwei Centnsional weichen Matrizen, die unabhängig voneinander zu steuern wichtige Hinweise Mechanotransduktion erlauben: Matrix Steifigkeit, Zellgeometrie und Haft, Natur des Proteins und Zell-Ligandendichte.
ECM lenkt zelluläre Prozesse über Gradienten in Morphogenen (Chemotaxis), Klebeproteine (Haptotaxis) und Steifigkeit (durotaxis). Im Laufe der letzten Jahrzehnte, fortschrittliche In-vitro-Plattformen wurden entwickelt, um diese extrazelluläre Signale, um zu isolieren, um herauszuarbeiten, wie die Zellen in der Lage, biochemische und biophysikalische Eigenschaften in physiologische Prozesse 2-5 zu übersetzen. Elektronenstrahl 6, Photolithographie 7, photochemische Immobilisierung 8 oder plasmaunterstützte Techniken 9 entwickelt worden, um das Wachstum der lebenden Zellen auf mikro Substrate zu lenken. Obwohl diese Techniken haben wichtige Ergebnisse gebracht, die meisten von ihnen Diskriminierung zwischen den einzelnen Einfluss verschiedener Hinweise auf das Zellverhalten nicht zulassen,und sie erfordern technische Einrichtungen, die nur wenige Labors leisten können. Unter diesen Techniken, Mikrokontakt-Drucken (mCP), wurde als robust und leicht zugängliche Verfahren zur Zell-anhaftenden Mikroinseln 10 zu schaffen taucht. In jüngerer Zeit umfangreiche Bemühungen 11-14 wurden unternommen, um mCP auf Hydrogelen mit abstimmbaren Rigiditäten, um das breite Spektrum der in lebenden Geweben beobachtet Rigiditäten reproduzieren zu entwickeln. Unter diesen Werken, Polyacrylamid (PAAm) populär geworden 15 und ist schon jetzt einer der am häufigsten verwendeten Polymerbasis Matrizen für die Zell Biomechanik-Assays.
PAAm Oberflächen sind häufig mit dem heterobifunktionellen Vernetzungsmittel N-Sulfosuccinimidyl-6-[4'-Azido-2'-nitrophenylamido] (Sulfo-SANPAH) und ECM-Proteine auf der Oberfläche durch UV-Aktivierung des Sulfo-SANPAH nitrophenyl verbunden funktionalisierten Azid-Gruppen 16. Eine weitere Technik besteht in Kupplungs Hydrazin, Proteine, die stark oxidiert worden sindmit Perjodat 17. Hynd und Mitarbeiter wurde eine Technik zur Strukturierung biomimetische Oberflächen Hydrogel mit Protein und Peptide, die Photopolymerisation in Gegenwart eines acroyl-Streptavidin-Monomer 18 erfordert. In jüngerer Zeit, Tseng et al. Einen neuen Mikrostrukturierungsverfahren 19 basierend auf tiefen UV-Belichtung durch einen optischen PAAm Quarzmaske, die aktiviert PA-Gelen mit 1-Ethyl-3-[3-dimethylaminopropyl] carbodiimidhydrochlorid inkubieren erfordert (EDC) berichtet und N-Hydroxysuccinimid (NHS) wässrigen Lösungen vor, die das Protein hinzuzufügen. Trotz der Fähigkeit dieser Techniken, um homogene und reproduzierbare Mikroproteine zu erzeugen, die meisten von ihnen leiden wesentliche Einschränkungen: lange Syntheseverfahren (zum Beispiel Dialyse, Lyophilisierung usw.), teure chemische Verbindungen (zB Hyaluronsäure, Sulfo-SANPAH) oder tiefen UV- Bestrahlung. Hinzu kommt, dass diese Techniken nicht zulassen, dass unabhängige Modulation der Steifigkeit Substrat, MikroGeometrie, ECM-Protein der Natur, und Zell-Ligandendichte.
Unter Berücksichtigung dieser Einschränkungen zu berücksichtigen, wurde ein neues und einfach auf Acrylamid basierenden Ansatz, der Immobilisierung einer Vielzahl von Proteinen und Biomolekülen auf weichen Hydrogele ermöglicht und erlaubt unabhängige Abstimmung der Mechanotransduktion Signale, um ihre Rolle bei Zellfunktionen entschlüsseln entwickelt. Statt der Behandlung PAAm Hydrogele mit aggressiven chemischen Verbindungen führen wir eine kommerzielle Acrylamid-Monomer mit Hydroxylgruppen während PAAm Polymerisation. Dieser einfache Vorgang überwindet den inneren Antihafteigenschaft PAAm Hydrogele ohne weitere technische Anforderungen.
Die Gegenwart von Hydroxyl-Gruppen führt zu einer hohen Affinität Hydroxy-PAAm Hydrogele Proteine und Biomoleküle, die Wasserstoffbrücken bilden. In Kombination mit mCP, Hydroxy-PAAm Hydrogele ermöglichen eine schnelle Erzeugung von zweidimensionalen Kulturplattform mit einem unabhängigen Steuerauf Matrix Steifigkeit, Art der ECM-Proteine, Zelldichte und-Liganden beschränkt Haft, die geplant, um eine leistungsstarke Plattform für die Untersuchung Mechanotransduktion sein werden.
Der Zweck dieses Protokolls ist es, die notwendigen Informationen für leicht machen Hydroxy-PAAm Hydrogele ohne Know-how in den Materialwissenschaften liefern. Das ultimative Ziel ist es, ein Mittel bereitzustellen, für Forscher, die physiologisch relevanten Fragen an den zellulären und Gewebespiegel, die zu einem besseren Verständnis der Mechanotransduktion Wege in pathophysiologische Mechanismen führen kann fragen.
Protokoll
1. Aktivieren der Oberfläche des Deckgläser
- Ort Glaskreisdeckgläser (25 mm Durchmesser) in einer Petrischale und Abstrich 0,1 M NaOH-Lösung auf sie für 5 min (chemischen Abzugshaube empfohlen).
- Entfernen Sie die NaOH-Lösung und vollständig eintauchen Deckgläser mit sterilem ddH2O für 20 min unter leichtem Schaukeln auf einem Schaukelplatte in einem sterilen Kultur Kapuze.
- Abtropfen sterilen ddH2O und wiederholen Sie den Schritt 1.2.
- Entfernen Sie die Deckgläser mit einer sterilen Pinzette und legen Sie sie in eine neue Petrischale mit der Aktivseite nach oben.
- Trockendeckgläser unter einem ständigen Strom von hochreinem Stickstoffgas.
- In einem sterilen Kultur Haube, schmieren eine dünne Schicht von 3 (trimethoxysilyl) propylacrylat (92%) auf der Aktivseite der Deckglas für 1 Stunde.
- Ausgiebig waschen Deckgläschen mit 3 Waschungen von sterilen ddH2O und tauchen sie in sterilen ddH2O in einem neuen Petrischale.
- Tippen Sie auf die Petrischalemit Parafilm und legen Sie es auf einer Wippe Platte unter leichtem Schütteln für 10 min.
- Deckgläser abnehmen ddH2O mit einer sterilen Pinzette mit feinen Spitzen und legen Sie sie in eine neue Petrischale mit der Aktivseite nach oben.
- Speichern bei RT in einem trockenen Ort mit Aluminiumfolie, um Staub vom Festhalten an den Deckgläsern zu vermeiden.
2. Herstellung von Hydroxy-PAAm Hydrogele
- Vorbereitung ein Gewicht von 65 mg N-Hydroxyethyl-acrylamid (HEA) in einem 1,5 ml Eppendorf-Röhrchen. Es ist wichtig, um eine frische HEA-Lösung herzustellen.
- 1 ml 50 mM HEPES-Puffer, um HEA und mischen mit einem Vortexer bis zur vollständigen Auflösung HEA.
- Werden 400 ul 40% w / w in HEPES Acrylamid-Lösung und der gewünschten Menge von 2% w / w in HEPES-bis-acrylamid-Lösung (siehe Tabelle 1), um die gewünschte Steifigkeit zu erreichen Hydrogel. Einstellen mit 50 mM HEPES auf ein Endvolumen von 5 ml.
- Mischen Sie die Lösung mit einem Vortexer und entgasenin einer Vakuumkammer für 20 Minuten, um die Sauerstoffkonzentration in der Lösung, die Hydroxy-PAAm Polymerisation verhindert reduzieren.
- Unter einer sterilen Haube, filtern das entgaste Lösung mit einer 0,2 um Porengröße Filter, um sie zu sterilisieren.
- Aktivieren runden Glasdeckgläschen (22 mm Durchmesser) in einem UV / Ozon-Reiniger während 7 min.
- Planen 100 ul 10% Ammoniumpersulfat (APS)-Lösung, das heißt 10 mg APS in 100 ul ddH 2 O. Es ist wichtig, um eine frische APS-Lösung herzustellen.
- Fügen 2,5 ul Tetramethylendiamin (TEMED) und 25 ul APS Lösung des sterilisierten Hydroxy-PAAm-Lösung (Schritt 2.5), um die Polymerisation zu initiieren. Mischen Sie die Lösung von 3 aufeinander folgenden Pipettierungen ohne Einführung von Blasen, unter sterilen Bedingungen.
- Unter einer sterilen Haube, legen Sie einen 25 ul Tropfen der Hydroxy-PAAm Lösung im 25 mm Deckglas (ab Schritt 1.9) und sofort legen Sie eine 22 mm glArsch Deckglas (auf Stufe 2.5 vorbereitet) auf der Oberseite des Tropfens, um das Hydroxy-PAAm Lösung zu quetschen. Zentrieren Sie die 22 mm Deckglas mit einer sterilen Pinzette und glätten keine Blasen.
- Ermöglichen Hydroxy-PAAm Hydrogele bei RT für 15 min polymerisiert. Kehren Sie manuell die restlichen Hydroxy-PAAm Lösung in der Eppendorf-Röhrchen, um die Beendigung der Polymerisation Prozess zu folgen.
- Voll eintauchen Deckgläser mit sterilem ddH2O und sorgfältig trennen die 22 mm Deckgläschen durch die Einführung der Kante einer Rasierklinge zwischen den 22 mm Deckgläschen und dem Hydroxy-PAAm Hydrogel-Schicht.
- Mit sterilem PBS waschen Hydroxy-PAAm Hydrogele (3 Austausch von PBS) und lassen Sie die Gele vollständig in sterilem PBS eingetaucht, um Hydratation beizubehalten.
- Speichern Hydroxy-PAAm Hydrogele in sterilem PBS bei 4 ° C für bis zu 3 Tagen.
3. Polydimethylsiloxan (PDMS) Microstamp Fabrication
HINWEIS: Die Herstellung eines Silizium-Master ist vor der staRT Das PDMS microstamp Fertigung. Diese Mikro eines Silizium-Master kann durch lithographische Techniken, die spezielle Ausrüstung und Ausbildung erfordert geführt werden. Kooperationen mit einer Nanofabrikation Anlage werden ermutigt, den Silizium-Master herzustellen. Alternativ wenden Sie ein Unternehmen, das maßgeschneiderte mikrostrukturierte Silizium-Meister fertigt auf Anfrage. Es ist wichtig zu beachten, daß die Herstellung des Silizium-Master muss nur einmal durchgeführt werden. In der Tat können mikrostrukturierte Silizium-Meister auf unbestimmte Zeit zu Elastomer Briefmarken verwendet werden.
- Mix PDMS und Härter in einem 10: 1-Verhältnis in einem Kunststoffbecher und mischen mit einer Pipette für 10 min.
- Entgast PDMS-Mischung unter Vakuum, um Luftblasen, die während der Stufe 3.1 gebildet wurden zu entfernen.
- Legen Sie die mikrostrukturierte Silizium-Master in einer Petrischale und warf einen 10-mm-dicke Schicht von entgastem PDMS-Mischung auf, ohne Bildung von Blasen.
- Lassen Sie die PDMS für 2 Stunden bei 60 ° C in einer heilenOfen.
- In einer staubfreien Umgebung, Peel-off der PDMS-Schicht und der Verbrauch 1 cm 2 microstamps mit einem Skalpell.
- Mit einer Pinzette, microstamps Ort PDMS Muster-up in einer Petrischale.
4. Mikrostrukturierung Hydroxy-PAAm Hydrogele
- Ort PDMS microstamps in einem Ethanol / Wasser (50:50)-Lösung und beschallen für 15 min.
- Trocknen der Stempel mit einem Strom von Stickstofffluss und sie muster in einem UV / Ozon-Reinigungsmittel (λ <200 nm) für 7 min.
- Unter einer sterilen Haube, legen eine 150 ul-Tropfen einer gewünschten Proteinlösung (beispielsweise 100 ug / ml Laminin in PBS oder 25 ug / ml Fibronektin in PBS) auf die mikrostrukturierte Oberfläche eine 1-cm 2 PDMS-Stempel.
- Optional: Ändern der Konzentration der Proteinlösung in die Zelle-Ligandendichte zu modulieren.
- Ausbreitung der Proteinlösung über die Stempeloberfläche durch Verschieben mit einer sterilen Spitze einer Pipette zu jeder Eckeder Stempel.
- Verlassen Sie die Proteinlösung auf der PDMS-Stempel für 60 Minuten unter einer sterilen Haube zu adsorbieren. Schalten Sie Lampen, um die Proteinschäden zu vermeiden.
- Unter einer sterilen Haube, übertragen Hydroxy-PAAm beschichtete Deckgläser (erhältlich bei Schritt 2.13) in eine Petrischale.
- Entfernen überschüssigen PBS von der Oberfläche Hydroxy-PAAm Substrate mit einem geringen Stickstoffstrom unter sterilen Bedingungen. Stoppen des Verfahrens, sobald keine Hinweise stehendem Wasser auf der Gel-Oberfläche beobachtet. Das Gel sollte nicht gründlich in diesem Stadium getrocknet werden.
- Trocken sorgfältig die strukturierte Oberfläche der PDMS-Stempel mit einem stetigen Strom von hochreinem Stickstoffgas.
- Fassen Sie die Protein-beschichteten Stempel mit Dressing Gewebe Pinzette und legen Sie die strukturierte Oberfläche in Kontakt mit der Oberfläche getrocknete Hydrogel. Gelten kurze Druckpunkte mit der Spitze der Pinzette auf der Oberseite der PDMS-Stempel, um einen guten Kontakt zwischen Stempel und Mikroformen des Hydrogels Oberfläche zu gewährleisten.
- Verlassen Sie die PDMS-Stempel auf the Hydrogel Oberfläche für 1 h bei RT.
- Entfernen Sie vorsichtig PDMS-Stempel aus Hydroxy-PAAm Hydrogele mit Dressing Gewebe Pinzette und folgen Sie den Schritt 4.1, um den Stempel zu reinigen.
- Waschen umfassend die Stanz Hydroxy-PAAm Hydrogele von 3 Austausch von PBS (pH = 7,4) unter sterilen Bedingungen 10 min pro Austausch.
- Optional: Zusätzliche Mikro anderer ECM-Proteine können durch folgende Schritte 4,5-4,11 auf die Hydroxy-PAAm Oberfläche hinzugefügt werden.
- Passivierung nicht bedruckten Bereiche mit einer sterilen Lösung von BSA bei 5 mg / ml in PBS während einer Nacht bei 4 ° C unter leichtem Schütteln auf einer Schwingplatte.
- Umfassend Waschen von 3 Austausch von PBS (pH = 7,4) unter sterilen Bedingungen 10 min pro Austausch. In diesem Stadium kann gestanzt Hydroxy-PAAm Hydrogele bei 4 ° C bis zu einer Woche gelagert werden.
5. Zellablage auf mikrostrukturierten Hydroxy-PAAm Hydrogele
- Deckgläschen in Zellmedium inkubieren 30-45 min vor dem Beschichten cEllen.
- Waschen adhärenten Zellen in einer 75 cm 2 Kulturflasche mit sterilem PBS bei 37 ° C, und nehmen Sie mit 3 ml Trypsin-EDTA oder Accutase für 10 min.
- Übertragen Sie die gewünschte Menge des vorgewärmten komplette Wachstumsmedium entsprechend Ihrer Zelllinie in den Kolben mit den abgelösten Zellen und Zentrifugieren der Zellsuspension für 3 min bei 650 x g.
- Den Überstand mit einer Mikropipette und Die Zellen in komplettem Kulturmedium bei 15-20.000 Zellen / ml.
- 4 ml der Zelllösung zu einem mikroDeckGlas (aus Stufe 5.1) erhalten und Küvette bedeckten Deckglas in einem Brutschrank bei 37 ° C und 5% Feuchtigkeit für 1-2 Stunden.
- Saugen Sie sanft ungebunden Zellen und ersetzen Kulturmedium. Bringen Sie die anhaftenden Zellen in den Inkubator und lassen Sie sie vollständig verteilt (3-6 Stunden, je nach Zelltyp).
Ergebnisse
Figur 1A zeigt die Co-Polymerisation von Acrylamid (AAM) und Bisacrylamid (bis-AAM) mit N-Hydroxyethylacrylamid (HEA) Monomeren, die eine primäre Hydroxylgruppe durch statistische radikalische Polymerisation mit eingelagerten Hydroxygruppen gebildet ein hydrophiles Netzwerk von Polyacrylamid (hydroxy-PAAm) . In diesem Protokoll muss ein Gewicht 65 mg HEA in einem Volumen von 1 ml HEPES verdünnt werden. Wissend, dass die Dichte der HEA ist ungefähr gleich eins ist, gehen wir davon aus, dass wir erhalten ein Arbeitsvolumen von 1.065 ul (HEA + HEPES). Wie in Tabelle 1 dargestellt, die Gesamtzugabe von 1.065 ul bis 400 ul AAm und 50 ul bisAAm führt zu einem Volumen von 1.515 ul. Daher wird ein Volumen von 3.485 ul HEPES benötigt wird, um die Lösung auf ein Endvolumen von 5 ml einzustellen. Wie in Schritt 2.6 angegeben, muss die Oberfläche der 22 mm Deckglas während 7 Minuten in einem UV / Ozon in Reihenfolge aktiviert, um es zu entfernen, ohne dassSchäden an der Oberfläche Hydrogel. Tatsächlich wird die Glasoberfläche hydrophiler nach dem UV / Ozon-Behandlung und kann daher leicht durch Eintauchen des gesamten Systems in Wasser entfernt werden. Darüber hinaus verhindert die UV / Ozonbehandlung eine chemische Verunreinigung der 22 mm Deckglas, das in direktem Kontakt mit der Hydrogel-Oberfläche. Diese Technik erlaubt, eine flache kreisförmige Oberfläche Polyacrylamid (22 mm Durchmesser) auf einem Deckglas gebunden (25 mm im Durchmesser) zu erhalten.
Wie in 1B dargestellt, können Mikrostrukturen von Proteinen auf der Oberfläche Hydroxy-PAAm Hydrogele durch Mikrokontaktdruck erzeugt werden. In diesem experimentellen Verfahren erlauben UV / Ozon-Exposition durch Bildung Silanolgruppen an der Oberfläche vorübergehend verringern die intrinsische Hydrophobizität der PDMS-Stempel. Tatsächlich ist die 185-nm-Linie erzeugt Ozon aus molekularem Sauerstoff, während der 254 nm-Linie wandelt das Ozon zu atomarem Sauerstoff. Diese reaktiven Spezies greift die Siloxan-backbone von PDMS zu sauerstoffreichen SiOx Kieselsäure artigen Schicht und Si-OH-Oberflächengruppen zu bilden. Das oxidierte PDMS Oberfläche ist bekannt, seine Hydrophobie in nur wenigen Stunden nach der Exposition gegenüber Luft, bedingt durch die Migration von niedermolekularen unvernetzten Polymerketten von der Bulk-Phase an der Oberfläche. Diese Strategie hilft die Verbreitung der Proteinlösung auf der Oberfläche des PDMS-Stempels.
Einer der wesentlichen Vorteile dieses Verfahrens besteht darin, unabhängig modulieren Matrixsteifigkeit (2A), Mikrogeometrie (2B), Zell-Ligandendichte (2C) und Proteinnatur (3A und 3B). Wie in 2A gezeigt, Hydroxy-PAAm Hydrogele zeigen eine lineare Abhängigkeit der Elastizitätsmodule auf Vernetzerkonzentration von wenigen kPa bis mehrere Dutzend kPa, so dass feine Wiedergabe der Steifigkeit der zellulären Mikroumgebung. 2B zeigt Epifluoreszenz Bilder von Laminin (LM) rechteckigen Mikro auf hydroxy-PAAm Hydrogele aus drei unterschiedlichen Steifigkeiten (2,5, 15 und 40 kPa) aufgebracht wird, zeigt deutlich die unabhängige Abstimmung der Mikrogeometrie und Matrixsteifigkeit. 2C zeigt, dass die Zelle ligandkomplex Dichte kann durch Variation der Konzentration des zur PDMS-Stempel inkubieren Proteinlösung moduliert werden. Figur 3 zeigt ein Fluoreszenzbild von Kollagen Linien über Laminin und Fibronectin Linien mit aufeinanderfolgenden Mikro Auflagen versehen.
Es ist interessant für die Leser zu beachten, dass verschiedene Größen und Formen von Mikro wurden effizient, unabhängig des Hydrogels Steifigkeit gestempelt. Wir haben erfolgreich Mikrostrukturen von Proteinen mit scharfen Kanten (beispielsweise Dreiecke und Sterne) und gerade (zB Linien) oder gekrümmt (beispielsweise Kreise) Formen wiedergegeben werden, zeigen, dass es keine major Einschränkung der Musterkomplexität. Für einzelne Zelle Experiment wurde die Mikro Oberfläche zwischen 400 und 2500 um 2, die untere Wert entsprechend der Grenze der einzelnen Zelllebensfähigkeit. Wie viele andere Mikrodruck-basierte Methoden, die wichtigste Einschränkung des vorgestellten Verfahrens betrifft die räumliche Auflösung. Auf steife Hydrogele (E> 10 kPa), ist die räumliche Auflösung auf der Mikrometer und vor allem durch die Auflösung des Stempels bestimmt, während auf "weiche" Hydrogele, die Grenze der Auflösung wird teilweise von der Oberfläche, die während der Verformung auftreten können, bestimmt Proteintransfer.
Die Toxizität von Hydroxy-PAAm Hydrogele wurde durch Quantifizierung der Lebensfähigkeit der primären endothelialen Zellen 1, 2 und 3 Tagen in Kultur auf homogen beschichteten plattiert und Mikrodruck weichen Hydroxy-PAAm Hydrogele (4A) untersucht. Über 80% der HUVECs vergoldet auf mikro weichen Hydroxy-PAAm Hydrogele erhaltenihre Lebensfähigkeit für drei Tage, was die Biokompatibilität des Hydroxy-PAAm Hydrogele für die Zellkultur. Interessanterweise wurde ähnlich Lebensfähigkeit in unserem Labor mit primären kortikalen Neuronen Zellen erhalten. Darüber hinaus sind die primären Endothelzellen vermehren Mehr zu "steif" (500 kPa) im Vergleich zu "weichen" (25 kPa) Substrate (4B), was darauf hinweist, dass dieses Verfahren eine geeignete Mikroumgebung für die zelluläre Proliferation Studium in einem breiten Spektrum von Steifigkeiten .
Um die Wirkung der Substrat Steifigkeit und Ausbreitungsfläche auf Mechanotransduktion entkoppeln, wurden primäre Endothelzellen (HUVECs) auf rechteckigen FN-beschichteten Mikro plattiert (konstante Fläche von 1200 um 2) Hydroxy-PAAm Hydrogele aus drei unterschiedlichen Steifigkeiten (2.5, 8.5 aufgebracht, und 25 kPa). Dann wurden HUVECs für Aktin-Filamenten, Vinculin und DNA durch Anschluss an eine Standard-Immunzytochemie Verfahren gefärbt, wie Mama verwendetlian Zellen auf Glassubstraten beschichtet. Auf den weichsten Substrate, HUVECs zeigen niedrige Aktin Faserdichte und eine abgerundete Zellkern, während auf steifer Untergründen, sind Aktinfasern gerader und dicker und der Kern deformiert (Abbildung 5). Änderungen der Substrat Steifigkeit bei konstanter Ausbreitungsfläche modulieren Spannung und Verteilung von Aktin Stressfasern, die bei der Schrumpfung des Kerns führt. Diese Beobachtung deutet auf eine mechanische Kopplung zwischen Matrix Steifigkeit, Zytoskelett und Kern.
| Schluss AAm / bisAAm Verhältnis | AAm 40% (ul) | Gewicht HEA in 1 ml HEPES (mg) auflösen | Bis AAm (2%) (Ul) | HEPES (ul) | Elastizitätsmodul (10 3 Pa) |
| 0,2 / 50 0,5 / 50 1:50 2/50 3/50 | 400 400 400 400 400 | 65 65 65 65 65 | 50 125 250 500 750 | 3.485 3.410 3.285 3.035 2.785 | ~ 1.4 ~ 3,6 ~ 8,7 ~ 17,2 ~ 25 |
Tabelle 1. Herstellung von Hydroxy-PAAm Hydrogele mit verschiedenen Steifigkeiten. Working Lösungen für Hydroxy-PAAm Hydrogele mit der endgültigen Steifigkeit von 1,4 bis 25 kPa vorzubereiten.
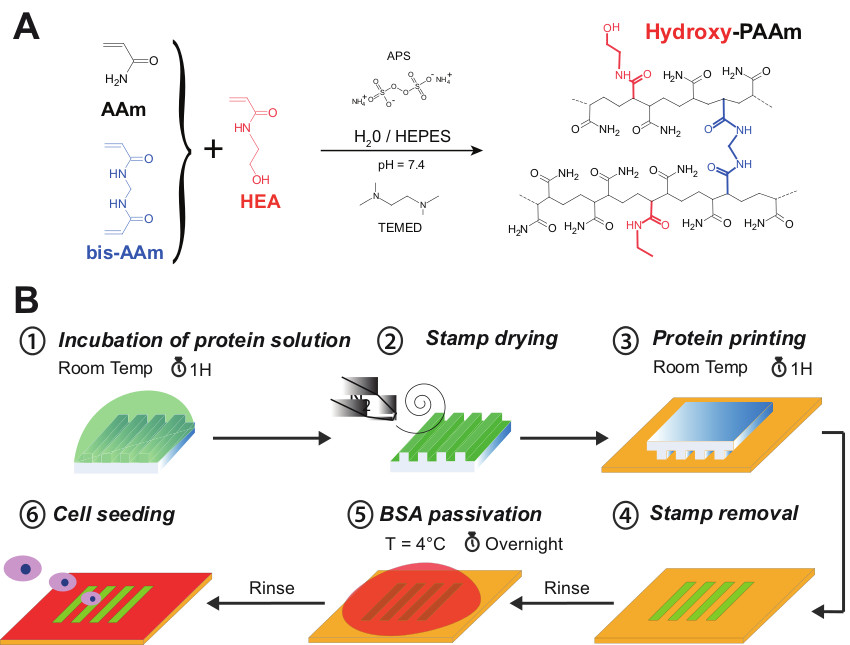
Figur 1 (A) Acrylamid (AAM, schwarz), N, N'-Methylenbisacrylamid (BIS-AAM, blau) und N-Hydroxyethylacrylamid (HEA, rot) wurden miteinander gemischt zur Bildung Hydroxy PAAm Hydrogele. (B) Schematische Darstellung der verschiedenen Schritte der Mikrostrukturierungsverfahren auf Hydroxy-PAAm Hydrogele. Eine Lösung von Protein zunächst während 1 Stunde auf der Struktur Fläche eines microstamp (Schritt # 1) inkubiert. Das Hydrogel Oberfläche sanft mit einem Stickstoffstrom (Schritt 2) getrocknet. Die microstamp wird dann in Kontakt mit der formalen Hydroxy-PAAm Oberfläche während 1 h (Schritt 3) gegeben. Nach aufeinanderfolgenden Wäschen wird die Oberfläche mit einem Mikrodruck abgeschieden O / N sterile BSA-Lösung bei 4 ° C (Schritt 5), um nicht-bedruckten Bereichen blockieren passiviert. Schließlich wird die Mikrodruck Hydroxy-PAAm Oberfläche mehrmals mit sterilem PBS gewaschen und ist bereit für die Zellaussaat (Schritt 6). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
1010 / 51010fig2highres.jpg "width =" 500 "/>
Abbildung 2 (a) die Entwicklung der Steifheit Hydroxy-PAAm Hydrogele linear mit der Menge der Bis-AAM-Vernetzer (rote Linie ist eine lineare Regression mit R 2 = 0,995) korrelierten. (B) Fluoreszenzbilder Laminin rechteckigen Mikromerkmalen auf hydroxy-PAAm Hydrogele mit unterschiedlicher Steifigkeit (E = 2,5, 15 und 40 kPa) eingeprägt. Maßstabsbalken entsprechen (A) 65 um, (B) 80 um, und (C) 50 um. (C) parallele Linien von 15 um Breite, einen LM-Gradienten auf 25 kPa Hydroxy-PAAm Hydrogel, wie durch die Entwicklung gekennzeichnet der Fluoreszenzintensität Profil. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
n "src =" / files / ftp_upload / 51010 / 51010fig3highres.jpg "width =" 500 "/>
Abbildung 3. (A) Immunfluoreszenz-Bild Fibronectin (in rot) und Laminin (grün) Streifen bei 90 ° gekreuzt. (B) Multilabeling von Fibronektin (in rot), Laminin (in grün) und Kollagen (in blau) Streifen Mikrodruck anschließend auf einem 25 kPa Hydrogel PAAm Substrat. Maßstabsbalken entsprechen 30 um. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
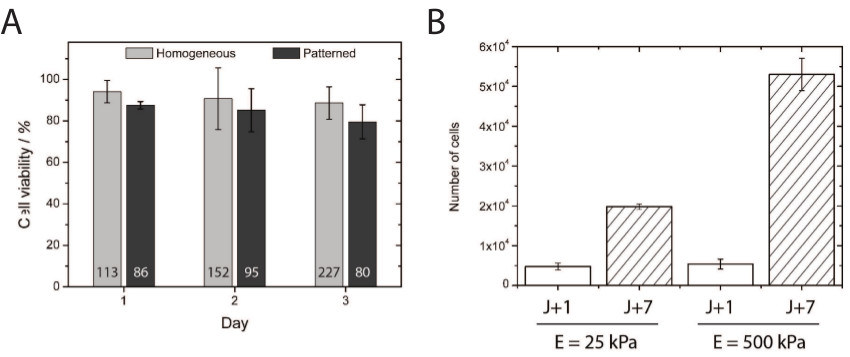
Figur 4 (A) Die Quantifizierung der Zelllebensfähigkeit demonstriert ausgezeichnete Zellüberleben bei 24, 48 und 72 Stunden nach dem Einschalten plattiert homogen beschichtete mikrostrukturiert und Hydroxy-PAAm Oberflächen. Die Anzahl an angegebenender Boden jeder Balken entspricht der Gesamtzahl der Zellen, die für die Lebensfähigkeitstest gezählt. (B) Quantifizierung der HUVEC-Proliferation auf 25 und 500 kPa homogen beschichtete Substrate nach 1 (weiße Balken) und 7 (Hash-bars) Tagen Kultur. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 5. Fluoreszenzbilder von immungefärbten primären Endothelzellen auf rechteckigen FN-beschichteten Mikro, die auf Hydroxy-PAAm Hydrogele von 2,5 kPa, 8,5 kPa abgelagert wurden kultiviert und 25 kPa (von links nach rechts). Die Aktin-Stressfasern (grün ) wurden mit Alexa Fluor 488 Phalloidin, fokalen Adhäsionen (in rot) wurden mit einer Maus PolyCLO beflecktnal primären Antikörper und mit einem rot-fluoreszierenden Sekundär IgG-Antikörper und der DNA markiert war, in blau mit DAPI gefärbt. Die Maßstabsbalken entsprechen 17 um. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Viele in vitro Beobachtungen in modernen Zellbiologie haben auf starren Glasplättchen, die oft mit einer dünnen Schicht aus ECM-Proteine oder synthetische Peptide, die die RGD-Sequenz beschichtet geführt. Allerdings sind solche grundlegenden Kultursubstraten nicht rekapitulieren die gesamte physikalisch-chemische Komplexität des ECM und somit nicht ein genaues Modell für die Untersuchung zellulärer Mechanotransduktion Prozesse. Um dieses Problem anzugehen, schlagen wir eine einfache Alternative zu zweidimensionalen Hydrogele mit jeder gewünschten Menge und Art der ECM-Proteine zu funktionalisieren. Diese Methode ermöglicht die unabhängige Steuerung von wichtigen Mechanotransduktion Cues, wie Matrix-Steifigkeit, Zellmorphologie und Entbindung oder Zell-Ligandendichte. Zusätzlich Hydroxy-PAAm Hydrogele überwinden eine der größten Einschränkungen derzeitiger Funktionalisierung Methoden, die die Unfähigkeit, zu immobilisieren und um die räumliche Verteilung von mehr als einem ECM-Protein unter Kontrolle ist. Aufgrund der hohen Affinität der hydroxy-PAAm Hydrogele für Biomoleküle, kann man die räumliche Verteilung der verschiedenen ECM-Proteinen auf der gleichen Oberfläche, unabhängig von der Matrix Steifigkeit durch Verwendung sequentieller microprintings, die keine zusätzliche Ausrüstung erforderlich ist steuern.
Wir schlagen ein neues Verfahren auf der Grundlage der Einbau von Hydroxylgruppen in Acrylamid-Hydrogele, ihre eigen nicht-klebenden Eigenschaften mit minimalen Anforderungen an Kosten und Know-how zu überwinden. Im Vergleich zu bestehenden Techniken zum Strukturieren Hydrogele Proteine über vermeidet die Hydroxy-PAAm Verfahren den Einsatz von ätzenden Chemikalien toxisch (beispielsweise Hydrazin-Hydrat), teuren photoreaktiven Vernetzer (zB Sulfo-SANPAH) und die Abhängigkeit von UV-Lampenleistung und Positionierung funktionalisieren weichen Hydrogele. Hydroxy-PAAm Hydrogele bleiben stabil und aktiv für mehrere Wochen, können Massenproduktion hergestellt werden, leicht Mikrodruck und ihrer hohen Affinität für Biomoleküle können synergistische Wirkungen zu untersuchenkonjugierten ECM-Proteinen auf zellulärer Funktionen. Zusätzlich können Hydroxy-PAAm Hydrogele zur quantitativen Untersuchung der Menge von Zellen, die auf das sie umgebende Mikro ausgeübte Kontraktionskräfte werden. In der Tat, die wir zuvor gezeigt haben, dass 1,20 fluoreszierende Kügelchen problemlos in Hydroxy-PAAm Hydrogele eingebettet werden, um Zelltraktionskraftmikroskopie (TFM) verwenden, um das Verschiebungsfeld zu messen und schätzen Sie die resultierende Traktion Feld von eukaryotischen Zellen ausgeübt vergoldet auf zweidimensionalen Mikrostrukturen.
Wie viele andere Mikrodruck-basierte Methoden, die wichtigste Einschränkung von Hydroxy-PAAm Hydrogele betrifft die räumliche Auflösung von Protein-Mikrostrukturen. Auf steife Hydrogele (E> 10 kPa), ist die räumliche Auflösung um einen Mikrometer und vor allem durch die Auflösung der Briefmarke, in Abhängigkeit von der Lithographietechnik verwendet, um die Silikonform herzustellen bestimmt. Auf weicher Hydrogele, wird die räumliche Auflösung teilweise durch th bestimmte Oberflächendeformation während der Proteintransfer, der die Haupt Beschränkung auf Mikrometer-Ortsauflösung erreichen wird. Die hier vorgestellte Ansatz ist derzeit zweidimensionalen Substraten beschränkt. Dieses Verfahren ist jedoch hochgradig skalierbar und weitere Studien werden derzeit in unserem Labor, um dieses Verfahren zu dreidimensionalen Strukturen erstrecken.
Wir hoffen, dass Hydroxy-PAAm Hydrogele können dazu beitragen, wichtige Mechanismen der komplexen zellulären und Gewebe Prozesse, die eng mit den physikalisch-chemischen Eigenschaften der Mikroumgebung der Zelle 21,22, inklusive der embryonalen Entwicklung, Entzündungsreaktionen, Wundheilung, Neuritenwachstum, adulten Gewebe verwandt sind zu entziffern Homöostase und der Pathogenese von Erkrankungen wie Fibrose und Krebs.
Offenlegungen
No conflicts of interest declared.
Danksagungen
This work was supported by the Belgian National Foundation for Scientific Research (F.R.S.-FNRS) through “MIS Confocal Microscopy”, “Crédit aux Chercheurs” grants and the “Nanomotility FRFC project” (no. 2.4622.11). T.G. doctoral fellowship is supported by the Foundation for Training in Industrial and Agricultural Research (FRIA). The authors gratefully acknowledge Sylvain Desprez for mechanical characterization and Géraldine Circelli for confocal imaging.
Materialien
| Name | Company | Catalog Number | Comments |
| UV/Ozone Photoreactor | Ultra-Violet Products | Model PR-100 | |
| Rocking plate | IKAcWerke | Model KS 130 Basic | |
| Vortexer | Scientific Industries | Model Vortex Genie2 | |
| Vacuum degassing chamber | Applied Vacuum Engineering | DP- 8-KIT | |
| Parafilm | Sigma-Aldrich | P7793-1EA | |
| Stainless steel forceps with fine tip | Sigma-Aldrich | Z225304-1EA | |
| Dressing tissue forceps | Sigma-Aldrich | F4392-1EA | |
| Petri dishes in polystyrene | Sigma-Aldrich | P5731-500EA | |
| Aluminium foil, thickness 0.5 mm | Sigma-Aldrich | 266574-3.4G | |
| Isopore membrane filter (0,2 µm pore size) | Millipore | GTTP Filter code | |
| Round glass coverslip (22 mm diameter) | Neuvitro | GG-22 | |
| Round glass coverslip (25 mm diameter) | Neuvitro | GG-25 | |
| Variable volume micropipette | Sigma-Aldrich | Z114820 | |
| Protein microcentrifuge tubes | Sigma-Aldrich | Z666505-100EA | |
| Scalpel handles | Sigma-Aldrich | S2896-1EA | |
| Scalpel blades | Sigma-Aldrich | S2771-100EA | |
| Cell culture flasks (75 cm2) | Sigma-Aldrich | CLS430641 | |
| Ultrasonic bath tray, solid (stainless steel) | Sigma-Aldrich | Z613983-1EA | |
| Name of the Reagent | Company | Catalogue Number | Comments |
| Polydimethylsiloxane | Dow Corning | Sylgard 184 silicone elastomer kit | |
| Acrylamide (powder) | Sigma-Aldrich | A3553 | |
| N,N’-Methylenebis(acrylamide) | Sigma-Aldrich | 146072 | |
| N-Hydroxyethylacrylamide | Sigma-Aldrich | 697931 | |
| N,N,N’,N’-Tetramethylethylenediamine | Sigma-Aldrich | T9281 | |
| Amonium PerSulfate (APS) | Sigma-Aldrich | A3678 | |
| 3-(Trimetoxysilyl)propyle acrylate | Sigma-Aldrich | 1805 | |
| Human Plasma Fibronectin | Millipore | FC010 | |
| Laminin from EHS | Sigma-Aldrich | L2020 | |
| Sodium hydroxyde | Sigma-Aldrich | 221465-25G | |
| Double-distilled water (ddH2O) | |||
| Endothelial cell growth medium | Cells Applications | 211K-500 | |
| Human Umbilical Vein Endothelial Cells (HUVEC) | Invitrogen | C-003-5C | |
| Accutase | PAA laboratories | L11-007 | |
| HEPES buffer solution 1M in H20 | Sigma-Aldrich | 83264-500ML-F | |
| Antibiotics-antimycotics | PAA laboratories | P11-002 | |
| Phosphate Buffer Saline solution | PAA laboratories | H15-002 | |
| Alexa Fluor 488 Phaloidin | Molecular Probes | A12379 | |
| Anti-vinculin antibody produced in mouse | Sigma-Aldrich | V9131 | |
| Goat anti-mouse antibody-tetramethylrhodamine | Molecular Probes | T-2762 | |
| Anti-Fibronectin | Sigma-Aldrich | F3648 | |
| (rabbit) | |||
| Streptavidin | Sigma-Aldrich | 41469 | |
| Anti-Laminin antibody | Sigma-Aldrich | L9393 | |
| (rabbit) | |||
| Anti-rabbit IgG-FITC | Sigma-Aldrich | F7512 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T3924-100ML | |
| Absolute ethanol | Sigma-Aldrich | 459844-2.5L |
Referenzen
- Grevesse, T., Versaevel, M., Circelli, G., Desprez, S., Gabriele, S. A simple route to functionalize polyacrylamide gels for the independent tuning of mechanotransduction cues. Lab Chip. 13 (5), 777-780 (2013).
- Gabriele, S., Benoliel, A. M., Bongrand, P., Théodoly, O. Microfluidic investigation reveals distinct roles for actin cytoskeleton and myosin II activity in capillary leukocyte trafficking. Biophys. J. 96 (10), 4308-4318 (2009).
- Atmanli, A., Domian, I. J. Generation of aligned functional myocardial tissue through microcontact printing. J. Vis. Exp. (73), e50288 (2013).
- Gabriele, S., Versaevel, M., Preira, P., Théodoly, O. A simple microfluidic method to select, isolate, and manipulate single-cells in mechanical and biochemical assays. Lab Chip. 10 (11), 1459-1467 (2010).
- Le Berre, M., Aubertin, J., Piel, M. Fine control of nuclear confinement identifies a threshold deformation leading to lamina rupture and induction of specific genes. Integr. Biol. 4 (11), 1406-1414 (2012).
- Rundqvist, J., et al. High fidelity functional patterns of an extracellular matrix protein by electron beam-based inactivation. J. Am. Chem. Soc. 129 (59), 59-67 (2006).
- Sorribas, H., Padeste, C., Tiefenauer, L. Photolithographic generation of proteins micropatterns for neuron culture applications. Biomaterials. 23 (3), 893-900 (2002).
- Holden, M. A., Cremer, P. S. Light activated patterning of dye-labeled molecules on surfaces. J. Am. Chem. Soc. 125 (27), 8074-8075 (2003).
- Cheng, Q., Li, S., Komvopoulos, K. Plasma-assisted surface chemical patterning for single-cell culture. Biomaterials. 30 (25), 4203-4210 (2009).
- Kumar, A., Whitesides, G. M. Features of gold having micrometer to centimeter dimensions can be formed through a combination of stamping with an elastomeric stamp and an alkanethiol "ink" followed by chemical etching. Appl. Phys. Lett. 63 (14), 2002-2004 (1993).
- Tseng, Q., et al. New micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11, 2231-2240 (2011).
- Palchesko, R. N., Zhang, L., Sun, Y., Feinberg, A. W. Development of Polydimethylsiloxane Substrates with Tunable Elastic Modulus to Study Cell Mechanobiology in Muscle and Nerve. PLoS ONE. 7, e51499 (2012).
- Herrick, W. G., Nguyen, T. V., Sleiman, M., McRae, S., Emrick, T. S., Peyton, S. R. PEG-Phosphorylcholine hydrogels as tunable and versatile platforms for mechanobiology. Biomacromolecules. 14, 2294-2304 (2013).
- Versaevel, M., Grevesse, T., Riaz, M., Lantoine, J., Gabriele, S. Micropatterning hydroxy-PAAm hydrogels and sylgard 184 silicone elastomers with tunable elastic moduli. Methods in Cell Biology. 121, 33-48 (2014).
- Kandow, C. E., Georges, P. C., Janmey, P. A., Beningo, K. A. Polyacrylamide hydrogels for cell mechanics: steps towards optimization and alternative uses. Methods Cell Biol. 83, 29-46 (2007).
- Hemphill, M. A., et al. A possible role for integrin signaling in diffuse axonal injury. PLoS ONE. 6 (7), e22899 (2011).
- Damljanovic, V., Lagerholm, B. C., Jacobson, K. Bulk and micropatterned conjugation of extracellular matrix proteins to characterized polyacrylamide substrates for cell mechanotransduction assays. BioTechniques. 39 (6), 847-851 (2005).
- Hynd, M. R., Frampton, J. P., Dowell-Mesfin, N., Turner, J. N., Shain, W. Directed cell growth on protein-functionalized hydrogel surfaces. Journal of Neuroscience Methods. 162, 255-263 (2007).
- Tseng, Q., et al. new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab Chip. 11 (13), 2231-2240 (2011).
- Versaevel, M., Grevesse, T., Gabriele, S. Spatial coordination between cell and nuclear shape within micropatterned endothelial cells. Nat. Commun. 3, 671 (2012).
- Versaevel, M., Grevesse, T., Riaz, M., Gabriele, S. Cell Confinement: Putting the squeeze on the nucleus. Soft Matter. 9, 6665-6676 (2013).
- Trappman, B., Chen, C. S. How cells sense extracellular matrix stiffness: a material's perspective. Current Opinion in Biotechnology. 24, 1-6 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten