Method Article
Измерение и вакуолярных Цитозольные рН
В этой статье
Резюме
Вакуоли и цитозольных рН может быть измерена в живых дрожжей ( С. CEREVISIAE) При использовании логометрического флуоресцентных красителей локализованы в конкретных клеточных компартментах. Опишем процедуры измерения рН вакуоли с BCECF-AM, который локализуется в вакуоль у дрожжей и цитозольных рН с цитозольного логометрических рН-чувствительных GFP (дрожжи pHluorin).
Аннотация
Вакуоли и цитозольных рН строго регулируется в клетках дрожжей и занимают центральную роль в гомеостазе общий рН. Мы описываем протоколы для радиометрические измерения рН в естественных условиях использования рН-чувствительных флуорофорам локализован в вакуоль или цитозоль. Вакуоли рН измеряли с использованием BCECF, который локализуется в вакуоль в дрожжах при введении в клетки в ацетоксиметил форме сложного эфира. Цитозольного рН измеряли с помощью рН-чувствительных GFP экспрессировался под контролем промотора, дрожжи, дрожжевой pHluorin. Методы измерения флуоресценции соотношений в дрожжевой клетке суспензий на флуориметре описаны. С помощью этих протоколов, один момент времени измерения рН в разных условиях и в разных мутантов дрожжей сравнением и изменения рН в течение долгого времени был проведен мониторинг. Эти методы также были адаптированы к флуоресцентным планшет-ридере формат высокой пропускной экспериментов. Преимущества радиометрические измерения рН по сравнению с другими APподходы используются в настоящее время, потенциальные экспериментальные проблемы и решения, а также перспективы для будущего использования этих методов также описаны.
Введение
рН гомеостаза является динамичной и строго регулируется процесс во всех 1,2 организмов. Биохимические процессы жестко регулируется рН и внутриклеточной среды настроены на узких диапазонах рН для оптимальной деятельности резидента ферментов. Однако гомеостаз внутриклеточного рН может быть оспорена быстрых изменений в рН среды, метаболические сдвиги, и определенные сигнальные пути. Кроме того, внутриклеточный рН сам по себе может служить в качестве важного сигнала. Наконец, многие органеллы поддержания просвета значениях рН, которые отличаются от окружающих цитозоль и необходимым для органелл конкретных функций.
Дрожжей Saccharomyces CEREVISIAE акций ряда рН гомеостаза механизмов высших эукариот 2. В кислой органелл эндоцитические / лизосомальных пути, рН главным образом управляется высоко консервативны вакуоли протон-АТФазы транслокации (V-АТФазы), действующее совместно с многими валеюрт зависит от рН градиента. Все эукариотической клетки также имеют механизмы протонной экспорт. В грибов и растений, второй, отличный протонного насоса в плазматической мембране, Pma1, экспорт метаболический протонов и, как полагают, основным фактором, определяющим цитозольного рН и потенциала плазматической мембране. Генетической гибкости С. CEREVISIAE и его коммерческой важности, сделали его очень интересной и важной моделью для изучения рН гомеостаза 2.
Помимо того, что главной движущей силой в подкисления органелл, V-АТФазы строго регулируется ферментами и наша лаборатория заинтересован в понимании механизмов V-АТФазы регулирования. Для достижения этой цели мы используем в естественных условиях измерения рН и вакуолярных цитозольные рН: 1) для контроля реакции на меняющийся внеклеточной условия, такие как глюкоза и лишения readdition, 2) для изучения влияния мутаций, что компромисс V-АТФазы, и 3) изучить координатахдинация органелл и плазматической мембраной протонного насоса 3-5. Эти эксперименты только стало возможным благодаря разработке надежных радиометрические показатели рН поддается использовать в клетках дрожжей. . Растений и др. впервые показали, что BCECF (2'7'-бис-(2-карбоксиэтил) -5 - (и 6)-карбоксифлуоресцеина), который широко используется для измерения цитозольного рН в клетках млекопитающих, накапливается в дрожжевой вакуоль вместо цитозоле 6. Это различие в локализации BCECF было обусловлено многими гидролитических ферментов в вакуоль, которые, вероятно, ответственных за отщеплению ацетокси-метиловый эфир из BCECF-AM (ацетоксиметил эфира BCECF) и вакуоли удержания 6. Али и др.. 7 дальнейшее развитие вакуолярных измерения рН с использованием BCECF и адаптировать этих измерений флуоресценции формате ридере. Brett соавт. Введены дрожжи pHluorin в качестве средства измерения цитозольного рН в дрожжах путем экспрессии плазмиды Гatiometric рН-чувствительных 8 GFP под контролем дрожжевого промотора 9.
Спектры возбуждения и BCECF и дрожжей pHluorin чувствительные к рН, поэтому они используются в качестве логометрических показатели рН, в которой отношение флуоресценции при возбуждении двух длинах волн, измеренные при одной длине волны излучения, обеспечивает измерение рН 8,10. Эти дрожжи вакуолярных и цитозольные датчики рН были использованы как для одноклеточных и популяционном уровнях измерений. Одноклеточные измерений 6,11 выполняются с помощью флуоресцентной микроскопии и анализа изображений. Вакуоли или цитозольных флуоресценции при двух длинах волн измеряют для каждой ячейки. Населения на основе измерения выполняются в любом планшетного флуоресценции с соответствующими возможностями или в флуориметра. В целом, мы сделали наши измерения на флуориметре, потому что она обеспечивает легкий доступ для добавления компонентов, таких как глюкоза во Conнепрерывный кинетических измерений. Наши текущие протоколы лаборатории для измерения и вакуолярных цитозольные рН перечислены ниже, оба они являются также легко адаптируется к микропланшет анализов.
протокол
1. Измерение рН вакуолярных In Vivo Использование BCECF-AM
- Grow 50 мл жидкой культуры штамма дрожжей должна быть измерена в нужном среде в течение ночи. Цель состоит в том, чтобы иметь клеток в середине логарифмической фазы (OD 600 (оптическая плотность при 600 нм) измерение примерно 0,8 суспензии).
- Гранул дрожжевые клетки центрифугированием. Ресуспендируют осадок в 0,6 мл среды роста и передачи в микроцентрифужных трубки, которая была предварительно взвешенный. Осаждения клеток снова в микроцентрифужных при 2000 мкг в течение 60 сек. Удалить супернатант настолько полно, насколько это возможно, и затем взвесить осадок клеток. Ресуспендируют гранул в конечную плотность 0,5 г / мл (вес / объем); культуры этого объема дает осадок клеток около 200 мг и 200 мкл буфера будут добавлены с получением конечного объема 400 мкл.
- Добавить BCECF-AM к клеточной суспензии до конечной концентрации 50 мМ в 12 мМ подготовлены в ДМСО. Хорошо перемешать и затем вклUbate клетки при 30 ° С в течение 30 мин. на платформе качалки или каток.
- В то время как клетки инкубации, готовят калибровки буферов. Калибровка буфер содержит 50 мМ MES (2 - (N-морфолино) этансульфоновой кислоты), 50 мМ HEPES (4 - (2-гидроксиэтил)-1-пиперазин-кислота), 50 мМ KCl, 50 мМ NaCl, 0,2 М ацетата аммония 10 мМ азида натрия и 10 мМ 2-дезоксиглюкозы, и доводят до значения рН подходит для вашей калибровки диапазона с NaOH или HCl. (Внимание: азид натрия обладает высокой токсичностью и должны использоваться с осторожностью.) Для измерения рН в клетках дикого типа, мы бы подготовить несколько калибровочных смесей при рН от 5,5 до 6,5, но для мутантов Ожидается, что более щелочной рН вакуолярных ( VMA мутанты), мы хотели бы подготовить дополнительные, более высокие буферы рН.
- Аликвотные 2 мл калибровки буфера для каждого рН в 15 мл конические пробирки и добавить монензином (15 мМ) и нигерицина (2 мМ), с получением конечной концентрации 110 мкМ монензином и 15 мкМ нигерицина, гespectively. Хорошо перемешайте на вихревой смеситель. (Внимание: Обе монензином и нигерицина токсичны и должны использоваться с осторожностью.)
- Когда BCECF-AM инкубационного периода завершен, гранулы суспензии клеток путем центрифугирования в течение 30 сек при 2000 х г в микроцентрифуге. Ресуспендируют клеток в 1 мл ростовой среде, не содержащей глюкозу и центрифуги, как описано выше. Повторите этот шаг мыть один раз, а затем ресуспендируют осадок в 200 мкл питательной среде без глюкозы. Место на льду.
- Добавить 20 мкл клеточной суспензии в каждую пробирку рН калибровки, полученный выше. Инкубируют при 30 ° С в течение 30-60 мин. на каток.
- Установите флуориметра поочередно проводить измерения при возбуждении длиной волны 450 нм и 490 нм, как с длиной волны излучения 535 нм. Установите температуру камеры для образца до 30 ° C. Выполнение всех измерений при непрерывном перемешивании смеси в кювете.
- Добавить 1,96 мл 1 мМ MES (до рН 5 или 7 в зависимости от рН клеток ростовой средего экспериментального проектирования). Добавить 20 мкл клеточной суспензии в кювете. Инициировать флуоресцентных измерений. Мы собираем как непрерывной, так и кинетического момента времени данные в различных экспериментах. Для непрерывного кинетические данные, мы берем измерений каждые 6 секунд в течение 5 мин, затем добавить глюкозы до конечной концентрации глюкозы 50 ммоль, и продолжить измерения в течение 5-10 мин. Для одной временной точке измерений, мы в целом проводить измерения на 1 и 5 мин. после добавления клеток в кювете, добавляют глюкоза, как и в кинетических измерений, а затем еще одно измерение, 5 мин. После того глюкозы. Эти добавки можно варьировать, а также дополнительные компоненты (ингибиторы и т.д.) также могут быть добавлены.
- После экспериментального измерения завершены, снимите калибровочный трубки от 30 ° C инкубации и передать весь объемом 2 мл для каждого к флуориметра кюветы. Измерение флуоресценции в то же параметры (см. 1.8) каждые 5 секунд в течение в общей сложности 30 сек для каждого образца.
- Экспорт данных флуоресценции в Microsoft Excel. (Для нашего флуориметр, это требует экспорта данных в виде текста в табуляции форму и импорта в Excel.) Получение калибровочной кривой путем расчета отношения флуоресценции при 490 нм до 450 нм для каждой калибровочной смеси. Флуоресценции соотношение Затем строили график зависимости от рН для получения калибровочной кривой.
- Преобразование экспериментальных данных флуоресценции и вычислить соотношение рН с использованием стандартной кривой. Вакуоли рН может затем в зависимости от времени (кинетику изменения рН), или по сравнению при различных условиях (рис. 1) или в различных мутантных штаммов.
2. Измерение цитозольного рН In Vivo Использование дрожжей pHluorin
- Преобразование нужный штамм дрожжей с дрожжами pHluorin плазмиды с помощью стандартных протоколов и выбора трансформантов на дополненный минимальной среде, не содержащей урацил (SC-урацил).
- Grow 50 мл жидкой культуры трансформированных клеток в SC-урацил до середины логарифмической фазы (OD 600 = 0,8 или ниже).
- Подготовка калибровочных стандартов, как описано для вакуолярных рН, но буфер рН подходит для измерения рН цитозольные, вообще рН 6-8. Аликвотные 2 мл калибровки буфера доводят до желаемого рН в несколько 15 мл конические пробирки. Добавить монензином и нигерицина, как описано выше (1.4) и хорошо перемешать.
- Урожай клетки центрифугированием, как описано выше, и ресуспендируют осадок в 600 мкл среды роста. Трансфер в микроцентрифужные весил трубку и осаждения клеток путем центрифугирования при 5000 оборотов в минуту в течение 30 сек. Ресуспендируют осадок в 1 мл ростовой среды без глюкозы (SC-урацил-глюкоза), осаждения клеток и повторить. После последнего центрифугирования, удалить супернатант как можно тщательнее и весят осадок клеток. Ресуспендируют клеток в конечной плотностью 0,5 г / мл в SC-урацил, без глюкозы.
- Добавьте 20 мкл клеточной суспензии в каждую пробирку калибровки буфера и хорошо перемешать на вортексе. Выдержите на 30 ° С на вращающийся барабанный ротор в течение 60 мин.
- Настройка флуориметра для возбуждения на длинах волн 405 и 485 нм и длине волны излучения 508 нм. Продолжайте одной точке времени или кинетических измерений и добавлением глюкозы, как описано выше для измерения BCECF.
- Измерение флуоресценции калибровочных образцов и построить калибровочный график, для BCECF (см. 1.10-1.11). Участок флуоресценции соотношении от рН линейна в диапазоне наиболее цитозольного измерения рН (рН 6,0-8,0) 9, так что экспериментальные измерения флуоресценции соотношение легко превращаются в рН.
Результаты
1 приведены данные вакуоли рН полученных на дрожжей дикого типа клеток, выращенных в обогащенной среде (дрожжевой экстракт-пептон-декстраном; YEPD), забуференном до рН 5 с помощью 50 мМ MES. Мы часто выращивать клетки в буферной среде, поскольку рН среды может резко измениться в течение ночи роста, в частности на минимальной среде, и было обнаружено, что величина рН питательной среды может повлиять вакуоли ответов рН 3. Тем не менее, это также приемлемо для многих экспериментов расти клеткам в небуферизованный среды. Фиг.1А показывает калибровочную кривую для клетки, инкубированные с BCECF-AM протоколом выше. Хотя отношения между BCECF флуоресценции соотношение и вакуоли рН является нелинейным в более широком диапазоне рН 7, это практически линейной в соответствующем диапазоне для этих экспериментальных измерений, и линейный тренд показан и используются для расчета значений рН в течение всего эксперимента. Вакуолярных изменения рН в результате GLucose дополнение к глюкозе лишенных клетки показано на фиг.1В. Вакуоли увеличивается рН во время BCECF-AM маркировки потому что клетки лишены глюкозы, но уменьшается после readdition глюкозы, по-видимому, в результате V-АТФазы активации через сборку 3,4. Небольшое увеличение вакуоли рН наблюдается при добавлении 50 мМ KCl, через три минуты после того глюкозы. В более крупном исследовании мы обычно работают не менее трех независимых экспериментах (биологических повторяет) и показать средний рН ± SE для каждого условия 3-5.
Кинетика цитозольного изменение рН с глюкозой Кроме того, показаны на рисунке 2. В этом эксперименте клетки дикого типа дрожжей выращивали в синтетической полной среде, не содержащей урацил (SC-урацил), забуференный до рН 5 с помощью 50 мМ MES. Эта среда является подходящей для поддержания плазмиды, содержащей phluorin дрожжей под контролем фосфоглицераткиназы (PGK), промоторкоторый мы использовали недавно 3,5; другие плазмиды могут требовать различных выбора условий. Калибровочной кривой (фиг. 2A) показывает, что радиометрические реакции pHluorin до рН линейна в широком диапазоне рН, как правило, охватывают любые физиологически значимых цитозольного рН. В ответ на это клетки дикого типа, показанный здесь, очень характерно, происходит немедленное снижение рН с последующим увеличением до рН 7,2-7,4.
Построены калибровочные кривые для каждого штамма и в каждом эксперименте. Мы используем смесь на месте калибровки описывается Бретт соавт. 9 как для BCECF и pHluorin измерений. Эта смесь включает проникающий в клетку ацетата аммония способны рушится градиентов рН в нескольких мембран, азид натрия и дезоксиглюкозы остановить производство АТФ и ингибируют Н +-насосов и монензином и нигерицин ионофоры вовлечен в распад градиентов рН в секреторных дрожжей / переменного токаuolar путей переноса 12 и внутренней мембране митохондрий 13 соответственно. Стоит отметить, что мы не вычитаем фоновое значение для немеченой клеток для вакуолярных или цитозольные измерения рН. Хотя клетки имеют некоторые внутренние флуоресценции, мы напрямую сравнивать измерения рН с и без фоне коррекции на калибровку и опытные образцы и не видел никакой разницы в конечные значения. Вычитание фона приведет к крутой кривой калибровки, а также может быть желательным в условиях, когда сигналы флуоресценции, являются низкими и отношение сигнал-шум становится проблемой. Например, при измерении от Гольджи / эндосома локализованных pHluorin 5, которая дает более низкий общий сигнал, мы сделали вычитания фона сигнал от всех измерений.
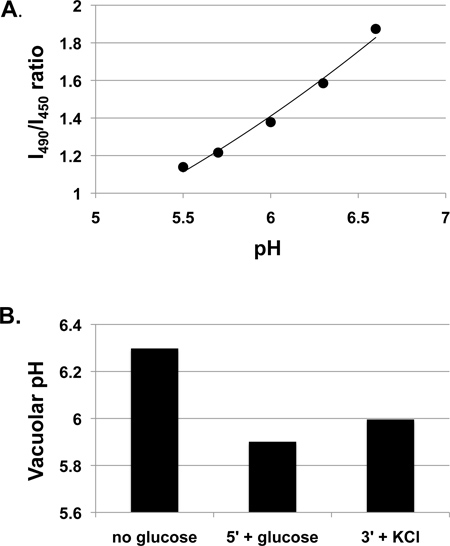
Рисунок 1. MeasurВЫРАЖЕНИЕ вакуолярных ответов рН в клетках дикого типа, выращенных в YEPD, рН 5. дикого типа (SF838-5Aα) Клетки выращивали до середины логарифмической фазы, а затем инкубировали с BCECF-AM, как описано выше. А. Калибровочная кривая показывает измеренные Отношение интенсивности флуоресценции при возбуждении при 490 нм (I490) с интенсивностью от возбуждение при 450 нм (I450) (оба измеряли при длине волны эмиссии 535 нм) при различных рН. Линейный тренда показана. B. вакуоли рН после краткого лишение глюкозы измеряли в части то же самое, обозначенный клеточной суспензии (без глюкозы). Глюкозу добавляли до конечной концентрации 50 мМ и флуоресценции соотношение измеряли после 5 мин (5 '+ глюкозы). 50 мМ KCl, затем добавляют и отношение флуоресценции измеряли через 3 мин и преобразуется в значение рН (3 '+ KCl).

Рисунок 2. Кинетика цитosolic ответ рН до глюкозы того, в клетках дикого типа. дикого типа клетки трансформировали дрожжевой pHluorin под контролем фосфоглицераткиназы (PGK) промотор и трансформанты культивировали, как описано выше. А. Калибровочная кривая показывает измеренное отношение интенсивности флуоресценции при 405 нм (I405) с интенсивностью при 485 нм (i485) от рН. B. Цитозольные рН была получена из измерений интенсивности флуоресценции каждые 6 сек. в течение 6 мин. Глюкоза (50 мМ конечной) добавляли к клеткам в кювете в указанное время.
Обсуждение
Мы использовали эти протоколы для решения ряда аспектов рН гомеостаза. Например, мы сравнивали цитозольного и рН реакции дикого типа и V-АТФазы с дефицитом мутантных клеток 4,5. Мы также исследовали влияние изменившихся условий роста, в частности рН внеклеточной, на вакуолярных ответа рН до глюкозы 3. Важно отметить, что ответы, которые мы наблюдаем оба согласуются с другими методами количественного измерения рН и с биохимическими данными, описывающими измененных деятельностью протонного насоса.
Два наиболее важных особенностей типа в естественных условиях измерения рН, описанные здесь, локализацию флуорофора и уровень сигнала, проблемы с любой из этих требуют модификации метода для конкретного приложения или мутанта. Вакуоли локализации BCECF несколько случайным 6, но сохраняется в ряде различных мутантов, в том числеVMA мутанты 4, которые снизили уровни вакуолярных гидролаз. Дрожжи вакуолей легко визуализируются под микроскопом Номарского оптика, и мы подтверждаем вакуолярных локализации красителя для каждого штамма. pHluorin более универсален, как датчик рН, особенно учитывая его способность реагировать на большей части физиологическом интервале рН (фиг. 2А). PHluorin дрожжей, которые мы использовали, кажется, исключительно цитозольные, предположительно потому, что ему не хватает других целевую информацию. Тем не менее, pHluorin была ориентирована в аппарат Гольджи, помечая с последовательностями из транспортер Гольджи хлорид Gef1, вместе с дополнительной вставки мембраны сегментов из halorhodopsin дать правильный топологии (рН Gef1; 14). Orij соавт. Успешно целевых pHluorin в митохондриях и измерили митохондриальных изменений рН с метаболизмом 15. Эти результаты показывают, что правильно спроектированная слитые белки могут сделать его ко возможноLe контролировать рН ответов во многих органелл. Уровень сигнал-шум вакуолярных BCECF достаточно высок в большинстве штаммов дрожжей, которые мы рассмотрели. Сигнал от белков выразил pHluorin можно манипулировать с помощью управляемой промотором pHluorin выражения. В оригинальной конструкции цитозольные pHluorin 9, выражение было обусловлено тепловым шоком, содержащего элемент промоутер и не была очень высокой. Однако позже экспрессирующих конструкций из PGK промотор, TEF1 промотор и промотор актина видимому, дают более высокие уровни экспрессии 3,15,16. Гольджи конкретных pHluorin рН Gef1 выражается с индуцируемым промотором 14. Переходная индукция экспрессии может быть особенно полезно для небольших отсеков секреторную и эндоцитотический путей, где устойчивый высокий уровень экспрессии может привести к неправильной локализации pHluorin или даже возмущения в отсеке рН, проявляются через медленный рост или неправильная локализация других белков.
<р = класса "jove_content"> В дополнение к характеристикам флуорофоров, важно понимать, что в естественных условиях измерения рН, чувствительных к росту и метаболических условиях дрожжевые клетки сами. Эта чувствительность физиологически значимых и потенциально интересных, но может также быть источником изменчивости между измерениями. Мы заботимся, чтобы сравнить измерений из дрожжевых клеток в той же фазе роста, как правило, с начала до середины логарифмической фазы. Так как вакуоли ответов рН может быть чувствительным к внеклеточный рН 3, контролировать рН питательной среды, особенно для клеток, выращенных в небуферизованный среды. Хотя очевидно, что многие различные питательные среды, совместимые с радиометрические измерения рН, различия в состав среды может определенно повлиять рН 17. Кроме того, после того, как клетки собирают и подготовлены для измерения, мы обнаружили, что длительное лишение глюкозы (часов) не только снижает начальную цитosolic рН и увеличивает начальную вакуоли рН, но и значительно снижает ответ на глюкозу. Таким образом, мы, как правило начать эксперименты в течение 30 мин. или менее начала глюкозы лишений.Накопление флуоресцентного лизосомотропный амины, такие как Акрихин и акридиноранжа, широко используется для оценки отсеке подкисления в живых клетках дрожжей. Эти методы являются быстрый и простой, но следует рассматривать как более качественный, чем радиометрический измерений рН. В общем, методы, такие как акрихина поглощение полагаться на проницаемость мембраны из основной формы флуорофора, которые становятся захваченными когда она протонированные в кислой отсека и могут быть визуализированы под флуоресцентным микроскопом 18. Накопление красителя зависит от разбиения в соответствии с градиентом рН на мембране, так что поглощение в кислой органеллы могут быть ослаблены или подщелачивание органелл или acidificatiна в цитозоле. Эти методы будут оставаться полезными, но, вероятно, следует интерпретировать как обеспечение относительного уровня подкисления.
Применения логометрических флуоресцентные измерения рН в дрожжах продолжать расширяться. Бретт и соавт. Последнее измеренное вакуолярных рН в коллекции из более чем 4500 несущественные мутантов дрожжей удаления и обнаружила ряд новых механизмов регулирования рН 17. BCECF и pHluorin 19,20 также были адаптированы к флуоресцентно-активированном клеточном сортировка формат для облегчения скрининга новых V-АТФазы. Dechant соавт. Микрофлюидики 11 использовали в сочетании с флуоресцентной микроскопии для контроля V-АТФазы сборки и цитозольные рН одновременно через несколько циклов лишения глюкозы и readdition. Эти результаты показывают, что радиометрические измерения рН в дрожжах являются достаточно надежными и универсальными для применения во многих типах экспериментов.
Раскрытие информации
Авторы не имеют конфликта интересов раскрывать.
Благодарности
Эта работа была поддержана NIH R01 GM50322 в PM Кейна. Авторы благодарят доктора Раджини Рао, Университет Джона Хопкинса за предоставление дрожжей pHluorin плазмид и для рекомендаций по радиометрические измерения рН, и д-р Глория А. Мартинес Муньос для разработки этих протоколов для нашей лаборатории.
Материалы
| Name | Company | Catalog Number | Comments |
| Spectrofluorometer | Horiba Jobin Yvon | Model Fluoromax-4 | Temperature control and stirring capability are desirable. |
| BCECF-AM | Invitrogen/Molecular Probes | B1150 | Prepare a 12 mM stock in dry DMSO, store as aliquots at -20 °C |
| monensin | Sigma | M5273 | Toxic. |
| nigericin | Sigma | N7143 | Toxic. |
| MES | Sigma | M8250 |
Ссылки
- Casey, J. R., Grinstein, S., Orlowski, J. Sensors and regulators of intracellular pH. Nat. Rev. Mol. Cell Biol. 11, 50-61 (2010).
- Orij, R., Brul, S., Smits, G. J. Intracellular pH is a tightly controlled signal in yeast. Biochim. Biophys. Acta. 1810, 933-944 (2011).
- Diakov, T. T., Kane, P. M. Regulation of vacuolar proton-translocating ATPase activity and assembly by extracellular pH. J. Biol. Chem. 285, 23771-23778 (2010).
- Martinez-Munoz, G. A., Kane, P. Vacuolar and plasma membrane proton pumps collaborate to achieve cytosolic pH homeostasis in yeast. J. Biol. Chem. 283, 20309-20319 (2008).
- Tarsio, M., Zheng, H., Smardon, A. M., Martinez-Munoz, G. A., Kane, P. M. Consequences of loss of Vph1 protein-containing vacuolar ATPases (V-ATPases) for overall cellular pH homeostasis. J. Biol. Chem. 286, 28089-28096 (2011).
- Plant, P. J., Manolson, M. F., Grinstein, S., Demaurex, N. Alternative mechanisms of vacuolar acidification in H(+)-ATPase-deficient yeast. J. Biol. Chem. 274, 37270-37279 (1999).
- Ali, R., Brett, C. L., Mukherjee, S., Rao, R. Inhibition of sodium/proton exchange by a Rab-GTPase-activating protein regulates endosomal traffic in yeast. J. Biol. Chem. 279, 4498-4506 (2004).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Brett, C. L., Tukaye, D. N., Mukherjee, S., Rao, R. The yeast endosomal Na+K+/H+ exchanger Nhx1 regulates cellular pH to control vesicle trafficking. Mol. Biol. Cell. 16, 1396-1405 (2005).
- Owen, C. S. Comparison of spectrum-shifting intracellular pH probes 5'(and 6')-carboxy-10-dimethylamino-3-hydroxyspiro[7H-benzo[c]xanthene-7, 1'(3'H)-isobenzofuran]-3'-one and 2',7'-biscarboxyethyl-5(and 6)-carboxyfluorescein. Anal. Biochem. 204, 65-71 (1992).
- Dechant, R., et al. Cytosolic pH is a second messenger for glucose and regulates the PKA pathway through V-ATPase. Embo J. 29, 2515-2526 (2010).
- Gustavsson, M., Barmark, G., Larsson, J., Muren, E., Ronne, H. Functional genomics of monensin sensitivity in yeast: implications for post-Golgi traffic and vacuolar H+-ATPase function. Mol. Genet. Genomics. 280, 233-248 (2008).
- Kovac, L., Bohmerova, E., Butko, P. Ionophores and intact cells. I. Valinomycin and nigericin act preferentially on mitochondria and not on the plasma membrane of Saccharomyces cerevisiae. Biochim. Biophys. Acta. 721, 341-348 (1982).
- Braun, N. A., Morgan, B., Dick, T. P., Schwappach, B. The yeast CLC protein counteracts vesicular acidification during iron starvation. J. Cell Sci. 123, 2342-2350 (2010).
- Orij, R., Postmus, J., Beek, T. er, Brul, A., S,, Smits, G. J. In vivo measurement of cytosolic and mitochondrial pH using a pH-sensitive GFP derivative in Saccharomyces cerevisiae reveals a relation between intracellular pH and growth. Microbiology. 155, 268-278 (2009).
- Zhang, Y. Q., et al. Requirement for ergosterol in V-ATPase function underlies antifungal activity of azole drugs. PLoS Pathog. 6, e1000939(2010).
- Brett, C. L., et al. Genome-wide analysis reveals the vacuolar pH-stat of Saccharomyces cerevisiae. PLoS One. 6, e17619(2011).
- Roberts, C. J., Raymond, C. K., Yamashiro, C. T., Stevens, T. H. Methods for studying the yeast vacuole. Methods Enzymol. 194, 644-661 (1991).
- Chan, C. Y., et al. Inhibitors of V-ATPase proton transport reveal uncoupling functions of tether linking cytosolic and membrane domains of V0 subunit a (Vph1p). J. Biol. Chem. 287, 10236-10250 (2012).
- Johnson, R. M., et al. Identification of inhibitors of vacuolar proton-translocating ATPase pumps in yeast by high-throughput screening flow cytometry. Anal. Biochem. 398, 203-211 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены