Method Article
Mesure du pH vacuolaire et cytosolique
Dans cet article
Résumé
PH vacuolaire et cytosolique peut être mesurée en levures vivantes ( S. cerevisiae) Cellules en utilisant des colorants fluorescents ratiométriques localisés dans des compartiments cellulaires spécifiques. Nous décrivons les procédures pour mesurer le pH vacuolaire avec BCECF-AM, qui se localise dans la vacuole de la levure, et le pH cytosolique avec une GFP sensible au pH quotientométrique cytosolique (levure pHluorin).
Résumé
Vacuolar et pH cytosolique sont très réglementés dans les cellules de levure et d'occuper un rôle central dans l'homéostasie globale du pH. Nous décrivons les protocoles de mesure radiométrique de pH in vivo en utilisant des fluorophores sensibles au pH localisés dans la vacuole ou cytosol. PH vacuolaire est mesurée en utilisant BCECF, qui se localise dans la vacuole dans la levure lors de son introduction dans les cellules, sous sa forme d'ester d'acétoxyméthyle. PH cytosolique est mesuré avec une GFP sensible au pH exprimé sous le contrôle d'un promoteur de levure, la levure pHluorin. Les méthodes de mesure des ratios de fluorescence dans des suspensions de cellules de levure dans un fluorimètre sont décrits. Grâce à ces protocoles, des mesures ponctuelles de temps simples de pH dans des conditions différentes ou dans différents mutants de levure ont été comparées et les variations de pH au cours du temps ont été surveillés. Ces méthodes ont également été adaptés au format du lecteur de plaque à fluorescence pour des expériences à haut débit. Avantages de mesures de pH ratiométriques par rapport aux autres apapproches en cours d'utilisation, les problèmes potentiels et les solutions expérimentales, et les perspectives pour le futur usage de ces techniques sont également décrites.
Introduction
homéostasie du pH est un processus dynamique et très réglementé dans tous les organismes 1,2. Processus biochimiques sont strictement réglementées par le pH et les environnements intracellulaires sont accordés sur des gammes de pH étroite pour permettre une activité optimale des enzymes résidentes. Cependant, l'homéostasie du pH intracellulaire peut être contestée par des changements rapides dans l'environnement pH, les changements métaboliques et certaines voies de signalisation. En outre, le pH intracellulaire peut se servir comme un signal important. Enfin, de nombreux organites maintenir des valeurs de pH luminales qui sont distincts du cytosol environnante et indispensable au bon fonctionnement des organites spécifiques.
Saccharomyces cerevisiae actions d'un certain nombre de mécanismes d'homéostasie du pH avec eucaryotes supérieurs 2. Dans les organites acides de la voie d'endocytose / lysosomale, le pH est principalement contrôlée par l'ATPase vacuolaire translocation de protons hautement conservée (V-ATPase), agissant de concert avec de nombreux échangers dépendant du gradient de pH. Toutes les cellules eucaryotes ont aussi des mécanismes d'exportation de protons. Chez les champignons et les plantes, une seconde, la pompe à protons distinct à la membrane plasmique, PMA1, les exportations protons métaboliques et l'on croit être le déterminant majeur de pH cytosolique et du potentiel de membrane plasmique. La flexibilité génétique de S. cerevisiae et son importance commerciale, en ont fait un modèle très intéressant et important pour l'étude de l'homéostasie du pH 2.
En plus d'être les principaux moteurs de organite acidification, V-ATPase sont très réglementés et enzymes de notre laboratoire s'intéresse aux mécanismes de régulation V-ATPase comprendre. Pour atteindre cet objectif, nous avons eu recours à des mesures de pH in vivo de pH vacuolaire et cytosolique: 1) suivre les réponses à l'évolution des conditions extracellulaires, comme la privation de glucose et readdition, 2) d'examiner les effets des mutations qui compromettent l'activité V-ATPase, et 3) d'explorer la coornation des organelles et la membrane plasmique pompes à protons 3-5. Ces expériences ne sont devenus possibles grâce à l'élaboration d'indicateurs de pH ratiométriques robustes qui se prêtent à utiliser dans les cellules de levure. . Plant et al ont d'abord montré que BCECF (2'7'-bis-(2-carboxyéthyl) -5 - (et 6)-carboxyfluorescéine), qui a été largement utilisé pour mesurer le pH cytosolique dans les cellules de mammifères, s'accumule dans la vacuole de la levure au lieu de le cytosol 6. Cette différence de BCECF localisation a été attribué aux nombreuses enzymes hydrolytiques dans la vacuole, qui sont susceptibles responsable du clivage de l'ester méthylique de BCECF acétoxy-AM (ester acétoxyméthylique de BCECF) et vacuolaire rétention 6. Ali et al. 7 développées mesure du pH vacuolaire utilisant BCECF et adapté ces mesures à un format de lecteur de plaques à fluorescence. Brett et al. Introduit pHluorin de levure en tant que moyen de mesure du pH cytosolique dans la levure par l'expression d'un r plasmidiqueatiometric GFP sensible au pH 8 sous le contrôle d'un promoteur spécifique de levure 9.
Les spectres d'excitation des deux BCECF et la levure pHluorin sont sensibles au pH, si elles sont utilisées comme indicateurs de pH ratiométriques dans lequel le rapport de fluorescence à deux longueurs d'onde d'excitation, mesurée à une longueur d'onde d'émission, fournit une mesure de pH 8,10. Ces levures capteurs de pH vacuolaire et cytosolique ont été utilisées pour les deux mesures unicellulaires et basée sur la population. Mesures monocellulaires 6,11 sont réalisées par microscopie à fluorescence et une analyse d'image. Fluorescence vacuolaire ou cytosolique à deux longueurs d'onde est mesurée pour chaque cellule. Les mesures basées sur la population sont réalisées soit dans un lecteur de microplaques avec des capacités de fluorescence appropriés ou dans un fluorimètre. Nous avons généralement fait nos mesures dans un fluorimètre, car il permet un accès facile pour l'ajout d'éléments tels que le glucose au cours de conmesures cinétiques continue. Nos protocoles de laboratoire courants pour la mesure du pH vacuolaire et cytosolique sont énumérés ci-dessous, les deux sont également facilement adapté aux essais en microplaques.
Protocole
1. Mesure du pH Vacuolar in vivo en utilisant BCECF-AM
- Cultiver une culture liquide de 50 ml de la souche de levure à mesurer dans le milieu souhaité pendant une nuit. L'objectif est d'avoir des cellules en phase mi-log (DO600 (densité optique à 600 nm) d'environ 0,8 pour la suspension).
- Pellet les cellules de levure par centrifugation. Reprendre le culot dans 0,6 ml de milieu de croissance et la transférer dans un tube de centrifugation qui a été pesé antérieurement. Pellet les cellules à nouveau dans un centrifuger à 2000 g pendant 60 sec. Eliminer le surnageant aussi complètement que possible, puis peser le culot cellulaire. Reprendre le culot à une densité finale de 0,5 g / ml (p / v), une culture de ce volume va donner un culot cellulaire d'environ 200 mg, et 200 pi de tampon seraient ajoutés pour donner un volume final de 400 pl.
- Ajouter BCECF-AM à la suspension de cellules à une concentration finale de 50 mM à partir d'un stock 12 mM préparée dans du DMSO. Bien mélanger puis incUbate les cellules à 30 ° C pendant 30 min. sur une plate-forme à bascule ou le tambour du rouleau.
- Alors que les cellules sont en incubation, préparer des tampons d'étalonnage. Le tampon d'étalonnage contient 50 mM de MES (2 - (N-morpholino) éthanesulfonique), 50 mM de HEPES (4 - (2-hydroxyéthyl)-1-pipérazineéthanesulfonique acide), 50 mM KCl, 50 mM NaCl, 0,2 M d'acétate d'ammonium, 10 mM d'azoture de sodium, et 10 mM de 2-désoxyglucose, et est ajusté au pH valeurs appropriées pour votre gamme d'étalonnage avec NaOH ou HCl. (Attention: L'azoture de sodium est très toxique et doit être manipulé avec soin.) Pour la mesure du pH dans les cellules de type sauvage, nous serions préparer plusieurs mélanges d'étalonnage à pH 5,5 à 6,5, mais pour les mutants devraient avoir un pH vacuolaire plus alcaline ( mutants EGV), nous préparer supplémentaires, des tampons de pH plus élevés.
- Aliquote de 2 ml de tampon d'étalonnage pour chaque pH dans tubes coniques de 15 ml et ajouter monensin (Stock 15 mm) et nigéricine (Stock 2 mM) pour donner des concentrations finales de 110 pm monensin et 15 pm nigéricine, respectively. Mélangez bien sur un vortex. (Attention: les deux monensin et nigéricine sont toxiques et doivent être manipulés avec précaution.)
- Lorsque la durée d'incubation BCECF-AM est terminée, pellet la suspension cellulaire par centrifugation pendant 30 sec à 2000 xg dans une microcentrifugeuse. Resuspendre les cellules est de 1 ml de milieu de croissance dépourvu de glucose et centrifugeuse comme ci-dessus. Répétez cette étape de lavage une fois, puis remettre le culot dans 200 ul de milieu de croissance sans glucose. La place sur la glace.
- Ajouter 20 ul de la suspension cellulaire dans chaque tube d'étalonnage du pH préparé ci-dessus. Incuber à 30 ° C pendant 30-60 min. sur un tambour de rouleau.
- Réglez le fluorimètre pour mesurer en alternance à des longueurs d'onde d'excitation 450 nm et 490 nm, à la fois avec une longueur d'onde d'émission de 535 nm. Réglez la température de la chambre de l'échantillon à 30 ° C. Effectuer toutes les mesures avec une agitation continue du mélange dans la cuvette.
- Ajouter 1,96 ml de 1 mM de MES (ajusté à pH 5 ou 7, selon le pH du milieu de culture des cellules d'une le design expérimental). Ajouter 20 pl de suspension cellulaire dans la cuvette. Initier des mesures de fluorescence. Nous recueillons aussi des données temporelles ponctuelles dans différentes expériences de cinétique et continue. Pour les données cinétiques continues, nous prenons des mesures toutes les 6 sec pendant 5 min, puis ajouter le glucose à une concentration de glucose finale de 50 mM, et continuer mesure pendant 5-10 min. Pour des mesures de temps seul point, nous prenons des mesures généralement à 1 et 5 min. après addition de cellules dans la cuvette, ajouter le glucose comme dans les mesures cinétiques, puis une autre mesure 5 min. après l'addition de glucose. Ces ajouts peuvent être variés, et des composants supplémentaires (inhibiteurs, etc) peuvent également être ajoutés.
- Après les mesures expérimentales sont terminées, retirez les tubes d'étalonnage à partir de la 30 ° C incubation et de transférer la totalité du volume de 2 ml pour chaque dans la cuvette de fluorimètre. Mesurer la fluorescence avec les mêmes paramètres (voir 1.8) toutes les 5 sec sur un total de 30 secondes pour chaque échantillon.
- Exporter des données de fluorescence à Microsoft Excel. (Pour notre fluorimètre, ce qui nécessite l'exportation des données sous forme de texte sous forme délimité par des tabulations et l'importation dans Excel.) D'obtenir une courbe d'étalonnage en calculant le ratio de fluorescence à 490 nm à 450 nm pour chaque mélange d'étalonnage. Le rapport de fluorescence est ensuite tracée en fonction du pH pour obtenir une courbe d'étalonnage.
- Convertir les données expérimentales de rapport de fluorescence et de calculer le pH à l'aide de la courbe standard. PH vacuolaire peut alors en fonction du temps (cinétique de changements de pH) ou par rapport sous diverses conditions (Figure 1) ou dans différentes souches mutantes.
2. Mesure du pH cytosolique in vivo en utilisant pHluorin de levure
- Transformer la souche de levure souhaitée avec la pHluorin de plasmide de levure par des protocoles standard, et sélectionner les transformants sur un minimum sans uracile de milieu supplémenté (SC-uracile).
- Cultiver une culture liquide de 50 ml de cellules transformées dans SC-uracile à la phase mi-log (OD 600 = 0,8 ou plus bas).
- Préparer des normes d'étalonnage comme décrit pour le pH vacuolaire, mais tampon à une plage de pH appropriée pour la mesure du pH cytosolique, généralement pH 8.6. Aliquote de 2 ml de solution d'étalonnage ajusté au pH désiré dans plusieurs tubes coniques de 15 ml. Ajouter monensin et nigéricine comme décrit ci-dessus (1.4) et bien mélanger.
- Récolter les cellules par centrifugation comme décrit ci-dessus, et remettre le culot dans 600 ul du milieu de croissance. Transfert à un tube de pesée, et sédimenter les cellules par centrifugation à 5000 rpm pendant 30 sec. Reprendre le culot dans 1 ml de milieu de croissance sans glucose (SC-uracile,-glucose), sédimenter les cellules et répétez. Après la dernière centrifugation, éliminer le surnageant aussi complètement que possible et peser le culot cellulaire. Resuspendre les cellules à une densité finale de 0,5 g / ml dans du SC-uracile sans glucose.
- Ajouter 20 pl de suspension cellulaire dans chaque tube de tampon d'étalonnage et bien mélanger sur un agitateur vortex. Incuber à 30 ° C sur un rotor de tambour de filage pendant 60 min.
- Mettre en place le fluorimètre pour l'excitation aux longueurs d'onde 405 et 485 nm et une longueur d'onde d'émission de 508 nm. Procéder à un seul point du temps ou des mesures cinétiques et l'ajout de glucose comme décrit ci-dessus pour la mesure BCECF.
- Mesurer la fluorescence d'échantillons d'étalonnage et tracer une courbe d'étalonnage pour BCECF (voir 1.10-1.11). Une parcelle de rapport de fluorescence en fonction du pH est linéaire sur la plage de la plupart des mesures de pH cytosolique (pH 6,0-8,0) 9, la mesure du rapport de fluorescence de manière expérimentale sont facilement convertis au pH.
Résultats
La figure 1 présente les données de pH vacuolaire obtenus sur des cellules de levure de type sauvage cultivées dans un milieu riche (extrait de levure-peptone-dextran; YEPD) tamponnée à pH 5 avec 50 mM MES. Nous cultivons souvent les cellules dans un milieu tamponné parce que le pH du milieu peut changer de façon spectaculaire au cours de la croissance pendant la nuit, surtout pour un milieu minimal, et nous avons constaté que le pH du milieu de croissance peut influencer les réponses de pH vacuolaire 3. Cependant, il est également acceptable pour de nombreuses expériences de cultiver les cellules dans un milieu tampon. Figure 1A montre une courbe d'étalonnage pour les cellules incubées avec BCECF-AM par le protocole ci-dessus. Bien que la relation entre le rapport de fluorescence BCECF et pH vacuolaire est non linéaire dans une gamme de pH large 7, il est presque linéaire dans la plage correspondant à ces mesures expérimentales, et une courbe de tendance linéaire est représentée et utilisée pour calculer des valeurs de pH pour l'expérience. Des changements de pH vacuolaire résultant de glOutre ucose aux cellules le glucose-privés sont présentés dans la figure 1B. PH augmente vacuolaires pendant BCECF-Am étiquettent parce que les cellules sont privées glucose, mais diminue après readdition de glucose, probablement en raison de l'activation V-ATPase par remontage 3,4. Une légère augmentation du pH vacuolaire est observée lors de l'addition de 50 mM de KCl, soit trois minutes après l'addition de glucose. Dans une étude plus vaste, nous courons généralement au moins trois expériences indépendantes (biologiques réplique) et montrons le pH moyen ± écart-type pour chaque état 3-5.
La cinétique de changement de pH cytosolique avec ajout de glucose sont présentés dans la figure 2. Pour cette expérience, les cellules de levure de type sauvage ont été cultivées dans un milieu complet synthétique dépourvu d'uracile (SC-uracile), tamponnée à pH 5 avec 50 mM MES. Ce milieu est approprié pour le maintien du plasmide contenant pHluorin de levure sous le contrôle du promoteur de la phosphoglycérate kinase (PGK),que nous avons utilisé récemment 3,5; autres plasmides peuvent nécessiter des conditions de sélection. La courbe d'étalonnage (figure 2A) montre que la réponse ratiométrique du pHluorin de pH est linéaire sur une large gamme de pH; généralement couvrant toute pH cytosolique physiologiquement pertinent. La réponse des cellules de type sauvage montrées ici est très caractéristique, il ya une diminution immédiate du pH suivie d'une augmentation de pH 7,2-7,4.
Nous construisons des courbes d'étalonnage pour chaque souche et dans chaque expérience. Nous utilisons un mélange de d'étalonnage in situ décrit par Brett et al. 9 pour les deux mesures pHluorin BCECF et. Ce mélange comprend l'acétate d'ammonium cellule-agent de perméation capable de provoquer la désintégration des gradients de pH à travers plusieurs membranes, de l'azoture de sodium et le désoxyglucose pour stopper la production d'ATP et inhibent la H +-pompes, et monensin et nigéricine, ionophores impliquée dans effondrement des gradients de pH dans la levure sécrétoire / VACtransports uolar voies 12 et mitochondrial membrane interne 13, respectivement. Il est à noter que nous n'avons pas soustrait une valeur de fond de cellules non marquées pour les mesures de pH vacuolaire ou cytosolique. Bien que les cellules ont une certaine auto-fluorescence intrinsèque, nous avons comparé directement les mesures de pH avec et sans correction de fond sur les échantillons expérimentaux d'étalonnage et et n'avons constaté aucune différence dans les valeurs finales. Soustraction de fond se traduira par des courbes d'étalonnage plus raides, et il peut être souhaitable dans des conditions où les signaux de fluorescence sont faibles et le rapport signal sur bruit devient un problème. Par exemple, en mesurant à partir d'un appareil de Golgi / endosome-localisée pHluorin 5, ce qui donne un signal global inférieur, nous avons soustraire le signal de fond de toutes les mesures.
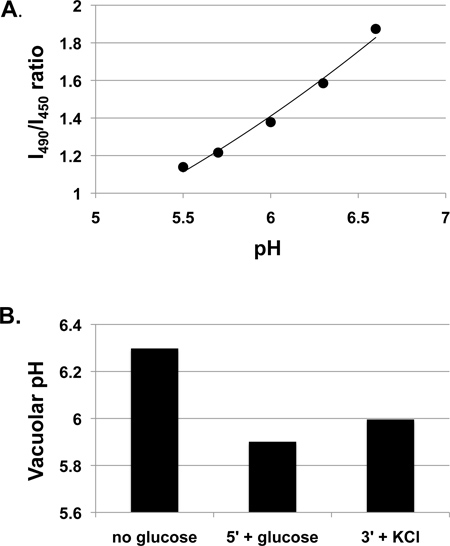
Figure 1. Measurement des réponses de pH vacuolaire dans les cellules de type sauvage cultivées dans YEPD, pH 5. cellules de type sauvage (SF838-5Aα) ont été cultivés à la phase mi-log puis incubés avec BCECF-AM comme décrit ci-dessus. A. courbe d'étalonnage montrant mesuré rapport de l'intensité de fluorescence à partir de l'excitation à 490 nm (I490) à partir de l'intensité d'excitation à 450 nm (I450) à la fois (mesurée à une longueur d'onde d'émission de 535 nm) à pH variée. Une courbe de tendance linéaire est représenté. B. Vacuolar pH après une brève privation de glucose a été mesurée dans une portion de la même, de la suspension cellulaire étiqueté (pas de glucose). Le glucose est ensuite ajoutée à une concentration finale de 50 mM et le ratio de fluorescence a été mesurée après 5 min (5 '+ glucose). 50 mM KCl a été ensuite ajoutée et le ratio de fluorescence a été mesurée après 3 min et convertie en pH (3 '+ KCl).

Figure 2. Cinétique de cytréponse au pH osolic à l'addition de glucose dans les cellules de type sauvage. cellules de type sauvage ont été transformées avec pHluorin de levure sous le contrôle de la phosphoglycérate kinase (PGK) du promoteur et les transformants cultivés comme décrit ci-dessus. A. courbe d'étalonnage montrant rapport mesuré l'intensité de fluorescence à 405 nm (I405) à l'intensité à 485 nm (I485) en fonction du pH. B. pH cytosolique a été dérivée à partir des mesures d'intensité de fluorescence prises toutes les 6 sec. plus de 6 min. Glucose (50 mM final) a été ajouté aux cellules dans la cuve à l'heure indiquée.
Discussion
Nous avons utilisé ces protocoles pour répondre à un certain nombre d'aspects de l'homéostasie du pH. Par exemple, nous avons comparé les réponses cytosolique et le pH des cellules mutantes et de type sauvage V-ATPase déficient 4,5. Nous avons également examiné les effets des conditions de croissance modifiées, le pH extracellulaire, en particulier sur la réponse du pH vacuolaire de glucose 3. Surtout, les réponses que nous observons sont cohérents avec d'autres méthodes de mesure quantitative du pH et des données biochimiques décrivant les activités altérés de la pompe à protons.
Les deux éléments les plus importants du type de mesures de pH dans vivo décrites ici sont la localisation du fluorophore et le niveau de signal; problèmes avec l'une de ces nécessitent une modification de la méthode d'application spécifique ou mutant. La localisation vacuolaire de BCECF est quelque peu fortuite 6, mais est conservé dans un certain nombre de différents mutants, y compris lemutants vma 4, qui ont réduit les niveaux de hydrolases vacuolaires. vacuoles de levures sont facilement visualisées par microscopie optique sous Nomarski, et nous confirment la localisation vacuolaire du colorant pour chaque souche. pHluorin est plus polyvalent que d'un capteur de pH, en particulier compte tenu de sa réactivité plus grande partie de la gamme de pH physiologique (figure 2A). Le pHluorin de levure que nous avons utilisé semble être exclusivement cytosolique, sans doute parce qu'il n'a pas d'autres informations de ciblage. Toutefois, pHluorin a été ciblé pour l'appareil de Golgi par marquage avec des séquences à partir du chlorure de Golgi GEF1 transporteur, avec une insertion supplémentaire de segments de la membrane à partir halorhodopsine pour donner topologie appropriée (pH GEF1; 14). Orij et al. Ont réussi à cibler pHluorin à la matrice mitochondriale et mesuré les changements de pH mitochondriales avec le métabolisme 15. Ces résultats suggèrent que les protéines de fusion bien conçus peuvent rendre possible de surveiller les réponses de pH dans de nombreux organites. Le signal au niveau de bruit de vacuolar BCECF est assez élevé dans la plupart des souches de levures que nous avons examinés. Signal de protéines exprimées pHluorin peut être manipulé par le promoteur dirigeant l'expression de pHluorin. Dans l'original cytosolique pHluorin construction 9, l'expression a été tirée par le promoteur élément contenant un choc thermique et n'était pas très élevé. Cependant, plus tard, des constructions d'expression à partir du promoteur PGK, le promoteur TEF1 et promoteur de l'actine semblent donner des niveaux plus élevés d'expression 3,15,16. L'appareil de Golgi-spécifique pHluorin pH GEF1 est exprimé à partir d'un promoteur inductible 14. Induction transitoire de l'expression peut être particulièrement utile pour les petits compartiments des sécrétoires et d'endocytose voies, où l'expression soutenue de haut niveau pourrait conduire à pHluorin mauvaise localisation ou même des perturbations dans le compartiment pH, qui se manifeste par une croissance lente ou mauvaise localisation d'autres protéines.
En plus des caractéristiques des fluorophores, il est important de reconnaître que, dans la mesure du pH in vivo sont sensibles à la croissance et les conditions métaboliques des cellules de levure eux-mêmes. Cette sensibilité est physiologiquement pertinente et potentiellement intéressant, mais peut aussi être une source de variabilité entre les mesures. Nous prenons soin de comparer les mesures des cellules de levure dans la même phase de croissance, généralement début au milieu de phase logarithmique. Parce que les réponses de pH vacuolaires peuvent être sensibles au pH extracellulaire 3, nous surveillons pH du milieu de croissance, en particulier pour les cellules cultivées dans un milieu tampon. Même s'il est clair que beaucoup de milieux de croissance différents sont compatibles avec la mesure du pH quotientométrique, les différences dans la composition du milieu peuvent certainement une incidence sur le pH 17. En outre, après que les cellules sont récoltées et préparées pour la mesure, nous avons constaté que la privation de glucose prolongée (heures) ne diminue pas seulement la première CYTpH osolic et augmente le pH vacuolaire initial, mais aussi ralentit de manière significative les réponses au glucose. Par conséquent, nous lançons généralement expériences dans les 30 minutes. ou moins du début de la privation de glucose.
Accumulation des amines lysosomotropiques fluorescents, tels que la quinacrine et l'acridine orange, a été largement utilisé pour évaluer l'acidification du compartiment des cellules de levure vivante. Ces méthodes sont rapides et simples, mais doivent être considérées comme beaucoup plus qualitative que les mesures ratiométriques de pH. En général, les méthodes telles que l'absorption quinacrine s'appuient sur la perméabilité de la membrane de la forme de base du fluorophore, qui sont piégées quand il est protoné dans un compartiment acide et peut être visualisé sous un microscope à fluorescence 18. L'accumulation du colorant repose sur la séparation en fonction du gradient de pH à travers la membrane, de sorte que l'absorption dans les organites acides peut être affaibli par l'une alcalinisation de l'organite ou acidificatisur le cytosol. Ces méthodes resteront utiles, mais devraient probablement être interprété comme offrant un niveau relatif de l'acidification.
Les applications de mesures de pH fluorescents ratiométriques dans la levure continuent à se développer. Brett et al. Récemment mesuré pH vacuolaire dans la collection de plus de 4500 mutants non essentiels suppression levure et découvert un certain nombre de nouveaux mécanismes de régulation pH 17. BCECF et pHluorin 19,20 ont aussi été adaptés pour un cellulaire activé par fluorescence tri format à faciliter le dépistage de nouveaux inhibiteurs de la V-ATPase. 11 microfluidique utilisé en combinaison avec la microscopie à fluorescence Dechant et al. Pour surveiller assemblée V-ATPase et pH cytosolique simultanément à travers de multiples cycles de privation de glucose et readdition. Ces résultats suggèrent que les mesures ratiométriques de pH dans la levure sont suffisamment robustes et polyvalents pour être utilisés dans de nombreux types d'expériences.
Déclarations de divulgation
Les auteurs n'ont aucun conflit d'intérêts à déclarer.
Remerciements
Ce travail a été soutenu par le NIH R01 GM50322 à PM Kane. Les auteurs remercient le Dr Rajini Rao, de l'Université Johns Hopkins de fournir les levures pHluorin plasmides et des conseils sur les mesures de pH ratiométriques, et le Dr Gloria A. Martinez Munoz pour travailler sur ces protocoles pour notre laboratoire.
matériels
| Name | Company | Catalog Number | Comments |
| Spectrofluorometer | Horiba Jobin Yvon | Model Fluoromax-4 | Temperature control and stirring capability are desirable. |
| BCECF-AM | Invitrogen/Molecular Probes | B1150 | Prepare a 12 mM stock in dry DMSO, store as aliquots at -20 °C |
| monensin | Sigma | M5273 | Toxic. |
| nigericin | Sigma | N7143 | Toxic. |
| MES | Sigma | M8250 |
Références
- Casey, J. R., Grinstein, S., Orlowski, J. Sensors and regulators of intracellular pH. Nat. Rev. Mol. Cell Biol. 11, 50-61 (2010).
- Orij, R., Brul, S., Smits, G. J. Intracellular pH is a tightly controlled signal in yeast. Biochim. Biophys. Acta. 1810, 933-944 (2011).
- Diakov, T. T., Kane, P. M. Regulation of vacuolar proton-translocating ATPase activity and assembly by extracellular pH. J. Biol. Chem. 285, 23771-23778 (2010).
- Martinez-Munoz, G. A., Kane, P. Vacuolar and plasma membrane proton pumps collaborate to achieve cytosolic pH homeostasis in yeast. J. Biol. Chem. 283, 20309-20319 (2008).
- Tarsio, M., Zheng, H., Smardon, A. M., Martinez-Munoz, G. A., Kane, P. M. Consequences of loss of Vph1 protein-containing vacuolar ATPases (V-ATPases) for overall cellular pH homeostasis. J. Biol. Chem. 286, 28089-28096 (2011).
- Plant, P. J., Manolson, M. F., Grinstein, S., Demaurex, N. Alternative mechanisms of vacuolar acidification in H(+)-ATPase-deficient yeast. J. Biol. Chem. 274, 37270-37279 (1999).
- Ali, R., Brett, C. L., Mukherjee, S., Rao, R. Inhibition of sodium/proton exchange by a Rab-GTPase-activating protein regulates endosomal traffic in yeast. J. Biol. Chem. 279, 4498-4506 (2004).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Brett, C. L., Tukaye, D. N., Mukherjee, S., Rao, R. The yeast endosomal Na+K+/H+ exchanger Nhx1 regulates cellular pH to control vesicle trafficking. Mol. Biol. Cell. 16, 1396-1405 (2005).
- Owen, C. S. Comparison of spectrum-shifting intracellular pH probes 5'(and 6')-carboxy-10-dimethylamino-3-hydroxyspiro[7H-benzo[c]xanthene-7, 1'(3'H)-isobenzofuran]-3'-one and 2',7'-biscarboxyethyl-5(and 6)-carboxyfluorescein. Anal. Biochem. 204, 65-71 (1992).
- Dechant, R., et al. Cytosolic pH is a second messenger for glucose and regulates the PKA pathway through V-ATPase. Embo J. 29, 2515-2526 (2010).
- Gustavsson, M., Barmark, G., Larsson, J., Muren, E., Ronne, H. Functional genomics of monensin sensitivity in yeast: implications for post-Golgi traffic and vacuolar H+-ATPase function. Mol. Genet. Genomics. 280, 233-248 (2008).
- Kovac, L., Bohmerova, E., Butko, P. Ionophores and intact cells. I. Valinomycin and nigericin act preferentially on mitochondria and not on the plasma membrane of Saccharomyces cerevisiae. Biochim. Biophys. Acta. 721, 341-348 (1982).
- Braun, N. A., Morgan, B., Dick, T. P., Schwappach, B. The yeast CLC protein counteracts vesicular acidification during iron starvation. J. Cell Sci. 123, 2342-2350 (2010).
- Orij, R., Postmus, J., Beek, T. e. r., Brul, A., S, G. J., Smits, In vivo measurement of cytosolic and mitochondrial pH using a pH-sensitive GFP derivative in Saccharomyces cerevisiae reveals a relation between intracellular pH and growth. Microbiology. 155, 268-278 (2009).
- Zhang, Y. Q., et al. Requirement for ergosterol in V-ATPase function underlies antifungal activity of azole drugs. PLoS Pathog. 6, e1000939 (2010).
- Brett, C. L., et al. Genome-wide analysis reveals the vacuolar pH-stat of Saccharomyces cerevisiae. PLoS One. 6, e17619 (2011).
- Roberts, C. J., Raymond, C. K., Yamashiro, C. T., Stevens, T. H. Methods for studying the yeast vacuole. Methods Enzymol. 194, 644-661 (1991).
- Chan, C. Y., et al. Inhibitors of V-ATPase proton transport reveal uncoupling functions of tether linking cytosolic and membrane domains of V0 subunit a (Vph1p). J. Biol. Chem. 287, 10236-10250 (2012).
- Johnson, R. M., et al. Identification of inhibitors of vacuolar proton-translocating ATPase pumps in yeast by high-throughput screening flow cytometry. Anal. Biochem. 398, 203-211 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon