Method Article
液泡和胞质pH值的测量
摘要
可以测量活酵母液泡膜和细胞内pH值( S。酵母)定位到特定的细胞区室的使用比例荧光染料的细胞。我们描述BCECF-AM,定位于液泡酵母,细胞内pH值与胞浆的比例的pH敏感GFP(酵母pHluorin所指示)测量空泡pH值的程序。
摘要
在酵母细胞中液泡和胞质pH值受到高度监管和整体pH值稳态占据了核心作用。我们描述了协议的比例测量pH值在体内使用pH敏感的荧光团本地化液泡或细胞质。 BCECF,乙酰甲酯形式导入细胞时,它定位在酵母液泡液泡pH值是衡量使用。细胞质pH值的测量是对pH敏感的绿色荧光蛋白表达的酵母启动子的控制下,酵母pHluorin所指示。在荧光计中的酵母细胞悬浮液的荧光比的测量方法进行说明。通过这些协议,单一时间点的pH值测量不同条件下或在不同的酵母突变体进行了比较,并已监测pH值的变化随着时间的推移。这些方法也适合于高通量实验的荧光板读数器的格式。比例比其他AP的pH测量的优点接近目前的用途,潜在实验的问题和解决方案,以备将来使用这些技术的前景也有所说明。
引言
pH值的平衡是一个充满活力和高度调节的过程中,在所有的生物1,2。生化过程严格监管的pH值,细胞内环境的调整,以使优化常住酶的活性狭窄的pH值范围。然而,细胞内pH稳态可以挑战的快速变化环境的pH值,代谢变化,以及某些信号传导通路。此外,细胞内pH值本身可以作为一个重要的信号。最后,许多细胞器保持腔的pH值是不同于周围的胞质溶胶和必需的细胞器的特定功能。
酵母酿酒酵母(Saccharomyces cerevisiae)股数与高等真核生物2的pH的体内平衡机制。酸性细胞内吞/溶酶体途径,pH值主要控制高度保守的空泡质子转运ATP酶(V-ATP酶),随许多EXCHAN蒙古包依赖于pH梯度。所有真核细胞中也有质子出口机制。在真菌和植物,在质膜上的第二,不同的质子泵,PMA1,出口代谢质子和被认为是细胞内pH值和细胞膜电位的主要决定因素。 S.遗传灵活性酵母和其商业上的重要性,提出了一个非常有趣和重要的研究pH值稳态模型2。
除了细胞器酸化的主要驱动,V-ATP酶被高度管制的酶和我们实验室的兴趣了解V-ATPase的调节机制。为了实现这一目标,我们一直在使用液泡和胞质pH值在体内 pH值的测量:1)监测反应改变外条件,如葡萄糖的剥夺和readdition,2)审查突变,妥协V-ATPase活性的影响, 3)探索COORdination细胞器和质膜质子泵3-5。这些实验通过强劲的比例适合于使用在酵母细胞中的pH值指标的发展才成为可能。厂房等人首先表明,BCECF(2'7'-二(2 -羧基乙基)-5 - (6) -羧基荧光素),它已被广泛应用,以测量细胞内pH值在哺乳动物细胞中,积聚在酵母液泡而不是在细胞质6。这种差异在BCECF本地化已被归因于液泡中的水解酶,这是有可能负责裂解乙酰氧甲基酯BCECF-AM(乙酰氧基甲基酯,BCECF)和液泡保留6。阿里等人进一步开发的液泡pH测量使用BCECF,适应这些测量荧光酶标仪格式。布莱特等人介绍了酵母pHluorin所指示由表达质粒源性ŗ的在酵母细胞内pH值的测定作为一种手段pH敏感的绿色荧光蛋白atiometric 8酵母特异性启动子的控制下9。
BCECF酵母pHluorin所指示的激发光谱是对pH敏感的,因此它们被用作比例的pH值如下:两个激发波长,在一个单一的发射波长测量,荧光的比例提供了一个衡量的pH为8,10。这些酵母液泡和胞质pH传感器已用于单细胞和人口为基础的测量。 6,11测量单细胞进行荧光显微镜和图像分析。液泡膜或胞浆上面的两个波长的荧光的测量为每个小区。人口为基础的测量进行适当的荧光功能酶标仪或荧光计中。我们通常是在荧光计测量,因为它提供了方便添加组件,如葡萄糖在con连续动力学测量。下面列出我们目前实验室协议液泡和胞质pH值的测量,二者也容易适应微孔板检测。
研究方案
1。 BCECF-AM 在体内使用液泡pH值测量
- 长出一个50毫升的液体培养过夜所需的媒体要被测量的酵母菌株。我们的目标是有细胞数中期(OD值(在600nm处的光密度)为约0.8的悬浮液中的测量)。
- 颗粒通过离心分离酵母细胞。悬浮颗粒0.6毫升培养基中生长和转移到已称重的离心管。颗粒细胞再次离心2,000 XG,持续60秒。尽可能完全去除上清,然后权衡细胞沉淀。重悬沉淀至最终密度为0.5克/毫升(重量/体积),将被添加到本卷文化将得到约200毫克的细胞沉淀,加入200μl缓冲液使最终体积为400μl。
- 添加BCECF-AM的细胞悬浮液从12毫米的股票,在DMSO中制备终浓度为50mM的。拌匀,然后公司ubate细胞在30℃下30分钟。在摇摆平台或辊筒。
- 虽然细胞培育,准备校准缓冲区。校准的缓冲液含有50mM的MES(2 - (N-吗啉代)乙磺酸),50mM的HEPES(4 - (2 - 羟基乙基)-1 - 哌嗪乙磺酸),50mM的氯化钾,氯化钠的50mM乙酸铵,0.2M,的10mM叠氮化钠,10mM的2 - 脱氧葡萄糖,并已被调整,以将pH值适当的校准范围内,用NaOH或HCl。 (注意:叠氮化钠是剧毒,应小心处理。)在野生型细胞中的pH值的测量,我们会准备几个校准混合物在pH值5.5至6.5,但预计将有更碱性空泡,pH值的突变体( VMA突变),我们会准备更多,更高的pH缓冲液。
- 各pH校准缓冲分装2毫升到15毫升锥形管,并添加莫能菌素(15毫米的股票)和尼日利亚菌素(2毫股票)给最终浓度莫能110微米和15微米尼日利亚菌素,Respectively。拌匀的旋涡混合器。 (注意:莫能菌素,尼日利亚菌素是有毒的,应谨慎处理。)
- 当BCECF-AM孵育时间完成后,沉淀细胞悬浮液通过离心分离,持续30秒,在2000×g离心微量离心。重悬细胞为1毫升生长培养基中缺乏葡萄糖和离心机如上。重复该洗涤步骤一次,然后将沉淀重悬于200微升生长培养基中不含葡萄糖。置于冰上。
- 的细胞悬浮液中加入20μl上述制备的各pH校正管。在30°C孵育30-60分钟。辊式转鼓上。
- 设置的荧光计,交替测量在激发波长450纳米和490纳米的发光波长为535 nm。样品室的温度设定至30℃。在连续搅拌下将混合物在比色皿中执行的所有测量。
- 加入1.96毫升1 mM的MES(调整至pH为5或7的pH值取决于细胞的生长培养基中的一个ND实验设计)。到试管中,加入20μl的细胞悬液。启动荧光测量。我们同时收集连续的动能和时间点在不同的实验数据。对于连续的动力学数据,每6秒测量5分钟,然后添加葡萄糖至最终的50mM的葡萄糖浓度,并继续测量5-10分钟。对于单一时间点的测量,我们一般采取的测量在1和5分钟。加入比色皿的细胞后,添加葡萄糖在动力学测量,然后进行下一次测量5分钟。后加入葡萄糖。这些增加的可以是多种多样的,并且,也可以添加额外的组件(抑制剂等)。
- 实验测量完成后,取出校准管从30°C孵育,整个2毫升的量为每次转移的荧光计比色皿。荧光测量在相同的设置(见1.8),每隔5秒,共30秒以上,每个样品。
- 荧光数据导出到Microsoft Excel。 (对于我们的荧光计,这要求出口数据作为制表符分隔的形式导入到Excel中的文本。)获得校准曲线计算荧光的比例在490纳米至450纳米每个校准混合物。的荧光的比率,然后与pH值的关系作图得到的校准曲线。
- 实验数据转换荧光比使用标准曲线计算pH值。液泡膜的pH值,然后随时间(动力学的pH值的变化),或者在各种条件下( 图1),或在不同的突变株相比。
2。 在体内使用酵母pHluorin所指示胞内pH值的测量
- 变换pHluorin所指示质粒标准协议与酵母所需的酵母菌株,并选择补充基本培养基缺乏尿嘧啶(SC-尿嘧啶)的转化。
- SC-尿嘧啶转化细胞长出了50毫升液体培养数中期(OD 的600 = 0.8或更低)。
- 准备校准标准所描述的液泡中的pH值,但缓冲区适当的pH值范围为胞质pH测量,一般pH值6-8。等分试样2毫升校准缓冲液调节到所需的pH值到15毫升锥形管的一些。添加莫能菌素,尼日利亚菌素(1.4)如上所述,拌匀。
- 如上所述通过离心收集细胞,将沉淀重悬于600微升生长培养基中。转移至称量微量离心管中,沉淀细胞,在5,000 rpm离心30秒。将沉淀重悬于1毫升生长培养基中没有葡萄糖(SC-尿嘧啶,葡萄糖),再次沉淀细胞,并重复。最后离心后,除去上清液尽可能彻底和权衡细胞沉淀。重悬细胞至最终密度为0.5克/毫升的SC-尿嘧啶没有葡萄糖。
- 加入20μl的细胞悬液,每管校准缓冲的旋涡混合器拌匀。孵育30℃60分钟,一个旋转的鼓形转子。
- 设置为在波长405和485nm的激发和发射波长为508 nm的荧光计。继续进行,单一的时间点或动力学测量和BCECF测量上述用于添加葡萄糖。
- 测量荧光校准样品,并构建BCECF(1.10-1.11)的校准曲线。 A地块的荧光比与pH值线性范围最胞质pH值测量值(PH值6.0-8.0)9,实验很容易转换荧光比率测量pH值。
结果
图1给出营养丰富的培养基中生长的野生型酵母细胞(酵母提取物,蛋白胨-葡聚糖YEPD)与50毫米的MES缓冲pH值至5液泡pH值获得的数据。我们经常在缓冲介质中生长的细胞,因为培养基的pH变化相当显着的期间,特别是对基本培养基中生长过夜,我们已经发现,生长培养基的pH值可能会影响液泡pH值的反应3。然而,也可以接受多次实验,在非缓冲培养基中生长的细胞。 图1A显示了细胞与BCECF-AM由协议所示的校准曲线。虽然BCECF荧光比值和液泡pH值之间的关系是非线性的,在更宽的pH范围内7,它几乎是线性的有关范围内的这些实验测量,示出的线性趋势线,并用来计算实验的pH值。液泡pH值的变化,导致从GLucose除了葡萄糖剥夺细胞, 如图1B所示。液泡pH值增加过程中的BCECF-AM标记,因为细胞缺糖,但会降低糖readdition后,大概是由于通过重组3,4 V-ATP酶的活化的结果。除了50毫米氯化钾,三分钟后,加入葡萄糖后观察到液泡pH值略有增加。在一个更大的研究中,我们通常运行至少三个独立的实验(生物)和3-5每个条件显示pH平均值±SE。
的动力学与葡萄糖此外,细胞内pH值的变化如图2所示。在这个实验中,野生型酵母细胞生长在缺乏尿嘧啶(SC-尿嘧啶)的合成完全培养基,用50mM MES缓冲至pH5。此介质是适当的维护pHluorin所指示的磷酸甘油酸激酶(PGK)启动子控制下的含质粒的酵母,我们已经使用了最近3,5;其他的质粒可能需要不同的选择条件。校准曲线( 图2A),表明pHluorin所指示的比例反应pH值在很宽的pH范围内是线性的,一般覆盖任何生理上相关的胞液的pH。此处所示的野生型细胞的响应非常有特点,有增加至pH为7.2-7.4的pH值,然后立即减少。
每个菌株和在每一个实验中,我们构建校准曲线。我们使用一个由布莱特等人描述的现场校准混合物。9 BCECF pHluorin所指示测量。这种混合物包括细胞透性的铵醋酸能够跨多个膜pH梯度崩溃的叠氮化钠和脱氧停止生产ATP抑制的H +泵,莫能菌素,尼日利亚菌素,离子载体牵连崩溃pH梯度的酵母分泌/ VACuolar运输途径分别为12和线粒体内膜13,。值得注意的是,我们不减去背景值未标记细胞空泡或细胞内pH值的测量。虽然有一些固有的自体荧光的细胞,我们已经直接比较与无背景校正的校准和实验样品的pH测量,并没有看到在最终值的差异。背景相减将导致校准曲线较陡,可能是可取的条件下荧光信号的低信号噪声比成为一个问题。例如,在测量从高尔基/内体本地化pHluorin所指示,这给出了一个较低的总体信号,我们做了所有测量值中减去背景信号。
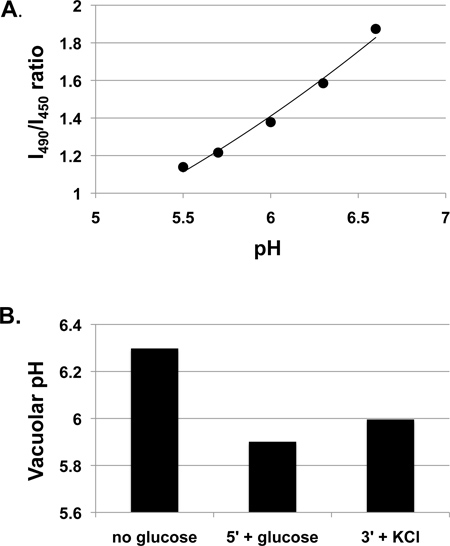
图1。测量键相生长在YEPD培养基,pH值为5。野生型细胞(SF838-5Aα)中的野生型细胞中的液泡的pH响应数中期生长,然后温育与BCECF-AM,如上所述。A.校正曲线示出测量从激发的荧光强度比,在490 nm处的强度(I490),以从激发在450nm处(I450)(包括在发光波长为535 nm)测定在多样化的pH值。所示的线性趋势线经过短暂的葡萄糖剥夺B.液泡pH值测定中一样,标记的细胞悬浮液(无葡萄糖)的一部分。然后加入终浓度为50mM的葡萄糖和5分钟(5'+葡萄糖)后,测定荧光强度。然后加入50mM的氯化钾,3分钟后,测定荧光强度,并转换为pH值(3'+氯化钾)。

图2。细胞色素动力学pH响应,在野生型细胞中,野生型细胞的葡萄糖除了osolic转化的酵母pHluorin所指示的磷酸甘油酸激酶(PGK)启动子和转化上述生长的控制下,A.的校正曲线示出在405nm测得的荧光强度比纳米(I405)的强度在485纳米(I485)与pH值B.胞质pH值来自荧光强度测量每6秒。超过6分钟。葡萄糖(50mM的最终)加入到细胞中,在指定的时间的比色皿中。
讨论
我们利用这些协议处理若干方面的pH稳态。例如,我们已经比较4,5野生型和V-ATP酶缺陷的突变细胞的细胞质和pH响应。我们还研究改变生长条件,尤其是细胞外pH值,葡萄糖3液泡pH响应的影响。重要的是,我们观察到的响应都与其它方法定量的pH测量和一致的生化数据,描述改变质子泵活动。
这里所描述的两个最重要的功能不同的体内 pH测量的荧光基团的本地化和信号的电平,使用其中任一问题需要修改的特定应用程序的方法或突变。 BCECF在液泡中有点偶然的6,但保留在许多不同的突变体,包括vma的突变体4,空泡水解酶的水平降低。酵母的空泡是容易的Nomarski光学显微镜下可视化,我们确认每一株液泡中的染料。 pHluorin所指示作为pH传感器的功能更加多样化,特别是考虑到其在大部分的生理pH范围内( 图2A)的响应。酵母pHluorin所指示我们已经使用似乎是专门胞浆,大概是因为它缺乏其他的定位信息。然而,pHluorin所指示已经有针对性地高尔基体高尔基体氯转运GEF1的从序列标记,以及一个额外的插入从halorhodopsin膜分部给予适当的拓扑(pH值GEF1 14)。成功锁定orij 等 pHluorin所指示的线粒体基质和测量线粒体代谢15的 pH值的变化。这些结果表明,设计适当的融合蛋白可能使possib文件监控pH值在许多细胞器的响应。液泡BCECF噪声电平的信号是相当高的,在大多数的酵母菌株,我们已审查。 pHluorin所指示蛋白表达的信号可以被操纵,通过启动子驱动pHluorin所指示的表达。在原来的胞浆pHluorin所指示构造9,热休克元素含有启动子驱动的表达,不是很高。然而,后来出现从PGK启动子,TEF1发起人,和肌动蛋白启动子的表达结构的表达3,15,16给予更高的水平。 pHluorin所指示的高尔基体特定的pH值GEF1表达诱导型启动子14。瞬态诱导表达可能是特别有用分泌和内吞途径,持续高水平表达可能导致pHluorin所指示的错误定位,甚至扰动室pH值通过缓慢增长或其他蛋白质的错误定位,体现的小隔间。
除的荧光基团的特性,重要的是要认识到, 在体内的pH测量是敏感的酵母细胞本身的生长和代谢条件。这种敏感性是生理上相关的,潜在的有趣的,但也可以是一个测量值之间的变异源。我们照顾测量从酵母细胞进行比较,在相同的成长阶段,通常是早期到中期对数生长期。由于液泡pH值响应可以是敏感的细胞外pH值3,我们监测生长培养基的pH值,特别是对无缓冲介质中生长的细胞。虽然很明显,许多不同的生长介质兼容比例测量pH值,培养基成分的差异,绝对可以影响pH值17。此外,后收获细胞并准备测量时,我们已经发现,长时间葡萄糖剥夺(小时)不仅降低了初始的细胞色素osolic pH值和增加的初始的液泡中的pH值,而且还显着地减慢对葡萄糖的反应。因此,我们一般会在30分钟内开始实验。或开始葡萄糖剥夺。荧光的溶酶体营养胺,如喹吖和吖啶橙,积累已被广泛使用,以评估在活酵母细胞中的隔室酸化。这些方法是快速,简便,但应被视为比比例测量的pH值的定性等等。奎纳克林摄取的方法,如在一般情况下,依赖于膜透性的荧光基团的基本形式,当它被质子化的酸性隔室,并且可以在荧光显微镜下18可视化成为包埋。染料的积累依赖于根据穿过膜的pH梯度的分区,因此可减弱酸性细胞摄取到由细胞器或acidificati的任一碱化对细胞质。这些方法将保持有用的,但应该被解释为提供一个相对电平酸化。
在酵母的比例荧光pH测量中的应用不断扩大。布雷特等最近液泡pH值测量,收集超过4500非必要的酵母缺失突变,并发现了一些新机制调节pH 17。 BCECF和pHluorin所指示19,20也适于荧光激活细胞分选的格式,以方便为新的V-ATP酶抑制剂的筛选。 等德坎特11荧光显微镜结合使用微流体监测同时V-ATPase的组件和胞质pH值通过多个周期缺糖readdition的。这些结果表明,在酵母中的比例测量的pH值是足够强大的多功能被应用在许多类型的实验。
披露声明
作者有没有利益冲突的披露。
致谢
这项工作是由美国国立卫生研究院R01 GM50322支持到PM凯恩。作者感谢pHluorin所指示的酵母质粒和建议比例pH值测量的约翰斯·霍普金斯大学博士饶Rajini,,凯莱博士A.马丁内斯·穆尼奥斯这些协议,我们的实验室工作。
材料
| Name | Company | Catalog Number | Comments |
| Spectrofluorometer | Horiba Jobin Yvon | Model Fluoromax-4 | Temperature control and stirring capability are desirable. |
| BCECF-AM | Invitrogen/Molecular Probes | B1150 | Prepare a 12 mM stock in dry DMSO, store as aliquots at -20 °C |
| monensin | Sigma | M5273 | Toxic. |
| nigericin | Sigma | N7143 | Toxic. |
| MES | Sigma | M8250 |
参考文献
- Casey, J. R., Grinstein, S., Orlowski, J. Sensors and regulators of intracellular pH. Nat. Rev. Mol. Cell Biol. 11, 50-61 (2010).
- Orij, R., Brul, S., Smits, G. J. Intracellular pH is a tightly controlled signal in yeast. Biochim. Biophys. Acta. 1810, 933-944 (2011).
- Diakov, T. T., Kane, P. M. Regulation of vacuolar proton-translocating ATPase activity and assembly by extracellular pH. J. Biol. Chem. 285, 23771-23778 (2010).
- Martinez-Munoz, G. A., Kane, P. Vacuolar and plasma membrane proton pumps collaborate to achieve cytosolic pH homeostasis in yeast. J. Biol. Chem. 283, 20309-20319 (2008).
- Tarsio, M., Zheng, H., Smardon, A. M., Martinez-Munoz, G. A., Kane, P. M. Consequences of loss of Vph1 protein-containing vacuolar ATPases (V-ATPases) for overall cellular pH homeostasis. J. Biol. Chem. 286, 28089-28096 (2011).
- Plant, P. J., Manolson, M. F., Grinstein, S., Demaurex, N. Alternative mechanisms of vacuolar acidification in H(+)-ATPase-deficient yeast. J. Biol. Chem. 274, 37270-37279 (1999).
- Ali, R., Brett, C. L., Mukherjee, S., Rao, R. Inhibition of sodium/proton exchange by a Rab-GTPase-activating protein regulates endosomal traffic in yeast. J. Biol. Chem. 279, 4498-4506 (2004).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Brett, C. L., Tukaye, D. N., Mukherjee, S., Rao, R. The yeast endosomal Na+K+/H+ exchanger Nhx1 regulates cellular pH to control vesicle trafficking. Mol. Biol. Cell. 16, 1396-1405 (2005).
- Owen, C. S. Comparison of spectrum-shifting intracellular pH probes 5'(and 6')-carboxy-10-dimethylamino-3-hydroxyspiro[7H-benzo[c]xanthene-7, 1'(3'H)-isobenzofuran]-3'-one and 2',7'-biscarboxyethyl-5(and 6)-carboxyfluorescein. Anal. Biochem. 204, 65-71 (1992).
- Dechant, R., et al. Cytosolic pH is a second messenger for glucose and regulates the PKA pathway through V-ATPase. Embo J. 29, 2515-2526 (2010).
- Gustavsson, M., Barmark, G., Larsson, J., Muren, E., Ronne, H. Functional genomics of monensin sensitivity in yeast: implications for post-Golgi traffic and vacuolar H+-ATPase function. Mol. Genet. Genomics. 280, 233-248 (2008).
- Kovac, L., Bohmerova, E., Butko, P. Ionophores and intact cells. I. Valinomycin and nigericin act preferentially on mitochondria and not on the plasma membrane of Saccharomyces cerevisiae. Biochim. Biophys. Acta. 721, 341-348 (1982).
- Braun, N. A., Morgan, B., Dick, T. P., Schwappach, B. The yeast CLC protein counteracts vesicular acidification during iron starvation. J. Cell Sci. 123, 2342-2350 (2010).
- Orij, R., Postmus, J., Beek, T. e. r., Brul, A., S, G. J., Smits, In vivo measurement of cytosolic and mitochondrial pH using a pH-sensitive GFP derivative in Saccharomyces cerevisiae reveals a relation between intracellular pH and growth. Microbiology. 155, 268-278 (2009).
- Zhang, Y. Q., et al. Requirement for ergosterol in V-ATPase function underlies antifungal activity of azole drugs. PLoS Pathog. 6, e1000939 (2010).
- Brett, C. L., et al. Genome-wide analysis reveals the vacuolar pH-stat of Saccharomyces cerevisiae. PLoS One. 6, e17619 (2011).
- Roberts, C. J., Raymond, C. K., Yamashiro, C. T., Stevens, T. H. Methods for studying the yeast vacuole. Methods Enzymol. 194, 644-661 (1991).
- Chan, C. Y., et al. Inhibitors of V-ATPase proton transport reveal uncoupling functions of tether linking cytosolic and membrane domains of V0 subunit a (Vph1p). J. Biol. Chem. 287, 10236-10250 (2012).
- Johnson, R. M., et al. Identification of inhibitors of vacuolar proton-translocating ATPase pumps in yeast by high-throughput screening flow cytometry. Anal. Biochem. 398, 203-211 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。