Method Article
La medición de pH vacuolar y citosólica
En este artículo
Resumen
PH vacuolar y citosólica se puede medir en la levadura en vivo ( S. cerevisiae) Células usando colorantes fluorescentes ratiometric localizados en compartimentos celulares específicos. Se describen procedimientos para la medición de pH vacuolar con BCECF-AM, que se localiza en la vacuola en levaduras, y el pH citosólico con una GFP sensible al pH radiométrica citosólica (levadura pHluorin).
Resumen
Vacuolar y el pH citosólico están altamente regulados en células de levadura y ocupan un papel central en la homeostasis global de pH. Se describen protocolos para la medición radiométrica de pH in vivo utilizando fluoróforos sensibles al pH localizadas en la vacuola o citosol. PH vacuolar se mide usando BCECF, que se localiza en la vacuola en la levadura cuando se introduce en las células en su forma de éster de acetoximetilo. PH citosólico se mide con una GFP sensible al pH expresado bajo el control de un promotor de levadura, levadura pHluorin. Se describen métodos para la medición de fluorescencia ratios en suspensiones de células de levadura en un fluorímetro. A través de estos protocolos, mediciones puntuales de tiempo individuales de pH bajo condiciones diferentes o en diferentes mutantes de levadura se han comparado y los cambios de pH a través del tiempo han sido controlados. Estos métodos también se han adaptado a un formato de lector de placas de fluorescencia para experimentos de alto rendimiento. Ventajas de las mediciones de pH ratiometric más de otros APTambién se describen los enfoques actualmente en uso, posibles problemas y soluciones experimentales, y las perspectivas para el futuro uso de estas técnicas.
Introducción
la homeostasis del pH es un proceso dinámico y altamente regulado en todos los organismos 1,2. Los procesos bioquímicos están fuertemente regulados por el pH, y los ambientes intracelulares están sintonizados con rangos estrechos de pH para permitir la óptima actividad de las enzimas residentes. Sin embargo, la homeostasis del pH intracelular puede ser impugnada por los rápidos cambios en el pH del medio ambiente, los cambios metabólicos y algunas vías de señalización. Además, el pH intracelular puede servir por sí misma como una señal importante. Por último, muchos orgánulos mantener los valores pH de la luz que son distintos desde el citosol circundante y esenciales para las funciones específicas de orgánulo.
Los Saccharomyces cerevisiae de levadura acciones un número de mecanismos de homeostasis de pH con eucariotas superiores 2. En los orgánulos ácidos de la vía endocítica / lisosomal, el pH se controla principalmente por el muy conservadas de protones ATPasa vacuolar translocación (V-ATPasa), en actuación conjunta con muchos intercambiadoresgers dependientes del gradiente de pH. Todas las células eucariotas también tienen mecanismos de exportación de protones. En los hongos y las plantas, un segundo, de la bomba de protones distinto en la membrana plasmática, PMA1, las exportaciones protones metabólicas y se cree que es el principal determinante de pH citosólico y el potencial de la membrana plasmática. La flexibilidad genética de S. cerevisiae y su importancia comercial, se han convertido en un modelo muy interesante e importante para el estudio de la homeostasis del pH 2.
Además de ser los principales impulsores de la acidificación de orgánulos, V-ATPasas están altamente regulados enzimas y nuestro laboratorio está interesado en comprender los mecanismos de regulación V-ATPasa. Para lograr este objetivo, hemos utilizado en las mediciones de pH in vivo de pH vacuolar y citosólica: 1) para monitorear las respuestas a las cambiantes condiciones extracelulares, tales como la privación de glucosa y readdition, 2) para examinar los efectos de las mutaciones que comprometen la actividad V-ATPasa, y 3) para explorar la coorsobre coordinación de los orgánulos y plasma bombas de protones de membrana 3-5. Estos experimentos sólo se hizo posible mediante el desarrollo de indicadores de pH ratiometric sólidas susceptibles de utilizar en células de levadura. . Planta et al primero mostró que BCECF (2'7'-bis-(2-carboxietil) -5 - (y 6)-carboxifluoresceína), que se ha utilizado ampliamente para medir el pH citosólico en células de mamífero, se acumula en la vacuola de levadura en lugar de la citosol 6. Esta diferencia en la localización de BCECF se ha atribuido a las muchas enzimas hidrolíticas en la vacuola, que probablemente responsable de la escisión del éster de metilo acetoxi de BCECF-AM (éster de acetoximetilo de BCECF) y vacuolar de retención 6. Ali et al. 7 desarrollado la medición del pH vacuolar con BCECF y adaptado estas mediciones en un formato de lector de placas de fluorescencia. Brett et al. Introducido pHluorin levadura como un medio de medir el pH citosólico en la levadura mediante la expresión de un plásmido r transmitidasatiometric GFP sensible al pH 8 bajo el control de un promotor de levadura-específica 9.
Los espectros de excitación de ambos BCECF y la levadura pHluorin son sensibles al pH, por lo que se utilizan como indicadores de pH radiométricos en los que la proporción de fluorescencia a dos longitudes de onda de excitación, medidos a una única longitud de onda de emisión, proporciona una medida de pH 8,10. Estas levaduras sensores de pH vacuolar y citosólica se han utilizado tanto para mediciones de una sola célula y poblacional. Mediciones de celda única 6,11 se realizan por microscopía de fluorescencia y análisis de imágenes. Fluorescencia vacuolar o citosólica en las dos longitudes de onda se mide para cada célula. Las mediciones basadas en la población se llevan a cabo ya sea en un lector de microplacas con capacidades de fluorescencia apropiados o en un fluorímetro. Hemos hecho generalmente nuestras mediciones en un fluorímetro, ya que proporciona un fácil acceso para la adición de componentes, tales como la glucosa durante el conmediciones cinéticas continuas. Nuestros protocolos de laboratorio actuales para la medición de pH vacuolar y citosólica se enumeran a continuación, ambos también se adaptan fácilmente a los ensayos de microplaca.
Protocolo
1. Medida del pH vacuolar in vivo usando BCECF-AM
- Crecer un cultivo líquido de 50 ml de la cepa de levadura a medir en el medio deseado durante la noche. El objetivo es que las células en fase semilogarítmica (OD600 (densidad óptica a 600 nm) de medición de aproximadamente 0,8 para la suspensión).
- Sedimentar las células de levadura mediante centrifugación. Resuspender el precipitado en 0,6 ml de medio de crecimiento y la transferencia a un tubo de microcentrífuga que ha sido previamente pesado. Pellet de nuevo las células en una microcentrífuga a 2000 xg durante 60 seg. Eliminar el sobrenadante tan completamente como sea posible y a continuación, pesar el sedimento celular. Resuspender el pellet a una densidad final de 0,5 g / ml (w / v); una cultura de este volumen dará un sedimento celular de aproximadamente 200 mg, y 200 l de tampón se añadiría para dar un volumen final de 400 l.
- Añadir BCECF-AM a la suspensión de células a una concentración final de 50 mM de una reserva de 12 mM en DMSO. Mezclar bien y luego incUbaté las células a 30 ° C durante 30 min. en una plataforma oscilante o vibratorios.
- Mientras que las células están incubando, preparar buffers de calibración. El tampón de calibración contiene 50 mM de MES (2 - (N-morfolino) etanosulfónico), 50 mM HEPES (4 - (2-hidroxietil)-1-piperazinetanosulfónico ácido), 50 mM KCl, 50 mM de NaCl, acetato de amonio 0,2 M, azida de sodio 10 mM, y 10 mM de 2-desoxiglucosa, y se ajusta el pH a valores apropiados para su rango de calibración con NaOH o HCl. (Atención: La azida sódica es altamente tóxica y debe manipularse con cuidado.) Para la medición de pH en las células de tipo salvaje, podríamos preparar varias mezclas de calibración a pH 5,5 a 6,5, pero para los mutantes que se espera que tenga un pH vacuolar más alcalino ( vma mutantes), nos prepare, tampones de pH superiores adicionales.
- Alícuota de 2 ml de tampón de calibración para cada pH en tubos cónicos de 15 ml, y añadir la monensina (15 mM de existencias) y nigericina (2 mM stock) para dar concentraciones finales de 110 mM monensina y 15 micras, nigericina, respectively. Mezclar bien con un vórtex. (Atención: Tanto monensina y nigericina son tóxicos y deben manejarse con cuidado.)
- Cuando el tiempo de incubación BCECF-AM se ha completado, la suspensión de células de pellets por centrifugación durante 30 segundos a 2.000 x g en una microcentrífuga. Resuspender las células es 1 ml de medio de crecimiento que carece de glucosa y se centrifuga como anteriormente. Repita este paso de lavado una vez, y luego volver a suspender el precipitado en 200 l de medio de cultivo sin glucosa. Coloque sobre hielo.
- Añadir 20 l de la suspensión celular a cada tubo de calibración de pH preparado anteriormente. Incubar a 30 ° C durante 30-60 min. en un tambor de rodillos.
- Ajuste el fluorímetro para medir alternativamente en longitudes de onda de excitación de 450 nm y 490 nm, ambos con una longitud de onda de emisión de 535 nm. Ajuste la temperatura de la cámara de la muestra a 30 ° C. Llevar a cabo todas las mediciones con agitación continua de la mezcla en la cubeta.
- Añadir 1,96 ml de 1 mM de MES (ajustado a pH 5 o 7 dependiendo del pH del medio de crecimiento de las células de unnd el diseño experimental). Añadir 20 l de suspensión de células en la cubeta. Iniciar las mediciones de fluorescencia. Recopilamos tanto cinética continua y datos de tiempo de punto en diferentes experimentos. Para los datos cinéticos continuos, tomamos mediciones cada 6 segundos durante 5 minutos, a continuación, añadir glucosa a una concentración final de glucosa de 50 mM, y continuar la medición durante 5-10 min. Para las mediciones de tiempo de un solo punto, por lo general, tomamos medidas a 1 y 5 min. después de la adición de las células a la cubeta, añadir la glucosa como en las mediciones cinéticas, y luego tomar otra medición 5 min. después de la adición de glucosa. Estas adiciones pueden ser variados, y también se pueden añadir componentes adicionales (inhibidores, etc).
- Después de las mediciones experimentales, retire los tubos de calibración de la incubación de 30 ° C y la transferencia de la totalidad del volumen de 2 ml para cada uno a la cubeta fluorímetro. Medir la fluorescencia en la misma configuración (ver 1.8) cada 5 segundos durante un total de 30 segundos para cada muestra.
- Exportar datos de fluorescencia para Microsoft Excel. (Para nuestro fluorímetro, esto requiere exportación de datos como texto en forma delimitado por tabuladores y la importación en Excel.) Obtener una curva de calibración mediante el cálculo de la proporción de fluorescencia a 490 nm a 450 nm para cada mezcla de calibración. El ratio de fluorescencia se representa gráficamente a continuación, vs pH para obtener una curva de calibración.
- Convertir los datos experimentales a la proporción de fluorescencia y calcular pH usando la curva estándar. PH vacuolar puede entonces representado frente al tiempo (cinética de los cambios de pH) o en comparación bajo diversas condiciones (Figura 1) o en diferentes cepas mutantes.
2. La medición de pH citosólico En Vivo Con pHluorin levadura
- Transformación de la cepa de levadura deseada con el plásmido por protocolos estándar de levadura pHluorin, y seleccionar los transformantes en medio mínimo suplementado carece de uracilo (SC-uracilo).
- Crecer un cultivo líquido de 50 ml de las células transformadas en SC-uracilo a la fase logarítmica media (OD 600 = 0,8 o inferior).
- Preparar los estándares de calibración como se describe para el pH vacuolar, pero tampón a un intervalo de pH apropiado para mediciones de pH citosólicas, generalmente de pH 6-8. Alícuota de 2 ml de tampón de calibración ajusta al pH deseado en varios tubos cónicos de 15 ml. Añadir monensina y nigericina como se describe anteriormente (1.4) y mezclar bien.
- Recoger las células por centrifugación como se describió anteriormente, y resuspender el sedimento en 600 l de medio de crecimiento. Transferir a un tubo de microcentrífuga de pesado, y precipitar las células por centrifugación a 5000 rpm durante 30 seg. Resuspender el precipitado en 1 ml de medio de crecimiento sin glucosa (SC-uracilo,-glucosa), sedimentar las células de nuevo y repetir. Después de la centrifugación final, eliminar el sobrenadante tan a fondo como sea posible y pesar el sedimento celular. Resuspender las células a una densidad final de 0,5 g / ml en SC-uracilo sin glucosa.
- Añadir 20 l de suspensión celular a cada tubo de tampón de calibración y mezcle bien en un mezclador de vórtice. Incubar a 30 ° C en un rotor de tambor giratorio durante 60 minutos.
- Configurar el fluorímetro para la excitación a longitudes de onda 405 y 485 nm y una longitud de onda de emisión de 508 nm. Proceder con el punto sola vez o mediciones cinéticas y la adición de glucosa como se describió anteriormente para la medición de BCECF.
- Medir la fluorescencia de las muestras de calibración, y la construcción de una curva de calibración como para BCECF (ver 1.10 a 1.11). Una gráfica de la proporción de fluorescencia vs pH es lineal en el rango de la mayoría de las mediciones de pH citosólico (pH 6,0-8,0) 9, medidas de relación de fluorescencia así experimentales se convierten fácilmente a pH.
Resultados
La Figura 1 presenta los datos de pH vacuolar obtenidos en células de levadura de tipo salvaje cultivadas en medio rico (extracto de levadura-peptona-dextrano; YEPD) tamponada a pH 5 con 50 mM de MES. A menudo crecer las células en medio tamponado debido a que el pH del medio puede cambiar de manera espectacular durante el crecimiento durante la noche, en particular para un medio mínimo, y hemos encontrado que el pH del medio de crecimiento puede afectar a las respuestas de pH vacuolar 3. Sin embargo, también es aceptable para muchos experimentos para crecer las células en medio sin memoria intermedia. Figura 1A muestra una curva de calibración para las células incubadas con BCECF-AM por el protocolo anterior. Aunque la relación entre la proporción de fluorescencia BCECF y pH vacuolar es no-lineal en un rango de pH más amplio 7, que es casi lineal en el rango relevante para estas mediciones experimentales, y una línea de tendencia lineal se muestra y se utiliza para calcular los valores de pH para el experimento. Cambios de pH vacuolar resultantes de glAdemás ucose a las células la glucosa-privados se muestran en la Figura 1B. Aumenta el pH vacuolar durante BCECF-AM etiquetando porque las células son privadas de glucosa, pero disminuye después readdition glucosa, presumiblemente como resultado de la activación de V-ATPasa mediante el montaje de 3,4. Se observó un ligero aumento en el pH vacuolar tras la adición de 50 mM de KCl, tres minutos después de la adición de glucosa. En un estudio más amplio, que normalmente se ejecutan al menos tres experimentos independientes (biológicas repeticiones) y se muestra el pH promedio ± SE para cada condición de 3-5.
La cinética del cambio de pH citosólico con adición de glucosa se muestran en la Figura 2. Para este experimento, las células de levadura de tipo salvaje fueron cultivadas en medio completo sintético sin uracilo (SC-uracilo), tamponada a pH 5 con 50 mM de MES. Este medio es apropiado para el mantenimiento de la pHluorin levadura que contiene el plásmido bajo el control del promotor de la fosfoglicerato quinasa (PGK),que hemos utilizado recientemente 3,5; otros plásmidos pueden requerir diferentes condiciones de selección. La curva de calibración (Figura 2A) muestra que la respuesta radiométrica de la pHluorin a pH es lineal en un amplio intervalo de pH, por lo general que cubre cualquier pH fisiológicamente relevante citosólica. La respuesta de las células de tipo salvaje que se muestran aquí es muy característica, hay una disminución inmediata en el pH seguido por un aumento a un pH de 7.2 a 7.4.
Construimos curvas de calibración para cada cepa y en cada experimento. Utilizamos una mezcla de calibración in situ descrito por Brett et al. 9, tanto para BCECF y mediciones pHluorin. Esta mezcla incluye acetato de amonio celular permeable capaz de colapsar gradientes de pH a través de múltiples membranas, azida sódica y desoxiglucosa para detener la producción de ATP e inhiben la H +-bombas, y monensina y nigericina, ionóforos implicados en el colapso de los gradientes de pH de la secreción de levadura / vactransporte uolar vías 12 y la membrana mitocondrial interna 13, respectivamente. Vale la pena señalar que no restamos un valor de fondo para las células no marcadas para las mediciones de pH vacuolar o citosólica. Aunque las células tienen cierta autofluorescencia intrínseca, se han comparado directamente las mediciones de pH con y sin corrección de fondo de la calibración y las muestras experimentales y he visto ninguna diferencia en los valores finales. Antecedentes resta dará lugar a curvas de calibración más empinadas, y puede ser deseable en condiciones en las señales de fluorescencia son bajos y la relación señal a ruido se convierte en un problema. Por ejemplo, en la medición de un aparato de Golgi / endosoma-localizada pHluorin 5, lo que da una señal más baja en general, lo hicimos restar la señal de fondo de todas las mediciones.
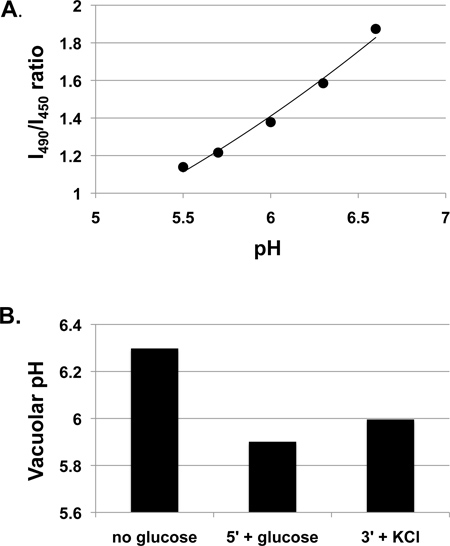
Figura 1. Measurement de respuestas pH vacuolar en las células de tipo salvaje cultivadas en YEPD, pH 5. células de tipo salvaje (SF838-5Aα) fueron cultivadas a mediados de la fase de registro y luego incubadas con BCECF-AM como se describió anteriormente. A. curva de calibración que muestra medido relación de intensidad de fluorescencia de excitación a 490 nm (I490) a la intensidad de excitación a 450 nm (I450) (ambos medidos en una longitud de onda de emisión de 535 nm) en variada pH. Se muestra una línea de tendencia lineal. B. pH vacuolar se midió después de una breve privación de glucosa en una porción de la misma, la suspensión celular marcada (sin glucosa). Glucosa a continuación, se añadió a una concentración final de 50 mM y la relación de fluorescencia se midió después de 5 min (5 '+ glucosa). A continuación se añadió 50 mM de KCl y la relación de fluorescencia se midió después de 3 min y se convierte a un pH de (3 '+ KCl).

Figura 2. Cinética de cytrespuesta pH osolic a la adición de glucosa en las células de tipo salvaje. células de tipo salvaje se transformaron con pHluorin levadura bajo control de la fosfoglicerato quinasa (PGK) y los transformantes cultivados como se describe anteriormente. A. Curva de calibración que muestra relación medida de la intensidad de fluorescencia a 405 nm (I405) de intensidad a 485 nm (I485) vs pH. B. pH citosólico se deriva de mediciones de la intensidad de fluorescencia tomadas cada 6 s. durante 6 min. La glucosa (50 mM final) se añadió a las células en la cubeta en el momento indicado.
Discusión
Hemos utilizado estos protocolos para hacer frente a una serie de aspectos de la homeostasis del pH. Por ejemplo, hemos comparado las respuestas citosólicas y el pH de las células mutantes de tipo salvaje y V-ATPasa deficiente en 4,5. También hemos examinado los efectos de las condiciones de crecimiento alterado, pH extracelular, particularmente en respuesta a la glucosa pH vacuolar 3. Es importante destacar que las respuestas que se observan son a la vez coherente con otros métodos de medición cuantitativa de pH y con datos que describen las actividades bioquímicas alteradas de las bombas de protones.
Las dos características más importantes del tipo de mediciones de pH in vivo descritos aquí son la localización del fluoróforo y el nivel de la señal; problemas con cualquiera de estos requieren modificación del método para la aplicación específica o mutante. La localización vacuolar de BCECF es algo fortuito 6, pero se conserva en un número de diferentes mutantes, incluyendo elvma mutantes 4, que han reducido los niveles de hidrolasas vacuolar. Vacuolas levadura son fácilmente visualizadas por microscopía óptica Nomarski bajo, y que confirman la localización vacuolar del colorante para cada cepa. pHluorin es más versátil como un sensor de pH, especialmente teniendo en cuenta su capacidad de respuesta en la mayor parte de la gama de pH fisiológico (Figura 2A). El pHluorin levadura que hemos utilizado parece ser exclusivamente citosólica, presumiblemente debido a que carece de otra información de orientación. Sin embargo, pHluorin ha sido dirigido al aparato de Golgi mediante el etiquetado con secuencias del transportador de cloruro de Golgi Gef1, junto con una inserción adicional de los segmentos de membrana de halorhodopsina para dar topología adecuada (pH-Gef1; 14). Orij et al. Han abordado con éxito pHluorin a la matriz mitocondrial y cambios de pH medido con el metabolismo mitocondrial 15. Estos resultados sugieren que las proteínas de fusión correctamente diseñadas pueden hacer que sea posibLe para monitorear las respuestas de pH en muchos orgánulos. La señal de nivel de ruido de vacuolar BCECF es bastante alto en la mayoría de las cepas de levadura que hemos examinado. De señal de las proteínas expresadas pHluorin puede ser manipulado a través del promotor que dirige la expresión pHluorin. En el original citosólica pHluorin constructo 9, la expresión fue impulsado por un promotor de choque térmico elemento que contiene y no era muy alta. Sin embargo, posteriores construcciones de expresión a partir del promotor PGK, promotor TEF1, y el promotor de la actina aparecen para dar niveles más altos de expresión 3,15,16. El aparato de Golgi-específica pHluorin pH-Gef1 se expresa a partir de un promotor inducible 14. Inducción transitoria de la expresión puede ser particularmente útil para los más pequeños compartimentos de los secretoras y endocítica vías, donde sostenido alto nivel de expresión podría conducir a pHluorin mislocalization o incluso las perturbaciones en el pH del compartimiento, que se manifiesta a través de un crecimiento lento o deslocalización de otras proteínas.
Además de las características de los fluoróforos, es importante reconocer que en las mediciones de pH in vivo son sensibles al crecimiento y las condiciones metabólicas de las propias células de levadura. Esta sensibilidad es fisiológicamente relevante y potencialmente interesante, pero también puede ser una fuente de variabilidad entre las mediciones. Nosotros nos encargamos de comparar las mediciones de las células de levadura en la misma fase de crecimiento, generalmente a principios y mediados de la fase logarítmica. Debido a que las respuestas de pH vacuolar pueden ser sensibles a pH extracelular 3, supervisamos pH del medio de crecimiento, en particular para las células cultivadas en medio sin memoria intermedia. Si bien es evidente que muchos medios de crecimiento diferentes son compatibles con la medición del pH radiométrica, las diferencias en la composición del medio puede afectar definitivamente pH 17. Además, después de las células se cosechan y se preparan para la medición, se ha encontrado que la privación de glucosa prolongado (horas) no sólo disminuye el cyt inicialpH osolic y aumenta el pH vacuolar inicial, sino que también reduce de forma considerable las respuestas a la glucosa. Por lo tanto, por lo general Iniciamos experimentos dentro de 30 min. o menos a partir de la privación de glucosa.
La acumulación de aminas lisosomotrópicos fluorescentes, tales como la quinacrina y naranja de acridina, se ha utilizado ampliamente para evaluar la acidificación del compartimento en células de levadura viva. Estos métodos son rápidos y simples, pero deben ser considerados como mucho más cualitativa que las mediciones radiométricas de pH. En general, los métodos tales como la absorción de quinacrina se basan en la permeabilidad de membrana de la forma básica del fluoróforo, que quedan atrapados cuando está protonado en un compartimiento de ácido y puede ser visualizado bajo un microscopio de fluorescencia 18. La acumulación del colorante se basa sobre la separación de acuerdo con el gradiente de pH a través de la membrana, por lo que la absorción en orgánulos ácidos puede ser debilitada por cualquiera de alcalinización del orgánulo o acidificatien el citosol de. Estos métodos siguen siendo útiles, pero probablemente se debe interpretar como que proporciona un nivel relativo de la acidificación.
Las aplicaciones de mediciones de pH fluorescentes radiométricos en la levadura continúan expandiéndose. Brett et al. Recientemente medido pH vacuolar en la colección de más de 4500 mutantes de levadura supresión no esenciales y descubierto una serie de nuevos mecanismos de regulación de pH 17. BCECF y pHluorin 19,20 también se han adaptado a una fluorescencia de células activadas por la clasificación formato para facilitar la detección de nuevos inhibidores de la V-ATPasa. Dechant et al. 11 microfluidos utilizados en combinación con microscopía de fluorescencia para monitorizar conjunto V-ATPasa y el pH citosólico simultáneamente a través de múltiples ciclos de privación de glucosa y readdition. Estos resultados sugieren que las mediciones radiométricas de pH en la levadura son lo suficientemente robusto y versátil para ser aplicado en muchos tipos de experimentos.
Divulgaciones
Los autores no tienen conflictos de intereses a revelar.
Agradecimientos
Este trabajo fue apoyado por el NIH R01 GM50322 a PM Kane. Los autores agradecen al Dr. Rajini Rao, de la Universidad Johns Hopkins para la prestación de los plásmidos pHluorin levadura y asesoramiento sobre medidas de pH radiométricos y Dra. Gloria A. Martínez Muñoz para la elaboración de estos protocolos para nuestro laboratorio.
Materiales
| Name | Company | Catalog Number | Comments |
| Spectrofluorometer | Horiba Jobin Yvon | Model Fluoromax-4 | Temperature control and stirring capability are desirable. |
| BCECF-AM | Invitrogen/Molecular Probes | B1150 | Prepare a 12 mM stock in dry DMSO, store as aliquots at -20 °C |
| monensin | Sigma | M5273 | Toxic. |
| nigericin | Sigma | N7143 | Toxic. |
| MES | Sigma | M8250 |
Referencias
- Casey, J. R., Grinstein, S., Orlowski, J. Sensors and regulators of intracellular pH. Nat. Rev. Mol. Cell Biol. 11, 50-61 (2010).
- Orij, R., Brul, S., Smits, G. J. Intracellular pH is a tightly controlled signal in yeast. Biochim. Biophys. Acta. 1810, 933-944 (2011).
- Diakov, T. T., Kane, P. M. Regulation of vacuolar proton-translocating ATPase activity and assembly by extracellular pH. J. Biol. Chem. 285, 23771-23778 (2010).
- Martinez-Munoz, G. A., Kane, P. Vacuolar and plasma membrane proton pumps collaborate to achieve cytosolic pH homeostasis in yeast. J. Biol. Chem. 283, 20309-20319 (2008).
- Tarsio, M., Zheng, H., Smardon, A. M., Martinez-Munoz, G. A., Kane, P. M. Consequences of loss of Vph1 protein-containing vacuolar ATPases (V-ATPases) for overall cellular pH homeostasis. J. Biol. Chem. 286, 28089-28096 (2011).
- Plant, P. J., Manolson, M. F., Grinstein, S., Demaurex, N. Alternative mechanisms of vacuolar acidification in H(+)-ATPase-deficient yeast. J. Biol. Chem. 274, 37270-37279 (1999).
- Ali, R., Brett, C. L., Mukherjee, S., Rao, R. Inhibition of sodium/proton exchange by a Rab-GTPase-activating protein regulates endosomal traffic in yeast. J. Biol. Chem. 279, 4498-4506 (2004).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Brett, C. L., Tukaye, D. N., Mukherjee, S., Rao, R. The yeast endosomal Na+K+/H+ exchanger Nhx1 regulates cellular pH to control vesicle trafficking. Mol. Biol. Cell. 16, 1396-1405 (2005).
- Owen, C. S. Comparison of spectrum-shifting intracellular pH probes 5'(and 6')-carboxy-10-dimethylamino-3-hydroxyspiro[7H-benzo[c]xanthene-7, 1'(3'H)-isobenzofuran]-3'-one and 2',7'-biscarboxyethyl-5(and 6)-carboxyfluorescein. Anal. Biochem. 204, 65-71 (1992).
- Dechant, R., et al. Cytosolic pH is a second messenger for glucose and regulates the PKA pathway through V-ATPase. Embo J. 29, 2515-2526 (2010).
- Gustavsson, M., Barmark, G., Larsson, J., Muren, E., Ronne, H. Functional genomics of monensin sensitivity in yeast: implications for post-Golgi traffic and vacuolar H+-ATPase function. Mol. Genet. Genomics. 280, 233-248 (2008).
- Kovac, L., Bohmerova, E., Butko, P. Ionophores and intact cells. I. Valinomycin and nigericin act preferentially on mitochondria and not on the plasma membrane of Saccharomyces cerevisiae. Biochim. Biophys. Acta. 721, 341-348 (1982).
- Braun, N. A., Morgan, B., Dick, T. P., Schwappach, B. The yeast CLC protein counteracts vesicular acidification during iron starvation. J. Cell Sci. 123, 2342-2350 (2010).
- Orij, R., Postmus, J., Beek, T. e. r., Brul, A., S, G. J., Smits, In vivo measurement of cytosolic and mitochondrial pH using a pH-sensitive GFP derivative in Saccharomyces cerevisiae reveals a relation between intracellular pH and growth. Microbiology. 155, 268-278 (2009).
- Zhang, Y. Q., et al. Requirement for ergosterol in V-ATPase function underlies antifungal activity of azole drugs. PLoS Pathog. 6, e1000939 (2010).
- Brett, C. L., et al. Genome-wide analysis reveals the vacuolar pH-stat of Saccharomyces cerevisiae. PLoS One. 6, e17619 (2011).
- Roberts, C. J., Raymond, C. K., Yamashiro, C. T., Stevens, T. H. Methods for studying the yeast vacuole. Methods Enzymol. 194, 644-661 (1991).
- Chan, C. Y., et al. Inhibitors of V-ATPase proton transport reveal uncoupling functions of tether linking cytosolic and membrane domains of V0 subunit a (Vph1p). J. Biol. Chem. 287, 10236-10250 (2012).
- Johnson, R. M., et al. Identification of inhibitors of vacuolar proton-translocating ATPase pumps in yeast by high-throughput screening flow cytometry. Anal. Biochem. 398, 203-211 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados