Method Article
Medição do valor pH vacuolar e Cytosolic
Neste Artigo
Resumo
PH vacuolar e citosólica pode ser medido em leveduras vivas ( S. cerevisiae) As células utilizando corantes fluorescentes raciométrica localizadas em compartimentos celulares específicos. Nós descrevemos processos de medição de pH vacuolar com BCECF-AM, que se localiza no vacúolo em levedura e pH citosólico com uma GFP sensível ao pH raciométrica citosólica (levedura pHluorin).
Resumo
Vacuolar e pH citosólica são altamente regulamentados em células de levedura e ocupam uma papel central na homeostase do global de pH. Nós descrever protocolos de para a medição de tipo raciométrico de de pH in vivo utilizando fluoróforos-sensíveis ao pH localizadas para o o vacúolo ou citosol. De pH vacuolar é medido usando BCECF, o qual localizes para o vacúolo em levedura quando introduzido em células de, na sua forma éster de acetoximetilo. De pH Cytosolic é medido com um a GFP de pH-sensível expressou ao abrigo o controle de um promotor de levedura, de levedura pHluorin. Métodos para a medição de dos rácios de de fluorescência em suspensões de celulares de leveduras em um fluorímetro são descritos. Através de estes protocolos, as medições de pontos tempo de solteiro de de pH ao abrigo condições diferentes ou em diferentes mutantes de de levedura tenham sido comparados e mudanças no pH ao longo do tempo tenham sido monitorizados. Esses métodos também tiverem sido adaptadas ao um formato de leitor de placas de a fluorescência para a experimentos high-throughput. Vantagens de medições de pH raciométrica mais de outro apdagens atualmente em uso, potenciais problemas de e soluções experimentais, e prospects para uso futuro de estas técnicas também são descritas.
Introdução
a homeostase de pH é uma processo dinâmico e altamente regulamentado em todos os organismos 1,2. Processos bioquímicos são rigidamente regulada pelo pH, e ambientes de intracelulares estão sintonizados para gamas de pH estreitas para permitir que uma actividade óptima de as enzimas de residentes. No entanto, a homeostase pH intracelular pode ser desafiado por mudanças rápidas na pH ambiental, turnos de metabólicas, e de certas vias de sinalização. Além disso, o pH de intracellular pode em si mesmo servir como um sinal importante. Finalmente, muitas organelas manter os valores de de pH lumenal que são distintas a partir de o citosol circundante e essencial para as funções específicas-organela.
Os de levedura de Saccharomyces partes cerevisiae um certo número de mecanismos de da homeostase de pH com a eucariotas superiores 2. In as organelas ácidas de o pathway endocytic / lysosomal, pH é controlado, principalmente, pela altamente conservada vacuolar ATPase próton-translocating (V-ATPase), atuando em tandem com muitos exchaniurtas dependentes relativa à gradiente de pH. Todos os células eucarióticas também têm mecanismos de exportação de prótons. In é acreditado fungos e plantas, uma segunda da bomba de próton, distinto na membrana plasma, Pma1, as exportações prótons metabólicas e para ser o dos principais determinantes da pH citosólica e potencial de membrana plasma. A flexibilidade genética de S. cerevisiae e sua importância comercial, fizeram-lhe um modelo de muito interessante e importante para o estudo de a homeostase pH 2.
In Além de ser os drivers de primárias de organelle a acidificação, V-ATPases são altamente regulamentados enzimas e nosso laboratório de está interessado em compreender mecanismos de regulação V-ATPase. Rumo a este objetivo, temos vindo a utilizar em medições de pH in vivo de pH vacuolar e citosólica: 1) para monitorar respostas aos mudanças nas condições de extracelulares, tais como privação glicose e readdition, 2 de) para examinar os efeitos de mutações que compromisso de atividade V-ATPase, e 3) para explorar a coordenação de organelle e plasma de membrana bombas de protões 3-5. Estes experimentos só se tornou possível através de o desenvolvimento de robustas indicadores de pH raciométrica passíveis da para usar em células de levedura. . Vegetal et ai mostrou pela primeira vez de que BCECF (2'7'-Bis-(2-carboxietilo) -5 - (e 6 de)-carboxif luoresceina), o qual tem sido utilizado amplamente para medir o pH citosólica em células de mamíferos, se acumula em o vacúolo de levedura em vez de o citosol 6. Esta diferença na BCECF localisation tem sido atribuída a as muitas enzimas hidrolíticas em o vacúolo, os quais são provável responsável pela clivagem do o éster de meti Io acetoxi a partir de BCECF-Rádio AM (éster acetoximetilo de BCECF) e retenção de vacuolar 6. Ali et ai. 7 ainda mais desenvolvido pela medição do pH vacuolar usando BCECF e adaptado estas medições para um formato de leitor de placas de de fluorescência. De Brett et ai. Apresentar-pHluorin de levedura como um meio de de medição de pH citosólica em levedura por expressar os um r r plasmídeo de-borneatiometric a GFP de pH-sensível 8, sob controlo de um promotor específico-levedura 9.
O Os espectros de de excitação de tanto BCECF e levedura de cerveja pHluorin são sensíveis-se até pH, assim, elas são usados como indicadores de pH raciométrica na qual o rácio de de de fluorescência a dois comprimentos de onda de excitação, medidos em condições um único comprimento de onda de emissão de, e que providencia uma medida de de pH 8,10. Estes sensores de pH vacuolares e citosólica levedura têm sido utilizados para ambas as medições single-cell and-baseada em população. Medições de-de células Um único 6,11 são executadas por microscopia de de fluorescência e de análise de imagem. De fluorescência vacuolar ou citosólica aqui as dois comprimentos de onda é medido para as cada célula. As medições-baseados em população são efectuado tanto na um leitor de microplacas de com capacidades de de fluorescência adequadas ou o em um f luorimetro. Nós têm, em geral feito os nossos de medições sobre uma fluorímetro, com um porque ele fornece do fácil acesso para adição de componentes, tais como glucose durante engodomedições de cinéticos contínuo. Nossos protocolos de actuais do laboratório para a medição de de de pH vacuolar e citosólica são coletados abaixo; ambos também são facilmente adaptados-se a ensaios de microplacas.
Protocolo
1. Medição do valor pH vacuolar Em a Vivo Usando BCECF-Rádio AM
- Cresça um de 50 ml de cultura líquido de o estirpe de levedura para ser medido em a médio o desejar o pernoite. A meta é para têm células de em fase de meados-de log (DO600 (densidade óptica a 600 de nm) à mensuração dos aproximadamente, de 0,8 para a suspensão).
- Da pelota as células de levedura, por centrifugação em. Ressuspender o o pellet em 0,6 ml de o meio de crescimento e transferência para um tubo de microcentrífuga de que tenha sido, previamente tarado com. De pellets as células novamente em um de microcentrífuga de a 2.000 xg por 60 sec. Remover filtro-se o sobrenadante, tão completamente quanto possível e em seguida, pesam o pellet célula. Ressuspender o pelete até uma densidade final de 0,5 de g / ml de (w / v) de; uma cultura de este volume irá dar um pelete de células de, aproximadamente, de 200 mg, e 200 jil de tampão de iria ser adicionado a dar um volume final de de 400 uL.
- Adicionar BCECF-AM às o suspensão celular a uma operação de concentração final de 50 mM de a partir de um Estoque 12 de mM de preparado no seio de DMSO. Misture bem e, em seguida, incUbate as células em 30 de ° C durante de automóvel 30 min. em uma plataforma de de balanço ou o tambor de rolete.
- Enquanto as células de estiverem incubando, prepare-se buffers de de calibração. O buffer de de calibração contém 50 mM de MES (2 - (N-morf olino) Solução de ácido etanossulfónico), a 50 mM de HEPES (4 - (2-de hidroxietilo)-1-piperazinoetanossulfónico ácido), de KCl equivalentes a 50 mM, NaCI a 50 mM, do acetato de de amónio 0,2 M, 10 azida de mM de sódio, e 10 mM 2-deoxyglucose, e é ajustado para o pH valoriza apropriado para o seu faixa de calibração com NaOH ou HCl. (Cuidado: A azida de Sódio é altamente tóxico, e deverá ser manuseado com cuidado.) Para a medição da de de pH em células de-Tipo de deixa selvagens, nós iria preparar vários misturas de calibração a pH 5,5 a 6,5, mas para os mutantes prevê venham a ter um pH vacuolar obter mais alcalina (de mutants vma), nós iria preparar buffers de pH adicionais, mais elevados.
- Aliquotar de 2 ml de tampão de de calibração para cada valor de pH em 15 ml tubos cónicos de, e de adicioná monensina na dieta (Estoque 15 de mM) e nigericina (Estoque 2 mM de) para dar origem concentrações finais de 110 | iM monensina de e 15 º uM nigericina, r respectively. Misture bem on um misturador de vórtice. (Caution: Both monensina e nigericina são tóxicos e deve ser manuseado com cuidado.)
- Quando o tempo de incubação BCECF-Rádio AM é concluída, peletizar a suspensão de células por centrifugação durante 30 de seg Rácio às 2,000 xg, em um de microcentrífuga de. Ressuspender as células é de 1 ml de meio de crescimento carente de glicose e centrifuga-se como acima. Repita este passo de lavagem com uma vez, e, em seguida, fim de ressuspender a sedimento em 200 jil de meio de crescimento sem glicose. Lugar on de gelo.
- Juntar 20 ul de a suspensão de células a cada tubo de de calibração de pH preparado acima. Incubar a uma temperatura 30 de ° C durante 30-60 mín. sobre um tambor rolete.
- Defina o fluorímetro para medir alternadamente em comprimentos de onda de excitação 450 nm e 490 nM, ambos os com um comprimento de onda de emissão de de 535 nm. Defina a temperatura do câmara de amostra para de 30 ° C. Perform todas as medições de, com agitação contínuas de-se a mistura na cuvete de.
- Adicionar 1,96 ml de do EEM dentro em 1 mM de (ajustado-se até pH 5 ou 7, dependendo da o pH de meio de crescimento as 'células que umand o design experimental). Juntar 20 jil de suspensão de células na cuvete de. Initiate medições de fluorescência. Nós coletamos tanto kinetic contínua e de dados em tempo-ponto em diferentes experimentos. Para obter dados cinéticos contínuas, nós tomamos medições a cada 6 seg Rácio para de automóvel 5 min,, em seguida, de adicioná glicose para uma operação de concentração definitivo de glicose de 50 mM de, e continuar medição de durante 5-10 min. Para medições de solteiras time-de ponto, nós geralmente efectuar medições em 1 e 5 min. depois de adição de células ao o cuvete, as de adicioná a glicose como em as medições cinéticos, e outra em seguida, tomar-se outra medição de automóvel 5 min. após a adição da glucose. Estas adições pode ser variada, e de componentes do adicionais de (inibidores da, etc) também pode ser adicionado.
- Depois que os medições experimentais são concluída, remova os tubos de de calibração a partir de o 30 ° C de incubação e transferir toda a ml volume de 2 para cada um para o cuvette fluorímetro. Meça fluorescência em as mesmas configurações de (ver 1.8) a cada 5 sec ao longo de um total de 30 de sec para cada amostra.
- Exportar dados de fluorescência para Microsoft Excel. (Para o nosso fluorímetro, isto requer exportação de dados como texto em forma de tab-delimited e importação para Excel.) Obter um curva de calibração por meio do cálculo a proporção de de fluorescência a 490 nm para 450 nm para cada mistura de calibração. O rácio de fluorescência é, em seguida, plotados vs de pH para obter um curva de calibração.
- Converta os dados de experimentais para rácio de de fluorescência e calcular do pH utilizando um a curva padrão. De pH vacuolar pode, em seguida, plotados contra o tempo (cinética da sua as alterações de pH) ou comparado ao abrigo diferentes condições (Figura 1) ou em diferentes estirpes mutantes.
2. Medição do valor pH Cytosolic Em a Vivo Usando pHluorin Levedura
- Transform o estirpe de levedura o desejar com o pHluorin plasmídeo de levedura por protocolos de forfetários, e selecionar para transf ormantes sobre suplementado meio mínimo de uracilo faltando (em SC-de uracil),.
- Cresça um de 50 ml de cultura líquido de células transformadas especialmente em SC-de uracilo até à fase meados-de log (Posição OD 600 = 0,8 ou inferior)-.
- Prepare a padrões de calibração de como se descreveu para de pH vacuolar, mas buffer para uma gama de pH apropriado para as medições de pH citosólicas, geralmente de pH 6-8. Aliquotar de 2 ml de tampão de de calibração ajustado para o pH o desejar em várias de 15 ml tubos cónicos de. Adicionar monensina e do nigericina tal como descrito de cima (1,4) e nos misture bem.
- Colha as células por centrifugação, tal como descrito, supra, e fim de ressuspender o sedimento em 600 ul de o meio de crescimento. Transfira para uma tubo de microcentrífuga de pesava, e as células da pelota por centrifugação a 5.000 rpm durante 30 de seg Rácio. Ressuspender o sedimento em 1 ml de meio de crescimento sem glicose (apenas SC-uracilo, cloridrato de-glucose), as células da pelota novamente e repita os. Depois que o centrifugação final, retire-se o sobrenadante tão completamente quanto possível e pesar o pelete célula. Ressuspender com células até uma densidade final de 0,5 de g / ml de em SC-de uracilo com nenhuma da glucose.
- Juntar 20 jil de suspensão celular aos cada tubo de de tampão de de calibração e misture bem sobre um mixador de de vórtice. Incubar a 30 ° C num rotor de tambor giratório durante 60 minutos.
- Configure o fluorímetro para a excitação em comprimentos de onda 405 e 485 nm e um comprimento de onda de emissão de 508 nm. Prosseguir com um único ponto de tempo ou medições cinéticas e adição de glicose como acima descrito para a medição de BCECF.
- Medir a fluorescência das amostras de calibração e construir uma curva de calibração como para BCECF (veja 1,10-1,11). A trama da relação de fluorescência versus pH é linear em toda a gama da maioria das medições de pH citosólicas (pH 6,0-8,0) 9, as medições relação fluorescência tão experimentais são facilmente convertidos em pH.
Resultados
A Figura 1 apresenta os dados de pH vacuolar obtidos em células de levedura de tipo selvagem cultivadas em meio rico (extracto de levedura-peptona-dextrano; YEPD), tamponadas a pH 5 com 50 mM de MES. Frequentemente crescer as células em meio tamponado, porque o pH do meio pode mudar dramaticamente durante o crescimento durante a noite, em especial para um meio mínimo, e verificou-se que o pH do meio de crescimento pode afectar as respostas do pH vacuolar 3. No entanto, também é aceitável para muitas experiências para crescer as células em meio não tamponado. Figura 1A mostra uma curva de calibração para as células incubadas com BCECF-AM, pelo protocolo acima. Embora a relação entre BCECF proporção de fluorescência e pH vacuolar não é linear ao longo de um intervalo de pH mais amplo 7, é aproximadamente linear na gama relevante para estas medições experimentais, e uma linha de tendência linear é mostrado e utilizado para calcular os valores de pH para o experimento. Alterações do pH vacuolar resultantes glAlém ucose a células de glucose-privadas são mostrados na Figura 1B. O aumento do pH vacuolar durante BCECF-AM etiquetagem porque as células são glucose privadas, mas diminui após readdition glucose, presumivelmente como resultado da activação do V-ATPase através remontagem 3,4. Um ligeiro aumento no pH vacuolar é observada após a adição de KCl a 50 mM, três minutos após a adição de glucose. Em um estudo mais amplo, que normalmente são executados pelo menos três experimentos independentes (biológico réplicas) e mostrar o pH médio ± SE para cada condição de 3-5.
A cinética da mudança de pH citosólico com adição de glucose são apresentados na Figura 2. Para esta experiência, as células de levedura do tipo selvagem foram cultivadas em meio sintético completo sem uracilo (SC-uracilo), tamponado a pH 5 com 50 mM de MES. Este meio é adequado para a manutenção do plasmídeo pHluorin levedura contendo sob controlo da quinase (PGK), o promotor de fosfoglicerato,que temos usado recentemente 3,5; outros plasmídeos podem exigir diferentes condições de seleção. A curva de calibração (Figura 2A) mostra que a resposta de medida proporcional da pHluorin para pH é linear ao longo de uma vasta gama de pH, geralmente abrangendo qualquer pH citosólico fisiologicamente relevante. A resposta das células de tipo selvagem aqui apresentados é muito característica, há uma diminuição imediata do pH, seguido por um aumento de pH 7,2-7,4.
Nós construímos as curvas de calibração para cada cepa e em cada experimento. Nós usamos uma em mistura de calibração situ descrita por Brett et al. 9 para ambos BCECF e medições pHluorin. Esta mistura inclui acetato de amónio célula-permeável capaz de colapso gradientes de pH através de múltiplas membranas, azida de sódio e deoxyglucose para interromper a produção de ATP e inibe a H +-bombas, e monensina e nigericina, ionóforos implicado no colapso de gradientes de pH na levedura secretora / vactransporte uolar caminhos 12 e mitocondrial membrana interna 13, respectivamente. É interessante notar que não subtrai um valor de fundo para as células não marcadas para as medições de pH vacuolar ou citosólica. Embora as células têm algum autofluorescência intrínseco, que compararam diretamente medições de pH, com e sem correcção de fundo da calibração e amostras experimentais e não vi nenhuma diferença nos valores finais. A subtração resultará em curvas de calibração mais íngremes, e pode ser desejável sob as condições em que os sinais de fluorescência são baixos e a relação sinal-ruído torna-se um problema. Por exemplo, na medição de um Golgi / endossoma localizada pHluorin 5, o que dá um sinal mais baixo em geral, nós fizemos subtrair o sinal de fundo a partir de todas as medições.
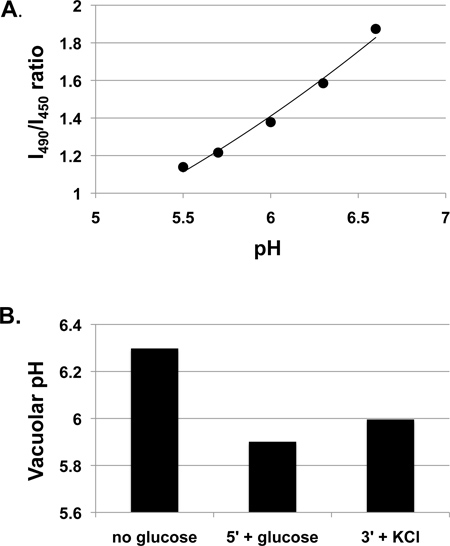
Figura 1. Measuremento de respostas pH vacuolares nas células de tipo selvagem cultivadas em caldo YEPD a pH 5. células de tipo selvagem (SF838-5Aα) foram cultivadas até à fase mid-log e depois incubadas com BCECF-AM conforme anteriormente descrito. curva de calibração A. mostrando medido proporção de intensidade de fluorescência de excitação a 490 nm (I490) a intensidade de excitação a 450 nm (I450) (ambos medidos em um comprimento de onda de emissão de 535 nm) a pH variado. Uma linha de tendência linear é mostrada. B. pH vacuolar após uma breve privação de glucose foi medida em uma porção do mesmo, a suspensão de células marcadas (sem glicose). A glucose foi então adicionada a uma concentração final de 50 mM e proporção de fluorescência foi medida após 5 minutos (5 '+ glucose). KCl 50 mM foi então adicionada e proporção de fluorescência foi medido após 3 minutos e convertido a pH (3 '+ KCl).

Figura 2. Cinética da citresposta pH osolic a adição de glicose nas células de tipo selvagem. células do tipo selvagem foram transformadas com pHluorin levedura sob o controle da cinase de fosfoglicerato (PGK), o promotor e os transformantes cultivados como descrito acima. A. Curva de calibração mostrando relação medida da intensidade de fluorescência a 405 nm (I405), a intensidade a 485 nm (i485) versus pH. B. pH citosólico foi derivada a partir de medições da intensidade de fluorescência tomadas a cada 6 segundos. mais de 6 min. Glucose (50 mM final) foi adicionado às células na cuvete na hora indicada.
Discussão
Nós utilizamos esses protocolos para abordar uma série de aspectos da homeostase do pH. Por exemplo, nós compararam respostas citosólicas e pH de células mutantes do tipo selvagem e V-ATPase deficiente 4,5. Examinamos, também, os efeitos das condições de crescimento alterados, pH particularmente extracelular, em resposta pH vacuolar de glicose 3. É importante ressaltar que as respostas que observamos são consistentes com outros métodos de medição de pH quantitativa e com dados bioquímicos que descrevem atividades alterados de bombas de protões.
Os dois aspectos mais importantes do tipo de em medições de pH in vivo aqui descritos são a localização do fluoróforo e do nível de sinal; problemas com qualquer destes requerem modificação do método para a aplicação ou mutante específico. A localização vacuolar da BCECF é um pouco fortuito 6, mas é mantida num certo número de mutantes diferentes, incluindo ovma mutantes 4, que têm níveis de hidrolases vacuolares reduzidos. Vacúolos leveduras são facilmente visualizados por microscopia sob Nomarski óptica, e confirmar a localização vacuolar do corante para cada estirpe. pHluorin é mais versátil do que um sensor de pH, nomeadamente tendo em conta a sua capacidade de resposta na maior parte da gama de pH fisiológico (Figura 2A). O pHluorin levedura que usamos parece ser exclusivamente citosólica, presumivelmente porque não tem outras informações segmentação. No entanto, pHluorin foi voltado para o aparelho de Golgi por marcação com sequências do Golgi cloreto transportador Gef1, juntamente com uma inserção adicional dos segmentos de membrana a partir de halorodopsina dar topologia adequada (pH Gef1, 14). Orij et al. Têm como alvo com sucesso pHluorin para a matriz mitocondrial e mediram as mudanças de pH mitocondrial com o metabolismo 15. Estes resultados sugerem que as proteínas de fusão adequadamente concebidos podem tornar possibilile para monitorar as respostas do pH em muitos organelos. O sinal de nível de ruído de vacuolar BCECF é bastante elevada na maioria das estirpes de leveduras que foram examinados. Sinais a partir de proteínas pHluorin expressos podem ser manipuladas através do promotor de dirigir a expressão pHluorin. No original cytosolic pHluorin construção 9, a expressão foi impulsionado por um choque térmico promotor elemento que contém e não foi muito alta. No entanto, mais tarde, construções de expressão a partir do promotor PGK, TEF1 promotor eo promotor de actina parece dar maiores níveis de expressão 3,15,16. O-específica de Golgi pHluorin pH Gef1 é expresso a partir de um promotor indutível 14. Indução transiente da expressão pode ser particularmente útil para pequenos compartimentos das vias secretoras e endocitose, onde a expressão de alto nível sustentado poderiam levar a pHluorin mislocalization ou mesmo perturbações do pH do compartimento, manifesta através de crescimento lento ou mislocalization de outras proteínas.
Além das características dos fluoróforos, é importante reconhecer que, em medições de pH in vivo são sensíveis a condições de crescimento e metabolismo das próprias células de levedura. Esta sensibilidade é fisiologicamente relevante e potencialmente interessante, mas também pode ser uma fonte de variabilidade entre as medições. Tomamos o cuidado de comparar as medições de células de levedura na mesma fase de crescimento, geralmente no início e meados fase logarítmica. Devido respostas pH vacuolar pode ser sensível ao pH extracelular 3, monitorar o pH do meio de crescimento, em particular para células cultivadas em meio não tamponado. Embora seja claro que muitos meios de crescimento diferentes são compatíveis com a medição do pH raciométrica, as diferenças na composição do meio pode definitivamente impactar pH 17. Além disso, depois que as células são colhidas e preparadas para medição, verificou-se que a privação de glicose prolongado (horas), não só diminui a cit inicialpH osolic e aumenta o pH vacuolar inicial, mas também diminui de forma significativa as respostas à glucose. Por isso, geralmente iniciar experimentos dentro de 30 min. ou menos do início da privação de glucose.Acumulação de aminas lysosomotropic fluorescentes, tais como quinacrina e laranja de acridina, tem sido amplamente utilizado para avaliar a acidificação do compartimento em células de levedura viva. Estes métodos são rápidos e simples, mas deve ser considerado como muito mais qualitativa do que medições raciométrica de pH. Em geral, os métodos, tais como absorção de quinacrina invocar a permeabilidade da membrana da forma básica do fluoróforo, que ficam presos quando é protonado por um compartimento ácido, e podem ser visualizados sob um microscópio de fluorescência 18. A acumulação do corante depende de particionamento de acordo com o gradiente de pH através da membrana, de modo a captação para organelos ácidas pode ser enfraquecida por qualquer alcalinização do organelo ou acidificatino do citosol. Estes métodos serão úteis, mas provavelmente deve ser interpretada como proporcionando um nível relativo de acidificação.
As aplicações das medições de pH fluorescente raciométrica em levedura continuar a expandir-se. Brett et al. Recentemente medido pH vacuolar na coleção de mais de 4500 mutantes não essenciais eliminação de leveduras e descobriu uma série de novos mecanismos de pH regulação 17. BCECF e pHluorin 19,20, também foram adaptadas para uma célula activado por fluorescência triagem formato para facilitar o rastreio de novos inibidores da V-ATPase. Dechant et al. 11 microfluidos utilizado em combinação com a microscopia de fluorescência para monitorizar V-ATPase montagem e pH citosólico em simultâneo através de múltiplos ciclos de privação de glicose e readdition. Estes resultados sugerem que as medições raciométrica de pH em levedura são suficientemente robustos e versátil para ser aplicado em diversos tipos de experiências.
Divulgações
Os autores não têm conflitos de interesse de divulgar.
Agradecimentos
Este trabalho foi financiado pelo NIH R01 GM50322 a PM Kane. Os autores agradecem ao Dr. Rajini Rao, Johns Hopkins University para fornecer as leveduras pHluorin plasmídeos e conselhos sobre as medições de pH raciométrica e Dr. Gloria A. Martinez Munoz para trabalhar fora estes protocolos para o nosso laboratório.
Materiais
| Name | Company | Catalog Number | Comments |
| Spectrofluorometer | Horiba Jobin Yvon | Model Fluoromax-4 | Temperature control and stirring capability are desirable. |
| BCECF-AM | Invitrogen/Molecular Probes | B1150 | Prepare a 12 mM stock in dry DMSO, store as aliquots at -20 °C |
| monensin | Sigma | M5273 | Toxic. |
| nigericin | Sigma | N7143 | Toxic. |
| MES | Sigma | M8250 |
Referências
- Casey, J. R., Grinstein, S., Orlowski, J. Sensors and regulators of intracellular pH. Nat. Rev. Mol. Cell Biol. 11, 50-61 (2010).
- Orij, R., Brul, S., Smits, G. J. Intracellular pH is a tightly controlled signal in yeast. Biochim. Biophys. Acta. 1810, 933-944 (2011).
- Diakov, T. T., Kane, P. M. Regulation of vacuolar proton-translocating ATPase activity and assembly by extracellular pH. J. Biol. Chem. 285, 23771-23778 (2010).
- Martinez-Munoz, G. A., Kane, P. Vacuolar and plasma membrane proton pumps collaborate to achieve cytosolic pH homeostasis in yeast. J. Biol. Chem. 283, 20309-20319 (2008).
- Tarsio, M., Zheng, H., Smardon, A. M., Martinez-Munoz, G. A., Kane, P. M. Consequences of loss of Vph1 protein-containing vacuolar ATPases (V-ATPases) for overall cellular pH homeostasis. J. Biol. Chem. 286, 28089-28096 (2011).
- Plant, P. J., Manolson, M. F., Grinstein, S., Demaurex, N. Alternative mechanisms of vacuolar acidification in H(+)-ATPase-deficient yeast. J. Biol. Chem. 274, 37270-37279 (1999).
- Ali, R., Brett, C. L., Mukherjee, S., Rao, R. Inhibition of sodium/proton exchange by a Rab-GTPase-activating protein regulates endosomal traffic in yeast. J. Biol. Chem. 279, 4498-4506 (2004).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394, 192-195 (1998).
- Brett, C. L., Tukaye, D. N., Mukherjee, S., Rao, R. The yeast endosomal Na+K+/H+ exchanger Nhx1 regulates cellular pH to control vesicle trafficking. Mol. Biol. Cell. 16, 1396-1405 (2005).
- Owen, C. S. Comparison of spectrum-shifting intracellular pH probes 5'(and 6')-carboxy-10-dimethylamino-3-hydroxyspiro[7H-benzo[c]xanthene-7, 1'(3'H)-isobenzofuran]-3'-one and 2',7'-biscarboxyethyl-5(and 6)-carboxyfluorescein. Anal. Biochem. 204, 65-71 (1992).
- Dechant, R., et al. Cytosolic pH is a second messenger for glucose and regulates the PKA pathway through V-ATPase. Embo J. 29, 2515-2526 (2010).
- Gustavsson, M., Barmark, G., Larsson, J., Muren, E., Ronne, H. Functional genomics of monensin sensitivity in yeast: implications for post-Golgi traffic and vacuolar H+-ATPase function. Mol. Genet. Genomics. 280, 233-248 (2008).
- Kovac, L., Bohmerova, E., Butko, P. Ionophores and intact cells. I. Valinomycin and nigericin act preferentially on mitochondria and not on the plasma membrane of Saccharomyces cerevisiae. Biochim. Biophys. Acta. 721, 341-348 (1982).
- Braun, N. A., Morgan, B., Dick, T. P., Schwappach, B. The yeast CLC protein counteracts vesicular acidification during iron starvation. J. Cell Sci. 123, 2342-2350 (2010).
- Orij, R., Postmus, J., Beek, T. e. r., Brul, A., S, G. J., Smits, In vivo measurement of cytosolic and mitochondrial pH using a pH-sensitive GFP derivative in Saccharomyces cerevisiae reveals a relation between intracellular pH and growth. Microbiology. 155, 268-278 (2009).
- Zhang, Y. Q., et al. Requirement for ergosterol in V-ATPase function underlies antifungal activity of azole drugs. PLoS Pathog. 6, e1000939 (2010).
- Brett, C. L., et al. Genome-wide analysis reveals the vacuolar pH-stat of Saccharomyces cerevisiae. PLoS One. 6, e17619 (2011).
- Roberts, C. J., Raymond, C. K., Yamashiro, C. T., Stevens, T. H. Methods for studying the yeast vacuole. Methods Enzymol. 194, 644-661 (1991).
- Chan, C. Y., et al. Inhibitors of V-ATPase proton transport reveal uncoupling functions of tether linking cytosolic and membrane domains of V0 subunit a (Vph1p). J. Biol. Chem. 287, 10236-10250 (2012).
- Johnson, R. M., et al. Identification of inhibitors of vacuolar proton-translocating ATPase pumps in yeast by high-throughput screening flow cytometry. Anal. Biochem. 398, 203-211 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados