Method Article
Toxoplasma Киста гондий стены Образование в Активированный костномозгового происхождения Макрофаги и Bradyzoite условия
В этой статье
Резюме
Toxoplasma гондий превращается в кисту форме в ответ на экологические стрессы, которые могут быть передразнил в моделях культуры тканей. Это видео демонстрирует методы для проверки образованию кист стене путем активации костномозгового происхождения макрофагов или изменении рН среды роста фибробластов в клетках.
Аннотация
Toxoplasma гондий является облигатным внутриклеточным паразитом, которые могут проникать любые ядерные ячейки теплокровных животных. Во время инфекции, Т. гондий распространяет в качестве быстрого тиражирования форму, которая называется tachyzoite. Tachyzoites превращаются в медленно растущих осумкованный форму, которая называется bradyzoite по сигнализации процесс, который не очень хорошо охарактеризованы. В животных, bradyzoite кисты находятся в центральной нервной системы и мышечной ткани и представляют собой хроническую стадию инфекции. Преобразование в bradyzoites можно смоделировать в культуре ткани СО 2 голод, используя среде с высоким рН, или добавлением интерферона гамма (IFNγ). Bradyzoites характеризуются наличием кисты стене, к которой лектин Dolichos biflorus агглютининов (DBA) связывает. Флуоресцентно меченных DBA используется для визуализации кисты стене у паразитов, выращенные в человеческие фибробласты крайней плоти (HFFS), которые были выставлены низкие CO 2 и высоким рН среды. Кроме того, паразиты, проживающих в мышиной костномозгового происхождения макрофагов (BMMs) дисплей стенки цисты обнаруживаются DBA после BMMs активируются с IFNγ и липополисахарида (ЛПС). Этот протокол будет показано, как вызвать преобразование T. гондий к bradyzoites использованием высокой питательной среде с низким рН 2 CO и активации BMMs. Клетки-хозяева будут культивировали на покровных, инфицированных tachyzoites и либо активированный с добавлением IFNγ и LPS (BMMs) или подвергается высокой питательной среде рН (HFFS) в течение трех дней. После завершения инфекции, клетки-хозяина будет исправлено, проницаемыми, и блокировали. Киста стены будут визуализированы использованием родамина DBA с флуоресцентной микроскопии.
протокол
1. Подготовка человеческие фибробласты крайней плоти (HFF)-покрытием покровные
- Место стерильные круглые покровного стекла на дне лунки 24-луночного планшета для культуры ткани.
- Для уборки HFFS из сливной 150см 2 колбы, промыть колбу дважды 1X PBS и добавить 2,5 мл 0,025% трипсина-EDTA. Инкубируйте колбы при 37 ° С в течение 5-10 минут.
- Нажатие стороне колбы с ладонь может помочь в отсоединения клеток из колбы. Как только клетки выпустили из колбы, добавляют 150 мл HFF среды (Дульбеко изменения Eagle Средний [DMEM] с 10% FBS, 2 мМ L-глутамина, и 1% пенициллина стрептомицин) и использования средних промыть колбу и собирать клеток.
- Внесите 1 мл клеток на лунку с покровные.
- Разрешить клетки, чтобы стать сливной при 37 ° C, 5% СО 2.
2. Подготовка L929 кондиционированной среды (КМ) для BMC развития
- L929 является мышиным анеуплоидных фибросаркома клеточной линии, которая выделяет макрофаг колониестимулирующий фактор после длительного слияния. Это позволяет секреции см от L929 ячейки, которые будут использованы для разработки мышиных клеток костного мозга в макрофаги в культуре клеток 1.
- После L929 клетки вырожденная, то пусть они инкубировать дополнительные 7-9 дней, пока они появляются сферические и начать отрывая колбу. Сбор супернатант и гранулы любых отдельные клетки в 425 мкг в течение 10 минут. Это супернатант CM.
- Один 150 см 2 колбу клеток L929 дает 30 мл CM, который генерирует 150 мл среды BMC. BMC среда состоит из 10% FBS, 20% CM, 1% пенициллина стрептомицин, и 1% L-глютамина в DMEM.
3. Выделение костный мозг и клеточные культуры контроллеров BMC
- Жертва один C57BL / 6 мышей СО 2 удушья и поверхностных стерилизовать с 70% этанола.
- Expose брюшины, поднимая брюшную кожи вокруг ног и резка ножницами. Избегайте прокола брюшной полости. Сократите до ног, чтобы разоблачить голени и бедра. Сокращение мышечной ткани от костей голени с помощью ножниц.
- Для удаления бедренной кости, один раз отрежь ниже колена, и когда-то у бедра. Место костей в бактериологические чашки Петри, содержащие холодной 1X PBS. Не используйте культуры тканей лечение чашки Петри для этих шагов, потому контроллеров BMC будет придерживаться постоянно. Используйте скальпель, чтобы соскрести дополнительной мышечной ткани. Вырезать кости чуть выше колена, чтобы разоблачить мозга.
- Повторите шаги (б) и (с) для сбора костного мозга от второго бедра.
- Используйте 10cc шприц с холодной 1X PBS и 25 иглы, чтобы сместить костного мозга в 50 мл коническую трубку. Кость должна появиться чистый белый раз мозга удаляется.
- Pass PBS / мозга смесь через 22 иглы, чтобы разбить любой кости агрегатов мозга.
- Спиновые смеси при 425 мкг в течение 10 минут, и удалить супернатант.
- Ресуспендируют гранул в 8 мл среды BMC. Добавьте 1 мл суспензии клеток и 9 мл BMC среду до 8 бактериологических чашках Петри.
- Инкубировать при 37 ° С, 5% СО 2.
- На 5 день, добавляют 10 мл BMC средних каждой пластины. Днем 7, клетки будут полностью разработаны. Контроллеров BMC может быть пассировать в течение 1-2 недель после созревания.
- Чтобы разделить контроллеров BMC, удалить среднего и добавьте 5 мл холодной 1X PBS в каждую чашку Петри. Инкубируйте при 4 ° С в течение 30 минут, пока клетки начинают подниматься. Промыть контроллеров BMC от пластины с стерильной пипетки передачи.
- Бассейн контроллеров BMC в 50 мл коническую трубку и гранул в 425 мкг в течение 10 минут.
- Ресуспендируют гранул в 10 мл BMC средних и рассчитывать на гемоцитометра. Семенной 2x105 контроллеров BMC на лунку в 24-луночный планшет с круглыми покровные стекла на дно. Давайте придерживаться контроллеров BMC ночь до заражения с Т. гондий. Избыточный контроллеров BMC может быть reseeded на чашки Петри для последующего использования.
4. Заражение клеток с Т. гондий
- Infect 25 см 2 колбы вырожденных HFFS с 2x10 6 Т. гондий и расти, пока клетки начинают лизировать (около 2-3 дней).
- Используйте ячейки скребок для удаления инфицированных монослоя клетки-хозяина из колбы культуры ткани затем отпустите паразитов из клеток хозяина, передавая выбили монослоя через 27-иглы.
- Используйте гемоцитометра, чтобы определить количество паразитов в среду.
- Infect 10 5 паразитов на лунку с покровным из HFF монослоев из Протокола № 1, или контроллеров BMC из протокола 3. Пусть паразиты вторгнуться в течение 3 часов при 37 ° C, 5% СО 2.
5. Инициирование Т. гондий bradyzoite развитие экологических стрессов
- Bradyzoite развития в HFFS со средним увеличением рН и CO 2 голода
- Подготовка развития среды. Развитие среда содержит RPMЯ 1640 без бикарбоната, 1% FBS, 1% пенициллина стрептомицин, и 42 мМ HEPES. рН до 8,0 и фильтр стерилизуют.
- Удалить DMEM с зараженных HFFS, промыть 1X PBS, и добавьте 1 мл развития среды.
- Инкубируйте в течение 3 дней при температуре 37 ° С с окружающим воздухом.
- Активация контроллеров BMC
- Подготовка среды для активации BMC. Активация среде BMC среде, дополненной 100U/ml IFN-γ и 100 нг / мл LPS. Разрушать ультразвуком ЛПС на водяной бане в течение 2 минут перед использованием, чтобы сорвать агрегатов.
- Удалить BMC среды из скважин и заменить 1 мл активации среды.
- Инкубировать при 37 ° C, 5% СО 2 в течение 3 дней.
6. Иммунофлуоресценции обнаружения
- Промыть инфицированных скважин три раза 1X PBS.
- Fix монослоя с 200ul в размере 3% формальдегида в течение 20 минут.
- Удалить фиксатор и ополосните скважин с 1X PBS.
- Добавить 200 мкл 0,1 М глицина скважин и дайте постоять 5 минут.
- Удалить глицина и промыть скважин с 1X PBS.
- Добавить 250 мкл 3% BSA/0.2% TritonX-100 в 1X PBS, чтобы permeabilize и блокировать монослоя в течение 30 минут.
- Удалите блокирующий раствор и ополосните скважин с 1X PBS.
- Добавить 50 мкл разведения 1:250 родамина Dolichos biflorus агглютининов в 3% BSA/0.2% Тритон Х-100 в 1X PBS.
- Крышка и место на платформе шейкера при комнатной температуре в течение 1 часа
- Вымойте покровные 3 раза с 0,2% Тритон Х-100 в 1X PBS в течение 5 минут на платформе шейкера.
- Горы покровные использованием VectaShield монтажа среде, содержащей 4'6-diamidino-2-фенилиндола (DAPI).
- Витражи Т. гондий могут быть визуализированы использованием флуоресцентного микроскопа с фильтром подходит для родамина при увеличении в 100 раз.
7. Представитель результаты
На рисунке 1 показана представитель DBA окрашивание Т. гондий в активированных BMMs и HFFS при рН стресса. Оба окрашивания показать DBA вокруг паразита содержащие вакуоли, указывающие на наличие компонентов киста стены. Активированный БММ изображение показывает DBA окрашивания, которая согласуется с поверхности вакуоли. Сечение Т. гондий рН подчеркнул HFFS показывает, киста стены без каких-либо внутренних структур окрашенных.
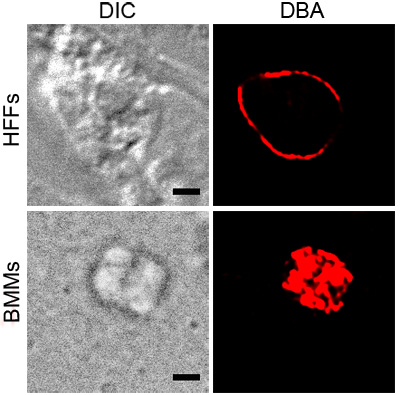
Рисунок 1. DBA окрашивание подчеркнул Т. гондий. внутриклеточные паразиты в условиях стресса, активированный BMMs или рН подчеркнул HFFS, окрашивали родамином сопряженных DBA (красный). Дифференциальная интерференционного контраста (DIC) показывает контуры кисты и черная полоса масштаба равна 2 мкм.
Эксперименты на животных
Эксперименты на животных были проведены в соответствии с руководящими принципами и правилами установленными Университета Висконсина уходу и использованию животных комитета.
Обсуждение
Хотя механизм развития bradyzoite до конца не изучен, молекулярно-генетический анализ Т. гондий стадии преобразования в культуре тканей привело к открытию генов, которые вовлечены в bradyzoite образованию кист 2,3,4. Анализ также привели к наблюдению, что некоторые bradyzoite маркеров, выраженных в иных условиях длительного стресса, в том числе рост активированными макрофагами 5,6. Выше способов описать, как вырастить Т. гондий и вызывают развитие DBA положительные структуры стены кисты в обоих контроллеров BMC и HFFS. Эти результаты свидетельствуют, что пути развития кисты могут быть вызваны различные стимулы стресса.
Поскольку Т. гондий могут расти практически в любой ядросодержащих клеток из теплокровных хозяев, многих типах клеток может быть использован для выращивания T. гондий в пробирке. HFFS были использованы в данном протоколе, потому что они контакте ингибирует клеточную линию. Так как культура клеток bradyzoite развития занимает три дня, она проще в использовании клеточных линий, которые не зарастают. HFFS являются первичные клетки, которые не могут быть культурными на неопределенный срок. Больше HFFS являются пассировать в культуре ткани, менее терпимыми они становятся к высоким рН среды, и таким образом менее непригодными они становятся для bradyzoite переключения. Для получения оптимальных результатов клеток хозяина должна быть низкой проход и позволили, чтобы отдохнуть по крайней мере неделю после того, сливающийся. Есть другие методы для стимулирования развития bradyzoites которые оказывают различное влияние на клетки-хозяина 7.
Т. гондий процветает во многих типов иммунных клеток. Для некоторых приложений контроллеров BMC предпочтительнее макрофагов клеточных линий, потому что они избежать артефактов, которые могут быть введены увековечение 8. Контроллеров BMC также полезны для лабораторного эксперимента, потому что они плоские морфологии по сравнению с RAW264.7 клетки, что делает их более пригодными для микроскопии. Основные культуры BMC метод, описанный здесь, может быть адаптирован для других целей, в том числе производство контроллеров BMC от других линий мышей 9,10. Степень активации видели с IFNγ и ЛПС может отличаться в зависимости от поставщика и даже много. Поэтому необходимо для титрования количество ЛПС и IFNγ, используемые в активации среды для оптимальной и последовательной работы.
Раскрытие информации
Благодарности
Материалы
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | GIBCO, by Life Technologies | 11960-051 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | heat inactivate |
| Rhodamine Dolichos biflorus agglutinin | Vector Laboratories | RL-1032 | |
| Formaldehyde (16%) | Polysciences, Inc. | 18814 | |
| Glycine | Fisher Scientific | BP381-5 | |
| HEPES | Fisher Scientific | BP310-1 | |
| IFNγ | PeproTech Inc | 315-05 | Store in single use aliquots |
| L-glutamine (200mM) | GIBCO, by Life Technologies | 25030 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L4391-1MG | Store in single use aliquots |
| Microscope Cover Glass | Fisher Scientific | 12-545-80 12CIR-1 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| RPMI medium 1640 powder (with L-glutamine, without bicarbonate) | GIBCO, by Life Technologies | 31800-022 | |
| Triton-X-100 | Fisher Scientific | BP151-500 | |
| Trypsin-EDTA (0.25%) | GIBCO, by Life Technologies | 25200 | |
| VectaShield mounting media with DAPI | Vector Laboratories | H-1200 |
Ссылки
- Tomida, M., Yamamoto-Yamaguchi, Y., Hozumi, M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 259 (17), 10978-10980 (1984).
- Matrajt, M., Donald, R. G., Singh, U., Roos, D. S. Identification and characterization of differentiation mutants in the protozoan parasite Toxoplasma gondii. Mol Microbiol. 44, 735-747 (2002).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Mol Microbiol. 44, 721-733 (2002).
- J, P., Knoll, L. J. Isolation of Toxoplasma gondii development mutants identifies a potential proteophosphogylcan that enhances cyst wall formation. Molecular and Biochemical Parasitology. 169 (2), 120-123 (2010).
- Bohne, W., Heesemann, J., Gross, U. Induction of Bradyzoite-Specific Toxoplasma gondii Antigens in Gamma Interferon-Treated Mouse Macrophages. Infection and Immunity. 61 (3), 1141-1145 (1993).
- Ibrahim, H. M., Bannai, H., Xuan, X., Nishikawa, Y. Toxoplasma gondii Cyclophilin 18-Mediated Production of Nitric Oxide Induces Bradyzoite Conversion in a CCR5-Dependent Manner. Infection and Immunity. 77 (9), 3686-3695 (2009).
- Lyons, R. E., McLeod, R., Roberts, C. W. Toxoplasma gondii tachyzoite-bradyzoite interconversion. Trends in Parasitology. 18 (5), 198-201 (2002).
- Berghaus, L. J., Moore, J. N., Hurley, D. J., Vandenplas, M. L., Fortes, B. P., Wolfert, M. A., Boons, G. J. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comp Immunol Microbiol Infect Dis. , (2009).
- Mordue, D. G., Scott-Weathers, C. F., Tobin, C. M., Knoll, L. J. A patatin-like protein protects Toxoplasma gondii from degradation in activated macrophages. Mol Microbiol. 63 (2), 482-496 (2007).
- Bohne, W., Heesemann, J., Gross, U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infection and Immunity. 62 (5), 1761-1777 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены