Method Article
Quiste Toxoplasma gondii Muro de Formación en Activado médula ósea procedentes de los macrófagos y Condiciones bradizoíto
En este artículo
Resumen
Toxoplasma gondii se convierte en una forma de quiste en respuesta al estrés ambiental, que puede ser imitado en los modelos de cultivo de tejidos. Este video muestra las técnicas para examinar la formación de la pared del quiste mediante la activación de médula ósea procedentes de los macrófagos o el cambio de pH de crecimiento medio en las células de fibroblastos.
Resumen
Toxoplasma gondii es un parásito intracelular obligado que puede invadir cualquier célula nucleada de animales de sangre caliente. Durante la infección, T. gondii difunde como una forma de replicar rápida llamada de taquizoitos. Taquizoitos de convertirse en una forma enquistada de crecimiento lento llamado bradizoíto por un proceso de señalización que no está bien caracterizado. Dentro de los animales, los quistes bradizoíto se encuentran en el sistema nervioso central y el tejido muscular y representan la etapa crónica de la infección. La conversión a bradizoítos se pueden simular en el cultivo de tejidos de CO 2 de hambre, utilizando un medio con un pH alto, o la adición de interferón gamma (IFN). Bradizoítos se caracterizan por la presencia de una pared del quiste, a la que la lectina de Dolichos biflorus aglutinina (DBA) se une. DBA etiqueta fluorescente se utiliza para visualizar la pared del quiste en los parásitos cultivados en fibroblastos de prepucio humano (HFFS) que han sido expuestos a bajas emisiones de CO 2 y medio de alto pH. Del mismo modo, los parásitos que residen en el hueso murinas derivadas de la médula macrófagos (BMMs) muestran una pared del quiste detectable por DBA después de la BMMs se activan con IFN y lipopolisacárido (LPS). Este protocolo será demostrar cómo inducir a la conversión de T. gondii a bradizoítos utilizando un medio de pH alto crecimiento con bajas emisiones de CO 2 y la activación de BMMs. Las células huésped se cultivaron en cubreobjetos, infectados con taquizoítos y sea activado con la adición de IFN y LPS (BMMs) o expuestos a un medio de pH alto crecimiento (HFFS) de tres días. Al término de las infecciones, las células huésped se fija, permeabilized y bloqueado. Las paredes del quiste se visualizan mediante DBA rodamina con microscopía de fluorescencia.
Protocolo
1. Preparación de fibroblastos de prepucio humano (HFF) recubierto cubreobjetos
- Coloque un cubreobjetos de vidrio estériles redonda sobre el fondo de los pozos de una placa de tejido de 24 pocillos.
- Para la cosecha de un HFFS confluentes 150 cm 2 matraz, enjuagar el frasco dos veces con PBS 1X y añadir 2,5 ml de 0,025% de tripsina-EDTA. Incubar matraz a 37 ° C durante 5-10 minutos.
- Tocando el lateral del recipiente contra la palma de su mano puede ayudar a separar las células del frasco. Una vez que las células se han dado de alta del matraz, añadir 150 ml de HFF medio (Dulbecco modificada de Eagle Medium [DMEM] con 10% de SFB, 2 mM L-glutamina y 1% de penicilina-estreptomicina) y usar el medio para enjuagar el frasco y recoger las células.
- Dispensar 1 ml de células por pocillo con el cubreobjetos.
- Permiten a las células para convertirse en confluentes a 37 ° C, 5% de CO 2.
2. Preparación L929 medio condicionado (CM) de BMC desarrollo
- L929 es un fibrosarcoma murino aneuploides línea de células que secreta el factor estimulante de colonias de macrófagos después de largos períodos de confluencia. Esto permite que la secreción de las células L929 CM a ser utilizado para desarrollar células de médula ósea de ratón se convierten en macrófagos en cultivo celular 1.
- Una vez que las células L929 son confluentes, que los incuban por un período adicional de 7-9 días hasta que aparecen esférico y comenzar a levantar de la botella. Recoger el líquido sobrenadante y pellet cualquier célula independiente a 425 xg durante 10 minutos. Este sobrenadante es el CM.
- Un frasco de 150 cm2 de células L929 rinde 30 ml de la CM, que genera 150 ml de medio de BMC. BMC medio está compuesto de 10% de SFB, 20% de CM, el 1% de penicilina-estreptomicina, y el 1% de L-glutamina en DMEM.
3. El aislamiento de la médula ósea y cultivo de células de BMC
- Sacrificio de un C57BL / 6 ratones por asfixia de CO 2 y la superficie de esterilizar con un 70% de etanol.
- Exponer el peritoneo, levantando la piel del abdomen, cerca de la pierna y cortar con tijeras. Evitar perforar la cavidad peritoneal. Reducir a la pierna para exponer la tibia y el fémur. Cortar el tejido muscular de los huesos de las piernas con unas tijeras.
- Para eliminar el fémur, una vez cortadas por debajo de la rodilla y una vez cerca de la cadera. Coloque los huesos en una placa de Petri que contiene bacteriológica frío PBS 1X. No utilice el cultivo de tejidos tratados con placas de Petri para estas medidas porque los PMP se adhiere de forma permanente. Use un bisturí para raspar el tejido muscular extra. Cortar el hueso justo por encima de la rodilla para exponer la médula ósea.
- Repita los pasos (b) y (c) para recolectar la médula ósea del fémur segundos.
- Use una jeringa de 10cc llena de frío PBS 1X y una aguja de calibre 25 para desalojar a la médula ósea en un tubo cónico de 50 ml. El hueso debe aparecer pura médula, una vez el blanco es eliminado.
- Pase la mezcla de PBS / médula ósea a través de una aguja de calibre 22 para romper los agregados de médula ósea.
- Haga girar la mezcla a 425 xg durante 10 minutos, y eliminar el sobrenadante.
- Resuspender el precipitado en 8 ml de medio de BMC. Añadir 1 ml de suspensión celular y 9 ml de medio de BMC a 8 bacteriológica placas de Petri.
- Se incuba a 37 ° C, 5% de CO 2.
- El día 5, añadir 10 ml de medio de BMC para cada plato. El día 7, las células se desarrollará plenamente. BMC pueden ser pasados por 1-2 semanas después de la maduración.
- Para dividir BMC, se elimina el medio y añadir 5 ml de PBS frío 1X a cada placa de Petri. Incubar a 4 ° C durante 30 minutos, hasta que las células comienzan a levantar. Enjuague los PMP de la placa con una pipeta de transferencia estéril.
- La piscina del BMC en un tubo cónico de 50 ml y el pellet a 425 xg durante 10 minutos.
- Resuspender el precipitado en 10 ml de medio de BMC y el recuento en un hemocitómetro. Semillas de 2x105 BMC por pocillo en una placa de 24 pocillos con cubreobjetos de vidrio redondas en la parte inferior. Deje que los PMP se adhieran noche a la mañana antes de infectar con T. gondii. BMC en exceso puede ser sembrados en placas de Petri para su uso posterior.
4. Infectar células con T. gondii
- Infectar a 25 cm 2 frasco de HFFS confluentes con 2x10 6 T. gondii y crecer hasta que las células comienzan a lisar (2-3 días).
- Use un raspador para eliminar células de la monocapa de células huésped infectadas desde el frasco de cultivo de tejido y luego suelte los parásitos de las células huésped pasando la monocapa desalojados a través de una aguja de calibre 27.
- Use un hemocitómetro para determinar el número de parásitos en el medio.
- Infectar a 10 5 parásitos por bien con cubreobjetos de monocapas de HFF del Protocolo n º 1, o de países miembros prestatarios del Protocolo n º 3. Deje que los parásitos invaden durante 3 horas a 37 ° C, 5% de CO 2.
5. Iniciar T. gondii bradizoíto desarrollo por el estrés ambiental
- Bradizoíto desarrollo en HFFS con el aumento de pH del medio y el hambre de CO 2
- Preparar el medio de desarrollo. Medio de desarrollo contiene RPMI 1640 sin bicarbonato, 1% de SFB, 1% de penicilina-estreptomicina, y 42 mM HEPES. el pH a 8.0 y el filtro de esterilización.
- Quitar DMEM de HFFS infectados, enjuague con PBS 1X, y añadir 1 ml de medio de desarrollo.
- Incubar durante 3 días a 37 º C con el aire ambiente.
- La activación de BMC
- Preparar el medio para activar la BMC. Medio de la activación es de tamaño medio BMC complementado con IFN-γ 100U/ml y 100 ng / ml LPS. Sonicar LPS en un baño de agua durante 2 minutos antes de su uso para interrumpir los agregados.
- Quitar BMC medio de pozos y reemplazar con 1 ml de medio de activación.
- Se incuba a 37 ° C, 5% de CO 2 durante 3 días.
6. Detección de inmunofluorescencia
- Enjuague infectadas tres veces con PBS 1X.
- Fijar la monocapa con 200ul de 3% de formaldehído durante 20 minutos.
- Retire el fijador y enjuague los pozos con PBS 1X.
- Agregar 200μl de 0,1 M de glicina a los pozos y dejar reposar durante 5 minutos.
- Eliminar la glicina y enjuague los pozos con PBS 1X.
- Añadir 250 ml del 3% BSA/0.2% TritonX-100 en PBS 1X a permeabilizar y bloquear la monocapa durante 30 minutos.
- Retire la solución de bloqueo y enjuagar los pocillos con PBS 1X.
- Añadir 50 l de una dilución 1:250 de rodamina Dolichos biflorus aglutinina en el 3% BSA/0.2% Triton X-100 en PBS 1X.
- Cubierta de la placa y el lugar en la plataforma de agitación a temperatura ambiente durante 1 hora
- Lavar los cubreobjetos 3 veces con 0,2% Triton X-100 en PBS 1X durante 5 minutos cada uno en un agitador de plataforma.
- Cubreobjetos utilizando medio de montaje Vectashield montaje que contiene 4'6-diamidino-2-phenylindole (DAPI).
- Manchado T. gondii pueden ser visualizados con un microscopio de fluorescencia con un filtro apropiado para rodamina con un aumento de 100x.
7. Los resultados representativos
La figura 1 muestra tinción representante DBA de T. gondii en BMMs activado y HFFS pH bajo estrés. Ambas manchas DBA mostrar todo parásito que contienen vacuolas, lo que indica la presencia de componentes de la pared del quiste. La imagen muestra la tinción BMM activado DBA que es consistente con la superficie de la vacuola. La sección transversal de la T. gondii en el pH destacó HFFS muestra la pared del quiste sin estructuras internas manchadas.
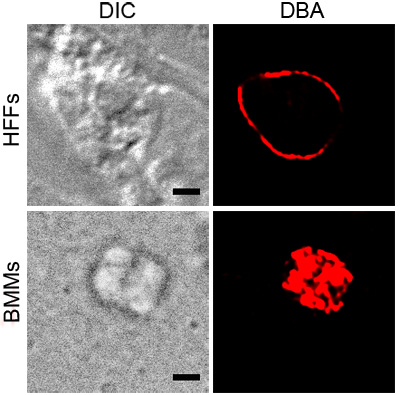
Figura 1. DBA destacó la tinción de T. gondii. parásitos intracelulares en condiciones de estrés, BMMs activa o pH destacó HFFS, se tiñeron con DBA rodamina conjugado (rojo). Contraste de interferencia diferencial (DIC) se muestra el esquema del quiste y la barra de escala negro es igual a 2 micras.
Los experimentos con animales
Los experimentos con animales se realizaron de acuerdo con las directrices y normas establecidas por la Universidad de Wisconsin Cuidado de Animales y el empleo.
Discusión
Si bien el mecanismo de desarrollo bradizoíto no se entiende completamente, los análisis de genética molecular de T. conversión gondii etapa de cultivo de tejidos ha llevado al descubrimiento de genes que están involucrados en la formación de quistes bradizoíto 2,3,4. El análisis también dio lugar a la observación de que algunos marcadores bradizoíto se expresan en otras condiciones de estrés prolongado, como el crecimiento en los macrófagos activados 5,6. Los métodos anteriores describen cómo crecen T. gondii y el desarrollo de inducir a un DBA estructura positiva pared del quiste, tanto en países miembros prestatarios y HFFS. Estos resultados ponen de manifiesto que la vía de desarrollo de un quiste puede ser inducida por estímulos de estrés diferentes.
Debido a que T. gondii puede crecer en prácticamente cualquier célula nucleada de alimentar con sangre, muchos tipos de células pueden ser utilizadas para el cultivo T. gondii in vitro. HFFS se utilizaron en este protocolo, ya que está en contacto inhibe la línea celular. Desde el cultivo de células de desarrollo bradizoíto lleva tres días, es más fácil de usar líneas de células que no crecen en exceso. HFFS son las células primarias que no pueden ser cultivadas indefinidamente. El HFFS ya se pasan en el cultivo de tejidos, los menos tolerantes se vuelven a medio alto pH, y por lo tanto menos que se conviertan en inservibles para la conmutación de bradizoíto. Para obtener resultados óptimos, las células del huésped debe ser el paso de baja y se deja descansar por lo menos una semana después de convertirse en confluentes. Hay otros métodos para inducir el desarrollo de bradizoítos que tienen diferentes efectos en la célula huésped 7.
T. gondii crece en muchos tipos de células inmunes. Para algunas aplicaciones, BMC son preferibles a las líneas celulares de macrófagos, ya que puede evitar los artefactos que han sido introducidos por la inmortalización 8. BMC también son útiles para los experimentos in vitro, ya que tienen una morfología plana en comparación con RAW264.7 células, haciéndolas más susceptibles a la microscopía. El método básico BMC cultura descritas aquí pueden ser adaptados para otros fines, incluyendo la producción de países miembros prestatarios a partir de cepas de ratón 9,10. El grado de activación visto con IFN y LPS puede variar según el vendedor, e incluso el lote. Por ello es necesario para valorar las cantidades de LPS y IFN utilizado en el medio de activación para un desempeño óptimo y consistente.
Divulgaciones
Agradecimientos
Materiales
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | GIBCO, by Life Technologies | 11960-051 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | heat inactivate |
| Rhodamine Dolichos biflorus agglutinin | Vector Laboratories | RL-1032 | |
| Formaldehyde (16%) | Polysciences, Inc. | 18814 | |
| Glycine | Fisher Scientific | BP381-5 | |
| HEPES | Fisher Scientific | BP310-1 | |
| IFNγ | PeproTech Inc | 315-05 | Store in single use aliquots |
| L-glutamine (200mM) | GIBCO, by Life Technologies | 25030 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L4391-1MG | Store in single use aliquots |
| Microscope Cover Glass | Fisher Scientific | 12-545-80 12CIR-1 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| RPMI medium 1640 powder (with L-glutamine, without bicarbonate) | GIBCO, by Life Technologies | 31800-022 | |
| Triton-X-100 | Fisher Scientific | BP151-500 | |
| Trypsin-EDTA (0.25%) | GIBCO, by Life Technologies | 25200 | |
| VectaShield mounting media with DAPI | Vector Laboratories | H-1200 |
Referencias
- Tomida, M., Yamamoto-Yamaguchi, Y., Hozumi, M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 259 (17), 10978-10980 (1984).
- Matrajt, M., Donald, R. G., Singh, U., Roos, D. S. Identification and characterization of differentiation mutants in the protozoan parasite Toxoplasma gondii. Mol Microbiol. 44, 735-747 (2002).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Mol Microbiol. 44, 721-733 (2002).
- J, P., Knoll, L. J. Isolation of Toxoplasma gondii development mutants identifies a potential proteophosphogylcan that enhances cyst wall formation. Molecular and Biochemical Parasitology. 169 (2), 120-123 (2010).
- Bohne, W., Heesemann, J., Gross, U. Induction of Bradyzoite-Specific Toxoplasma gondii Antigens in Gamma Interferon-Treated Mouse Macrophages. Infection and Immunity. 61 (3), 1141-1145 (1993).
- Ibrahim, H. M., Bannai, H., Xuan, X., Nishikawa, Y. Toxoplasma gondii Cyclophilin 18-Mediated Production of Nitric Oxide Induces Bradyzoite Conversion in a CCR5-Dependent Manner. Infection and Immunity. 77 (9), 3686-3695 (2009).
- Lyons, R. E., McLeod, R., Roberts, C. W. Toxoplasma gondii tachyzoite-bradyzoite interconversion. Trends in Parasitology. 18 (5), 198-201 (2002).
- Berghaus, L. J., Moore, J. N., Hurley, D. J., Vandenplas, M. L., Fortes, B. P., Wolfert, M. A., Boons, G. J. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comp Immunol Microbiol Infect Dis. , (2009).
- Mordue, D. G., Scott-Weathers, C. F., Tobin, C. M., Knoll, L. J. A patatin-like protein protects Toxoplasma gondii from degradation in activated macrophages. Mol Microbiol. 63 (2), 482-496 (2007).
- Bohne, W., Heesemann, J., Gross, U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infection and Immunity. 62 (5), 1761-1777 (1994).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados