Method Article
Toxoplasma gondii Zystenwand Formation in Activated Knochenmark abgeleiteten Makrophagen und Bradyzoite AGB
In diesem Artikel
Zusammenfassung
Toxoplasma gondii verwandelt sich in eine Zyste bilden als Reaktion auf Belastungen der Umwelt, die in Gewebekultur-Modellen nachgeahmt werden kann. Dieses Video zeigt Techniken, um Zystenwand Bildung durch Aktivierung des Knochenmarks-Makrophagen oder Ändern Wachstumsmedium pH in Fibroblasten-Zellen zu untersuchen.
Zusammenfassung
Toxoplasma gondii ist ein obligat intrazelluläre Parasiten, die jeder kernhaltigen Zelle des Warmblüter eindringen können. Während der Infektion, T. gondii verbreitet als schneller replizierende Form genannt tachyzoite. Tachyzoiten in eine langsam wachsende encystierten Form genannt bradyzoite durch eine Signalisierung, die nicht gut charakterisiert konvertieren. Innerhalb Tiere sind bradyzoite Zysten in das zentrale Nervensystem und Muskelgewebe und stellen die chronische Phase der Infektion. Die Umstellung auf Bradyzoiten können in Gewebekultur simuliert CO 2 Hunger, mit Medium mit hoher pH-Wert oder die Zugabe von Interferon-gamma (IFN &ggr;). Bradyzoiten werden durch die Anwesenheit einer Zystenwand, zu denen das Lektin Dolichos biflorus Agglutinin (DBA) bindet charakterisiert. Fluoreszenzmarkierten DBA wird die Zystenwand in Parasiten im menschlichen Vorhaut-Fibroblasten (HFFS), die zu niedrigen CO 2 und hoher pH-Milieu ausgesetzt waren, gewachsen zu visualisieren. Ebenso, wohnhaft Parasiten in murinen Knochenmark-Makrophagen (BMMS) zeigt eine Zystenwand nachweisbar durch DBA nach dem BMMS mit IFNy und Lipopolysaccharid (LPS) aktiviert werden. Dieses Protokoll wird zeigen, wie die Umwandlung von T. induzieren gondii zu Bradyzoiten mit einem hohen pH-Wachstumsmedium mit niedrigem CO 2 und die Aktivierung der BMMS. Wirtszellen wird auf Deckgläsern kultiviert werden, infiziert mit Tachyzoiten und entweder mit Zugabe von IFN &ggr; und LPS (BMMS) aktiviert oder die von einem hohen pH Wachstumsmedium (HFFS) für drei Tage. Nach Abschluss der Infektionen wird Wirtszellen fixiert, permeabilisiert werden, und blockiert. Cyst Wände werden visualisiert Rhodamin DBA mit Fluoreszenzmikroskopie.
Protokoll
1. Vorbereitung der menschlichen Vorhaut-Fibroblasten (HFF)-beschichteten Deckgläschen
- Legen Sie eine sterile runde Deckglas auf dem Boden der Wells einer 24-well Zellkulturschale.
- Zur Ernte HFFS aus einer konfluenten 150cm 2 Flasche, spülen Sie die Flasche zweimal mit 1X PBS und 2,5 ml von 0,025% Trypsin-EDTA. Inkubieren Kolben bei 37 ° C für 5-10 Minuten.
- Tippen Sie auf die Seite der Kolben gegen die Handfläche in Ablösen der Zellen aus der Flasche zu unterstützen. Sobald Zellen aus dem Kolben gelöst, fügen Sie 150 ml der HFF Medium (Dulbecco Modified Eagle Medium [DMEM] mit 10% FBS, 2 mM L-Glutamin und 1% Penicillin-Streptomycin) zu verwenden und das Medium in den Kolben spülen und zu sammeln der Zellen.
- Dispense 1 ml der Zellen pro Vertiefung mit dem Deckgläschen.
- Lassen Zellen zu bei 37 konfluenten ° C, 5% CO 2.
2. Vorbereitung L929 konditioniertem Medium (CM) für BMC Entwicklung
- L929 ist eine murine aneuploid Fibrosarkom-Zelllinie, die Makrophagen-Kolonie-stimulierender Faktor sondert nach längerer Konfluenz. Dieses Sekret kann der CM von L929-Zellen verwendet werden, um auf Knochenmarkszellen der Maus in die Makrophagen in Zellkultur 1 zu entwickeln sein.
- Sobald L929 Zellen konfluent sind, lassen Sie sie für eine weitere 7-9 Tage inkubieren, bis sie kugelförmig und erscheinen beginnen Abheben des Kolbens. Sammeln Überstand und Pellet keine abgelösten Zellen bei 425 xg für 10 Minuten. Dieser Überstand ist der CM.
- Ein 150 cm 2-Kolben von L929-Zellen ergibt 30 ml CM, die 150 ml des BMC Medium erzeugt. BMC Medium ist von 10% FBS, 20% CM, 1% Penicillin-Streptomycin und 1% L-Glutamin in DMEM zusammen.
3. Isolierung von Knochenmark-und Zellkultur von BMC
- Opfern C57BL / 6 Maus durch CO 2 Ersticken und Oberfläche sterilisieren mit 70% Ethanol.
- Expose des Bauchfells durch Anheben der Bauchhaut in der Nähe des Beines und Schneiden mit der Schere. Vermeiden Sie Punktion der Bauchhöhle. Reduzieren Sie das Bein an der Tibia und des Femurs freizulegen. Cut Muskelgewebe aus dem Beinknochen mit einer Schere.
- Um den Oberschenkelknochen entfernen, einmal unter dem Knie und einmal in der Nähe der Hüfte geschnitten. Legen Sie die Knochen in eine bakteriologische Petrischale mit kaltem 1X PBS. Verwenden Sie keine Gewebekultur behandelt Petrischalen für diese Schritte, da die BMC dauerhaft halten wird. Verwenden Sie ein Skalpell abkratzen zusätzliche Muskelgewebe. Schneiden Sie die Knochen knapp oberhalb des Knies bis auf die Knochen freizulegen.
- Wiederholen Sie die Schritte (b) und (c) des Knochenmarks aus der zweiten Femur zu sammeln.
- Verwenden Sie einen 10cc Spritze mit kaltem 1X PBS und eine 25-Gauge-Nadel in das Knochenmark in einem 50 ml konischen Rohr entfernen gefüllt. Die Knochen erscheinen soll reinweiß einmal Knochenmark entnommen wird.
- Führen Sie das PBS / Knochenmark-Gemisch durch eine 22-Gauge-Nadel zu zerbrechen alle Knochenmark-Aggregate.
- Drehen Sie die Mischung bei 425 xg für 10 Minuten, und entfernen Sie den Überstand.
- Das Pellet in 8 ml BMC Medium. 1 ml der Zellsuspension und 9 ml BMC Medium zu 8 bakteriologischen Petrischalen.
- Bei 37 ° C, 5% CO 2.
- Am Tag 5, 10 ml BMC Medium zu jeder Platte. Am Tag 7, werden die Zellen voll entwickelt sein. BMC können für 1-2 Wochen nach der Reifung passagiert werden.
- So teilen BMC, entfernen Sie das Medium und mit 5 ml kaltem 1X PBS, um jede Petrischale. Inkubation bei 4 ° C für 30 Minuten, bis die Zellen zu heben beginnen. Spülen Sie den BMC von der Platte mit einem sterilen Transferpipette.
- Pool der BMC in einem 50 ml konischen Rohr-und Pellet bei 425 xg für 10 Minuten.
- Das Pellet in 10 ml Medium BMC und zählen auf einer Zählkammer. Seed 2x105 BMC pro Well in einer 24-Well-Platte mit runden Deckgläschen auf der Unterseite. Lassen Sie den BMC über Nacht halten, bevor Infektion mit T. gondii. Excess BMC kann auf Petrischalen für die spätere Verwendung reseeded werden.
4. Infizieren Zellen mit T. gondii
- Infect 25 cm 2 Flasche konfluent HFFS mit 2x10 6 T. gondii und wachsen, bis die Zellen zu lysieren beginnen (ca. 2-3 Tage).
- Verwenden Sie einen Zellschaber der infizierten Wirtszelle Monoschicht aus der Zellkulturflasche entfernen Sie dann die Parasiten aus den Wirtszellen, indem das verdrängt Monoschicht durch eine 27-Gauge-Nadel.
- Verwenden Sie eine Zählkammer die Anzahl der Parasiten in das Medium zu bestimmen.
- Infect 10 5 Parasiten pro Well mit Deckglas des HFF-Monoschichten von Protokoll 1, oder BMC von Protokoll Nr. 3. Lassen Sie die Parasiten dringen 3 Stunden bei 37 ° C, 5% CO 2.
5. Initiieren von T. gondii bradyzoite Entwicklung von Belastungen der Umwelt
- Bradyzoite Entwicklung in HFFS mit mittleren pH-Wert erhöhen und die CO 2 Hungertod
- Bereiten Entwicklung Medium. Entwicklung Medium enthält RPMI 1640 ohne Bicarbonat, 1% FBS, 1% Penicillin-Streptomycin und 42 mM HEPES. pH auf 8,0 und Filter zu sterilisieren.
- Entfernen DMEM aus infizierten HFFS mit 1X PBS spülen, und fügen Sie 1ml Entwicklung Medium.
- Inkubieren für 3 Tage bei 37 ° C mit Umgebungsluft.
- Die Aktivierung von BMC
- Bereiten Sie mittel-bis BMC aktivieren. Activation Medium ist BMC Medium mit IFN-γ 100U/ml und 100 ng / ml LPS ergänzt. Ultraschallbad LPS in einem Wasserbad für 2 Minuten vor der Verwendung zu Aggregaten zu stören.
- Entfernen BMC Medium aus Brunnen und ersetzen mit 1 ml der Aktivierung Medium.
- Bei 37 ° C, 5% CO 2 für 3 Tage.
6. Immunfluoreszenz-Nachweis
- Spülen infizierten Vertiefungen dreimal mit 1X PBS.
- Fix der Monoschicht mit 200 &mgr; l von 3% Formaldehyd für 20 Minuten.
- Entfernen Fixativ und spülen Brunnen mit 1X PBS.
- Add 200 ul von 0,1 M Glycin, um Brunnen und lassen Sie sich für 5 Minuten.
- Entfernen Glycin und spülen Brunnen mit 1X PBS.
- Add 250 ul 3% BSA/0.2% TritonX-100 in 1X PBS permeabilisiert und blockieren die Monolayer für 30 Minuten.
- Entfernen Sie blockiert und spülen Brunnen mit 1X PBS.
- Add 50 ul einer 1:250 Verdünnung von Rhodamin Dolichos biflorus Agglutinin in 3% BSA/0.2% Triton X-100 in 1X PBS.
- Abdeckplatte und legen auf der Plattform Schüttler bei Raumtemperatur für 1 Stunde
- Waschen Sie die Deckgläschen 3 mal mit 0,2% Triton X-100 in 1X PBS für jeweils 5 Minuten auf einer Plattform Schüttler.
- Berg Deckgläser mit Vectashield Eindeckmedium mit 4'6-diamidino-2-phenylindole (DAPI).
- Stained T. gondii visualisiert werden können mit Hilfe eines Fluoreszenz-Mikroskops mit einem Filter geeignet für Rhodamin bei einer Vergrößerung von 100x.
7. Repräsentative Ergebnisse
Abbildung 1 zeigt repräsentative DBA-Färbung von T. gondii in aktiviert BMMS und HFFS unter pH Stress. Beide zeigen DBA Färbung um Parasiten mit Vakuolen, die das Vorhandensein von Zystenwand Komponenten. Die aktivierte BMM Bild zeigt DBA Färbung, die mit der Oberfläche der Vakuole ist. Der Querschnitt des T. gondii in pH betonte HFFS zeigt die Zystenwand ohne internen Strukturen gefärbt.
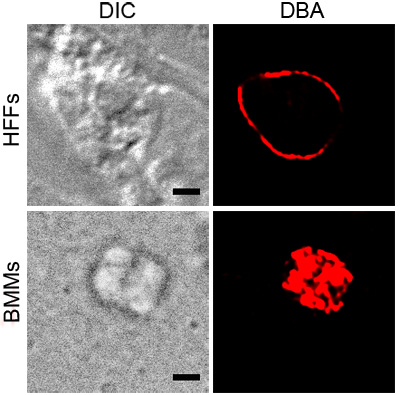
Abbildung 1. DBA Färbung betont T. gondii. intrazelluläre Parasiten unter Stress-Bedingungen, aktiviert BMMS oder pH betonte HFFS wurden mit Rhodamin konjugiert DBA (rot) gefärbt. Differential-Interferenz-Kontrast (DIC) zeigt den Umriss der Zyste und dem schwarzen Maßstab entspricht 2 pM.
Experimente an Tieren
Tierversuche wurden in Übereinstimmung mit den Richtlinien und Vorschriften her von der University of Wisconsin Animal Care und Verwenden Ausschusses durchgeführt.
Diskussion
Während der Mechanismus der bradyzoite Entwicklung ist noch nicht vollständig verstanden, molekulargenetische Analysen von T. gondii Bühne Umwandlung in Gewebekultur hat zur Entdeckung von Genen, die in bradyzoite Zystenbildung 2,3,4 beteiligt sind geführt. Die Analysen auch auf die Beobachtung, dass einige bradyzoite Marker in anderen längeren Stress-Bedingungen, einschließlich des Wachstums in aktivierten Makrophagen 5,6 ausgedrückt werden geführt. Die oben genannten Methoden beschreiben, wie T. wachsen gondii und induzieren die Entwicklung eines DBA positive Zystenwand Struktur in beiden BMC und HFFS. Diese Ergebnisse unterstreichen, dass die Entwicklung von Zysten Weg durch verschiedene Stress-Stimuli induziert werden kann.
Da T. gondii kann in nahezu jeder kernhaltigen Zelle von warmblütigen Gastgeber wachsen, können viele Zelltypen verwendet, um T. wachsen gondii in vitro. HFFS wurden in diesem Protokoll verwendet, weil sie einen Kontakt gehemmt Zelllinie. Da Zellkultur bradyzoite Entwicklung dauert drei Tage, ist es einfacher, Zell-Linien, die nicht überwuchern verwenden wird. HFFS sind primäre Zellen, die nicht kultiviert unbegrenzt sein kann. Je länger HFFS in Gewebekultur sind passagiert, desto weniger tolerant werden sie zu hohen pH-Milieu und damit die weniger unbrauchbar werden sie für bradyzoite Schalten. Für optimale Ergebnisse sollte die Wirtszellen niedrigen Durchgang werden und ruhen können mindestens eine Woche, nachdem er konfluent. Es gibt alternative Methoden zur Induktion der Entwicklung bis zur Bradyzoiten, dass unterschiedliche Wirkungen auf die Wirtszelle 7 haben.
T. gondii gedeiht in vielen Zelltypen. Für manche Anwendungen sind BMCs vorzuziehen Zelllinien Makrophagen, weil sie Artefakte, die durch Immortalisierung 8 wurden eingeführt haben können, zu vermeiden. BMC sind auch nützlich für die in-vitro-Experimente, weil sie eine flache Morphologie im Vergleich zu RAW 264.7-Zellen haben macht sie zugänglich für Mikroskopie. Die grundlegende BMC Kultur hier beschriebene Methode kann für andere Zwecke angepasst werden, einschließlich der Erzeugung von BMC aus anderen Mausstämme 9,10. Der Grad der Aktivierung mit IFN &ggr; und LPS gesehen kann je nach Anbieter unterschiedlich und auch die Menge. Es ist daher notwendig, die Mengen von LPS und IFN &ggr; bei der Aktivierung Medium für eine optimale und konstante Leistung verwendet titrieren.
Offenlegungen
Danksagungen
Materialien
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | GIBCO, by Life Technologies | 11960-051 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | heat inactivate |
| Rhodamine Dolichos biflorus agglutinin | Vector Laboratories | RL-1032 | |
| Formaldehyde (16%) | Polysciences, Inc. | 18814 | |
| Glycine | Fisher Scientific | BP381-5 | |
| HEPES | Fisher Scientific | BP310-1 | |
| IFNγ | PeproTech Inc | 315-05 | Store in single use aliquots |
| L-glutamine (200mM) | GIBCO, by Life Technologies | 25030 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L4391-1MG | Store in single use aliquots |
| Microscope Cover Glass | Fisher Scientific | 12-545-80 12CIR-1 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| RPMI medium 1640 powder (with L-glutamine, without bicarbonate) | GIBCO, by Life Technologies | 31800-022 | |
| Triton-X-100 | Fisher Scientific | BP151-500 | |
| Trypsin-EDTA (0.25%) | GIBCO, by Life Technologies | 25200 | |
| VectaShield mounting media with DAPI | Vector Laboratories | H-1200 |
Referenzen
- Tomida, M., Yamamoto-Yamaguchi, Y., Hozumi, M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 259 (17), 10978-10980 (1984).
- Matrajt, M., Donald, R. G., Singh, U., Roos, D. S. Identification and characterization of differentiation mutants in the protozoan parasite Toxoplasma gondii. Mol Microbiol. 44, 735-747 (2002).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Mol Microbiol. 44, 721-733 (2002).
- J, P., Knoll, L. J. Isolation of Toxoplasma gondii development mutants identifies a potential proteophosphogylcan that enhances cyst wall formation. Molecular and Biochemical Parasitology. 169 (2), 120-123 (2010).
- Bohne, W., Heesemann, J., Gross, U. Induction of Bradyzoite-Specific Toxoplasma gondii Antigens in Gamma Interferon-Treated Mouse Macrophages. Infection and Immunity. 61 (3), 1141-1145 (1993).
- Ibrahim, H. M., Bannai, H., Xuan, X., Nishikawa, Y. Toxoplasma gondii Cyclophilin 18-Mediated Production of Nitric Oxide Induces Bradyzoite Conversion in a CCR5-Dependent Manner. Infection and Immunity. 77 (9), 3686-3695 (2009).
- Lyons, R. E., McLeod, R., Roberts, C. W. Toxoplasma gondii tachyzoite-bradyzoite interconversion. Trends in Parasitology. 18 (5), 198-201 (2002).
- Berghaus, L. J., Moore, J. N., Hurley, D. J., Vandenplas, M. L., Fortes, B. P., Wolfert, M. A., Boons, G. J. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comp Immunol Microbiol Infect Dis. , (2009).
- Mordue, D. G., Scott-Weathers, C. F., Tobin, C. M., Knoll, L. J. A patatin-like protein protects Toxoplasma gondii from degradation in activated macrophages. Mol Microbiol. 63 (2), 482-496 (2007).
- Bohne, W., Heesemann, J., Gross, U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infection and Immunity. 62 (5), 1761-1777 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten