Method Article
활성 골수 - 유래 Macrophages과 Bradyzoite Toxoplasma gondii 약관의 낭종의 벽 형성
요약
Toxoplasma gondii는 조직 문화 모델 했었 수있는 환경 스트레스에 대한 응답으로 낭종 형태로 변환됩니다. 이 동영상은 골수 파생 macrophages 뼈를 활성화하거나 fibroblast 세포 성장 매체 산도를 변경하여 낭종 벽 형성을 검토하기 위해 기술을 보여줍니다.
초록
Toxoplasma gondii는 온혈 동물의 nucleated 세포에 침입할 수있는 의무 세포내 기생충이다. 감염 동안, T. 빠른 복제 양식이 tachyzoite 전화로 gondii는 disseminates. Tachyzoites 잘 묘사되지 않은 신호 처리에 의해 bradyzoite라는 느린 성장 encysted 형식으로 변환합니다. 동물 내에서 bradyzoite의 cysts는 중추 신경계와 근육 조직에서 발견하고 감염의 만성 단계를 대표하고 있습니다. bradyzoites 전환은 높은 산도, 또는 인터페론 감마 (IFNγ)의 추가로 매체를 사용하여 CO 2 기아의 조직 문화에 시뮬레이션 할 수 있습니다. Bradyzoites는 렉틴가 Dolichos biflorus agglutinin (DBA)가 바인딩에 낭종 벽의 존재에 의해 특징입니다. 찬란 분류 DBA는 낮은 CO 2와 높은 산도 매체에 노출되었습니다 인간의 포피의 섬유아 세포 (HFFs) 재배 기생충에있는 낭종 벽을 시각화하는 데 사용됩니다. 마찬가지로, 기생충은 BMMs가 IFNγ와 lipopolysaccharide (LPS)로 활성화한 후 골수 파생 macrophages (BMMs)가 DBA에 의해 감지 낭종 벽을 표시 murine 뼈에 거주. 이 프로토콜은 T.의 전환을 유도하는 방법을 보여줍니다 것입니다 BMMs의 낮은 CO 2 및 활성화와 높은 산도 성장 매체를 사용하여 bradyzoites하는 gondii. 호스트 세포는 coverslips에 대한 교양 tachyzoites와 감염 중 IFNγ와 LPS (BMMs)를 추가로 활성이나 사흘 동안 높은 산도 성장 매체 (HFFs)에 노출됩니다. 감염 완료되면, 호스트 세포는 고정 permeabilized 및 차단됩니다. 낭종 벽은 형광 현미경과 rhodamine의 DBA를 사용하여 시각 것입니다.
프로토콜
1. 인간의 포피의 섬유아 세포 (HFF) 코팅 coverslips의 준비
- 24 잘 조직 문화 판의 우물의 바닥에 살균 둥근 유리 coverslip를 놓습니다.
- 합류 150cm 두 플라스크에서 HFFs을 수확하려면, 1X PBS로 두 번 술병을 씻어 0.025 % 트립신 - EDTA (에틸렌 다이아 민 테트라 초산) 2.5 ML를 추가합니다. ° C 50~10분에 대한 37 휴대용 술병을 품어.
- 손바닥에 대한 술병의 측면을 감청하는 것은 술병에서 세포를 분리에 도움하실 수 있습니다. 일단 세포가 술병에서 발표했습니다 HFF 중간 150 ML (Dulbecco의 수정된 이글 매체 [DMEM]이 10% FBS와 2 MM L - 글루타민,, 1 % 페니실린 - 스트렙토 마이신)과 그 술병을 씻어 수집 매체를 사용을 추가 세포.
- coverslips 잘 당 세포의 1 ML 하는걸.
- 세포가 37 ° C 5 % CO 2 합류가 될 수 있습니다.
2. BMC 개발 L929 에어컨 매체 (CM)를 준비
- L929은 confluency 오랜 기간 후에 요소를 자극 대식 세포 콜로니를 secretes murine fibrosarcoma aneuploid의 셀 라인이다. 이 분비는 세포 배양 1 macrophages에 마우스 골수 세포를 개발하는 데 사용할 L929 세포에서 CM 수 있습니다.
- L929 세포가 합류되면, 그들은 구형 나타나고 술병을 리프팅 시작할 때까지 그들이 추가 7~9일에 대해 품어 보자. 뜨는 및 펠렛 10 분 425 XG든지 분리된 세포를 수집합니다. 이 뜨는은 CM입니다.
- L929 세포 중 하나는 150cm이 플라스크는 BMC 매체 150 ML를 생성 CM 30 ML을 산출. BMC 매체 10% FBS, DMEM에 20 %의 CM, 1 % 페니실린 - 스트렙토 마이신,, 1 % L - 글루타민으로 구성되어 있습니다.
3. 골수 및 BMCs의 세포 배양의 분리
- CO 2 질식 및 표면 70 % 에탄올로 소독 한 C57BL / 6 마우스를 희생.
- 다리 근처의 복부 피부를 리프팅과 가위로 절단하여 복막을 폭로. 복막 구멍을 펑쳐링하지 마십시오. 발목 부분의 경골과 대퇴골을 폭로하기 위해 다리 아래로 잘라. 가위를 사용하여 다리의 뼈가 근육 조직을 잘라 버릴거야.
- 대퇴골을 제거하려면 한 번 무릎 아래와 한번 엉덩이 근처 컷. 차가운 1X PBS를 포함하는 세균 배양 접시에있는 뼈를 놓습니다. BMCs 영구적으로 준수하기 때문에 다음 단계를위한 페트리 요리를 대접 조직 문화를 사용하지 마십시오. 추가 근육 조직을 긁어 메스를 사용합니다. 그냥 골수를 노출하기 위해 무릎 위의 뼈를 잘라.
- 단계를 반복 (B) 그리고 (c) 두 번째 대퇴골의 골수를 수집합니다.
- 차가운 1X PBS와 50 ML 원뿔 관에 골수를 이동시키다하는 25 게이지 바늘로 가득한 10cc 주사기를 사용하십시오. 뼈를 새하얀 한 골수이 제거됩니다 나타납니다.
- 모든 골수 집계를 깨고 22 게이지 바늘을 통해 PBS / 골수 혼합물 패스.
- 10 분 425 XG에서 혼합 스핀, 그리고 표면에 뜨는를 제거합니다.
- BMC 매체 8 ML에서 펠렛을 Resuspend. 8 세균 배양 접시에 세포 현탁액 9 ML BMC 매체 1 ML을 추가합니다.
- 37 품어 ° C 5 % CO 2.
- 5 일째, 각 접시 10 ML BMC 매체를 추가합니다. 일 7.2으로 전지가 완전히 개발됩니다. BMCs는 성숙 후 1-2주에 대한 passaged 수 있습니다.
- BMCs을 분할하려면 미디어를 제거하고 각 페트리 접시에 차가운 1X PBS의 5 ML를 추가합니다. 4 품어 ° 세포 리프트 시작까지 30 분 C. 멸균 전송 피펫과 접시에서 BMCs을 씻어.
- 50 ML 원뿔 관 및 펠릿 10 분 425 XG에 수영장에서 BMCs합니다.
- 10 ML BMC 매체와 hemocytometer 의지의 펠렛을 Resuspend. 바닥에 둥근 유리 coverslips로 24 잘 플레이트에 잘마다 씨앗 2x105 BMCs. T.과 감염 전에 BMCs가 밤새 준수합시다 gondii. 초과 BMCs는 나중에 사용하기 위해 배양 접시에 reseeded 수 있습니다.
4. T.과 감염 세포 gondii
- 2x10 6 T.과 합류 HFFs의 25cm 두 플라스크를 감염 세포 (2-3 일 정도) lyse 시작할 때까지 gondii하고 성장합니다.
- 조직 문화 플라스크에서 감염된 숙주 세포의 monolayer를 제거하는 세포 스크레이퍼를 사용하여 다음 27 게이지 바늘을 통해 dislodged monolayer를 전달하여 호스트 세포에서 기생충을 놓습니다.
- 매체에 기생충의 수를 결정하는 hemocytometer를 사용합니다.
- 프로토콜 1 또는 프로토콜 3 BMCs에서 HFF monolayers의 coverslip 잘 당 10 5 기생충 감염. 기생충, 37에서 3 시간 동안 침략 ° C 5 % CO 2를 보자.
5. T.을 시작 환경 스트레스에 의해 gondii bradyzoite 개발
- 중간 산도 증가와 CO 2 기아와 HFFs에 Bradyzoite 개발
- 개발 매체를 준비합니다. 개발 매체 RPM을 포함I 중탄산염없이 1640, 1 % FBS, 1 % 페니실린 - 스트렙토 마이신, 42 MM HEPES. 8.0 산도와 필터 소독.
- 감염된 HFFs에서 DMEM 제거 1X PBS와 린스, 개발 매체 1ml를 추가합니다.
- 주변 공기와 함께 37 삼일 ° C에 대해 숙고하다.
- BMCs의 활성화
- BMCs을 활성화하기 위해 매체를 준비합니다. 활성화 매체 100U/ml IFN - γ와 100 NG / ML LPS와 함께 보충 BMC의 매체입니다. 집계를 중단하기 위해 사용하기 전에 2 분 동안 물을 욕조에 LPS를 Sonicate.
- 우물에서 BMC 매체를 제거하고 활성 매체 1 ML로 바꿉니다.
- 37 품어 ° C, 5 % 3 일간 CO 2.
6. Immunofluorescence 검출
- 1X PBS에 감염된 우물을 세 번 씻어.
- 20 분 3 % 포름 알데히드의 200ul와 monolayer을 수정.
- 정착액을 제거하고 1X PBS로 우물을 씻어.
- 우물에 0.1 M 글리신의 200μl를 추가하고 5 분 앉아 보자.
- 글라 이신를 제거하고 1X PBS로 우물을 씻어.
- 30 분 monolayer를 permeabilize하고 차단하는 3퍼센트 BSA/0.2 % 1X PBS에서 TritonX - 100 250 μl를 추가합니다.
- 차단 솔루션을 제거하고 1X PBS로 우물을 씻어.
- 3퍼센트에 rhodamine Dolichos biflorus agglutinin의 1:250 희석의 50 μl를 추가 BSA/0.2 % 트리톤 1X PBS에서 X - 100.
- 1 시간 동안 실온에서 플랫폼에 쉐이크 판과 장소를 커버
- 0.2 %로 coverslips에게 3 번 씻어 튼과 각 플랫폼 쉐이크 5 분 1X PBS에서 X - 100.
- 4'6 - diamidino - 2 - phenylindole (DAPI)를 포함하는 VectaShield 장착 매체를 사용하여 마운트 coverslips.
- 스테인드 T. gondii는 100x의 확대에 rhodamine에 대한 필터를 적절한 형광 현미경을 사용하여 시각하실 수 있습니다.
7. 대표 결과
그림 1은 T.의 대표적인 DBA의 염색법을 보여줍니다 산도 응력 하에서 활성화 BMMs과 HFFs에 gondii. 기생충 주변 모두보기 DBA의 얼룩은 낭종 벽 구성 요소의 존재를 나타내는 vacuoles을 포함. 활성화 BMM 이미지는 공포의 표면과 일치 DBA 염색법을 보여줍니다. T.의 단면 gondii는 산도에 HFFs은 스테인드없이 내부 구조와 낭종 벽을 보여줍니다 강조했다.
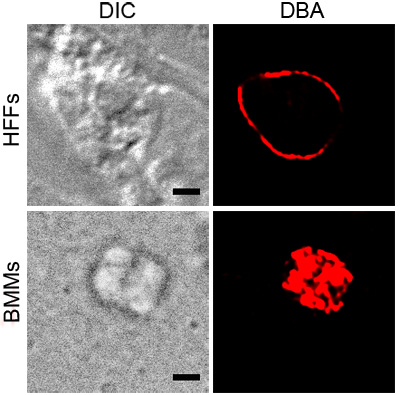
그림 1. 스트레스 T.의 DBA 염색법 스트레스 조건, 활성화 BMMs이나 산도에 따라 gondii. 세포내 기생충, HFFs 강조 rhodamine 복합 DBA (적색)와 스테인드되었습니다. 차동 간섭 대비 (DIC)은 낭종의 개요를 보여줍 검은 스케일 바는 2 μm의 같습니다.
동물 실험
동물 실험 위스콘신 애니멀 케어 및 사용위원회의 대학에 의해 명시된 지침과 규정에 따라 수행되었다.
토론
T.의 bradyzoite 개발의 메커니즘은 완전히 이해되지 않지만, 분자 유전 분석 조직 문화 gondii 단계 변환 bradyzoite의 낭종 형성 2,3,4에 관련된 유전자의 발견되었다. 분석은 또한 일부 bradyzoite 마커가 활성화 macrophages 5,6 성장 등 다른 장기 응력 조건에서 표현되는 관찰되었다. 위의 방법은 T. 성장하는 방법을 설명합니다 gondii와 유도 발전 BMCs과 HFFs 모두에서 DBA 양성 낭종 벽 구조. 낭종 개발 경로가 다른 스트레스 자극에 의해 유도된 수 있습니다 이러한 결과는 강조 표시합니다.
때문에 T. gondii는 온혈 호스트에서 거의 모든 nucleated 셀에 성장할 수 많은 세포 유형은 T. 성장하는 데 사용할 수 있습니다 체외에서 gondii. 그들이 접촉 세포 라인을 저해하기 때문에 HFFs이 프로토콜에 사용되었습니다. 세포 배양 bradyzoite 개발가 삼일이 걸리므로, 그것은 크다되지 않습니다 세포 라인을 사용하는 것이 더 쉽습니다. HFFs은 무기한 교양 수없는 기본 세포입니다. 이상 HFFs가 조직 문화에 passaged 있으며, 덜 관대들은 높은 산도 매체로되며, 따라서 덜 사용할 수 없게 그들은 bradyzoite 전환된다. 최적의 결과를 얻으려면, 호스트 세포가 낮은 통과하고 합류 된 후 적어도 일주일 휴식을 허용한다. 숙주 세포 7 가지 영향을 bradyzoites을 개발 유도를위한 대체 방법이 있습니다.
T. gondii 많은 면역 세포 유형의 번성. 그들이 불멸화 8 시까지 도입되었을 수도 있습니다 아티팩트를 방지하기 때문에 일부 응용 프로그램에 대한, BMCs는 세포 라인을 대식 세포 것이 바람직합니다. 그들은 현미경으로보다 의무가 만드는 RAW264.7 세포에 비해 평면 형태를 가지고 있기 때문에 BMCs 또한 체외 실험에 유용합니다. 여기에서 설명한 기본 BMC 문화 방법은 다른 마우스 종자 9,10에서 BMCs 생산 등 다른 용도로 적용할 수 있습니다. IFNγ와 LPS로 본 활성화의 정도는 공급 업체에 따라 다를 심지어 많이 있습니다. 그러므로 최적의 일관성 성능을 활성화 매체에 사용되는 LPS와 IFNγ의 양을 적정하다하는 것이 필요합니다.
공개
감사의 말
자료
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | GIBCO, by Life Technologies | 11960-051 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | heat inactivate |
| Rhodamine Dolichos biflorus agglutinin | Vector Laboratories | RL-1032 | |
| Formaldehyde (16%) | Polysciences, Inc. | 18814 | |
| Glycine | Fisher Scientific | BP381-5 | |
| HEPES | Fisher Scientific | BP310-1 | |
| IFNγ | PeproTech Inc | 315-05 | Store in single use aliquots |
| L-glutamine (200mM) | GIBCO, by Life Technologies | 25030 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L4391-1MG | Store in single use aliquots |
| Microscope Cover Glass | Fisher Scientific | 12-545-80 12CIR-1 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| RPMI medium 1640 powder (with L-glutamine, without bicarbonate) | GIBCO, by Life Technologies | 31800-022 | |
| Triton-X-100 | Fisher Scientific | BP151-500 | |
| Trypsin-EDTA (0.25%) | GIBCO, by Life Technologies | 25200 | |
| VectaShield mounting media with DAPI | Vector Laboratories | H-1200 |
참고문헌
- Tomida, M., Yamamoto-Yamaguchi, Y., Hozumi, M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 259 (17), 10978-10980 (1984).
- Matrajt, M., Donald, R. G., Singh, U., Roos, D. S. Identification and characterization of differentiation mutants in the protozoan parasite Toxoplasma gondii. Mol Microbiol. 44, 735-747 (2002).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Mol Microbiol. 44, 721-733 (2002).
- J, P., Knoll, L. J. Isolation of Toxoplasma gondii development mutants identifies a potential proteophosphogylcan that enhances cyst wall formation. Molecular and Biochemical Parasitology. 169 (2), 120-123 (2010).
- Bohne, W., Heesemann, J., Gross, U. Induction of Bradyzoite-Specific Toxoplasma gondii Antigens in Gamma Interferon-Treated Mouse Macrophages. Infection and Immunity. 61 (3), 1141-1145 (1993).
- Ibrahim, H. M., Bannai, H., Xuan, X., Nishikawa, Y. Toxoplasma gondii Cyclophilin 18-Mediated Production of Nitric Oxide Induces Bradyzoite Conversion in a CCR5-Dependent Manner. Infection and Immunity. 77 (9), 3686-3695 (2009).
- Lyons, R. E., McLeod, R., Roberts, C. W. Toxoplasma gondii tachyzoite-bradyzoite interconversion. Trends in Parasitology. 18 (5), 198-201 (2002).
- Berghaus, L. J., Moore, J. N., Hurley, D. J., Vandenplas, M. L., Fortes, B. P., Wolfert, M. A., Boons, G. J. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comp Immunol Microbiol Infect Dis. , (2009).
- Mordue, D. G., Scott-Weathers, C. F., Tobin, C. M., Knoll, L. J. A patatin-like protein protects Toxoplasma gondii from degradation in activated macrophages. Mol Microbiol. 63 (2), 482-496 (2007).
- Bohne, W., Heesemann, J., Gross, U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infection and Immunity. 62 (5), 1761-1777 (1994).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유