Method Article
В месте субклеточных Фракционирование Приверженец и не соблюдают клетках млекопитающих
В этой статье
Резюме
В месте субклеточных фракционирования клеток млекопитающих на микроскопе покровные позволяет визуализировать белки локализации.
Аннотация
Белки функции тесно связаны с белком локализации. Хотя некоторые белки ограничены в определенном месте или субклеточных отсек, многие белки присутствуют в виде свободно диффундирующих населения в свободном обмене с подгруппы населения, тесно связанный с определенным субклеточных домена или структуры. Натурные субклеточного фракционирования позволяет визуализировать компартментализация белка, а также может выявить белок подгруппах, локализовать к конкретным структурам. Например, удаление растворимых цитоплазматических белков и слабозакрепленных ядерных белков может выявить устойчивые ассоциации некоторых факторов транскрипции с хроматином. Последующие переваривания ДНК может в некоторых случаях выявить связь с сетью белков и РНК, является общее название ядерной эшафот или ядерного матрикса.
Здесь мы опишем шаги, необходимые во время на месте фракционирования сторонник и не сторонник клетках млекопитающих на микроскопе покровные. Белки визуализации можно достичь с помощью специфических антител или флуоресцентных белков слияния и флуоресцентной микроскопии. Антитела и / или флуоресцентными красителями, которые выступают в качестве маркеров для конкретного отделения или структуры позволяют белка локализации быть отображены в деталях. Натурные фракционирования также может быть объединена с западной промокательной сравнить количество белков, присутствующих в каждой фракции. Этот простой биохимический подход может выявить ассоциации, которые могли бы остаться незамеченными.
протокол
I. Подготовка для фракционирования
В этом разделе описывается подготовка поли-L-лизин покрытием покровные микроскопа и прикрепление клеток до фракционирования. При необходимости клетки могут быть временно трансфицированных векторов экспрессии белка до или после вложения.
А. Получение поли-L-лизин покрытием покровные
- Подготовка решения 1mg/ml поли-L-лизин в дистиллированной воде.
- Пальто чистой покровные с поли-L-лизин, путем инкубации их в раствор, по крайней мере 1 час на качалке платформы при 22 ° C.
- Мыть покрытие покровные стерильной дистиллированной водой в два раза и следовать с одной мыть с 96% этанола.
- Воздух сухой покрытием покровные на кусочек фильтровальной бумаги и держать их в сухом контейнере для использования в будущем (после высыхания они могут быть сложены).
Б. Прикрепление клетки покровных
Номера для прилипшие клетки (здесь мы используем клеток К562)
- Место поли-L-лизин, покрытой покровным в хорошо в 6-луночный планшет с покрытием вверх.
- Семенной клеток К562 при плотности 7х10 5 клеток / лунку в Дульбеко изменения орлы Средняя (DMEM) с добавлением 10% эмбриональной телячьей сыворотки (FBS), П. С. (пенициллин 100units/ml, стрептомицин 100мг/мл). В случае клеток К562 временной трансфекции можно выполнить с помощью электропорации (0.4cm электропорации кюветы с 1х10 7 клеток в 200 мкл среды при 250 В / 975μF) перед посевом клеток.
- Инкубируйте клетки в течение 24 часов при 37 ° С в 5% СО 2.
- Вылейте средних и мыть клетки дважды с ледяной фосфатным буферным раствором (PBS).
- Следуйте с субклеточных протокол фракционирования.
Приверженец клетки (здесь мы используем Cos-7 клеток)
- Место немелованной покровное в хорошо в 6-луночный планшет.
- Мыть два раза в ФБР предварительно нагретого при температуре 37 ° C.
- Отсоедините клетки путем переваривания трипсином (0,03% ЭДТА, 0,25% трипсина) в PBS при температуре 37 ° С в течение 2 до 5 минут. Важно не переусердствовать-дайджест клетки и остановить пищеварения, как только преимущественно отдельные плавающие клетки присутствуют.
- Стоп пищеварения путем посева клеток на плотность 3х10 5 клеток / лунку в 6-луночный планшет в DMEM с добавлением 10% ЭТС и ПСЖ (пенициллин 100 ед / мл, стрептомицин 100ug/ml и L-глютамина 292ug/ml) , на нормальных покровные. Приверженец клетки обычно придают также на нормальном покровные микроскоп, тем не менее, поли-L-лизин покрытием покровные могут быть использованы в случае необходимости.
- Инкубируйте клетки в течение 24 часов при температуре 37 ° С и 5% СО 2. В случае Cos-7 клеток временной трансфекции можно выполнить с помощью Fugene 6 (Roche), если требуется, и клетки слева оправиться еще 24 часов при 37 ° C и 5% СО 2.
- Вылейте средних и мыть клетки дважды с ледяной PBS.
- Следуйте с субклеточных протокол фракционирования.
II. Субклеточных фракционированием
В месте доли производится по схеме показано на рисунке 1 и основано на методике, описанной ранее 5 с изменениями, описанный ранее 7 и подробный протокол ниже. Рекомендуется для передачи покровные для свежих 6-луночный планшет после каждого шага фракционирования удаления покровного перед удалением жидкости. Хотя только четыре покровные требуются для работы с изображениями, дополнительные покровные обязаны производить весь экстракт клеток и ядерной фракции матрицы для западных промокательной если это будет выполняться параллельно.
- Подготовка и фильтр цитоскелета буфер (ЦСК): 10mm ТРУБЫ, 300 Сахароза, 100 мм NaCl, 3 мМ MgCl 2, 1 мМ EGTA. ЦСК буфера должен быть свежеприготовленным в день фракционирования.
- При необходимости из одной клетки покровного могут быть использованы для подготовки целого экстракт ячейки для западных промокательной, осторожно размещения 200ul TES буфера (1% SDS, 2 мМ EDTA, 20 мМ Трис-HCl, рН 7,4), прямо на покровное и инкубации в течение 1 или 2 минуты при 22 ° C. Весь экстракт ячейка может быть удалена и белки осаждали добавлением 250ul 1М (NH 4) 2 SO 4 и инкубации на льду, пока другие западные образцы будут готовы.
- Вымойте оставшиеся покровные с 1 мл ледяной PBS в два раза при 22 ° С, наклоняя 6 хорошо пластины два или три раза.
- Удалить покровное представляющие целые клетки и трансфер в свежем 6-луночный планшет. Следуйте с фиксацией клеток и иммуно-флуоресценции протокола.
- Аккуратно снимите PBS от остальных скважин.
- Извлечение цитоплазматических и слабозакрепленных ядерные белки, осторожно размещения буфера 200ul ЦСК + 0,1% (V / V) Тритон Х-100 непосредственно на каждого оставшегося покровное и инкубации нальда в течение 1 минуты.
- Удалить цитоплазматических и ядерных слабозакрепленных экстракта и выпадают в осадок, как описано в шаге 2.
- Вымойте покровные с 1 мл ледяной PBS в два раза при 22 ° С, наклоняя 6 хорошо пластины.
- Удалить покровное представляющих плотно провели ядерные материалы и пойти с фиксацией клеток и иммуно-флуоресценции протокола.
- Аккуратно снимите PBS от остальных скважин затем извлечь плотно состоялась белки, осторожно размещения буфера 200ul ЦСК + 0,5% (V / V) Тритон Х-100 непосредственно на каждого оставшегося покровное и инкубации на льду в течение 20 минут.
- Удалить плотно состоялась экстракта и выпадают в осадок, как описано в шаге 2.
- Вымойте покровные с 1 мл ледяной PBS в два раза при 22 ° С, наклоняя 6 хорошо пластины.
- Удалить покровное представляющих хроматина фракции и следовать с фиксацией клеток и иммуно-флуоресценции протокола.
- Аккуратно снимите PBS от остальных скважин затем поместить 200ul ЦСК буфера + 100ug/ml из ДНКазы я на оставшиеся покровные и инкубировать 30 минут при 37 ° C.
- Удалить хроматина экстракта и выпадают в осадок, как описано в шаге 2.
- Вымойте покровные с ледяным PBS в два раза при 22 ° С, наклоняя 6 хорошо пластины.
- Удалить покровное представляющих ядерной фракции матрицы и следовать с фиксацией клеток и иммуно-флуоресценции протокола.
- При необходимости матрицу белки могут быть удалены из дополнительных покровное матрицы для западных промокательной использованием буфера 200ul TES, как описано в шаге 2.
- Образцы для западных пятно должно быть центрифугировали при 13000 оборотов в минуту в настольный микроцентрифужных при 4 ° С и гранулы ресуспендировали в 40ul SDS загрузки буфера (62.5mM Трис-HCl рН 6,8, 2% SDS (м / о), 50 мМ DTT, 10% глицерина, 0,01% бромфенола синий (м / о)) перед анализом на SDS-PAGE.
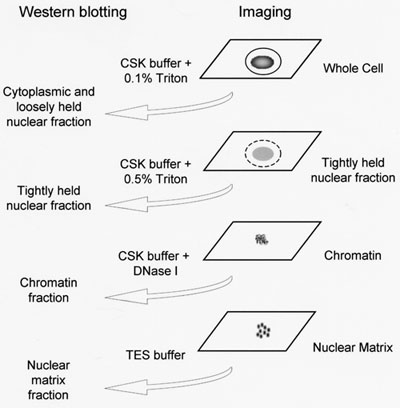
Рисунок 1. Схематическое изображение на месте субклеточных фракционирования. Цитоскелета буфер (ЦСК) состоит из 10 мМ ТРУБЫ, 300 Сахароза, 100 мм NaCl, 3 мМ MgCl 2, 1 мМ EGTA. TES буфер состоит из 1% SDS, 2 мМ EDTA, 20 мМ Трис-HCl, рН 7,4.
III. Сотовые фиксации и иммуно-флуоресценции
- Аккуратно добавить 1 мл 4% формальдегида / PBS каждому покровное и инкубировать при температуре 4 ° С в течение 30 минут.
- Промыть каждую покровное мягко 2-3 раза с 1 мл PBS при 22 ° C.
- Добавить 400ul 0,1% X-100/PBS Тритон каждому покровное и инкубировать при 22 ° С в течение 10 минут.
- Промыть каждую покровное мягко 2-3 раза с 1 мл PBS при 22 ° C.
- Добавить 400ul в размере 3% бычьего сывороточного альбумина (БСА) / PBS и инкубировать при 22 ° С в течение 20 минут, чтобы уменьшить потенциальную окрашивание фона.
- Промыть каждую покровное мягко 2-3 раза с 1 мл PBS при 22 ° C.
- Место 100 мкл первичных антител в PBS прямо на покровное и инкубировать при 22 ° С в течение 1 часа. Первичные и вторичные антитела должен быть разведен в ФСБ до необходимой концентрации. Это, возможно, должны быть оптимизированы для каждого антитела используются.
- Промыть каждую покровное мягко 2-3 раза с 1 мл PBS при 22 ° C.
- Место 200ul вторичных антител в PBS и инкубировать при 22 ° C вдали от света в течение 1 часа.
- Промыть каждую покровное мягко 2-3 раза с 1 мл PBS при 22 ° C.
- Горе каждого покровное (клетки вниз) на предметное стекло микроскопа использованием Vectashield монтажа среде, содержащей DAPI (4 ',6-diamidino-2-фенилиндола гидрохлорид).
- Протрите избыточного монтажа среды со всего покровное помощью бумажного полотенца и инкубировать слайд при 22 ° С, по крайней мере в 30 минутах езды от света месте.
- Fix покровное к стеклу с использованием четких лак для ногтей акрилом.
- Хранить слайды от света до визуализации флуоресцентной микроскопии.
IV. Представитель результаты

Рисунок 2. Субклеточных фракционированием без трансфицированных COS-7 клетках. Фракционированный Cos-7 клетки фиксировали с формальдегидом и immunostained использованием α-тубулина, α-гистонов H1 или α-Ламин / C антител, конъюгированных с TRITC с последующей обработкой монтажа среде, содержащей DAPI . Изображения были получены с 10-кратным линзы глаз и 63x объектив с использованием микроскопа Leica конфокальной. Клеточных ядер были визуализированы с помощью набора фильтров DAPI в то время как в тех же камерах поле окрашивали антителами маркером были визуализированы использованием TRITC набор фильтров.
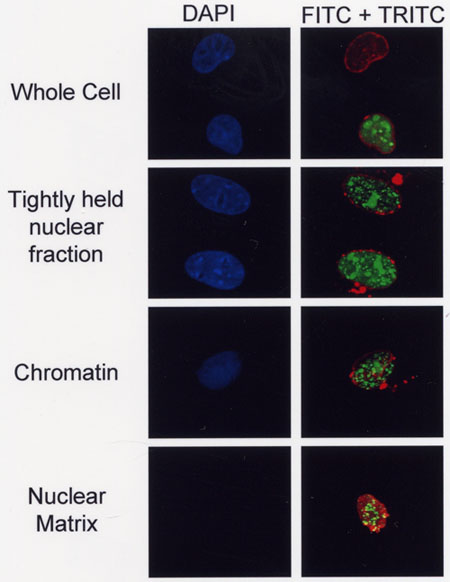
Рисунок 3. GFP-6Е2 гибридный белок связан с ядерным матриксом. Субклеточных фракционированием Cos-7 клеток, экспрессирующих белок слияния, состоящий из зеленого флуоресцентного белка (GFP), слитый с вирусом папилломы человека (ВПЧ) 6-го типаЕ2 белок (GFP-6Е2). Клеточных ядер были визуализированы с помощью окрашивания DAPI в то время как локализация GFP-6Е2 в трансфекции клеток непосредственно визуализируются с помощью GFP флуоресценции. Ламин / C визуализировалось использованием α-Ламин / C антител, конъюгированных с TRITC и TRITC набор фильтров. Слияние изображений показывают, что некоторые из GFP-6Е2 белок связан с ядерным матриксом (нижняя правая панель). Изображения были получены, как описано на рисунке 2.
Обсуждение
Общие проблемы и предложения:
Все или большинство из клетки потеряли во время стирки. Во время промывки жидкости должны быть медленно добавляют в сторону 6-луночный планшет избегая покровное. Аналогично жидкостей должны быть удалены путем тщательного наклоняя тарелку и медленно пипетирования лишнюю жидкость. Адгезия клеток может быть увеличено использованием поли-L-лизин покрытием покровные.
Геномная ДНК не полностью переваривается. Для некоторых типов клеток пищеварения ДНКазы я шаг, возможно, должны быть расширены и / или концентрации ДНКазы я увеличил, чтобы достичь полного удаления геномной ДНК.
Фиксация и фракционирования артефактов. Важно отметить, что некоторые белки могут relocalize во время фиксации или фракционирования 6. Белки освобожден от нарушения ядре следующие ядерной мембраны, например, могут связываться с сайтов, которые иначе были бы расположены в хорошо разделенных отсеках. Эти эффекты могут быть сведены к минимуму путем сравнения результатов, полученных с использованием различных методов фиксации например, с помощью параформальдегида вместо формальдегида. Живая клетка изображения также могут быть полезны для целых клеток по крайней мере 3.
Этот метод хорошо подходит для обнаружения белка GFP синтеза. Тем не менее, важно, чтобы подтвердить, что гибридный белок ведет себя аналогичным образом, чтобы немаркированные белка. Важно также, чтобы подтвердить путем титрования, что белки экспрессируются при сопоставимом уровне с белком-за выражение может изменить резко субклеточные локализации.
Применение методики:
Этот метод позволяет недостаточно белка локализации, которые будут определены со ссылкой на хорошо изученных маркеров различных субклеточных доменов или структур и находит применение во многих областях клеточной биологии. Например, многие факторы транскрипции дисплей сложное распределение с локализацией в цитоплазме, слабозакрепленных нуклеоплазмы, хроматин и / или ядерного матрикса 1,2,4. Локализация в каждой из этих областей могут влиять на функции белка, а также оборот белка и пост-трансляционной модификации.
Белки совместно локализации конкретных областях, таких как ядерная матрица может дать ответ на функции белка. Белки повторно локализации в ответ на конкретные сигналы и / или выражение партнером белки могут также пролить свет на 1,4 функции белка.
Раскрытие информации
Благодарности
Anyaporn Sawasdichai и Nazefah Абдул Хамид благодарны правительству Королевства Таиланд и правительством Малайзии, соответственно, для доктор философии Стипендии. Эта работа финансировалась Wellcome Trust грант присужден PSJ и KG. Мы также благодарны Бристольского университета фонда Bioimaging Вольфсон.
Материалы
| Name | Company | Catalog Number | Comments | |
| BSA | Chemical | Sigma-Aldrich | A9647-100G | |
| DNase I | Chemical | Sigma-Aldrich | DN25-1G | |
| poly-L-Lysine | Chemical | Sigma-Aldrich | P-8920 | |
| Trypsin | Chemical | |||
| EGTA | Chemical | Sigma-Aldrich | E4378-25G | |
| Fomaldehyde | Chemical | VWR | 284216N | |
| PIPES | Chemical | Sigma-Aldrich | P-6757 | |
| Sucrose | Chemical | Fisher Scientific | S/8600/53 | |
| Triton X-100 | Chemical | Sigma-Aldrich | T-6876 | |
| Mounting Medium with DAPI | Chemical | Vector Laboratories | H-1200 | |
| Fugene 6 Transfection Reagent | Chemical | Roche Group | 11814443001 | |
| Histone H1 | Antibodies | Santa Cruz Biotechnology, Inc. | SC-8030 | |
| Lamin A/C | Antibodies | Santa Cruz Biotechnology, Inc. | SC-20681 | |
| Tubulin-α | Antibodies | Santa Cruz Biotechnology, Inc. | SC-32293 |
Ссылки
- Donaldson, M. M., Boner, W., Morgan, I. M. TopBP1 regulates human papillomavirus type 16 E2 interaction with chromatin. J Virol. 81, 4338-4342 (2007).
- Javed, A., Guo, B., Hiebert, S., Choi, J. Y., Green, J., Zhao, S. C., Osborne, M. A., Stifani, S., Stein, J. L., Lian, J. B., van Wijnen, A. J., Stein, G. S. Groucho/TLE/R-esp proteins associate with the nuclear matrix and repress RUNX (CBF(alpha)/AML/PEBP2(alpha)) dependent activation of tissue-specific gene transcription. J Cell Sci. 113, 2221-2231 (2000).
- Kowalczyk, A. M., Roeder, G. E., Green, K., Stephens, D. J., Gaston, K. Measuring the induction or inhibition of apoptosis by HPV proteins. Methods Mol. Med. 119, 419-432 (2005).
- McLarren, K. W., Theriault, F. M., Stifani, S. Association with the nuclear matrix and interaction with Groucho and RUNX proteins regulate the transcription repression activity of the basic helix loop helix factor Hes1. J Biol. Chem. 276, 1578-1584 (2001).
- McNeil, S., Guo, B., Stein, J. L., Lian, J. B., Bushmeyer, S., Seto, E., Atchison, M. L., Penman, S., van Wijnen, A. J., Stein, G. S. Targeting of the YY1 transcription factor to the nucleolus and the nuclear matrix in situ: the C-terminus is a principal determinant for nuclear trafficking. J Cell Biochem. 68, 500-510 (1998).
- Melan, M. A., Sluder, G. Redistribution and differential extraction of soluble proteins in permeabilized cultured cells. Implications for immunofluorescence microscopy. J Cell Sci. 101, 731-743 (1992).
- Zou, N., Lin, B. Y., Duan, F., Lee, K. Y., Jin, G., Guan, R., Yao, G., Lefkowitz, E. J., Broker, T. R., Chow, L. T. The hinge of the human papillomavirus type 11 E2 protein contains major determinants for nuclear localization and nuclear matrix association. J. Virol. 74, 3761-3770 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены