Seleção de Células Ativadas por Magnetismo (MACS): Isolamento de Linfócitos T Tímicos
Visão Geral
Fonte: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unidade de Linfopose, Departamento de Imunologia, Instituto Pasteur, Paris, França
2 INSERM U1223, Paris, França
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, França
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Pasteur Institute, Paris, França
A defesa contra patógenos depende da vigilância do sistema imunológico. Este sistema é complexo e compreende muitos tipos de células, cada uma com funções específicas. Essa composição complexa permite respostas imunes a uma grande diversidade de patógenos e lesões. A imunidade adaptativa permite respostas específicas contra patógenos específicos. A maioria das células responsáveis por esse tipo de imunidade são os linfócitos (células B e células T). Geralmente, as células B respondem a infecções extracelulares (como infecções bacterianas), e as células T respondem a infecções intracelulares (como infecções virais). Os diferentes tipos de células em populações de linfócitos podem ser caracterizados pela combinação de proteínas de superfície celular que expressam e/ou por um painel de citocinas secretadas.
A classificação magnética permite o enriquecimento de populações de células-alvo usando propriedades magnéticas e expressão de uma ou várias proteínas da superfície celular (1, 2). Esta técnica consiste em três passos. Primeiro, as células são incubadas com contas magnéticas que são acopladas a um ou vários anticorpos monoclonais específicos. Células que expressam proteínas superficiais que se ligam a esses anticorpos se prendem às contas magnéticas. Então, as populações de células-alvo são capturadas com um ímã. Para terminar, as células-alvo são eluidas do ímã. No final, são obtidos dois produtos de triagem, um contendo células não rotuladas e o segundo contendo as células-alvo, juntamente com as contas magnéticas. Colunas podem ser usadas para melhorar a eficiência da classificação magnética. Na coluna, um elemento não magnético alonga o caminho da célula através da coluna. Assim, o fluxo celular é desacelerado, facilitando a captura celular pelo ímã.
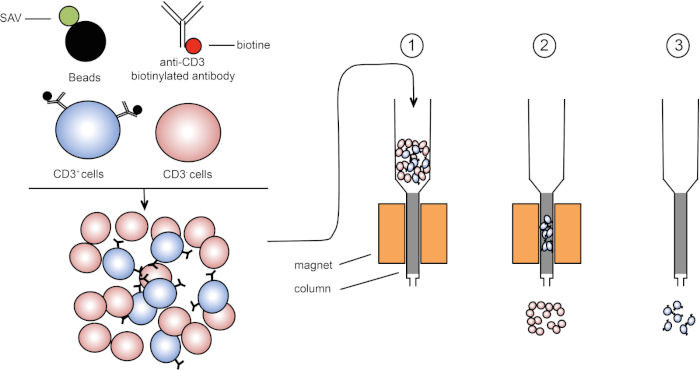
Figura 1: Representação esquemática da separação magnética. Leucócitos timimicos estão manchados com anticorpos biotinilados anti-CD3. Após a lavagem, streptavidin (SAV) acoplado contas especificamente fixam a biotina em anticorpos anti-CD3. (1) As células são transferidas em uma coluna. (2) O ímã não retém células não rotuladas, enquanto as células CD3 positivas permanecem na coluna. Finalmente, a coluna é separada do ímã e (3) células CD3 positivas são elucidadas em média. Clique aqui para ver uma versão maior desta figura.
Existem dois tipos de classificação magnética (3). Em classificação positiva, células de interesse são capturadas com as contas magnéticas. Na classificação negativa, as células indesejadas são removidas capturando com as contas magnéticas carregando os anticorpos apropriados. Esta técnica macs permite um bom enriquecimento de células-alvo e melhora a porcentagem de células recuperadas de 1-20% para 60-98% em um órgão. Após a triagem, é necessário verificar a pureza celular e a classificação por diferentes métodos (por exemplo, citometria de fluxo). A técnica MACS é ideal para enriquecer uma população-alvo para outros experimentos, como cultura celular ou análise de ciclo celular.
Neste exercício de laboratório, demonstramos como isolar leucócitos timiços e, posteriormente, enriquecer células timmicas CD3 positivas da mistura usando a técnica de classificação celular magnética.
Procedimento
1. Preparação
- Antes de começar, coloque luvas de laboratório e roupas de proteção apropriadas.
- Lave todas as ferramentas de dissecção, primeiro com um detergente e depois com 70% de etanol e depois seque-as com uma toalha de papel limpa.
- Prepare 200 mL da solução de sal balanceada da Hank (HBSS) contendo 2% de soro fetal de bezerro (FCS).
2. Dissecção
- Fixar um rato eutanizado em uma placa de dissecção na posição supina.
- Usando tesouras e fórceps, faça uma laparotomia longitudinal para acessar a cavidade torácica.
- Remova o coração para ter acesso ao timo, que está localizado acima do coração. Em seguida, identifique o timo, que é composto por dois lobos brancos e está localizado na cavidade torácica acima do coração.
- Usando fórceps cuidadosamente desprender o timo e colocá-lo na placa de Petri com 5 mL de HBSS 2% FCS.
3. Isolamento de células imunes
- Coloque o timo em um coador de célula de 40 μm sobre a mesma placa de Petri. Esmague o timo com um êmbolo para dissociá-lo no mesmo prato.
- Transfira o timo dissociado e o fluido em um tubo de centrífuga de 15 mL.
- Lave a placa de Petri com 5 mL de HBSS 2% FCS e transfira o meio lavado também para o mesmo tubo de centrífuga.
- Centrifugar o tubo a 370 x g por 7 min a 20°C e descartar o supernatante evitando a pelota.
- Resuspenque a pelota em 2 mL de acetato de potássio para lise os eritrócitos. Aguarde 2 min e, em seguida, compor o volume de até 14 mL usando HBSS 2% FCS.
- Centrifugar o tubo novamente a 370 x g por 7 min a 20°C. Descarte o supernatante e resuspenque a pelota em 5 mL de HBSS 2% FCS.
- Estime a concentração celular usando o ensaio de coloração azul trypan e ajuste a concentração celular final para 107 células/mL usando volume apropriado de HBSS 2% FCS.
4. Rotulagem magnética de células imunes
- Pegue dois tubos FACS. Rotular um tubo, "células T não enriquecidas", e o outro tubo, "células T enriquecidas", que serão separados usando rotulagem magnética.
- Distribuição da solução celular em cada um dos dois tubos FACS.
- Centrifugar o tubo "células T enriquecidas" a 370 x g por 3 min a 20°C e descartar o supernatante evitando a pelota.
- Resuspende a pelota em 250 μL de mistura de anticorpos biotinilados anti-CD3 (Tabela 1, Mix 1).
| Misturar | Rotulagem de reagentes | Diluição |
| 1 | Anticorpo biotinilado anti-CD3 | 1/400 (em HBSS 2% FCS) |
| 2 | Streptavidin acoplado contas | 1/5 (em HBSS 2% FCS) |
| 3 | Anti-CD3 BV421 | 1/200 (em HBSS 2% FCS) |
Tabela 1: Mistura de anticorpos. Misturas 1 e 2 são usadas para separação magnética. Mix 3 é usado para avaliar o enriquecimento celular após a separação magnética.
- Incubar a mistura de anticorpos suspensão celular por 15 minutos a 4°C no escuro.
- Adicione 3 mL de HBSS 2% FCS aos tubos e centrífugue novamente a 370 x g por 3 min a 20°C.
- Descarte o supernatante e resuspenda a pelota em 250 contas acoplado streptavidin (Tabela 1, Mix 2).
- Incubar a mistura celular e as contas por 20 minutos no gelo.
- Em seguida, adicione 3 mL de HBSS 2% FCS e misture bem e centrífuga novamente a 370 x g para 3 min a 20°C.
- Resuspense a pelota em 2 mL de HBSS 2% FCS.
5. Separação magnética de células CD3-Positivas
- Coloque a coluna no ímã e adicione 3 mL de HBSS 2% FCS para umidificar o sistema. Espere 5 minutos.
- Em seguida, coloque as células rotuladas na coluna.
- Após a suspensão do celular passar pela coluna, lave a coluna X3 vezes com 3 mL de HBSS 2% FCS.
- Em seguida, remova a coluna do ímã e coloque-a em um tubo de coleta de 15 mL.
- Para elutar as células-alvo, adicione 5 mL de HBSS 2% FCS à coluna e lave a coluna com o êmbolo.
- Repetir a etapa de eluição com mais 5 mL de HBSS 2% FCS.
6. Avaliação do enriquecimento de células-alvo por citometria de fluxo
- Transfira 500 μL de suspensão celular elucida para um tubo FACS rotulado de "células T enriquecidas". Transfira 200 μL de suspensão "células T não enriquecidas" para um segundo FACS.
- Em seguida, centrifugar ambos os tubos a 370 x g por 7 min a 20°C.
- Descarte o supernatante e adicione 100 μL de anticorpo fluorescente Mix 3 (ver Tabela 1) a ambos os tubos.
- Incubar os dois tubos por 20 min a 4°C no escuro.
- Em seguida, adicione 3 mL de HBSS 2% FCS aos tubos e centrífugue-os a 370 x g por 3 min a 20°C.
- Descarte o supernasal, depois resuspende cada tubo em 250 μL de HBSS 2% FCS.
- Agora, avalie a taxa de enriquecimento celular CD3 positivo por citometria de fluxo.
7. Análise de dados
- Abra o ícone 'FlowJo' e arraste os arquivos para cada tubo na janela "All Sample".
- Clique duas vezes no arquivo "células T enriquecidas" para exibir o gráfico de pontos exibindo dispersão para a frente (FSC-A) no eixo X e dispersão lateral (SSC-A) no eixo Y.
- Clique em "Polígono" para circular as populações de linfócitos.
- Em seguida, clique duas vezes na população circulada para criar uma nova janela.
- Selecione "FSC-W" no eixo Y e "FSC-A" no eixo X, e circule as células negativas FSA-W. Na janela"Identificação de Subpopulação",nomeie a população celular como "células únicas".
- Clique duas vezes na população circulada para criar uma nova janela. Selecione "CD3" no eixo Y e circule as células CD3 positivos. Na janela"Identificação de Subpopulação"nomeie sua população celular "células T".
- Repita com as "células T não enriquecidas".
- Para visualizar a população celular, clique em "Editor de layout" e arraste a população de "células T" de arquivos "células T enriquecidas" e "células T não enriquecidas" na guia.
- Gráficos de ponto representando linfócitos CD3+aparecerão. As células CD3+ só devem aparecer na população de interesse do tubo enriquecido CD3+.
- Para avaliar o enriquecimento de linfócitos CD3+ nas células classificadas, clique em "Table editor", e depois arraste a população de "células T" de arquivos "células T enriquecidas" e "células T não enriquecidas" para a mesa.
- No menu "Estatística", selecione "Frequência de linfócitos" para verificar a porcentagem de células CD3+ em todos os linfócitos, em seguida, clique em "Criar tabela".
- Os valores dos parâmetros aparecerão em uma nova tabela. Para as "células T enriquecidas", a frequência das células CD3+ deve ser em torno de 80%.
Resultados
Neste protocolo, as células CD3-positivas foram enriquecidas a partir de leucócitos timiêmicos usando classificação de células magnéticas (Figura 1). Antes do enriquecimento celular magnético, as células CD3-positivas representavam 53,6% do total das células timmicas (Figura 2, painéis superiores). Após o enriquecimento de células magnéticas, a porcentagem de células CD3 positivas aumentou para 95% (Figura 2, painéis inferiores). Assim, o MACS é uma técnica simples, rápida e eficiente de enriquecimento celular para enriquecer as populações celulares desejadas a partir de uma mistura de suspensão celular.
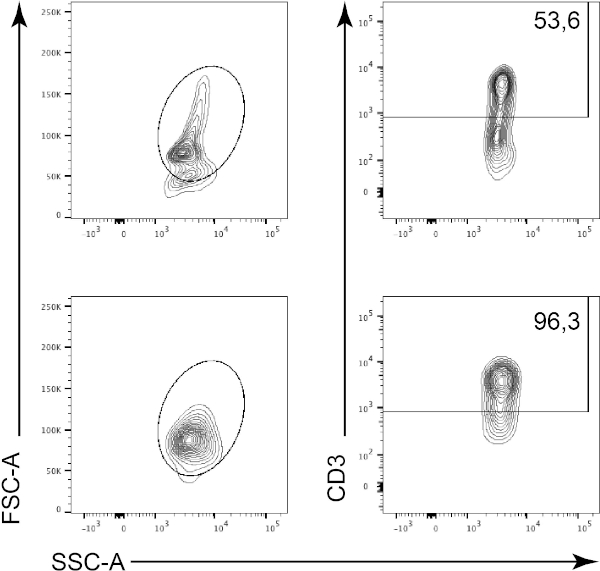
Figura 2: Estratégia de gating e classificação de teste de pureza. As células são primeiro fechadas com base em sua morfologia (esquerda: FSC-A, SSC-A), e então as células são plotadas contra CD3 (à direita: CD3, SSC-A). O painel superior representa a suspensão celular de timo antes do enriquecimento celular. O painel inferior representa a suspensão da célula de timo após a classificação celular magnética. Clique aqui para ver uma versão maior desta figura.
Aplicação e Resumo
A tecnologia de separação magnética é um método comum para classificar facilmente e rapidamente uma população celular alvo. Usando anticorpos específicos de células T e contas magnéticas enriquecemos a frequência de células T em nossa amostra. A taxa de pureza no final do experimento depende da porcentagem de células-alvo na suspensão celular inicial. As células obtidas após a classificação celular magnética podem ser usadas para vários propósitos, como transferência de células ou análise de ciclo celular. Outro método de classificação, usando citometria de fluxo, pode ser usado para enriquecer células. Este rendimento da técnica tem uma taxa de pureza muito alta após a classificação celular, porém requer mais passos e leva mais tempo.
Referências
- Owen, C. S. and Sykes, N. L. Magnetic labeling and cell sorting. Journal of Immunological Methods. 73 (1), 41-48 (1984).
- Miltenyi, S., Müller, W., Weichel, W. and Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Plouffe, B. D., Murthy, S. K. and Lewis, L. H. Fundamentals and application of magnetic particles in cell isolation and enrichment: a review. Reports on Progress in Physics. 78 (1), (2014).
Pular para...
Vídeos desta coleção:

Now Playing
Seleção de Células Ativadas por Magnetismo (MACS): Isolamento de Linfócitos T Tímicos
Immunology
22.8K Visualizações

Citometria de Fluxo e Separação de Células Ativadas por Fluorescência (FACS): Isolamento de Linfócitos B Esplênicos
Immunology
92.8K Visualizações

Ensaios ELISA: Indireto, Sanduíche e Competitivo
Immunology
237.6K Visualizações

Ensaio ELISPOT: Detecção de Esplenócitos Secretores de IFN-γ
Immunology
28.4K Visualizações

Imunohistoquímica e imunocitoquímica: imageamento de tecidos via microscopia de luz
Immunology
78.7K Visualizações

Geração de anticorpos: produzindo anticorpos monoclonais usando hibridomas
Immunology
43.5K Visualizações

Microscopia de imunofluorescência: Coloração por imunofluorescência de secções de tecido embebidos em parafina
Immunology
53.7K Visualizações

Microscopia confocal de fluorescência: uma técnica para determinar a localização de proteínas em fibroblastos de camundongos
Immunology
43.1K Visualizações

Técnicas Baseadas em Imunoprecipitação: Purificação de Proteínas Endógenas Usando Esferas de Agarose
Immunology
87.5K Visualizações

Análise do Ciclo Celular: Avaliação da Proliferação de Células T CD4 e CD8 Após Estimulação Usando Coloração CFSE e Citometria de Fluxo
Immunology
24.1K Visualizações

Transferência de células adotivas: introduzindo esplenócitos de camundongos doadores para um camundongo hospedeiro e avaliando o sucesso via FACS
Immunology
22.2K Visualizações

Ensaio para Morte Celular: Ensaio de Liberação de Cromo para Avaliar a Capacidade Citotóxica
Immunology
151.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados