磁性活细胞分拣 (MACS): 胸腺 T 淋巴细胞的分离
Overview
资料来源: 穆尼尔·西尔万1,2,3,佩尔切特·蒂鲍特1,2,3,苏菲·诺沃4,雷切尔·戈卢布1,2,3
1法国巴黎巴斯德研究所免疫学系淋巴病系
2 INSERM U1223, 巴黎, 法国
3巴黎迪德罗大学,索邦巴黎城,大提琴巴斯德,巴黎,法国
4流式细胞测定,细胞学和生物标志物 UtechS,转化科学中心,巴斯德研究所,法国巴黎
预防病原体取决于免疫系统的监测。该系统很复杂,包括许多细胞类型,每种类型都有特定的功能。这种复杂的组成能够对大量病原体和损伤进行免疫反应。适应性免疫允许对特定病原体作出特定反应。负责这种免疫的大多数细胞是淋巴细胞(B细胞和T细胞)。通常,B细胞对细胞外感染(如细菌感染)作出反应,T细胞对细胞内感染(如病毒感染)作出反应。淋巴细胞群中不同类型的细胞可以通过它们表达的细胞表面蛋白和/或分泌细胞因子的面板的组合来表示。
磁性分选允许使用磁性特性和一个或多个细胞表面蛋白的表达来丰富目标细胞群(1,2)。此技术包括三个步骤。首先,细胞用磁珠孵育,磁珠与一个或多个单克隆特异性抗体结合。表达与这些抗体结合的表面蛋白的细胞附着在磁珠上。然后,用磁铁捕获目标细胞群。最后,目标细胞从磁铁中洗脱。最后,获得两个分拣产品,一个包含未标记的细胞,第二个包含与磁珠结合的目标细胞。列可用于提高磁分拣效率。在列中,非磁性元素延长细胞穿过列的路径。因此,细胞流减慢,促进细胞捕获的磁铁。
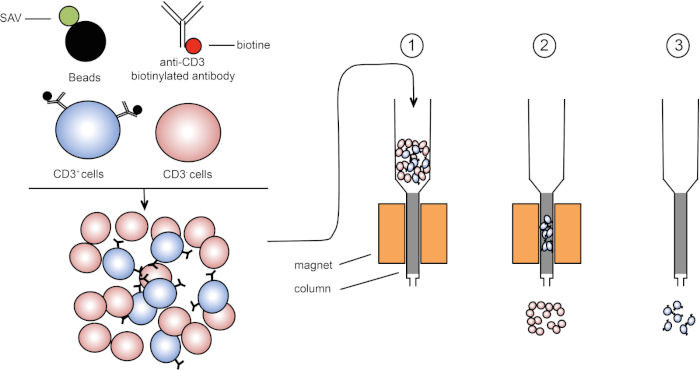
图1:磁分离的原理表示。双核白细胞被染色的抗CD3生物素化抗体。洗涤后,链球菌(SAV)耦合珠子在抗CD3抗体上专门固定生物链。(1) 单元格在列中传输。(2) 磁体不保留未标记的细胞,而CD3阳性细胞则保留在柱中。最后,将柱与磁体分离,(3)CD3阳性细胞在介质中洗脱。请点击此处查看此图的较大版本。
有两种类型的磁性分拣 (3)。在正排序中,感兴趣的细胞被磁珠捕获。在负排序中,通过捕获携带相应抗体的磁珠来去除不需要的细胞。这种MACS技术允许目标细胞的良好富集,并将器官中回收的细胞的百分比从1-20%提高到60-98%。分拣后,有必要用不同的方法(例如流式细胞测定)验证细胞纯度和分拣。MACS 技术是丰富目标人群的理想,用于其他实验,如细胞培养或细胞周期分析。
在本实验练习中,我们演示如何分离胸腺白细胞,然后使用磁细胞分选技术从混合物中丰富胸腺CD3阳性细胞。
Procedure
1. 准备
- 开始之前,戴上实验室手套和适当的防护服。
- 清洗所有解剖工具,首先用洗涤剂,然后用70%乙醇,然后用干净的纸巾擦干。
- 准备 200 mL 的汉克平衡盐溶液 (HBSS), 含有 2% 的胎儿小牛血清 (FCS)。
2. 解剖
- 将安乐死小鼠固定在解剖板上。
- 使用剪刀和钳子进行纵向腹腔切除术进入胸腔。
- 取出心脏,进入位于心脏上方的胸腺。然后,识别胸腺,由两个白色叶组成,位于心脏上方的胸腔。
- 使用钳子小心地分离胸腺,并将其放在培养皿与 5 mL 的 HBSS 2% FCS。
3. 免疫细胞分离
- 将胸腺放在40μm细胞滤网上,放在同一个培养皿上。用柱塞粉碎胸腺,使其在同一菜中分离。
- 分离胸腺和液体转移到15 mL离心管中。
- 用 5 mL 的 HBSS 2% FCS 清洗培养皿,并将洗涤介质也转移到同一离心管中。
- 在 20°C 下将管在 370 x g下离心 7 分钟,并丢弃上清液,避免颗粒。
- 将颗粒重新悬浮在2 mL的醋酸钾中,以赖解红细胞。等待 2 分钟,然后用 HBSS 2% FCS 将音量补至 14 mL。
- 在 20°C 下,在 370 x g下再次将管离心 7 分钟。丢弃上清液,将颗粒重新悬浮在 5 mL 的 HBSS 2% FCS 中。
- 使用锥蓝色染色测定估计细胞浓度,并使用适当的HBSS 2%FCS调整最终细胞浓度至107细胞/mL。
4. 免疫细胞的磁性标记
- 取两个 FACS 管。将一个管标为"非富集T细胞",另一管"富集T细胞",使用磁性标记分离。
- 将细胞溶液分配到两个FACS管中。
- 在 370 x g下将"富集 T 细胞"管在 20°C 下离心 3 分钟,并丢弃上清液,避免颗粒。
- 在250 μL的抗CD3生物异位抗体混合物中重新悬浮颗粒(表1,混合1)。
| 混合 | 标记试剂 | 稀释 |
| 1 | 抗CD3生物仿当抗体 | 1/400 (在哈佛商学院 2% FCS) |
| 2 | 链球菌结合珠 | 1/5 (在哈佛商学院 2% FCS) |
| 3 | 防 CD3 BV421 | 1/200 (在哈佛商学院 2% FCS) |
表1:抗体混合组合。混合1和2用于磁分离。混合3用于评估磁分离后的细胞富集。
- 在黑暗中4°C下孵育细胞悬浮抗体混合物15分钟。
- 在20°C下,在370 x g下再次向管中加入3 mL的HBSS 2%FCS,然后再次离心。
- 丢弃上清液,在 250 μL 链球蛋白耦合珠中重新悬浮颗粒(表 1,混合 2)。
- 在冰上孵育细胞混合物和珠子20分钟。
- 接下来,加入 3 mL 的 HBSS 2% FCS,在 370 x g 下再次混合,在 20°C 下再离心 3 分钟。
- 在 2 mL 的 HBSS 2% FCS 中重新悬浮颗粒。
5. CD3-正细胞的磁性分离
- 将柱放在磁铁上,加入 3 mL 的 HBSS 2% FCS,使系统加湿。等待 5 分钟。
- 接下来,将标记的单元格移入列中。
- 细胞悬浮液通过柱后,用3 mL的HBSS 2%FCS清洗柱X3。
- 然后,从磁铁上取下柱子,并将其放入 15 mL 收集管中。
- 要洗至目标细胞,将 5 mL 的 HBSS 2% FCS 添加到柱中,然后用柱塞冲洗柱塞。
- 重复洗脱步骤与另外 5 mL 的 HBSS 2% FCS。
6. 流量细胞测定对靶细胞富集的评价
- 将500μL的洗脱细胞悬浮液转移到标有"富集T细胞"的FACS管中。将200μL的"非富集T细胞"悬浮液转移到第二个FACS。
- 然后,在20°C下以370 x g将两个管离心7分钟。
- 丢弃上清液,然后向两管中加入100 μL荧光抗体混合3(见表1)。
- 在黑暗中4°C下孵育两个管子20分钟。
- 接下来,在管中加入 3 mL 的 HBSS 2% FCS,并在 370 x g下在 20°C 下将其离心 3 分钟。
- 丢弃上清液,然后将每根管重新悬浮在 250 μL 的 HBSS 2% FCS 中。
- 现在,通过流动细胞测定法评估CD3阳性细胞富集率。
7. 数据分析
- 打开"FlowJo"图标,在"所有样本"窗口中拖动每个管的文件。
- 双击"富集 T 单元格"文件,显示 Y 轴上向前散点 (FSC-A) 和 Y 轴上的侧散射 (SSC-A) 显示的点图。
- 点击"多边形"圈出淋巴细胞群。
- 接下来,双击圆圈填充以创建新窗口。
- 在 Y 轴上选择"FSC-W",在 X 轴上选择"FSC-A",然后圈出 FSA-W 负数。在"子人口标识"窗口中,将单元格群命名为"单个单元格"。
- 双击圆圈填充以创建新窗口。在 Y 轴上选择"CD3",然后圈出 CD3 阳性细胞。在"亚人口标识"窗口中命名您的单元格群"T 单元格"。
- 重复"非富集T细胞"。
- 要可视化单元格群,请单击"布局编辑器",并将"T单元格"填充从"富集 T 单元格"和"非富集 T 单元格"文件拖到选项卡中。
- 将显示表示 CD3+ 淋巴细胞的点图。CD3+ 细胞应只出现在 CD3+ 浓缩管的感兴趣人群中。
- 要评估已排序单元格中 CD3+ 淋巴细胞的富集性,请单击"表编辑器",然后将"富集 T 细胞"和"非富集 T 细胞"文件的"T 细胞"总体拖到表中。
- 在"统计"菜单上,选择"淋巴细胞的频率"细胞以检查所有淋巴细胞中CD3+细胞的百分比,然后单击"创建表"。
- 参数值将显示在新表中。对于"富集T细胞",CD3+细胞的频率应在80%左右。
Results
在此协议中,CD3阳性细胞通过磁细胞分拣从胸腺白细胞中富集(图1)。在磁细胞富集CD3阳性细胞之前,CD3阳性细胞占胸腺细胞总数的53.6%(图2,顶部面板)。磁细胞富集后,CD3阳性细胞的百分比增加到95%(图2,底部面板)。因此,MACS是一种简单、快速、高效的细胞浓缩技术,用于从细胞悬浮混合物中丰富所需的细胞群。
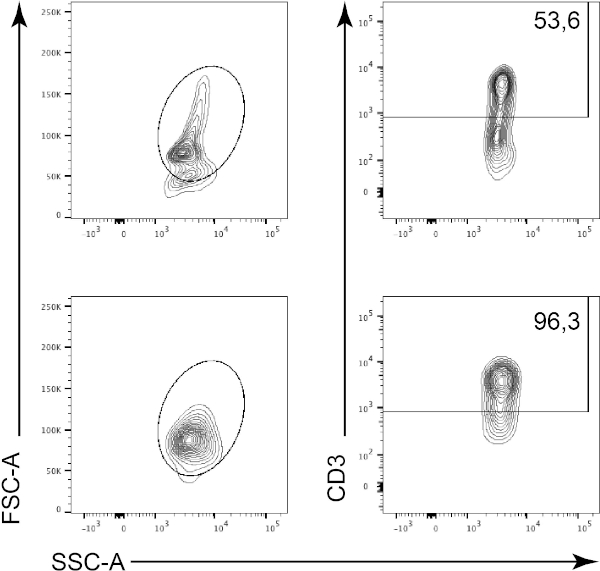
图2:浇注策略和纯度测试排序。首先根据细胞的形态(左:FSC-A、SSC-A)对细胞进行封闭,然后根据CD3(右图:CD3,SSC-A)绘制细胞。顶部面板表示细胞富集前的胸腺细胞悬浮液。底部面板表示磁细胞分类后的胸腺细胞悬浮液。请点击此处查看此图的较大版本。
Application and Summary
磁分离技术是方便快速地对目标细胞群进行分类的常用方法。使用T细胞特异性抗体和磁珠,我们丰富了样品中的T细胞频率。实验结束时的纯度取决于初始细胞悬浮液中目标细胞的百分比。磁细胞分类后获得的细胞可用于各种用途,如细胞转移或细胞周期分析。另一种排序方法,使用流细胞测定法,可用于丰富细胞。这种技术在细胞分类后具有非常高的纯度,但它需要更多的步骤,需要更多的时间。
Tags
跳至...
此集合中的视频:

Now Playing
磁性活细胞分拣 (MACS): 胸腺 T 淋巴细胞的分离
Immunology
23.1K Views

流细胞学和荧光活化细胞分拣(FACS):血性B淋巴细胞的分离
Immunology
93.2K Views

ELISA Asas :间接、三明治和竞争
Immunology
239.4K Views

ELISPOT 分析:检测 IFN-- 分泌性细胞
Immunology
28.8K Views

免疫组织化学和免疫细胞化学:通过光显微镜进行组织成像
Immunology
79.2K Views

抗体生成:使用杂交瘤生产单克隆抗体
Immunology
43.7K Views

免疫荧光显微镜:石蜡内嵌组织部分的免疫荧光染色
Immunology
54.0K Views

共聚焦荧光显微镜:确定小鼠纤维细胞中蛋白质定位的技术
Immunology
43.4K Views

基于免疫沉淀的技术:使用阿加玫瑰珠纯化内源性蛋白质
Immunology
87.9K Views

细胞周期分析:使用CFSE染色和流细胞测定法评估刺激后CD4和CD8 T细胞增殖
Immunology
24.3K Views

收养细胞转移:将供体小鼠孢子细胞引入宿主小鼠,并通过FACS评估成功
Immunology
22.6K Views

细胞死亡测定:细胞毒性能力的铬释放测定
Immunology
151.5K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。