マウス脊髄のマイクロCTイメージング
概要
出典:ペイマン・シャーベイギ・ルードポシュティとシナ・シャーバズモハマディ、バイオメディカル工学部、コネチカット大学、ストールズ、コネチカット州
X線の発見と(不注意な)使用が史上初のノーベル物理学賞を受賞したことは、あまり知られていない事実です。科学界を通じて衝撃波を送った1895年のレントゲン博士の妻の手の有名なX線画像は、現代の2D医療X線画像のように見えます。最新の技術ではありませんが、X線吸収イメージングは不可欠なツールであり、世界トップの研究開発や大学の研究室、病院、空港などで見つけることができます。おそらく、X線吸収イメージングの最も先進的な用途は、2D医療用X線に見られるが、コンピュータ断層撮影(CTまたはマイクロCT)を介して3Dで実現されたような情報を達成することを含む。一連の2D X線投影を行うことで、高度なソフトウェアはデータを再構築して3Dボリュームを形成することができます。3D 情報は、開いたままにすることなく、プローブされたオブジェクトの内部からの情報を含むことができる場合があります。ここでは、マイクロCTスキャンが得られ、画質に影響を与える主な要因について説明します。
原則
X線は、0.1~100keVのエネルギー範囲のフォトン、または波長が0.01~10nmの電磁波と見なすことができます。X線はいくつかの異なる方法で作成できますが、ここでは連続的なスペクトル円錐形ビームX線イメージングに限定されています。これらのX線は、ドイツ語で「制動力放射線」を意味する「ブレムスストラルン」と呼ばれる現象によって作られています。これは、荷電粒子が加速度[1]を受けた場合に発生します。X線源では、負の荷電電子が真空管で撮影され、標的物質(通常タングステン、モリブデン、銅、または他の金属)に衝撃を与え、その減速を通じて、X線のスケールで光子を放出する。[2]に見られるようにターゲット材料の特性エネルギーを中心とした分布にスパイクがあるが、減速が均一でも瞬間的でもないため、X線の連続スペクトルが発生する。エネルギーとターゲット材料には異なる曲線があります。これは、マイクロ CT スキャンを実行する際に考慮すべき非常に重要な事項であり、後のセクションで説明します。
一般的なマイクロCTシステムは、[3]に示すように、3つの主要なコンポーネントを備えています。このシステムの基本的な構成要素には、a)X線源、b)サンプル取り付け用の回転ステージ、ccD検出器を備えたc)フラットパネルまたは光学目的が含まれます。X線は源を離れ、検出器に到着する前にサンプルによって吸収、透過、または散乱される。吸収は、体内の異なる材料が異なるX線を吸収するので、microCTで測定される主要な相互作用です。例えば、骨には原子カルシウムが多く含まれており、X線をよく吸収します。したがって、骨はX線が検出器に到達するのをブロックし、画像に影として現れてしまいます。その後、サンプルは段階的に回転し、サンプルが360°または場合によっては180°で画像化されるまでプロセスが繰り返されます。断層撮影の出力は、3D ボリュームに再構築できるさまざまな方向の一連の 2D 投影です。
マイクロCTは顕微鏡検査の一形態であり、マイクロスケールの特徴を解決する能力からその名を得る。マイクロCTのこの特定のカテゴリの分解能の制限は、ソーススポットのサイズとエネルギー拡散、および検出器のタイプと有効性によって制御されます。X線の波長によるものではない。マイクロCTのこのカテゴリのために可能な最もよい決断は3次元の約500-700 nmである。しかし、そのサイズの10分の1または100分の1の特徴を検出することは可能です。
倍率は、幾何学的倍率によってほとんどのCTシステムで行われます。[3] の画像は、幾何学的倍率の考え方を示しています。シャドウ効果として簡単に想像できます。光源がオブジェクトに近いほど、光源は近い。オブジェクトのシャドウが大きいほど、壁または画面に表示されます。同様に、その壁またはスクリーンが静止光源とサンプルから離れる場合、オブジェクトのシャドウのサイズは大きくなりますが、かすみに大きくなります。十分な信号、高解像度、短いスキャン時間が必要な場合、X線源と検出器の動作距離の最適化は非常に困難で精神的に刺激的な作業です。何と同様に、ポイントソースの理想化が破壊され、収差が大きくなり、幾何学的な倍率に制限があります。
マイクロCTの多くの課題の1つは、スキャンが完了して再構築されるまで、3Dボリュームの画質が調査者に多少知られていないということです。しかし、十分な経験があれば、いくつかの2D突起を注意深く調べると、CTスキャンに自信を持つほどの情報が得られます。次のセクションでは、一連の演習で、データセットに対するさまざまなイメージング パラメータの影響を明らかにし、クリーンな 3D ボリュームを取得するために必要な理解を科学者に提供します。この調査の目的のために、生物学的サンプルは、手順がサンプルタイプに限定されないが、プローブされるであろう。
サンプルを取り付けるのは些細なステップのように聞こえますが、最も重要で見落とされているステップの1つです。アプリケーションに関係なく、サンプルは可能な限り最もコンパクトな方法でマウントする必要があります。[3]の画像を考えると、サンプルが一方向に突き出ていて、それが幾何学的倍率にどのような影響を与えるかが原因で、ソースと検出器の位置の範囲が制限されていた場合を想像してみてください。作業時間に加えて、マウントはスループットに大きく影響します。サンプルがラットの無傷の膝関節である場合は、脛骨と大腿骨が直立するようにサンプルを取り付けるのが理にかなっています。このようにして、X線は短い距離を通過し、検出器に十分な信号が存在します。サンプルを取り付ける際に考慮すべき最後のことは、安定性です。マイクロCTに対する最大の敵は動きです。サンプルの移動の大きさがスキャンの解像度に近づくと、おそらく役に立たないデータになります。動きは、マウントへの安全な接着とサンプル組成の変化への制御によって制限されるべきです。生物学的サンプルの場合、それはスキャンの長さにわたって蒸発によって形態を変えないことを保障することを意味する。アガロースゲル中の懸濁液またはパラフィンフィルムの薄層でのラッピングは、脱水および動きを避けるために可能なアプローチの両方である。
X線エネルギーは、最終的な3D体積の品質にも大きな影響を与えます。目標は、サンプルから十分な減衰を有しながら、検出器で十分な信号を取得することです。X線減衰は式(1)に従い、Iはカウントの最終数(強度)、I0はカウントの初期数、μは所定の材料とX線エネルギーに固有の質量吸収係数(広く公表)、εは材料の密度、xはX線経路長である。
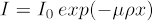 (1)
(1)
理想的には、I/I0 (伝送値) は、サンプルのすべての向きに対して 5 ~ 95% の間で、最良の結果が中間範囲の周りに来る必要があります。この値を確認するには、サンプルの画像を取得し、画像のピクセル値を空気の画像で除算します(つまり、サンプルを視野の外側に表示します)。この正規化は、一般にシステム ソフトウェア ワークフローで見つかります。生物学的サンプルがソースでのX線フィルタリングの使用を要求することはあまりないので、ここでは説明しません。理想的な伝送値を持つことに加えて、サンプルの任意の部分の理想的なカウント数は5000カウントです。これを確保するには、投影あたりの露光時間を増やす必要があります。これにより、全体的なスキャン時間が長くなります。図 1 は、クリーンな 2D 投影法を示しています。
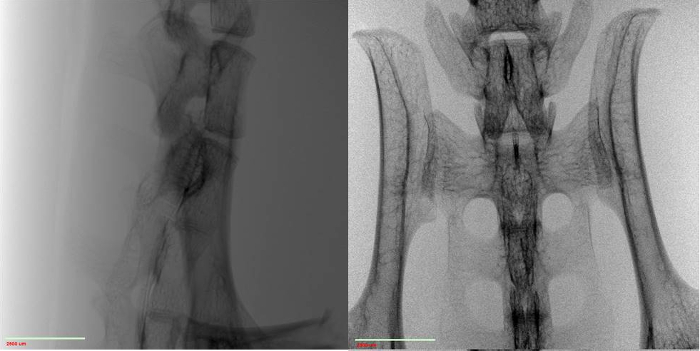
図1:マウス脊髄の2D画像を0°(左)と90°(右)の空気に対して正規化した。
手順
1. サンプル(ボーン)の取り付け
- 脊椎のような骨のネットワークを調べるには、アガロースゲル内の構造を一時停止し、非常に薄肉のプラスチックチューブで硬化させます(図2)。チューブの薄さは非常に重要であり、信号スループットと全体的な画質に大きく影響します。これは、機能を解決する機能に影響します。チューブの伝送値は、可能な限り100%に近い値でなければなりません。
- テープまたはカスタムスタンドを作ることによって、サンプルステージにチューブを取り付け、最終的にステージが回転したときにサンプルが静止して安定していることを確認します。

図2:マウス脊椎は、マイクロCTシステムのサンプルステージに座っている薄肉プラスチックチューブ内のアガロースゲルに懸濁した。
2. 画像取得
- X線源を90 keV(90 kVおよび10 W)の範囲のエネルギーにオンにします。
- ソースがウォームアップし、エネルギーに落ち着いた後、システムのソフトウェアを介して画像を取得します。
- 空気の画像に対して画像を正規化して送信値を確認します。自動参照取得とアプリケーションの場合は、サンプルがクラッシュすることなく特定の方向に移動できることを確認します。
- 画像の伝送が大きすぎる場合は、伝送値が十分になるまでエネルギーを徐々に下げます。画像が騒がれ、粒状に見えないように、それに応じて露出時間を増やしてください。画像の伝送速度が低すぎる場合は、伝送値が十分になるまでエネルギーを徐々に増やします。
- X線源をサンプルに近づけながら、クラッシュしないように細分かるようにします。ソースをできるだけサンプルに近づけることは、スループットを最大化し、可能な限り最適な解像度を確保する方向への一歩です。
- これを行うにつれ、サンプルステージをリニアアクチュエータでシフトすることで、サンプルの視野を絞り込みます。
- ソフトウェアは、現在の解像度と同様に扱われるピクセルサイズと呼ばれるパラメータが表示されます(実際には異なります)。
- 数値がまだ大きすぎて、ソースが非常に近い場合、検出器はサンプルから離れ始めることができます。
- 数値が小さすぎる場合は、検出器をサンプルの近くに慎重に移動します。
- 異なる光学目標と検出器の位置も試してみてくださいが、スキャンパラメータを最適化しようとすると、これがもたらす合併症に注意してください。
- サンプルのすべての向きをチェックして、最適な露出時間を見つけるためにクラッシュがないことを確認します。これは、作業距離、ピクセル サイズ、およびサンプル位置の変更が原因で実行されます。
- キャビネット内カメラを介してソースと検出器に対する相対的な位置を監視しながら、サンプルをゆっくりと2度ずつ回転させます。衝突が発生する可能性がある場合は、必ずソースと検出器を離してください。
- カウント/伝送値の数が最も少ない最長のX線パス長を見つけ、どこでも約5000カウントを確保するために必要な露光時間を見つけます。
3. 断層撮影の提出と再構築
ユーザーの観点からの再構築プロセスは、前の手順で行った他のパラメーターの選択よりも複雑ではありません。ただし、このプロセスのプログラミングと計算にかかる費用は、実際には非常に大きくなります。ユーザーは、スムーズなソフトウェア UI の下で何が起こっているのか、および意思決定が最終製品に与える影響を最もよく理解することを目指す必要があります。多くのCTシステムは、2D投影法がピクセル値を記述する一連の線形方程式に変換される反復代数再構成アルゴリズムを利用しています。他のいくつかのシステムでは、Radon 変換によって投影法がシノグラムに変換され、一連のライン統合操作に渡される、フィルター処理されたバックプロジェクション アルゴリズムが使用されます。もちろん、他のアプローチやハイブリッドメソッドを使用するものもあります。これらのアルゴリズムとの関与の最も低いレベルでは、投影の数と回転した変位の合計が最終的な再構築されたボリュームに影響を与することが知られています。
- まず、サンプルのアスペクト比に基づいて180°以上または360°をスキャンするかどうかを決定します。サンプルのアスペクト比が高く、X線経路の長さが180°スキャンよりも0°向きよりも90°方向で約4倍以上長くなるのが賢明な選択です。(短いX線経路の長さで収集された情報は、一方の側から他方に変わらないという議論です。より多くの投影法を長い X 線パスの長さの方向に専用にできる場合は、データセットよりも有益です。投影間の角度変位は低くなり、再構築アルゴリズムに供給されるこれらのトリッキーな方向からのより多くの情報があります。アスペクト比が高くない場合は、360°スキャンを使用します。
- 次に、投影の数と総角度変位を選択します。この角度が小さいほど、補間が少なくなり、微細なフィーチャ情報が切り捨てられます。(より多くの投影は、サンプルが移動できる大きなウィンドウに相関するスキャン時間が長く、他のものをスキャンする時間が短く、ソースの有効期間が短いため、バランスを確立する必要があります。経験則では、360° を超える少なくとも 800 の投影を持ち、3200 の投影を超えない必要があります。
- スキャンを送信します。
- 断層撮影が終了した後(通常は4~16時間)、2Dシリーズの画像をシステム(または一部のオープンソース)再構築ソフトウェアに取り込みます。
- 最適なセンターシフト補正を選択します。センターシフトは、プロジェクトを整列させるパラメータです(きちんとしたスタックのように集めて整列する必要があるカードの大まかにシャッフルされたデッキを考えてください)。通常、この値は -10 ~ 10 ピクセルの間です。
- 最適なビーム硬化補正係数を選択します。ビーム硬化補正は、サンプルフィルタリングによって生成されるコントラストの人工的な除去である。サンプルが十分に厚い場合、または光と重い材料の範囲が含まれている場合は、低エネルギー(ソフト)X線の減衰に基づいて偽のコントラストを持つことになります。これは控えめに適用する必要があります。平均値は 0 ~ 0.5 の間です。
- 再構築を送信します。
結果
次の図は、上記の手順でmicro-CTを使用して得られる結果の概要を示しています。さまざまな吸収に関する定性的測定は、これらの画像に基づいて直接指摘することができる。材料の空隙率、特徴の大きさや分布などの定量的なデータは、別のソフトウェアで追加の画像処理を必要とします。
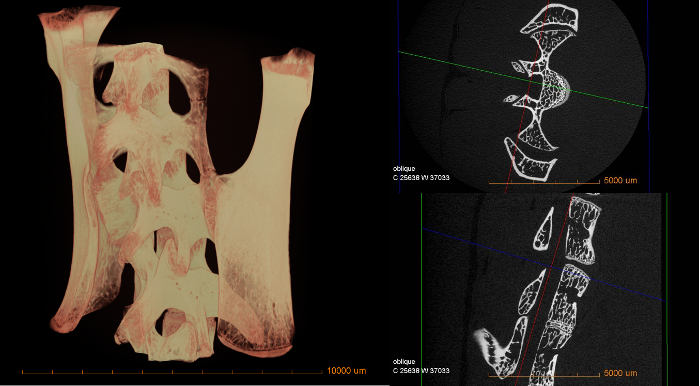
図3:マウス脊髄の3D体積(左)と2つのデジタル断面スライス(右)
申請書と概要
この実験では、マイクロCTを使用する際、特に生物学的試料について考慮すべき多くの因子を調べた。このプロジェクトは、調査者がマイクロ CT が提供できるデータにどのような影響を与えるかを調査者が理解できるように設計されています。例示したように、取り付け、X線エネルギー、露光時間、ソースと検出器の位置、突起の数、および総スキャン角度変位を含む多くの従属および敏感なパラメータを考慮する必要があります。この演習は序文として意図されており、CT データセットの制御の表面を傷つけるだけです。
この実験は、生体試料のイメージングに関してマイクロCTの紹介を行うことを中心に行いましたが、3D X線断層撮影の応用はマイクロエレクトロニクス、地質学、添加剤製造、コーティング、燃料電池などの世界にまで及びます。.これらの顕微鏡は点検、故障の分析、特徴付け、品質管理、そして非破壊試験のために使用される。実際の 3D 情報に非破壊的にアクセスできるようになったため、CT から抽出されたジオメトリをシミュレーションにインポートして、オブジェクトを仮想的にテストできます。
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
マウス脊髄のマイクロCTイメージング
Biomedical Engineering
8.3K 閲覧数

光学・共焦点顕微鏡による生体試料のイメージング
Biomedical Engineering
36.3K 閲覧数

生体試料のSEMイメージング
Biomedical Engineering
24.1K 閲覧数

ナノドラッグキャリアのバイオディストリビューション:SEMの応用
Biomedical Engineering
9.6K 閲覧数

腹部大オルタの高周波超音波イメージング
Biomedical Engineering
14.8K 閲覧数

腹部大動脈瘤の定量的ひずみマッピング
Biomedical Engineering
4.6K 閲覧数

インフラレナル大オルタにおける血液と脂質を画像化する光音響断層撮影
Biomedical Engineering
5.9K 閲覧数

心臓磁気共鳴イメージング
Biomedical Engineering
15.0K 閲覧数

脳動脈瘤における血流の計算流体力学シミュレーション
Biomedical Engineering
11.9K 閲覧数

腹部大動脈瘤の近赤外蛍光イメージング
Biomedical Engineering
8.4K 閲覧数

非侵襲的な血圧測定技術
Biomedical Engineering
12.1K 閲覧数

心電図(心電図)信号の獲得と解析
Biomedical Engineering
107.0K 閲覧数

リバーブルバイオマテリアルの引張強度
Biomedical Engineering
7.7K 閲覧数

ラットにおける非侵襲的ACL損傷後の膝関節変性の可視化
Biomedical Engineering
8.3K 閲覧数

SPECTとCTイメージングを組み合わせて心臓機能を可視化
Biomedical Engineering
11.2K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved