Method Article
Protocolo de injeção direta do nervo vago para ratos
Neste Artigo
Resumo
Apresentamos um protocolo para injeção direta do nervo vago em ratos, permitindo a administração do medicamento diretamente no nervo sem complicações pós-injeção. Este método se aplica a estudos neurológicos pré-clínicos envolvendo manipulação do sistema nervoso autônomo. Pode ser usado para injeção direta de nervos para outros nervos em ratos e outras espécies, com as modificações necessárias.
Resumo
Há uma abundância relativa de estratégias e metodologias para facilitar a entrega de medicamentos ao sistema nervoso central. No entanto, a administração de medicamentos diretamente no sistema nervoso periférico é menos comum, com menos publicações de métodos detalhados disponíveis para ajudar os pesquisadores. Aqui, descrevemos um método de injeção direta de nervo para administração de medicamentos no sistema nervoso periférico, usando o nervo vago como nervo modelo. Este método pode ser usado no tratamento de distúrbios do sistema nervoso autônomo através do direcionamento do nervo vago esquerdo, embora este método geral de injeção possa ser extrapolado para injeção de outros nervos com pequenas modificações. Este método explica todas as etapas críticas envolvidas no procedimento envolvendo microcirurgia em ratos adultos anestesiados sob um microscópio de dissecação. O uso de um corante de rastreamento é descrito para facilitar o monitoramento da fidelidade da injeção em tempo real. São fornecidas ilustrações de injeções bem-sucedidas e fracassadas. Se realizadas corretamente, as injeções diretas do nervo vago podem ser conduzidas de maneira segura e bem tolerada pelo rato, sem complicações pós-parto. Por exemplo, uma vez que os cirurgiões foram treinados neste método, seis dos seis ratos foram injetados com sucesso sem complicações. Este método de injeção direta de nervos para estudos pré-clínicos em ratos é capaz de fornecer agentes (incluindo, mas não se limitando à terapia genética) aos nervos periféricos.
Introdução
A aplicação do método correto de administração de medicamentos é um dos fatores críticos para alcançar resultados terapêuticos bem-sucedidos. Apesar da abundância de métodos para entrega de agentes terapêuticos ao sistema nervoso central (SNC), apenas alguns métodos são relatados para entrega do sistema nervoso periférico (SNP) por injeção direta no nervo. A injeção direta do nervo, como a injeção nos gânglios da raiz dorsal (DRG) em ratos, foi testada em estudos pré-clínicos para melhor compreensão dos mecanismos de dor, toxicidade de drogas, transferência de genes 1,2,3 e desenvolvimento de métodos gerais 1,4. Relatos adicionais sobre injeção direta do nervo incluem injeção do nervo espinhal4, injeção do nervo ciático1 e injeção do nervo vago em ratos5 e camundongos6. Recentemente, um método de injeção supracondrial foi proposto para a melhor distribuição da terapêutica na cabeça do nervo óptico em coelhos7.
O DRG é considerado o local ideal para injeção direta de vetores carregados de transgenes, como o vírus adeno-associado (AAV), devido à função sensorial dos corpos celulares no DRG2. Métodos cirúrgicos e não cirúrgicos de injeções de DRG foram descritos 1,8. No entanto, conclusões controversas foram encontradas sobre a consistência dos resultados com o método não cirúrgico de injeção de DRG1. Um método cirúrgico envolvendo uma laminectomia parcial foi sugerido como 100% bem-sucedido para injeção de DRG em ratos sem qualquer alteração nos resultados comportamentais3, bem como um método envolvendo osteotomia parcial em camundongos9. Vários estudos relatam os métodos de injeção de DRG de drug delivery, que têm sido utilizados na pesquisa pré-clínica de terapia gênica em ratos e camundongos 1,2,10. Estudos de terapia gênica baseados em vetores envolvendo injeções localizadas podem incluir os seguintes benefícios: diminuição da expressão fora do alvo, redução da toxicidade sistêmica e menores cargas virais e volumes de injeção, diminuição do risco de complicações imunogênicas11,12.
O método de injeção direta no nervo ciático, o nervo mais longo do corpo, foi tentado expondo o nervo ciático direito no nível médio da coxa de um rato. O método utilizou uma pipeta de vidro puxado equipada com um sistema de injeção controlado por microprocessador para injetar um volume total de 10 μL de corante com uma taxa de fluxo de 1,2 μL/min1. Este experimento mostrou uma falta de distribuição de corante ao nível de DRG, e a distribuição foi limitada principalmente em torno do local da injeção. Da mesma forma, outros métodos de injeções diretas de nervos, como injeções de nervos espinhais, foram testados com corante para avaliar a quantidade apropriada de volume de injeção e padrão de distribuição de corante em ratos. Sugere-se que 2 μL sejam ideais para injeção no nervo espinhal, enquanto 3 μL de corante por injeção de DRG mostraram a distribuição nos gânglios da raiz dorsal e ventral em ratos1. O volume para injeção de DRG em camundongos foi relatado como ideal de 1,0 μL a 1,5 μL com base na cepa e no tamanho do corpo 2,9.
O método de injeção direta do nervo vago foi usado em ratos5 e camundongos6 para avaliar o papel da lesão neural ou integridade celular na transferência de α-sinucleína humana. Esses dois estudos, conduzidos pelo mesmo grupo de pesquisadores, descrevem um breve método de injeção direta de vetores AAV no nervo vago esquerdo na região cervical. Em ratos, o método envolveu um capilar de vidro com um diâmetro de ponta de 60 μm para injetar 2 μL de vetor a uma taxa de fluxo de 0,5 μL / min com uma seringa Hamilton de 5 μL. Em camundongos, um volume total de solução vetorial de 750 nL foi injetado a uma taxa de fluxo de 160 nL / min usando uma agulha de aço rombo de 36 G encaixada em uma seringa NanoFil de 10 μL6. Esses experimentos mostraram que o transgene foi entregue e expresso em axônios na ponte e no mesencéfalo dos ratos e camundongos. Da mesma forma, o núcleo motor dorsal do nervo vago esquerdo mostrou imunorreação positiva com o transgene. Essas evidências ilustram que o método de injeção direta do nervo vago pode ser um método confiável em terapia genética, onde a transdução celular é estendida para vários locais do cérebro, que projetam axônios através do nervo vago. No entanto, esses métodos não mencionam o uso de nenhum corante para rastrear a fidelidade da injeção.
Aqui, é descrito um método para injeção direta no nervo vago esquerdo usando corantes de rastreamento não tóxicos amplamente aplicáveis a pesquisadores em estudos pré-clínicos. Armadilhas potenciais que podem causar dificuldades na entrega de medicamentos e as formas de superá-las são discutidas. Essas situações são ilustradas com fotos para mostrar o que torna a entrega malsucedida e a maneira de torná-la bem-sucedida.
Protocolo
O protocolo a seguir é conduzido de acordo com as diretrizes de ética institucional e a aprovação do Comitê Institucional de Cuidados e Uso de Animais (IACUC).
1. Preparação da habitação
NOTA: Este protocolo é para ratos adultos com pelo menos 2 meses. Animais menores (incluindo camundongos e ratos mais jovens) são possíveis, mas não são recomendados e serão consideravelmente mais difíceis.
- Forneça ração úmida ou qualquer outro alimento macio (gel de recuperação veterinária) por 48 h antes da cirurgia do nervo vago. Como os animais podem enfrentar dificuldade para comer após o procedimento, apresente esses itens aos animais antes da cirurgia para ajudá-los a se familiarizar com o sabor desses itens e induzir a motivação alimentar.
- Ratos domésticos individualmente em uma gaiola pelo menos 1 semana antes da cirurgia, bem como 1 semana após a cirurgia. Isso permitirá que eles se acostumem com o estresse de estar sozinhos e evitem arranhões nas feridas após a cirurgia por um companheiro de ninhada.
2. Preparação dos itens cirúrgicos e espaço
- Faça uma lista de todos os itens necessários com antecedência e verifique novamente se todos os itens estão disponíveis para a cirurgia.
- Esterilize todos os itens com métodos apropriados de esterilização antes da cirurgia.
- Configure o espaço cirúrgico estéril sob o microscópio de dissecação. Coloque uma almofada de aquecimento sob o microscópio para manter o rato aquecido durante a cirurgia.
- Coloque todos os materiais cirúrgicos em uma mesa cirúrgica sobre uma cortina estéril. Mantenha espaço suficiente para a cirurgia sob o microscópio de dissecação. Certifique-se de que o foco do microscópio seja ideal e abranja a área cirúrgica para visualizar o nervo.
- Coloque a bomba de seringa perto do estágio cirúrgico para que o comprimento do tubo seja suficiente para alcançar o local da injeção.
- Coloque as ferramentas cirúrgicas ao lado da mão dominante do cirurgião.
3. Preparando uma mistura do medicamento candidato e do corante de rastreamento
- Certifique-se de que o medicamento candidato seja diluído para atingir a concentração necessária no diluente recomendado, de modo que 5 μL do medicamento misturado com corante forneçam a quantidade necessária do medicamento candidato a ser administrado. Recomenda-se que um volume máximo de injeção pelo método do nervo vago direto seja de 5 μL (incluindo o corante de rastreamento, consulte a etapa 3.2).
- Misture um corante compatível com o medicamento candidato para permitir o rastreamento da fidelidade da injeção em tempo real. Por exemplo, uma concentração final de 1% de Luxol Fast Blue ou 0,002% de fluoresceína são corantes compatíveis a serem usados.
CUIDADO: Use o corante em sua concentração ideal na mistura de corante e medicamento candidato. Quando a concentração de corante na mistura é muito baixa, pode não ser visível rastrear a injeção. Quando a concentração de corante é muito alta, pode resultar em uma mistura muito espessa e com alta viscosidade, o que bloqueará a agulha de injeção.
4. Carregando a mistura candidata de medicamento e corante na tubulação
- Ligue uma seringa de vidro de 100 μL com o êmbolo removido a uma agulha de 27 G.
- Conecte uma extremidade de aproximadamente 45 cm de tubo de polietileno esterilizado à agulha de 27 G.
- Pegue uma seringa de plástico de 3 mL e encaixe-a com uma agulha de 27 G. Carregue a seringa com cerca de 0,5 mL de solução salina normal a 0,9%.
- Encha o tubo de polietileno com solução salina normal a 0,9% da extremidade aberta para preencher todo o comprimento do tubo e todo o cilindro da seringa de vidro até que transborde.
NOTA: É fundamental evitar que bolhas de ar fiquem presas dentro da tubulação. - Remova e descarte a seringa e a agulha de 3 mL.
- Insira o êmbolo da seringa no cilindro da seringa de vidro e empurre-o ligeiramente para a frente até o meio do cilindro.
- Coloque a seringa de vidro na bomba de seringa.
- Puxe o êmbolo ligeiramente para trás usando a bomba de seringa para criar um espaço de ar de cerca de 1.5 cm na extremidade aberta do comprimento do tubo.
- Pipete pelo menos 5 μL de corante e mistura de medicamento candidato com uma micropipeta de 10 μL e coloque-a em um pedaço esterilizado de parafilme.
- Retire a mistura de medicamentos candidatos para a tubulação puxando o êmbolo para trás através da bomba de seringa. Mantenha a bolha de ar entre a solução salina a 0,9% e a solução de injeção, mas, caso contrário, evite prender bolhas de ar dentro da solução de injeção. Marque o nível da mistura de injeção na tubulação com um marcador.
NOTA: O espaço de ar entre a mistura candidata de corante medicamentoso e a solução salina estéril dentro da tubulação é fundamental para evitar a mistura das duas soluções. - Encaixe a agulha de 35 G com o tubo. Fixe a agulha na superfície limpa do estágio cirúrgico com fita adesiva para que a agulha não fique solta, não se mova e toque em mais nada e permaneça esterilizada.
5. Escorva da agulha de injeção
- Defina o programa da bomba de seringa para dispensar 0.5 μL/min.
- Ligue a bomba de seringa por cerca de 10-15 s, até que a solução de injeção comece a sair da ponta da agulha. Uma pequena quantidade da mistura na ponta da agulha sem vazamento na junta do tubo e da agulha de injeção (ou em qualquer outro lugar ao longo do comprimento da seringa, tubo ou agulha) indica que a configuração está correta.
NOTA: Se uma pequena gota na ponta da agulha não for vista, isso indica um bloqueio da agulha. O bloqueio da agulha pode ocorrer devido à alta viscosidade do medicamento candidato e da mistura de corante, excesso de ar preso no sistema e a seringa de vidro não está encaixada corretamente dentro da bomba da seringa. Consulte a Figura 1 para obter um exemplo de vazamento na junção entre a agulha e o tubo. O priming é fundamental porque ajuda a identificar se a agulha está desobstruída e se a injeção dentro do nervo passaria suavemente.
6. Preparação do rato para a cirurgia
- Obter o peso corporal do rato para calcular a dose necessária de analgésicos. Por exemplo, o carprofeno é usado na dose de 5 mg / kg por via subcutânea em ratos.
NOTA: Recomenda-se armazenar o carprofeno a 4 °C antes da injeção. - Anestesiar o rato com um vaporizador de isoflurano usando uma taxa de fluxo de 3% -4% para indução da anestesia por cerca de 2-3 min. Reduza a taxa de fluxo de isoflurano para cerca de 1,75% -2% para manutenção da anestesia.
- Transfira o rato para uma mesa separada com uma configuração para depilação e preparação do local. Certifique-se de que esta mesa esteja próxima ao espaço cirúrgico.
- Aplique pomada lacrimal artificial em ambos os olhos do rato para evitar o ressecamento excessivo.
- Administre analgésicos de acordo com o protocolo institucional aprovado para controlar a dor quando o rato voltar à consciência.
- Depile a área cirúrgica com uma máquina de cortar cabelo no lado ventral do pescoço, na região cervical. Faça a barba até cerca de 2 cm de distância perpendicular da linha média em ambos os lados, do queixo ao esterno.
- Esterilize a área com álcool etílico 70% e betadina 10%, limpando a área três vezes alternadamente com um cotonete embebido em álcool e iodopovidona. Limpe do centro da área para fora em um padrão circular.
- Transferir o rato para a fase cirúrgica ao microscópio em decúbito dorsal. Ajuste o foco do microscópio para visualizar a área da cirurgia na região cervical.
7. Realização de cirurgia em ratos para injetar o medicamento candidato diretamente no nervo vago esquerdo (Figura 2, Figura 3 e Figura 4)
NOTA: Esta parte do método exigirá uma segunda pessoa para auxiliar o cirurgião.
- Coloque o rato em uma almofada de aquecimento em decúbito dorsal sob o microscópio de dissecação associado a uma luz montada.
- Prenda os dentes da mandíbula superior frontal do rato com um pedaço de sutura não absorvível e fixe a extremidade aberta da sutura dentro do cone do nariz para que a narina do rato fique sempre dentro do cone do nariz durante a anestesia.
- Posicione o rato de forma que sua cabeça fique no lado esquerdo do cirurgião destro (ou no lado direito de um cirurgião canhoto). Nesta posição, a parte frontal do cirurgião é perpendicular ao corpo do rato. Coloque uma almofada de calibre esterilizado sob o pescoço e ajuste o ângulo da região cervical do rato para que a região cervical fique reta. Isso facilitará a localização do nervo vago esquerdo e a realização da injeção.
- Cubra todo o corpo do rato com um campo esterilizado, mantendo o espaço cirúrgico aberto.
- Fixe quatro pinos retratores individualmente com 4 fixadores magnéticos com elastômeros e coloque os fixadores nos quatro cantos do estágio cirúrgico.
- Injete anestésicos locais epidérmicos na linha média da região cervical onde a incisão é feita. Por exemplo, geralmente é usada uma mistura de lidocaína e bupivacaína.
- Faça uma incisão longitudinal na pele com cerca de 2 cm de comprimento na linha média entre o queixo e o esterno com uma lâmina de bisturi no lado ventral do pescoço na região cervical (Figura 3A).
- Separe as bordas cortadas da pele com pontas de algodão esterilizadas.
- Retraia as bordas da pele em direções opostas do local da incisão com a ajuda de pontas retratoras.
- Separe o painel com pontas de algodão para ir mais fundo. Empurre as glândulas salivares para o lado lateral.
- Separe os músculos esternomastóideos com pontas de algodão e retraia-os com os pinos. À medida que a separação do músculo esternomastóideo avança, a traqueia aparece no meio, coberta por músculo esterno-hióideo (Figura 3B).
NOTA: Tenha cuidado para não exercer pressão sobre a traqueia. - Avance a separação do tecido no lado esquerdo da traqueia do rato até que apareça a bainha carotídea, que contém a artéria carótida comum correndo junto com o nervo vago esquerdo.
- Faça cuidadosamente um pequeno orifício na bainha carotídea com uma pinça fina, prestando atenção para não ferir a artéria carótida ao microscópio. Separe o nervo vago esquerdo da artéria carótida comum com uma pinça fina.
NOTA: A área cirúrgica é anatomicamente crítica. A parede da artéria carótida é espessa, escorregadia e não se machuca facilmente, mas a ponta afiada de uma pinça fina pode machucá-la e pode ocorrer sangramento. Ao mesmo tempo, preste atenção para não ferir o nervo. - Uma vez que o nervo é separado da artéria pela pinça, use uma agulha curva de 25 G encaixada em uma seringa de 1 mL desse orifício para "enganchar" e segurar o nervo pela mão não dominante (Figura 4A).
NOTA: A ponta da agulha curva é cega para não ferir o nervo e a artéria. O ângulo de curvatura da ponta da agulha é feito sob medida para cerca de 90° usando um hemostático (Figura 2). - Com a mão dominante, segure a agulha carregada com a mistura candidata de corante medicamentoso e pique suavemente o nervo na mesma direção em que o nervo corre, de modo que o chanfro da agulha fique voltado para cima.
- Para uma picada fácil, mantenha o nervo reto puxando suavemente usando o gancho de 25 G. Insira a agulha no nervo e avance para frente, mais de 0,5 cm, mantendo a agulha paralela ao nervo vago. Em seguida, puxe ligeiramente para trás para que cerca de 0,4-0,5 cm da agulha permaneça dentro do nervo.
NOTA: O ângulo da agulha deve ser raso o suficiente para penetrar dentro do nervo sem passar para o outro lado.
- Para uma picada fácil, mantenha o nervo reto puxando suavemente usando o gancho de 25 G. Insira a agulha no nervo e avance para frente, mais de 0,5 cm, mantendo a agulha paralela ao nervo vago. Em seguida, puxe ligeiramente para trás para que cerca de 0,4-0,5 cm da agulha permaneça dentro do nervo.
- Pode haver ocasiões em que a agulha está desobstruída fora do nervo no momento da preparação, mas a mistura candidata de corante medicamentoso não passa suavemente dentro do nervo. Para evitar essa situação, limite o número de picadas nervosas com uma única agulha não mais do que 3 vezes. Se a agulha ficar embotada, as chances de bloqueio ou injeção inadequada aumentarão.
- Certifique-se de que a agulha esteja completamente dentro do nervo. Mantenha a posição imóvel e ligue a bomba da seringa.
NOTA: Verifique cuidadosamente no local da injeção para ver se a mistura candidata de corante medicamentoso não está refluindo para fora do nervo. - Enquanto a injeção estiver em andamento, examine constantemente se a infusão permanece dentro do nervo e flui suavemente. Use a marca feita no tubo de infusão para monitorar o movimento da mistura de corante a partir do ponto de partida.
- Se a mistura candidata de corante medicamentoso não estiver fluindo suavemente, puxe a agulha para fora e repita a etapa de primer (etapa 5.2). Em seguida, reinsira a agulha no nervo e retome a infusão.
- O nervo começa a desenvolver a cor do corante (Figura 4B). Continue a infusão a 0,5 μL / min por 10 min para infundir todos os 5 μL da mistura candidata de medicamento e corante.
NOTA: Recomenda-se irrigar os tecidos expostos com uma pequena quantidade de solução salina estéril quente a 0,9%, conforme necessário, para evitar ressecamento excessivo e danos. - Depois que os 5 μL forem infundidos e a bomba da seringa parada, mantenha a agulha no lugar por mais 1 minuto para permitir que toda a mistura candidata de medicamento e corante se espalhe do local da injeção. Remova a agulha.
- Remova a agulha curva de 25 G. Use pontas de algodão estéreis para mover suavemente os lenços de volta ao seu local original. Remova as pontas do retrator.
- Feche a ferida com uma sutura não absorvível (sutura absorvível também pode ser usada). Aplique uma pequena quantidade de cola de tecido entre os pontos, se necessário, para fechar a ferida perfeitamente.
8. Cuidados pós-operatórios de um rato
- Infundir cerca de 3 mL de solução salina morna a 0,9% por via subcutânea após o fechamento da ferida. Isso ajuda os ratos a se reidratarem imediatamente.
- Coloque o rato em uma fonte de calor até que ele se recupere totalmente da anestesia para a condição normal. Observe qualquer coisa observada que seja anormal durante o processo de recuperação.
NOTA: a duração da recuperação pode ser maior se o procedimento de injeção nervosa demorar muito. - Transfira o rato para sua gaiola doméstica com ração úmida no chão da gaiola. Certifique-se de que a água esteja disponível o tempo todo. Observe o rato no pós-operatório por cerca de 2 h para garantir que o rato não esteja sentindo frio.
NOTA: Coloque o rato em uma fonte de calor por mais horas se sentir frio. - Monitore o rato em 12 h, 24 h, 36 h, 48 h e 72 h após a cirurgia com notas escritas de observações. Repita os analgésicos de acordo com o protocolo institucional aprovado para controlar a dor. Por exemplo, o carprofeno é administrado a uma taxa de 5 mg / kg por via subcutânea duas vezes no intervalo de 24 h. Consulte um veterinário se a dor permanecer no rato por mais de 48 h.
- Repita a injeção subcutânea de cerca de 3 mL de solução salina morna a 0,9% em 24 h com base nas condições do rato.
- Continue a avaliar a ferida. Certifique-se de que a ferida esteja seca e em processo de cicatrização.
NOTA: Vermelhidão, inchaço e condição dolorosa da ferida com inatividade e embotamento do rato podem ser uma indicação de inflamação da ferida e podem justificar uma consulta veterinária adicional. Um rato com dor mostrará costas curvadas, pelagem com babados, olhos vermelhos e condição inativa. Geralmente é encontrado em um canto da gaiola. - Remova as suturas não absorvíveis dentro de 2 semanas após a cicatrização da ferida.
Resultados
Seis ratos adultos (3 machos e 3 fêmeas) foram utilizados no presente estudo. De seis, um rato foi injetado várias vezes para demonstrar uma condição de falha na injeção que mostra uma difusão de corante ao redor do local da injeção Figura 5A. Todos os outros ratos apresentaram injeção lisa e coloração nervosa, conforme mostrado na Figura 4B e na Figura 5B.
A Figura 1 demonstra uma situação em que ocorreu vazamento de corante entre a agulha e o tubo quando o ajuste da agulha de injeção com o tubo não está correto. O corante a 1% usado neste experimento não é muito espesso, mas a passagem do corante pela agulha de injeção falhou devido a um vazamento na vedação. Esse tipo de problema pode ser facilmente identificado no processo de preparação (consulte a etapa 5.2). Para resolver esta condição, verifique se a conexão entre a agulha e o tubo foi feita corretamente. Certifique-se de que cerca de 3 mm de agulha foram inseridos no tubo e certifique-se de que o tamanho do tubo e da agulha esteja correto. Repita a escorva após a conexão defeituosa ter sido corrigida, especialmente se forem introduzidas bolhas de ar (repita a etapa 5.2).
A Figura 2 mostra uma configuração de uma agulha curva e embotada de 25 G encaixada em uma seringa de plástico de 1 mL. A ponta da agulha é embotada e dobrada em um ângulo de cerca de 90° por um porta-agulha. É esterilizado antes do uso e encaixado na seringa esterilizada de 1 mL no momento da cirurgia. Esta agulha encaixada em seringa é usada para separar o nervo vago esquerdo da artéria carótida comum, conforme descrito na etapa 7.14, enganchar e segurá-lo no momento da injeção, conforme mostrado na Figura 4A.
A Figura 3 mostra uma configuração de um procedimento asséptico de incisão na linha média com uma lâmina de bisturi na região ventral do pescoço de um rato para cortar a camada de pele. Depois que o rato é coberto com um campo esterilizado, é feita uma incisão horizontal de cerca de 2 cm de comprimento para cortar a camada de pele, Figura 3A. Uma vez que a pele é cortada, as duas bordas da pele cortada são puxadas para lados opostos com a ajuda de pinos conectados com elastômeros. A tração das bordas cortadas para o lado oposto cria um espaço mais amplo para ir mais fundo. A camada de fácia sob a pele e os músculos esternomastóideos são separados sem corte por pontas de algodão esterilizadas, conforme mostrado na Figura 3B. Uma vez que o nervo vago esquerdo aparece no lado esquerdo da traqueia dentro da bainha carotídea comum, conforme descrito no passo 7.12, ele é separado por uma pinça fina e enganchado como na Figura 4A.
A Figura 4 demonstra uma situação de separação do nervo vago esquerdo da artéria carótida comum e sua retenção pronta para injeção. O cirurgião está segurando a agulha de injeção com a mão dominante (mão direita) e a outra mão (esquerda) está segurando o nervo vago esquerdo do rato com a ajuda de uma agulha curva encaixada em uma seringa de 1 mL, Figura 4A. O nervo vago esquerdo é bem separado da artéria carótida comum e esticado o suficiente para injetar nela. O retângulo pontilhado no lado direito do nervo mostra a área da traqueia coberta com músculo esterno-hióideo. A Figura 4B mostra o nervo vago esquerdo colorido com a cor do corante azul após injeção bem-sucedida sem difusão do corante. O retângulo pontilhado branco é a área da traqueia. A Figura 4B é esticada mais do que a Figura 4A para mostrar uma imagem clara do nervo e seus arredores após a injeção.
A Figura 5 mostra exemplos de injeções fracassadas e bem-sucedidas no nervo vago esquerdo de um rato. Essas injeções usaram 5 μL de corante a 1% a uma taxa de fluxo de 0,5 μL / min no nervo. A Figura 5A mostra uma condição de falha da injeção porque o corante não se limita apenas ao interior do nervo (ver inserção). Em vez disso, o corante se difundiu por toda a área ao redor do nervo. Além disso, o local real da injeção no nervo não é claro. Isso sugere que a injeção não estava dentro do nervo, e uma quantidade significativa de volume de injeção vazou e se difundiu para a área circundante.
Uma situação semelhante pode ser observada em condições em que a agulha precisa ser reinserida ou reposicionada no nervo. Isso pode ser necessário quando a agulha entope e não passa a mistura ou se a agulha fica cega e não pode passar facilmente para o nervo. No exemplo mostrado na Figura 5A, a pequena quantidade de sangue acumulada na área mostra a ruptura acidental de minúsculos vasos sanguíneos na área. Isso acontece quando os vasos sanguíneos da área são lesionados durante a separação do nervo.
A Figura 5B demonstra uma injeção bem-sucedida no nervo. Mostra um ponto claro de injeção e nervo bem manchado, distinto da área circundante. Uma pequena área de mancha de corante fora do nervo é devido a uma pequena quantidade da solução de corante na ponta da agulha que está presente após o primer (ver inserção). O primer é feito para testar a obstrução da agulha antes de picar o nervo.

Figura 1: Vazamento de corante (seta) devido a uma vedação defeituosa entre a agulha e o tubo. Esse tipo de erro ocorre se o tubo não estiver encaixado corretamente com a ponta da agulha. Para evitar esse tipo de vazamento, cerca de 3 mm ou mais da ponta da agulha são inseridos no tubo e o tamanho correto da agulha e do tubo são usados. Clique aqui para ver uma versão maior desta figura.

Figura 2: Uma agulha embotada de 25 G curvada em um ângulo de cerca de 90° e encaixada em uma seringa de plástico de 1 mL. Clique aqui para ver uma versão maior desta figura.
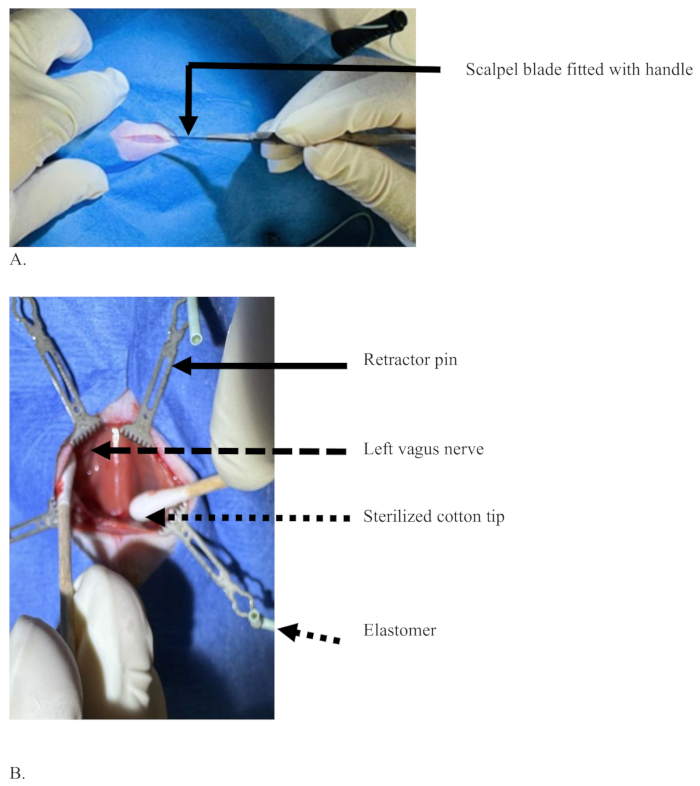
Figura 3: Uma incisão na linha média com uma lâmina de bisturi na região ventral do pescoço de um rato para cortar a camada de pele. (A) Uma incisão com apenas a pele cortada, mas sem sangue, e uma lâmina de bisturi com cabo segurado com a mão dominante do cirurgião. (B) As pontas de algodão esterilizadas (seta pontilhada) separando os tecidos para expor o nervo vago esquerdo (seta tracejada), tecidos separados com a ajuda de alfinetes (seta sólida) suportados por elastômero (seta pontilhada curta). Clique aqui para ver uma versão maior desta figura.
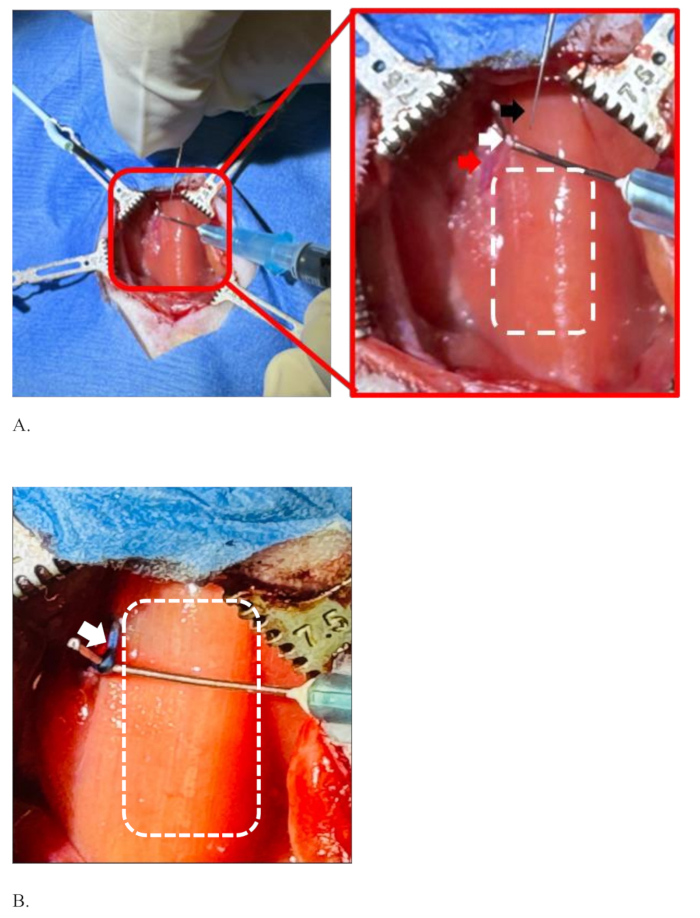
Figura 4: Ilustração da separação do nervo vago esquerdo da artéria carótida comum, segurando-o antes e depois da injeção. (A) A agulha de injeção (seta preta), o nervo vago esquerdo (seta branca), a artéria carótida comum (seta vermelha) e o retângulo pontilhado mostrando a área da traqueia coberta com músculo esterno-hióideo. (B) O nervo vago esquerdo na cor azul, a cor do corante após a injeção bem-sucedida sem difusão do corante (seta branca) e a área da traqueia (retângulo pontilhado). Clique aqui para ver uma versão maior desta figura.
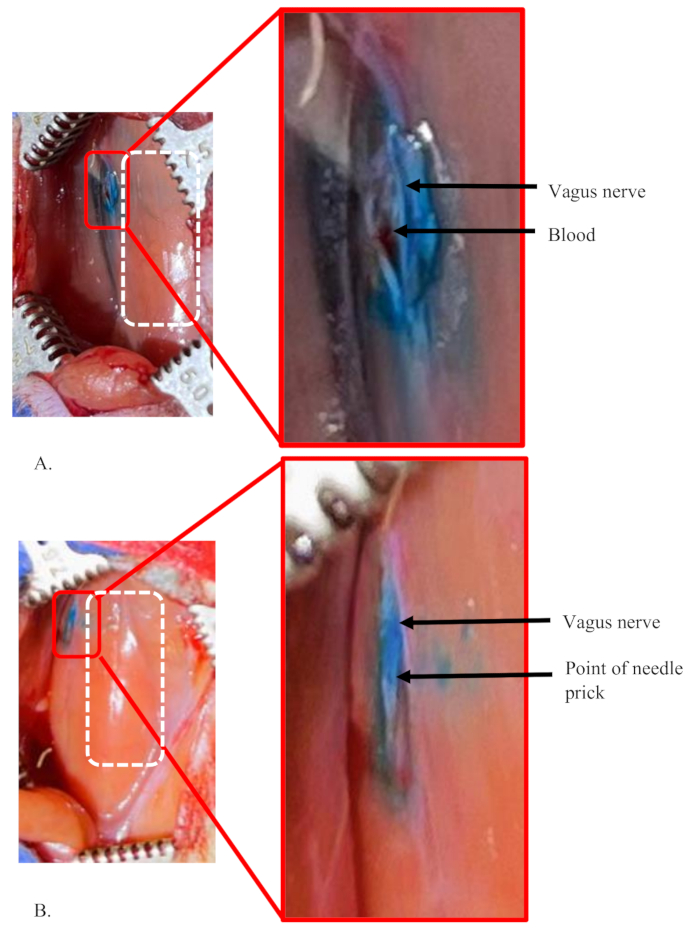
Figura 5: Exemplos de uma injeção fracassada e uma injeção bem-sucedida no nervo vago esquerdo de um rato. (A, B) 5 μL de corante na concentração de 1% foram injetados no nervo vago esquerdo de ratos. O retângulo tracejado branco mostra a área da traqueia em ambos os painéis. (A) Uma condição de falha mostrando que o corante não se limita apenas ao interior do nervo, sugerindo uma quantidade significativa de perda de solução de corante durante o procedimento. A pequena quantidade de sangue acumulada na área mostra uma ruptura acidental de um minúsculo vaso sanguíneo na área, que foi danificado durante a separação do nervo. (B) Uma injeção bem-sucedida no nervo. Mostra um ponto claro de injeção única e nervo bem corado, distinto da área circundante. Clique aqui para ver uma versão maior desta figura.
Discussão
O método de injeção direta no nervo vago esquerdo pode ser feito com segurança e sem complicações pós-cirúrgicas em ratos. A administração de medicamentos ao nervo vago pode ser usada para atingir o sistema nervoso autônomo (SNA). Isso envolve certas etapas críticas que exigem prática e um grau moderado a alto de habilidade cirúrgica.
Este procedimento cirúrgico requer anestesia geral balanceada em ratos. O cirurgião pretende terminar a cirurgia em um período mais curto para limitar a exposição de anestésicos para uma melhor recuperação, especialmente em ratos velhos. Este método também pressupõe um cirurgião treinado com um certo nível de habilidades cirúrgicas assépticas para tornar a injeção e a recuperação pós-operatória bem-sucedidas. A localização anatômica do nervo vago está profundamente assentada em um local crítico13. O nervo vago esquerdo corre lado a lado com a artéria carótida comum esquerda, o que representa um risco de lesão tanto para a artéria quanto para o nervo no momento da separação e injeção. Um alto grau de prática e habilidade é necessário para separar corretamente o nervo da artéria carótida comum. Deve ser mantido no ângulo apropriado durante o procedimento, mantendo a agulha dentro do nervo.
Embora existam apenas dois exemplos publicados de procedimentos diretos do nervo vago em ratos5 e camundongos6 pelo mesmo grupo de pesquisadores, ambos os estudos carecem de uma descrição detalhada de como conduzir o procedimento. O uso de uma agulha 35 G para injetar o nervo foi conveniente (ou seja, nenhum equipamento especial foi necessário para preparar agulhas), e os resultados permaneceram consistentes em comparação com o uso da micropipeta de vidro puxado usada pelo outro grupo. Comparado com as injeções em outros nervos, como o nervo ciático, o nervo vago é relativamente menor em tamanho e só pode conter um volume menor de mistura de corante de drogas por vez. Em um estudo publicado injetando uma solução de corante de 10 μL no nervo ciático, a difusão do corante atingiu um comprimento total de 2,3 cm dentro do nervo a partir do local da injeção sem atingir o DRG1. O nervo vago pode absorver até 5 μL de volume de mistura de corante de droga com segurança usando este protocolo de injeção.
Esta injeção requer um microscópio de dissecação. Embora o uso de um corante na solução injetável não seja absolutamente necessário, é altamente recomendável permitir a visualização da fidelidade da injeção em tempo real durante o procedimento. Ao mesmo tempo, se a concentração de corante for muito alta no medicamento candidato e na mistura de corante, isso pode fazer com que a agulha fique bloqueada no momento da injeção. Limitar o número de picadas de injeção por uma única agulha também é crítico neste método. Sugere-se não usar a mesma agulha para mais de 3-5 picadas nervosas (equivalente a 3 ratos por agulha) para evitar o embotamento da agulha. A reutilização da agulha (opcional) requer que ela seja esterilizada entre os animais, limpando-a três vezes com álcool a 70%.
Exemplos de estudos na literatura utilizando injeção direta do nervo vago são extremamente limitados, especialmente para roedores 5,6. Alguns estudos relataram DRG direto e outras injeções nervosas com modificações nos métodos e quantidade de volume a ser injetado em camundongos e ratos 1,2,9. O presente método é altamente significativo como uma abordagem para administrar os medicamentos candidatos ou outros agentes através do nervo vago para atingir aspectos do SNA. O nervo vago é o nervo craniano mais longo e inerva quase todos os órgãos viscerais para regular suas funções fisiológicas. Assim, a aplicação dessa abordagem tem importância presente e futura em estudos pré-clínicos, incluindo, mas não se limitando à terapia gênica usando ratos. Além disso, esse método pode ser extrapolado para outras injeções nervosas, como o nervo ciático, com modificações relativamente pequenas.
Em suma, o método de injeção direta do nervo vago é uma via potencial de administração de medicamentos para estudos de modelos de ratos relacionados ao SNA. Nossa experiência é que o procedimento em si não causa efeitos adversos a longo prazo, pois os animais que foram mantidos por mais de um ano após a injeção não desenvolveram complicações a longo prazo. No entanto, também envolve várias etapas críticas e exige práticas em cirurgia de roedores. Todos esses pontos críticos foram cautelosamente incluídos neste protocolo passo a passo detalhado no texto. Atenção específica é dada a vários pontos críticos: 1) separação do nervo vago da artéria carótida comum, 2) manter o nervo em uma posição estável durante e após a inserção da agulha no nervo vago durante todo o período de injeção e 3) uma entrega suave da mistura de corante da droga sem bloqueio da agulha. A prática cirúrgica extensiva é a melhor maneira de superar todos esses problemas cirúrgicos.
Divulgações
Os autores NR e XC não têm conflitos de interesse. RMB e SJG são inventores da propriedade intelectual relacionada à transferência de genes para o SNA por meio de injeções no nervo vago (patente dos Estados Unidos # 11.753.655). A SJG e a RMB receberam receita de royalties da Taysha Gene Therapies, e a SJG recebeu receita de consultoria da Taysha Gene Therapies.
Agradecimentos
Gostaríamos de agradecer ao UT Southwestern Animal Resource Center Facility por providenciar o espaço cirúrgico para ratos. O financiamento para este trabalho foi fornecido pelas seguintes fontes para o SJG: NIH / NINDS R01 NS087175, Hannah's Hope Fund e Taysha Gene Therapies.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL BD Tuberculin Syringe with Detachable 25 G x 5/8". Needle | Becton, Dickinson and Company | SKU:309626 | Used to connect with curved needle to pull the vagus nerve and hold it at the time of injection. |
| 0.5% Bupivacaine Hydrochloride Injection | Hospira | NDC 0409-1162-19 | Local anesthetics used to anesthetize local tissue. |
| 100 mL 0.9% Sodium Chloride Irrigation USP | Stericare Solutions | Item #6240 | Normal saline, used to rehydrate rat and tissue. |
| 20 Blunt, Retractor Tips, 7.5 mm | Kent Scientific Corporation | Surgi 5018 | Used to pull apart and hold tissues at the time of surgery. |
| 3 mL BD-Luer-Lok Syringe, Sterile, Single Use | Becton, Dickinson and Company | SKU # 309657 | Used to inject saline in rat and fill the saline into the Polythene tubing. |
| AK-Fluor10% | Akorn | NDC 17478-253-10 | Fluorescein dye visible within the nerve. Used to track injection fidelity. |
| Animal Weighing Scale | Kent Scientific Corporation | SCL 4000 | Used to measure body weight of rat. |
| Ansell ENCORE Perry Style 42 PF Surgical Gloves | Ansell | ASTM D3577 | Sterilie glove, it is used at the time of surgery by a surgeon. |
| Artificial Tears Ointment 3.5g | Pivetal | NDC 46066-753-55 | Used in eyses to prevent excessive dryness of eyes. |
| Baby-Myxter Hemostat | Fine Science Tools | 13013-14 | Used to stop bleeding in case of emergency. Also used to bend the 25 G x 5/8" in needle. |
| BD Intramedic PE Tubing | Becton, Dickinson and Company | 14-170-12A | Used in the injection set up system to connect with Hamilton needle and NanoFil Needles. It also holds the injection mixture. |
| BD Precison Glide Needle, 25 G x 5/8" | Becton, Dickinson and Company | REF#305122 | Used to inject saline in rat, and to make a curved needle. |
| BD Precison Glide Needle, 27 G x ½" | Becton, Dickinson and Company | REF#301629 | Used to fill sterile saline into the BD Intradermic tubing. |
| Benchmark Accuris ”NextPette” Variable Volume Pipette Micro Starter Setincludes 4 pipettes: 10/20/200/1000 μL, plus stand | MilliporeSigma | BMSP7700S1 | Used to pippette sterile solution. |
| Betadine, Povidine Iodine 10% | Honestmed | 67618015017 | Used to disinfect the surgical area. |
| Carprofen Injectable solution 50 mg/mL | Supplied by Covtrus (6451506845) | SKU 591149 | In our case, we used diluted carprofen at the dose rate of 5 mg/kg provided by the Animal Resource Center of University of Texas Southwestern Medical Center. |
| Curved needle (custom made) | Becton, Dickinson and Company | REF#305122 | BD PrecisionGlide 25 G x 5/8" in needle is curved to 90 degrees with the help of a hemostat. The tip of the needle is made blunt. It needs to be sterilized before use. It is used to hook the vagus nerve and hold it at the time of separation and injection. |
| Dissecting microscope | Motic | SMZ-171-BLED (Binocular with Lights) | Used to magnify the crifical anatomical area at the time of vagus nerve separation, injeciton, and to check injection leakage. |
| Drape sheet | Dynarex | Reorder#8122 | Used as drape after sterilization. |
| Dukal Cotton Tip Applicators, Non-Sterile | Dukal | Item 9003 | Used to blunt separation of tissue, needs to sterilize before use. |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | Used to separate the left vagus nerve from common carotid artery. It is curved so easy to use. |
| Ethicon PDS II Undyed Monofilament Suture - SUTURE, 4/0 18 PDS II CLR MONO PS | Ethicon | VA - Z682G | Used in suturing the wound. |
| Ethilon Nylon Suture Black Monofilament | Ethicon | 1856G | Used in suturing the wound if non-absorbale suture is used. Also used to hook the rat tooth to fix nose inside the nose cone. |
| Fine Forceps - Mirror Finish | Fine Science Tools | 11412-11 | Used at the time of vagus nerve separation from the common carotid artery. This is straight. |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | Ued to cut tissue. |
| Hamilton cleaning solution | Hamilton | HT18311 | Used to clean the Hamilton after use. |
| Hamilton Needle, 27G, Small Hub RN Needle, 2”, PT3, 6/PK | Hamilton | 7762-01 | Used to connect BD Intramedic™ PE Tubing. |
| Hamilton Syringe , 710RN | Hamilton | 7638-01 | Used to hold drug at the time of vagus nerve injection. |
| Insulin Syringe | EXEL INT, Comfort point | REF 26027 | Used to inject carprofen and local anesthetics. |
| Lidocaine 2% Injection | Covetrus | Reorder#002468 | Used to mix with Bupivacaine and inject at the site of incision. |
| Luxol Fast Blue MBSN | Acros Organics | 212170250 | Dye visible within the nerve, used to mix with drug so that injection mixture is visible. |
| Micro Bead Sterilizer with Glass Beads | Fine Science Tools | Item No. 18090-46 | Used to sterilize surgical tools in between the rat surgery. |
| NanoFil Needles-NF35BV-2 | World Precision Instrument | NC9708956 | Used to inject drug - dye mixture inside the vagus nerve. |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | Used in wound suturing. |
| Parafilm M Laboratory Wrapping Film, 4 Inches x 125 Feet, 1 Roll per Box, 12 Count | Honestmed | PM#996 | Used to hold the aliquoted 5 uL of drug-dye mixture so that loading of drug-dye mixture into the BDTM intradermic tubing is accurate. |
| PDI Alcohol Prep Pads | Honestmed | NDC 10819-3914-2 | Used to disinfect the surgical area. |
| Premium Care Sterile Type VII Gauze Sponges, 8-Ply, 2" x 2" | Dukal | Item C5119 | Used as cushon under the neck of rat at the time of surgery. |
| Press’n Seal Cling Film | Glad | Used to cover a rat at the time of surgery like a drape. | |
| Rat Retractor Set | Kent Scientific Corporation | Surgi 5002 | Used to keep the incision open so that it is easy to separate the vagus nerve from the carotid artery. |
| RightTemp Jr. | Kent Scientific Corporation | 20.3 cm W x 25.4 cm L (8 in W x 10 in L), used to keep rat warm. | |
| S&T Forceps - SuperGrip Tips | Fine Science Tools | 00632-11 | Used at the time of suturing to hold tissue without damage. |
| S&T Suture Tying Forceps | Fine Science Tools | 00272-13 | Used to tight the suture. |
| Scalpel blade #15 | Fine Science Tools | 10015-00 | Used to make an incision in the skin at the ventral side of neck. |
| Scalpel Handle-#7 | Fine Science Tools | 10007-12 | Used to hold the scalpel blade. |
| Syringe Pump | KD Scientific | 78-81-8052GL | Serial #D107034, Model#LEGATO-180, is a programmable pump that can pump small volume of mixture under a program. |
| TipOne Filter Tip Refill Starter Systems | USA Scientific | Item #1120-3510 | Used to pipette the drug and dye mixture. |
| Vaporizer for Isoflurane, Funnel Filled | Kent Scientific Corporation | Vetflow 1231 | Used to anesthetize rats. |
| Vetbond Tissue Adhesives | 3M Science Applied to Life | ID B00016067 | Used to seal tissue at the site of cut wound if suturing is not perfect. |
| Wahl BravMini+ Professional Cordless Clipper Kit | Kent Scientific Corporation | CL7300-Kit | Used to cut hair of rat. |
Referências
- Fischer, G., et al. Direct injection into the dorsal root ganglion: Technical, behavioral, and histological observations. J Neurosci Methods. 199 (1), 43-55 (2011).
- O'donnell, M., Fontaine, A., Caldwell, J., Weir, R. Direct dorsal root ganglia (drg) injection in mice for analysis of adeno-associated viral (AAV) gene transfer to peripheral somatosensory neurons. J Neurosci Methods. 411, 110268 (2024).
- Puljak, L., Kojundzic, S. L., Hogan, Q. H., Sapunar, D. Targeted delivery of pharmacological agents into rat dorsal root ganglion. J Neurosci Methods. 177 (2), 397-402 (2009).
- Rueter, L. E., Kohlhaas, K. L., Curzon, P., Surowy, C. S., Meyer, M. D. Peripheral and central sites of action for a-85380 in the spinal nerve ligation model of neuropathic pain. Pain. 103 (3), 269-276 (2003).
- Ulusoy, A., et al. Neuron-to-neuron alpha-synuclein propagation in vivo is independent of neuronal injury. Acta Neuropathol Commun. 3, 13 (2015).
- Helwig, M., et al. Brain propagation of transduced alpha-synuclein involves non-fibrillar protein species and is enhanced in alpha-synuclein null mice. Brain. 139 (Pt 3), 856-870 (2016).
- Chiang, B., et al. Development of a novel suprachoroidal-to-optic-nerve (scone) drug delivery system. Drug Deliv. 31 (1), 2379369 (2024).
- Ferrari, L. F., Cunha, F. Q., Parada, C. A., Ferreira, S. H. A novel technique to perform direct intraganglionar injections in rats. J Neurosci Methods. 159 (2), 236-243 (2007).
- Yuan, X. M., et al. Rapid injection of lumbar dorsal root ganglia under direct vision: Relevant anatomy, protocol, and behaviors. Front. Neurol. 14, 1138933 (2023).
- Mason, M. R., et al. Comparison of AAV serotypes for gene delivery to dorsal root ganglion neurons. Mol Ther. 18 (4), 715-724 (2010).
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Ertl, H. C. J. Immunogenicity and toxicity of AAV gene therapy. Front Immunol. 13, 975803 (2022).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados