Method Article
Protocollo di iniezione diretta del nervo vago per i ratti
In questo articolo
Riepilogo
Presentiamo un protocollo per l'iniezione diretta del nervo vago nei ratti, che consente la somministrazione del farmaco direttamente nel nervo senza complicazioni post-iniezione. Questo metodo si applica agli studi neurologici preclinici che coinvolgono la manipolazione del sistema nervoso autonomo. Può essere utilizzato per l'iniezione diretta di nervi per altri nervi nei ratti e in altre specie, con le modifiche necessarie.
Abstract
C'è una relativa abbondanza di strategie e metodologie per facilitare la somministrazione di farmaci al sistema nervoso centrale. Tuttavia, la somministrazione diretta di farmaci al sistema nervoso periferico è meno comune, con meno pubblicazioni dettagliate sui metodi disponibili per aiutare i ricercatori. Qui, descriviamo un metodo di iniezione diretta del nervo per la somministrazione di farmaci nel sistema nervoso periferico, utilizzando il nervo vago come nervo modello. Questo metodo può essere utilizzato nel trattamento dei disturbi del sistema nervoso autonomo attraverso il targeting del nervo vago sinistro, sebbene questo metodo di iniezione generale possa essere estrapolato all'iniezione di altri nervi con piccole modifiche. Questo metodo spiega tutte le fasi critiche coinvolte nella procedura che coinvolge la microchirurgia in ratti adulti anestetizzati sotto un microscopio da dissezione. L'uso di un colorante tracciante è descritto per facilitare il monitoraggio della fedeltà dell'iniezione in tempo reale. Vengono fornite illustrazioni di iniezioni riuscite e fallite. Se eseguite correttamente, le iniezioni dirette del nervo vago possono essere condotte in modo sicuro e ben tollerato dal ratto senza complicazioni post-parto. Ad esempio, una volta che i chirurghi sono stati formati su questo metodo, sei ratti su sei sono stati iniettati con successo senza complicazioni. Questo metodo di iniezione diretta del nervo per studi preclinici sui ratti è in grado di somministrare agenti (inclusa, a titolo esemplificativo ma non esaustivo, la terapia genica) ai nervi periferici.
Introduzione
L'applicazione del corretto metodo di somministrazione dei farmaci è uno dei fattori critici per ottenere risultati terapeutici di successo. Nonostante l'abbondanza di metodi per la somministrazione di agenti terapeutici al sistema nervoso centrale (SNC), solo pochi metodi sono riportati per la somministrazione di agenti terapeutici al sistema nervoso periferico (PNS) mediante iniezione diretta di nervo. L'iniezione diretta di nervi, come l'iniezione nei gangli della radice dorsale (DRG) nei ratti, è stata provata in studi preclinici per una migliore comprensione dei meccanismi del dolore, della tossicità dei farmaci, del trasferimento genico 1,2,3 e dello sviluppo di metodi generali 1,4. Ulteriori segnalazioni sull'iniezione diretta del nervo includono l'iniezione del nervo spinale4, l'iniezione del nervo sciatico1 e l'iniezione del nervo vago nei ratti5 e nei topi6. Recentemente è stato proposto un metodo per l'iniezione sopracondriale per una migliore distribuzione di terapie nella testa del nervo ottico nei conigli7.
Il DRG è considerato il luogo ideale per l'iniezione diretta di vettori caricati con transgeni come il virus adeno-associato (AAV) a causa della funzione sensoriale dei corpi cellulari nel DRG2. Sono stati descritti metodi chirurgici e non chirurgici di iniezioni di DRG 1,8. Tuttavia, sono state riscontrate conclusioni controverse sulla coerenza dei risultati con il metodo non chirurgico di iniezione DRG1. È stato suggerito che un metodo chirurgico che prevede una laminectomia parziale sia efficace al 100% per l'iniezione di DRG nei ratti senza alcuna alterazione degli esiti comportamentali3, così come un metodo che prevede l'osteotomia parziale nei topi9. Diversi studi riportano i metodi di iniezione DRG per la somministrazione di farmaci, che sono stati utilizzati nella ricerca preclinica sulla terapia genica nei ratti e nei topi 1,2,10. Gli studi di terapia genica basati su vettori che coinvolgono iniezioni localizzate possono includere i seguenti benefici: diminuzione dell'espressione off-target, riduzione della tossicità sistemica e minori cariche virali e volumi di iniezione, diminuzione del rischio di complicanze immunogeniche11,12.
Il metodo dell'iniezione diretta nel nervo sciatico, il nervo più lungo del corpo, è stato provato esponendo il nervo sciatico destro a metà coscia di un ratto. Il metodo ha utilizzato una pipetta di vetro tirata dotata di un sistema di iniezione controllato da microprocessore per iniettare un volume totale di 10 μl di colorante con una portata di 1,2 μl/min1. Questo esperimento ha mostrato una mancanza di distribuzione del colorante al livello di DRG e la distribuzione era per lo più limitata intorno al sito di iniezione. Allo stesso modo, altri metodi di iniezioni nervose dirette, come le iniezioni del nervo spinale, sono stati provati con il colorante per valutare la quantità appropriata di volume di iniezione e il modello di distribuzione del colorante nei ratti. Si ritiene che 2 μL siano ottimali per l'iniezione del nervo spinale, mentre 3 μL di colorante mediante iniezione DRG hanno mostrato la distribuzione sia nei gangli della radice dorsale che in quelli ventrali nei ratti1. È stato riportato che il volume per l'iniezione di DRG nei topi è ottimale da 1,0 μL a 1,5 μL in base al ceppo e alle dimensioni corporee 2,9.
Il metodo di iniezione diretta del nervo vago è stato utilizzato nei ratti5 e nei topi6 per valutare il ruolo del danno neurale o dell'integrità cellulare nel trasferimento della α-sinucleina umana. Questi due studi, condotti dallo stesso gruppo di ricercatori, descrivono un breve metodo per iniettare direttamente vettori AAV nel nervo vago sinistro nella regione cervicale. Nei ratti, il metodo prevedeva un capillare di vetro con un diametro della punta di 60 μm per iniettare 2 μL di vettore a una velocità di flusso di 0,5 μL/min con una siringa Hamilton da 5 μL. Nei topi, un volume totale di soluzione vettoriale da 750 nL è stato iniettato a una velocità di flusso di 160 nL/min utilizzando un ago in acciaio smussato da 36 G montato su una siringa NanoFil da 10 μL6. Questi esperimenti hanno dimostrato che il transgene è stato consegnato ed espresso negli assoni nel ponte e nel mesencefalo dei ratti e dei topi. Allo stesso modo, il nucleo motorio dorsale del nervo vago sinistro ha mostrato un'immunoreazione positiva con il transgene. Queste prove illustrano che il metodo di iniezione diretta del nervo vago potrebbe essere un metodo affidabile nella terapia genica in cui la trasduzione cellulare è estesa in diverse posizioni del cervello, che proiettano assoni attraverso il nervo vago. Tuttavia, questi metodi non menzionano l'uso di alcun colorante per monitorare la fedeltà dell'iniezione.
Qui, viene descritto un metodo per l'iniezione diretta nel nervo vago sinistro utilizzando coloranti di tracciamento non tossici ampiamente applicabili ai ricercatori negli studi preclinici. Vengono discusse le potenziali insidie che possono causare difficoltà nella somministrazione dei farmaci e i modi per superarle. Queste situazioni sono illustrate con immagini per mostrare cosa rende la consegna non riuscita e il modo per renderla di successo.
Protocollo
Il seguente protocollo è condotto in conformità con le linee guida etiche istituzionali e l'approvazione del Comitato Istituzionale per la Cura e l'Uso degli Animali (IACUC).
1. Preparazione dell'alloggio
NOTA: Questo protocollo è per ratti adulti di almeno 2 mesi. Gli animali più piccoli (compresi i topi e i ratti più giovani) sono possibili, ma non sono raccomandati e saranno considerevolmente più difficili.
- Fornire cibo umido o qualsiasi altro cibo morbido (gel di recupero veterinario) per 48 ore prima dell'intervento chirurgico al nervo vago. Poiché gli animali possono avere difficoltà a mangiare dopo la procedura, introduci questi elementi agli animali prima dell'intervento chirurgico per aiutarli a familiarizzare con il gusto di questi elementi e indurre la motivazione alimentare.
- Ospita i ratti individualmente in una gabbia almeno 1 settimana prima dell'intervento chirurgico e 1 settimana dopo l'intervento. Ciò consentirà loro di acclimatarsi allo stress di essere soli e prevenire il graffio delle ferite dopo l'intervento chirurgico da parte di un compagno di cucciolata.
2. Preparazione degli articoli chirurgici e dello spazio
- Fai un elenco di tutti gli elementi necessari in anticipo e ricontrolla che tutti gli articoli siano disponibili per l'intervento.
- Sterilizzare tutti gli articoli con metodi di sterilizzazione appropriati prima dell'intervento chirurgico.
- Allestire lo spazio chirurgico sterile sotto il microscopio da dissezione. Posiziona un termoforo sotto il microscopio per mantenere il ratto al caldo durante l'intervento chirurgico.
- Posizionare tutto il materiale chirurgico su un tavolo operatorio su un telo sterile. Mantenere uno spazio sufficiente per l'intervento chirurgico sotto il microscopio da dissezione. Assicurati che la messa a fuoco del microscopio sia ottimale e che abbracci l'area chirurgica per visualizzare il nervo.
- Posizionare la pompa a siringa vicino alla fase chirurgica in modo che la lunghezza del tubo sia sufficiente per raggiungere il sito di iniezione.
- Posizionare gli strumenti chirurgici verso il lato della mano dominante del chirurgo.
3. Preparazione di una miscela del farmaco candidato e del colorante di tracciamento
- Assicurarsi che il farmaco candidato sia diluito per raggiungere la concentrazione richiesta nel diluente raccomandato in modo tale che 5 μL di farmaco miscelato con colorante diano la quantità richiesta del farmaco candidato da erogare. Si raccomanda che il volume massimo di iniezione con il metodo del nervo vago diretto sia di 5 μl (compreso il colorante tracciante, vedere punto 3.2).
- Miscelare un colorante compatibile con il farmaco candidato per consentire il monitoraggio della fedeltà dell'iniezione in tempo reale. Ad esempio, una concentrazione finale dell'1% di Luxol Fast Blue o dello 0,002% di fluoresceina sono coloranti compatibili da utilizzare.
ATTENZIONE: Utilizzare il colorante alla sua concentrazione ottimale nella miscela di colorante e farmaco candidato. Quando la concentrazione di colorante nella miscela è troppo bassa, potrebbe non essere visibile per tracciare l'iniezione. Quando la concentrazione di colorante è troppo alta, può risultare in una miscela troppo densa e con un'elevata viscosità, che bloccherà l'ago di iniezione.
4. Caricamento del farmaco candidato e della miscela di colorante nel tubo
- Collegare una siringa di vetro da 100 μl con lo stantuffo rimosso a un ago da 27 G.
- Collegare un'estremità di circa 45 cm di tubo in polietilene sterilizzato all'ago da 27 G.
- Prendi una siringa di plastica da 3 ml e inseriscila con un ago da 27 G. Caricare la siringa con circa 0,5 mL di soluzione fisiologica allo 0,9%.
- Riempire il tubo di polietilene con la soluzione fisiologica normale allo 0,9% dall'estremità aperta per riempire l'intera lunghezza del tubo e l'intero fusto della siringa di vetro fino a quando non trabocca.
NOTA: È fondamentale evitare che le bolle d'aria rimangano intrappolate all'interno del tubo. - Rimuovere ed eliminare la siringa da 3 ml e l'ago.
- Inserire lo stantuffo della siringa nel cilindro della siringa di vetro e spingerlo leggermente in avanti fino al centro del cilindro.
- Posizionare la siringa di vetro nella pompa a siringa.
- Tirare leggermente indietro lo stantuffo utilizzando la pompa a siringa per creare uno spazio d'aria di circa 1,5 cm all'estremità aperta nella lunghezza del tubo.
- Pipettare almeno 5 μl di miscela di colorante e farmaco candidato con una micropipetta da 10 μl e farla cadere su un pezzo di parafilm sterilizzato.
- Estrarre la miscela di farmaco candidato nel tubo tirando indietro lo stantuffo tramite la pompa a siringa. Mantenere la bolla d'aria tra la soluzione salina allo 0,9% e la soluzione iniettabile, ma in caso contrario, evitare di intrappolare bolle d'aria all'interno della soluzione iniettabile. Contrassegnare il livello della miscela iniettabile nel tubo con un pennarello.
NOTA: Il traferro tra la miscela di colorante farmacologico candidato e la soluzione salina sterile all'interno del tubo è fondamentale per evitare la miscelazione delle due soluzioni. - Montare l'ago da 35 G con il tubo. Fissare l'ago sulla superficie pulita del tavolino chirurgico con del nastro adesivo in modo che l'ago non sia allentato, non si muova e tocchi nient'altro e rimanga sterilizzato.
5. Adescamento dell'ago per iniezione
- Impostare il programma della pompa a siringa per erogare 0,5 μl/min.
- Avviare la pompa a siringa per circa 10-15 s, fino a quando la soluzione iniettabile inizia a fuoriuscire dalla punta dell'ago. Una piccola quantità di miscela sulla punta dell'ago senza perdite all'articolazione del tubo e dell'ago per iniezione (o in qualsiasi altro punto lungo la lunghezza della siringa, del tubo o dell'ago) indica che la configurazione è corretta.
NOTA: Se non si vede una minuscola gocciolina sulla punta dell'ago, ciò indica un blocco dell'ago. L'ostruzione dell'ago può verificarsi a causa dell'elevata viscosità del farmaco candidato e della miscela di colorante, dell'aria in eccesso intrappolata all'interno del sistema e della siringa di vetro non posizionata correttamente all'interno della pompa a siringa. Vedere la Figura 1 per un esempio di perdita alla giunzione tra l'ago e il tubo. L'adescamento è fondamentale perché aiuta a identificare se l'ago non è ostruito e l'iniezione all'interno del nervo passerebbe senza intoppi.
6. Preparazione del ratto per l'intervento chirurgico
- Ottenere il peso corporeo del ratto per calcolare la dose necessaria di analgesici. Ad esempio, il carprofene viene utilizzato alla dose di 5 mg/kg per via sottocutanea nei ratti.
NOTA: Si consiglia di conservare il carprofene a 4 °C prima dell'iniezione. - Anestetizzare il ratto con un vaporizzatore di isoflurano utilizzando una velocità di flusso del 3%-4% per l'induzione dell'anestesia per circa 2-3 minuti. Ridurre la velocità di flusso dell'isoflurano a circa l'1,75%-2% per il mantenimento dell'anestesia.
- Trasferisci il ratto su un tavolo separato con una configurazione per la depilazione e la preparazione del sito. Assicurarsi che questo tavolo sia vicino allo spazio chirurgico.
- Applicare un unguento lacrimante artificiale in entrambi gli occhi del ratto per prevenire un'eccessiva secchezza.
- Somministrare analgesici secondo il protocollo istituzionale approvato sugli animali per controllare il dolore quando il ratto torna in coscienza.
- Radere l'area chirurgica con un tagliacapelli sul lato ventrale del collo nella regione cervicale. Radere fino a circa 2 cm di distanza perpendicolare dalla linea mediana su entrambi i lati dal mento allo sterno.
- Sterilizzare l'area con alcol etilico al 70% e betadina al 10%, strofinando l'area tre volte alternativamente con un tampone imbevuto di alcol e iodio povidone. Strofinare dal centro dell'area verso l'esterno con uno schema circolare.
- Trasferire il ratto allo stadio chirurgico al microscopio in posizione supina. Regolare la messa a fuoco del microscopio per visualizzare l'area dell'intervento chirurgico nella regione cervicale.
7. Esecuzione di un intervento chirurgico nel ratto per iniettare il farmaco candidato direttamente nel nervo vago sinistro (Figura 2, Figura 3 e Figura 4)
NOTA: Questa parte del metodo richiederà una seconda persona per assistere il chirurgo.
- Posizionare il ratto su un termoforo in posizione supina sotto il microscopio da dissezione associato a una luce montata.
- Agganciare i denti anteriori della mascella superiore del ratto con un pezzo di sutura non assorbibile e fissare l'estremità aperta della sutura all'interno del cono del naso in modo che la narice del ratto sia sempre all'interno del cono del naso durante l'anestesia.
- Posiziona il ratto in modo che la sua testa si trovi sul lato sinistro del chirurgo destrorso (o sul lato destro di un chirurgo mancino). In questa posizione, il lato anteriore del chirurgo è perpendicolare al corpo del ratto. Posizionare un cuscino di calibro sterilizzato sotto il collo e regolare l'angolo della regione cervicale del ratto in modo che la regione cervicale diventi diritta. In questo modo sarà più facile localizzare il nervo vago sinistro ed eseguire l'iniezione.
- Avvolgere l'intero corpo del ratto con un telo sterilizzato, mantenendo aperto lo spazio chirurgico.
- Fissare singolarmente quattro perni divaricatori con 4 fissatori magnetici con elastomeri e posizionare i fissatori ai quattro angoli della fase chirurgica.
- Iniettare anestetici locali per via epidermica sulla linea mediana della regione cervicale in cui viene praticata l'incisione. Ad esempio, di solito viene utilizzata una miscela di lidocaina e bupivacaina.
- Praticare un'incisione cutanea longitudinale lunga circa 2 cm sulla linea mediana tra il mento e lo sterno con una lama di bisturi nel lato ventrale del collo nella regione cervicale (Figura 3A).
- Separare smussate i bordi tagliati della pelle con punte di cotone sterilizzate.
- Ritrarre i bordi della pelle in direzioni opposte rispetto al sito dell'incisione con l'aiuto delle punte dei divaricatori.
- Separa la plancia con punte di cotone per andare più in profondità. Spingere le ghiandole salivari verso il lato laterale.
- Separare i muscoli sternomastoidei con punte di cotone e ritrarli con gli spilli. Man mano che la separazione del muscolo sternomastoideo avanza, la trachea appare al centro, ricoperta di muscolo sternoioideo (Figura 3B).
NOTA: Fare attenzione a non esercitare pressione sulla trachea. - Far avanzare la separazione dei tessuti sul lato sinistro della trachea del ratto fino a quando appare la guaina carotidea, che contiene l'arteria carotide comune che corre insieme al nervo vago sinistro.
- Praticare con cura un piccolo foro appuntito nella guaina carotidea con una pinza fine, prestando attenzione a non ferire l'arteria carotide al microscopio. Separare il nervo vago sinistro dall'arteria carotide comune con una pinza fine.
NOTA: L'area chirurgica è anatomicamente critica. La parete dell'arteria carotide è spessa, scivolosa e non si ferisce facilmente, ma la punta affilata della pinza sottile può ferirla e può verificarsi sanguinamento. Allo stesso tempo, prestare attenzione per non ferire il nervo. - Una volta che il nervo è stato separato dall'arteria con il forcipe, utilizzare un ago curvo da 25 G montato su una siringa da 1 ml da quel foro per "agganciare" e tenere il nervo per la mano non dominante (Figura 4A).
NOTA: La punta dell'ago curvo è smussata in modo da non ferire il nervo e l'arteria. L'angolo di curvatura della punta dell'ago è realizzato su misura a circa 90° utilizzando un emostatico (Figura 2). - Con la mano dominante, tenere l'ago caricato con la miscela di colorante farmacologico candidato e pungere delicatamente il nervo nella stessa direzione in cui scorre il nervo in modo che lo smusso dell'ago sia rivolto verso l'alto.
- Per una puntura facile, mantieni il nervo dritto tirando delicatamente con l'uncinetto da 25 G. Inserire l'ago nel nervo e avanzare in avanti, di oltre 0,5 cm, mantenendo l'ago parallelo al nervo vago. Quindi, tirare leggermente indietro in modo che l'ago rimanga all'interno del nervo circa 0,4-0,5 cm.
NOTA: L'angolo dell'ago deve essere sufficientemente basso da penetrare all'interno del nervo senza passare dall'altra parte.
- Per una puntura facile, mantieni il nervo dritto tirando delicatamente con l'uncinetto da 25 G. Inserire l'ago nel nervo e avanzare in avanti, di oltre 0,5 cm, mantenendo l'ago parallelo al nervo vago. Quindi, tirare leggermente indietro in modo che l'ago rimanga all'interno del nervo circa 0,4-0,5 cm.
- Potrebbero esserci occasioni in cui l'ago non è ostruito all'esterno del nervo al momento dell'adescamento, ma la miscela di colorante candidato non passa uniformemente all'interno del nervo. Per evitare questa situazione, limitare il numero di punture nervose con un singolo ago non più di 3 volte. Se l'ago si smussa, le possibilità di blocco o comunque di iniezione scadente aumenteranno.
- Assicurati che l'ago sia completamente all'interno del nervo. Mantenere la posizione immobile e accendere la pompa a siringa.
NOTA: Controllare attentamente nel sito di iniezione per vedere che la miscela di colorante farmaco-farmaco candidato non rifluisca dal nervo. - Mentre l'iniezione procede, esaminare costantemente che l'infusione rimanga all'interno del nervo e scorra senza intoppi. Utilizzare il segno apposto sul tubo di infusione per monitorare il movimento della miscela di colorante dal punto di partenza.
- Se la miscela farmaco-colorante candidato non scorre senza intoppi, estrarre l'ago e ripetere il passaggio di adescamento (passaggio 5.2). Quindi reinserire l'ago nel nervo e riprendere l'infusione.
- Il nervo inizia a sviluppare il colore del colorante (Figura 4B). Continuare l'infusione a 0,5 μl/min per 10 minuti per infondere tutti i 5 μl della miscela farmaco-colorante candidata.
NOTA: Si consiglia di irrigare i tessuti esposti con una piccola quantità di soluzione salina sterile calda allo 0,9%, se necessario, per evitare secchezza e danni eccessivi. - Dopo che i 5 μl sono stati infusi e la pompa a siringa si è fermata, mantenere l'ago in posizione per un ulteriore 1 minuto per consentire a tutta la miscela di colorante candidato di diffondersi dal sito di iniezione. Rimuovere l'ago.
- Rimuovere l'ago curvo da 25 G. Usa punte di cotone sterili per riportare delicatamente i fazzoletti nella loro posizione originale. Rimuovere le punte del divaricatore.
- Chiudere la ferita con una sutura non assorbibile (può essere utilizzata anche una sutura riassorbibile). Applicare una piccola quantità di colla per tessuti tra i punti, se necessario, per chiudere perfettamente la ferita.
8. Cura post-operatoria di un ratto
- Infondere circa 3 ml di soluzione fisiologica calda allo 0,9% per via sottocutanea dopo che la ferita è stata chiusa. Questo aiuta i ratti a reidratarsi immediatamente.
- Metti il ratto in una fonte di calore fino a quando non si riprende completamente dall'anestesia alla condizione normale. Notare tutto ciò che è stato osservato che è anormale durante il processo di recupero.
NOTA: la durata del recupero può essere più lunga se la procedura di iniezione nervosa richiede molto tempo. - Trasferisci il topo nella sua gabbia domestica con cibo umido sul pavimento della gabbia. Assicurati che l'acqua sia sempre disponibile. Osservare il ratto dopo l'intervento per circa 2 ore per assicurarsi che non senta freddo.
NOTA: Metti il topo in una fonte di calore per altre ore se sente freddo. - Monitorare il ratto a 12 ore, 24 ore, 36 ore, 48 ore e 72 ore dopo l'intervento chirurgico con note scritte di osservazioni. Ripetere gli analgesici secondo il protocollo istituzionale approvato per gli animali per controllare il dolore. Ad esempio, il carprofene viene dosato al ritmo di 5 mg/kg per via sottocutanea due volte a intervalli di 24 ore. Consultare un veterinario se il dolore rimane nel ratto per più di 48 ore.
- Ripetere l'iniezione sottocutanea di circa 3 mL di soluzione salina calda allo 0,9% a 24 ore in base alle condizioni del ratto.
- Continuare a valutare la ferita. Assicurati che la ferita sia asciutta e sia in fase di guarigione.
NOTA: Arrossamento, gonfiore e condizione dolorosa della ferita con inattività e ottusità del ratto possono essere un'indicazione di infiammazione della ferita e possono giustificare un'ulteriore consultazione veterinaria. Un ratto con dolore mostrerà la schiena curva, il pelo arruffato, gli occhi rossi e una condizione di inattività. Di solito si trova in un angolo della gabbia. - Rimuovere le suture non assorbibili entro 2 settimane una volta che la ferita è guarita.
Risultati
Nel presente studio sono stati utilizzati sei ratti adulti (3 maschi e 3 femmine). Su sei, un ratto è stato iniettato più volte per dimostrare una condizione di fallimento dell'iniezione che mostra una diffusione del colorante intorno al sito di iniezione Figura 5A. Tutti gli altri ratti hanno mostrato un'iniezione liscia e una colorazione nervosa, come mostrato nella Figura 4B e nella Figura 5B.
La Figura 1 mostra una situazione in cui si è verificata una perdita di colorante tra l'ago e il tubo quando l'impostazione dell'ago di iniezione con il tubo non è corretta. Il colorante all'1% utilizzato in questo esperimento non è troppo denso, ma il passaggio del colorante attraverso l'ago di iniezione non è riuscito a causa di una tenuta che perde. Questo tipo di problema può essere facilmente identificato nel processo di adescamento (vedere il passaggio 5.2). Per risolvere questa condizione, verificare che il collegamento tra l'ago e il tubo sia effettuato correttamente. Assicurarsi che circa 3 mm di ago siano stati inseriti nel tubo e assicurarsi che le dimensioni del tubo e dell'ago siano corrette. Ripetere l'adescamento dopo che il collegamento difettoso è stato corretto, soprattutto se vengono introdotte bolle d'aria (ripetere il passaggio 5.2).
La Figura 2 mostra una configurazione di un ago curvo e smussato da 25 G montato su una siringa di plastica da 1 mL. La punta dell'ago è smussata e piegata a un angolo di circa 90° da un portaaghi. Viene sterilizzato prima dell'uso e montato sulla siringa sterilizzata da 1 ml al momento dell'intervento chirurgico. Questo ago montato su una siringa viene utilizzato per separare il nervo vago sinistro dall'arteria carotide comune, come descritto al punto 7.14, agganciarlo e tenerlo premuto al momento dell'iniezione, come mostrato nella Figura 4A.
La Figura 3 mostra l'impostazione di una procedura asettica di incisione della linea mediana con una lama di bisturi nella regione ventrale del collo di un ratto per tagliare lo strato cutaneo. Dopo che il ratto è stato coperto con un telo sterilizzato, viene praticata un'incisione orizzontale lunga circa 2 cm per tagliare lo strato di pelle, Figura 3A. Una volta tagliata la pelle, i due bordi della pelle tagliata vengono tirati ai lati opposti con l'aiuto di perni collegati con elastomeri. La trazione dei bordi tagliati sul lato opposto crea uno spazio più ampio per andare più in profondità. Lo strato di plancia sotto la pelle e i muscoli sternomastoidei sono separati senza mezzi termini da punte di cotone sterilizzate, come mostrato nella Figura 3B. Una volta che il nervo vago sinistro appare sul lato sinistro della trachea all'interno della guaina carotidea comune, come descritto nel passaggio 7.12, viene separato da una pinza sottile e uncinato come nella Figura 4A.
La Figura 4 mostra una situazione di separazione del nervo vago sinistro dall'arteria carotide comune e la sua tenuta pronta per l'iniezione. Il chirurgo tiene l'ago per iniezione con la mano dominante (mano destra) e l'altra mano (sinistra) tiene il nervo vago sinistro del ratto con l'aiuto di un ago curvo montato su una siringa da 1 ml, Figura 4A. Il nervo vago sinistro è ben separato dall'arteria carotide comune e allungato abbastanza da poter essere iniettato in essa. Il rettangolo tratteggiato sul lato destro del nervo mostra l'area della trachea ricoperta dal muscolo sternoioide. La Figura 4B mostra il nervo vago sinistro colorato con il colore del colorante blu dopo un'iniezione riuscita senza diffusione del colorante. Il rettangolo tratteggiato bianco è l'area della trachea. La Figura 4B è allungata più della Figura 4A per mostrare un'immagine chiara del nervo e dei suoi dintorni dopo l'iniezione.
La Figura 5 mostra esempi di iniezioni fallite e riuscite nel nervo vago sinistro di un ratto. Queste iniezioni hanno utilizzato 5 μl di colorante all'1% a una velocità di flusso di 0,5 μl/min nel nervo. La Figura 5A mostra una condizione di fallimento dell'iniezione perché il colorante non è limitato solo all'interno del nervo (vedi riquadro). Piuttosto, il colorante si è diffuso in tutta l'area intorno al nervo. Inoltre, il sito di iniezione effettivo nel nervo non è chiaro. Ciò suggerisce che l'iniezione non era all'interno del nervo e che una quantità significativa di volume di iniezione è fuoriuscita e si è diffusa nell'area circostante.
Una situazione simile può essere osservata in condizioni in cui l'ago deve essere reinserito o riposizionato nel nervo. Questo può essere necessario quando l'ago si intasa e non passa la miscela o se l'ago si smussa e non può passare facilmente nel nervo. Nell'esempio mostrato nella Figura 5A, la piccola quantità di sangue accumulata nell'area mostra la rottura accidentale di minuscoli vasi sanguigni nell'area. Ciò accade quando i vasi sanguigni nell'area vengono danneggiati durante la separazione dei nervi.
La Figura 5B mostra un'iniezione riuscita nel nervo. Mostra un chiaro punto di iniezione e un nervo ben colorato, distinto dall'area circostante. Una minuscola area di colorazione al di fuori del nervo è dovuta a una piccola quantità di soluzione colorante sulla punta dell'ago che è presente dopo l'adescamento (vedi riquadro). L'adescamento viene eseguito per testare l'ostruzione dell'ago appena prima di pungere il nervo.

Figura 1: Perdita di colorante (freccia) a causa di una guarnizione difettosa tra l'ago e il tubo. Questo tipo di errore si verifica se il tubo non è montato correttamente con la punta dell'ago. Per evitare questo tipo di perdite, circa 3 mm o più della punta dell'ago vengono inseriti nel tubo e vengono utilizzati la dimensione corretta dell'ago e del tubo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Un ago smussato da 25 G curvato su misura con un angolo di circa 90° e montato su una siringa di plastica da 1 mL. Clicca qui per visualizzare una versione più grande di questa figura.
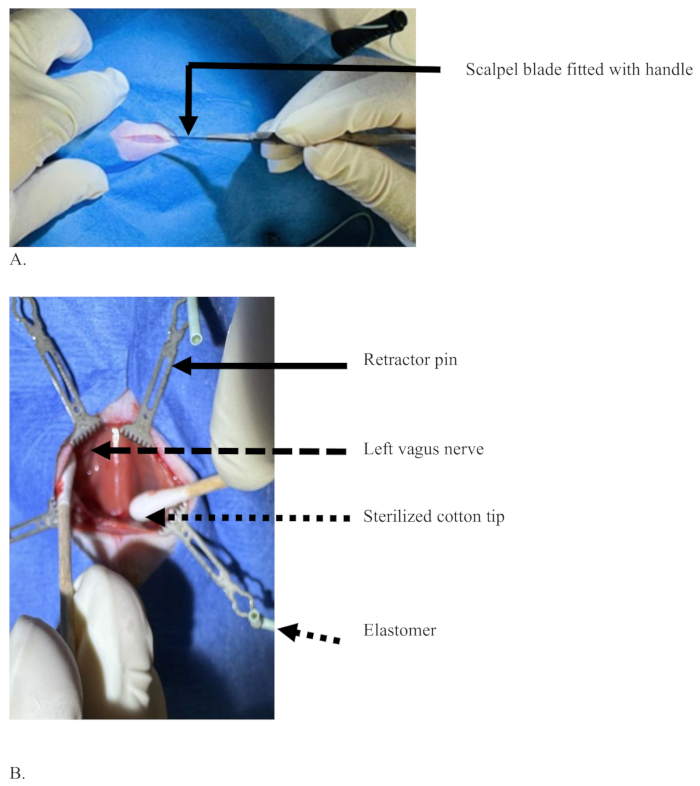
Figura 3: Un'incisione sulla linea mediana con una lama di bisturi nella regione ventrale del collo di un ratto per tagliare lo strato cutaneo. (A) Un'incisione con solo la pelle tagliata ma senza sangue, e una lama di bisturi con un manico tenuto con la mano dominante del chirurgo. (B) Le punte di cotone sterilizzato (freccia tratteggiata) che separano i tessuti per esporre il nervo vago sinistro (freccia tratteggiata), tessuti separati con l'aiuto di spilli (freccia solida) supportati da elastomero (freccia tratteggiata corta). Clicca qui per visualizzare una versione più grande di questa figura.
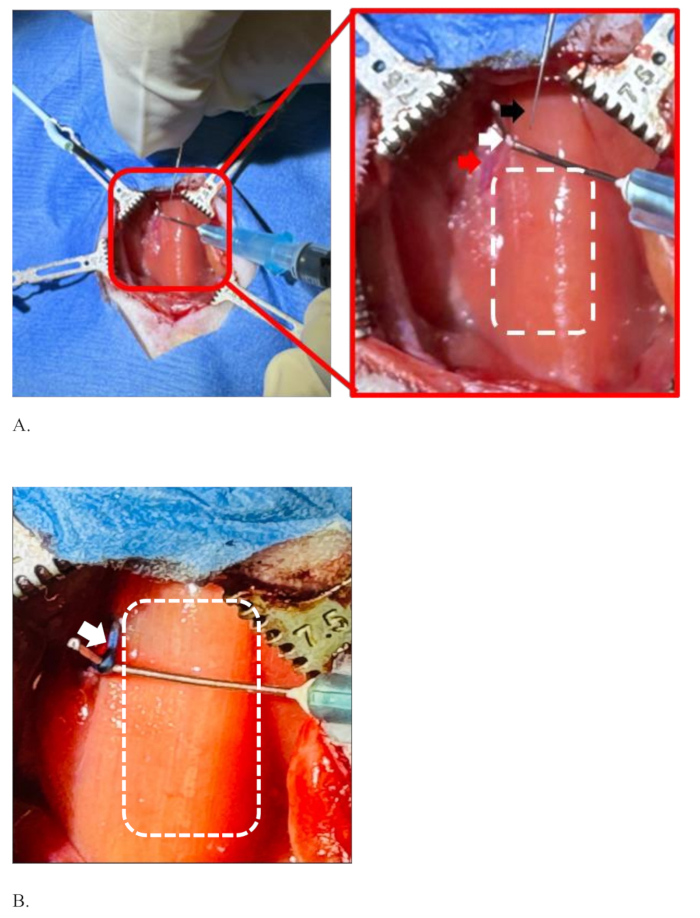
Figura 4: Illustrazione della separazione del nervo vago sinistro dall'arteria carotide comune, trattenendolo prima e dopo l'iniezione. (A) L'ago per iniezione (freccia nera), il nervo vago sinistro (freccia bianca), l'arteria carotide comune (freccia rossa) e il rettangolo tratteggiato che mostra l'area della trachea ricoperta dal muscolo sternoioide. (B) Il nervo vago sinistro di colore blu, il colore del colorante dopo un'iniezione riuscita senza diffusione del colorante (freccia bianca) e l'area della trachea (rettangolo tratteggiato). Clicca qui per visualizzare una versione più grande di questa figura.
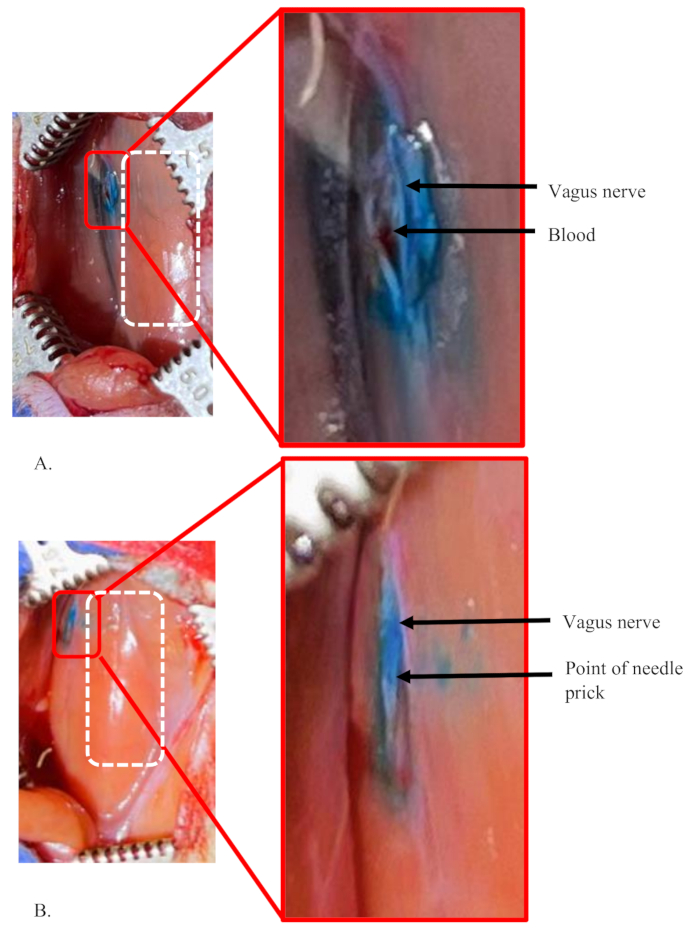
Figura 5: Esempi di un'iniezione fallita e di un'iniezione riuscita nel nervo vago sinistro di un ratto. (A,B) 5 μL di colorante all'1% di concentrazione sono stati iniettati nel nervo vago sinistro di ratti. Il rettangolo tratteggiato bianco mostra l'area della trachea in entrambi i pannelli. (A) Una condizione di guasto che mostra il colorante non è limitata solo all'interno del nervo, suggerendo una quantità significativa di perdita di soluzione colorante durante la procedura. La piccola quantità di sangue accumulata nell'area mostra una rottura accidentale di un minuscolo vaso sanguigno nell'area, che è stato danneggiato durante la separazione dei nervi. (B) Un'iniezione riuscita nel nervo. Mostra un chiaro punto di iniezione singola e un nervo ben colorato, distinto dall'area circostante. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo per l'iniezione diretta nel nervo vago sinistro può essere eseguito in modo sicuro e senza complicazioni post-operatorie nei ratti. La somministrazione di farmaci al nervo vago può essere utilizzata per colpire il sistema nervoso autonomo (ANS). Ciò comporta alcuni passaggi critici che richiedono pratica e un grado di abilità chirurgica da moderato ad alto.
Questa procedura chirurgica richiede un'anestesia generale equilibrata nei ratti. Il chirurgo mira a terminare l'intervento in una durata più breve per limitare l'esposizione agli anestetici per un migliore recupero, soprattutto nei ratti anziani. Questo metodo presuppone anche un chirurgo qualificato con un certo livello di competenze chirurgiche asettiche per rendere l'iniezione e il recupero post-operatorio di successo. La posizione anatomica del nervo vago è profondamente radicata in una posizione critica13. Il nervo vago sinistro corre fianco a fianco con l'arteria carotide comune sinistra, il che rappresenta un rischio di lesione sia per l'arteria che per il nervo al momento della separazione e dell'iniezione. È necessario un alto grado di pratica e abilità per separare correttamente il nervo dall'arteria carotide comune. Dovrebbe essere tenuto all'angolazione appropriata durante la procedura mantenendo l'ago all'interno del nervo.
Sebbene esistano solo due esempi pubblicati di procedure dirette del nervo vago nei ratti5 e nei topi6 dallo stesso gruppo di ricercatori, entrambi gli studi mancano di una descrizione dettagliata di come condurre la procedura. L'uso di un ago da 35 G per iniettare il nervo è stato conveniente (cioè, non è stata necessaria alcuna attrezzatura speciale per preparare gli aghi) e i risultati sono rimasti coerenti rispetto all'utilizzo della micropipetta di vetro tirata utilizzata dall'altro gruppo. Rispetto alle iniezioni in altri nervi, come il nervo sciatico, il nervo vago è di dimensioni relativamente più piccole e può contenere solo un volume minore di miscela di colorante alla volta. In uno studio pubblicato che ha iniettato una soluzione di colorante da 10 μl nel nervo sciatico, la diffusione del colorante ha raggiunto una lunghezza totale di 2,3 cm all'interno del nervo dal sito di iniezione senza raggiungere il DRG1. Il nervo vago può assorbire fino a 5 μL di volume di miscela di coloranti in modo sicuro utilizzando questo protocollo di iniezione.
Questa iniezione richiede un microscopio da dissezione. Sebbene l'uso di un colorante nella soluzione di iniezione non sia assolutamente necessario, si consiglia vivamente di consentire la visualizzazione della fedeltà dell'iniezione in tempo reale durante la procedura. Allo stesso tempo, se la concentrazione di colorante è troppo alta nella miscela di farmaco e colorante candidato, può causare il blocco dell'ago al momento dell'iniezione. Anche limitare il numero di punture di iniezione con un singolo ago è fondamentale in questo metodo. Si consiglia di non utilizzare lo stesso ago per più di 3-5 punture nervose (equivalenti a 3 ratti per ago) per evitare l'ottundimento dell'ago. Il riutilizzo dell'ago (opzionale) richiede la sterilizzazione tra gli animali strofinandolo tre volte con alcol al 70%.
Gli esempi di studi in letteratura che utilizzano l'iniezione diretta del nervo vago sono estremamente limitati, soprattutto per i roditori 5,6. Alcuni studi hanno riportato DRG diretto e altre iniezioni nervose con modifiche nei metodi e nella quantità di volume da iniettare in topi e ratti 1,2,9. Il presente metodo è molto significativo come approccio per somministrare i farmaci candidati o altri agenti attraverso il nervo vago per colpire gli aspetti del SNA. Il nervo vago è il nervo cranico più lungo e innerva quasi tutti gli organi viscerali per regolarne le funzioni fisiologiche. Pertanto, l'applicazione di questo approccio ha un'importanza presente e futura negli studi preclinici, inclusa ma non limitata alla terapia genica con ratti. Inoltre, questo metodo può essere estrapolato ad altre iniezioni nervose, come il nervo sciatico, con modifiche relativamente minori.
In breve, il metodo di iniezione diretta del nervo vago è una potenziale via di somministrazione di farmaci per gli studi su modelli di ratto correlati all'ANS. La nostra esperienza è che la procedura in sé non causa effetti avversi a lungo termine, poiché gli animali che sono stati mantenuti oltre un anno dopo l'iniezione non hanno sviluppato alcuna complicanza a lungo termine. Tuttavia, comporta anche diversi passaggi critici e richiede pratiche nella chirurgia dei roditori. Tutti questi punti critici sono stati cautamente inclusi in questo dettagliato protocollo passo dopo passo nel testo. Particolare attenzione è rivolta a diversi punti critici: 1) separazione del nervo vago dall'arteria carotide comune, 2) mantenimento del nervo in una posizione stabile al momento e dopo l'inserimento dell'ago all'interno del nervo vago per tutto il periodo di iniezione e 3) erogazione regolare della miscela di farmaco e colorante senza blocco dell'ago. Un'ampia pratica chirurgica è il modo migliore per superare tutti questi problemi chirurgici.
Divulgazioni
Gli autori NR e XC non hanno conflitti di interesse. RMB e SJG sono inventori della proprietà intellettuale relativa al trasferimento genico all'ANS tramite iniezioni di nervo vago (brevetto degli Stati Uniti #11,753,655). SJG e RMB hanno ricevuto royalties da Taysha Gene Therapies e SJG ha ricevuto proventi da consulenze da Taysha Gene Therapies.
Riconoscimenti
Vorremmo ringraziare l'UT Southwestern Animal Resource Center Facility per aver organizzato lo spazio chirurgico per i ratti. Il finanziamento per questo lavoro è stato fornito dalle seguenti fonti a SJG: NIH/NINDS R01 NS087175, Hannah's Hope Fund e Taysha Gene Therapies.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL BD Tuberculin Syringe with Detachable 25 G x 5/8". Needle | Becton, Dickinson and Company | SKU:309626 | Used to connect with curved needle to pull the vagus nerve and hold it at the time of injection. |
| 0.5% Bupivacaine Hydrochloride Injection | Hospira | NDC 0409-1162-19 | Local anesthetics used to anesthetize local tissue. |
| 100 mL 0.9% Sodium Chloride Irrigation USP | Stericare Solutions | Item #6240 | Normal saline, used to rehydrate rat and tissue. |
| 20 Blunt, Retractor Tips, 7.5 mm | Kent Scientific Corporation | Surgi 5018 | Used to pull apart and hold tissues at the time of surgery. |
| 3 mL BD-Luer-Lok Syringe, Sterile, Single Use | Becton, Dickinson and Company | SKU # 309657 | Used to inject saline in rat and fill the saline into the Polythene tubing. |
| AK-Fluor10% | Akorn | NDC 17478-253-10 | Fluorescein dye visible within the nerve. Used to track injection fidelity. |
| Animal Weighing Scale | Kent Scientific Corporation | SCL 4000 | Used to measure body weight of rat. |
| Ansell ENCORE Perry Style 42 PF Surgical Gloves | Ansell | ASTM D3577 | Sterilie glove, it is used at the time of surgery by a surgeon. |
| Artificial Tears Ointment 3.5g | Pivetal | NDC 46066-753-55 | Used in eyses to prevent excessive dryness of eyes. |
| Baby-Myxter Hemostat | Fine Science Tools | 13013-14 | Used to stop bleeding in case of emergency. Also used to bend the 25 G x 5/8" in needle. |
| BD Intramedic PE Tubing | Becton, Dickinson and Company | 14-170-12A | Used in the injection set up system to connect with Hamilton needle and NanoFil Needles. It also holds the injection mixture. |
| BD Precison Glide Needle, 25 G x 5/8" | Becton, Dickinson and Company | REF#305122 | Used to inject saline in rat, and to make a curved needle. |
| BD Precison Glide Needle, 27 G x ½" | Becton, Dickinson and Company | REF#301629 | Used to fill sterile saline into the BD Intradermic tubing. |
| Benchmark Accuris ”NextPette” Variable Volume Pipette Micro Starter Setincludes 4 pipettes: 10/20/200/1000 μL, plus stand | MilliporeSigma | BMSP7700S1 | Used to pippette sterile solution. |
| Betadine, Povidine Iodine 10% | Honestmed | 67618015017 | Used to disinfect the surgical area. |
| Carprofen Injectable solution 50 mg/mL | Supplied by Covtrus (6451506845) | SKU 591149 | In our case, we used diluted carprofen at the dose rate of 5 mg/kg provided by the Animal Resource Center of University of Texas Southwestern Medical Center. |
| Curved needle (custom made) | Becton, Dickinson and Company | REF#305122 | BD PrecisionGlide 25 G x 5/8" in needle is curved to 90 degrees with the help of a hemostat. The tip of the needle is made blunt. It needs to be sterilized before use. It is used to hook the vagus nerve and hold it at the time of separation and injection. |
| Dissecting microscope | Motic | SMZ-171-BLED (Binocular with Lights) | Used to magnify the crifical anatomical area at the time of vagus nerve separation, injeciton, and to check injection leakage. |
| Drape sheet | Dynarex | Reorder#8122 | Used as drape after sterilization. |
| Dukal Cotton Tip Applicators, Non-Sterile | Dukal | Item 9003 | Used to blunt separation of tissue, needs to sterilize before use. |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | Used to separate the left vagus nerve from common carotid artery. It is curved so easy to use. |
| Ethicon PDS II Undyed Monofilament Suture - SUTURE, 4/0 18 PDS II CLR MONO PS | Ethicon | VA - Z682G | Used in suturing the wound. |
| Ethilon Nylon Suture Black Monofilament | Ethicon | 1856G | Used in suturing the wound if non-absorbale suture is used. Also used to hook the rat tooth to fix nose inside the nose cone. |
| Fine Forceps - Mirror Finish | Fine Science Tools | 11412-11 | Used at the time of vagus nerve separation from the common carotid artery. This is straight. |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | Ued to cut tissue. |
| Hamilton cleaning solution | Hamilton | HT18311 | Used to clean the Hamilton after use. |
| Hamilton Needle, 27G, Small Hub RN Needle, 2”, PT3, 6/PK | Hamilton | 7762-01 | Used to connect BD Intramedic™ PE Tubing. |
| Hamilton Syringe , 710RN | Hamilton | 7638-01 | Used to hold drug at the time of vagus nerve injection. |
| Insulin Syringe | EXEL INT, Comfort point | REF 26027 | Used to inject carprofen and local anesthetics. |
| Lidocaine 2% Injection | Covetrus | Reorder#002468 | Used to mix with Bupivacaine and inject at the site of incision. |
| Luxol Fast Blue MBSN | Acros Organics | 212170250 | Dye visible within the nerve, used to mix with drug so that injection mixture is visible. |
| Micro Bead Sterilizer with Glass Beads | Fine Science Tools | Item No. 18090-46 | Used to sterilize surgical tools in between the rat surgery. |
| NanoFil Needles-NF35BV-2 | World Precision Instrument | NC9708956 | Used to inject drug - dye mixture inside the vagus nerve. |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | Used in wound suturing. |
| Parafilm M Laboratory Wrapping Film, 4 Inches x 125 Feet, 1 Roll per Box, 12 Count | Honestmed | PM#996 | Used to hold the aliquoted 5 uL of drug-dye mixture so that loading of drug-dye mixture into the BDTM intradermic tubing is accurate. |
| PDI Alcohol Prep Pads | Honestmed | NDC 10819-3914-2 | Used to disinfect the surgical area. |
| Premium Care Sterile Type VII Gauze Sponges, 8-Ply, 2" x 2" | Dukal | Item C5119 | Used as cushon under the neck of rat at the time of surgery. |
| Press’n Seal Cling Film | Glad | Used to cover a rat at the time of surgery like a drape. | |
| Rat Retractor Set | Kent Scientific Corporation | Surgi 5002 | Used to keep the incision open so that it is easy to separate the vagus nerve from the carotid artery. |
| RightTemp Jr. | Kent Scientific Corporation | 20.3 cm W x 25.4 cm L (8 in W x 10 in L), used to keep rat warm. | |
| S&T Forceps - SuperGrip Tips | Fine Science Tools | 00632-11 | Used at the time of suturing to hold tissue without damage. |
| S&T Suture Tying Forceps | Fine Science Tools | 00272-13 | Used to tight the suture. |
| Scalpel blade #15 | Fine Science Tools | 10015-00 | Used to make an incision in the skin at the ventral side of neck. |
| Scalpel Handle-#7 | Fine Science Tools | 10007-12 | Used to hold the scalpel blade. |
| Syringe Pump | KD Scientific | 78-81-8052GL | Serial #D107034, Model#LEGATO-180, is a programmable pump that can pump small volume of mixture under a program. |
| TipOne Filter Tip Refill Starter Systems | USA Scientific | Item #1120-3510 | Used to pipette the drug and dye mixture. |
| Vaporizer for Isoflurane, Funnel Filled | Kent Scientific Corporation | Vetflow 1231 | Used to anesthetize rats. |
| Vetbond Tissue Adhesives | 3M Science Applied to Life | ID B00016067 | Used to seal tissue at the site of cut wound if suturing is not perfect. |
| Wahl BravMini+ Professional Cordless Clipper Kit | Kent Scientific Corporation | CL7300-Kit | Used to cut hair of rat. |
Riferimenti
- Fischer, G., et al. Direct injection into the dorsal root ganglion: Technical, behavioral, and histological observations. J Neurosci Methods. 199 (1), 43-55 (2011).
- O'donnell, M., Fontaine, A., Caldwell, J., Weir, R. Direct dorsal root ganglia (drg) injection in mice for analysis of adeno-associated viral (AAV) gene transfer to peripheral somatosensory neurons. J Neurosci Methods. 411, 110268 (2024).
- Puljak, L., Kojundzic, S. L., Hogan, Q. H., Sapunar, D. Targeted delivery of pharmacological agents into rat dorsal root ganglion. J Neurosci Methods. 177 (2), 397-402 (2009).
- Rueter, L. E., Kohlhaas, K. L., Curzon, P., Surowy, C. S., Meyer, M. D. Peripheral and central sites of action for a-85380 in the spinal nerve ligation model of neuropathic pain. Pain. 103 (3), 269-276 (2003).
- Ulusoy, A., et al. Neuron-to-neuron alpha-synuclein propagation in vivo is independent of neuronal injury. Acta Neuropathol Commun. 3, 13 (2015).
- Helwig, M., et al. Brain propagation of transduced alpha-synuclein involves non-fibrillar protein species and is enhanced in alpha-synuclein null mice. Brain. 139 (Pt 3), 856-870 (2016).
- Chiang, B., et al. Development of a novel suprachoroidal-to-optic-nerve (scone) drug delivery system. Drug Deliv. 31 (1), 2379369 (2024).
- Ferrari, L. F., Cunha, F. Q., Parada, C. A., Ferreira, S. H. A novel technique to perform direct intraganglionar injections in rats. J Neurosci Methods. 159 (2), 236-243 (2007).
- Yuan, X. M., et al. Rapid injection of lumbar dorsal root ganglia under direct vision: Relevant anatomy, protocol, and behaviors. Front. Neurol. 14, 1138933 (2023).
- Mason, M. R., et al. Comparison of AAV serotypes for gene delivery to dorsal root ganglion neurons. Mol Ther. 18 (4), 715-724 (2010).
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Ertl, H. C. J. Immunogenicity and toxicity of AAV gene therapy. Front Immunol. 13, 975803 (2022).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon