Method Article
Direktes Vagusnerv-Injektionsprotokoll für Ratten
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll für die direkte Injektion des Vagusnervs bei Ratten vor, das die direkte Verabreichung von Medikamenten in den Nerv ohne Komplikationen nach der Injektion ermöglicht. Diese Methode gilt für präklinische neurologische Studien, bei denen das autonome Nervensystem manipuliert wird. Es kann für die direkte Nerveninjektion für andere Nerven bei Ratten und anderen Spezies verwendet werden, mit den notwendigen Modifikationen.
Zusammenfassung
Es gibt eine relative Fülle von Strategien und Methoden, um die Verabreichung von Medikamenten an das zentrale Nervensystem zu erleichtern. Die direkte Verabreichung von Medikamenten an das periphere Nervensystem ist jedoch seltener, da weniger detaillierte Methodenpublikationen zur Verfügung stehen, um Forschern zu helfen. Hier beschreiben wir eine direkte Nerveninjektionsmethode für die Medikamentenabgabe im peripheren Nervensystem, wobei der Vagusnerv als Modellnerv verwendet wird. Diese Methode kann bei der Behandlung von Störungen des autonomen Nervensystems durch gezielte Behandlung des linken Vagusnervs angewendet werden, obwohl diese allgemeine Injektionsmethode mit geringfügigen Modifikationen auf die Injektion anderer Nerven extrapoliert werden kann. Diese Methode erklärt alle kritischen Schritte des mikrochirurgischen Eingriffs bei anästhesierten erwachsenen Ratten unter einem Präpariermikroskop. Die Verwendung eines Tracking-Farbstoffs wird beschrieben, um die Überwachung der Injektionstreue in Echtzeit zu erleichtern. Es werden Abbildungen von erfolgreichen und fehlgeschlagenen Injektionen bereitgestellt. Bei sachgemäßer Durchführung können direkte Vagusnerv-Injektionen auf sichere und von der Ratte gut vertragene Weise durchgeführt werden, ohne dass es zu Komplikationen nach der Entbindung kommt. Nachdem die Chirurgen in dieser Methode geschult waren, wurden beispielsweise sechs von sechs Ratten erfolgreich und ohne Komplikationen injiziert. Diese Methode der direkten Nerveninjektion für präklinische Studien an Ratten ist in der Lage, Wirkstoffe (einschließlich, aber nicht beschränkt auf die Gentherapie) an periphere Nerven abzugeben.
Einleitung
Die Anwendung der richtigen Methode der Arzneimittelverabreichung ist einer der entscheidenden Faktoren für das Erreichen erfolgreicher therapeutischer Ergebnisse. Trotz der Fülle an Methoden zur Verabreichung von Therapeutika an das Zentralnervensystem (ZNS) werden nur wenige Methoden für die Verabreichung des peripheren Nervensystems (PNS) durch direkte Nerveninjektion berichtet. Die direkte Injektion von Nerven, wie z. B. die Injektion in die Spinalganglien (DRG) bei Ratten, wurde in präklinischen Studien zum besseren Verständnis der Schmerzmechanismen, der Arzneimitteltoxizität, des Gentransfers 1,2,3 und derallgemeinen Methodenentwicklung 1,4 versucht. Weitere Berichte über die direkte Nerveninjektion umfassen die Injektion des Spinalnervs4, die Ischiasnerv-Injektion1 und die Injektion des Vagusnervs bei Ratten5 und Mäusen6. Vor kurzem wurde ein Verfahren zur suprachondrialen Injektion zur besseren Verteilung von Therapeutika in den Sehnervenkopf bei Kaninchen vorgeschlagen7.
DRG gilt aufgrund der sensorischen Funktion der Zellkörper im DRG2 als idealer Ort für die direkte Injektion von transgenbeladenen Vektoren wie dem Adeno-assoziierten Virus (AAV). Sowohl chirurgische als auch nicht-chirurgische Methoden der DRG-Injektionen wurden beschrieben 1,8. Es wurden jedoch kontroverse Schlussfolgerungen über die Konsistenz der Ergebnisse mit der nicht-chirurgischen Methode der DRG-Injektion1 gefunden. Es wurde vorgeschlagen, dass eine chirurgische Methode, die eine partielle Laminektomie beinhaltet, für die DRG-Injektion bei Ratten ohne Veränderung der Verhaltensergebnissezu 100 % erfolgreich ist 3, sowie eine Methode mit partieller Osteotomie bei Mäusen9. Mehrere Studien berichten über die DRG-Injektionsmethoden der Arzneimittelverabreichung, die in der präklinischen Gentherapieforschung bei Ratten und Mäusen eingesetzt wurden 1,2,10. Vektorbasierte Gentherapiestudien mit lokalisierten Injektionen können die folgenden Vorteile umfassen: verminderte Off-Target-Expression, Verringerung der systemischen Toxizität und kleinere Viruslasten und Injektionsvolumina, verringertes Risiko immunogener Komplikationen11,12.
Die direkte Injektionsmethode in den Ischiasnerv, den längsten Nerv des Körpers, wurde ausprobiert, indem der rechte Ischiasnerv in der Mitte des Oberschenkels einer Ratte freigelegt wurde. Bei der Methode wurde eine gezogene Glaspipette verwendet, die mit einem mikroprozesseurgesteuerten Injektionssystem ausgestattet war, um ein Gesamtvolumen von 10 μl Farbstoff mit einer Flussrate von 1,2 μl/min zu injizieren1. Dieses Experiment zeigte einen Mangel an Farbstoffverteilung auf dem Niveau von DRG, und die Verteilung war meist um die Injektionsstelle herum begrenzt. In ähnlicher Weise wurden andere Methoden der direkten Nerveninjektionen, wie z. B. Spinalnerveninjektionen, mit Farbstoff ausprobiert, um die angemessene Menge an Injektionsvolumen und das Farbstoffverteilungsmuster bei Ratten zu bewerten. 2 μl werden als optimal für die Injektion des Spinalnervs empfohlen, während 3 μl Farbstoff durch DRG-Injektion die Verteilung sowohl in den dorsalen als auch in den ventralen Wurzelganglien bei Rattenzeigten 1. Es wurde berichtet, dass das Volumen für die DRG-Injektion bei Mäusen von 1,0 μl bis 1,5 μl auf der Grundlage des Stammes und der Körpergröße 2,9 optimal ist.
Die direkte Vagusnerv-Injektionsmethode wurde bei Ratten5 und Mäusen6 verwendet, um die Rolle der neuronalen Verletzung oder der zellulären Integrität bei der Übertragung von humanem α-Synuclein zu bewerten. Diese beiden Studien, die von derselben Forschergruppe durchgeführt wurden, beschreiben eine kurze Methode zur direkten Injektion von AAV-Vektoren in den linken Vagusnerv im Gebärmutterhalsbereich. Bei Ratten wurde eine Glaskapillare mit einem Spitzendurchmesser von 60 μm verwendet, um einen 2-μl-Vektor mit einer Flussrate von 0,5 μl/min mit einer 5-μl-Hamilton-Spritze zu injizieren. Bei Mäusen wurde ein Gesamtvolumen von 750 nL Vektorlösung mit einer Flussrate von 160 nL/min unter Verwendung einer 36-G-Nadel aus stumpfem Stahl injiziert, die auf eine 10 μl NanoFil-Spritzeaufgesetzt wurde 6. Diese Experimente zeigten, dass das Transgen in Axonen im Pons und Mittelhirn der Ratten und Mäuse abgegeben und exprimiert wurde. In ähnlicher Weise zeigte der dorsale motorische Kern des linken Vagusnervs eine positive Immunreaktion mit dem Transgen. Diese Beweise zeigen, dass die direkte Vagusnerv-Injektionsmethode eine zuverlässige Methode in der Gentherapie sein könnte, bei der die zelluläre Transduktion auf mehrere Stellen des Gehirns ausgedehnt wird, die Axone durch den Vagusnerv projizieren. Bei diesen Methoden wird jedoch nicht die Verwendung eines Farbstoffs zur Verfolgung der Injektionstreue erwähnt.
Hier wird ein Verfahren zur direkten Injektion in den linken Vagusnerv unter Verwendung von ungiftigen Tracking-Farbstoffen beschrieben, die für Forscher in präklinischen Studien weitgehend anwendbar sind. Mögliche Fallstricke, die Schwierigkeiten bei der Verabreichung von Medikamenten verursachen können, und die Möglichkeiten, diese zu überwinden, werden diskutiert. Diese Situationen werden mit Bildern illustriert, um zu zeigen, was die Lieferung nicht erfolgreich macht und wie sie erfolgreich sein kann.
Protokoll
Das folgende Protokoll wird in Übereinstimmung mit den institutionellen Ethikrichtlinien und der Genehmigung des Institutional Animal Care and Use Committee (IACUC) durchgeführt.
1. Vorbereitung des Gehäuses
HINWEIS: Dieses Protokoll gilt für erwachsene Ratten im Alter von mindestens 2 Monaten. Kleinere Tiere (einschließlich Mäuse und jüngere Ratten) sind möglich, werden aber nicht empfohlen und sind erheblich schwieriger.
- Stellen Sie feuchtes Futter oder anderes weiches Futter (tierärztliches Erholungsgel) für 48 Stunden vor der Operation des Vagusnervs bereit. Da die Tiere nach dem Eingriff Schwierigkeiten beim Fressen haben können, sollten Sie den Tieren diese Artikel vor der Operation vorstellen, um ihnen zu helfen, sich mit dem Geschmack dieser Artikel vertraut zu machen und die Essmotivation zu induzieren.
- Halten Sie Ratten mindestens 1 Woche vor der Operation sowie 1 Woche nach der Operation einzeln in einem Käfig unter. Das ermöglicht es ihnen, sich an den Stress des Alleinseins zu gewöhnen und das Kratzen von Wunden nach der Operation durch einen Wurfgeschwister zu verhindern.
2. Vorbereitung der chirurgischen Gegenstände und des Raumes
- Erstellen Sie im Voraus eine Liste aller notwendigen Artikel und überprüfen Sie, ob alle Artikel für die Operation verfügbar sind.
- Sterilisieren Sie alle Gegenstände vor der Operation mit geeigneten Sterilisationsmethoden.
- Richten Sie den sterilen Operationsraum unter dem Präpariermikroskop ein. Legen Sie ein Heizkissen unter das Mikroskop, um die Ratte während der Operation warm zu halten.
- Legen Sie alle chirurgischen Materialien auf einen Operationstisch auf einem sterilen Tuch. Lassen Sie genügend Platz für Operationen unter dem Präpariermikroskop. Stellen Sie sicher, dass der Fokus des Mikroskops optimal ist und den Operationsbereich umfasst, um den Nerv sichtbar zu machen.
- Platzieren Sie die Spritzenpumpe in der Nähe des Operationstisches, so dass die Länge des Schlauchs ausreicht, um die Injektionsstelle zu erreichen.
- Platzieren Sie die chirurgischen Instrumente an der Seite der dominanten Hand des Chirurgen.
3. Herstellen einer Mischung aus dem Wirkstoffkandidaten und dem Tracking-Farbstoff
- Stellen Sie sicher, dass der Wirkstoffkandidat verdünnt ist, um die erforderliche Konzentration im empfohlenen Verdünnungsmittel zu erreichen, so dass 5 μl des Arzneimittels, gemischt mit Farbstoff, die erforderliche Menge des zu verabreichenden Arzneimittelkandidaten ergibt. Es wird empfohlen, dass das maximale Injektionsvolumen nach der Methode des direkten Vagusnervs 5 μl beträgt (einschließlich Tracking-Farbstoff, siehe Schritt 3.2).
- Mischen Sie einen kompatiblen Farbstoff mit dem Wirkstoffkandidaten, um die Injektionstreue in Echtzeit verfolgen zu können. Zum Beispiel ist eine Endkonzentration von entweder 1 % Luxol Fast Blue oder 0,002 % Fluorescein kompatible Farbstoffe.
ACHTUNG: Verwenden Sie den Farbstoff in seiner optimalen Konzentration in der Mischung aus Farbstoff und Wirkstoffkandidat. Wenn die Farbstoffkonzentration in der Mischung zu niedrig ist, ist die Injektion möglicherweise nicht sichtbar. Wenn die Farbstoffkonzentration zu hoch ist, kann dies zu einer zu dicken Mischung mit hoher Viskosität führen, die die Injektionsnadel blockiert.
4. Laden des Wirkstoff- und Farbstoffgemisches in den Schlauch
- Verbinden Sie eine 100-μl-Glasspritze mit entferntem Kolben mit einer 27-G-Nadel.
- Verbinden Sie ein Ende von ca. 45 cm sterilisiertem Polyethylenschlauch mit der 27-G-Nadel.
- Nehmen Sie eine 3-ml-Plastikspritze und setzen Sie sie mit einer 27-g-Nadel ein. Befüllen Sie die Spritze mit etwa 0,5 ml 0,9 % normaler Kochsalzlösung.
- Füllen Sie den Polyethylenschlauch mit der 0,9%igen normalen Kochsalzlösung aus dem offenen Ende, um die gesamte Länge des Schlauchs und den gesamten Zylinder der Glasspritze zu füllen, bis er herausläuft.
HINWEIS: Es ist wichtig zu vermeiden, dass Luftblasen im Schlauch eingeschlossen werden. - Entfernen und entsorgen Sie die 3-ml-Spritze und die Nadel.
- Führen Sie den Spritzenkolben in den Zylinder der Glasspritze ein und schieben Sie ihn leicht nach vorne bis zur Mitte des Zylinders.
- Setzen Sie die Glasspritze in die Spritzenpumpe ein.
- Ziehen Sie den Kolben mit der Spritzenpumpe leicht nach hinten, so dass am offenen Ende in der Länge des Schlauches ein Luftraum von ca. 1,5 cm entsteht.
- Pipettieren Sie mindestens 5 μl des Farbstoff-Wirkstoff-Gemisches mit einer 10-μl-Mikropipette und geben Sie es auf ein sterilisiertes Stück Parafilm.
- Ziehen Sie das Wirkstoffkandidatengemisch in den Schlauch zurück, indem Sie den Kolben über die Spritzenpumpe zurückziehen. Halten Sie die Luftblase zwischen der 0,9%igen Kochsalzlösung und der Injektionslösung, aber vermeiden Sie es sonst, Luftblasen in der Injektionslösung einzuschließen. Markieren Sie den Füllstand des Injektionsgemisches im Schlauch mit einem Marker.
HINWEIS: Der Luftspalt zwischen dem Wirkstoff-Farbstoff-Gemisch und der sterilen Kochsalzlösung im Schlauch ist entscheidend, um eine Vermischung der beiden Lösungen zu verhindern. - Setzen Sie die 35 G Nadel in den Schlauch ein. Befestigen Sie die Nadel mit Klebeband auf der sauberen Oberfläche des Operationstisches, so dass die Nadel nicht locker ist, sich nicht bewegt und nichts anderes berührt und sterilisiert bleibt.
5. Grundierung der Injektionsnadel
- Stellen Sie das Spritzenpumpenprogramm auf 0,5 μl/min ein.
- Starten Sie die Spritzenpumpe für ca. 10-15 s, bis die Injektionslösung aus der Nadelspitze austritt. Eine winzige Menge der Mischung an der Spitze der Nadel ohne Leck an der Verbindung von Schlauch und Injektionsnadel (oder an einer anderen Stelle entlang der Länge der Spritze, des Schlauchs oder der Nadel) zeigt an, dass die Einstellung korrekt ist.
HINWEIS: Wenn kein winziges Tröpfchen an der Spitze der Nadel zu sehen ist, deutet dies auf eine Verstopfung der Nadel hin. Eine Verstopfung der Nadel kann aufgrund der hohen Viskosität des Wirkstoff- und Farbstoffgemisches, der im System eingeschlossenen überschüssigen Luft und der nicht richtig in der Spritzenpumpe sitzenden Glasspritze auftreten. In Abbildung 1 sehen Sie ein Beispiel für eine Leckage an der Verbindungsstelle zwischen Nadel und Schlauch. Das Priming ist von entscheidender Bedeutung, da es hilft zu erkennen, ob die Nadel frei ist und die Injektion in den Nerv reibungslos verläuft.
6. Vorbereitung der Ratte auf die Operation
- Ermitteln Sie das Körpergewicht der Ratte, um die erforderliche Dosis von Analgetika zu berechnen. Zum Beispiel wird Carprofen in einer Dosierung von 5 mg/kg subkutan bei Ratten angewendet.
HINWEIS: Es wird empfohlen, Carprofen vor der Injektion bei 4 °C zu lagern. - Betäuben Sie die Ratte mit einem Isofluran-Verdampfer mit einer Flussrate von 3%-4% zur Einleitung der Anästhesie für ca. 2-3 Minuten. Reduzieren Sie die Isofluran-Flussrate auf etwa 1,75 % bis 2 % zur Aufrechterhaltung der Anästhesie.
- Bringen Sie die Ratte auf einen separaten Tisch mit einer Einrichtung für die Haarentfernung und die Vorbereitung der Stelle. Stellen Sie sicher, dass sich diese Liege in der Nähe des Operationsraums befindet.
- Tragen Sie künstliche Tränensalbe auf beide Augen der Ratte auf, um übermäßige Trockenheit zu verhindern.
- Verabreichen Sie Analgetika gemäß dem genehmigten institutionellen Tierprotokoll, um die Schmerzen zu kontrollieren, wenn die Ratte wieder zu Bewusstsein kommt.
- Rasieren Sie den Operationsbereich mit einem Haarschneider an der Bauchseite des Halses im Halsbereich. Rasieren Sie bis zu ca. 2 cm senkrechten Abstand von der Mittellinie auf beiden Seiten vom Kinn bis zum Brustbein.
- Sterilisieren Sie den Bereich mit 70 % Ethylalkohol und 10 % Betadin und wischen Sie den Bereich dreimal abwechselnd mit einem Alkoholtupfer und Povidon-Jod ab. Wischen Sie von der Mitte des Bereichs in einem kreisförmigen Muster nach außen.
- Bringen Sie die Ratte in Rückenlage unter dem Mikroskop in den Operationstisch. Passen Sie den Fokus des Mikroskops an, um den Operationsbereich im Gebärmutterhalsbereich sichtbar zu machen.
7. Durchführung einer Rattenoperation zur direkten Injektion des Wirkstoffkandidaten in den linken Vagusnerv (Abbildung 2, Abbildung 3 und Abbildung 4)
HINWEIS: Für diesen Teil der Methode ist eine zweite Person erforderlich, die den Chirurgen unterstützt.
- Legen Sie die Ratte in Rückenlage unter das Präpariermikroskop, das mit einer montierten Lampe verbunden ist, auf ein Heizkissen.
- Haken Sie die vorderen Oberkieferzähne der Ratte mit einem Stück nicht resorbierbarer Naht ein und fixieren Sie das offene Ende der Naht im Nasenkonus, so dass sich das Nasenloch der Ratte während der gesamten Narkose immer im Nasenkonus befindet.
- Positioniere die Ratte so, dass ihr Kopf auf der linken Seite des rechtshändigen Chirurgen (oder der rechten Seite eines linkshändigen Chirurgen) liegt. In dieser Position steht die Vorderseite des Chirurgen senkrecht zum Körper der Ratte. Legen Sie ein Kissen aus sterilisiertem Messgerät unter den Hals und stellen Sie den Winkel des Gebärmutterhalsbereichs der Ratte so ein, dass der Gebärmutterhalsbereich gerade wird. Dies erleichtert die Lokalisierung des linken Vagusnervs und die Durchführung der Injektion.
- Drapieren Sie den gesamten Körper der Ratte mit einem sterilisierten Tuch und halten Sie den Operationsraum offen.
- Befestigen Sie vier Retraktorstifte einzeln mit 4 magnetischen Fixateuren mit Elastomeren und platzieren Sie die Fixateure an den vier Ecken des Operationstisches.
- Injizieren Sie Lokalanästhetika epidermal an der Mittellinie des Gebärmutterhalsbereichs, wo der Schnitt gemacht wird. Zum Beispiel wird in der Regel eine Mischung aus Lidocain und Bupivacain verwendet.
- Machen Sie einen etwa 2 cm langen Längsschnitt der Haut an der Mittellinie zwischen Kinn und Brustbein mit einer Skalpellklinge an der ventralen Seite des Halses im Halsbereich (Abbildung 3A).
- Trennen Sie die Schnittkanten der Haut mit sterilisierten Wattespitzen ab.
- Ziehen Sie die Hautränder mit Hilfe von Retraktorspitzen in entgegengesetzte Richtungen von der Stelle des Schnitts zurück.
- Trennen Sie die Gesichtsmaske mit Wattestäbchen, um tiefer zu gehen. Schiebe die Speicheldrüsen in Richtung der Seitenseite.
- Trennen Sie die Sternomastoideusmuskeln mit Wattestäbchen und ziehen Sie sie mit den Stecknadeln zur Seite. Wenn die Trennung des Sternomastoideusmuskels weit voranschreitet, erscheint in der Mitte die Luftröhre, die mit dem M. sternohyoideus bedeckt ist (Abbildung 3B).
HINWEIS: Achten Sie darauf, keinen Druck auf die Luftröhre auszuüben. - Schieben Sie die Gewebetrennung auf der linken Seite der Luftröhre der Ratte voran, bis die Halsschlagaderscheide erscheint, in der sich die gemeinsame Halsschlagader befindet, die zusammen mit dem linken Vagusnerv verläuft.
- Stechen Sie vorsichtig mit einer feinen Pinzette ein kleines spitzes Loch in die Halsschlagaderscheide und achten Sie darauf, die Halsschlagader unter dem Mikroskop nicht zu verletzen. Trennen Sie den linken Vagusnerv mit einer feinen Pinzette von der Halsschlagader.
HINWEIS: Das Operationsgebiet ist anatomisch kritisch. Die Wand der Halsschlagader ist dick, rutschig und nicht leicht zu verletzen, aber die scharfe Spitze einer feinen Pinzette kann sie verletzen und es kann zu Blutungen kommen. Achten Sie gleichzeitig darauf, den Nerv nicht zu verletzen. - Sobald der Nerv durch die Pinzette von der Arterie getrennt ist, verwenden Sie eine gebogene 25-G-Nadel, die an eine 1-ml-Spritze aus diesem Loch angebracht ist, um den Nerv mit der nicht dominanten Hand zu "haken" und zu halten (Abbildung 4A).
HINWEIS: Die Spitze der gebogenen Nadel ist stumpf gemacht, um den Nerv und die Arterie nicht zu verletzen. Der Krümmungswinkel der Nadelspitze wird mit Hilfe eines Blutstillers auf ca. 90° individuell angepasst (Abbildung 2). - Halten Sie mit der dominanten Hand die mit dem Wirkstoff-Farbstoff-Kandidatengemisch beladene Nadel und stechen Sie vorsichtig in die gleiche Richtung, in die der Nerv verläuft, so dass die Abschrägung der Nadel nach oben zeigt.
- Für einen leichten Stich halten Sie den Nerv gerade, indem Sie vorsichtig mit dem 25-G-Haken ziehen. Führen Sie die Nadel in den Nerv ein und schieben Sie sie mehr als 0,5 cm nach vorne, während Sie die Nadel parallel zum Vagusnerv halten. Ziehen Sie dann leicht nach hinten, so dass etwa 0,4-0,5 cm Nadel im Nerv verbleibt.
HINWEIS: Der Winkel der Nadel sollte flach genug sein, um in das Innere des Nervs einzudringen, ohne auf die andere Seite zu gelangen.
- Für einen leichten Stich halten Sie den Nerv gerade, indem Sie vorsichtig mit dem 25-G-Haken ziehen. Führen Sie die Nadel in den Nerv ein und schieben Sie sie mehr als 0,5 cm nach vorne, während Sie die Nadel parallel zum Vagusnerv halten. Ziehen Sie dann leicht nach hinten, so dass etwa 0,4-0,5 cm Nadel im Nerv verbleibt.
- Es kann vorkommen, dass die Nadel zum Zeitpunkt des Primings außerhalb des Nervs frei ist, aber das Wirkstoff-Farbstoff-Gemisch nicht reibungslos innerhalb des Nervs verläuft. Um diese Situation zu vermeiden, begrenzen Sie die Anzahl der Nervenstiche mit einer einzigen Nadel nicht mehr als 3 Mal. Wenn die Nadel abgestumpft wird, steigt die Wahrscheinlichkeit, dass sie blockiert oder anderweitig schlecht injiziert wird.
- Stellen Sie sicher, dass sich die Nadel vollständig im Nerv befindet. Halten Sie die Position unbeweglich und schalten Sie die Spritzenpumpe ein.
HINWEIS: Überprüfen Sie sorgfältig an der Injektionsstelle, ob das Wirkstoff-Farbstoff-Gemisch nicht aus dem Nerv zurückfließt. - Prüfen Sie während der Injektion ständig, ob die Infusion im Nerv verbleibt und reibungslos fließt. Verwenden Sie die Markierung auf dem Infusionsschlauch, um die Bewegung des Arzneimittel-Farbstoff-Gemisches vom Ausgangspunkt aus zu überwachen.
- Wenn das Wirkstoff-Farbstoff-Gemisch nicht gleichmäßig fließt, ziehen Sie die Nadel heraus und wiederholen Sie den Ansaugschritt (Schritt 5.2). Führen Sie dann die Nadel wieder in den Nerv ein und setzen Sie die Infusion fort.
- Der Nerv beginnt, die Farbe des Farbstoffs zu entwickeln (Abbildung 4B). Setzen Sie die Infusion bei 0,5 μl/min für 10 Minuten fort, um alle 5 μl des Wirkstoff-Farbstoff-Kandidatengemisches zu infundieren.
HINWEIS: Es wird empfohlen, das freiliegende Gewebe bei Bedarf mit einer kleinen Menge warmer 0,9% steriler Kochsalzlösung zu spülen, um übermäßige Trockenheit und Beschädigung zu vermeiden. - Nachdem die 5 μl infundiert wurden und die Spritzenpumpe gestoppt wurde, halten Sie die Nadel für weitere 1 Minute an Ort und Stelle, damit sich das gesamte Wirkstoff-Farbstoff-Gemisch von der Injektionsstelle ausbreiten kann. Entfernen Sie die Nadel.
- Die 25 g gebogene Nadel entfernen. Verwenden Sie sterile Wattestäbchen, um das Taschentuch vorsichtig wieder an seine ursprüngliche Position zu bringen. Entfernen Sie die Aufrollspitzen.
- Verschließen Sie die Wunde mit einer nicht resorbierbaren Naht (es kann auch resorbierbares Nahtmaterial verwendet werden). Tragen Sie bei Bedarf eine winzige Menge Gewebekleber zwischen den Nähten auf, um die Wunde perfekt zu schließen.
8. Nachsorge einer Ratte
- Nach dem Schließen der Wunde etwa 3 ml 0,9% warme Kochsalzlösung subkutan infundieren. Dies hilft den Ratten, sofort zu rehydrieren.
- Setzen Sie die Ratte in eine Wärmequelle, bis sie sich vollständig von der Narkose bis zum Normalzustand erholt hat. Notieren Sie alles, was während des Erholungsprozesses beobachtet wurde, was abnormal ist.
HINWEIS: Die Erholungsdauer kann länger sein, wenn die Nerveninjektion lange dauert. - Setzen Sie die Ratte in ihren Heimkäfig mit feuchtem Futter auf dem Boden des Käfigs um. Stellen Sie sicher, dass jederzeit Wasser zur Verfügung steht. Beobachten Sie die Ratte postoperativ etwa 2 Stunden lang, um sicherzustellen, dass sie sich nicht friert.
HINWEIS: Stellen Sie die Ratte für weitere Stunden in eine Wärmequelle, wenn es sich kalt anfühlt. - Überwachen Sie die Ratte 12 h, 24 h, 36 h, 48 h und 72 h nach der Operation mit schriftlichen Notizen der Beobachtungen. Wiederholen Sie die Analgetika gemäß dem genehmigten institutionellen Tierprotokoll, um die Schmerzen zu kontrollieren. Zum Beispiel wird Carprofen in einer Menge von 5 mg/kg zweimal im Abstand von 24 h subkutan dosiert. Konsultieren Sie einen Tierarzt, wenn die Schmerzen bei der Ratte länger als 48 Stunden anhalten.
- Wiederholen Sie die subkutane Injektion von etwa 3 ml 0,9% warmer Kochsalzlösung nach 24 Stunden, je nach dem Zustand der Ratte.
- Fahren Sie mit der Untersuchung der Wunde fort. Stellen Sie sicher, dass die Wunde trocken ist und gerade heilt.
HINWEIS: Rötung, Schwellung und schmerzhafter Zustand der Wunde mit Inaktivität und Stumpfheit der Ratte können ein Hinweis auf eine Wundentzündung sein und können eine zusätzliche tierärztliche Beratung rechtfertigen. Eine Ratte mit Schmerzen zeigt einen gekrümmten Rücken, ein zerzaustes Fell, rote Augen und einen inaktiven Zustand. Er befindet sich normalerweise in einer Ecke des Käfigs. - Entfernen Sie die nicht resorbierbaren Nähte innerhalb von 2 Wochen, sobald die Wunde verheilt ist.
Ergebnisse
In der vorliegenden Studie wurden sechs erwachsene Ratten (3 Männchen und 3 Weibchen) verwendet. Von sechs Ratten wurde eine Ratte mehrfach injiziert, um einen Zustand des Versagens der Injektion zu demonstrieren, der eine Diffusion des Farbstoffs um die Injektionsstelle herum zeigt Abbildung 5A. Alle anderen Ratten zeigten eine glatte Injektion und Nervenflecken, wie in Abbildung 4B und Abbildung 5B gezeigt.
Abbildung 1 zeigt eine Situation, in der Farbstoff zwischen Nadel und Schlauch ausgetreten ist, wenn die Einstellung der Injektionsnadel mit dem Schlauch nicht korrekt ist. Der in diesem Experiment verwendete Farbstoff von 1 % ist nicht zu dickflüssig, aber der Durchgang des Farbstoffs durch die Injektionsnadel ist aufgrund einer undichten Versiegelung fehlgeschlagen. Diese Art von Problem kann beim Grundieren leicht erkannt werden (siehe Schritt 5.2). Um diese Bedingung zu lösen, überprüfen Sie, ob die Verbindung zwischen Nadel und Schlauch korrekt hergestellt ist. Stellen Sie sicher, dass etwa 3 mm Nadel in den Schlauch eingeführt wurden, und stellen Sie sicher, dass die Größe des Schlauchs und der Nadel korrekt ist. Wiederholen Sie das Ansaugen, nachdem die fehlerhafte Verbindung behoben wurde, insbesondere wenn Luftblasen eingebracht werden (Schritt 5.2 wiederholen).
Abbildung 2 zeigt den Aufbau einer 25 G gebogenen, abgestumpften Nadel, die auf eine 1-ml-Kunststoffspritze aufgesetzt ist. Die Spitze der Nadel wird durch einen Nadelhalter abgestumpft und um ca. 90° Winkel gebogen. Es wird vor der Verwendung sterilisiert und zum Zeitpunkt der Operation auf die sterilisierte 1-ml-Spritze aufgesetzt. Diese mit der Spritze eingesetzte Nadel wird verwendet, um den linken Vagusnerv von der Arteria carotis communis zu trennen, wie in Schritt 7.14 beschrieben, und um sie zum Zeitpunkt der Injektion einzuhaken und zu halten, wie in Abbildung 4A gezeigt.
Abbildung 3 zeigt den Aufbau eines aseptischen Verfahrens der Mittellinieninzision mit einer Skalpellklinge im ventralen Halsbereich einer Ratte, um die Hautschicht zu durchtrennen. Nachdem die Ratte mit einem sterilisierten Tuch bedeckt wurde, wird ein etwa 2 cm langer horizontaler Schnitt gemacht, um die Hautschicht zu durchtrennen ( Abbildung 3A). Sobald die Haut geschnitten ist, werden die beiden Kanten der Schnitthaut mit Hilfe von Stiften, die mit Elastomeren verbunden sind, an gegenüberliegende Seiten gezogen. Die Traktion der Schnittkanten zur gegenüberliegenden Seite schafft einen breiteren Raum, um tiefer zu gehen. Die Gesichtsschicht unter der Haut und die Sternomastoideusmuskeln sind durch sterilisierte Wattestäbchen stumpf getrennt, wie in Abbildung 3B gezeigt. Sobald der linke Vagusnerv auf der linken Seite der Luftröhre innerhalb der gemeinsamen Halsschlagaderscheide erscheint, wie in Schritt 7.12 beschrieben, wird er mit einer feinen Pinzette getrennt und wie in Abbildung 4A eingehakt.
Abbildung 4 zeigt eine Situation, in der sich der linke Vagusnerv von der Arteria carotis communis trennt und diese für die Injektion bereithält. Der Chirurg hält die Injektionsnadel mit seiner dominanten Hand (rechte Hand), und die andere Hand (links) hält den linken Vagusnerv der Ratte mit Hilfe einer gebogenen Nadel, die an einer 1-ml-Spritze befestigt ist, Abbildung 4A. Der linke Vagusnerv ist gut von der Arteria carotis communis getrennt und so gedehnt, dass er in diese injiziert werden kann. Das gestrichelte Rechteck auf der rechten Seite des Nervs zeigt den Bereich der Luftröhre, der mit dem M. sternohyoideus bedeckt ist. Abbildung 4B zeigt den linken Vagusnerv, eingefärbt mit der Farbe des blauen Farbstoffs nach erfolgreicher Injektion ohne Diffusion des Farbstoffs. Das weiß gepunktete Rechteck ist der Bereich der Luftröhre. Abbildung 4B ist stärker gedehnt als Abbildung 4A , um ein klares Bild des Nervs und seiner Umgebung nach der Injektion zu zeigen.
Abbildung 5 zeigt Beispiele für fehlgeschlagene und erfolgreiche Injektionen in den linken Vagusnerv einer Ratte. Bei diesen Injektionen wurden 5 μl 1 % Farbstoff mit einer Flussrate von 0,5 μl/min in den Nerv verwendet. Abbildung 5A zeigt einen Versagenszustand der Injektion, da der Farbstoff nicht nur auf das Innere des Nervs beschränkt ist (siehe Einschub). Vielmehr hat sich der Farbstoff über den gesamten Bereich um den Nerv verteilt. Darüber hinaus ist die tatsächliche Injektionsstelle im Nerv nicht klar. Dies deutet darauf hin, dass sich die Injektion nicht im Inneren des Nervs befand und eine beträchtliche Menge des Injektionsvolumens austrat und in die Umgebung diffundierte.
Eine ähnliche Situation ist bei Bedingungen zu beobachten, unter denen die Nadel wieder eingeführt oder im Nerv neu positioniert werden muss. Dies kann notwendig sein, wenn die Nadel verstopft und die Mischung nicht durchlässt oder wenn die Nadel stumpf wird und nicht leicht in den Nerv eindringen kann. In dem in Abbildung 5A gezeigten Beispiel zeigt die geringe Menge an Blut, die sich in diesem Bereich angesammelt hat, den versehentlichen Bruch winziger Blutgefäße in diesem Bereich. Dies geschieht, wenn Blutgefäße in der Umgebung während der Nerventrennung verletzt werden.
Abbildung 5B zeigt eine erfolgreiche Injektion in den Nerv. Es zeigt eine klare Injektionsstelle und einen gut gefärbten Nerv, der sich von der Umgebung unterscheidet. Ein winziger Farbstofffleckenbereich außerhalb des Nervs ist auf eine kleine Menge der Farbstofflösung an der Nadelspitze zurückzuführen, die nach dem Grundieren vorhanden ist (siehe Einschub). Das Priming wird durchgeführt, um die Obstruktion der Nadel zu testen, kurz bevor der Nerv gestochen wird.

Abbildung 1: Austritt von Farbstoff (Pfeil) aufgrund einer fehlerhaften Dichtung zwischen Nadel und Schlauch. Diese Art von Fehler tritt auf, wenn der Schlauch nicht richtig mit der Spitze der Nadel befestigt ist. Um diese Art von Undichtigkeit zu verhindern, werden etwa 3 mm oder mehr der Nadelspitze in den Schlauch eingeführt und die richtige Größe der Nadel und des Schlauchs verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Eine 25 G stumpfe Nadel, die in einem Winkel von etwa 90° gebogen und auf eine 1 ml-Kunststoffspritze aufgesetzt wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
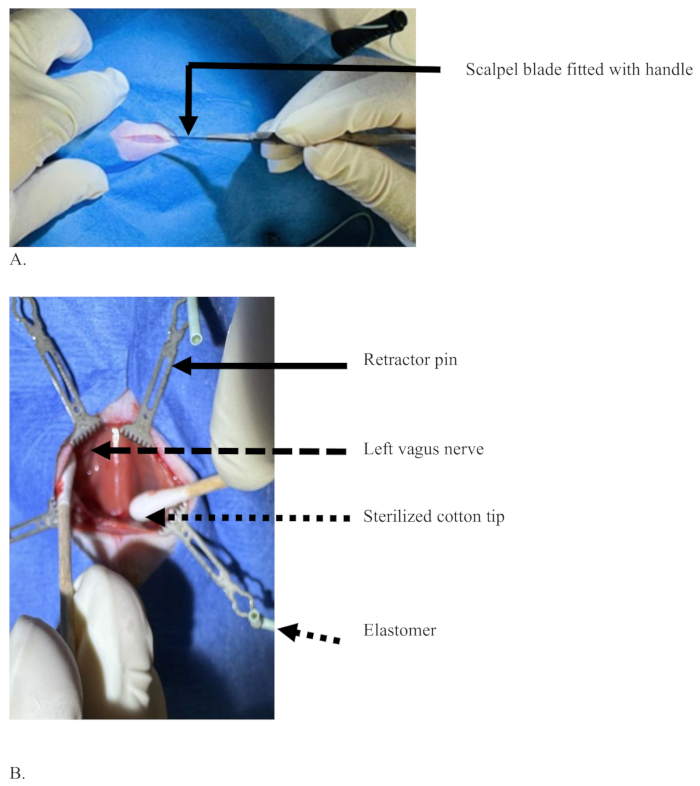
Abbildung 3: Ein Mittellinienschnitt mit einer Skalpellklinge im ventralen Halsbereich einer Ratte, um die Hautschicht zu durchtrennen. (A) Ein Schnitt, bei dem nur die Haut, aber ohne Blut geschnitten wird, und eine Skalpellklinge mit einem Griff, der mit der dominanten Hand des Chirurgen gehalten wird. (B) Die sterilisierten Wattespitzen (gestrichelter Pfeil), die das Gewebe voneinander trennen, um den linken Vagusnerv freizulegen (gestrichelter Pfeil), Gewebe, das mit Hilfe von Stecknadeln (durchgezogener Pfeil) auseinandergezogen wird, die von Elastomer gestützt werden (kurzer gepunkteter Pfeil). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
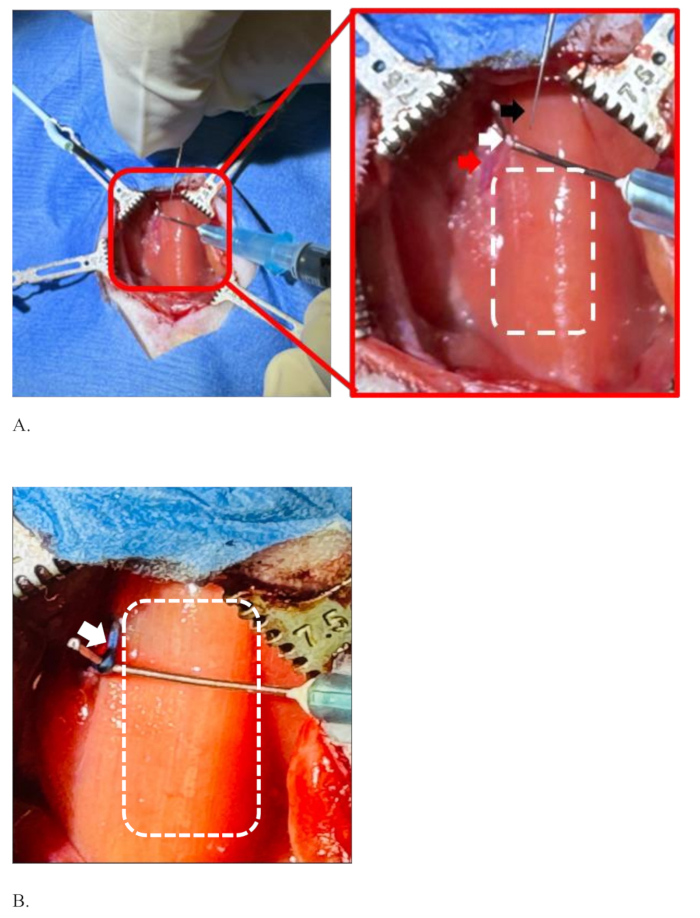
Abbildung 4: Illustration der Trennung des linken Vagusnervs von der Arteria carotis communis, die vor und nach der Injektion gehalten wird. (A) Die Injektionsnadel (schwarzer Pfeil), der linke Vagusnerv (weißer Pfeil), die Arteria carotis communis (roter Pfeil) und das gestrichelte Rechteck, das den Bereich der Luftröhre zeigt, der mit dem M. sternohyoideus bedeckt ist. (B) Der linke Vagusnerv in der blauen Farbe, die Farbe des Farbstoffs nach erfolgreicher Injektion ohne Diffusion des Farbstoffs (weißer Pfeil) und der Bereich der Luftröhre (gestricheltes Rechteck). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
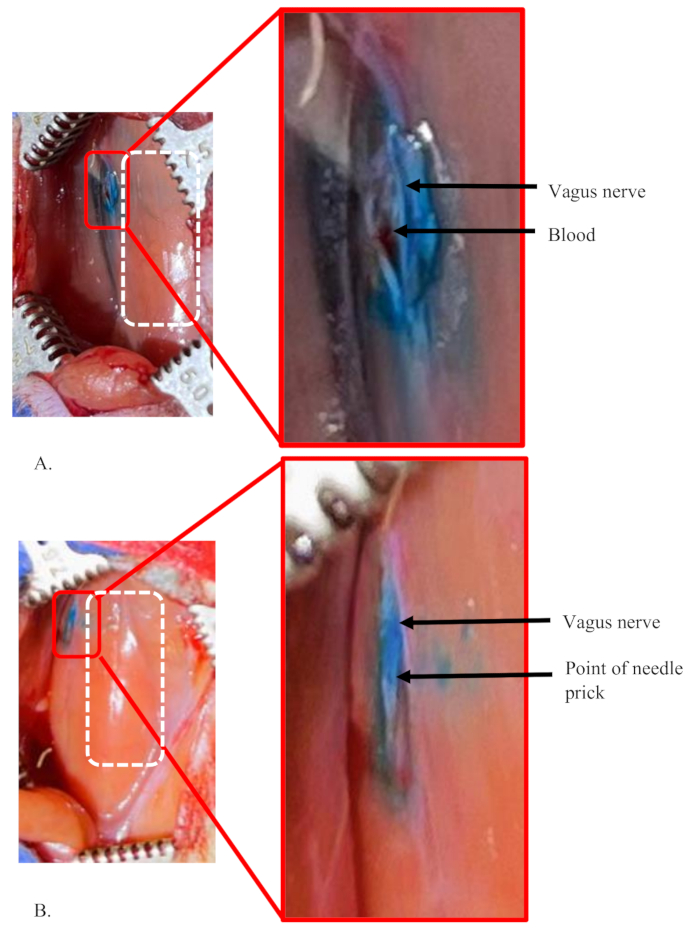
Abbildung 5: Beispiele für eine fehlgeschlagene Injektion und eine erfolgreiche Injektion in den linken Vagusnerv einer Ratte. (A,B) 5 μl Farbstoff in einer Konzentration von 1% wurden in den linken Vagusnerv von Ratten injiziert. Das weiße gestrichelte Rechteck zeigt den Bereich der Luftröhre in beiden Feldern. (A) Ein Versagenszustand, der zeigt, dass der Farbstoff nicht nur auf das Innere des Nervs beschränkt ist, deutet auf einen signifikanten Verlust der Farbstofflösung während des Eingriffs hin. Die geringe Menge Blut, die sich in dem Bereich angesammelt hat, zeigt einen versehentlichen Riss eines winzigen Blutgefäßes in diesem Bereich, das bei der Nerventrennung beschädigt wurde. (B) Eine erfolgreiche Injektion in den Nerv. Es zeigt einen klaren Punkt einer einzelnen Injektion und einen gut gefärbten Nerv, der sich von der Umgebung unterscheidet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Methode zur direkten Injektion in den linken Vagusnerv kann bei Ratten sicher und ohne postoperative Komplikationen durchgeführt werden. Die Verabreichung von Medikamenten an den Vagusnerv kann verwendet werden, um das autonome Nervensystem (ANS) zu bekämpfen. Dies beinhaltet bestimmte kritische Schritte, die Übung und ein mittleres bis hohes Maß an chirurgischer Geschicklichkeit erfordern.
Dieser chirurgische Eingriff erfordert bei Ratten eine ausgewogene Vollnarkose. Der Chirurg ist bestrebt, die Operation innerhalb einer kürzeren Zeit abzuschließen, um die Exposition gegenüber Anästhetika für eine bessere Genesung zu begrenzen, insbesondere bei alten Ratten. Auch bei dieser Methode ist ein ausgebildeter Chirurg mit einem gewissen Maß an aseptisch-chirurgischen Fähigkeiten erforderlich, um die Injektion und die postoperative Genesung erfolgreich zu gestalten. Die anatomische Lokalisation des Vagusnervs sitzt tief an einer kritischen Stelle13. Der linke Vagusnerv verläuft Seite an Seite mit der linken Arteria carotis communis, was zum Zeitpunkt der Trennung und Injektion ein Verletzungsrisiko sowohl für die Arterie als auch für den Nerv darstellt. Ein hohes Maß an Übung und Geschicklichkeit ist erforderlich, um den Nerv korrekt von der Halsschlagader zu trennen. Sie sollte während des Eingriffs im richtigen Winkel gehalten werden, während die Nadel im Nerv bleibt.
Obwohl es nur zwei veröffentlichte Beispiele für direkte Vagusnerv-Eingriffe bei Ratten5 und Mäusen6 von derselben Forschergruppe gibt, fehlt in beiden Studien eine detaillierte Beschreibung, wie das Verfahren durchzuführen ist. Die Verwendung einer 35-G-Nadel zur Injektion des Nervs war praktisch (d. h. es war keine spezielle Ausrüstung erforderlich, um die Nadeln vorzubereiten), und die Ergebnisse blieben konsistent im Vergleich zur Verwendung der gezogenen Glasmikropipette, die von der anderen Gruppe verwendet wurde. Im Vergleich zu den Injektionen in andere Nerven, wie z. B. den Ischiasnerv, ist der Vagusnerv relativ kleiner und kann jeweils nur ein kleineres Volumen des Wirkstoff-Farbstoff-Gemisches aufnehmen. In einer veröffentlichten Studie, in der eine 10 μl Farbstofflösung in den Ischiasnerv injiziert wurde, erreichte die Farbstoffdiffusion von der Injektionsstelle aus eine Gesamtlänge von 2,3 cm innerhalb des Nervs, ohne in den DRG1 zu greifen. Der Vagusnerv kann mit diesem Injektionsprotokoll bis zu 5 μl Volumen des Wirkstoff-Farbstoff-Gemisches sicher aufnehmen.
Für diese Injektion ist ein Präpariermikroskop erforderlich. Obwohl die Verwendung eines Farbstoffs in der Injektionslösung nicht unbedingt erforderlich ist, wird dringend empfohlen, die Visualisierung der Injektionstreue in Echtzeit während des Eingriffs zu ermöglichen. Wenn die Farbstoffkonzentration in der Mischung aus Arzneimittel und Farbstoff zu hoch ist, kann dies gleichzeitig dazu führen, dass die Nadel zum Zeitpunkt der Injektion blockiert wird. Die Begrenzung der Anzahl der Injektionsstiche durch eine einzige Nadel ist bei dieser Methode ebenfalls von entscheidender Bedeutung. Es wird empfohlen, dieselbe Nadel nicht für mehr als 3-5 Nervenstiche (entspricht 3 Ratten pro Nadel) zu verwenden, um ein Abstumpfen der Nadel zu verhindern. Die Wiederverwendung der Nadel (optional) erfordert, dass sie zwischen den Tieren sterilisiert wird, indem sie dreimal mit 70 % Alkohol abgewischt wird.
Beispiele für Studien in der Literatur, die die direkte Injektion des Vagusnervs verwenden, sind äußerst begrenzt, insbesondere für Nagetiere 5,6. Einige Studien berichteten über direkte DRG- und andere Nerveninjektionen mit Modifikationen in den Methoden und der Menge des zu injizierenden Volumens bei Mäusen und Ratten 1,2,9. Das vorliegende Verfahren ist von großer Bedeutung als Ansatz zur Verabreichung der Wirkstoffkandidaten oder anderer Wirkstoffe durch den Vagusnerv, um Aspekte des ANS zu erreichen. Der Vagusnerv ist der längste Hirnnerv und innerviert fast alle viszeralen Organe, um deren physiologische Funktionen zu regulieren. Daher ist die Anwendung dieses Ansatzes in präklinischen Studien von gegenwärtiger und zukünftiger Bedeutung, einschließlich, aber nicht beschränkt auf die Gentherapie mit Ratten. Darüber hinaus kann diese Methode mit relativ geringen Modifikationen auf andere Nerveninjektionen, wie z. B. den Ischiasnerv, extrapoliert werden.
Kurz gesagt, die direkte Vagusnerv-Injektionsmethode ist ein potenzieller Weg der Arzneimittelverabreichung für ANS-bezogene Rattenmodellstudien. Unsere Erfahrung ist, dass das Verfahren selbst keine langfristigen Nebenwirkungen verursacht, da Tiere, die über ein Jahr nach der Injektion gehalten wurden, keine Langzeitkomplikationen entwickelt haben. Es umfasst jedoch auch mehrere kritische Schritte und erfordert Praktiken in der Nagetierchirurgie. All diese kritischen Punkte sind vorsichtig in dieses detaillierte Schritt-für-Schritt-Protokoll in den Text aufgenommen worden. Besonderes Augenmerk wird auf mehrere kritische Punkte gelegt: 1) Trennung des Vagusnervs von der Arteria carotis communis, 2) Halten des Nervs in einer stabilen Position bei und nach dem Einstechen der Nadel innerhalb des Vagusnervs während der gesamten Injektionsperiode und 3) eine reibungslose Abgabe des Wirkstoff-Farbstoff-Gemisches ohne Nadelverstopfung. Umfangreiche chirurgische Praxis ist der beste Weg, um all diese chirurgischen Probleme zu überwinden.
Offenlegungen
Die Autoren NR und XC haben keine Interessenkonflikte. RMB und SJG sind Erfinder von geistigem Eigentum im Zusammenhang mit dem Gentransfer zum ANS durch Vagusnerv-Injektionen (US-Patent #11,753,655). SJG und RMB haben Lizenzeinnahmen von Taysha Gene Therapies erhalten, und SJG hat Beratungseinnahmen von Taysha Gene Therapies erhalten.
Danksagungen
Wir möchten uns bei der UT Southwestern Animal Resource Center Facility für die Einrichtung von Operationsräumen für Ratten bedanken. Die Finanzierung dieser Arbeit wurde von den folgenden Quellen an die SJG zur Verfügung gestellt: NIH/NINDS R01 NS087175, Hannah's Hope Fund und Taysha Gene Therapies.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL BD Tuberculin Syringe with Detachable 25 G x 5/8". Needle | Becton, Dickinson and Company | SKU:309626 | Used to connect with curved needle to pull the vagus nerve and hold it at the time of injection. |
| 0.5% Bupivacaine Hydrochloride Injection | Hospira | NDC 0409-1162-19 | Local anesthetics used to anesthetize local tissue. |
| 100 mL 0.9% Sodium Chloride Irrigation USP | Stericare Solutions | Item #6240 | Normal saline, used to rehydrate rat and tissue. |
| 20 Blunt, Retractor Tips, 7.5 mm | Kent Scientific Corporation | Surgi 5018 | Used to pull apart and hold tissues at the time of surgery. |
| 3 mL BD-Luer-Lok Syringe, Sterile, Single Use | Becton, Dickinson and Company | SKU # 309657 | Used to inject saline in rat and fill the saline into the Polythene tubing. |
| AK-Fluor10% | Akorn | NDC 17478-253-10 | Fluorescein dye visible within the nerve. Used to track injection fidelity. |
| Animal Weighing Scale | Kent Scientific Corporation | SCL 4000 | Used to measure body weight of rat. |
| Ansell ENCORE Perry Style 42 PF Surgical Gloves | Ansell | ASTM D3577 | Sterilie glove, it is used at the time of surgery by a surgeon. |
| Artificial Tears Ointment 3.5g | Pivetal | NDC 46066-753-55 | Used in eyses to prevent excessive dryness of eyes. |
| Baby-Myxter Hemostat | Fine Science Tools | 13013-14 | Used to stop bleeding in case of emergency. Also used to bend the 25 G x 5/8" in needle. |
| BD Intramedic PE Tubing | Becton, Dickinson and Company | 14-170-12A | Used in the injection set up system to connect with Hamilton needle and NanoFil Needles. It also holds the injection mixture. |
| BD Precison Glide Needle, 25 G x 5/8" | Becton, Dickinson and Company | REF#305122 | Used to inject saline in rat, and to make a curved needle. |
| BD Precison Glide Needle, 27 G x ½" | Becton, Dickinson and Company | REF#301629 | Used to fill sterile saline into the BD Intradermic tubing. |
| Benchmark Accuris ”NextPette” Variable Volume Pipette Micro Starter Setincludes 4 pipettes: 10/20/200/1000 μL, plus stand | MilliporeSigma | BMSP7700S1 | Used to pippette sterile solution. |
| Betadine, Povidine Iodine 10% | Honestmed | 67618015017 | Used to disinfect the surgical area. |
| Carprofen Injectable solution 50 mg/mL | Supplied by Covtrus (6451506845) | SKU 591149 | In our case, we used diluted carprofen at the dose rate of 5 mg/kg provided by the Animal Resource Center of University of Texas Southwestern Medical Center. |
| Curved needle (custom made) | Becton, Dickinson and Company | REF#305122 | BD PrecisionGlide 25 G x 5/8" in needle is curved to 90 degrees with the help of a hemostat. The tip of the needle is made blunt. It needs to be sterilized before use. It is used to hook the vagus nerve and hold it at the time of separation and injection. |
| Dissecting microscope | Motic | SMZ-171-BLED (Binocular with Lights) | Used to magnify the crifical anatomical area at the time of vagus nerve separation, injeciton, and to check injection leakage. |
| Drape sheet | Dynarex | Reorder#8122 | Used as drape after sterilization. |
| Dukal Cotton Tip Applicators, Non-Sterile | Dukal | Item 9003 | Used to blunt separation of tissue, needs to sterilize before use. |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | Used to separate the left vagus nerve from common carotid artery. It is curved so easy to use. |
| Ethicon PDS II Undyed Monofilament Suture - SUTURE, 4/0 18 PDS II CLR MONO PS | Ethicon | VA - Z682G | Used in suturing the wound. |
| Ethilon Nylon Suture Black Monofilament | Ethicon | 1856G | Used in suturing the wound if non-absorbale suture is used. Also used to hook the rat tooth to fix nose inside the nose cone. |
| Fine Forceps - Mirror Finish | Fine Science Tools | 11412-11 | Used at the time of vagus nerve separation from the common carotid artery. This is straight. |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | Ued to cut tissue. |
| Hamilton cleaning solution | Hamilton | HT18311 | Used to clean the Hamilton after use. |
| Hamilton Needle, 27G, Small Hub RN Needle, 2”, PT3, 6/PK | Hamilton | 7762-01 | Used to connect BD Intramedic™ PE Tubing. |
| Hamilton Syringe , 710RN | Hamilton | 7638-01 | Used to hold drug at the time of vagus nerve injection. |
| Insulin Syringe | EXEL INT, Comfort point | REF 26027 | Used to inject carprofen and local anesthetics. |
| Lidocaine 2% Injection | Covetrus | Reorder#002468 | Used to mix with Bupivacaine and inject at the site of incision. |
| Luxol Fast Blue MBSN | Acros Organics | 212170250 | Dye visible within the nerve, used to mix with drug so that injection mixture is visible. |
| Micro Bead Sterilizer with Glass Beads | Fine Science Tools | Item No. 18090-46 | Used to sterilize surgical tools in between the rat surgery. |
| NanoFil Needles-NF35BV-2 | World Precision Instrument | NC9708956 | Used to inject drug - dye mixture inside the vagus nerve. |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | Used in wound suturing. |
| Parafilm M Laboratory Wrapping Film, 4 Inches x 125 Feet, 1 Roll per Box, 12 Count | Honestmed | PM#996 | Used to hold the aliquoted 5 uL of drug-dye mixture so that loading of drug-dye mixture into the BDTM intradermic tubing is accurate. |
| PDI Alcohol Prep Pads | Honestmed | NDC 10819-3914-2 | Used to disinfect the surgical area. |
| Premium Care Sterile Type VII Gauze Sponges, 8-Ply, 2" x 2" | Dukal | Item C5119 | Used as cushon under the neck of rat at the time of surgery. |
| Press’n Seal Cling Film | Glad | Used to cover a rat at the time of surgery like a drape. | |
| Rat Retractor Set | Kent Scientific Corporation | Surgi 5002 | Used to keep the incision open so that it is easy to separate the vagus nerve from the carotid artery. |
| RightTemp Jr. | Kent Scientific Corporation | 20.3 cm W x 25.4 cm L (8 in W x 10 in L), used to keep rat warm. | |
| S&T Forceps - SuperGrip Tips | Fine Science Tools | 00632-11 | Used at the time of suturing to hold tissue without damage. |
| S&T Suture Tying Forceps | Fine Science Tools | 00272-13 | Used to tight the suture. |
| Scalpel blade #15 | Fine Science Tools | 10015-00 | Used to make an incision in the skin at the ventral side of neck. |
| Scalpel Handle-#7 | Fine Science Tools | 10007-12 | Used to hold the scalpel blade. |
| Syringe Pump | KD Scientific | 78-81-8052GL | Serial #D107034, Model#LEGATO-180, is a programmable pump that can pump small volume of mixture under a program. |
| TipOne Filter Tip Refill Starter Systems | USA Scientific | Item #1120-3510 | Used to pipette the drug and dye mixture. |
| Vaporizer for Isoflurane, Funnel Filled | Kent Scientific Corporation | Vetflow 1231 | Used to anesthetize rats. |
| Vetbond Tissue Adhesives | 3M Science Applied to Life | ID B00016067 | Used to seal tissue at the site of cut wound if suturing is not perfect. |
| Wahl BravMini+ Professional Cordless Clipper Kit | Kent Scientific Corporation | CL7300-Kit | Used to cut hair of rat. |
Referenzen
- Fischer, G., et al. Direct injection into the dorsal root ganglion: Technical, behavioral, and histological observations. J Neurosci Methods. 199 (1), 43-55 (2011).
- O'donnell, M., Fontaine, A., Caldwell, J., Weir, R. Direct dorsal root ganglia (drg) injection in mice for analysis of adeno-associated viral (AAV) gene transfer to peripheral somatosensory neurons. J Neurosci Methods. 411, 110268 (2024).
- Puljak, L., Kojundzic, S. L., Hogan, Q. H., Sapunar, D. Targeted delivery of pharmacological agents into rat dorsal root ganglion. J Neurosci Methods. 177 (2), 397-402 (2009).
- Rueter, L. E., Kohlhaas, K. L., Curzon, P., Surowy, C. S., Meyer, M. D. Peripheral and central sites of action for a-85380 in the spinal nerve ligation model of neuropathic pain. Pain. 103 (3), 269-276 (2003).
- Ulusoy, A., et al. Neuron-to-neuron alpha-synuclein propagation in vivo is independent of neuronal injury. Acta Neuropathol Commun. 3, 13 (2015).
- Helwig, M., et al. Brain propagation of transduced alpha-synuclein involves non-fibrillar protein species and is enhanced in alpha-synuclein null mice. Brain. 139 (Pt 3), 856-870 (2016).
- Chiang, B., et al. Development of a novel suprachoroidal-to-optic-nerve (scone) drug delivery system. Drug Deliv. 31 (1), 2379369 (2024).
- Ferrari, L. F., Cunha, F. Q., Parada, C. A., Ferreira, S. H. A novel technique to perform direct intraganglionar injections in rats. J Neurosci Methods. 159 (2), 236-243 (2007).
- Yuan, X. M., et al. Rapid injection of lumbar dorsal root ganglia under direct vision: Relevant anatomy, protocol, and behaviors. Front. Neurol. 14, 1138933 (2023).
- Mason, M. R., et al. Comparison of AAV serotypes for gene delivery to dorsal root ganglion neurons. Mol Ther. 18 (4), 715-724 (2010).
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Ertl, H. C. J. Immunogenicity and toxicity of AAV gene therapy. Front Immunol. 13, 975803 (2022).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten