Method Article
ラットのための直接迷走神経注射プロトコル
要約
ラットにおける直接迷走神経注射のプロトコルを提示し、注射後の合併症なしに神経に直接薬物送達を可能にします。この方法は、自律神経系の操作を含む前臨床神経学的研究に適用されます。ラットや他の種の他の神経に対する直接神経注射に使用でき、必要な変更を加えることができます。
要約
中枢神経系への薬物送達を促進するための戦略と方法論は比較的豊富にあります。しかし、末梢神経系に直接薬物を送達することはあまり一般的ではなく、研究者を支援するために利用できる詳細な方法の発表も少ない。ここでは、迷走神経をモデル神経として、末梢神経系への薬物送達のための直接神経注入法について述べます。この方法は、左迷走神経を標的とすることにより自律神経系障害の治療に使用できますが、この一般的な注射方法は、わずかな変更を加えて他の神経の注射に外挿できます。この方法は、解剖顕微鏡下で麻酔をかけた成体ラットのマイクロサージェリーを含む手順に含まれるすべての重要なステップを説明しています。トラッキング色素の使用は、リアルタイムでの注入フィデリティのモニタリングを容易にするために説明されています。成功した注入と失敗した注入の図が示されています。適切に実施されれば、直接迷走神経注射は、ラットが十分に許容できる安全な方法で実施でき、分娩後の合併症はありません。例えば、外科医がこの方法の訓練を受けると、6匹中6匹のラットが合併症なく注射に成功しました。前臨床ラット研究のための直接神経注射のこの方法は、末梢神経に薬剤(遺伝子治療を含むがこれに限定されない)を送達することができる。
概要
正しい薬物投与方法の適用は、治療結果を成功に導くための重要な要素の1つです。中枢神経系(CNS)への治療薬の送達方法は豊富にありますが、直接神経注射による末梢神経系(PNS)の送達については、ごくわずかしか報告されていません。ラットの後根神経節(DRG)への注射などの直接神経注射は、疼痛メカニズム、薬物毒性、遺伝子導入1,2,3、および一般的な方法開発1,4の理解を深めるために、前臨床試験で試みられています。直接神経注射に関する追加の報告には、ラット5およびマウス6における脊髄神経注射4、坐骨神経注射1、迷走神経注射が含まれます。最近、ウサギの視神経乳頭への治療薬のより良い分布のために、上膜下注射の方法が提案されている7。
DRGは、DRG2の細胞体の感覚機能のために、アデノ随伴ウイルス(AAV)などの導入遺伝子をロードしたベクターの直接注入に理想的な場所と考えられています。DRG注射の外科的方法と非外科的方法の両方が記載されている1,8。しかし、DRG注射の非外科的方法との結果の一貫性について、物議を醸す結論が見つかっています1。椎弓部分切除術を含む外科的方法は、行動結果3を変更することなくラットへのDRG注射で100%成功することが示唆されており、マウス9では部分骨切り術を含む方法が提案されています。いくつかの研究は、ラットおよびマウスにおける前臨床遺伝子治療研究で使用されてきた薬物送達のDRG注射方法を報告している1,2,10。局所注射を含むベクターベースの遺伝子治療研究には、オフターゲット発現の減少、全身毒性の減少、ウイルス量と注射量の減少、免疫原性合併症のリスクの減少などの利点が含まれる場合があります11,12。
体の中で最も長い神経である坐骨神経に直接注入する方法は、ラットの大腿部中央部にある右の坐骨神経を露出させることによって試みられてきました。この方法は、マイクロプロセッサ制御の注入システムを備えたプルドガラスピペットを使用して、総量10μLの色素を1.2μL/minの流量で注入しました1。この実験では、DRGのレベルまで色素の分布が不足していることが示され、その分布は注入部位の周囲にほとんど限られていました。同様に、脊髄神経注射などの他の直接神経注射法も、ラットの適切な注入量と色素分布パターンを評価するために、染料を用いて試みられています。脊髄神経注射には2μLが最適であることが示唆されているが、DRG注射による色素3μLはラットの背根神経節と腹根神経節の両方に分布を示した1。マウスでのDRG注射の量は、ひずみと体のサイズに基づいて1.0μLから1.5μLに最適であると報告されています2,9。
ラット5 およびマウス6 において、ヒトα-シヌクレインの移行における神経損傷または細胞完全性の役割を評価するために、直接迷走神経注射法を用いた。同じ研究者グループによって実施されたこれら 2 つの研究では、頸部の左迷走神経に AAV ベクターを直接注入する簡単な方法が説明されています。ラットでは、この方法には、先端径 60 μm のガラス キャピラリーを使用して、5 μL のハミルトン シリンジで 0.5 μL/分の流速で 2 μL のベクターを注入しました。マウスでは、10 μL NanoFil シリンジ6 に取り付けた 36 G の鈍いスチール製ニードルを使用して、総量 750 nL のベクター溶液を 160 nL/分の流速で注入しました。これらの実験により、導入遺伝子はラットとマウスの橋と中脳の軸索に送達され、発現されることが示されました。同様に、左迷走神経の背側運動核は、導入遺伝子による陽性の免疫反応を示しました。これらの証拠は、直接迷走神経注射法が、細胞形質導入が脳のいくつかの場所に拡張され、迷走神経を介して軸索を投影する遺伝子治療における信頼できる方法である可能性があることを示しています。ただし、これらの方法では、注入忠実度を追跡するための色素の使用については言及されていません。
ここでは、前臨床試験の研究者に大部分適用可能な無毒の追跡染料を使用して左迷走神経に直接注射する方法について説明します。薬物送達に困難を引き起こす可能性のある潜在的な落とし穴と、それらを克服する方法について説明します。これらの状況は、配信が失敗する原因と成功させる方法を示すために、写真で示されています。
プロトコル
以下のプロトコルは、施設の倫理ガイドラインと施設動物管理および使用委員会(IACUC)からの承認に従って実施されます。
1. ハウジングの準備
注:このプロトコルは、少なくとも2か月齢の成体ラット用です。より小さな動物(マウスや若いラットを含む)も可能ですが、推奨されず、かなり難しくなります。
- 迷走神経手術の48時間前に、湿ったチャウまたはその他の柔らかい食品(獣医用回復ジェル)を提供します。.手術後は動物が食べるのが難しくなる可能性があるため、手術前にこれらのアイテムを動物に紹介することで、これらのアイテムの味に慣れ親しんでもらい、食べる意欲を誘発してください。
- イエネズミは、手術の少なくとも1週間前、および手術後1週間にケージ内で個別に飼育します。これにより、一人でいることのストレスに順応し、同腹仔による手術後の傷の引っ掻き傷を防ぐことができます。
2. 手術用品とスペースの準備
- 事前に必要なすべてのアイテムのリストを作成し、すべてのアイテムが手術に使用できることを再確認してください。
- 手術前に、適切な滅菌方法ですべてのアイテムを滅菌してください。
- 解剖顕微鏡の下に無菌手術スペースを設置します。手術中にラットを暖かく保つために、顕微鏡の下に加熱パッドを置きます。
- すべての手術材料を滅菌ドレープの手術台に置きます。解剖顕微鏡下で手術のための十分なスペースを確保してください。顕微鏡の焦点が最適で、神経を視覚化するために手術領域を包含していることを確認してください。
- シリンジポンプを手術段階の近くに置き、チューブの長さが注射部位に到達するのに十分になるようにします。
- 手術器具を外科医の利き手の側面に置きます。
3. 候補薬とトラッキング色素の混合物を調製する
- 推奨希釈液中で必要な濃度になるように候補薬剤が希釈され、色素と混合した薬剤5μLで必要な量の候補薬剤が送達されることを確認してください。直接迷走神経法による注射の最大量は5μLにすることをお勧めします(トラッキング色素を含む、ステップ3.2を参照)。
- 適合色素を候補薬剤と混合することで、注射のフィデリティをリアルタイムで追跡できます。例えば、最終濃度が1%のルクソールFast Blueまたは0.002%のフルオレセインが適合する色素です。
注意:染料と候補薬物混合物中の最適な濃度で染料を使用してください。混合物中の色素の濃度が低すぎると、注入を追跡するために目立たない場合があります。染料の濃度が高すぎると、混合物が濃すぎて粘度が高くなり、注入針が詰まる可能性があります。
4. 候補薬剤と染料混合物をチューブに装填します。
- プランジャーを取り外した100 μLガラスシリンジを27 G針に接続します。
- 約45cmの滅菌済みポリエチレンチューブの一端を27Gの針に接続します。
- 3mLのプラスチックシリンジを取り、27Gの針で取り付けます。シリンジに約0.5mLの0.9%生理食塩水をロードします。
- ポリエチレンチューブに開放端から0.9%生理食塩水を充填して、チューブの全長とガラスシリンジのバレル全体にオーバーフローするまで充填します。
注意: 気泡がチューブ内に閉じ込められないようにすることが重要です。 - 3mLのシリンジと針を取り外して廃棄します。
- シリンジプランジャーをガラスシリンジのバレルに挿入し、バレルの中央まで少し前方に押し込みます。
- ガラスシリンジをシリンジポンプに入れます。
- シリンジポンプを使用してプランジャーを少し後ろに引き、チューブの長さの開放端に約1.5cmの空隙を作ります。
- 少なくとも 5 μL の色素と候補薬物混合物を 10 μL のマイクロピペットでピペットで取り、滅菌したパラフィルムに滴下します。
- シリンジポンプを介してプランジャーを引き戻すことにより、候補薬物混合物をチューブに引き込みます。.0.9%生理食塩水と注入液の間に気泡を維持しますが、それ以外の場合は、注入液内に気泡を閉じ込めないでください。チューブ内の注入混合物のレベルをマーカーでマークします。
注:候補の薬物-染料混合物とチューブ内の滅菌生理食塩水との間のエアギャップは、2つの溶液の混合を防ぐために重要です。 - 35Gの針をチューブに取り付けます。針が緩まないように、針が緩まないように、他のものに触れたりせず、滅菌されたままになるように、針を手術段階の清潔な面に固定します。
5.注射針のプライミング
- シリンジポンププログラムを0.5μL / min分分に分注するように設定します。
- 注射液が針の先端から出始めるまで、シリンジポンプを約10〜15秒間始動します。チューブと注射針の接合部(またはシリンジ、チューブ、または針の長さに沿った他の場所)に漏れのない針の先端に少量の混合物がある場合は、セットアップが正しいことを示しています。
注意: 針の先端に小さな液滴が見られない場合は、針が詰まっていることを示しています。候補薬剤と染料混合物の粘度が高い、システム内に過剰な空気が閉じ込められている、ガラスシリンジがシリンジポンプ内に適切に装着されていないなどにより、針の詰まりが発生する可能性があります。図 1 の例については、ニードルとチューブの間の接合部での漏れのファイルを参照してください。プライミングは、針が遮られず、神経内の注射がスムーズに通過するかどうかを特定するのに役立つため、非常に重要です。
6. 手術のためのラットの準備
- ラットの体重を取得して、必要な鎮痛薬の用量を計算します。例えば、カルプロフェンはラットに5mg/kgの用量で皮下投与されます。
注:カルプロフェンは、注射前に4°Cで保存することをお勧めします。 - 約2〜3分間の麻酔導入のために3%〜4%の流量を使用して、イソフルラン気化器でラットに麻酔をかけます。麻酔の維持のために、イソフルランの流量を約1.75%〜2%に減らします。
- ラットを脱毛と部位の準備のためのセットアップを備えた別のテーブルに移します。このテーブルが手術スペースに近いことを確認してください。
- ラットの両目に人工涙液軟膏を塗布して、過度の乾燥を防ぎます。
- 承認された施設の動物プロトコルに従って鎮痛薬を投与し、ラットが意識を取り戻したときの痛みを制御します。
- 頸部の首の腹側にあるバリカンで手術部位を剃ります。あごから胸骨までの両側の正中線から垂直な距離を約2cmまで剃ります。
- 70%エチルアルコールと10%ベタジンでその領域を滅菌し、アルコール綿棒とポビドンヨードで交互に3回拭きます。領域の中心から外側に向かって円形に拭きます。
- ラットを顕微鏡下で仰臥位の手術段階に移します。顕微鏡の焦点を調整して、頸部の手術領域を視覚化します。
7. 候補薬を左迷走神経に直接注入するラット手術を行う(図2、 図3、 図4)
注:この部分では、外科医を補助するために2人目の人が必要になります。
- ラットを加熱パッドの上に仰臥位に置き、取り付けられたライトに関連付けられた解剖顕微鏡の下に置きます。
- ラットの前顎上顎の歯を非吸収性縫合糸で引っ掛け、縫合糸の開放端を鼻円錐の内側に固定して、麻酔中、ラットの鼻孔が常に鼻円錐の内側にくるようにします。
- ラットの頭が右利きの外科医の左側(または左利きの外科医の右側)になるようにラットを配置します。この位置では、外科医の前面はラットの体に対して垂直です。滅菌ゲージのクッションを首の下に置き、ラットの頸部の角度を調整して、頸部がまっすぐになるようにします。これにより、左迷走神経の位置を特定し、注射を行うことが容易になります。
- 滅菌されたドレープでラットの全身をドレープし、手術スペースを開いたままにします。
- エラストマー付きの4つの磁気固定具で4つのリトラクターピンを個別に固定し、固定具を手術段階の四隅に配置します。
- 切開が行われる頸部の正中線に局所麻酔薬を表皮に注入します。例えば、リドカインとブピバカインの混合物が通常使用されます。
- 頸部の首の腹側にメスの刃を使用して、あごと胸骨の間の正中線に約2cmの長さの縦方向の皮膚切開を行います(図3A)。
- 滅菌した綿の先端で皮膚の切り口を鈍く分離します。
- リトラクターチップの助けを借りて、切開部位から反対方向に皮膚の端を引っ込めます。
- フェイシアをコットンチップで分離して、さらに深く掘り下げます。唾液腺を外側に向かって押します。
- 胸骨乳突起筋を綿の先端で分離し、ピンで脇に引っ込めます。胸骨乳様突起筋の分離が広く進むと、気管が中央に現れ、胸骨舌骨筋で覆われます(図3B)。
注意: 気管に圧力をかけないように注意してください。 - ラットの気管の左側で組織分離を進め、左迷走神経と一緒に走る総頸動脈を含む頸動脈鞘が現れるまで進めます。
- 顕微鏡下で頸動脈を傷つけないように注意しながら、細かい鉗子で頸動脈鞘に小さな点穴を慎重に開けます。左迷走神経を細い鉗子で総頸動脈から分離します。
注:手術領域は解剖学的に重要です。頸動脈の壁は厚く滑りやすく、傷つきにくいですが、細い鉗子の鋭い先端が傷つけたり、出血が起こることがあります。同時に、神経を傷つけないように注意を払います。 - 神経が鉗子によって動脈から分離されたら、その穴から1mLの注射器に取り付けられた25Gの湾曲した針を使用して「フック」し、非利き手で神経を保持します(図4A)。
注:湾曲した針の先端は、神経や動脈を傷つけないように鈍く作られています。針先の曲率の角度は、止血器を使用して約90°にカスタムメイドされています(図2)。 - 利き手で、候補薬と染料の混合物を装填した針を持ち、針の斜角が上を向くように神経が走るのと同じ方向に神経を優しく刺します。
- 簡単に刺すには、25Gフックを使用してそっと引っ張って神経をまっすぐに保ちます。針を神経に挿入し、針を迷走神経と平行に保ちながら、0.5cm以上前進します。その後、神経の内側に約0.4〜0.5cmの針が残るように、少し後ろに引きます。
注:針の角度は、反対側に通らずに神経の内側を貫通するのに十分なほど浅くする必要があります。
- 簡単に刺すには、25Gフックを使用してそっと引っ張って神経をまっすぐに保ちます。針を神経に挿入し、針を迷走神経と平行に保ちながら、0.5cm以上前進します。その後、神経の内側に約0.4〜0.5cmの針が残るように、少し後ろに引きます。
- プライミング時に針が神経の外側に遮られていない場合があるかもしれませんが、候補の薬剤と染料の混合物は神経内をスムーズに通過しません。この状況を回避するには、神経刺し傷の数を1本の針で3回以下に制限します。針が鈍くなると、詰まりや注射不良の可能性が高まります。
- 針が完全に神経の内側にあることを確認してください。位置を動かさないようにし、シリンジポンプをオンにします。
注:注射部位で注意深くチェックして、候補の薬物と染料の混合物が神経から逆流していないことを確認してください。. - 注入が進行している間、注入が神経内に残り、スムーズに流れていることを常に調べます。輸液チューブに付けられたマークを使用して、開始点からの薬物-染料混合物の動きを監視します。.
- 候補の薬剤と染料の混合物がスムーズに流れない場合は、針を引き抜き、プライミングステップ(ステップ5.2)を繰り返します。次に、針を神経に再挿入し、注入を再開します。
- 神経は染料の色を発達させ始めます(図4B)。0.5 μL/minで10分間注入を続け、候補薬剤-染料混合物の5 μLすべてを注入します。
注:過度の乾燥や損傷を防ぐために、必要に応じて少量の温かい0.9%滅菌生理食塩水で露出した組織を洗浄することをお勧めします。 - 5 μL を注入し、シリンジポンプを停止した後、針をさらに 1 分間所定の位置に保持して、候補となる薬剤と色素の混合物をすべて注入部位から広げます。針を外します。
- 25Gの湾曲した針を取り外します。滅菌コットンチップを使用して、ティッシュをゆっくりと元の位置に戻します。リトラクターチップを取り外します。
- 非吸収性縫合糸で傷口を閉じます(吸収性縫合糸も使用できます)。傷を完全に閉じるために、必要に応じてステッチの間に少量のティッシュ接着剤を塗布します。
8. ラットの術後ケア
- 創傷を閉じた後、約3mLの0.9%温かい生理食塩水を皮下に注入します。.これにより、ラットはすぐに水分を補給することができます。
- 麻酔から正常な状態に完全に回復するまで、ラットを熱源に置きます。リカバリーの過程で異常が観察されたものはすべて書き留めておきます。
注:神経注射の施術に時間がかかる場合、回復期間が長くなる可能性があります。 - ケージの床に湿った餌を付けて、ラットをホームケージに移します。常に水が利用可能であることを確認してください。ラットが寒さを感じていないことを確認するために、術後にラットを約2時間観察します。
注意: 寒く感じる場合は、ラットをさらに数時間熱源に置きます。 - 手術後12時間、24時間、36時間、48時間、および72時間のラットを、観察のメモを書いた状態で監視します。痛みを制御するために、承認された施設の動物プロトコルに従って鎮痛薬を繰り返します。例えば、カルプロフェンは5mg/kgの割合で24時間間隔で2回皮下投与されます。ラットに痛みが48時間以上残っている場合は、獣医師に相談してください。
- ラットの状態に基づいて、24時間で約3 mLの0.9%温かい生理食塩水の皮下注射を繰り返します。.
- 傷の評価を続けます。傷が乾いていて、治癒過程にあることを確認してください。
注:ラットの不活動と鈍さを伴う創傷の発赤、腫れ、痛みを伴う状態は、創傷の炎症の兆候である可能性があり、追加の獣医師の診察が必要になる場合があります。.痛みのあるネズミは、背中が丸まったり、毛皮がフリルになったり、目が赤くなったり、不活発な状態を示します。通常、ケージの隅にあります。 - 傷が治ったら2週間以内に非吸収性縫合糸を取り出します。
結果
本研究では、6匹の成体ラット(雄3匹、雌3匹)を使用しました。6匹のうち、1匹のラットを複数回注射して、注射部位の周りの色素の拡散を示す失敗注射の状態を示しました図 5A。他のすべてのラットは、 図4B および 図5Bに示すように、滑らかな注射および神経染色を示した。
図1は、注射針とチューブの設定が正しくない場合に、針とチューブの間に色素が漏れた状況を示しています。この実験で使用した1%染料は厚すぎませんが、シールの漏れにより、注射針への染料の通過に失敗しました。この種の問題は、プライミングの過程で簡単に特定できます(ステップ5.2を参照)。この状態を解決するには、針とチューブの間の接続が正しく行われているかどうかを確認します。チューブに約3mmの針が挿入されていることを確認し、チューブと針のサイズが正しいことを確認してください。特に気泡が発生した場合は、接続不良を修正した後、プライミングを繰り返します(手順5.2を繰り返します)。
図 2 は、25 G の湾曲した鈍い針を 1 mL のプラスチックシリンジに取り付けたセットアップを示しています。針の先端を鈍くし、針ホルダーで約90°の角度に曲げます。使用前に滅菌し、手術時に1mLの滅菌シリンジに装着します。この注射器に取り付けられた針は、ステップ7.14で説明されているように、左迷走神経を総頸動脈から分離するために使用され、 図4Aに示すように、注射時にそれをフックして保持します。
図3は、ラットの腹側頸部にメスの刃を使用して正中線切開を行い、皮膚層を切断する無菌手順の設定を示しています。ラットを滅菌したドレープで覆った後、皮膚層を切断するために約2cmの長さの水平切開が行われます( 図3A)。皮膚が切断されると、切断された皮膚の2つの端は、エラストマーで接続されたピンの助けを借りて反対側に引っ張られます。カットされたエッジが反対側に牽引されることで、より深く入るためのより広いスペースが生まれます。図 3Bに示すように、皮膚の下の顔面と胸骨乳突起筋の層は、滅菌された綿の先端によって鈍く分離されています。ステップ7.12で説明したように、左迷走神経が総頸動脈鞘内の気管の左側に現れると、 図4Aのように細い鉗子で分離され、フックされます。
図4は、左迷走神経が総頸動脈から分離し、注射の準備ができている状態を示しています。外科医は利き手(右手)で注射針を保持し、もう一方の手(左)は1mL注射器に取り付けられた湾曲した針の助けを借りてラットの左迷走神経を保持しています(図4A)。左迷走神経は総頸動脈から十分に分離されており、そこに注入するのに十分なほど伸びています。神経の右側にある点線の長方形は、胸骨舌骨筋で覆われた気管の領域を示しています。図4Bは、色素の拡散なしに成功した注射後の青色の染料の色で着色された左迷走神経を示しています。白い点線の長方形は気管の領域です。Figure 4Bは、注射後の神経とその周囲の鮮明な画像を示すために、Figure 4Aよりも引き伸ばされています。
図5は、ラットの左迷走神経への注射の失敗例と成功した例の両方を示しています。これらの注射では、5 μL の 1% 色素を 0.5 μL/分の流量で神経に使用しました。 図5A は、色素が神経の内部だけに限定されないため、注射の失敗状態を示しています(挿入図を参照)。むしろ、染料は神経の周りの領域全体に拡散しています。また、実際の神経の注入部位は明確ではありません。これは、注射が神経の内部になく、かなりの量の注射量が漏れ出し、周囲に拡散したことを示唆しています。
同様の状況は、針を神経に再挿入または再配置する必要がある状況でも見られます。これは、針が詰まって混合物を通過しない場合、または針が鈍くなり、神経に簡単に通過できない場合に必要になることがあります。 図5Aに示す例では、その領域に蓄積された少量の血液は、その領域内の小さな血管が誤って破裂したことを示しています。これは、神経分離中にその領域の血管が損傷したときに発生します。
図5B は、神経への注射が成功したことを示しています。それは、周囲から特徴的な、注射の明確な点とよく染色された神経を示しています。神経の外側の小さな染料染色領域は、プライミング後に存在する針の先端にある少量の染料溶液によるものです(挿入図を参照)。プライミングは、神経を刺す直前に針の閉塞をテストするために行われます。

図1:針とチューブの間のシール不良による染料(矢印)の漏れ。 このタイプのエラーは、チューブが針の先端に正しく取り付けられていない場合に発生します。このような漏れを防ぐために、チューブには針先を約3mm以上挿入し、正しいサイズの針とチューブを使用します。 この図の拡大版を表示するには、ここをクリックしてください。

図2:約90°の角度でカスタムカーブした25Gの鈍い針を1mLのプラスチックシリンジに取り付けたもの。 この図の拡大版を表示するには、ここをクリックしてください。
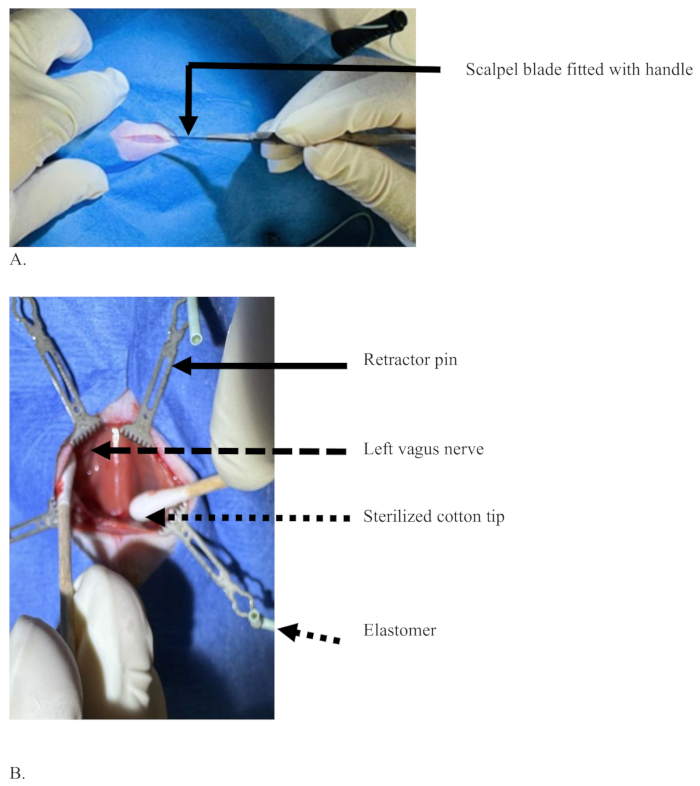
図3:ラットの腹側頸部にメスの刃で正中線を切開し、皮膚層を切断します。 (A)皮膚のみを切開したが血液はなく、外科医の利き手でハンドルを保持したメスの刃。(B)滅菌された綿の先端(点線の矢印)が組織を分離して左迷走神経を露出させ(破線の矢印)、エラストマーで支えられたピン(実線の矢印)の助けを借りて組織を引き離します(短い点線の矢印)。 この図の拡大版を表示するには、ここをクリックしてください。
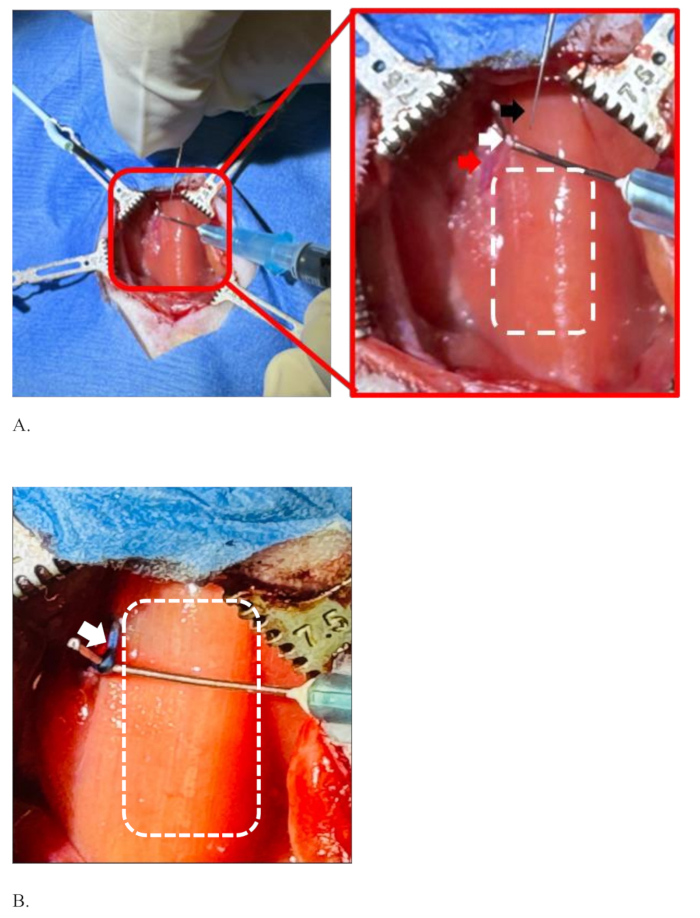
図4:注射前と注射後に左迷走神経を総頸動脈から分離し、それを保持 した状態の図(A)注射針(黒矢印)、左迷走神経(白矢印)、総頸動脈(赤矢印)、胸骨舌骨筋で覆われた気管の領域を示す点線の長方形。(B)青色の左迷走神経、色素の拡散を伴わない注射成功後の色素の色(白矢印)、および気管の領域(点線の長方形)。 この図の拡大版を表示するには、ここをクリックしてください。
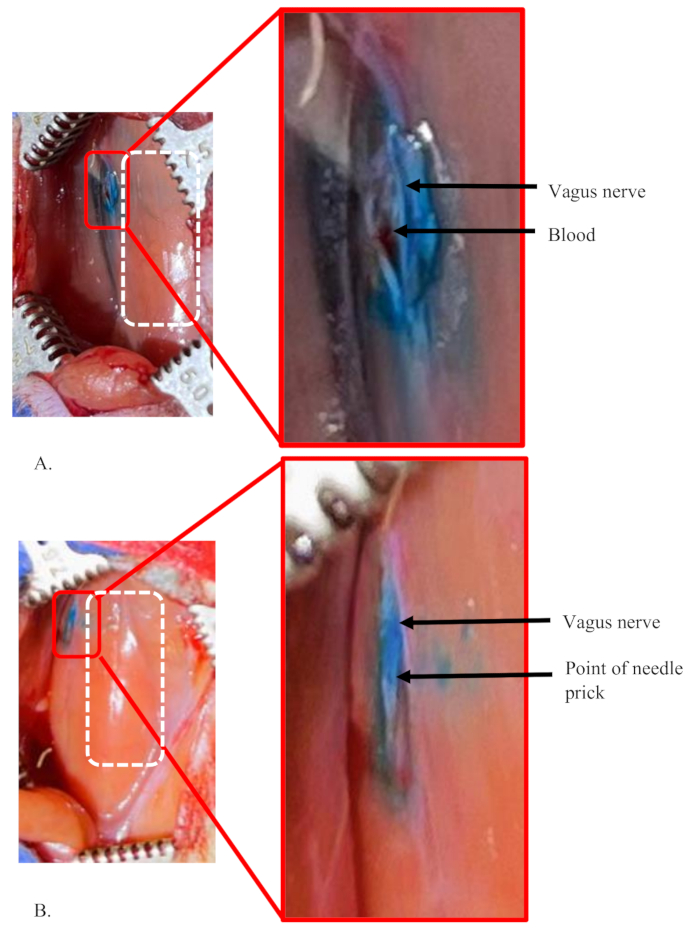
図5:ラットの左迷走神経への注射の失敗例と成功した注射の例(A,B)1%濃度の5μLの染料をラットの左迷走神経に注射した。白い破線の長方形は、両方のパネルの気管の面積を示しています。(A)色素を示す失敗状態は、神経の内部のみに限定されず、処置中にかなりの量の色素溶液の損失を示唆しています。その領域に蓄積された少量の血液は、神経分離中に損傷を受けた領域の小さな血管が誤って破裂したことを示しています。(B)神経への成功した注射。単回注射の明確な点とよく染色された神経を示しており、周囲とは特徴的です。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
左迷走神経への直接注射の方法は、ラットの手術後の合併症なしに安全に行うことができます。迷走神経への薬物送達は、自律神経系(ANS)を標的とするために使用できます。これには、練習と中等度から高度の外科的スキルを必要とする特定の重要なステップが含まれます。
この外科的処置には、ラットのバランスの取れた全身麻酔が必要です。外科医は、特に老齢ラットにおいて、より良い回復のために麻酔薬の曝露を制限するために、より短い期間で手術を完了することを目指しています。この方法はまた、注射と術後の回復を成功させるために、一定レベルの無菌手術スキルを持つ訓練を受けた外科医を前提としています。迷走神経の解剖学的位置は、重要な位置に深く座っています13。左迷走神経は左総頸動脈と並んで走っているため、分離および注入時に動脈と神経の両方に損傷を与えるリスクがあります。総頸動脈から神経を正しく分離するには、高度な練習とスキルが必要です。手術中は、針を神経の内側に保ちながら、適切な角度で保持する必要があります。
ラット5 とマウス6 の直接迷走神経処置の発表例は、同じ研究者グループによる2つだけですが、どちらの研究も手順の実施方法に関する詳細な説明を欠いています。神経を注入するために35Gの針を使用することは便利であり(すなわち、針を準備するために特別な機器は必要なかった)、結果は他のグループが使用したプルガラスマイクロピペットを使用した場合と比較して一貫していた。坐骨神経などの他の神経への注射と比較して、迷走神経はサイズが比較的小さく、一度に保持できる薬物と染料の混合物の量は少なくなります。10μLの色素溶液を坐骨神経に注入した発表済みの研究では、色素の拡散は、DRG1に到達することなく、注射部位から神経内の全長2.3cmに達しました。迷走神経は、この注射プロトコルを使用して、最大5μLの量の薬物-染料混合物を安全に吸収できます。
この注射には解剖顕微鏡が必要です。注入液に色素を使用することは絶対に必要というわけではありませんが、処置中にリアルタイムで注入フィデリティを可視化できるようにすることを強くお勧めします。同時に、候補薬剤と色素混合物の色素濃度が高すぎると、注射時に針が詰まってしまう原因となります。この方法では、注射の刺し傷の数を1本の針で制限することも重要です。針の鈍化を防ぐために、3〜5回の神経刺し傷(針あたり3匹のラットに相当)以上に同じ針を使用しないことをお勧めします。針の再利用(オプション)には、70%アルコールで3回拭いて動物間で滅菌する必要があります。
直接迷走神経注射を利用した文献の研究の例は、特にげっ歯類の場合、非常に限られています5,6。いくつかの研究では、マウスとラットに注射する方法と量を変更した直接DRGおよびその他の神経注射が報告されています1,2,9。本方法は、候補薬物または他の薬剤を迷走神経を通じてANSの側面を標的とするアプローチとして非常に重要である。迷走神経は最も長い脳神経であり、ほぼすべての内臓を神経支配して生理機能を調節します。したがって、このアプローチの適用は、ラットを用いた遺伝子治療を含むがこれに限定されない前臨床研究において、現在および将来にわたって重要性を有する。さらに、この方法は、比較的わずかな変更を加えて、坐骨神経などの他の神経注射に外挿することができます。
要するに、直接迷走神経注射法は、ANS関連のラットモデル研究のための薬物投与の潜在的な経路です。私たちの経験では、注射後1年以上維持された動物は長期的な合併症を発症していないため、手順自体は長期的な副作用を引き起こしません。ただし、これにはいくつかの重要な手順も含まれており、げっ歯類の手術では実践が必要です。これらすべての重要な点は、テキストのこの詳細な段階的なプロトコルに慎重に含まれています。特に注意が払われているのは、1)迷走神経の総頸動脈からの迷走神経の分離、2)注射期間中、針挿入時および挿入後の神経を安定した位置に保持すること、および3)針が詰まることなく薬物と染料の混合物をスムーズに送達することである。広範な外科的実践は、これらすべての外科的問題を克服するための最良の方法です。
開示事項
著者NRとXCには利益相反はありません。RMBとSJGは、迷走神経注射によるANSへの遺伝子導入に関連する知的財産の発明者です(米国特許#11,753,655)。SJGとRMBはTaysha Gene Therapiesからロイヤリティ収入を受け取っており、SJGはTaysha Gene Therapiesからコンサルティング収入を得ています。
謝辞
ラットの手術スペースを手配してくださったUTサウスウェスタンアニマルリソースセンター施設に感謝します。この研究のための資金は、SJGに対してNIH/NINDS R01 NS087175、Hannah's Hope Fund、Taysha Gene Therapiesから提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL BD Tuberculin Syringe with Detachable 25 G x 5/8". Needle | Becton, Dickinson and Company | SKU:309626 | Used to connect with curved needle to pull the vagus nerve and hold it at the time of injection. |
| 0.5% Bupivacaine Hydrochloride Injection | Hospira | NDC 0409-1162-19 | Local anesthetics used to anesthetize local tissue. |
| 100 mL 0.9% Sodium Chloride Irrigation USP | Stericare Solutions | Item #6240 | Normal saline, used to rehydrate rat and tissue. |
| 20 Blunt, Retractor Tips, 7.5 mm | Kent Scientific Corporation | Surgi 5018 | Used to pull apart and hold tissues at the time of surgery. |
| 3 mL BD-Luer-Lok Syringe, Sterile, Single Use | Becton, Dickinson and Company | SKU # 309657 | Used to inject saline in rat and fill the saline into the Polythene tubing. |
| AK-Fluor10% | Akorn | NDC 17478-253-10 | Fluorescein dye visible within the nerve. Used to track injection fidelity. |
| Animal Weighing Scale | Kent Scientific Corporation | SCL 4000 | Used to measure body weight of rat. |
| Ansell ENCORE Perry Style 42 PF Surgical Gloves | Ansell | ASTM D3577 | Sterilie glove, it is used at the time of surgery by a surgeon. |
| Artificial Tears Ointment 3.5g | Pivetal | NDC 46066-753-55 | Used in eyses to prevent excessive dryness of eyes. |
| Baby-Myxter Hemostat | Fine Science Tools | 13013-14 | Used to stop bleeding in case of emergency. Also used to bend the 25 G x 5/8" in needle. |
| BD Intramedic PE Tubing | Becton, Dickinson and Company | 14-170-12A | Used in the injection set up system to connect with Hamilton needle and NanoFil Needles. It also holds the injection mixture. |
| BD Precison Glide Needle, 25 G x 5/8" | Becton, Dickinson and Company | REF#305122 | Used to inject saline in rat, and to make a curved needle. |
| BD Precison Glide Needle, 27 G x ½" | Becton, Dickinson and Company | REF#301629 | Used to fill sterile saline into the BD Intradermic tubing. |
| Benchmark Accuris ”NextPette” Variable Volume Pipette Micro Starter Setincludes 4 pipettes: 10/20/200/1000 μL, plus stand | MilliporeSigma | BMSP7700S1 | Used to pippette sterile solution. |
| Betadine, Povidine Iodine 10% | Honestmed | 67618015017 | Used to disinfect the surgical area. |
| Carprofen Injectable solution 50 mg/mL | Supplied by Covtrus (6451506845) | SKU 591149 | In our case, we used diluted carprofen at the dose rate of 5 mg/kg provided by the Animal Resource Center of University of Texas Southwestern Medical Center. |
| Curved needle (custom made) | Becton, Dickinson and Company | REF#305122 | BD PrecisionGlide 25 G x 5/8" in needle is curved to 90 degrees with the help of a hemostat. The tip of the needle is made blunt. It needs to be sterilized before use. It is used to hook the vagus nerve and hold it at the time of separation and injection. |
| Dissecting microscope | Motic | SMZ-171-BLED (Binocular with Lights) | Used to magnify the crifical anatomical area at the time of vagus nerve separation, injeciton, and to check injection leakage. |
| Drape sheet | Dynarex | Reorder#8122 | Used as drape after sterilization. |
| Dukal Cotton Tip Applicators, Non-Sterile | Dukal | Item 9003 | Used to blunt separation of tissue, needs to sterilize before use. |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | Used to separate the left vagus nerve from common carotid artery. It is curved so easy to use. |
| Ethicon PDS II Undyed Monofilament Suture - SUTURE, 4/0 18 PDS II CLR MONO PS | Ethicon | VA - Z682G | Used in suturing the wound. |
| Ethilon Nylon Suture Black Monofilament | Ethicon | 1856G | Used in suturing the wound if non-absorbale suture is used. Also used to hook the rat tooth to fix nose inside the nose cone. |
| Fine Forceps - Mirror Finish | Fine Science Tools | 11412-11 | Used at the time of vagus nerve separation from the common carotid artery. This is straight. |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | Ued to cut tissue. |
| Hamilton cleaning solution | Hamilton | HT18311 | Used to clean the Hamilton after use. |
| Hamilton Needle, 27G, Small Hub RN Needle, 2”, PT3, 6/PK | Hamilton | 7762-01 | Used to connect BD Intramedic™ PE Tubing. |
| Hamilton Syringe , 710RN | Hamilton | 7638-01 | Used to hold drug at the time of vagus nerve injection. |
| Insulin Syringe | EXEL INT, Comfort point | REF 26027 | Used to inject carprofen and local anesthetics. |
| Lidocaine 2% Injection | Covetrus | Reorder#002468 | Used to mix with Bupivacaine and inject at the site of incision. |
| Luxol Fast Blue MBSN | Acros Organics | 212170250 | Dye visible within the nerve, used to mix with drug so that injection mixture is visible. |
| Micro Bead Sterilizer with Glass Beads | Fine Science Tools | Item No. 18090-46 | Used to sterilize surgical tools in between the rat surgery. |
| NanoFil Needles-NF35BV-2 | World Precision Instrument | NC9708956 | Used to inject drug - dye mixture inside the vagus nerve. |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | Used in wound suturing. |
| Parafilm M Laboratory Wrapping Film, 4 Inches x 125 Feet, 1 Roll per Box, 12 Count | Honestmed | PM#996 | Used to hold the aliquoted 5 uL of drug-dye mixture so that loading of drug-dye mixture into the BDTM intradermic tubing is accurate. |
| PDI Alcohol Prep Pads | Honestmed | NDC 10819-3914-2 | Used to disinfect the surgical area. |
| Premium Care Sterile Type VII Gauze Sponges, 8-Ply, 2" x 2" | Dukal | Item C5119 | Used as cushon under the neck of rat at the time of surgery. |
| Press’n Seal Cling Film | Glad | Used to cover a rat at the time of surgery like a drape. | |
| Rat Retractor Set | Kent Scientific Corporation | Surgi 5002 | Used to keep the incision open so that it is easy to separate the vagus nerve from the carotid artery. |
| RightTemp Jr. | Kent Scientific Corporation | 20.3 cm W x 25.4 cm L (8 in W x 10 in L), used to keep rat warm. | |
| S&T Forceps - SuperGrip Tips | Fine Science Tools | 00632-11 | Used at the time of suturing to hold tissue without damage. |
| S&T Suture Tying Forceps | Fine Science Tools | 00272-13 | Used to tight the suture. |
| Scalpel blade #15 | Fine Science Tools | 10015-00 | Used to make an incision in the skin at the ventral side of neck. |
| Scalpel Handle-#7 | Fine Science Tools | 10007-12 | Used to hold the scalpel blade. |
| Syringe Pump | KD Scientific | 78-81-8052GL | Serial #D107034, Model#LEGATO-180, is a programmable pump that can pump small volume of mixture under a program. |
| TipOne Filter Tip Refill Starter Systems | USA Scientific | Item #1120-3510 | Used to pipette the drug and dye mixture. |
| Vaporizer for Isoflurane, Funnel Filled | Kent Scientific Corporation | Vetflow 1231 | Used to anesthetize rats. |
| Vetbond Tissue Adhesives | 3M Science Applied to Life | ID B00016067 | Used to seal tissue at the site of cut wound if suturing is not perfect. |
| Wahl BravMini+ Professional Cordless Clipper Kit | Kent Scientific Corporation | CL7300-Kit | Used to cut hair of rat. |
参考文献
- Fischer, G., et al. Direct injection into the dorsal root ganglion: Technical, behavioral, and histological observations. J Neurosci Methods. 199 (1), 43-55 (2011).
- O'donnell, M., Fontaine, A., Caldwell, J., Weir, R. Direct dorsal root ganglia (drg) injection in mice for analysis of adeno-associated viral (AAV) gene transfer to peripheral somatosensory neurons. J Neurosci Methods. 411, 110268 (2024).
- Puljak, L., Kojundzic, S. L., Hogan, Q. H., Sapunar, D. Targeted delivery of pharmacological agents into rat dorsal root ganglion. J Neurosci Methods. 177 (2), 397-402 (2009).
- Rueter, L. E., Kohlhaas, K. L., Curzon, P., Surowy, C. S., Meyer, M. D. Peripheral and central sites of action for a-85380 in the spinal nerve ligation model of neuropathic pain. Pain. 103 (3), 269-276 (2003).
- Ulusoy, A., et al. Neuron-to-neuron alpha-synuclein propagation in vivo is independent of neuronal injury. Acta Neuropathol Commun. 3, 13 (2015).
- Helwig, M., et al. Brain propagation of transduced alpha-synuclein involves non-fibrillar protein species and is enhanced in alpha-synuclein null mice. Brain. 139 (Pt 3), 856-870 (2016).
- Chiang, B., et al. Development of a novel suprachoroidal-to-optic-nerve (scone) drug delivery system. Drug Deliv. 31 (1), 2379369 (2024).
- Ferrari, L. F., Cunha, F. Q., Parada, C. A., Ferreira, S. H. A novel technique to perform direct intraganglionar injections in rats. J Neurosci Methods. 159 (2), 236-243 (2007).
- Yuan, X. M., et al. Rapid injection of lumbar dorsal root ganglia under direct vision: Relevant anatomy, protocol, and behaviors. Front. Neurol. 14, 1138933 (2023).
- Mason, M. R., et al. Comparison of AAV serotypes for gene delivery to dorsal root ganglion neurons. Mol Ther. 18 (4), 715-724 (2010).
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Ertl, H. C. J. Immunogenicity and toxicity of AAV gene therapy. Front Immunol. 13, 975803 (2022).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved