Method Article
Protocolo de inyección directa del nervio vago para ratas
En este artículo
Resumen
Presentamos un protocolo para la inyección directa del nervio vago en ratas, que permite la administración del fármaco directamente en el nervio sin complicaciones posteriores a la inyección. Este método se aplica a los estudios neurológicos preclínicos que involucran la manipulación del sistema nervioso autónomo. Se puede utilizar para la inyección directa de nervios para otros nervios en ratas y otras especies, con las modificaciones necesarias.
Resumen
Existe una relativa abundancia de estrategias y metodologías para facilitar la administración de fármacos al sistema nervioso central. Sin embargo, la administración de fármacos directamente al sistema nervioso periférico es menos común, con menos publicaciones de métodos detallados disponibles para ayudar a los investigadores. Aquí, describimos un método de inyección directa de nervio para la administración de fármacos en el sistema nervioso periférico, utilizando el nervio vago como nervio modelo. Este método se puede utilizar en el tratamiento de los trastornos del sistema nervioso autónomo mediante la focalización del nervio vago izquierdo, aunque este método general de inyección puede extrapolarse a la inyección de otros nervios con pequeñas modificaciones. Este método explica todos los pasos críticos involucrados en el procedimiento que involucra la microcirugía en ratas adultas anestesiadas bajo un microscopio de disección. Se describe el uso de un colorante de seguimiento para facilitar el seguimiento de la fidelidad de la inyección en tiempo real. Se proporcionan ilustraciones de inyecciones exitosas y fallidas. Si se llevan a cabo correctamente, las inyecciones directas del nervio vago se pueden realizar de una manera segura que sea bien tolerada por la rata sin complicaciones posteriores al parto. Por ejemplo, una vez que los cirujanos fueron entrenados en este método, seis de cada seis ratas fueron inyectadas con éxito sin ninguna complicación. Este método de inyección directa de nervios para estudios preclínicos en ratas es capaz de administrar agentes (incluida, entre otras, la terapia génica) a los nervios periféricos.
Introducción
La aplicación del método correcto de administración de medicamentos es uno de los factores críticos para lograr resultados terapéuticos exitosos. A pesar de la abundancia de métodos para la administración de agentes terapéuticos al sistema nervioso central (SNC), solo se han reportado unos pocos métodos para la administración del sistema nervioso periférico (SNP) mediante inyección nerviosa directa. La inyección directa de nervios, como la inyección en los ganglios de la raíz dorsal (DRG) en ratas, se ha probado en estudios preclínicos para una mejor comprensión de los mecanismos del dolor, la toxicidad de los fármacos, la transferencia de genes 1,2,3 y el desarrollo de métodos generales 1,4. Los informes adicionales sobre la inyección directa del nervio incluyen la inyección del nervio espinal4, la inyección del nervio ciático1 y la inyección del nervio vago en ratas5 y ratones6. Recientemente, se ha propuesto un método para la inyección supracondrial para una mejor distribución de la terapéutica en la cabeza del nervio óptico en conejos7.
El DRG se considera el lugar ideal para la inyección directa de vectores cargados con transgenes, como el virus adenoasociado (AAV), debido a la función sensorial de los cuerpos celulares en el DRG2. Se han descrito métodos quirúrgicos y no quirúrgicos de inyecciones de DRG 1,8. Sin embargo, se han encontrado conclusiones controvertidas sobre la consistencia de los resultados con el método no quirúrgico de inyección de DRG1. Se ha sugerido que un método quirúrgico que involucra una laminectomía parcial es 100% exitoso para la inyección de DRG en ratas sin ninguna alteración en los resultados del comportamiento3, así como un método que involucra osteotomía parcial en ratones9. Varios estudios informan sobre los métodos de inyección de DRG para la administración de fármacos, que se han utilizado en la investigación preclínica de terapia génica en ratas y ratones 1,2,10. Los estudios de terapia génica basados en vectores que involucran inyecciones localizadas pueden incluir los siguientes beneficios: disminución de la expresión fuera del objetivo, reducción de la toxicidad sistémica y menores cargas virales y volúmenes de inyección, disminución del riesgo de complicaciones inmunogénicas11,12.
El método de inyección directa en el nervio ciático, el nervio más largo del cuerpo, se ha probado exponiendo el nervio ciático derecho a la altura de la mitad del muslo de una rata. El método utilizó una pipeta de vidrio estirado equipada con un sistema de inyección controlado por un microprocesador para inyectar un volumen total de 10 μL de colorante con un caudal de 1,2 μL/min1. Este experimento mostró una falta de distribución del colorante al nivel de DRG, y la distribución fue principalmente limitada alrededor del sitio de inyección. De manera similar, se han probado otros métodos de inyecciones directas en el nervio, como las inyecciones en el nervio espinal, con tinte para evaluar la cantidad adecuada de volumen de inyección y el patrón de distribución del tinte en ratas. Se sugiere que 2 μL son óptimos para la inyección del nervio espinal, mientras que 3 μL de colorante por inyección de DRG mostraron la distribución en los ganglios de la raíz dorsal y ventral en ratas1. Se ha informado que el volumen para la inyección de DRG en ratones es óptimo de 1,0 μL a 1,5 μL según la cepa y el tamaño corporal 2,9.
El método de inyección directa del nervio vago se utilizó en ratas5 y ratones6 para evaluar el papel de la lesión neuronal o la integridad celular en la transferencia de α-sinucleína humana. Estos dos estudios, realizados por el mismo grupo de investigadores, describen un breve método de inyección directa de vectores AAV en el nervio vago izquierdo en la región cervical. En ratas, el método involucró un capilar de vidrio con un diámetro de punta de 60 μm para inyectar un vector de 2 μL a un caudal de 0,5 μL/min con una jeringa Hamilton de 5 μL. En ratones, se inyectó un volumen total de solución vectorial de 750 nL a un caudal de 160 nL/min utilizando una aguja de acero romo de 36 G instalada en una jeringa NanoFil de 10 μL6. Estos experimentos demostraron que el transgén se entregaba y expresaba en axones en la protuberancia y el mesencéfalo de las ratas y ratones. Del mismo modo, el núcleo motor dorsal del nervio vago izquierdo mostró inmunorreacción positiva con el transgén. Estas pruebas ilustran que el método de inyección directa del nervio vago podría ser un método fiable en la terapia génica, en el que la transducción celular se extiende a varios lugares del cerebro, que proyectan los axones a través del nervio vago. Sin embargo, estos métodos no mencionan el uso de ningún tinte para rastrear la fidelidad de la inyección.
Aquí, se describe un método para la inyección directa en el nervio vago izquierdo utilizando tintes de seguimiento no tóxicos aplicables en gran medida a los investigadores en estudios preclínicos. Se analizan los posibles escollos que pueden causar dificultades en la administración de fármacos y las formas de superarlos. Estas situaciones se ilustran con imágenes para mostrar qué hace que la entrega no sea exitosa y la forma de hacerla exitosa.
Protocolo
El siguiente protocolo se lleva a cabo de acuerdo con los lineamientos de ética institucional y la aprobación del Comité Institucional de Cuidado y Uso de Animales (IACUC).
1. Preparación de la vivienda
NOTA: Este protocolo es para ratas adultas de al menos 2 meses de edad. Los animales más pequeños (incluidos ratones y ratas más jóvenes) son posibles, pero no se recomiendan y serán considerablemente más difíciles.
- Proporcione comida húmeda o cualquier otro alimento blando (gel de recuperación veterinario) durante 48 horas antes de la cirugía del nervio vago. Dado que los animales pueden tener dificultades para comer después del procedimiento, presénteles estos artículos antes de la cirugía para ayudarles a familiarizarse con el sabor de estos artículos e inducir la motivación para comer.
- Las ratas domésticas están individualmente en una jaula al menos 1 semana antes de la cirugía, así como 1 semana después de la cirugía. Eso les permitirá aclimatarse al estrés de estar solos y evitar rascarse las heridas después de la cirugía de un compañero de camada.
2. Preparación de los elementos quirúrgicos y del espacio
- Haga una lista de todos los artículos necesarios con anticipación y verifique que todos los artículos estén disponibles para la cirugía.
- Esterilice todos los artículos con métodos apropiados de esterilización antes de la cirugía.
- Coloque el espacio quirúrgico estéril bajo el microscopio de disección. Coloque una almohadilla térmica debajo del microscopio para mantener a la rata caliente durante la cirugía.
- Coloque todos los materiales quirúrgicos en una mesa quirúrgica sobre un paño estéril. Deje suficiente espacio para la cirugía bajo el microscopio de disección. Asegúrese de que el enfoque del microscopio sea óptimo y abarque el área quirúrgica para visualizar el nervio.
- Coloque la bomba de jeringa cerca de la etapa quirúrgica de modo que la longitud del tubo sea suficiente para llegar al lugar de la inyección.
- Coloque los instrumentos quirúrgicos hacia el lado de la mano dominante del cirujano.
3. Preparación de una mezcla del fármaco candidato y el colorante de seguimiento
- Asegúrese de que el fármaco candidato esté diluido para alcanzar la concentración requerida en el diluyente recomendado, de modo que 5 μL del fármaco mezclado con el colorante proporcionen la cantidad necesaria del fármaco candidato que se va a administrar. Se recomienda que el volumen máximo de inyección por el método directo del nervio vago sea de 5 μL (incluido el colorante de seguimiento, ver paso 3.2).
- Mezcle un colorante compatible con el fármaco candidato para permitir el seguimiento de la fidelidad de la inyección en tiempo real. Por ejemplo, una concentración final de 1% de Luxol Fast Blue o 0,002% de fluoresceína son tintes compatibles para usar.
PRECAUCIÓN: Utilice el colorante en su concentración óptima en la mezcla de colorante y fármaco candidato. Cuando la concentración de tinte en la mezcla es demasiado baja, es posible que no sea visible para rastrear la inyección. Cuando la concentración de tinte es demasiado alta, puede resultar en una mezcla demasiado espesa y de alta viscosidad, lo que bloqueará la aguja de inyección.
4. Carga del fármaco candidato y la mezcla de colorante en el tubo
- Conecte una jeringa de vidrio de 100 μL con el émbolo extraído a una aguja de 27 G.
- Conecte un extremo de aproximadamente 45 cm de tubo de polietileno esterilizado a la aguja de 27 G.
- Tome una jeringa de plástico de 3 ml y colóquela con una aguja de 27 G. Cargue la jeringa con aproximadamente 0,5 ml de solución salina normal al 0,9%.
- Llene el tubo de polietileno con solución salina normal al 0,9% desde el extremo abierto para llenar toda la longitud del tubo y todo el cilindro de la jeringa de vidrio hasta que se desborde.
NOTA: Es fundamental evitar que las burbujas de aire queden atrapadas dentro del tubo. - Retire y deseche la jeringa y la aguja de 3 ml.
- Inserte el émbolo de la jeringa en el cilindro de la jeringa de vidrio y empújelo ligeramente hacia adelante hasta el centro del barril.
- Coloque la jeringa de vidrio en la bomba de jeringa.
- Tire del émbolo ligeramente hacia atrás con la bomba de jeringa para crear un espacio de aire de aproximadamente 1,5 cm en el extremo abierto a lo largo del tubo.
- Pipetear al menos 5 μL de colorante y mezcla de fármaco candidato con una micropipeta de 10 μL y colóquela sobre una pieza esterilizada de parafilm.
- Retire la mezcla del fármaco candidato en el tubo tirando del émbolo hacia atrás a través de la bomba de jeringa. Mantenga la burbuja de aire entre la solución salina al 0,9% y la solución de inyección, pero de lo contrario, evite atrapar burbujas de aire dentro de la solución de inyección. Marque el nivel de la mezcla de inyección en el tubo con un marcador.
NOTA: El espacio de aire entre la mezcla de fármaco y colorante candidato y la solución salina estéril dentro del tubo es fundamental para evitar la mezcla de las dos soluciones. - Coloque la aguja de 35 G con el tubo. Fije la aguja a la superficie limpia de la etapa quirúrgica con cinta adhesiva para que la aguja no quede suelta, no se mueva ni toque nada más y permanezca esterilizada.
5. Cebado de la aguja de inyección
- Ajuste el programa de la bomba de jeringa para dispensar 0,5 μL/min.
- Ponga en marcha la bomba de jeringa durante unos 10-15 s, hasta que la solución inyectable comience a salir de la punta de la aguja. Una pequeña cantidad de la mezcla en la punta de la aguja sin fugas en la unión del tubo y la aguja de inyección (o en cualquier otro lugar a lo largo de la jeringa, el tubo o la aguja) indica que la configuración es correcta.
NOTA: Si no se ve una pequeña gota en la punta de la aguja, eso indica una obstrucción de la aguja. La obstrucción de la aguja puede ocurrir debido a la alta viscosidad del fármaco candidato y la mezcla de colorante, el exceso de aire atrapado dentro del sistema y la jeringa de vidrio no está correctamente asentada dentro de la bomba de la jeringa. Consulte la Figura 1 para ver un ejemplo de fuga en la unión entre la aguja y el tubo. El cebado es fundamental porque ayuda a identificar si la aguja no está obstruida y si la inyección dentro del nervio pasaría sin problemas.
6. Preparación de la rata para la cirugía
- Obtener el peso corporal de la rata para calcular la dosis necesaria de analgésicos. Por ejemplo, el carprofeno se utiliza a dosis de 5 mg/kg por vía subcutánea en ratas.
NOTA: Se recomienda almacenar el carprofeno a 4 °C antes de la inyección. - Anestesiar a la rata con un vaporizador de isoflurano utilizando un caudal de 3%-4% para la inducción de la anestesia durante unos 2-3 min. Reducir el caudal de isoflurano a aproximadamente 1,75%-2% para el mantenimiento de la anestesia.
- Transfiera la rata a una mesa separada con una configuración para la depilación y la preparación del sitio. Asegúrese de que esta mesa esté cerca del espacio quirúrgico.
- Aplique un ungüento lagrimal artificial en ambos ojos de la rata para evitar la sequedad excesiva.
- Administrar analgésicos según el protocolo institucional aprobado para animales para controlar el dolor cuando la rata recupera la conciencia.
- Afeitar el área quirúrgica con un cortapelos en el lado ventral del cuello en la región cervical. Afeita hasta unos 2 cm de distancia perpendicular desde la línea media en ambos lados, desde la barbilla hasta el esternón.
- Esterilice el área con alcohol etílico al 70% y betadina al 10%, limpiando el área tres veces alternativamente con un hisopo con alcohol y povidona yodada. Limpie desde el centro del área hacia afuera en un patrón circular.
- Transfiera la rata a la etapa quirúrgica bajo el microscopio en posición supina. Ajuste el enfoque del microscopio para visualizar el área de la cirugía en la región cervical.
7. Realizar una cirugía en ratas para inyectar el fármaco candidato directamente en el nervio vago izquierdo (Figura 2, Figura 3 y Figura 4)
NOTA: Esta parte del método requerirá que una segunda persona ayude al cirujano.
- Coloque la rata en una almohadilla térmica en posición supina bajo el microscopio de disección asociado con una luz montada.
- Enganche los dientes de la mandíbula superior delantera de la rata con un trozo de sutura no absorbible y fije el extremo abierto de la sutura dentro del cono de la nariz de modo que la fosa nasal de la rata esté siempre dentro del cono de la nariz durante toda la anestesia.
- Coloque la rata de modo que su cabeza quede en el lado izquierdo del cirujano diestro (o en el lado derecho de un cirujano zurdo). En esta posición, la parte frontal del cirujano es perpendicular al cuerpo de la rata. Coloque una almohadilla de calibre esterilizado debajo del cuello y ajuste el ángulo de la región cervical de la rata para que la región cervical se enderece. Esto facilitará la localización del nervio vago izquierdo y la realización de la inyección.
- Cubre todo el cuerpo de la rata con un paño esterilizado, manteniendo abierto el espacio quirúrgico.
- Fije cuatro clavijas retractoras individualmente con 4 fijadores magnéticos con elastómeros y coloque los fijadores en las cuatro esquinas de la etapa quirúrgica.
- Inyectar anestésicos locales por vía epidérmica en la línea media de la región cervical donde se realiza la incisión. Por ejemplo, se suele utilizar una mezcla de lidocaína y bupivacaína.
- Realice una incisión cutánea longitudinal de unos 2 cm de largo en la línea media entre el mentón y el esternón con una hoja de bisturí en el lado ventral del cuello en la región cervical (Figura 3A).
- Separe los bordes cortados de la piel con puntas de algodón esterilizadas.
- Retraiga los bordes de la piel en direcciones opuestas desde el sitio de la incisión con la ayuda de puntas retractoras.
- Separe la facia con puntas de algodón para que sea más profunda. Empuje las glándulas salivales hacia el lado lateral.
- Separe los músculos esternomastoideos con puntas de algodón y retírelos a un lado con los alfileres. A medida que la separación del músculo esternomastoideo se amplía, la tráquea aparece en el medio, cubierta con músculo esternohioideo (Figura 3B).
NOTA: Tenga cuidado de no ejercer presión sobre la tráquea. - Avance la separación del tejido en el lado izquierdo de la tráquea de la rata hasta que aparezca la vaina carotídea, que contiene la arteria carótida común que corre junto con el nervio vago izquierdo.
- Haga con cuidado un pequeño orificio en la vaina carotídea con pinzas finas, prestando atención para no lesionar la arteria carótida bajo el microscopio. Separe el nervio vago izquierdo de la arteria carótida común con pinzas finas.
NOTA: El área quirúrgica es anatómicamente crítica. La pared de la arteria carótida es gruesa, resbaladiza y no se lesiona fácilmente, pero la punta afilada de unas pinzas finas puede lesionarla y puede producirse sangrado. Al mismo tiempo, preste atención para no lesionar el nervio. - Una vez que el nervio esté separado de la arteria por las pinzas, use una aguja curva de 25 G ajustada a una jeringa de 1 mL desde ese orificio para "enganchar" y sujetar el nervio con la mano no dominante (Figura 4A).
NOTA: La punta de la aguja curva se roma para no lesionar el nervio y la arteria. El ángulo de curvatura de la punta de la aguja se hace a medida a unos 90° utilizando un hemostático (Figura 2). - Con la mano dominante, sostenga la aguja cargada con la mezcla de droga y tinte candidata y pinche suavemente el nervio en la misma dirección en la que corre el nervio para que el bisel de la aguja quede hacia arriba.
- Para un pinchazo fácil, mantenga el nervio recto tirando suavemente con el gancho de 25 G. Inserte la aguja en el nervio y avance hacia adelante, más de 0,5 cm, mientras mantiene la aguja paralela al nervio vago. A continuación, tire ligeramente hacia atrás para que la aguja quede entre 0,4 y 0,5 cm dentro del nervio.
NOTA: El ángulo de la aguja debe ser lo suficientemente superficial como para penetrar dentro del nervio sin pasar al otro lado.
- Para un pinchazo fácil, mantenga el nervio recto tirando suavemente con el gancho de 25 G. Inserte la aguja en el nervio y avance hacia adelante, más de 0,5 cm, mientras mantiene la aguja paralela al nervio vago. A continuación, tire ligeramente hacia atrás para que la aguja quede entre 0,4 y 0,5 cm dentro del nervio.
- Puede haber ocasiones en las que la aguja no esté obstruida fuera del nervio en el momento del cebado, pero la mezcla de fármaco y colorante candidato no pasa suavemente dentro del nervio. Para evitar esta situación, limite el número de pinchazos nerviosos con una sola aguja no más de 3 veces. Si la aguja se desafila, aumentarán las posibilidades de que la inyección se bloquee o se produzca una inyección deficiente.
- Asegúrese de que la aguja esté completamente dentro del nervio. Mantenga la posición inmóvil y encienda la bomba de jeringa.
NOTA: Revise cuidadosamente en el sitio de la inyección para ver que la mezcla de droga y tinte candidata no reflujo fuera del nervio. - Mientras se realiza la inyección, examine constantemente que la infusión permanezca dentro del nervio y fluya sin problemas. Utilice la marca hecha en el tubo de infusión para controlar el movimiento de la mezcla de droga y colorante desde el punto de partida.
- Si la mezcla de fármaco y colorante candidato no fluye suavemente, extraiga la aguja y repita el paso de cebado (paso 5.2). A continuación, vuelva a insertar la aguja en el nervio y reanude la infusión.
- El nervio comienza a desarrollar el color del tinte (Figura 4B). Continúe la perfusión a 0,5 μL/min durante 10 min para infundir los 5 μL de la mezcla de fármaco y colorante candidata.
NOTA: Se recomienda irrigar los tejidos expuestos con una pequeña cantidad de solución salina estéril tibia al 0,9% según sea necesario para evitar la sequedad excesiva y el daño. - Después de que se hayan infundido los 5 μL y se haya detenido la bomba de la jeringa, mantenga la aguja en su lugar durante 1 minuto adicional para permitir que toda la mezcla de fármaco y tinte candidato se extienda desde el lugar de la inyección. Retire la aguja.
- Retire la aguja curva de 25 G. Use puntas de algodón estériles para mover suavemente los pañuelos de papel a su ubicación original. Retire las puntas del retractor.
- Cierre la herida con una sutura no reabsorbible (también se puede utilizar sutura reabsorbible). Aplique una pequeña cantidad de pegamento tisular entre los puntos si es necesario para cerrar la herida perfectamente.
8. Cuidados postoperatorios de una rata
- Infundir aproximadamente 3 mL de solución salina tibia al 0,9% por vía subcutánea después de cerrar la herida. Esto ayuda a las ratas a rehidratarse de inmediato.
- Coloque a la rata en una fuente de calor hasta que se recupere completamente de la anestesia y vuelva a su condición normal. Observe cualquier cosa observada que sea anormal durante el proceso de recuperación.
NOTA: la duración de la recuperación puede ser más larga si el procedimiento de inyección nerviosa lleva mucho tiempo. - Transfiere la rata a su jaula casera con comida húmeda en el piso de la jaula. Asegúrese de que el agua esté disponible todo el tiempo. Observe a la rata después de la operación durante aproximadamente 2 horas para asegurarse de que la rata no sienta frío.
NOTA: Coloque la rata en una fuente de calor durante horas adicionales si siente frío. - Monitoree la rata a las 12 h, 24 h, 36 h, 48 h y 72 h después de la cirugía con notas escritas de las observaciones. Repetir los analgésicos según el protocolo institucional aprobado en animales para controlar el dolor. Por ejemplo, el carprofeno se dosifica a razón de 5 mg/kg por vía subcutánea dos veces en un intervalo de 24 h. Consulte a un veterinario si el dolor persiste en la rata durante más de 48 h.
- Repita la inyección subcutánea de aproximadamente 3 mL de solución salina tibia al 0,9% a las 24 h según las condiciones de la rata.
- Continúe evaluando la herida. Asegúrate de que la herida esté seca y en proceso de curación.
NOTA: El enrojecimiento, la hinchazón y la condición dolorosa de la herida con inactividad y opacidad de la rata pueden ser una indicación de inflamación de la herida y pueden justificar una consulta veterinaria adicional. Una rata con dolor mostrará la espalda encorvada, el pelaje con volantes, los ojos rojos y la condición de inactividad. Por lo general, se encuentra en una esquina de la jaula. - Retire las suturas no absorbibles dentro de las 2 semanas una vez que la herida haya cicatrizado.
Resultados
En el presente estudio se utilizaron seis ratas adultas (3 machos y 3 hembras). De las seis, una rata fue inyectada varias veces para demostrar una condición de falla en la inyección que muestra una difusión de tinte alrededor del sitio de inyección Figura 5A. Todas las demás ratas mostraron una inyección suave y tinción nerviosa, como se muestra en la Figura 4B y la Figura 5B.
La figura 1 muestra una situación en la que se ha producido una fuga de tinte entre la aguja y el tubo cuando el ajuste de la aguja de inyección con el tubo no es correcto. El tinte al 1% utilizado en este experimento no es demasiado espeso, pero el paso del tinte a través de la aguja de inyección ha fallado debido a un sello con fugas. Este tipo de problema se puede identificar fácilmente en el proceso de cebado (consulte el paso 5.2). Para resolver esta condición, verifique si la conexión entre la aguja y el tubo está realizada correctamente. Asegúrese de que se hayan insertado aproximadamente 3 mm de aguja en el tubo y asegúrese de que el tamaño del tubo y la aguja sean correctos. Repita el cebado después de que se haya corregido la conexión defectuosa, especialmente si se introducen burbujas de aire (repita el paso 5.2).
La Figura 2 muestra una configuración de una aguja curva y desafilada de 25 G ajustada a una jeringa de plástico de 1 mL. La punta de la aguja está desafilada y doblada en un ángulo de unos 90° por un portaagujas. Se esteriliza antes de su uso y se coloca en la jeringa esterilizada de 1 ml en el momento de la cirugía. Esta aguja ajustada a una jeringa se utiliza para separar el nervio vago izquierdo de la arteria carótida común, como se describe en el paso 7.14, engancharlo y sostenerlo en el momento de la inyección, como se muestra en la figura 4A.
La figura 3 muestra una configuración de un procedimiento aséptico de incisión en la línea media con una hoja de bisturí en la región ventral del cuello de una rata para cortar la capa de piel. Después de cubrir la rata con un paño esterilizado, se hace una incisión horizontal de unos 2 cm de largo para cortar la capa de piel, Figura 3A. Una vez que se corta la piel, los dos bordes de la piel cortada se tiran de lados opuestos con la ayuda de alfileres conectados con elastómeros. La tracción de los bordes cortados hacia el lado opuesto crea un espacio más amplio para profundizar. La capa de facia debajo de la piel y los músculos esternomastoideos están separados sin rodeos por puntas de algodón esterilizadas, como se muestra en la Figura 3B. Una vez que el nervio vago izquierdo aparece en el lado izquierdo de la tráquea dentro de la vaina carotídea común, como se describe en el paso 7.12, se separa con pinzas finas y se engancha como en la Figura 4A.
La figura 4 muestra una situación de separación del nervio vago izquierdo de la arteria carótida común y su mantenimiento listo para la inyección. El cirujano sostiene la aguja de inyección con su mano dominante (mano derecha) y la otra mano (izquierda) sostiene el nervio vago izquierdo de la rata con la ayuda de una aguja curva ajustada a una jeringa de 1 mL, Figura 4A. El nervio vago izquierdo está bien separado de la arteria carótida común y lo suficientemente estirado como para inyectarse en ella. El rectángulo punteado en el lado derecho del nervio muestra el área de la tráquea cubierta con músculo esternohioideo. La figura 4B muestra el nervio vago izquierdo coloreado con el color del tinte azul después de una inyección exitosa sin difusión del tinte. El rectángulo punteado blanco es el área de la tráquea. La figura 4B se estira más que la figura 4A para mostrar una imagen clara del nervio y sus alrededores después de la inyección.
La Figura 5 muestra ejemplos de inyecciones fallidas y exitosas en el nervio vago izquierdo de una rata. En estas inyecciones se utilizaron 5 μL de colorante al 1 % a un caudal de 0,5 μL/min en el nervio. La figura 5A muestra una condición de falla de la inyección porque el tinte no se limita solo al interior del nervio (ver recuadro). Más bien, el tinte se ha difundido por toda el área alrededor del nervio. Además, el sitio real de la inyección en el nervio no está claro. Esto sugiere que la inyección no estaba dentro del nervio, y una cantidad significativa de volumen de inyección se filtró y se difundió al área circundante.
Una situación similar se puede ver en condiciones en las que la aguja necesita ser reinsertada o reposicionada en el nervio. Esto puede ser necesario cuando la aguja se obstruye y no pasa la mezcla o si la aguja se desafila y no puede pasar fácilmente al nervio. En el ejemplo que se muestra en la Figura 5A, la pequeña cantidad de sangre acumulada en el área muestra la ruptura accidental de pequeños vasos sanguíneos en el área. Esto sucede cuando los vasos sanguíneos de la zona se lesionan durante la separación del nervio.
La figura 5B muestra una inyección exitosa en el nervio. Muestra un punto claro de inyección y un nervio bien teñido, distinto del área circundante. Una pequeña área de tinte fuera del nervio se debe a una pequeña cantidad de la solución de tinte en la punta de la aguja que está presente después del cebado (ver recuadro). El cebado se realiza para probar la obstrucción de la aguja justo antes de pinchar el nervio.

Figura 1: Fuga de tinte (flecha) debido a un sello defectuoso entre la aguja y el tubo. Este tipo de error se produce si el tubo no está correctamente ajustado con la punta de la aguja. Para evitar este tipo de fugas, se insertan aproximadamente 3 mm o más de la punta de la aguja en el tubo, y se utilizan el tamaño correcto de la aguja y el tubo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Una aguja desafilada de 25 G curvada a medida en un ángulo de aproximadamente 90° y ajustada a una jeringa de plástico de 1 mL. Haga clic aquí para ver una versión más grande de esta figura.
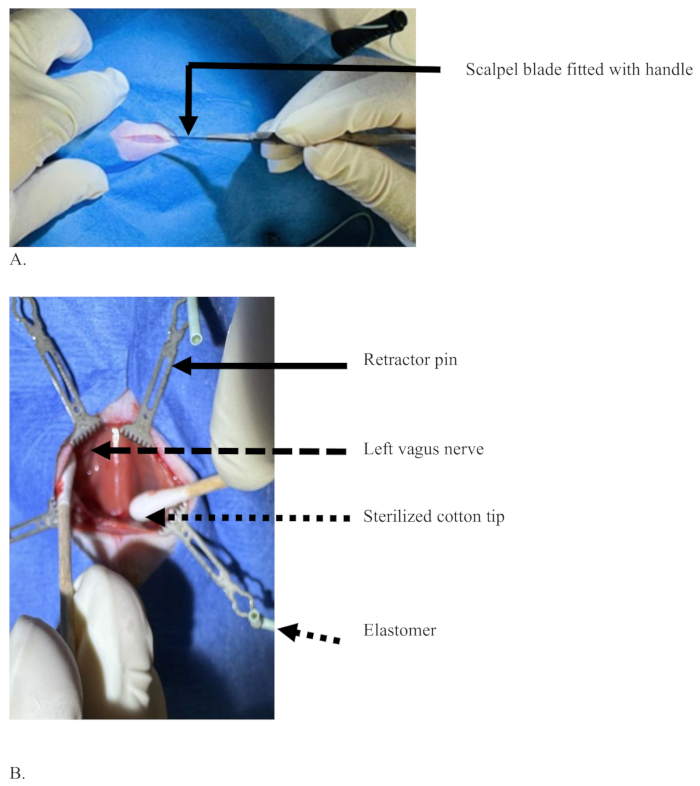
Figura 3: Una incisión en la línea media con una hoja de bisturí en la región ventral del cuello de una rata para cortar la capa de piel. (A) Una incisión con solo la piel cortada pero sin sangre, y una hoja de bisturí con un mango sostenido con la mano dominante del cirujano. (B) Las puntas de algodón esterilizadas (flecha punteada) separan los tejidos para exponer el nervio vago izquierdo (flecha discontinua), los tejidos se separan con la ayuda de alfileres (flecha sólida) sostenidos por elastómero (flecha punteada corta). Haga clic aquí para ver una versión más grande de esta figura.
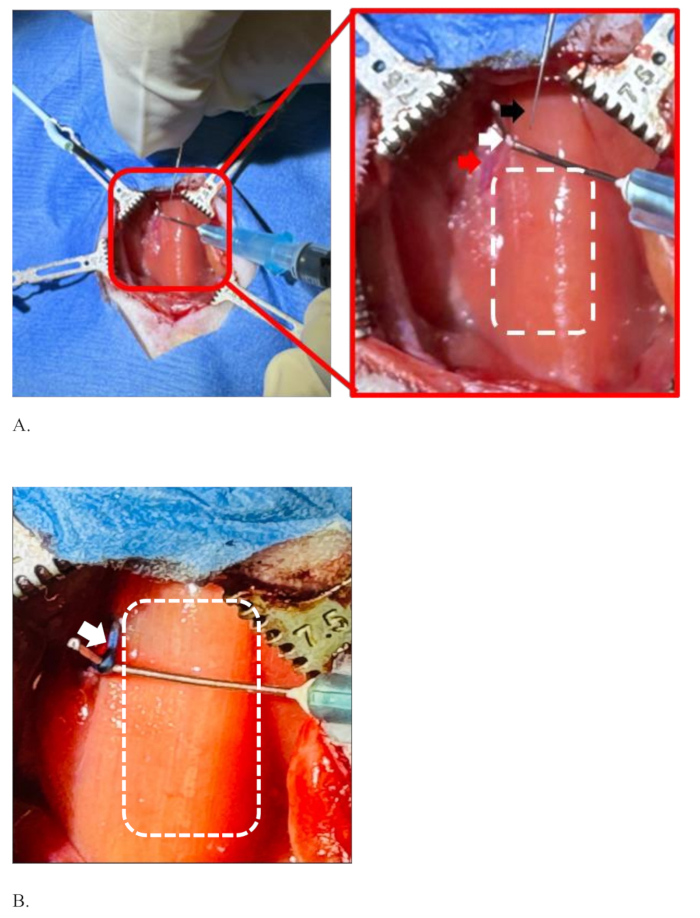
Figura 4: Ilustración de la separación del nervio vago izquierdo de la arteria carótida común, sosteniéndolo antes y después de la inyección. (A) La aguja de inyección (flecha negra), el nervio vago izquierdo (flecha blanca), la arteria carótida común (flecha roja) y el rectángulo punteado que muestra el área de la tráquea cubierta con músculo esternohioideo. (B) El nervio vago izquierdo en color azul, el color del tinte después de una inyección exitosa sin difusión del tinte (flecha blanca) y el área de la tráquea (rectángulo punteado). Haga clic aquí para ver una versión más grande de esta figura.
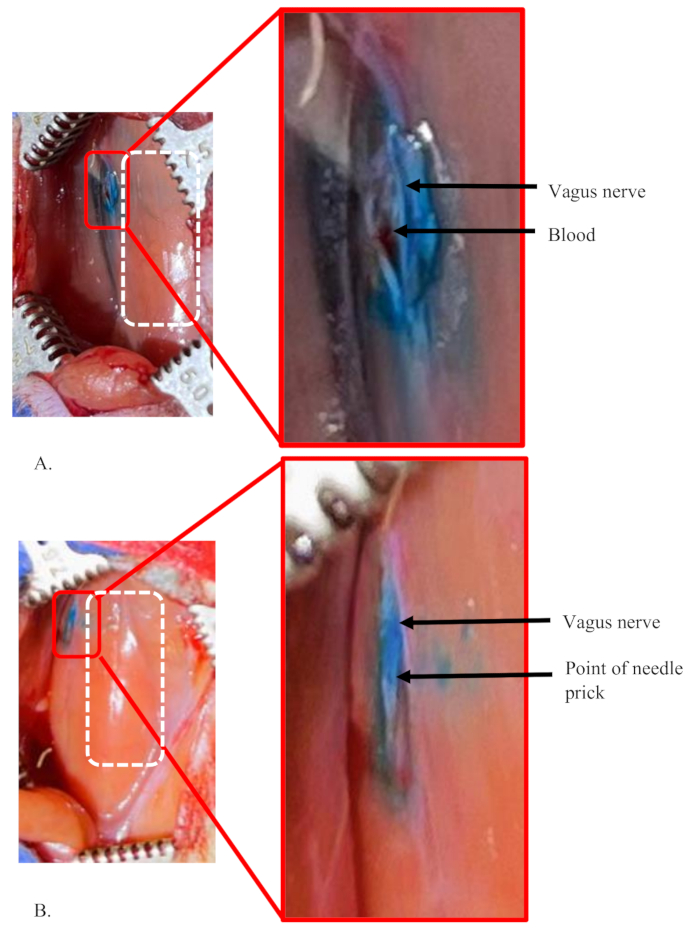
Figura 5: Ejemplos de una inyección fallida y una inyección exitosa en el nervio vago izquierdo de una rata. (A,B) Se inyectaron 5 μL de colorante a una concentración del 1% en el nervio vago izquierdo de ratas. El rectángulo blanco discontinuo muestra el área de la tráquea en ambos paneles. (A) Una condición de falla que muestra que el tinte no se limita solo al interior del nervio, lo que sugiere una cantidad significativa de pérdida de la solución de tinte durante el procedimiento. La pequeña cantidad de sangre acumulada en el área muestra una ruptura accidental de un pequeño vaso sanguíneo en el área, que se dañó durante la separación del nervio. (B) Una inyección exitosa en el nervio. Muestra un punto claro de inyección única y un nervio bien teñido, distintivo del área circundante. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método de inyección directa en el nervio vago izquierdo se puede realizar de forma segura y sin complicaciones postoperatorias en ratas. La administración de fármacos al nervio vago puede utilizarse para dirigirse al sistema nervioso autónomo (SNA). Esto implica ciertos pasos críticos que requieren práctica y un grado moderado a alto de habilidad quirúrgica.
Este procedimiento quirúrgico requiere anestesia general equilibrada en ratas. El cirujano tiene como objetivo terminar la cirugía en un plazo más corto para limitar la exposición a los anestésicos y lograr una mejor recuperación, especialmente en ratas viejas. Este método también supone un cirujano capacitado con un cierto nivel de habilidades quirúrgicas asépticas para que la inyección y la recuperación postoperatoria sean exitosas. La localización anatómica del nervio vago se encuentra profundamente asentada en una localización crítica13. El nervio vago izquierdo corre al lado de la arteria carótida común izquierda, lo que representa un riesgo de lesión tanto para la arteria como para el nervio en el momento de la separación y la inyección. Se requiere un alto grado de práctica y habilidad para separar correctamente el nervio de la arteria carótida común. Debe sostenerse en el ángulo adecuado durante el procedimiento mientras se mantiene la aguja dentro del nervio.
Si bien solo hay dos ejemplos publicados de procedimientos directos del nervio vago en ratas5 y ratones6 por el mismo grupo de investigadores, ambos estudios carecen de una descripción detallada de cómo realizar el procedimiento. El uso de una aguja de 35 G para inyectar el nervio fue conveniente (es decir, no se necesitó ningún equipo especial para preparar las agujas) y los resultados se mantuvieron consistentes en comparación con el uso de la micropipeta de vidrio estirado utilizada por el otro grupo. En comparación con las inyecciones en otros nervios, como el nervio ciático, el nervio vago es relativamente más pequeño en tamaño y solo puede contener un volumen más pequeño de mezcla de medicamento y tinte a la vez. En un estudio publicado en el que se inyectó una solución de colorante de 10 μL en el nervio ciático, la difusión del colorante alcanzó una longitud total de 2,3 cm dentro del nervio desde el lugar de la inyección sin llegar al DRG1. El nervio vago puede absorber hasta 5 μL de volumen de mezcla de fármaco y colorante de forma segura utilizando este protocolo de inyección.
Esta inyección requiere un microscopio de disección. Si bien el uso de un tinte en la solución de inyección no es absolutamente necesario, se recomienda encarecidamente permitir la visualización de la fidelidad de la inyección en tiempo real durante el procedimiento. Al mismo tiempo, si la concentración de tinte es demasiado alta en la mezcla de fármaco candidato y colorante, puede hacer que la aguja se bloquee en el momento de la inyección. Limitar el número de pinchazos de inyección con una sola aguja también es fundamental en este método. Se sugiere no utilizar la misma aguja para más de 3-5 pinchazos nerviosos (equivalentes a 3 ratas por aguja) para evitar el desafilamiento de la aguja. La reutilización de la aguja (opcional) requiere que se esterilice entre animales limpiándola tres veces con alcohol al 70%.
Los ejemplos de estudios en la literatura que utilizan la inyección directa del nervio vago son extremadamente limitados, especialmente para roedores 5,6. Algunos estudios informaron sobre la DRG directa y otras inyecciones nerviosas con modificaciones en los métodos y la cantidad de volumen a inyectar en ratones y ratas 1,2,9. El presente método es muy importante como enfoque para administrar los fármacos candidatos u otros agentes a través del nervio vago para dirigirse a aspectos del SNA. El nervio vago es el nervio craneal más largo e inerva casi todos los órganos viscerales para regular sus funciones fisiológicas. Por lo tanto, la aplicación de este enfoque tiene importancia presente y futura en los estudios preclínicos, que incluyen, entre otros, la terapia génica con ratas. Además, este método se puede extrapolar a otras inyecciones nerviosas, como el nervio ciático, con modificaciones relativamente menores.
En resumen, el método de inyección directa del nervio vago es una posible vía de administración de fármacos para los estudios modelo de ratas relacionados con el SNA. Nuestra experiencia es que el procedimiento en sí mismo no causa ningún efecto adverso a largo plazo, ya que los animales que se han mantenido más de un año después de la inyección no han desarrollado ninguna complicación a largo plazo. Sin embargo, también implica varios pasos críticos y exige prácticas en cirugía de roedores. Todos esos puntos críticos se han incluido cautelosamente en este detallado protocolo paso a paso en el texto. Se presta especial atención a varios puntos críticos: 1) la separación del nervio vago de la arteria carótida común, 2) el mantenimiento del nervio en una posición estable durante y después de la inserción de la aguja dentro del nervio vago durante todo el período de inyección, y 3) una administración suave de la mezcla de fármaco y colorante sin obstrucción de la aguja. La práctica quirúrgica extensiva es la mejor manera de superar todos esos problemas quirúrgicos.
Divulgaciones
Los autores NR y XC no tienen conflictos de interés. RMB y SJG son inventores de propiedad intelectual relacionada con la transferencia de genes al SNA a través de inyecciones en el nervio vago (patente de los Estados Unidos #11,753,655). SJG y RMB han recibido ingresos por regalías de Taysha Gene Therapies, y SJG ha recibido ingresos por consultoría de Taysha Gene Therapies.
Agradecimientos
Nos gustaría agradecer a las instalaciones del Centro de Recursos Animales de UT Southwestern por organizar el espacio quirúrgico para ratas. Los fondos para este trabajo fueron proporcionados por las siguientes fuentes a SJG: NIH/NINDS R01 NS087175, Hannah's Hope Fund y Taysha Gene Therapies.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 mL BD Tuberculin Syringe with Detachable 25 G x 5/8". Needle | Becton, Dickinson and Company | SKU:309626 | Used to connect with curved needle to pull the vagus nerve and hold it at the time of injection. |
| 0.5% Bupivacaine Hydrochloride Injection | Hospira | NDC 0409-1162-19 | Local anesthetics used to anesthetize local tissue. |
| 100 mL 0.9% Sodium Chloride Irrigation USP | Stericare Solutions | Item #6240 | Normal saline, used to rehydrate rat and tissue. |
| 20 Blunt, Retractor Tips, 7.5 mm | Kent Scientific Corporation | Surgi 5018 | Used to pull apart and hold tissues at the time of surgery. |
| 3 mL BD-Luer-Lok Syringe, Sterile, Single Use | Becton, Dickinson and Company | SKU # 309657 | Used to inject saline in rat and fill the saline into the Polythene tubing. |
| AK-Fluor10% | Akorn | NDC 17478-253-10 | Fluorescein dye visible within the nerve. Used to track injection fidelity. |
| Animal Weighing Scale | Kent Scientific Corporation | SCL 4000 | Used to measure body weight of rat. |
| Ansell ENCORE Perry Style 42 PF Surgical Gloves | Ansell | ASTM D3577 | Sterilie glove, it is used at the time of surgery by a surgeon. |
| Artificial Tears Ointment 3.5g | Pivetal | NDC 46066-753-55 | Used in eyses to prevent excessive dryness of eyes. |
| Baby-Myxter Hemostat | Fine Science Tools | 13013-14 | Used to stop bleeding in case of emergency. Also used to bend the 25 G x 5/8" in needle. |
| BD Intramedic PE Tubing | Becton, Dickinson and Company | 14-170-12A | Used in the injection set up system to connect with Hamilton needle and NanoFil Needles. It also holds the injection mixture. |
| BD Precison Glide Needle, 25 G x 5/8" | Becton, Dickinson and Company | REF#305122 | Used to inject saline in rat, and to make a curved needle. |
| BD Precison Glide Needle, 27 G x ½" | Becton, Dickinson and Company | REF#301629 | Used to fill sterile saline into the BD Intradermic tubing. |
| Benchmark Accuris ”NextPette” Variable Volume Pipette Micro Starter Setincludes 4 pipettes: 10/20/200/1000 μL, plus stand | MilliporeSigma | BMSP7700S1 | Used to pippette sterile solution. |
| Betadine, Povidine Iodine 10% | Honestmed | 67618015017 | Used to disinfect the surgical area. |
| Carprofen Injectable solution 50 mg/mL | Supplied by Covtrus (6451506845) | SKU 591149 | In our case, we used diluted carprofen at the dose rate of 5 mg/kg provided by the Animal Resource Center of University of Texas Southwestern Medical Center. |
| Curved needle (custom made) | Becton, Dickinson and Company | REF#305122 | BD PrecisionGlide 25 G x 5/8" in needle is curved to 90 degrees with the help of a hemostat. The tip of the needle is made blunt. It needs to be sterilized before use. It is used to hook the vagus nerve and hold it at the time of separation and injection. |
| Dissecting microscope | Motic | SMZ-171-BLED (Binocular with Lights) | Used to magnify the crifical anatomical area at the time of vagus nerve separation, injeciton, and to check injection leakage. |
| Drape sheet | Dynarex | Reorder#8122 | Used as drape after sterilization. |
| Dukal Cotton Tip Applicators, Non-Sterile | Dukal | Item 9003 | Used to blunt separation of tissue, needs to sterilize before use. |
| Dumont #7 - Fine Forceps | Fine Science Tools | 11274-20 | Used to separate the left vagus nerve from common carotid artery. It is curved so easy to use. |
| Ethicon PDS II Undyed Monofilament Suture - SUTURE, 4/0 18 PDS II CLR MONO PS | Ethicon | VA - Z682G | Used in suturing the wound. |
| Ethilon Nylon Suture Black Monofilament | Ethicon | 1856G | Used in suturing the wound if non-absorbale suture is used. Also used to hook the rat tooth to fix nose inside the nose cone. |
| Fine Forceps - Mirror Finish | Fine Science Tools | 11412-11 | Used at the time of vagus nerve separation from the common carotid artery. This is straight. |
| Fine Scissors - Sharp | Fine Science Tools | 14060-09 | Ued to cut tissue. |
| Hamilton cleaning solution | Hamilton | HT18311 | Used to clean the Hamilton after use. |
| Hamilton Needle, 27G, Small Hub RN Needle, 2”, PT3, 6/PK | Hamilton | 7762-01 | Used to connect BD Intramedic™ PE Tubing. |
| Hamilton Syringe , 710RN | Hamilton | 7638-01 | Used to hold drug at the time of vagus nerve injection. |
| Insulin Syringe | EXEL INT, Comfort point | REF 26027 | Used to inject carprofen and local anesthetics. |
| Lidocaine 2% Injection | Covetrus | Reorder#002468 | Used to mix with Bupivacaine and inject at the site of incision. |
| Luxol Fast Blue MBSN | Acros Organics | 212170250 | Dye visible within the nerve, used to mix with drug so that injection mixture is visible. |
| Micro Bead Sterilizer with Glass Beads | Fine Science Tools | Item No. 18090-46 | Used to sterilize surgical tools in between the rat surgery. |
| NanoFil Needles-NF35BV-2 | World Precision Instrument | NC9708956 | Used to inject drug - dye mixture inside the vagus nerve. |
| Olsen-Hegar Needle Holders with Suture Cutters | Fine Science Tools | 12002-12 | Used in wound suturing. |
| Parafilm M Laboratory Wrapping Film, 4 Inches x 125 Feet, 1 Roll per Box, 12 Count | Honestmed | PM#996 | Used to hold the aliquoted 5 uL of drug-dye mixture so that loading of drug-dye mixture into the BDTM intradermic tubing is accurate. |
| PDI Alcohol Prep Pads | Honestmed | NDC 10819-3914-2 | Used to disinfect the surgical area. |
| Premium Care Sterile Type VII Gauze Sponges, 8-Ply, 2" x 2" | Dukal | Item C5119 | Used as cushon under the neck of rat at the time of surgery. |
| Press’n Seal Cling Film | Glad | Used to cover a rat at the time of surgery like a drape. | |
| Rat Retractor Set | Kent Scientific Corporation | Surgi 5002 | Used to keep the incision open so that it is easy to separate the vagus nerve from the carotid artery. |
| RightTemp Jr. | Kent Scientific Corporation | 20.3 cm W x 25.4 cm L (8 in W x 10 in L), used to keep rat warm. | |
| S&T Forceps - SuperGrip Tips | Fine Science Tools | 00632-11 | Used at the time of suturing to hold tissue without damage. |
| S&T Suture Tying Forceps | Fine Science Tools | 00272-13 | Used to tight the suture. |
| Scalpel blade #15 | Fine Science Tools | 10015-00 | Used to make an incision in the skin at the ventral side of neck. |
| Scalpel Handle-#7 | Fine Science Tools | 10007-12 | Used to hold the scalpel blade. |
| Syringe Pump | KD Scientific | 78-81-8052GL | Serial #D107034, Model#LEGATO-180, is a programmable pump that can pump small volume of mixture under a program. |
| TipOne Filter Tip Refill Starter Systems | USA Scientific | Item #1120-3510 | Used to pipette the drug and dye mixture. |
| Vaporizer for Isoflurane, Funnel Filled | Kent Scientific Corporation | Vetflow 1231 | Used to anesthetize rats. |
| Vetbond Tissue Adhesives | 3M Science Applied to Life | ID B00016067 | Used to seal tissue at the site of cut wound if suturing is not perfect. |
| Wahl BravMini+ Professional Cordless Clipper Kit | Kent Scientific Corporation | CL7300-Kit | Used to cut hair of rat. |
Referencias
- Fischer, G., et al. Direct injection into the dorsal root ganglion: Technical, behavioral, and histological observations. J Neurosci Methods. 199 (1), 43-55 (2011).
- O'donnell, M., Fontaine, A., Caldwell, J., Weir, R. Direct dorsal root ganglia (drg) injection in mice for analysis of adeno-associated viral (AAV) gene transfer to peripheral somatosensory neurons. J Neurosci Methods. 411, 110268 (2024).
- Puljak, L., Kojundzic, S. L., Hogan, Q. H., Sapunar, D. Targeted delivery of pharmacological agents into rat dorsal root ganglion. J Neurosci Methods. 177 (2), 397-402 (2009).
- Rueter, L. E., Kohlhaas, K. L., Curzon, P., Surowy, C. S., Meyer, M. D. Peripheral and central sites of action for a-85380 in the spinal nerve ligation model of neuropathic pain. Pain. 103 (3), 269-276 (2003).
- Ulusoy, A., et al. Neuron-to-neuron alpha-synuclein propagation in vivo is independent of neuronal injury. Acta Neuropathol Commun. 3, 13 (2015).
- Helwig, M., et al. Brain propagation of transduced alpha-synuclein involves non-fibrillar protein species and is enhanced in alpha-synuclein null mice. Brain. 139 (Pt 3), 856-870 (2016).
- Chiang, B., et al. Development of a novel suprachoroidal-to-optic-nerve (scone) drug delivery system. Drug Deliv. 31 (1), 2379369 (2024).
- Ferrari, L. F., Cunha, F. Q., Parada, C. A., Ferreira, S. H. A novel technique to perform direct intraganglionar injections in rats. J Neurosci Methods. 159 (2), 236-243 (2007).
- Yuan, X. M., et al. Rapid injection of lumbar dorsal root ganglia under direct vision: Relevant anatomy, protocol, and behaviors. Front. Neurol. 14, 1138933 (2023).
- Mason, M. R., et al. Comparison of AAV serotypes for gene delivery to dorsal root ganglion neurons. Mol Ther. 18 (4), 715-724 (2010).
- Arjomandnejad, M., Dasgupta, I., Flotte, T. R., Keeler, A. M. Immunogenicity of recombinant adeno-associated virus (AAV) vectors for gene transfer. BioDrugs. 37 (3), 311-329 (2023).
- Ertl, H. C. J. Immunogenicity and toxicity of AAV gene therapy. Front Immunol. 13, 975803 (2022).
- Wayman, C., et al. Performing permanent distal middle cerebral with common carotid artery occlusion in aged rats to study cortical ischemia with sustained disability. J Vis Exp. (108), e53106 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados