Method Article
Usando dispositivos vestíveis de espectroscopia de infravermelho próximo para identificar limitações centrais versus periféricas durante o exercício
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo integra a tecnologia de espectroscopia de infravermelho próximo (NIRS) para avaliar alterações hematológicas e de oxigenação localizadas no córtex pré-frontal, músculos respiratórios (m.Intercostales) e locomotores (m.Vastus Lateralis) durante o teste de exercício cardiopulmonar, permitindo a identificação de fatores limitantes centrais e periféricos que afetam o desempenho do exercício.
Resumo
O padrão-ouro para avaliar a capacidade aeróbia em indivíduos fisicamente ativos e atletas é o teste de consumo máximo de oxigênio (VO2–max), que envolve a análise de gases expirados e variáveis cardiorrespiratórias obtidas pelo método breath-by-breath em um ergoespirômetro durante um exercício incremental. No entanto, este método não pode elucidar alterações metabólicas no nível muscular. A espectroscopia de infravermelho próximo (NIRS) surgiu como uma tecnologia valiosa para avaliar os níveis locais de oxigênio (Índice de Saturação Tissular, TSI) por meio da quantificação das concentrações de hemoglobina oxigenada (O2-Hb) e desoxigenada (H-Hb) na microvasculatura dos tecidos. As aplicações do NIRS se estendem aos músculos respiratórios e locomotores, avaliando as alterações metabólicas associadas ao custo da respiração (COB) e à carga de trabalho periférica, respectivamente. Além disso, regiões cerebrais, como o córtex pré-frontal, têm sido exploradas com a tecnologia NIRS para avaliar alterações fisiológicas relacionadas à demanda cognitiva associadas ao planejamento ou ideação de tarefas motoras ligadas ao desempenho esportivo. Assim, ao analisar as alterações induzidas pelo exercício (D) em O 2-Hb, H-Hb e TSI, é possível identificar limitações centrais e periféricas do exercício, particularmente quando o treinamento de resistência é o principal componente da aptidão física (por exemplo, corrida, ciclismo, triatlo, etc.). Abordar esses fatores é fundamental para treinadores e fisiologistas do exercício otimizarem o desempenho atlético, incorporando estratégias de treinamento focadas nos principais fatores limitantes do exercício. Este estudo descreve um protocolo para a utilização de dispositivos vestíveis equipados com tecnologia NIRS para analisar as alterações do exercício em TSI, O 2-Hb e H-Hb, juntamente com variáveis cardiorrespiratórias normalmente registradas em atletas durante testes VO2-max. Essa abordagem oferece um método abrangente para identificar os principais sistemas envolvidos na interrupção da progressão do exercício e na melhoria do desempenho esportivo.
Introdução
Atletas de resistência contam com um equilíbrio eficiente de fornecimento e absorção de oxigênio para sustentar exercícios de alta intensidade e melhorar seu desempenho atlético 1,2. O teste de consumo máximo de oxigênio (VO2-max) é uma avaliação fisiológica vital que determina o desempenho esportivo por meio da análise de gases expirados e variáveis cardiorrespiratórias durante a intensidade incremental do exercício1. Essa avaliação, conhecida como ergoespirometria ou Teste de Exercício Cardiopulmonar (TCPE), reflete a resposta ao exercício dos sistemas cardiovascular, respiratório e muscular3. Nesse sentido, o aumento do custo energético associado à respiração, conhecido como custo da respiração (COB), aumenta a demanda por nutrientes e oxigênio nos tecidos circundantes. Foi documentado que esse fenômeno reduz potencialmente o fluxo sanguíneo para os músculos envolvidos nos movimentos ativos, resultando em uma diminuição da tolerância ao esforço físico e uma cessação precoce da progressão do exercício devido ao reflexo metabólico4.
Durante um teste VO2-max , também é possível identificar os limiares ventilatórios (LVs), que correspondem a intensidades específicas de exercício que marcam a transição do metabolismo aeróbio para o anaeróbio (limiar aeróbio ou limiar ventilatório 1 [LV1] e limiar anaeróbio ou ponto de compensação respiratória [PCR] ou limiar ventilatório 2 [LV2])5. Os VTs refletem as respostas ventilatórias que compensam as alterações metabólicas durante o exercício incremental6. Ao identificar esses limites, o TCPE oferece uma avaliação abrangente, integrando as respostas de vários sistemas biológicos criticamente envolvidos durante o exercício de alta intensidade.
No entanto, embora a ergoespirometria seja amplamente considerada o padrão-ouro para avaliar o TCPE, ela não captura as alterações metabólicas que ocorrem no nível muscular. Essas mudanças são cruciais para a compreensão dos fatores fisiológicos limitantes associados à falta de progressão durante o exercício de alta intensidade em atletas de resistência. Nesse contexto, a tecnologia NIRS surgiu como uma ferramenta valiosa na ciência do exercício, auxiliando na análise de variáveis hemodinâmicas no nível do músculo microvascular7.
Nos últimos anos, profissionais do esporte e pesquisadores usaram uma ampla gama de wearables comerciais equipados com a tecnologia NIRS para explorar mudanças musculares não invasivas durante o exercício, fornecendo a capacidade de determinar VT1 e VT2 com essa tecnologia8. Assim, a análise integrativa dos dados do NIRS e do TCPE oferece uma compreensão abrangente das respostas fisiológicas ao exercício.
A tecnologia NIRS utiliza a lei de Beer-Lambert modificada para quantificar as alterações (D) nas concentrações de oxihemoglobina (O2-Hb) e desoxihemoglobina (H-Hb) durante o exercício7. No nível tecidual local, uma diminuição no O 2-Hb reflete um aumento na demanda metabólica local, enquanto um aumento no H-Hb reflete um aumento na extração de oxigênio. A hemoglobina total (tHb), a soma de O2-Hb e H-Hb, é usada como um índice do fluxo sanguíneo tecidual local. Por outro lado, a diferençaentre O2-Hb e H-Hb (Hbdiff) fornece um índice de extração de oxigênio tecidual9. O índice de saturação tecidual (TSI), calculado como a razão entre O2-Hb e tHb, reflete o nível de saturação de oxigênio tecidual e indica o equilíbrio entre a oferta local de oxigênio e a captação10,11. Assim, os dados do NIRS fornecem informações críticas sobre o estado fisiológico no nível microvascular, fornecendo uma compreensão detalhada da oxigenação e hemodinâmica dos tecidos que complementa as informações obtidas do TCPE.
Essa compreensão detalhada fornecida pela tecnologia NIRS se estende a muitas aplicações práticas. Pesquisas recentes destacam a versatilidade do NIRS e demonstram sua aplicação prática no monitoramento dos músculosrespiratórios12,13 e locomotores7, bem como de regiões cerebrais envolvidas na ideação do ato motor, como o córtex pré-frontal (CPF)14,15. Essa ampla aplicabilidade ressalta a capacidade do NIRS de fornecer informações abrangentes sobre as respostas fisiológicas a vários tipos de contrações musculares (contrações concêntricas ou excêntricas ou isométricas) e exercícios.
Ao analisar a DTSI induzida pelo exercício nos níveis muscular e cerebral, o NIRS fornece um potencial valioso para identificar associações entre fatores limitantes periféricos e centrais que afetam a progressão do exercício 16,17. Por exemplo, entre os fatores limitantes centrais, a diminuição do fluxo sanguíneo resultante da vasoconstrição cerebral causada pela hiperventilação compensatória devido aos níveis elevados de hidrogênio do metabolismo anaeróbio e ao aumento do lactato sanguíneo durante o exercício de alta intensidade é um contribuinte significativo para a redução do TSI no córtex pré-frontal17,18. Em contraste, os fatores limitantes periféricos são caracterizados por um desequilíbrio entre a oferta e a demanda de oxigênio na musculatura em exercício19. A redução do fornecimento local de oxigênio e o aumento do consumo de oxigênio podem levar à desoxigenação tecidual, como evidenciado pela diminuição do TSI20. Essa distinção destaca a natureza multifacetada das limitações de desempenho durante exercícios de alta intensidade, onde os mecanismos centrais e periféricos são críticos. Esse entendimento sugere que retardar o aparecimento desses fatores limitantes durante o exercício pode contribuir para melhorar o desempenho atlético.
Para aproveitar totalmente o potencial da tecnologia NIRS na identificação dessas limitações, procedimentos padronizados são essenciais para garantir a coleta e análise de dados de alta qualidade. Este documento descreve métodos para a realização de testes de exercício de resistência máxima usando a tecnologia NIRS para coletar dados fisiológicos e elucidar a relação entre fatores limitantes centrais e periféricos durante o exercício de alta intensidade em atletas de resistência. O protocolo proposto fornece uma abordagem padronizada para garantir consistência e precisão na avaliação dos fenômenos fisiológicos subjacentes a esses fatores limitantes.
Protocolo
O protocolo foi aprovado pelo Comitê de Ética em Pesquisa da Pontifícia Universidade Católica do Chile (projetos nº 210525001 e 220608010), e o estudo foi conduzido de acordo com a Declaração de Helsinque. Todos os participantes forneceram consentimento informado por escrito antes de participar do teste descrito.
1. Colocação e configuração de wearables NIRS
NOTA: Vários wearables NIRS e software de aquisição de dados podem ser utilizados. Os pesquisadores devem consultar minuciosamente as instruções e diretrizes do fabricante para garantir a configuração e o uso adequados. Neste estudo, são utilizados os dispositivos que utilizam um registro de onda contínua do sinal NIRS. Esses dispositivos comerciais são fáceis de usar, mas só podem detectar mudanças na atenuação da luz em relação à fase de referência ou linha de base e não podem detectar concentrações absolutas como outros dispositivos que empregam um registro de NIRS no domínio do tempo.
- Preparação de wearables NIRS e diretrizes gerais de colocação
- Antes de colocar os dispositivos e iniciar as medições, certifique-se de que todos os wearables estejam totalmente carregados.
NOTA: Para os dispositivos usados neste estudo, o fabricante relata que uma bateria com carga completa pode registrar de 6 a 8 horas continuamente. - Aplique fita adesiva dupla face em todos os wearables para prendê-los à pele do participante, garantindo que a fita não obstrua os emissores e detectores de luz.
- Cubra todos os wearables com uma camada de filme plástico, seguida por uma camada de um curativo adesivo à prova d'água para protegê-los do suor.
- Antes de colocar os dispositivos, limpe a área alvo com uma compressa embebida em álcool para remover qualquer resíduo que possa interferir no registo (por exemplo, cremes, cosméticos, etc.). Se necessário, raspe a área ao redor do local alvo, pois o cabelo pode interferir nos sinais NIRS.
NOTA: Recomenda-se que uma lavagem completa das mãos seja realizada antes de colocar qualquer dispositivo na pele do participante para evitar uma possível contaminação. O uso de luvas é incentivado, pois pode reduzir ainda mais o risco de contaminação. - Depois que todos os wearables estiverem corretamente colocados na pele do participante (consulte a seção 1.2), prenda-os com uma camada de fita terapêutica elástica. Se for necessária fixação adicional, use um envoltório de bandagem elástica de cor escura, garantindo que a compressão excessiva não altere as medidas (menor que a pressão de oclusão capilar de 25 mm Hg medida por um esfigmomanômetro convencional).
- Coloque um pano preto sobre todos os wearables para evitar que a luz ambiente penetre. Se não for possível cobrir a área com um pano (cerca de 6 cm2), use fita terapêutica elástica preta para bloquear a luz ambiente.
- Antes de colocar os dispositivos e iniciar as medições, certifique-se de que todos os wearables estejam totalmente carregados.
- Colocação do dispositivo NIRS
NOTA: Certifique-se de que os dispositivos vestíveis NIRS sejam colocados de forma que os botões ON/OFF e de configuração sejam facilmente acessíveis.- Córtex pré-frontal: Coloque a sonda NIRS no córtex pré-frontal dorsolateral esquerdo ou direito, aproximadamente 10 mm acima do arco superciliar do participante, semelhante à colocação do eletrodo Fp1 de acordo com o sistema internacional modificado EEG 10-2021.
- m.Intercostais: Coloque a sonda NIRS sobre o7º espaço intercostal na linha axilar anterior direita 22,23,24. Se, por algum motivo, não estiver posicionado sobre o hemitórax direito, posicione-o sobre o hemitórax esquerdo, mas o sinal da frequência cardíaca pode ser mais pronunciado no lado esquerdo.
- Para confirmar a profundidade de penetração do NIRS, use um ultrassom modo B para verificar a distância do tecido subcutâneo até a borda externa do m.Intercostales. Para medições em m.Intercostales, certifique-se de que a distância entre a pele e o músculo seja inferior a 15 mm.
- m.Vasto Lateral: Posicionar a sonda NIRS 5 cm lateral ao ponto médio da linha imaginária, conectando a borda superior da patela e o trocânter maior do fêmur 24,25,26.
- Para garantir que a espessura do tecido adiposo (TAT) não altere o registro do sinal NIRS, medir a espessura das dobras cutâneas para confirmar a profundidade de penetração do NIRS27. Para medições em m.Vastus Lateralis, certifique-se de que o TAT seja inferior a 20 mm.
- Configuração do software NIRS
- Depois que todos os wearables NIRS estiverem colocados corretamente (consulte a seção 1.2), ligue-os antes de iniciar a medição.
- Inicie o software de aquisição de dados fornecido pelo fabricante, crie um novo arquivo e vincule os wearables NIRS.
- Depois que todos os wearables NIRS forem vinculados com sucesso, defina a taxa de amostragem para 10 Hz para aquisição de dados e conversão analógico-digital para os tecidos avaliados. Para medições do córtex pré-frontal, ajuste o fator diferencial de comprimento do caminho (DPF) de acordo com o DPF dependente da idade para cada participante28. Para a mensuração muscular, definir o DPF para 4, conforme utilizado em protocolos anteriores com atletas como sujeitos do estudo29,30.
2. Calibração e configuração do ergoespirômetro
- Calibração de volume
- Abra o software do ergoespirômetro fornecido pelo fabricante para iniciar o processo de calibração.
- Conecte o medidor de vazão a uma turbina de 28 mm com um adaptador de seringa. Conecte um tubo corrugado ao adaptador da seringa e o outro a uma seringa de calibração de 3 L.
- Realize seis manobras de retirada/injeção, mantendo uma vazão constante. Após a conclusão, o software confirmará automaticamente se o teste de calibração foi aprovado.
- Calibração de gás
NOTA: Certifique-se de que a calibração do fluxo seja feita antes de iniciar a calibração do gás.- Calibração de ar
- Certifique-se de que o sample linha do analisador de gás está desconectado da porta de calibração e pendurado livremente. Em seguida, inicialize o processo de calibração.
- Durante a calibração, observa-se uma linha plana estável, pois as concentrações de oxigênio (O2) e dióxido de carbono (CO2) não variam significativamente (menos de 5%). Uma vez concluída a calibração do ar com sucesso, prossiga para a calibração do gás metabólico.
- Calibração de gás metabólico
- Abra as válvulas de gás e verifique se a pressão adequada é fornecida ao sistema verificando o manômetro (consulte o fabricante para obter instruções específicas).
- Conecte a linha de amostra à porta de calibração e inicialize o processo de calibração. Realize um pré-aquecimento de 3 minutos antes de iniciar a calibração, conforme recomendado pelo fabricante.
- Se feito corretamente, após o período de pré-aquecimento de 3 min, duas linhas planas devem ser observadas: uma flutuando entre o ar ambiente (aproximadamente 21,00% O2 e 0,04% CO2) e a outra entre o gás de calibração (16,00% O2 e 5,00% CO2).
- Por fim, desconecte o sample linha da porta de calibração e conecte-a ao bocal que será usado para o próximo teste.
- Calibração de ar
3. Colocação do eletrodo de ECG (12 derivações)
- Prepare a pele esfoliando com um creme e/ou raspando qualquer cabelo dos locais de colocação do eletrodo, se necessário. Limpe as áreas com uma compressa com álcool para remover quaisquer resíduos superficiais de tecido.
- Coloque os eletrodos de ECG da seguinte forma31:
- Coloque as derivações bipolares (eletrodos de derivação do membro) da seguinte forma: Braço esquerdo (AE): lado esquerdo da fossa subclavicular; Braço direito (AD): lado direito da fossa subclavicular; Perna esquerda (MMII): projeção anterior da cabeça femoral esquerda; Perna direita (RL): projeção anterior da cabeça femoral direita.
- Coloque os eletrodos de derivação precordiais da seguinte forma: V1:4º espaço intercostal à direita do esterno; V2:4º espaço intercostal à esquerda do esterno (alinhado com V1); V3: A meio caminho entre V2 e V4; V4:5º espaço intercostal na linha hemiclavicular; V5: linha axilar anterior no mesmo nível de V4; V6: linha axilar média no mesmo nível de V4 e V5.
4. Teste de esforço máximo incremental (teste de exercício cardiopulmonar, TCPE)
- Peça ao participante para se sentar na bicicleta, certificando-se de que o assento e o guidão estejam ajustados à sua altura para conforto e posicionamento ideais.
NOTA: É aconselhável ajustar a altura do assento de forma que o joelho fique ligeiramente dobrado na extensão total32. O guidão deve ser posicionado para permitir uma leve flexão dos cotovelos. - Conecte um oxímetro de pulso ao lóbulo da orelha do participante, garantindo que o local esteja limpo, limpando-o com uma compressa com álcool.
- Explique o protocolo e instrua o participante a respirar através da máscara antes, durante e depois do teste.
NOTA: O participante deve evitar falar ou assobiar enquanto estiver usando a máscara, pois isso pode afetar as leituras do ergoespirômetro33. - Uma vez que o participante esteja posicionado e preparado, faça com que o participante estenda a perna direita e aguarde 2 minutos pela instrução inicial (estágio inicial de descanso). Faça com que o participante pedale em uma cadência entre 80–100 rpm por 6 min a 0,6 W·kg-1 e 0,8 W·kg-1 para mulheres/homens, respectivamente (fase de aquecimento). Em seguida, incremente a carga de trabalho a uma taxa de 20 W·min-¹ para mulheres e 25 W·min-¹ para homens até que o participante atinja a exaustão (fase de exercício).
- Após completar a fase de exercício, instrua o participante a permanecer imóvel e continuar respirando na máscara por 3 min (fase de resfriamento ou recuperação).
- Assim que o protocolo de exercícios for concluído, remova cuidadosamente o oxímetro de pulso do lóbulo da orelha, a máscara, todos os três wearables NIRS e os eletrodos de ECG.
NOTA: Para manter a condição ambiente do laboratório (por exemplo, temperatura do ar ~ 20 ± 2 ° C, umidade relativa ~ 40% ± 5%), é um critério crucial. Alguns participantes podem apresentar alta taxa de suor, o que interfere na fixação dos dispositivos na pele e afeta o registro de dados NIRS. O uso de ventiladores pode ajudar a reduzir a termorregulação quente pela transpiração.
Resultados
Durante a conclusão de um TCPE, os sintomas de dispneia, fadiga nas pernas e taxa de esforço percebido (RPE) foram relatados em todos os indivíduos. O uso complementar dos dispositivos NIRS não acrescentou nenhum desconforto à avaliação da sensação dos sujeitos. Além disso, não interrompemos as avaliações do TCPE por nenhum evento de risco associado ao estresse fisiológico excessivo.
Estudamos dois ciclistas competitivos recrutados em um clube nacional de ciclismo. Os critérios de inclusão para este estudo foram participantes fisicamente ativos (≥150 min de atividade física moderada ou ≥75 min de atividade física vigorosa por semana) com índice de massa corporal normal (20–25 kg·m-2). Os critérios de exclusão para este estudo foram histórico de doença respiratória, cardiovascular, metabólica, musculoesquelética ou neoplásica ou processo infeccioso ou inflamatório pelo menos 2 semanas antes das avaliações do estudo.
A realização de um TCPE, acompanhado de registro não invasivo das alterações hemodinâmicas e de oxigenação tecidual resultantes de alterações metabólicas induzidas pelo aumento da intensidade do exercício utilizando dispositivos equipados com a tecnologia NIRS, permite a identificação de fatores limitantes centrais associados a alterações nas áreas cerebrais versus fatores limitantes periféricos relacionados às respostas respiratórias ou musculoesqueléticas ao aumento da intensidade do exercício. O protocolo de teste engloba uma série de etapas, incluindo a preparação do participante, a execução do teste ergométrico e a coleta de dados fisiológicos relevantes.
A execução bem-sucedida do protocolo CPET-NIRS é demonstrada por dados claros e consistentes em vários parâmetros. Durante o estágio inicial de repouso, medições como frequência cardíaca (FC), saturação de oxigênio de pulso (SpO2) e leituras NIRS são registradas para estabelecer uma linha de base. A fase de aquecimento, caracterizada por pedaladas de baixa carga, prepara o participante para a fase de exercícios incrementais, onde a carga aumenta progressivamente (ver Figura 1).

Figura 1: Desenho experimental do esquema do protocolo de exercícios. Representação esquemática das etapas do protocolo de exercício utilizado no estudo, destacando os principais eventos como repouso (R), aquecimento (W), exercício (E), finalização (F) e parada (S), que correspondem ao fluxo do protocolo de teste de exercício cardiopulmonar. Clique aqui para ver uma versão maior desta figura.
Os resultados representativos dos dados do TCPE (Figura 2) e NIRS (Figura 3 e Figura 4) de dois atletas do sexo masculino avaliados em condições ambientais controladas de laboratório (temperatura do ar ~ 20 ± 2 ° C; umidade relativa ~ 40% ± 5%) são mostrados: (i) Participante 1 (Figura 2A e Figura 3) (idade: 33 anos, peso: 80 kg, altura: 178 cm, carga de trabalho máx.: 300 W, VO2-max: 46 mL·kg-1·min-1, VE: 177 L·min-1, FC-max (% previsto, 220 anos): 100%, PetCO2: 27 mmHg); e (ii) Participante 2 (Figura 2B e Figura 4) (idade: 26 anos, peso: 67 kg, altura: 178 cm, carga de trabalho máx: 300 W, VO2-máx: 51 mL·kg-1·min-1, VE: 131 L·min-1, FC-máx (% do previsto, 220 anos): 93%, PetCO2: 33 mmHg).
Em ambos os participantes, o VO2 (consumo de oxigênio), VCO2 (produção de dióxido de carbono), RQ (quociente respiratório, VCO2· VO 2-1), FC, VE (ventilação pulmonar) e FR (frequência respiratória) exibem um aumento contínuo à medida que a intensidade do exercício aumenta até que o valor máximo de VO 2 seja atingido (ver Figura 2).
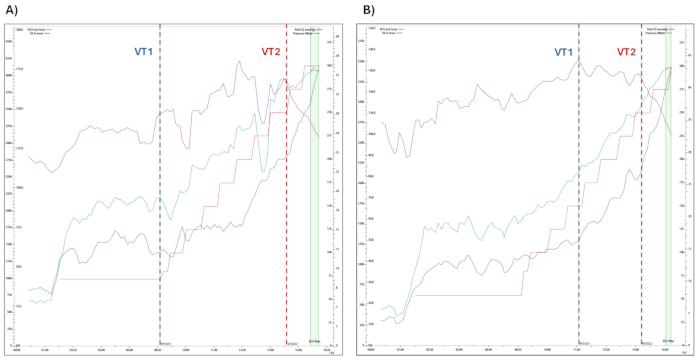
Figura 2: Alterações nas variáveis fisiológicas avaliadas durante o TCPE. A progressão das variáveis fisiológicas medidas durante o teste de exercício cardiopulmonar, incluindo consumo de oxigênio (VO2), ventilação minuto (VE), pressão expirada de CO2 (PetCO2) e potência (Watts), são mostradas. As transições entre os limiares ventilatórios 1 e 2 (LV1 e LV2) são indicadas dentro das etapas do exercício. (A) Participante 1 e (B) Participante 2. Clique aqui para ver uma versão maior desta figura.
Os dados do NIRS forneceram informações sobre a demanda metabólica local durante o TCPE. As alterações induzidas pelo exercício observadas no tecido-alvo (muscular versus cerebral) variam dependendo do tecido específico e da intensidade do exercício analisado. Portanto, uma estrutura fisiológica útil para interpretar os dados NIRS induzidos pelo exercício é o modelo trifásico de intensidade do exercício proposto por Skinner e McLellan34. Nesse modelo, os autores delineiam três zonas definidas por VTs: Fase I ou aeróbica, (ii) Fase II ou transição aeróbico-anaeróbica e (ii) Fase III ou "instabilidade metabólica".
Em intensidades de exercício abaixo do LV2 (Fases I e II), ocorrerá uma diminuiçãono O2-Hb e um aumento no H-Hb no nível muscular – se não houver variação significativa no T-Hb como parâmetro do fluxo sanguíneo local. Nosso protocolo CPET-NIRS consiste em exercícios cíclicos com contrações/relaxamentos musculares repetitivos, portanto, espera-se uma variação mínima no T-Hb. No entanto, as alterações induzidas pelo exercício variam dependendo do tecido muscular alvo que está sendo avaliado. Nos músculos locomotores, como o vasto lateral, o aumento progressivo da intensidade do exercício, induz alterações nos dados do NIRS concomitantes com a carga de trabalho (ver Figura 3A). Em contraste, nos músculos respiratórios acessórios, como o m.Intercostales, as alterações são concomitantes com as alterações ventilatórias e não com a carga de trabalho (ver Figura 3B). No PFC, observa-se um aumento de O 2-Hb, H-Hb e T-Hb porque o fluxo sanguíneo excede a demanda local induzida pelo exercício; além disso, observou-se uma ligeira diminuição do TSI (ver figura 3C). Em todos os tecidos avaliados, o parâmetro TSI diminui à medida que a intensidade do exercício aumenta, tornando as alterações no m.Vastus Lateralis mais notórias do que no m.Intercostales e PFC (ver Figura 3D).

Figura 3: Exemplo de limitação central (Participante 1). Dados NIRS durante o protocolo CPET (Eventos: W = Aquecimento, E = Exercício, LV1 = Limiar ventilatório 1 ou limiar ventilatório aeróbio, VT2 = Limiar ventilatório 2 ou limiar ventilatório anaeróbico, F = Exercício finalizado ou VO2-max). (A) m.Vasto lateral, (B) m.Intercostais e (C) Córtex pré-frontal (PFC). Clique aqui para ver uma versão maior desta figura.
À medida que a demanda metabólica induzida pelo exercício aumenta, particularmente em intensidades acima do LV2 (Fase III ou "instabilidade metabólica"), respostas fisiológicas interessantes a serem estudadas ocorrem tanto no nível muscular (músculos locomotores e respiratórios) quanto no PFC. Estes consistem em uma diminuição acentuada em O2-Hb e tHb, juntamente com um aumento notável em H-Hb, aspectos que suportam o declínio pronunciado no TSI.
Em indivíduos com alta demanda ventilatória durante o exercício de alta intensidade, o aumento exponencial de VE e FR causa hiperventilação elevada devido ao aumento do CO2 de "origem metabólica". Essa hiperventilação pode induzir vasoconstrição cerebral pronunciada, limitando assim o desempenho por limitação central, como visto neste sujeito representativo. Teoricamente, as alterações observadas nos dados do NIRS resultam da vasoconstrição cerebral induzida pela hipocapnia inferida da diminuição abrupta da pressão expirada de CO2 (PetCO2) registrada no TCPE (ver Figura 2). Essas alterações fisiológicas demonstraram ter alta relação com o aumento da dispneia induzida pelo exercício, registrada pela escala de Borg modificada35,36.
Por outro lado, indivíduos com alta demanda locomotora, mas não alta demanda respiratória, não apresentam vasoconstrição cerebral por hipocapnia. Consequentemente, os dados NIRS podem continuar a refletir mudanças como as observadas em intensidades moderadas de exercício. Nesses indivíduos, o desempenho do exercício é limitado por fatores limitantes periféricos e não centrais (ver Figura 4). Essas alterações fisiológicas demonstraram ter uma alta relação com o aumento da fadiga das pernas induzida pelo exercício.
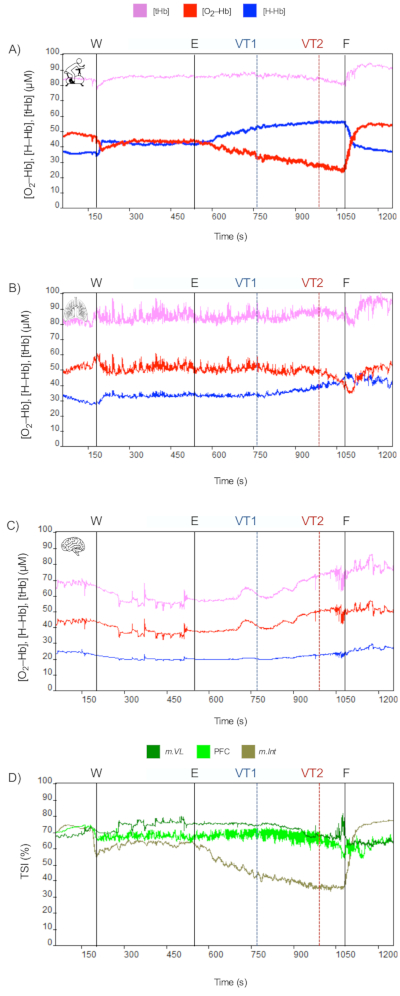
Figura 4: Exemplo de limitação periférica (Participante 2). Dados NIRS durante o protocolo CPET (Eventos: W = Aquecimento, E = Exercício, LV1 = Limiar ventilatório 1 ou limiar ventilatório aeróbio, VT2 = Limiar ventilatório 2 ou limiar ventilatório anaeróbico, F = Exercício finalizado ou VO2–max). (A) m.Vasto lateral, (B) m.Intercostais e (C) Córtex pré-frontal (PFC). Clique aqui para ver uma versão maior desta figura.
Discussão
Há um potencial significativo no uso de wearables NIRS como uma ferramenta complementar ao TCPE para avaliar o desempenho atlético e identificar fatores limitantes do exercício central e periférico em atletas aeróbicos ou de resistência, uma vez que a tecnologia NIRS provou sua validade e confiabilidade na avaliação da hemodinâmica microvascular nas regiões cerebral e muscular37,38. No entanto, para maximizar os benefícios dessa tecnologia, várias considerações devem ser abordadas para garantir medições precisas.
As diretrizes gerais para a colocação de dispositivos vestíveis NIRS envolvem adaptar o posicionamento ao tecido-alvo e garantir a fixação segura à pele do participante, pois o movimento durante o exercício pode afetar os sinais NIRS (artefatos)7. Para isso, o dispositivo deve estar em contato completo com a pele e fixado com fita adesiva dupla face, garantindo que os emissores e detectores de luz estejam desobstruídos. Para maior estabilidade, fita terapêutica elástica pode ser aplicada sobre o dispositivo. Ao colocar o dispositivo em um membro que será ativamente engajado durante o exercício, como o m.Vastus Lateralis, um envoltório de bandagem elástica pode ser usado para maior estabilidade durante o ciclismo. No entanto, evitar a compressão excessiva ao redor dos optódios NIRS é crucial, pois pode alterar o fluxo sanguíneo local e potencialmente afetar a precisão das medições NIRS (a pressão não deve ser maior que a pressão de perfusão capilar, ~ 25 mm Hg)7. Recomenda-se que qualquer fita ou curativo usado sobre o dispositivo NIRS seja preto para evitar interferência da luz ambiente 39,40. Além disso, a iluminação esmaecida no ambiente de teste pode minimizar possíveis interrupções na precisão do sinal NIRS.
Embora o posicionamento e a fixação adequados dos dispositivos sejam essenciais, é igualmente importante considerar as características anatômicas individuais que podem influenciar as medições do NIRS. Uma grande limitação é que a precisão das medidas do NIRS pode ser afetada por fatores como a espessura do tecido adiposo (TAT)41,42. A profundidade máxima de penetração para NIRS é aproximadamente metade da distância entre a fonte de luz e o detector43. À medida que a TAT aumenta, a proporção do sinal NIRS originado do músculo esquelético subjacente diminui11. Essa redução na contribuição do sinal resulta em níveis mais baixos de O, 2-Hb e H-Hb, entre outros cromóforos42. Portanto, recomenda-se que a TAT seja medida para garantir a penetração adequada da luz no músculo. Um paquímetro ou ultrassom pode ser usado para esse fim, pois ambos os métodos avaliam com precisão a composição corporal em atletas; no entanto, este último fornece precisão superior e pode ser preferido44.
Além do ATT, a precisão das medições NIRS também é influenciada pelo fator de comprimento do caminho diferencial (DPF), que é usado para calcular as concentrações de O2–Hb e H–Hb por meio da lei de Beer-Lambert modificada45. A maioria dos dispositivos NIRS comerciais utiliza sistemas de ondas contínuas que emitem luz em uma intensidade constante e assumem um DPF11 constante. No entanto, o DPF não é um valor fixo, pois varia devido a diferenças anatômicas individuais, incluindo crânio e TAT41,46. Além disso, a variabilidade na DPF entre os indivíduos e as diferenças nas características anatômicas entre os sexos, como variações na distribuição óssea, muscular e do tecido adiposo, também podem influenciar na precisão das medidas28. Devido à suposição de um DPF constante, esses dispositivos só podem medir mudanças relativasem O2-Hb e H-Hb a partir de uma linha de base, em vez de fornecer valores absolutos11. Portanto, embora a tecnologia NIRS seja valiosa para monitorar as tendências na oxigenação tecidual, deve-se ter cautela ao interpretar essas medições. Pesquisas futuras devem se concentrar no desenvolvimento de métodos para estimar a DPF nos tecidos cerebrais e musculares com precisão. Nesse ínterim, recomenda-se documentar os valores de DPF usados nos estudos para melhorar a reprodutibilidade dos resultados.
Outra característica anatômica que pode afetar as medidas do NIRS é a concentração de melanina na pele. A melanina, juntamente com a hemoglobina, é um cromóforo primário na pele47. Indivíduos com pigmentação cutânea mais escura apresentam melanossomos maiores e mais concentrados, o que pode levar a uma maior atenuação do sinal devido ao aumento da absorção de luz7. A força do sinal detectado depende da luz absorvida pelos cromóforos, das propriedades de dispersão de luz do tecido e da distância entre a fonte de luz e o detector47. Consequentemente, concentrações mais altas de melanina podem interferir na qualidade do sinal NIRS, levando a leituras atenuadas da saturação tecidual de oxigênio, principalmente no nível muscular48,49. Para levar em conta essas variações e melhorar a interpretabilidade dos dados NIRS em diversas populações, recomenda-se que a pigmentação da pele seja relatada usando a escala de classificação do tipo de pele de Fitzpatrick7.
Em relação à aplicabilidade desse protocolo na prescrição de exercícios, a tecnologia NIRS tem sido utilizada principalmente para avaliar o metabolismo muscular durante o exercício de endurance, particularmente em protocolos onde a oxidação do substrato serve como principal fonte de energia para a ressíntese de ATP. Evidências limitadas estão disponíveis sobre sua aplicação no treinamento resistido, mas uma revisão da literatura sugere que os efeitos agudos do treinamento de força no TSI dependem da composição das fibras musculares. Especificamente, músculos com maior proporção de fibras do tipo I, como o m.Vastus Lateralis , apresentam um ΔTSI maior em comparação com outros grupos musculares treinados na mesma intensidade. No entanto, a considerável heterogeneidade nas metodologias de estudo continua a limitar a generalização dos achados relatados. Os resultados preliminares deste estudo, juntamente com futuras publicações de protocolos padronizados, apoiarão aplicações mais amplas dessa tecnologia para prescrever a intensidade do exercício em diversos contextos50.
Em conclusão, os dispositivos vestíveis NIRS representam um avanço significativo no monitoramento não invasivo das respostas hemodinâmicas no nível microvascular durante o exercício, complementando as variáveis cardiopulmonares avaliadas pelo TCPE. Ao contrário dos métodos invasivos, o NIRS fornece dados em tempo real sobre o equilíbrio entre o fornecimento e o consumo de oxigênio sem interromper o movimento natural do atleta. Essa tecnologia identifica efetivamente os fatores limitantes do exercício central e periférico, detectando alterações em O 2-Hb, H-Hb e TSI em vários tecidos e intensidades de exercício. Os insights detalhados sobre variações na demanda metabólica e respostas fisiológicas destacam o potencial do NIRS para otimizar programas de treinamento e melhorar o desempenho atlético. Além disso, a capacidade do NIRS de avaliar a hemodinâmica microvascular cerebral e muscular oferece novas oportunidades para explorar as respostas fisiológicas a diferentes modalidades e intensidades de exercício. No geral, a tecnologia NIRS é uma promessa considerável para avançar nossa compreensão da fisiologia humana e contribuir para a pesquisa em ciência do exercício, fornecendo uma ferramenta valiosa para melhorar o desempenho atlético e refinar as estratégias de treinamento.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Agradecemos a todos os participantes deste estudo e à equipe técnica do laboratório pelo apoio nas medições realizadas no Laboratório de Fisiologia do Exercício. Os autores FC-B e ME-R foram parcialmente apoiados pelos III, IV e V Concursos de Pesquisa e Inovação da Faculdade de Ciências da Saúde (Faculdade de Medicina da Pontifícia Universidade Católica do Chile). O autor RC-C foi financiado por Projeto apoiado pelo Concurso de Projetos Regulares de Pesquisa, ano 2023, código LPR23-17, Universidad Tecnológica Metropolitana.
Materiais
| Name | Company | Catalog Number | Comments |
| Column Scale | SECA | 711 | There are numerous alternatives to this item |
| Portable Stadiometer | SECA | 217 | There are numerous alternatives to this item |
| 12-lead ECG | COSMED | Quark T12x | A 12-lead ECG provides a better understanding of HR during exercise and facilitates the detection of arrhythmias. |
| Pulse Oxymeter | COSMED | Integrated pulse oxymeter | |
| Ergoespirometer | COSMED | Quark-CPET | Calibration gases and calibration syringe are included |
| Cycle-ergometer | Ergoline GmH | ViaSprint 150P | There are numerous alternatives to this item. Must ensure compatibility with provided software |
| NIRS weareable | Artinis Medical Systems | Portalite | Articulated NIRS weareable fits the surface where it's placed upon. |
| NIRS weareable | Artinis Medical Systems | Portamon | Portamon device provides better results on high adipose-tissue surfaces. |
| Metabolic Data Management Software (OMNIA) | COSMED | Software will vary upon system choice | |
| NIRS Data Management Software (Oxysoft) | Artinis Medical Systems | Software will vary upon device choice | |
| Wireless Probe Type Ultrasound Scanner | SONUS | Duo LC | There are numerous alternatives to this item |
Referências
- Bassett, D. R. Limiting factors for maximum oxygen uptake and determinants of endurance performance. Med Sci Sports Exerc. 70 (1), 12-25 (2000).
- Seiler, S. What is best practice for training intensity and duration distribution in endurance athletes. Int J Sports Physiol Perform. 5 (3), 276-291 (2010).
- Palange, P., et al. Recommendations on the use of exercise testing in clinical practice. Eur Respir J. 29 (1), 185-209 (2006).
- Contreras-Briceño, F., et al. Intercostal muscles oxygenation and breathing pattern during exercise in competitive marathon runners. Int J Environ Res Public Health. 18 (16), 8287 (2021).
- Mier, C. M., Alexander, R. P., Mageean, A. L. Achievement of VO2max criteria during a continuous graded exercise test and a verification stage performed by college athletes. J Strength Cond Res. 26 (10), 2648-2654 (2012).
- Racinais, S., Buchheit, M., Girard, O. Breakpoints in ventilation, cerebral and muscle oxygenation, and muscle activity during an incremental cycling exercise. Front Physiol. 5, 142 (2014).
- Perrey, S., Quaresima, V., Ferrari, M. Muscle oximetry in sports science: An updated systematic review. Sports Med. 54 (4), 975-996 (2024).
- Contreras-Briceño, F., et al. Determination of the respiratory compensation point by detecting changes in intercostal muscles oxygenation by using near-infrared spectroscopy. Life (Basel). 12 (3), 444 (2022).
- Kozlova, S. G. The use of near-infrared spectroscopy in the sport-scientific context. J Neurol Neurol Diord. 4 (2), 203 (2018).
- Perrey, S. Non-invasive NIR spectroscopy of human brain function during exercise. Methods. 45 (4), 289-299 (2008).
- Barstow, T. J. Understanding near infrared spectroscopy and its application to skeletal muscle research. J Appl Physiol. 126 (5), 1360-1376 (2019).
- Kowalski, T., et al. Respiratory muscle training induces additional stress and training load in well-trained triathletes—randomized controlled trial. Front Physiol. 14, 1264265 (2023).
- Espinosa-Ramírez, M., et al. Sex-differences in the oxygenation levels of intercostal and vastus lateralis muscles during incremental exercise. Front Physiol. 12, 738063 (2021).
- Perrey, S. Evaluating brain functioning with NIRS in sports: Cerebral oxygenation and cortical activation are two sides of the same coin. Front Neuroergonomics. 3, 1022924 (2022).
- Thomas, R., Perrey, S. Prefrontal cortex oxygenation and neuromuscular responses to exhaustive exercise. Eur J Appl Physiol. 102 (2), 153-163 (2007).
- Kirby, B. S., Clark, D. A., Bradley, E. M., Wilkins, B. W. The balance of muscle oxygen supply and demand reveals critical metabolic rate and predicts time to exhaustion. J Appl Physiol. 130 (6), 1915-1927 (2021).
- Perrey, S. Training monitoring in sports: It is time to embrace cognitive demand. Sports (Basel). 10 (4), 56 (2022).
- Angius, L., et al. Transcranial direct current stimulation over the left dorsolateral prefrontal cortex improves inhibitory control and endurance performance in healthy individuals. Neuroscience. 419, 34-45 (2019).
- Dempsey, J. A., McKenzie, D. C., Haverkamp, H. C., Eldridge, M. W. Update in the understanding of respiratory limitations to exercise performance in fit, active adults. Chest. 134 (3), 613-622 (2008).
- Peltonen, J. E., et al. Cerebral and muscle deoxygenation, hypoxic ventilatory chemosensitivity and cerebrovascular responsiveness during incremental exercise. Respir Physiol Neurobiol. 169 (1), 24-35 (2009).
- Klem, G. H., Lüders, H. O., Jasper, H. H., Elger, C. The ten-twenty electrode system of the International Federation. Electroencephalogr Clin Neurophysiol Suppl. 52, 3-6 (1999).
- Vogiatzis, I., et al. Intercostal muscle blood flow limitation in athletes during maximal exercise. J Physiol. 587 (14), 3665-3677 (2009).
- Vogiatzis, I., et al. Intercostal muscle blood flow limitation during exercise in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 182 (9), 1105-1113 (2010).
- Contreras-Briceño, F., et al. Reliability of NIRS portable device for measuring intercostal muscles oxygenation during exercise. J Sports Sci. 37 (23), 2653-2659 (2019).
- Crum, E. M., O'Connor, W. J., Van Loo, L., Valckx, M., Stannard, S. R. Validity and reliability of the Moxy oxygen monitor during incremental cycling exercise. Eur J Sport Sci. 17 (8), 1037-1043 (2017).
- Vogiatzis, I., et al. Quadriceps muscle blood flow and oxygen availability during repetitive bouts of isometric exercise in simulated sailing. J Sports Sci. 29 (10), 1041-1049 (2011).
- Grassi, B., Quaresima, V. Near-infrared spectroscopy and skeletal muscle oxidative function in vivo in health and disease: A review from an exercise physiology perspective. J Biomed Opt. 21 (9), 091313 (2016).
- Duncan, A., et al. Measurement of cranial optical path length as a function of age using phase resolved near infrared spectroscopy. Pediatr Res. 39 (5), 889-894 (1996).
- Aebi, M. R., Willis, S. J., Girard, O., Borrani, F., Millet, G. P. Active preconditioning with blood flow restriction or/and systemic hypoxic exposure does not improve repeated sprint cycling performance. Front Physiol. 10, 1393 (2019).
- Cocking, S., et al. Repeated sprint cycling performance is not enhanced by ischaemic preconditioning or muscle heating strategies. Eur J Sport Sci. 21 (2), 166-175 (2021).
- Kligfield, P., et al. Recommendations for the standardization and interpretation of the electrocardiogram. J Am Coll Cardiol. 49 (10), 1109-1127 (2007).
- Dillon, H. T., et al. The effect of posture on maximal oxygen uptake in active healthy individuals. Eur J Appl Physiol. 121 (5), 1487-1498 (2021).
- DeCato, T. W., Haverkamp, H., Hegewald, M. J. Cardiopulmonary exercise testing (CPET). Am J Respir Crit Care Med. 201 (1), P1-P2 (2020).
- Skinner, J. S., Mclellan, T. H. The transition from aerobic to anaerobic metabolism. Res Q Exerc Sport. 51 (1), 234-248 (1980).
- Elmberg, V., et al. Reference equations for breathlessness during incremental cycle exercise testing. ERJ Open Res. 9 (2), 00566-02022 (2023).
- Borg, G. A. Psychophysical bases of perceived exertion. Med Sci Sports Exerc. 14 (5), 377-381 (1982).
- Perrey, S. Could near infrared spectroscopy be the new weapon in our understanding of the cerebral and muscle microvascular oxygen demand during exercise. J Sport Health Sci. 13 (4), 457-458 (2024).
- Orcioli-Silva, D., et al. Cerebral and muscle tissue oxygenation during exercise in healthy adults: A systematic review. J Sport Health Sci. 13 (4), 459-471 (2024).
- Kovalenko, B., Roskosky, M., Freedman, B. A. Effect of ambient light on near infrared spectroscopy. J Trauma Treat. 04 (03), (2014).
- Wik, L. Near-infrared spectroscopy during cardiopulmonary resuscitation and after restoration of spontaneous circulation: A valid technology. Curr Opin Crit Care. 22 (3), 191-198 (2016).
- Pirovano, I., et al. Effect of adipose tissue thickness and tissue optical properties on the differential pathlength factor estimation for NIRS studies on human skeletal muscle. Biomed Opt Express. 12 (1), 571 (2021).
- Van Beekvelt, M. C. P., Borghuis, M. S., Van Engelen, B. G. M., Wevers, R. A., Colier, W. N. J. M. Adipose tissue thickness affects in vivo quantitative near-IR spectroscopy in human skeletal muscle. Clin Sci (Lond). 101 (1), 21-28 (2001).
- Homma, S. Influence of adipose tissue thickness on near infrared spectroscopic signal in the measurement of human muscle. J Biomed Opt. 1 (4), 418 (1996).
- Gomes, A. C., et al. Body composition assessment in athletes: Comparison of a novel ultrasound technique to traditional skinfold measures and criterion DXA measure. J Sci Med Sport. 23 (11), 1006-1010 (2020).
- Delpy, D. T., Cope, M., Zee, P. V. D., Arridge, S., Wray, S., Wyatt, J. Estimation of optical pathlength through tissue from direct time of flight measurement. Phys Med Biol. 33 (12), 1433-1442 (1988).
- Talukdar, T., Moore, J. H., Diamond, S. G. Continuous correction of differential path length factor in near-infrared spectroscopy. J Biomed Opt. 18 (5), 056001 (2013).
- Zonios, G., Bykowski, J., Kollias, N. Skin melanin, hemoglobin, and light scattering properties can be quantitatively assessed in vivo using diffuse reflectance spectroscopy. J Invest Dermatol. 117 (6), 1452-1457 (2001).
- Patel, N. A., Bhattal, H. S., Griesdale, D. E., Hoiland, R. L., Sekhon, M. S. Impact of skin pigmentation on cerebral regional saturation of oxygen using near-infrared spectroscopy: A systematic review. Crit Care Explor. 6 (2), e1049 (2024).
- Wassenaar, E. B., Van Den Brand, J. G. H. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clin Monit Comput. 19 (3), 195-199 (2005).
- Miranda-Fuentes, C., et al. Changes in muscle oxygen saturation measured using wireless near-infrared spectroscopy in resistance training: A systematic review. Int J Environ Res Public Health. 18 (8), 4293 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados