Method Article
Near-Infrared Spectroscopy 웨어러블 장치를 사용하여 운동 중 중추 및 주변 장치 제한 식별
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 근적외선 분광법(NIRS) 기술을 통합하여 심폐 운동 검사 중 전전두엽 피질, 호흡기(m.Intercostales) 및 운동 운동(m.Vastus Lateralis) 근육의 국소 혈액 및 산소 농도 변화를 평가하여 운동 수행에 영향을 미치는 중추 및 말초 제한 요인을 식별할 수 있습니다.
초록
신체 활동이 활발한 피험자와 운동선수의 유산소 능력을 평가하기 위한 황금 표준은 최대 산소 소비량 검사(VO2–max)이며, 이는 증분 운동 중 에르고폐계에서 호흡별 방법을 통해 얻은 호기 가스 및 심폐 변수를 분석하는 것을 포함합니다. 그러나 이 방법은 근육 수준의 대사 변화를 설명할 수 없습니다. 근적외선 분광법(NIRS)은 조직의 미세혈관에서 산소화(O2-Hb) 및 탈산소화(H-Hb) 헤모글로빈의 농도를 정량화하여 국소 산소 농도(Tissular Saturation Index, TSI)를 평가하는 유용한 기술로 부상했습니다. NIRS 응용 분야는 호흡 및 운동 근육으로 확장되어 각각 호흡 비용(COB) 및 말초 작업량과 관련된 대사 변화를 평가합니다. 또한 전전두엽 피질과 같은 대뇌 영역을 NIRS 기술로 탐색하여 스포츠 수행과 관련된 운동 작업의 계획 또는 아이디어 구상과 관련된 인지 요구와 관련된 생리적 변화를 평가했습니다. 따라서,O2-Hb, H-Hb 및 TSI에서 운동에 의한 변화(D)를 분석함으로써, 특히 지구력 훈련이 체력의 주요 구성 요소(예: 달리기, 사이클링, 트라이애슬론 등)인 경우, 중추 및 말초 운동의 제한을 식별할 수 있다. 이러한 요인을 해결하는 것은 코치와 운동 생리학자가 운동 성과를 최적화하고 주요 운동 제한 요인에 초점을 맞춘 훈련 전략을 통합하는 데 가장 중요합니다. 이 연구는 NIRS 기술이 탑재된 웨어러블 장치를 사용하여 VO2-max 테스트 중 운동선수에게 일반적으로 등록된 심폐 변수와 함께 TSI, O2-Hb 및 H-Hb의 운동 변화를 분석하기 위한 프로토콜을 간략하게 설명합니다. 이 접근법은 운동 진행 및 스포츠 성능 향상을 멈추는 것과 관련된 주요 시스템을 식별하기 위한 포괄적인 방법을 제공합니다.
서문
지구력 운동 선수는 고강도 운동을 지속하고 운동 능력을 향상시키기 위해 산소 공급과 흡수의 효율적인 균형에 의존합니다 1,2. 최대 산소 섭취량 검사(VO2-max)는 운동 강도증가 1 동안 날숨 가스 및 심폐 변수를 분석하여 스포츠 성능을 결정하는 중요한 생리학적 평가입니다. 폐활량 측정법 또는 심폐 운동 검사(CPET)로 알려진 이 평가는 심혈관, 호흡기 및 근육계의 운동 반응을 반영합니다3. 이와 같이 호흡 비용(COB)이라고 하는 호흡과 관련된 에너지 비용 증가는 주변 조직의 영양분과 산소에 대한 수요를 증가시킵니다. 이러한 현상은 활동적인 움직임에 관여하는 근육으로 가는 혈류를 감소시킬 수 있으며, 이로 인해 신체 활동에 대한 내성이 감소하고 대사 반사로 인해 운동 진행이 조기에 중단되는 것으로 보고되었다4.
VO2–max 검사 중에는 유산소 대사에서 무산소 대사로의 전환을 표시하는 특정 운동 강도에 해당하는 환기 역치(VT)를 식별할 수도 있습니다(유산소 역치 또는 환기 역치 1[VT1], 무산소 역치 또는 호흡 보상점[RCP] 또는 환기 역치 2[VT2])5. VT는 증분 운동 중 대사 변화를 보상하는 환기 반응을 반영한다6. 이러한 임계값을 식별함으로써 CPET는 고강도 운동 중에 결정적으로 관여하는 여러 생물학적 시스템의 반응을 통합하여 포괄적인 평가를 제공합니다.
그러나 폐활량 측정은 CPET를 평가하기 위한 황금 표준으로 널리 간주되지만 근육 수준에서 발생하는 대사 변화를 포착하지는 못합니다. 이러한 변화는 지구력 운동 선수의 고강도 운동 중 진행 부족과 관련된 생리적 제한 요인을 이해하는 데 중요합니다. 이러한 맥락에서 NIRS 기술은 미세혈관 근육 수준7에서 혈류역학적 변수를 분석하는 데 도움이 되는 운동 과학의 귀중한 도구로 부상했습니다.
최근 몇 년 동안 스포츠 전문가와 연구자들은 NIRS 기술이 탑재된 다양한 상업용 웨어러블을 사용하여 운동 중 비침습적 근육 변화를 탐색하고 있으며, 이 기술로 VT1 및 VT2를 결정할 수 있는 기능을 제공하고 있다8. 따라서 NIRS 및 CPET의 데이터를 통합적으로 분석하면 운동에 대한 생리적 반응에 대한 포괄적인 이해를 얻을 수 있습니다.
NIRS 기술은 수정된 Beer-Lambert 법칙을 활용하여 운동7 동안 옥시헤모글로빈(O 2-Hb) 및 디옥시헤모글로빈(H-Hb) 농도의 변화(D)를 정량화합니다. 국소 조직 수준에서,O2-Hb의 감소는 국소 대사 요구량의 증가를 반영하는 반면, H-Hb의 증가는 산소 추출의 증가를 반영한다. 총 헤모글로빈(tHb)은O2-Hb와 H-Hb의 합으로 국소 조직 혈류의 지표로 사용됩니다. 반대로,O2-Hb와 H-Hb의 차이(Hbdiff)는 조직 산소 추출(9)의 지수를 제공한다. O2-Hb 대 tHb의 비율로 계산된 구상포화도지수(TSI)는 조직 산소포화도 수준을 반영하고 국소 산소 전달과 흡수 사이의 균형을 나타낸다(10,11). 따라서 NIRS 데이터는 미세혈관 수준의 생리학적 상태에 대한 중요한 통찰력을 제공하여 CPET에서 얻은 정보를 보완하는 조직 산소화 및 혈류역학에 대한 자세한 이해를 제공합니다.
NIRS 기술이 제공하는 이러한 상세한 이해는 많은 실제 응용 분야로 확장됩니다. 최근 연구는 NIRS의 다양성을 강조하고 호흡기12,13 및 운동 근육7뿐만 아니라 전전두엽 피질 (PFC) 14,15과 같은 운동 행위 아이디어 도출에 관여하는 뇌 영역을 모니터링하는 데 실용적인 응용 프로그램을 보여줍니다. 이러한 광범위한 적용 가능성은 다양한 유형의 근육 수축(동심원 또는 편심 또는 등척성 수축) 및 운동에 대한 생리학적 반응에 대한 포괄적인 통찰력을 제공하는 NIRS의 능력을 강조합니다.
NIRS는 근육 및 대뇌 수준 모두에서 운동 유발 DTSI를 분석함으로써 운동의 진행에 영향을 미치는 말초 및 중추 제한 요인 간의 연관성을 식별할 수 있는 귀중한 잠재력을 제공합니다16,17. 예를 들어, 중추 제한 요인 중 혐기성 대사로 인한 수소 수치 상승과 고강도 운동 중 혈중 젖산 증가로 인한 보상적 과호흡으로 인한 대뇌 혈관 수축으로 인한 혈류 감소는 전전두엽 피질의 TSI 감소에 중요한 기여를 합니다17,18. 대조적으로, 말초 제한 요인은 운동 근육 조직에서 산소 공급과 수요 사이의 불균형을 특징으로 한다19. 국소 산소 전달이 감소하고 산소 소비가 증가하면 TSI20 감소로 입증된 것처럼 조직 탈산소화로 이어질 수 있습니다. 이러한 구분은 고강도 운동 중 성능 제한의 다면적인 특성을 강조하며, 중추 및 말초 메커니즘이 모두 중요합니다. 이러한 이해는 운동 중 이러한 제한 요인의 발병을 지연시키는 것이 운동 능력 향상에 기여할 수 있음을 시사합니다.
이러한 한계를 식별하는 데 있어 NIRS 기술의 잠재력을 최대한 활용하려면 고품질 데이터 수집 및 분석을 보장하기 위해 표준화된 절차가 필수적입니다. 이 문서는 NIRS 기술을 사용하여 생리학적 데이터를 수집하고 지구력 운동선수의 고강도 운동 중 중추 및 말초 제한 요인 간의 관계를 설명하기 위해 최대 지구력 운동 테스트를 수행하는 방법을 간략하게 설명합니다. 제안된 프로토콜은 이러한 제한 요인의 기저에 있는 생리학적 현상을 평가할 때 일관성과 정확성을 보장하기 위한 표준화된 접근 방식을 제공합니다.
프로토콜
이 프로토콜은 Pontificia Universidad Católica de Chile의 기관 검토 위원회(프로젝트 nº 210525001 및 220608010)의 승인을 받았으며 연구는 헬싱키 선언에 따라 수행되었습니다. 모든 참가자는 설명된 테스트에 참여하기 전에 서면 동의서를 제공했습니다.
1. NIRS 웨어러블의 배치 및 설정
참고: 다양한 NIRS 웨어러블 및 데이터 수집 소프트웨어를 활용할 수 있습니다. 연구원은 적절한 설정 및 사용을 보장하기 위해 제조업체의 지침과 지침을 철저히 참조해야 합니다. 이 연구에서는 NIRS 신호의 연속파 레지스터를 사용하는 장치를 사용합니다. 이러한 상용 장치는 사용하기 쉽지만 기준 또는 기준선 위상에 대한 광 감쇠의 변화만 감지할 수 있으며 NIRS의 시간 영역 레지스터를 사용하는 다른 장치와 같이 절대 농도를 감지할 수 없습니다.
- NIRS 웨어러블 준비 및 일반 배치 지침
- 장치를 배치하고 측정을 시작하기 전에 모든 웨어러블이 완전히 충전되었는지 확인하십시오.
알림: 이 연구에 사용된 장치의 경우 제조업체는 완전히 충전된 배터리가 6-8시간 연속으로 등록할 수 있다고 보고합니다. - 모든 웨어러블에 양면 접착 테이프를 부착하여 참가자의 피부에 고정하고 테이프가 발광기 및 감지기를 방해하지 않도록 합니다.
- 모든 웨어러블을 접착 필름 층으로 덮은 다음 땀으로부터 보호하기 위해 방수 접착 드레싱 층을 덮습니다.
- 장치를 배치하기 전에 알코올 패드로 대상 영역을 청소하여 레지스터를 방해할 수 있는 잔여물(예: 크림, 화장품 등)을 제거하십시오. 필요한 경우 머리카락이 NIRS 신호를 방해할 수 있으므로 대상 부위 주변을 면도하십시오.
알림: 잠재적인 오염을 방지하기 위해 참가자의 피부에 장치를 놓기 전에 철저한 손 세척을 수행하는 것이 좋습니다. 장갑을 착용하는 것이 권장되며, 장갑을 착용하면 오염 위험을 더욱 줄일 수 있습니다. - 모든 웨어러블이 참가자의 피부에 올바르게 배치되면(섹션 1.2 참조) 탄성 치료 테이프 층으로 고정합니다. 추가 고정이 필요한 경우 어두운 색상의 탄성 붕대 랩을 사용하여 과도한 압박으로 인해 측정값이 변경되지 않도록 합니다(기존 혈압계로 측정한 25mm Hg 모세관 폐색 압력 미만).
- 주변광이 침투하지 않도록 모든 웨어러블 위에 검은색 천을 씌웁니다. 천으로 해당 부위를 덮을 수 없는 경우(약6cm2) 검은색 탄성 치료 테이프를 사용하여 주변광을 차단합니다.
- 장치를 배치하고 측정을 시작하기 전에 모든 웨어러블이 완전히 충전되었는지 확인하십시오.
- NIRS 디바이스 배치
알림: NIRS 웨어러블 장치가 ON/OFF 및 설정 버튼에 쉽게 접근할 수 있도록 배치되어 있는지 확인하십시오.- 전전두엽 피질(Prefrontal Cortex): NIRS 프로브를 참가자의 상측 섬모궁에서 약 10mm 위에 있는 왼쪽 또는 오른쪽 배외측 전전두엽 피질에 배치하며, 이는 수정된 국제 EEG 10-20 시스템21에 따른 Fp1 전극 배치와 유사합니다.
- m. 늑간: 우측 전방 겨드랑이 7선의 22,23,24번째 늑간 공간에 NIRS 프로브를 놓습니다. 어떤 이유로 오른쪽 반흉부 위에 위치하지 않는 경우 왼쪽 반흉부 위에 위치하지만 심박수 신호는 왼쪽에서 더 뚜렷할 수 있습니다.
- NIRS 침투 깊이를 확인하려면 B-모드 초음파를 사용하여 피하 조직에서 m.Intercostales의 바깥쪽 경계까지의 거리를 확인합니다. m.Intercostales에서 측정하려면 피부와 근육 사이의 거리가 15mm 미만인지 확인하십시오.
- m.Vastus Lateralis: NIRS 프로브를 허상선의 중간점에서 측면으로 5cm 배치하여 슬개골의 위쪽 가장자리와 대퇴골 24,25,26의 대퇴골을 연결합니다.
- 지방 조직 두께(ATT)가 NIRS 신호의 레지스터를 변경하지 않도록 하려면 스킨폴드 두께를 측정하여 NIRS 침투 깊이(27)를 확인합니다. m.Vastus Lateralis에서 측정하려면 ATT가 20mm 미만인지 확인하십시오.
- NIRS 소프트웨어 설정
- 모든 NIRS 웨어러블이 올바르게 배치되면(섹션 1.2 참조) 측정을 시작하기 전에 전원을 켭니다.
- 제조업체에서 제공하는 데이터 수집 소프트웨어를 실행하고, 새 파일을 생성하고, NIRS 웨어러블을 연결합니다.
- 모든 NIRS 웨어러블이 성공적으로 연결되면 데이터 수집 및 평가된 조직의 아날로그-디지털 변환을 위해 샘플링 속도를 10Hz로 설정합니다. 전전두엽 피질 측정의 경우, 각 참가자의 연령에 따른 DPF에 따라 차등 경로 길이 인자(DPF)를 조정한다28. 근육 측정의 경우 운동 선수를 연구 대상으로 하는 이전 프로토콜에서 사용된 것처럼 DPF를 4로 설정합니다29,30.
2. 에르고피로계의 교정 및 설정
- 볼륨 캘리브레이션
- 제조업체에서 제공한 폐체계의 소프트웨어를 열어 교정 프로세스를 시작합니다.
- 주사기 어댑터를 사용하여 유량계를 28mm 터빈에 부착합니다. 주름관 하나를 주사기 어댑터에 연결하고 다른 튜브를 3L 교정 주사기에 연결합니다.
- 일정한 유속을 유지하면서 6번의 인출/주입 조작을 수행합니다. 완료되면 소프트웨어가 교정 테스트를 통과했는지 자동으로 확인합니다.
- 가스 캘리브레이션
알림: 가스 보정을 시작하기 전에 유량 보정이 완료되었는지 확인하십시오.- 공기 보정
- s가 s를 확인하십시오.amp가스 분석기의 라인이 교정 포트에서 분리되어 있고 자유롭게 매달려 있습니다. 그런 다음 보정 프로세스를 초기화합니다.
- 교정하는 동안 산소(O2)와 이산화탄소(CO2)의 농도가 크게 변하지 않기 때문에(5% 미만) 안정적인 평탄선이 관찰됩니다. 공기 보정이 성공적으로 완료되면 대사 가스 보정을 진행합니다.
- 대사 가스 보정
- 가스 밸브를 열고 압력계를 확인하여 시스템에 적절한 압력이 전달되는지 확인하십시오 (특정 지침은 제조업체에 문의하십시오).
- 샘플 라인을 교정 포트에 연결하고 교정 프로세스를 초기화합니다. 제조업체의 조언에 따라 보정을 시작하기 전에 3분 예열을 수행하십시오.
- 올바르게 수행되면 3분 예열 기간 후에 두 개의 평평한 선, 즉 실내 공기(약 21.00% O2 및 0.04% CO2) 사이에서 변동하는 선과 보정 가스 (16.00% O2 및 5.00% CO2) 사이에서 변동하는 선.
- 마지막으로, 샘플 라인을 교정 포트에서 분리하고 향후 테스트에 사용할 마우스피스에 부착합니다.
- 공기 보정
3. ECG 전극 배치(12 리드)
- 크림으로 각질을 제거하거나 필요한 경우 전극 배치 부위의 머리카락을 면도하여 피부를 준비합니다. 표면 조직 잔여물을 제거하기 위해 알코올 패드로 해당 부위를 청소하십시오.
- ECG 전극을 다음과 같이 배치합니다31:
- 바이폴라 리드(사지 리드 전극)를 다음과 같이 배치합니다. 왼팔(LA): 쇄골하 포사의 왼쪽; 오른팔(RA): 쇄골하 포사의 오른쪽; 왼쪽 다리(LL): 왼쪽 대퇴골두의 전방 돌출부; 오른쪽 다리(RL): 오른쪽 대퇴골두의 전방 돌출부.
- 다음과 같이 흉부 리드 전극을 배치합니다 : V1 : 흉골 오른쪽의 4번째 늑간 공간; V2: 흉골 왼쪽의 4번째 늑간 공간(V1과 일치); V3: V2와 V4의 중간; V4 : 쇄골 중앙선의 5번째 늑간 공간; V5: V4와 같은 수준의 전방 겨드랑이 선; V6 : V4 및 V5와 같은 수준의 중간 겨드랑이 선.
4. 증분 최대 운동 검사(심폐 운동 검사, CPET)
- 참가자에게 자전거에 앉도록 요청하고 최적의 편안함과 위치를 위해 시트와 핸들바가 높이에 맞게 조정되었는지 확인합니다.
알림: 무릎이 완전히 펴진32에서 약간 구부러지도록 시트 높이를 설정하는 것이 좋습니다. 핸들바는 팔꿈치가 약간 구부러질 수 있도록 위치해야 합니다. - 맥박 산소 측정기를 참가자의 귓불에 부착하고 알코올 패드로 닦아 사이트가 깨끗한지 확인합니다.
- 프로토콜을 설명하고 참가자에게 테스트 전, 테스트 중, 테스트 후에 마스크를 통해 숨을 쉬도록 지시합니다.
알림: 참가자는 폐체계의 판독값에 영향을 미칠 수 있으므로 마스크를 착용하는 동안 말하거나 휘파람을 불지 않아야 합니다(33). - 참가자가 위치를 잡고 준비되면 참가자가 오른쪽 다리를 뻗고 시작 지시를 위해 2분 동안 기다리게 합니다(초기 휴식 stage). 참가자가 여성/남성의 경우 각각 80W·kg-6 및 0.6W·kg-6 에서 1분 동안 0.8–1rpm 사이의 케이던스로 페달을 밟도록 합니다(워밍업 단계). 그런 다음 참가자가 탈진(운동 단계)에 도달할 때까지 여성의 경우 20W·min-¹, 남성의 경우 25W·min-¹의 비율로 작업량을 증가시킵니다.
- 운동 단계를 완료한 후 참가자에게 3분 동안 가만히 있고 마스크에 숨을 계속 들이마시도록 지시합니다(쿨다운 또는 회복 단계).
- 운동 프로토콜이 완료되면 귓불, 마스크, 세 가지 NIRS 웨어러블 및 ECG 전극에서 맥박 산소 측정기를 조심스럽게 제거합니다.
알림: 실험실 주변 조건(예: 기온 ~20 ± 2°C, 상대 습도 ~40% ± 5%)을 유지하려면 중요한 기준입니다. 일부 참가자는 높은 땀 속도를 보일 수 있으며, 이는 피부에 장치를 고정하는 데 방해가 되고 NIRS 데이터 기록에 영향을 미칩니다. 인공호흡기를 사용하면 땀을 흘려 뜨거운 체온 조절을 줄이는 데 도움이 될 수 있습니다.
결과
CPET를 완료하는 동안 모든 피험자에서 호흡 곤란, 다리 피로 및 인지된 운동 속도(RPE)의 증상이 보고되었습니다. NIRS 장치의 보완적인 사용은 피험자의 감각 평가에 불편함을 추가하지 않았습니다. 또한, 과도한 생리적 스트레스와 관련된 위험 사건에 의해 CPET 평가를 중단하지 않았다.
우리는 전국 사이클링 클럽에서 모집한 두 명의 경쟁력 있는 남성 사이클리스트를 연구했습니다. 이 연구의 포함 기준은 정상 체질량 지수(20–25kg·m-2)와 신체 활동이 활발한 참가자(주당 ≥150분 또는 ≥75분)였습니다. 이 연구의 제외 기준은 호흡기, 심혈관, 대사, 근골격계 또는 종양 질환의 병력 또는 연구 평가 최소 2주 전의 감염성 또는 염증성 과정이었습니다.
NIRS 기술이 탑재된 장치를 사용하여 운동 강도 증가로 인한 대사 변화로 인한 혈류역학 및 조직 산소화 변화의 비침습적 기록과 함께 CPET를 완료하면 뇌 영역의 변화와 관련된 중추 제한 요인과 운동 강도 증가에 대한 호흡기 또는 근골격계 반응과 관련된 말초 제한 요인을 식별할 수 있습니다. 테스트 프로토콜은 참가자 준비, 운동 테스트 실행 및 관련 생리학적 데이터 수집을 포함한 일련의 단계를 포함합니다.
CPET-NIRS 프로토콜의 성공적인 실행은 여러 매개변수에 걸쳐 명확하고 일관된 데이터로 입증됩니다. 초기 휴식 단계에서는 심박수(HR), 맥박 산소 포화도(SpO2) 및 NIRS 판독값과 같은 측정값을 기록하여 기준선을 설정합니다. 낮은 작업량 페달링을 특징으로 하는 워밍업 단계는 참가자가 작업량이 점진적으로 증가하는 증분 운동 단계를 준비합니다( 그림 1 참조).

그림 1: 운동 프로토콜 체계의 실험적 설계. 연구에 사용된 운동 프로토콜의 단계를 개략적으로 표현하여 심폐 운동 테스트 프로토콜의 흐름에 해당하는 휴식(R), 워밍업(W), 운동(E), 마무리(F) 및 중지(S)와 같은 주요 이벤트를 강조합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
통제된 실험실 주변 조건(기온 ~20 ± 2°C, 상대 습도 ~40% ± 5%)에서 평가한 두 명의 남성 운동선수의 CPET(그림 2) 및 NIRS(그림 3 및 그림 4) 데이터의 대표적인 결과가 표시됩니다. (i) 참가자 1(그림 2A 및 그림 3) (연령: 33세, 체중: 80kg, 신장: 178cm, 최대 작업 부하: 300W, VO2-max: 46 mL·kg-1·min-1, VE: 177 L·min-1, HR-max(%예측, 220년): 100%, PetCO2: 27mmHg); (ii) 참가자 2(그림 2B 및 그림 4)(연령: 26세, 체중: 67kg, 키: 178cm, 최대 작업량: 300W, VO2-최대: 51mL·kg-1·min-1, VE: 131L·min-1, HR-max(% 예측, 220세): 93%, PetCO2: 33mmHg).
두 참가자 모두에서 VO2(산소 소비량), VCO2(이산화탄소 생성), RQ(호흡 지수, VCO2· VO 2-1), HR, VE(폐 환기) 및 RR(호흡수)은 VO2의 최대 값에 도달할 때까지 운동 강도가 증가함에 따라 지속적으로 상승합니다(그림 2 참조).
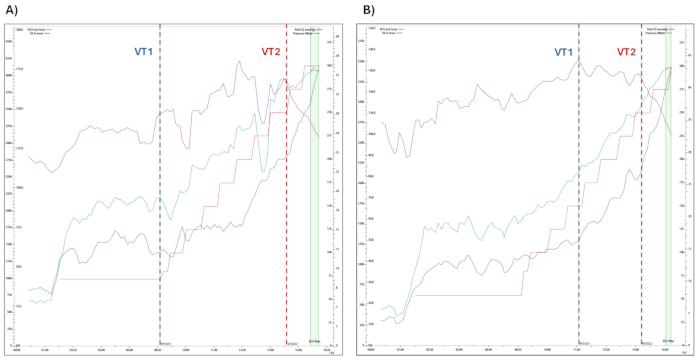
그림 2: CPET 중 평가된 생리적 변수의 변화. 산소 소비량(VO2), 분간 환기(VE), 호기말 CO2 압력(PetCO2) 및 출력(와트)을 포함하여 심폐 운동 검사 중에 측정된 생리학적 변수의 진행을 보여줍니다. 인공호흡 임계값 1과 2(VT1 및 VT2) 사이의 전환은 운동 단계 내에 표시됩니다. (a) 참가자 1 및 (b) 참가자 2. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
NIRS 데이터는 CPET 중 국소 대사 수요에 대한 통찰력을 제공했습니다. 목표 조직(근육 대 뇌)에서 관찰되는 운동으로 인한 변화는 특정 조직과 분석된 운동의 강도에 따라 다릅니다. 따라서 운동 유발 NIRS 데이터를 해석하는 유용한 생리학적 프레임워크는 Skinner와 McLellan34가 제안한 운동 강도의 삼중 모델입니다. 이 모델에서 저자는 VT에 의해 정의된 세 가지 영역, 즉 I단계 또는 호기성, (ii) II단계 또는 호기성 혐기성 전이, (ii) III단계 또는 "대사 불안정성"을 설명합니다.
VT2 (단계 I 및 II) 미만의 운동 강도에서 O2-Hb의 감소와 H-Hb의 증가는 근육 수준에서 발생합니다 - 국소 혈류의 매개 변수로서 T-Hb에 큰 변동이없는 경우. 당사의 CPET-NIRS 프로토콜은 반복적인 근육 수축/이완을 수반하는 주기적인 운동으로 구성되어 있으므로 T-Hb의 변동이 최소화될 것으로 예상됩니다. 그러나 운동으로 인한 변화는 평가되는 목표 근육 조직에 따라 다릅니다. 운동 근육에서 m.Vastus Lateralis와 같이 운동 강도의 점진적인 증가는 작업량에 수반되는 NIRS 데이터 변경을 유도합니다( 그림 3A 참조). 이와는 대조적으로, 늑간근(m.Intercostales )과 같은 부속 호흡 근육에서는 변화가 작업량보다는 환기 변화와 동시에 일어난다( 그림 3B 참조). PFC에서O2-Hb, H-Hb 및 T-Hb의 증가는 혈류가 운동에 의해 유도된 국소 요구량을 초과하기 때문에 관찰됩니다. 또한 TSI가 약간 감소하는 것을 볼 수 있습니다( 그림 3C 참조). 평가된 모든 조직에서 TSI 매개변수는 운동 강도가 증가함에 따라 감소하므로 m.Vastus Lateralis 의 변화는 m.Intercostales 및 PFC보다 더 악명이 높습니다( 그림 3D 참조).

그림 3: 중앙 제한의 예(참가자 1). CPET 프로토콜 중 NIRS 데이터(이벤트: W = 워밍업, E = 운동, VT1 = 환기 임계값 1 또는 유산소 환기 임계값, VT2 = 환기 임계값 2 또는 혐기성 환기 임계값, F = 최종 운동 또는 VO2-max). (A) m.Vastus Lateralis, (B) m.Intercostales, (C) 전전두엽 피질(PFC). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
운동으로 인한 대사 요구가 증가함에 따라, 특히 VT2 이상의 강도(3단계 또는 "대사 불안정")에서 근육(운동 및 호흡 근육) 및 PFC 수준 모두에서 흥미로운 생리학적 반응이 발생합니다. 이는 H-Hb의 현저한 증가와 함께O2-Hb 및 tHb의 현저한 감소로 구성되며, 이는 TSI의 뚜렷한 감소를 뒷받침하는 측면입니다.
고강도 운동 중 환기 요구량이 높은 피험자에서 VE와 RR의 기하급수적인 증가는 "대사 기원"의 CO2 증가로 인해 높은 과호흡을 유발합니다. 이러한 과호흡은 뚜렷한 뇌 혈관 수축을 유발할 수 있으며, 이 대표적인 피험자에서 볼 수 있듯이 중추 제한에 의해 수행 능력을 제한할 수 있습니다. 이론적으로, NIRS 데이터에서 관찰된 변화는 CPET에 등록된 CO2(PetCO2)의 기압 호기말 압력의 급격한 감소로 추론된 저탄산증에 의해 유도된 뇌 혈관 수축의 결과입니다(그림 2 참조). 이러한 생리적 변화는 운동에 의해 유발된 호흡곤란 증가와 높은 관계가 있는 것으로 나타났으며, 이는 수정된 Borg's scale35,36을 사용하여 등록되었습니다.
반면에, 운동 요구량이 높지만 호흡 요구량이 높지 않은 피험자는 저탄혈증에 의한 뇌 혈관 수축을 나타내지 않습니다. 결과적으로, NIRS 데이터는 중간 정도의 운동 강도에서 관찰된 것과 같은 변화를 계속 반영할 수 있습니다. 이러한 피험자에서 운동 수행은 중추 제한 요인이 아닌 말초 제한 요인에 의해 제한됩니다( 그림 4 참조). 이러한 생리적 변화는 운동으로 인한 다리 피로 증가와 높은 관계가 있는 것으로 나타났습니다.
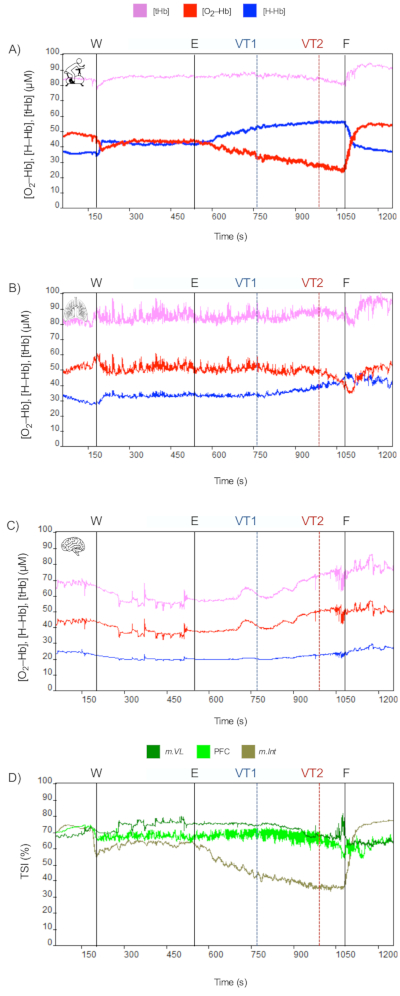
그림 4: 주변 장치 제한의 예(참가자 2). CPET 프로토콜 중 NIRS 데이터(이벤트: W = 워밍업, E = 운동, VT1 = 환기 임계값 1 또는 유산소 환기 임계값, VT2 = 환기 임계값 2 또는 혐기성 환기 임계값, F = 최종 운동 또는 VO2–max). (A) m.Vastus Lateralis, (B) m.Intercostales, (C) 전전두엽 피질(PFC). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
NIRS 기술이 대뇌 및 근육 영역 모두에서 미세혈관 혈류역학을 평가하는 데 있어 그 타당성과 신뢰성을 입증했다는 점을 감안할 때, NIRS 웨어러블을 운동 성능을 평가하고 유산소 또는 지구력 운동선수의 중추 및 말초 운동 제한 요인을 식별하기 위한 CPET의 보완 도구로 사용할 수 있는 상당한 잠재력이 있습니다37,38. 그러나 이 기술의 이점을 극대화하려면 정확한 측정을 보장하기 위해 몇 가지 고려 사항을 해결해야 합니다.
NIRS 웨어러블 장치 배치에 대한 일반 지침에는 운동 중 움직임이 NIRS 신호(아티팩트)에 영향을 미칠 수 있으므로 목표 조직에 대한 위치를 조정하고 참가자의 피부에 단단히 부착되도록 하는 것이 포함됩니다.7. 이를 위해 장치는 피부와 완전히 접촉하고 양면 접착 테이프를 사용하여 부착하여 발광체와 감지기가 막히지 않도록 해야 합니다. 안정성을 높이기 위해 탄성 치료용 테이프를 장치에 붙일 수 있습니다. m.Vastus Lateralis와 같이 운동 중에 활발하게 사용되는 팔다리에 장치를 놓을 때 탄력 붕대 랩을 사용하여 사이클링 중 안정성을 높일 수 있습니다. 그러나 NIRS 옵토드 주변의 과도한 압축은 국소 혈류를 변경하고 잠재적으로 NIRS 측정의 정확도에 영향을 미칠 수 있으므로 매우 중요합니다(압력은 모세관 관류 압력, ~25mm Hg보다 높지 않음)7. NIRS 장치 위에 사용되는 모든 테이프 또는 붕대는 주변광39,40의 간섭을 방지하기 위해 검은색으로 하는 것이 좋습니다. 또한 테스트 환경의 조명이 어두워지면 NIRS 신호 정확도에 대한 잠재적인 중단을 최소화할 수 있습니다.
장치를 적절하게 배치하고 고정하는 것이 필수적이지만 NIRS 측정에 영향을 줄 수 있는 개별 해부학적 특성을 고려하는 것도 마찬가지로 중요합니다. 한 가지 주요 제한 사항은 NIRS 측정의 정확도가 지방 조직 두께(ATT)41,42와 같은 요인에 의해 영향을 받을 수 있다는 것입니다. NIRS에 대한 최대 침투 깊이는 광원과 검출기(43) 사이의 거리의 대략 절반이다. ATT가 증가함에 따라, 기저 골격근에서 발생하는 NIRS 신호의 비율은 감소한다11. 이러한 신호 기여도의 감소는 다른 발색단(42) 중에서도O2-Hb 및 H-Hb의 수준을 낮춘다. 따라서 근육에 적절한 빛이 침투하도록 ATT를 측정하는 것이 좋습니다. 캘리퍼 또는 초음파는 두 방법 모두 운동 선수의 신체 구성을 정확하게 평가하기 때문에 이러한 목적으로 사용할 수 있습니다. 그러나, 후자는 우수한 정확도를 제공하며, 바람직할 수있다(44).
ATT 외에도 NIRS 측정의 정확도는 수정된 Beer-Lambert 법칙45를 통해 O2–Hb 및 H–Hb의 농도를 계산하는 데 사용되는 DPF(Differential Path Length Factor)의 영향을 받습니다. 대부분의 상용 NIRS 장치는 일정한 강도로 빛을 방출하고 일정한 DPF11을 가정하는 연속파 시스템을 사용합니다. 그러나 DPF는 두개골과 ATT41,46을 포함한 개인의 해부학적 차이로 인해 다르기 때문에 고정된 값이 아닙니다. 또한, 개인별 DPF의 변동성과 뼈, 근육량, 지방 조직 분포의 변화와 같은 성별 간의 해부학적 특성의 차이도 측정의 정확도에 영향을 미칠 수 있다28. 일정한 DPF의 가정으로 인해, 이들 장치는 절대값(11)을 제공하는 대신 기준선에서O2-Hb 및 H-Hb의 상대적 변화만 측정할 수 있다. 따라서 NIRS 기술은 조직 산소화의 추세를 모니터링하는 데 유용하지만 이러한 측정을 해석할 때는 주의를 기울여야 합니다. 추가 연구는 뇌 및 근육 조직에서 DPF를 정확하게 추정하는 방법을 개발하는 데 중점을 두어야 합니다. 그 동안에는 결과의 재현성을 개선하기 위해 연구에 사용된 DPF 값을 문서화하는 것이 권장됩니다.
NIRS 측정에 영향을 줄 수 있는 또 다른 해부학적 특성은 피부 멜라닌 농도입니다. 멜라닌은 헤모글로빈과 함께 피부의 주요 발색단이다47. 피부색이 짙은 사람은 멜라노솜이 더 크고 집중되어 있어 광 흡수 증가로 인해 신호 감쇠가 더 커질 수 있다7. 검출된 신호의 세기는 발색단에 의해 흡수되는 빛, 조직 광 산란 특성, 및 광원과 검출기(47) 사이의 거리에 따라 달라진다. 결과적으로 멜라닌 농도가 높으면 NIRS 신호 품질을 방해하여 주로 근육 수준48,49에서 산소 조직 포화도 판독값이 약화될 수 있습니다. 이러한 차이를 고려하고 다양한 인구 집단에 대한 NIRS 데이터의 해석 가능성을 높이려면 Fitzpatrick 피부 유형 분류 척도7을 사용하여 피부 색소 침착을 보고하는 것이 좋습니다.
운동 처방에 대한 이 프로토콜의 적용 가능성과 관련하여, NIRS 기술은 주로 지구력 운동 중 근육 대사를 평가하는 데 사용되었으며, 특히 기질 산화가 ATP 재합성의 주요 에너지원으로 작용하는 프로토콜에서 더욱 그렇습니다. 저항 운동에서의 적용에 관한 증거는 제한적이지만 문헌 검토에 따르면 TSI에 대한 근력 운동의 급성 효과는 근섬유 구성에 따라 다릅니다. 특히, m.Vastus Lateralis 와 같이 I형 섬유의 비율이 높은 근육은 동일한 강도로 훈련된 다른 근육 그룹에 비해 더 큰 ΔTSI를 보여줍니다. 그럼에도 불구하고, 연구 방법론의 상당한 이질성은 보고된 결과의 일반화를 계속 제한하고 있습니다. 이 연구의 예비 결과는 표준화된 프로토콜의 향후 간행물과 함께 다양한 상황에서 운동 강도를 처방하기 위해 이 기술의 광범위한 적용을 지원할 것입니다50.
결론적으로, NIRS 웨어러블 장치는 CPET에 의해 평가된 심폐 변수를 보완하여 운동 중 미세혈관 수준에서 혈류역학적 반응의 비침습적 모니터링에서 상당한 발전을 나타냅니다. 침습적 방법과 달리 NIRS는 선수의 자연스러운 움직임을 방해하지 않으면서 산소 전달과 소비 사이의 균형에 대한 실시간 데이터를 제공합니다. 이 기술은 다양한 조직과 운동 강도에 걸쳐O2-Hb, H-Hb 및 TSI의 변화를 감지하여 중추 및 말초 운동 제한 요인을 효과적으로 식별합니다. 신진대사 요구량 및 생리적 반응의 변화에 대한 자세한 통찰력은 훈련 프로그램을 최적화하고 운동 능력을 향상시킬 수 있는 NIRS의 잠재력을 강조합니다. 또한 NIRS의 대뇌 및 근육 미세혈관 혈류역학을 평가하는 능력은 다양한 운동 방식과 강도에 대한 생리학적 반응을 탐구할 수 있는 새로운 기회를 제공합니다. 전반적으로 NIRS 기술은 인간 생리학에 대한 이해를 발전시키고 운동 과학 연구에 기여하여 운동 능력을 개선하고 훈련 전략을 개선하기 위한 귀중한 도구를 제공하는 데 상당한 가능성을 가지고 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구의 모든 참가자와 운동 생리학 실험실에서 수행한 측정을 지원해 주신 기술 실험실 직원에게 감사드립니다. 저자 FC-B 및 ME-R은 학교 보건 과학 (Pontificia Universidad Católica de Chile 의학부)의 III, IV 및 V 연구 및 혁신 대회에서 부분적으로 지원되었습니다. 저자 RC-C는 2023년 연구 정규 프로젝트 경쟁(Competition for Research Regular Projects, year 2023, code LPR23-17, Universidad Tecnológica Metropolitana)의 지원을 받는 프로젝트의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Column Scale | SECA | 711 | There are numerous alternatives to this item |
| Portable Stadiometer | SECA | 217 | There are numerous alternatives to this item |
| 12-lead ECG | COSMED | Quark T12x | A 12-lead ECG provides a better understanding of HR during exercise and facilitates the detection of arrhythmias. |
| Pulse Oxymeter | COSMED | Integrated pulse oxymeter | |
| Ergoespirometer | COSMED | Quark-CPET | Calibration gases and calibration syringe are included |
| Cycle-ergometer | Ergoline GmH | ViaSprint 150P | There are numerous alternatives to this item. Must ensure compatibility with provided software |
| NIRS weareable | Artinis Medical Systems | Portalite | Articulated NIRS weareable fits the surface where it's placed upon. |
| NIRS weareable | Artinis Medical Systems | Portamon | Portamon device provides better results on high adipose-tissue surfaces. |
| Metabolic Data Management Software (OMNIA) | COSMED | Software will vary upon system choice | |
| NIRS Data Management Software (Oxysoft) | Artinis Medical Systems | Software will vary upon device choice | |
| Wireless Probe Type Ultrasound Scanner | SONUS | Duo LC | There are numerous alternatives to this item |
참고문헌
- Bassett, D. R. Limiting factors for maximum oxygen uptake and determinants of endurance performance. Med Sci Sports Exerc. 70 (1), 12-25 (2000).
- Seiler, S. What is best practice for training intensity and duration distribution in endurance athletes. Int J Sports Physiol Perform. 5 (3), 276-291 (2010).
- Palange, P., et al. Recommendations on the use of exercise testing in clinical practice. Eur Respir J. 29 (1), 185-209 (2006).
- Contreras-Briceño, F., et al. Intercostal muscles oxygenation and breathing pattern during exercise in competitive marathon runners. Int J Environ Res Public Health. 18 (16), 8287(2021).
- Mier, C. M., Alexander, R. P., Mageean, A. L. Achievement of VO2max criteria during a continuous graded exercise test and a verification stage performed by college athletes. J Strength Cond Res. 26 (10), 2648-2654 (2012).
- Racinais, S., Buchheit, M., Girard, O. Breakpoints in ventilation, cerebral and muscle oxygenation, and muscle activity during an incremental cycling exercise. Front Physiol. 5, 142(2014).
- Perrey, S., Quaresima, V., Ferrari, M. Muscle oximetry in sports science: An updated systematic review. Sports Med. 54 (4), 975-996 (2024).
- Contreras-Briceño, F., et al. Determination of the respiratory compensation point by detecting changes in intercostal muscles oxygenation by using near-infrared spectroscopy. Life (Basel). 12 (3), 444(2022).
- Kozlova, S. G. The use of near-infrared spectroscopy in the sport-scientific context. J Neurol Neurol Diord. 4 (2), 203(2018).
- Perrey, S. Non-invasive NIR spectroscopy of human brain function during exercise. Methods. 45 (4), 289-299 (2008).
- Barstow, T. J. Understanding near infrared spectroscopy and its application to skeletal muscle research. J Appl Physiol. 126 (5), 1360-1376 (2019).
- Kowalski, T., et al. Respiratory muscle training induces additional stress and training load in well-trained triathletes—randomized controlled trial. Front Physiol. 14, 1264265(2023).
- Espinosa-Ramírez, M., et al. Sex-differences in the oxygenation levels of intercostal and vastus lateralis muscles during incremental exercise. Front Physiol. 12, 738063(2021).
- Perrey, S. Evaluating brain functioning with NIRS in sports: Cerebral oxygenation and cortical activation are two sides of the same coin. Front Neuroergonomics. 3, 1022924(2022).
- Thomas, R., Perrey, S. Prefrontal cortex oxygenation and neuromuscular responses to exhaustive exercise. Eur J Appl Physiol. 102 (2), 153-163 (2007).
- Kirby, B. S., Clark, D. A., Bradley, E. M., Wilkins, B. W. The balance of muscle oxygen supply and demand reveals critical metabolic rate and predicts time to exhaustion. J Appl Physiol. 130 (6), 1915-1927 (2021).
- Perrey, S. Training monitoring in sports: It is time to embrace cognitive demand. Sports (Basel). 10 (4), 56(2022).
- Angius, L., et al. Transcranial direct current stimulation over the left dorsolateral prefrontal cortex improves inhibitory control and endurance performance in healthy individuals. Neuroscience. 419, 34-45 (2019).
- Dempsey, J. A., McKenzie, D. C., Haverkamp, H. C., Eldridge, M. W. Update in the understanding of respiratory limitations to exercise performance in fit, active adults. Chest. 134 (3), 613-622 (2008).
- Peltonen, J. E., et al. Cerebral and muscle deoxygenation, hypoxic ventilatory chemosensitivity and cerebrovascular responsiveness during incremental exercise. Respir Physiol Neurobiol. 169 (1), 24-35 (2009).
- Klem, G. H., Lüders, H. O., Jasper, H. H., Elger, C. The ten-twenty electrode system of the International Federation. Electroencephalogr Clin Neurophysiol Suppl. 52, 3-6 (1999).
- Vogiatzis, I., et al. Intercostal muscle blood flow limitation in athletes during maximal exercise. J Physiol. 587 (14), 3665-3677 (2009).
- Vogiatzis, I., et al. Intercostal muscle blood flow limitation during exercise in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 182 (9), 1105-1113 (2010).
- Contreras-Briceño, F., et al. Reliability of NIRS portable device for measuring intercostal muscles oxygenation during exercise. J Sports Sci. 37 (23), 2653-2659 (2019).
- Crum, E. M., O'Connor, W. J., Van Loo, L., Valckx, M., Stannard, S. R. Validity and reliability of the Moxy oxygen monitor during incremental cycling exercise. Eur J Sport Sci. 17 (8), 1037-1043 (2017).
- Vogiatzis, I., et al. Quadriceps muscle blood flow and oxygen availability during repetitive bouts of isometric exercise in simulated sailing. J Sports Sci. 29 (10), 1041-1049 (2011).
- Grassi, B., Quaresima, V. Near-infrared spectroscopy and skeletal muscle oxidative function in vivo in health and disease: A review from an exercise physiology perspective. J Biomed Opt. 21 (9), 091313(2016).
- Duncan, A., et al. Measurement of cranial optical path length as a function of age using phase resolved near infrared spectroscopy. Pediatr Res. 39 (5), 889-894 (1996).
- Aebi, M. R., Willis, S. J., Girard, O., Borrani, F., Millet, G. P. Active preconditioning with blood flow restriction or/and systemic hypoxic exposure does not improve repeated sprint cycling performance. Front Physiol. 10, 1393(2019).
- Cocking, S., et al. Repeated sprint cycling performance is not enhanced by ischaemic preconditioning or muscle heating strategies. Eur J Sport Sci. 21 (2), 166-175 (2021).
- Kligfield, P., et al. Recommendations for the standardization and interpretation of the electrocardiogram. J Am Coll Cardiol. 49 (10), 1109-1127 (2007).
- Dillon, H. T., et al. The effect of posture on maximal oxygen uptake in active healthy individuals. Eur J Appl Physiol. 121 (5), 1487-1498 (2021).
- DeCato, T. W., Haverkamp, H., Hegewald, M. J. Cardiopulmonary exercise testing (CPET). Am J Respir Crit Care Med. 201 (1), P1-P2 (2020).
- Skinner, J. S., Mclellan, T. H. The transition from aerobic to anaerobic metabolism. Res Q Exerc Sport. 51 (1), 234-248 (1980).
- Elmberg, V., et al. Reference equations for breathlessness during incremental cycle exercise testing. ERJ Open Res. 9 (2), 00566-02022 (2023).
- Borg, G. A. Psychophysical bases of perceived exertion. Med Sci Sports Exerc. 14 (5), 377-381 (1982).
- Perrey, S. Could near infrared spectroscopy be the new weapon in our understanding of the cerebral and muscle microvascular oxygen demand during exercise. J Sport Health Sci. 13 (4), 457-458 (2024).
- Orcioli-Silva, D., et al. Cerebral and muscle tissue oxygenation during exercise in healthy adults: A systematic review. J Sport Health Sci. 13 (4), 459-471 (2024).
- Kovalenko, B., Roskosky, M., Freedman, B. A. Effect of ambient light on near infrared spectroscopy. J Trauma Treat. 04 (03), (2014).
- Wik, L. Near-infrared spectroscopy during cardiopulmonary resuscitation and after restoration of spontaneous circulation: A valid technology. Curr Opin Crit Care. 22 (3), 191-198 (2016).
- Pirovano, I., et al. Effect of adipose tissue thickness and tissue optical properties on the differential pathlength factor estimation for NIRS studies on human skeletal muscle. Biomed Opt Express. 12 (1), 571(2021).
- Van Beekvelt, M. C. P., Borghuis, M. S., Van Engelen, B. G. M., Wevers, R. A., Colier, W. N. J. M. Adipose tissue thickness affects in vivo quantitative near-IR spectroscopy in human skeletal muscle. Clin Sci (Lond). 101 (1), 21-28 (2001).
- Homma, S. Influence of adipose tissue thickness on near infrared spectroscopic signal in the measurement of human muscle. J Biomed Opt. 1 (4), 418(1996).
- Gomes, A. C., et al. Body composition assessment in athletes: Comparison of a novel ultrasound technique to traditional skinfold measures and criterion DXA measure. J Sci Med Sport. 23 (11), 1006-1010 (2020).
- Delpy, D. T., Cope, M., Zee, P. V. D., Arridge, S., Wray, S., Wyatt, J. Estimation of optical pathlength through tissue from direct time of flight measurement. Phys Med Biol. 33 (12), 1433-1442 (1988).
- Talukdar, T., Moore, J. H., Diamond, S. G. Continuous correction of differential path length factor in near-infrared spectroscopy. J Biomed Opt. 18 (5), 056001(2013).
- Zonios, G., Bykowski, J., Kollias, N. Skin melanin, hemoglobin, and light scattering properties can be quantitatively assessed in vivo using diffuse reflectance spectroscopy. J Invest Dermatol. 117 (6), 1452-1457 (2001).
- Patel, N. A., Bhattal, H. S., Griesdale, D. E., Hoiland, R. L., Sekhon, M. S. Impact of skin pigmentation on cerebral regional saturation of oxygen using near-infrared spectroscopy: A systematic review. Crit Care Explor. 6 (2), e1049(2024).
- Wassenaar, E. B., Van Den Brand, J. G. H. Reliability of near-infrared spectroscopy in people with dark skin pigmentation. J Clin Monit Comput. 19 (3), 195-199 (2005).
- Miranda-Fuentes, C., et al. Changes in muscle oxygen saturation measured using wireless near-infrared spectroscopy in resistance training: A systematic review. Int J Environ Res Public Health. 18 (8), 4293(2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유