Method Article
Visualização intraoperatória de injeção sub-retiniana e descolamento de retina em ratos
Neste Artigo
Resumo
Este artigo descreve métodos para injeção sub-retiniana em ratos, utilizando visualização intraoperatória para controlar o local da injeção e a área de descolamento de retina.
Resumo
A injeção sub-retiniana, a entrega de uma solução entre os fotorreceptores e o epitélio pigmentar da retina (EPR), cria um espaço sub-retiniano onde os componentes estão em contato direto com os fotorreceptores e as células EPR. Este método de entrega permite o tratamento direcionado dessas células. Terapêuticas para injeção sub-retiniana foram desenvolvidas e aprovadas, particularmente para doenças hereditárias da retina. Em animais, os procedimentos de injeção sub-retiniana podem ser desafiadores devido ao tamanho do cristalino, especialmente em roedores. Este artigo descreve métodos para injeção sub-retiniana em ratos, permitindo a visualização intraoperatória e o controle do local da injeção e do tamanho da área descolada, como realizado em humanos. O procedimento é realizado sob anestesia geral e local e requer dilatação da pupila. Usando um microscópio oftálmico, a injeção sub-retiniana é realizada através de um canal escleral de 30 G, com a ponta da cânula aplicada suavemente na retina para criar uma retinotomia. Volumes que variam de 10 a 25 μL podem ser fornecidos, correspondendo a dois quintos a metade da retina de ratos. Exames pós-operatórios imediatos usando fotografia de fundo de olho e tomografia de coerência óptica confirmam a entrega bem-sucedida no espaço sub-retiniano com fluido sub-retiniano visível. Os principais riscos desse procedimento incluem danos ao cristalino (catarata), falha no descolamento, hemorragia intravítrea, hemorragia sub-retiniana e ceratite pós-operatória. Além de fornecer terapêutica no espaço sub-retiniano, essa técnica é usada para induzir descolamento de retina de curto ou longo prazo usando produtos aquosos ou viscosos, respectivamente. Ao contrário da abordagem transescleral, este método permite o posicionamento intraoperatório preciso do descolamento de retina.
Introdução
A retina é um tecido neuronal sensível à luz localizado na parte interna e posterior do globo ocular. A camada externa da neurorretina contém fotorreceptores, que são neurônios especializados dedicados a converter a luz em sinais eletroquímicos e, portanto, são essenciais para a visão. O epitélio pigmentar da retina (EPR), localizado abaixo da neurorretina, fornece amplo suporte metabólico aos fotorreceptores, facilitando a regeneração do pigmento visual e a renovação regular de seus segmentos externos1.
A degeneração dos fotorreceptores é a causa mais comum de perda irreversível da visão e ocorre em várias doenças da retina, como degeneração macular relacionada à idade, retinite pigmentosa, retinopatia diabética e descolamento de retina 1,2,3,4. A maioria dessas condições resulta da perda primária ou secundária de fotorreceptores, muitas vezes secundária à perda ou disfunção do EPR. Portanto, é particularmente importante estudar fotorreceptores e células RPE in vivo para prevenir sua degeneração. Até o momento, não existem terapias eficazes para inúmeras doenças da retina, como distrofias retinianas (incluindo retinite pigmentosa) ou degeneração macular (incluindo degeneração macular relacionada à idade).
A injeção sub-retiniana, a entrega de uma solução entre os fotorreceptores e o EPR, cria um espaço sub-retiniano onde os componentes estão em contato direto com os fotorreceptores e as células EPR. Este método de entrega permite o tratamento direcionado dessas células, contornando várias barreiras retinianas ou vasculares. Várias terapêuticas para parto sub-retiniano foram desenvolvidas e aprovadas, particularmente para doenças hereditáriasda retina 5,6.
É importante harmonizar as práticas cirúrgicas para o parto sub-retiniano. Em humanos, o procedimento padrão envolve vitrectomia de 25 G pars plana, que fornece acesso relativamente fácil ao segmento posterior do olho porque o cristalino é pequeno em proporção a todo o olho. A administração sub-retiniana é realizada através de um trocarte de 25 G usando uma cânula biocompatível com ponta de silicone de 38 G ou 41 G, permitindo um fluxo transretiniano suave5.
Em animais, os procedimentos de injeção sub-retiniana podem ser desafiadores devido ao tamanho da lente. Por exemplo, em roedores, o cristalino ocupa até 90% da cavidade vítrea. Em ratos, o cristalino ocupa menos espaço do que em camundongos, mas permanece significativo (ver Figura 1A). Além disso, as injeções sub-retinianas podem ser usadas para modelar o descolamento de retina (DR) usando soluções viscosas para prevenir a depuração do fluido sub-retiniano pelas células RPE 7,8. Esses modelos são empregados principalmente no desenvolvimento de terapias para doenças da retina.
Este artigo descreve métodos para administração sub-retiniana ou DR induzida em ratos, permitindo o controle intraoperatório total do local da injeção e da área retiniana descolada.
Protocolo
Os experimentos e procedimentos foram aprovados pelo Comitê de Ética Animal Local e conduzidos em instalações associadas ao laboratório, em conformidade com a legislação local. Todos os trabalhos experimentais aderiram às políticas institucionais sobre procedimentos de biossegurança e segurança (Comitê Local de Ética Animal Charles Darwin CEEACD #5) e seguiram a Diretiva Europeia 2010/63/UE. Ratos Long Evans (Rattus norvegicus) fêmeas selvagens de oito semanas de idade foram usados neste estudo. Vários modelos de degeneração retiniana de ratos, como P23H e RCS, podem ser usados para testar a entrega sub-retiniana de diferentes terapêuticas, incluindo drogas e terapias genéticas. Os detalhes dos reagentes e equipamentos usados neste estudo são fornecidos na Tabela de Materiais.
1. Preparação das soluções
- Entrega sub-retiniana: Dilua moléculas em PBS ou dimetilsulfóxido para entrega sub-retiniana aquosa.
- Indução de RD: Use hidroxipropilmetilcelulose a 2% ou hialuronato de sódio a 1% a 5% para induzir DR a longo prazo.
2. Configuração experimental
- Monte uma ponta de metal de cânula de 10 mm 30 G não chanfrada cimentada em uma seringa de 10 μL ou 25 μL em um microinjetor.
- Carregue a solução preparada na seringa.
3. Preparação do animal
- Anestesia
- Anestesia geral: Anestesiar os ratos com uma injeção intraperitoneal de 40 mg/kg de cetamina e 0,14 mg/kg de medetomidina.
NOTA: Esta anestesia dura o suficiente para a duração do procedimento e para explorações pós-operatórias imediatas. - Dilatação da pupila: Coloque uma gota de tropicamida a 0,5% para obter midríase em um olho.
NOTA: Para cirurgiões destros, o procedimento será mais fácil no olho esquerdo e vice-versa. - Anestesia local ( Figura 2B): Coloque um colírio de oxibuprocaína no olho a ser operado.
- Anestesia geral: Anestesiar os ratos com uma injeção intraperitoneal de 40 mg/kg de cetamina e 0,14 mg/kg de medetomidina.
4. Cirurgia ao microscópio
- Visualização intraoperatória: Use um microscópio oftálmico conectado a um pedal para realizar a cirurgia.
- Exposição escleral (Figura 2C,D)
- Use duas suturas de tração palpebral (5-0 ou 6-0) ancoradas no quarto externo da margem palpebral nas pálpebras superior e inferior.
- Puxe as suturas para obter um abaulamento suave do olho.
- Canal escleral (Figura 2E, F): Use uma agulha de 30 G para criar um canal escleral através da conjuntiva bulbar temporal, a aproximadamente 1-2 mm do limbo da córnea.
NOTA: Insira mal a ponta da agulha chanfrada sem empurrá-la ainda mais para evitar o risco de toque na lente e catarata subsequente. Observe a hemorragia conjuntival por dezenas de segundos neste estágio. Evite tamponar o sangramento, pois isso pode fazer com que o sangue se acumule no vítreo e comprometer o procedimento. Limpe suavemente qualquer sangue na área do canal ou que impeça a visualização usando um cotonete. - Proteção da córnea (Figura 2G): Use um gel lacrimal como interface lente-olho durante todo o procedimento.
- Visualização do plano retiniano (Figura 2G)
- Coloque uma lente de contato plana (8 mm de diâmetro) na superfície do olho para visualizar o plano da retina com ampliação adequada.
- Use o pedal do microscópio para focar no plano da retina.
- Injeção sub-retiniana (Figura 2H - M)
- Insira a cânula verticalmente através do canal escleral pré-formado (Figura 2H).
- Evite tocar na lente mantendo a cânula na vertical.
- Aproxime-se lentamente da retina e pressione-a suavemente até que o clareamento da retina seja observado (setas na Figura 2I).
- Mantenha a estabilidade da ponta durante a injeção através da retinotomia formada pelo fluxo de injeção (Figura 2J). Evite retirar a ponta muito cedo da retinotomia, pois isso fará com que o produto seja injetado no vítreo.
- Após a injeção, remova a ponta da retinotomia e, em seguida, retire suavemente toda a cânula da cavidade vítrea, garantindo que a lente não seja tocada (Figura 2K).
NOTA: Se a bolha estiver insuficientemente desenvolvida ou a área retiniana descolada estiver muito restrita quando a seringa estiver vazia, execute uma reinjeção usando o mesmo canal escleral e inserindo a ponta na retinotomia previamente formada. - Certifique-se de que o reflexo vermelho pupilar seja alterado pelo descolamento de retina sem observar o fluxo sanguíneo dentro da cavidade vítrea (Figura 2L,M).
- Término da cirurgia (Figura 2N,O)
- Remova as suturas palpebrais e limpe cuidadosamente qualquer sangramento (Figura 2N).
- Avalie brevemente a pressão intraocular manualmente.
NOTA: Uma pequena quantidade de fluido vítreo pode emergir no espaço subconjuntival, mas não deve ocorrer vazamento ativo (Figura 2O).
5. Cuidados pós-operatórios e despertar
- Aplique pomada ocular cloranfenicol-retinol no olho operado.
- Administre 1 mL de glicose a 5% monohidratada por via intraperitoneal.
- Injete 0,9 mg / kg de atipamezol por via subcutânea.
- Coloque o animal em uma câmara com temperatura controlada e monitore-o até que ele acorde.
Resultados
O sucesso de uma injeção sub-retiniana depende da entrega precisa e exclusiva no espaço sub-retiniano (ou seja, entre os fotorreceptores e as camadas de EPR) através da retinotomia, evitando hemorragia sub-retiniana, pois o sangue é tóxico para os fotorreceptores e células de EPR. O parto bem-sucedido é confirmado por visualização intraoperatória (Figura 2L), retinografia pós-operatória imediata e tomografia de coerência óptica (OCT). A fotografia do fundo de olho descarta hemorragia sub-retiniana, enquanto os exames de OCT B confirmam o descolamento de retina (DR) com líquido sub-retiniano claro (Figura 1 e Figura 3). Além disso, a fotografia de fundo de olho pode identificar o toque da lente ou catarata induzida que pode passar despercebida durante o procedimento (Figura 3C, D). Tanto a fotografia quanto as varreduras de OCT podem estimar o tamanho da área destacada ou bolha (Figura 1B-E).
Vários fatores influenciam o tamanho da bolha: (1) Localização do local da injeção: Quanto mais distante o local da injeção estiver do disco óptico, menor será a área destacada; (2) Volume injetado: Um volume de injeção de 20-25 μL pode desprender aproximadamente metade da retina em ratos; (3) Qualidade do descolamento de retina: Em modelos de degeneração retiniana (por exemplo, P23H, RCS), o descolamento pode ser desafiador devido ao aumento da resistência entre fotorreceptores e células RPE causada por processos degenerativos, como gliose e acúmulo de material sub-retiniano. Nesses casos, os descolamentos de retina induzidos são tipicamente planos, e as OCT são cruciais para delinear claramente a área descolada.
Uma pequena hemorragia intravítrea pode ocorrer no local da injeção porque os microvasos da retina nem sempre podem ser completamente evitados (Figura 3E). No entanto, essas hemorragias geralmente não se estendem para o espaço sub-retiniano.
Em casos de descolamento insuficiente, o problema deve ser reconhecido no intraoperatório, necessitando de reinjeção imediata através da retinotomia pré-formada. Durante uma sessão experimental com 20 ratos, dois cirurgiões (um experiente e um iniciante) realizaram o método passo a passo. O cirurgião experiente obteve sucesso em 9 de 10 procedimentos, enquanto o iniciante obteve sucesso em 6 de 10.

Figura 1: Visão geral do processo e resultados. (A) Representação esquemática do processo de injeção sub-retiniana em um olho de rato, mostrando o volume significativo da lente. (B, C) Fotografia de fundo de olho imediatamente após a injeção (B) e 6 dias após a injeção (C). As pontas das setas indicam o local da injeção. A área de descolamento de retina é delineada por uma linha tracejada. (D, E) Tomografia de coerência óptica B-scan imediatamente após a injeção (D) e 6 dias após a injeção (E). ON: nervo óptico. Ampliação: 1x. Por favor, clique aqui para ver uma versão maior desta figura.
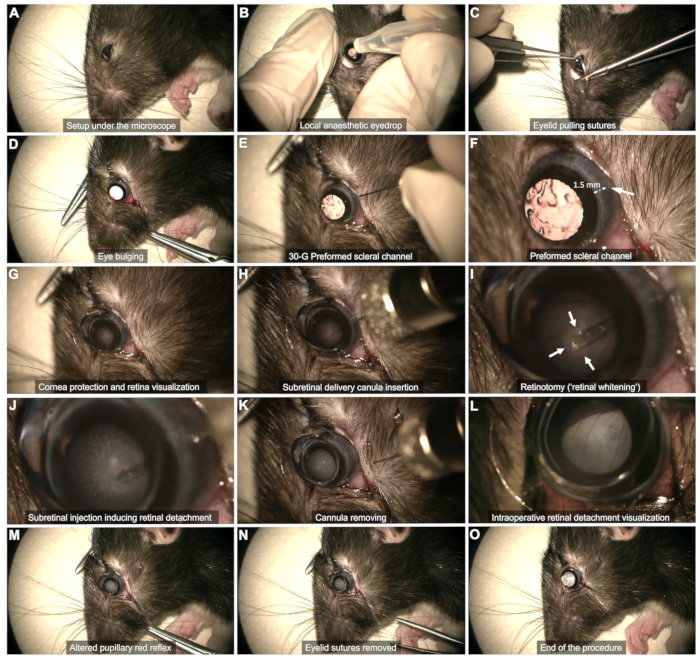
Figura 2: Etapas do protocolo de injeção sub-retiniana. O protocolo é demonstrado em um rato Long Evans de 8 semanas de idade sob anestesia geral. Para uma descrição detalhada de cada etapa, consulte o vídeo ou a seção "Protocolo" no texto. Clique aqui para ver uma versão maior desta figura.

Figura 3: Exemplos de vários resultados de fotografia de fundo de olho pós-operatório. (A) Aparência pós-operatória normal com menor dispersão de pigmento no local da injeção (seta). (B) Aparência pós-operatória normal com uma pequena bolha de ar intravítrea no local da injeção. Essas pequenas bolhas de ar se originam da seringa e são inofensivas, mesmo no espaço sub-retiniano. (C, D) Toque da lente resultando em opacificação menor (C) ou significativa (D) da lente (catarata). (E, F) Sangramento intravítreo menor (E) ou mais extenso (F) localizado próximo ao local da injeção, sem disseminação para o espaço sub-retiniano. (G) Sangramento no local da injeção se espalhando predominantemente para o espaço sub-retiniano. Nesse caso, a retinotomia causou uma lesão de um vaso sanguíneo da retina. (H) Hemorragia intravítrea extensa resultante de penetração escleral. Ampliação: 1x. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Este artigo descreve métodos para administração sub-retiniana transvítrea em ratos com visualização intraoperatória e controle do local da injeção e da área descolada.
Existem duas etapas críticas neste protocolo: exposição escleral e retinotomia. Posicionamento, exposição e acesso adequados são pré-requisitos fundamentais para qualquer procedimento cirúrgico. Nesse caso, é crucial garantir o acesso ideal à esclera e ao local da injeção. A exposição escleral insuficiente pode levar a dificuldades evitáveis nas etapas subsequentes. Além disso, a qualidade da retinotomia determina o risco de hemorragia. Deve ser realizado o mais suavemente possível e o mais longe possível de qualquer vaso retiniano. Se feito corretamente, o risco de sangramento intravítreo ou sub-retiniano significativo é muito baixo.
Ao usar essa abordagem para injeção sub-retiniana, a indução do descolamento de retina (RD) pode falhar por vários motivos. A etapa mais desafiadora no processo de aprendizagem é a própria injeção. O local da injeção deve ser cuidadosamente escolhido para permitir que o líquido flua através da retina através da retinotomia. Devido ao denso corpo vítreo posterior em roedores, pode atuar como uma barreira física ao fluxo transretiniano. Em nossa experiência, a penetração transretiniana ocorre suavemente quando a ponta da cânula é posicionada a aproximadamente 90° em relação à retina. É altamente recomendável, especialmente no início, praticar o uso de soluções coloridas, como a fluoresceína, para confirmar que a solução injetada flui apenas para o espaço sub-retiniano.
Duas limitações dessa técnica podem ser identificadas. Primeiro, a passagem transvítrea corre o risco de tocar na lente. Um toque na lente pode ser inócuo se a cápsula posterior da lente for preservada, pois não deve levar à formação de catarata. No entanto, se a cápsula posterior do cristalino estiver danificada, o risco de formação de catarata é alto e o animal pode não ser mais adequado para o projeto experimental, principalmente se forem necessários exames de acompanhamento da retina. Em segundo lugar, essa técnica pode levar a sangramento em vários estágios, o que pode impedir o processo experimental. O sangramento conjuntival pode resultar das suturas das pálpebras, embora isso geralmente não seja um problema e possa ser limpo com um cotonete. Além disso, duas retinotomias são realizadas durante o procedimento, ambas com risco de hemorragia. A primeira retinotomia é realizada enquanto o experimentador está cego para a retina (através do canal escleral), o que pode levar a hemorragia intravítrea durante a perfuração escleral, complicando ainda mais o procedimento. Raramente, pode ocorrer sangramento sub-retiniano ou coroidal. Essa 'retinotomia de entrada' pode ser evitada injetando através da córnea9, embora essa abordagem limite significativamente a gama de possíveis locais de injeção. A segunda retinotomia apresenta maior risco de sangramento se os vasos retinianos forem tocados pela ponta da cânula. A hemorragia sub-retiniana deve ser estritamente evitada, pois os componentes sanguíneos são tóxicos para os fotorreceptores10. Devido a esses riscos, os experimentadores novatos devem esperar uma taxa de falha de 1 em 5 a 1 em 10 injeções. Em nossa experiência, não foram encontrados casos de descolamento de coroide, endoftalmite ou dano retiniano induzido por hipertonia.
Alternativamente, métodos que usam abordagens transesclerais para parto sub-retiniano, que evitam a passagem transvítrea, foram descritos 8,11. No entanto, em nossa experiência, esses procedimentos não permitem locais de injeção ou bolhas precisos ou reprodutíveis e só devem ser realizados quando se usa camundongos. Além disso, esses procedimentos requerem uma incisão escleral autovedante com uma agulha que atravessa a coroide e o epitélio pigmentar da retina (EPR) no local do DR. Isso representa um risco de migração do pigmento sub-retiniano, que pode levar a consequências inflamatórias e distorcer o modelo de DR11. Além disso, a injeção é realizada sem visibilidade da ponta da seringa, aumentando o risco de descolamento supra ou subcoroidal em vez de DR. Existe também o risco de retinotomia não intencional, levando à entrega intravítrea subsequente, especialmente quando se trabalha com modelos de degeneração retiniana que possuem retinas mais finas e frágeis.
As aplicações de entrega sub-retiniana ou DR induzida incluem o teste de várias terapêuticas em modelos de degeneração retiniana ou em casos de DR 8,11,12,13,14. Em ambas as condições, o objetivo do procedimento é imitar os processos que ocorrem em humanos. Tanto a abordagem transescleral quanto a transvítrea podem modelar a DR, desde que a altura e a duração da DR sejam suficientes15. No caso da entrega sub-retiniana, os métodos atuais replicam mais de perto aqueles usados em primatas não humanos16 e humanos5, aumentando assim a traduzibilidade dos dados.
Divulgações
S.P: Consultor e interesses financeiros pessoais -Pixium Vision, GenSight Biologics (nenhuma dessas atividades é relevante para os dados aqui apresentados).
Agradecimentos
Este estudo foi apoiado pelo IHU FOReSIGHT (Paris), Fondation Voir & Entendre (Paris), UNADEV/Aviesan (no âmbito do projeto "neuroproteção do fotorreceptor do cone", Paris), HyVIS (GA 964468), Fighting Blindness Foundation (FFB PPA Vision Restoration: PPA-0919-0772-INSERM; FFB PPA Usher 1B: PPA-0922-0840-INSERM). Os salários de A.D. foram fornecidos por doações da Fondation pour la Recherche Médicale (número de concessão M2R202106013349, Paris), da Fondation de France (número de concessão WB-2023-49302, Paris) e da Sociedade Francesa de Oftalmologia. O patrocinador ou as organizações financiadoras não tiveram nenhum papel no projeto ou na condução desta pesquisa.
Materiais
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
Referências
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados