Method Article
Visualización intraoperatoria de la inyección subretiniana y el desprendimiento de retina en ratas
En este artículo
Resumen
Este artículo describe los métodos para la inyección subretiniana en ratas, utilizando la visualización intraoperatoria para controlar tanto el sitio de la inyección como el área de desprendimiento de retina.
Resumen
La inyección subretiniana, la administración de una solución entre los fotorreceptores y el epitelio pigmentario de la retina (EPR), crea un espacio subretiniano donde los componentes están en contacto directo con los fotorreceptores y las células EPR. Este método de administración permite un tratamiento específico de estas células. Se han desarrollado y aprobado terapias para la inyección subretiniana, particularmente para las enfermedades hereditarias de la retina. En los animales, los procedimientos de inyección subretiniana pueden ser difíciles debido al tamaño del cristalino, especialmente en roedores. Este artículo describe los métodos para la inyección subretiniana en ratas, lo que permite la visualización intraoperatoria y el control tanto del sitio de inyección como del tamaño del área desprendida, tal como se realiza en humanos. El procedimiento se lleva a cabo bajo anestesia general y local y requiere dilatación de la pupila. Utilizando un microscopio oftálmico, la inyección subretiniana se realiza a través de un canal escleral de 30 G, con la punta de la cánula aplicada suavemente a la retina para crear una retinotomía. Se pueden administrar volúmenes que oscilan entre 10 y 25 μL, lo que corresponde a dos quintas partes a la mitad de la retina de la rata. Los exámenes postoperatorios inmediatos con fotografía de fondo de ojo y tomografía de coherencia óptica confirman el parto exitoso en el espacio subretiniano con líquido subretiniano visible. Los principales riesgos de este procedimiento incluyen daño del cristalino (cataratas), falla del desprendimiento, hemorragia intravítrea, hemorragia subretiniana y queratitis posoperatoria. Además de administrar terapias en el espacio subretiniano, esta técnica se utiliza para inducir el desprendimiento de retina a corto o largo plazo utilizando productos acuosos o viscosos, respectivamente. A diferencia del abordaje transescleral, este método permite un posicionamiento intraoperatorio preciso del desprendimiento de retina.
Introducción
La retina es un tejido neuronal sensible a la luz situado en la parte interna y posterior del globo ocular. La capa externa de la neurorretina contiene fotorreceptores, que son neuronas especializadas en convertir la luz en señales electroquímicas y, por lo tanto, son esenciales para la visión. El epitelio pigmentario de la retina (EPR), situado debajo de la neurorretina, proporciona un amplio apoyo metabólico a los fotorreceptores, facilitando la regeneración visual del pigmento y la renovación regular de sus segmentos externos1.
La degeneración de los fotorreceptores es la causa más común de pérdida irreversible de la visión y se produce en diversas enfermedades de la retina, como la degeneración macular relacionada con la edad, la retinosis pigmentaria, la retinopatía diabética y el desprendimiento de retina 1,2,3,4. La mayoría de estas afecciones son el resultado de la pérdida primaria o secundaria de los fotorreceptores, a menudo secundaria a la pérdida o disfunción del EPR. Por lo tanto, es particularmente importante estudiar los fotorreceptores y las células EPR in vivo para prevenir su degeneración. Hasta la fecha, no existen terapias efectivas para numerosas enfermedades de la retina, como las distrofias de retina (incluida la retinosis pigmentaria) o la degeneración macular (incluida la degeneración macular relacionada con la edad).
La inyección subretiniana, la administración de una solución entre los fotorreceptores y el EPR, crea un espacio subretiniano donde los componentes están en contacto directo con los fotorreceptores y las células del EPR. Este método de administración permite un tratamiento dirigido de estas células, evitando varias barreras retinianas o vasculares. Se han desarrollado y aprobado varias terapias para el parto subretiniano, en particular para las enfermedades hereditarias de la retina 5,6.
Es importante armonizar las prácticas quirúrgicas para el parto subretiniano. En los seres humanos, el procedimiento estándar consiste en una vitrectomía pars plana de 25 G, que proporciona un acceso relativamente fácil al segmento posterior del ojo porque el cristalino es pequeño en proporción a todo el ojo. La administración subretiniana se realiza a través de un trócar de 25 G que utiliza una cánula biocompatible con punta de silicona de 38 G o 41 G, lo que permite un flujo transretiniano suave5.
En los animales, los procedimientos de inyección subretiniana pueden ser difíciles debido al tamaño del cristalino. Por ejemplo, en los roedores, el cristalino ocupa hasta el 90% de la cavidad vítrea. En las ratas, el cristalino ocupa menos espacio que en los ratones, pero sigue siendo significativo (véase la figura 1A). Además, las inyecciones subretinianas se pueden utilizar para modelar el desprendimiento de retina (RD) mediante el uso de soluciones viscosas para prevenir el aclaramiento del líquido subretiniano por parte de las células del EPR 7,8. Estos modelos se emplean principalmente en el desarrollo de terapias para las enfermedades de la retina.
En este artículo se describen los métodos para la administración subretiniana o RD inducida en ratas, lo que permite un control intraoperatorio total del lugar de la inyección y del área retiniana desprendida.
Protocolo
Los experimentos y procedimientos fueron aprobados por el Comité Local de Ética Animal y se llevaron a cabo en instalaciones asociadas al laboratorio, de acuerdo con la legislación local. Todo el trabajo experimental se adhirió a las políticas institucionales sobre bioseguridad y procedimientos de seguridad (Comité Local de Ética Animal Charles Darwin CEEACD #5) y siguió la Directiva Europea 2010/63/UE. En este estudio se utilizaron ratas Long Evans (Rattus norvegicus) hembras de tipo salvaje de ocho semanas de edad. Varios modelos de degeneración de la retina de ratas, como P23H y RCS, se pueden utilizar para probar la administración subretiniana de diferentes terapias, incluidos medicamentos y terapias génicas. Los detalles de los reactivos y equipos utilizados en este estudio se proporcionan en la Tabla de Materiales.
1. Preparación de soluciones
- Administración subretiniana: moléculas diluidas en PBS o dimetilsulfóxido para la administración subretiniana acuosa.
- Inducción de RD: Use hidroxipropilmetilcelulosa al 2% o hialuronato de sodio al 1%-5% para inducir RD a largo plazo.
2. Configuración experimental
- Monte una cánula metálica no biselada de 10 mm y 30 G con punta metálica cementada en una jeringa de 10 μL o 25 μL en un microinyector.
- Cargue la solución preparada en la jeringa.
3. Preparación animal
- Anestesia
- Anestesia general: Anestesiar a las ratas con una inyección intraperitoneal de 40 mg/kg de ketamina y 0,14 mg/kg de medetomidina.
NOTA: Esta anestesia dura lo suficiente para la duración del procedimiento y para las exploraciones postoperatorias inmediatas. - Dilatación de la pupila: Poner una gota de tropicamida al 0,5% para obtener midriasis en un ojo.
NOTA: Para los cirujanos diestros, el procedimiento será más fácil en el ojo izquierdo y viceversa. - Anestesia local ( Figura 2B): Coloque un colirio de oxibuprocaína en el ojo que se va a operar.
- Anestesia general: Anestesiar a las ratas con una inyección intraperitoneal de 40 mg/kg de ketamina y 0,14 mg/kg de medetomidina.
4. Cirugía bajo el microscopio
- Visualización intraoperatoria: Utilice un microscopio oftálmico conectado a un interruptor de pie para realizar la cirugía.
- Exposición escleral (Figura 2C,D)
- Utilice dos suturas de extracción de párpados (5-0 o 6-0) ancladas en el cuarto externo del margen palpebral en los párpados superior e inferior.
- Tire de las suturas para lograr un abombamiento suave del ojo.
- Canal escleral (Figura 2E,F): Utilice una aguja de 30 G para crear un canal escleral a través de la conjuntiva bulbar temporal, aproximadamente a 1-2 mm del limbo corneal.
NOTA: Apenas inserte la punta de la aguja biselada sin empujarla más para evitar el riesgo de contacto con la lente y la posterior catarata. Observe si hay hemorragia conjuntival durante decenas de segundos en esta etapa. Evite taponar el sangrado, ya que esto puede hacer que la sangre se acumule en el vítreo y ponga en peligro el procedimiento. Limpie suavemente cualquier sangre en el área del canal o que impida la visualización con un hisopo de algodón. - Protección de la córnea (Figura 2G): Utilice un gel lagrimal como interfaz entre el lente y el ojo durante todo el procedimiento.
- Visualización del plano retiniano (Figura 2G)
- Coloque una lente de contacto plana (8 mm de diámetro) en la superficie del ojo para visualizar el plano de la retina con el aumento adecuado.
- Utilice el pedal del microscopio para enfocar el plano de la retina.
- Inyección subretiniana (Figura 2H - M)
- Inserte la cánula verticalmente a través del canal escleral preformado (Figura 2H).
- Evite tocar la lente manteniendo la cánula vertical.
- Acérquese lentamente a la retina y presiónela suavemente hasta que se observe un blanqueamiento de la retina (flechas en la Figura 2I).
- Mantener la estabilidad de la punta mientras inyecta a través de la retinotomía formada por el flujo de inyección (Figura 2J). Evite retirar la punta demasiado pronto de la retinotomía, ya que esto hará que el producto se inyecte en el vítreo.
- Después de la inyección, retire la punta de la retinotomía y luego retire suavemente toda la cánula de la cavidad vítrea, asegurándose de que no se toque el cristalino (Figura 2K).
NOTA: Si la ampolla no está suficientemente desarrollada o el área de la retina desprendida está demasiado restringida una vez que la jeringa está vacía, realice una reinyección utilizando el mismo canal escleral e insertando la punta en la retinotomía previamente formada. - Asegúrese de que el reflejo rojo pupilar esté alterado por el desprendimiento de retina sin observar el flujo sanguíneo dentro de la cavidad vítrea (Figura 2L,M).
- Fin de la cirugía (Figura 2N,O)
- Retire las suturas de los párpados y frote cuidadosamente cualquier sangrado (Figura 2N).
- Evaluar brevemente la presión intraocular de forma manual.
NOTA: Una pequeña cantidad de líquido vítreo puede emerger en el espacio subconjuntival, pero no debe producirse una fuga activa (Figura 2O).
5. Cuidados postoperatorios y despertar
- Aplique el ungüento oftalmológico de cloranfenicol-retinol en el ojo operado.
- Administrar 1 mL de glucosa monohidrato al 5% por vía intraperitoneal.
- Inyectar 0,9 mg/kg de atipamezol por vía subcutánea.
- Coloque al animal en una cámara con temperatura controlada y vigílelo hasta que se despierte.
Resultados
El éxito de una inyección subretiniana se basa en la administración precisa y exclusiva en el espacio subretiniano (es decir, entre los fotorreceptores y las capas de EPR) a través de la retinotomía, evitando la hemorragia subretiniana, ya que la sangre es tóxica para los fotorreceptores y las células EPR. El éxito del parto se confirma mediante la visualización intraoperatoria (Figura 2L), la fotografía del fondo de ojo postoperatorio inmediata y la tomografía de coherencia óptica (OCT). La fotografía del fondo de ojo descarta la hemorragia subretiniana, mientras que las electrotomografías computarizadas (OCT) confirman el desprendimiento de retina (RD) con líquido subretiniano transparente (Figura 1 y Figura 3). Además, la fotografía del fondo de ojo puede identificar el contacto con el cristalino o las cataratas inducidas que pueden pasar desapercibidas durante el procedimiento (Figura 3C, D). Tanto la fotografía como la OCT pueden estimar el tamaño del área desprendida o ampolla (Figura 1B-E).
Varios factores influyen en el tamaño de la ampolla: (1) Ubicación del lugar de inyección: cuanto más lejos esté el sitio de inyección del disco óptico, menor será el área desprendida; (2) Volumen inyectado: Un volumen de inyección de 20-25 μL puede desprender aproximadamente la mitad de la retina en ratas; (3) Calidad del desprendimiento de retina: En los modelos de degeneración de la retina (por ejemplo, P23H, RCS), el desprendimiento puede ser un desafío debido al aumento de la resistencia entre los fotorreceptores y las células del EPR causado por procesos degenerativos, como la gliosis y la acumulación de material subretiniano. En tales casos, los desprendimientos de retina inducidos suelen ser planos, y las tomografías computarizadas son cruciales para delinear claramente el área desprendida.
Puede producirse una hemorragia intravítrea menor en el lugar de la inyección porque los microvasos de la retina no siempre pueden evitarse por completo (Figura 3E). Sin embargo, estas hemorragias no suelen extenderse al espacio subretiniano.
En casos de desprendimiento insuficiente, el problema debe reconocerse intraoperatoriamente, lo que requiere una reinyección inmediata a través de la retinotomía preformada. Durante una sesión experimental con 20 ratas, dos cirujanos (uno experimentado y otro principiante) realizaron el método paso a paso. El cirujano experimentado logró el éxito en 9 de cada 10 procedimientos, mientras que el principiante tuvo éxito en 6 de cada 10.

Figura 1: Resumen del proceso y resultados. (A) Representación esquemática del proceso de inyección subretiniana en un ojo de rata, mostrando el volumen significativo del cristalino. (B,C) Fotografía del fondo de ojo inmediatamente después de la inyección (B) y 6 días después de la inyección (C). Las puntas de flecha indican el lugar de inyección. El área de desprendimiento de retina está delimitada por una línea discontinua. (D,E) Tomografía de coherencia óptica B-scan inmediatamente después de la inyección (D) y 6 días después de la inyección (E). ON: nervio óptico. Ampliación: 1x. Haga clic aquí para ver una versión más grande de esta figura.
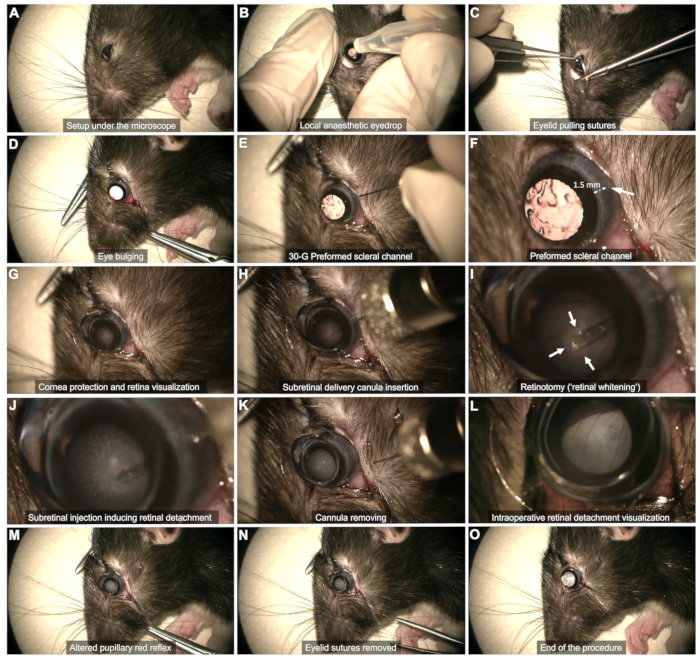
Figura 2: Pasos del protocolo de inyección subretiniana. El protocolo se demuestra en una rata Long Evans de 8 semanas de edad bajo anestesia general. Para obtener una descripción detallada de cada paso, consulte el video o la sección "Protocolo" en el texto. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ejemplos de varios resultados de la fotografía de fondo de ojo postoperatorio. (A) Apariencia postoperatoria normal con una menor dispersión de pigmento en el lugar de la inyección (flecha). (B) Aspecto postoperatorio normal con una pequeña burbuja de aire intravítreo en el lugar de la inyección. Estas pequeñas burbujas de aire se originan en la jeringa y son inofensivas, incluso en el espacio subretiniano. (C,D) El contacto con el cristalino que produce una opacificación menor (C) o significativa (D) del cristalino (cataratas). (E,F) Sangrado intravítreo menor (E) o más extenso (F) localizado cerca del sitio de la inyección, sin diseminación al espacio subretiniano. (G) Sangrado en el lugar de la inyección, que se extiende predominantemente hacia el espacio subretiniano. En este caso, la retinotomía causó una lesión de un vaso sanguíneo de la retina. (H) Hemorragia intravítrea extensa resultante de la penetración escleral. Ampliación: 1x. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo describe los métodos para la administración subretiniana transvítrea en ratas con visualización intraoperatoria y control tanto del sitio de inyección como del área desprendida.
Hay dos pasos críticos en este protocolo: la exposición escleral y la retinotomía. La posición, la exposición y el acceso adecuados son requisitos previos fundamentales para cualquier procedimiento quirúrgico. En este caso, es crucial garantizar un acceso óptimo a la esclerótica y al lugar de la inyección. Una exposición escleral insuficiente puede provocar dificultades evitables en los pasos posteriores. Además, la calidad de la retinotomía determina el riesgo de hemorragia. Debe realizarse con la mayor suavidad posible y lo más lejos posible de los vasos de la retina. Si se hace correctamente, el riesgo de sangrado intravítreo o subretiniano significativo es muy bajo.
Cuando se utiliza este enfoque para la inyección subretiniana, la inducción del desprendimiento de retina (RD) puede fallar por varias razones. El paso más desafiante en el proceso de aprendizaje es la inyección en sí. El lugar de la inyección debe elegirse cuidadosamente para permitir que el líquido fluya a través de la retina a través de la retinotomía. Debido al denso cuerpo vítreo posterior de los roedores, puede actuar como una barrera física para el flujo transretiniano. En nuestra experiencia, la penetración transretiniana se produce sin problemas cuando la punta de la cánula se coloca aproximadamente a 90° de la retina. Es muy recomendable, especialmente al principio, practicar el uso de soluciones coloreadas, como la fluoresceína, para confirmar que la solución inyectada fluye solo hacia el espacio subretiniano.
Se pueden identificar dos limitaciones de esta técnica. En primer lugar, el conducto transvítreo corre el riesgo de tocar el cristalino. El contacto con el cristalino puede ser inocuo si se conserva la cápsula posterior del cristalino, ya que no debería provocar la formación de cataratas. Sin embargo, si la cápsula posterior del cristalino está dañada, el riesgo de formación de cataratas es alto y es posible que el animal ya no sea adecuado para el proyecto experimental, especialmente si se requieren exámenes de seguimiento de la retina. En segundo lugar, esta técnica puede provocar sangrado en varias etapas, lo que podría impedir el proceso experimental. Las suturas de los párpados pueden provocar sangrado conjuntival, aunque esto generalmente no es un problema y se puede limpiar con un hisopo de algodón. Además, se realizan dos retinotomías durante el procedimiento, las cuales conllevan un riesgo de hemorragia. La primera retinotomía se realiza mientras el experimentador está ciego a la retina (a través del canal escleral), lo que puede provocar una hemorragia intravítrea durante la perforación escleral, lo que complica aún más el procedimiento. En raras ocasiones, puede producirse sangrado subretiniano o coroideo. Esta "retinotomía de entrada" puede evitarse inyectando a través de la córnea9, aunque este enfoque limita significativamente la gama de posibles sitios de inyección. La segunda retinotomía tiene un mayor riesgo de sangrado si los vasos de la retina entran en contacto con la punta de la cánula. La hemorragia subretiniana debe evitarse estrictamente, ya que los componentes de la sangre son tóxicos para los fotorreceptores10. Debido a estos riesgos, los experimentadores novatos deben esperar una tasa de fracaso de 1 en 5 a 1 en 10 inyecciones. En nuestra experiencia, no se han encontrado casos de desprendimiento de coroides, endoftalmitis o daño retiniano inducido por hipertonía.
Por otra parte, se han descrito métodos que utilizan abordajes transesclerales para el parto subretiniano, que evitan el paso transvítreo 8,11. Sin embargo, en nuestra experiencia, estos procedimientos no permiten sitios de inyección o ampollas precisos o reproducibles y solo deben realizarse cuando se utilizan ratones. Además, estos procedimientos requieren una incisión escleral autosellante con una aguja que cruza la coroides y el epitelio pigmentario de la retina (EPR) en la ubicación del RD. Esto plantea un riesgo de migración del pigmento subretiniano, lo que puede llevar a consecuencias inflamatorias y puede distorsionar el modelo de RD11. Además, la inyección se realiza sin visibilidad de la punta de la jeringa, lo que aumenta el riesgo de desprendimiento supracoroideo o subcoroideo en lugar de RD. También existe el riesgo de una retinotomía involuntaria, que conduce a una administración intravítrea posterior, especialmente cuando se trabaja con modelos de degeneración de retina que tienen retinas más delgadas y frágiles.
Las aplicaciones de la administración subretiniana o la RD inducida incluyen la prueba de diversas terapias en modelos de degeneración de la retina o en casos de RD 8,11,12,13,14. En ambas condiciones, el objetivo del procedimiento es imitar los procesos que finalmente ocurren en los seres humanos. Tanto el abordaje transescleral como el transvítreo pueden modelar la RD, siempre y cuando la altura y la duración de la RD sean suficientes15. En el caso de la administración subretiniana, los métodos actuales replican más fielmente los utilizados en primates no humanos16 y humanos5, mejorando así la traducibilidad de los datos.
Divulgaciones
S.P: Consultor e intereses financieros personales: Pixium Vision, GenSight Biologics (ninguna de estas actividades es relevante para los datos presentados aquí).
Agradecimientos
Este estudio contó con el apoyo de la IHU FOReSIGHT (París), la Fondation Voir & Entendre (París), UNADEV/Aviesan (en el marco del proyecto "neuroprotección de fotorreceptores de cono", París), HyVIS (GA 964468), la Fundación para la Lucha contra la Ceguera (FFB PPA Vision Restoration: PPA-0919-0772-INSERM; FFB PPA Usher 1B: PPA-0922-0840-INSERM). Los salarios de A.D. fueron proporcionados por subvenciones de la Fondation pour la Recherche Médicale (subvención número M2R202106013349, París), la Fondation de France (subvención número WB-2023-49302, París) y la Sociedad Francesa de Oftalmología. El patrocinador o las organizaciones financiadoras no tuvieron ningún papel en el diseño o la realización de esta investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
Referencias
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados
Utilizamos cookies para mejorar su experiencia en nuestra página web.
Al continuar usando nuestro sitio web o al hacer clic en 'Continuar', está aceptando nuestras cookies.
