Method Article
التصور أثناء الجراحة للحقن تحت الشبكية وانفصال الشبكية في الفئران
In This Article
Summary
توضح هذه المقالة طرق الحقن تحت الشبكية في الفئران ، باستخدام التصور أثناء الجراحة للتحكم في كل من موقع الحقن ومنطقة انفصال الشبكية.
Abstract
الحقن تحت الشبكية ، وهو توصيل محلول بين المستقبلات الضوئية وظهارة صبغة الشبكية (RPE) ، يخلق مساحة تحت الشبكية حيث تكون المكونات على اتصال مباشر مع المستقبلات الضوئية وخلايا RPE. تسمح طريقة التوصيل هذه بالعلاج المستهدف لهذه الخلايا. تم تطوير علاجات الحقن تحت الشبكية والموافقة عليها ، خاصة لأمراض الشبكية الوراثية. في ، يمكن أن تكون إجراءات الحقن تحت الشبكية صعبة بسبب حجم العدسة ، خاصة في القوارض. توضح هذه المقالة طرق الحقن تحت الشبكية في الفئران ، مما يتيح التصور أثناء الجراحة والتحكم في كل من موقع الحقن وحجم المنطقة المنفصلة ، كما هو الحال في البشر. يتم إجراء العملية تحت التخدير العام والموضعي وتتطلب توسيع حدقة العين. باستخدام مجهر العين ، يتم إجراء الحقن تحت الشبكية من خلال قناة صلبة 30 جم ، مع وضع طرف القنية برفق على شبكية العين لإنشاء بضع الشبكية. يمكن تسليم أحجام تتراوح من 10-25 ميكرولتر ، أي ما يعادل خمسي إلى نصف شبكية الفئران. تؤكد فحوصات ما بعد الجراحة الفورية باستخدام تصوير قاع العين والتصوير المقطعي للتماسك البصري التسليم الناجح في الفضاء تحت الشبكية باستخدام سائل تحت الشبكية المرئي. تشمل المخاطر الرئيسية لهذا الإجراء تلف العدسة (إعتام عدسة العين) ، وفشل الانفصال ، والنزيف داخل الجسم الزجاجي ، والنزيف تحت الشبكية ، والتهاب القرنية بعد الجراحة. بالإضافة إلى توصيل العلاجات إلى الفضاء تحت الشبكية ، تستخدم هذه التقنية للحث على انفصال الشبكية على المدى القصير أو الطويل باستخدام منتجات مائية أو لزجة ، على التوالي. على عكس النهج عبر الصلبة ، تتيح هذه الطريقة تحديد المواقع الدقيقة أثناء الجراحة لانفصال الشبكية.
Introduction
شبكية العين هي نسيج عصبي حساس للضوء يقع في الجزء الداخلي والخلفي من مقلة العين. تحتوي الطبقة الخارجية للشبكية العصبية على مستقبلات ضوئية ، وهي خلايا عصبية متخصصة مخصصة لتحويل الضوء إلى إشارات كهروكيميائية وبالتالي فهي ضرورية للرؤية. توفر ظهارة صبغة الشبكية (RPE) ، الموجودة أسفل الشبكية العصبية ، دعما استقلابا مكثفا للمستقبلات الضوئية ، مما يسهل تجديد الصبغة البصرية والتجديد المنتظم لأجزائه الخارجية1.
تنكس المستقبلات الضوئية هو السبب الأكثر شيوعا لفقدان البصر الذي لا رجعة فيه ويحدث في أمراض الشبكية المختلفة ، مثل الضمور البقعي المرتبط بالعمر ، والتهاب الشبكية الصباغي ، واعتلال الشبكية السكري ، وانفصال الشبكية1،2،3،4. تنتج معظم هذه الحالات عن الفقدان الأولي أو الثانوي للمستقبلات الضوئية ، وغالبا ما تكون ثانوية لفقدان RPE أو الخلل الوظيفي. لذلك ، من المهم بشكل خاص دراسة المستقبلات الضوئية وخلايا RPE في الجسم الحي لمنع تنكسها. حتى الآن ، لا توجد علاجات فعالة للعديد من أمراض الشبكية ، مثل ضمور الشبكية (بما في ذلك التهاب الشبكية الصباغي) أو التنكس البقعي (بما في ذلك التنكس البقعي المرتبط بالعمر).
الحقن تحت الشبكية ، وهو توصيل محلول بين المستقبلات الضوئية و RPE ، يخلق مساحة تحت الشبكية حيث تكون المكونات على اتصال مباشر مع المستقبلات الضوئية وخلايا RPE. تسمح طريقة التوصيل هذه بالعلاج المستهدف لهذه الخلايا ، متجاوزة حواجز الشبكية أو الأوعية الدموية المختلفة. تم تطوير العديد من العلاجات للولادة تحت الشبكية والموافقة عليها ، خاصة لأمراض الشبكية الوراثية5،6.
من المهم مواءمة الممارسات الجراحية للولادة تحت الشبكية. في البشر ، يتضمن الإجراء القياسي استئصال الزجاجية 25 G pars plana ، والذي يوفر وصولا سهلا نسبيا إلى الجزء الخلفي من العين لأن العدسة صغيرة بما يتناسب مع العين بأكملها. يتم إجراء التسليم تحت الشبكية من خلال مبزل 25 جم باستخدام قنية متوافقة حيويا برأس سيليكون 38 جم أو 41 جم ، مما يسمح بالتدفق السلس عبر الشبكية5.
في ، يمكن أن تكون إجراءات الحقن تحت الشبكية صعبة بسبب حجم العدسة. على سبيل المثال ، في القوارض ، تشغل العدسة ما يصل إلى 90٪ من التجويف الزجاجي. في الفئران ، تشغل العدسة مساحة أقل من الفئران ولكنها تظل مهمة (انظر الشكل 1 أ). بالإضافة إلى ذلك ، يمكن استخدام الحقن تحت الشبكية لنمذجة انفصال الشبكية (RD) باستخدام المحاليل اللزجة لمنع إزالة السوائل تحت الشبكية بواسطة خلايا RPE7،8. تستخدم هذه النماذج بشكل أساسي في تطوير علاجات لأمراض الشبكية.
توضح هذه المقالة طرق التسليم تحت الشبكية أو RD المستحث في الفئران ، مما يتيح التحكم الكامل أثناء الجراحة في موقع الحقن ومنطقة الشبكية المنفصلة.
Protocol
تمت الموافقة على التجارب والإجراءات من قبل اللجنة المحلية لأخلاقيات وأجريت في المرافق المرتبطة بالمختبر ، وفقا للتشريعات المحلية. التزمت جميع الأعمال التجريبية بالسياسات المؤسسية بشأن إجراءات الأمن البيولوجي والسلامة (اللجنة المحلية لأخلاقيات تشارلز داروين CEEACD # 5) واتبعت التوجيه الأوروبي 2010/63 / EU. تم استخدام أنثى فئران إيفانز البرية البالغة من العمر ثمانية أسابيع (Rattus norvegicus) في هذه الدراسة. يمكن استخدام نماذج تنكس الشبكية المختلفة للفئران ، مثل P23H و RCS ، لاختبار توصيل تحت الشبكية للعلاجات المختلفة ، بما في ذلك الأدوية والعلاجات الجينية. وترد تفاصيل الكواشف والمعدات المستخدمة في هذه الدراسة في جدول المواد.
1. إعداد الحلول
- التوصيل تحت الشبكية: تمييع الجزيئات في PBS أو ثنائي ميثيل سلفوكسيد للتوصيل المائي تحت الشبكية.
- تحريض RD: استخدم 2٪ هيدروكسي بروبيل ميثيل سلولوز أو 1٪ -5٪ هيالورونات الصوديوم للحث على RD على المدى الطويل.
2. الإعداد التجريبي
- قم بتركيب طرف معدني غير مشطوف 10 مم 30 جم مثبتا على حقنة 10 ميكرولتر أو 25 ميكرولتر على حاقن دقيق.
- قم بتحميل المحلول المحضر في المحقنة.
3. تحضير
- تخدير
- التخدير العام: تخدير الفئران بحقن داخل الصفاق 40 مجم / كجم من الكيتامين و 0.14 مجم / كجم ميديتوميدين.
ملاحظة: يستمر هذا التخدير لفترة كافية طوال مدة الإجراء ولاستكشافات ما بعد الجراحة مباشرة. - توسيع حدقة العين: ضعي قطرة واحدة من 0.5٪ تروبيكاميد للحصول على داء الميدريات في عين واحدة.
ملاحظة: بالنسبة للجراحين الذين يستخدمون اليد اليمنى ، سيكون الإجراء أسهل في العين اليسرى ، والعكس صحيح. - التخدير الموضعي ( الشكل 2 ب): ضع قطرة عين واحدة من أوكسي بوبروكائين في العين المراد تشغيلها.
- التخدير العام: تخدير الفئران بحقن داخل الصفاق 40 مجم / كجم من الكيتامين و 0.14 مجم / كجم ميديتوميدين.
4. الجراحة تحت المجهر
- التصور أثناء الجراحة: استخدم مجهر العيون المتصل بمفتاح القدم لإجراء الجراحة.
- التعرض الصلبي (الشكل 2 ج ، د)
- استخدمي خيوط سحب الجفن (5-0 أو 6-0) مثبتتين في الربع الخارجي من الحافة الجفنية في الجفون العلوية والسفلية.
- اسحب الغرز لتحقيق انتفاخ لطيف للعين.
- قناة الصلبة (الشكل 2E ، F): استخدم إبرة 30 جم لإنشاء قناة صلبية من خلال الملتحمة البصلية الصدغية ، على بعد حوالي 1-2 مم من طيفي القرنية.
ملاحظة: بالكاد أدخل طرف الإبرة المشطوف دون دفعه أكثر لتجنب خطر لمس العدسة وإعتام عدسة العين اللاحق. راقب نزيف الملتحمة لعشرات الثواني في هذه المرحلة. تجنب حشو النزيف ، لأن ذلك قد يتسبب في تجمع الدم في الجسم الزجاجي ويعرض الإجراء للخطر. امسح برفق أي دم في منطقة القناة أو يعيق الرؤية باستخدام قطعة قطن. - حماية القرنية (الشكل 2G): استخدم جل المسيل للدموع كواجهة للعدسة والعين طوال العملية.
- تصور مستوى الشبكية (الشكل 2G)
- ضع عدسات لاصقة مسطحة (قطرها 8 مم) على سطح العين لتصور مستوى الشبكية بالتكبير المناسب.
- استخدم مفتاح القدم في المجهر للتركيز على مستوى الشبكية.
- الحقن تحت الشبكية (الشكل 2H - M)
- أدخل القنية عموديا من خلال القناة الصلبة مسبقة التشكيل (الشكل 2H).
- تجنب لمس العدسة عن طريق إبقاء القنية عمودية.
- اقترب ببطء من شبكية العين واضغط عليها برفق حتى يتم ملاحظة تبييض الشبكية (الأسهم في الشكل 2I).
- حافظ على ثبات الطرف أثناء الحقن من خلال بضع الشبكية المتكون من تدفق الحقن (الشكل 2J). تجنب سحب الطرف في وقت مبكر جدا من بضع الشبكية ، لأن ذلك سيؤدي إلى حقن المنتج في الجسم الزجاجي.
- بعد الحقن ، قم بإزالة الطرف من بضع الشبكية ، ثم اسحب القنية بأكملها برفق من التجويف الزجاجي ، مع ضمان عدم لمس العدسة (الشكل 2 ك).
ملاحظة: إذا لم يتم تطوير الفقاعة بشكل كاف أو كانت منطقة الشبكية المنفصلة مقيدة للغاية بمجرد إفراغ المحقنة ، فقم بإجراء إعادة الحقن باستخدام نفس القناة الصلبة وإدخال الطرف في بضع الشبكية الذي تم تشكيله مسبقا. - تأكد من تغيير المنعكس الأحمر الحدقة بواسطة انفصال الشبكية دون مراقبة تدفق الدم داخل التجويف الزجاجي (الشكل 2L ، M).
- نهاية الجراحة (الشكل 2N ، O)
- قم بإزالة خيوط الجفن ومسح أي نزيف بعناية (الشكل 2N).
- قم بتقييم ضغط العين يدويا بإيجاز.
ملاحظة: قد تظهر كمية صغيرة من السائل الزجاجي في الفضاء تحت الملتحمة ، ولكن يجب ألا يحدث تسرب نشط (الشكل 2O).
5. رعاية ما بعد الجراحة والاستيقاظ
- ضع مرهم العين الكلورامفينيكول الريتينول على العين التي تم تشغيلها.
- يجب تطبيق 1 مل من 5٪ من الغلوكوز أحادي الهيدرات داخل الصفاق.
- حقن 0.9 ملغم/كغ أتيبامزول تحت الجلد.
- ضع في غرفة يتم التحكم في درجة حرارتها وراقبها حتى يستيقظ.
النتائج
يعتمد نجاح الحقن تحت الشبكية على التوصيل الدقيق والحصري إلى الفضاء تحت الشبكية (أي بين المستقبلات الضوئية وطبقات RPE) من خلال بضع الشبكية ، وتجنب النزيف تحت الشبكية ، حيث أن الدم سام للمستقبلات الضوئية وخلايا RPE. يتم تأكيد الولادة الناجحة من خلال التصور أثناء الجراحة (الشكل 2L) ، وتصوير قاع العين بعد الجراحة مباشرة ، والتصوير المقطعي للتماسك البصري (OCT). يستبعد تصوير قاع العين نزيف تحت الشبكية ، بينما تؤكد فحوصات OCT B انفصال الشبكية (RD) بسائل تحت الشبكية الشفاف (الشكل 1 والشكل 3). بالإضافة إلى ذلك ، يمكن لتصوير قاع العين تحديد لمسة العدسة أو إعتام عدسة العين المستحث الذي قد لا يلاحظه أحد أثناء الإجراء (الشكل 3 ج ، د). يمكن لكل من التصوير الفوتوغرافي ومسح OCT تقدير حجم المنطقة المنفصلة أو الفقاعة (الشكل 1B-E).
هناك عدة عوامل تؤثر على حجم الفقاعة: (1) موقع الحقن: كلما كان موقع الحقن بعيدا عن القرص البصري ، كلما كانت المنطقة المنفصلة أصغر. (2) الحجم المحقون: يمكن لحجم الحقن البالغ 20-25 ميكرولتر أن يفصل ما يقرب من نصف شبكية العين في الفئران ؛ (3) جودة شبكية العين المنفصلة: في نماذج تنكس الشبكية (على سبيل المثال ، P23H ، RCS) ، قد يكون الانفصال صعبا بسبب زيادة المقاومة بين المستقبلات الضوئية وخلايا RPE الناتجة عن العمليات التنكسية ، مثل الدبقي وتراكم المواد تحت الشبكية. في مثل هذه الحالات ، عادة ما تكون انفصالات الشبكية المستحثة مسطحة ، وتعد فحوصات OCT ضرورية لتحديد المنطقة المنفصلة بوضوح.
قد يحدث نزيف بسيط داخل الجسم الزجاجي في موقع الحقن لأنه لا يمكن دائما تجنب الأوعية الدقيقة في الشبكية تماما (الشكل 3 ه). ومع ذلك ، فإن مثل هذه النزيفات لا تمتد عادة إلى الفضاء تحت الشبكية.
في حالات عدم كفاية الانفصال ، يجب التعرف على المشكلة أثناء الجراحة ، مما يستلزم إعادة الحقن الفوري من خلال بضع الشبكية المشكل. خلال جلسة تجريبية مع 20 فأرا ، قام جراحان (أحدهما من ذوي الخبرة والآخر مبتدئ) بإجراء الطريقة خطوة بخطوة. حقق الجراح المتمرس النجاح في 9 من أصل 10 إجراءات، بينما نجح المبتدئ في 6 من أصل 10.

الشكل 1: نظرة عامة على العملية والنتائج. (أ) تمثيل تخطيطي لعملية الحقن تحت الشبكية في عين الفئران ، يوضح الحجم الكبير للعدسة. (ب ، ج) تصوير قاع العين مباشرة بعد الحقن (B) و 6 أيام بعد الحقن (C). تشير رؤوس الأسهم إلى موقع الحقن. يتم تحديد منطقة انفصال الشبكية بخط متقطع. (د ، ه) التصوير المقطعي البصري للتماسك B بعد الحقن مباشرة (D) وبعد 6 أيام من الحقن (E). تشغيل: العصب البصري. التكبير: 1x. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
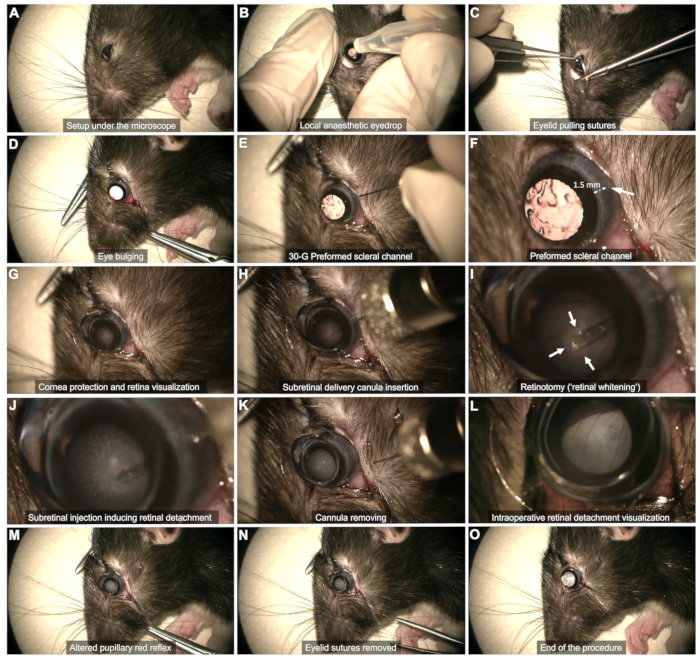
الشكل 2: خطوات بروتوكول الحقن تحت الشبكية. يظهر البروتوكول في فأر Long Evans البالغ من العمر 8 أسابيع تحت التخدير العام. للحصول على وصف تفصيلي لكل خطوة، يرجى الرجوع إلى الفيديو أو قسم "البروتوكول" في النص. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: أمثلة على نتائج تصوير قاع العين المختلفة بعد الجراحة. (أ) المظهر الطبيعي بعد الجراحة مع تشتت طفيف للصبغة في موقع الحقن (السهم). (ب) المظهر الطبيعي بعد الجراحة مع فقاعة هواء صغيرة داخل الجسم الزجاجي في موقع الحقن. تنشأ فقاعات الهواء الصغيرة هذه من المحقنة وهي غير ضارة ، حتى في الفضاء تحت الشبكية. (ج، د) يؤدي لمس العدسة إلى عتامة العدسة الطفيفة (C) أو الكبيرة (D) (إعتام عدسة العين). (ه، و) نزيف طفيف (E) أو أكثر اتساعا (F) داخل الجسم الزجاجي موضعي بالقرب من موقع الحقن، مع عدم انتشاره في الحيز تحت الشبكية. (ز) ينتشر نزيف موقع الحقن في الغالب في الحيز تحت الشبكية. في هذه الحالة ، تسبب بضع الشبكية في إصابة الأوعية الدموية في الشبكية. (ح) نزيف واسع النطاق داخل الجسم الزجاجي ناتج عن اختراق الصلبة. التكبير: 1x. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
توضح هذه المقالة طرق الولادة تحت الشبكية عبر الجسم الزجاجي في الفئران مع التصور أثناء الجراحة والتحكم في كل من موقع الحقن والمنطقة المنفصلة.
هناك خطوتان حاسمتان في هذا البروتوكول: التعرض للصلبة وبضع الشبكية. يعد الوضع الصحيح والتعرض والوصول من المتطلبات الأساسية لأي إجراء جراحي. في هذه الحالة ، من الأهمية بمكان ضمان الوصول الأمثل إلى الصلبة وموقع الحقن. يمكن أن يؤدي عدم كفاية التعرض للصلبة إلى صعوبات يمكن تجنبها في الخطوات اللاحقة. بالإضافة إلى ذلك ، تحدد جودة بضع الشبكية خطر النزيف. يجب إجراؤه بلطف قدر الإمكان وبقدر الإمكان من أي أوعية شبكية. إذا تم إجراؤه بشكل صحيح ، فإن خطر حدوث نزيف كبير داخل الجسم الزجاجي أو تحت الشبكية يكون منخفضا للغاية.
عند استخدام هذا النهج للحقن تحت الشبكية ، قد يفشل تحريض انفصال الشبكية (RD) لعدة أسباب. الخطوة الأكثر تحديا في عملية التعلم هي الحقن نفسه. يجب اختيار موقع الحقن بعناية للسماح للسائل بالتدفق عبر شبكية العين من خلال بضع الشبكية. بسبب الجسم الزجاجي الخلفي الكثيف في القوارض ، يمكن أن يكون بمثابة حاجز مادي للتدفق عبر الشبكية. في تجربتنا ، يحدث اختراق عبر الشبكية بسلاسة عندما يتم وضع طرف القنية عند حوالي 90 درجة إلى شبكية العين. يوصى بشدة ، خاصة في البداية ، بالتدرب على استخدام المحاليل الملونة ، مثل الفلورسين ، للتأكد من أن المحلول المحقون يتدفق فقط إلى الفضاء تحت الشبكية.
يمكن تحديد قيودين لهذه التقنية. أولا ، الممر العابر للزجاج معرض لخطر لمس العدسة. قد تكون لمسة العدسة غير ضارة إذا تم الحفاظ على كبسولة العدسة الخلفية ، حيث لا ينبغي أن تؤدي إلى تكوين إعتام عدسة العين. ومع ذلك ، في حالة تلف كبسولة العدسة الخلفية ، يكون خطر تكوين إعتام عدسة العين مرتفعا ، وقد لا يكون مناسبا للمشروع التجريبي ، خاصة إذا كانت فحوصات متابعة الشبكية مطلوبة. ثانيا ، قد تؤدي هذه التقنية إلى نزيف في عدة مراحل ، مما قد يعيق العملية التجريبية. قد ينتج نزيف الملتحمة عن خيوط الجفن ، على الرغم من أن هذه ليست مشكلة عادة ويمكن تنظيفها بقطعة قطن. بالإضافة إلى ذلك ، يتم إجراء قطعتين لبضع الشبكية أثناء العملية ، وكلاهما ينطوي على خطر النزيف. يتم إجراء بضع الشبكية الأول بينما يكون المجرب أعمى عن شبكية العين (من خلال القناة الصلبية) ، مما قد يؤدي إلى نزيف داخل الجسم الزجاجي أثناء ثقب الصلبة ، مما يزيد من تعقيد الإجراء. نادرا ما يحدث نزيف تحت الشبكية أو المشيمية. يمكن تجنب "بضع الشبكية الدخول" عن طريق الحقن من خلال القرنية9 ، على الرغم من أن هذا النهج يحد بشكل كبير من نطاق مواقع الحقن المحتملة. يكون بضع الشبكية الثاني أكثر عرضة للنزيف إذا تم لمس أوعية الشبكية بطرف القنية. يجب تجنب النزيف تحت الشبكية بشكل صارم ، لأن مكونات الدم سامة للمستقبلات الضوئية10. بسبب هذه المخاطر ، يجب أن يتوقع المجربون المبتدئون معدل فشل من 1 في 5 إلى 1 من كل 10 حقن. من خلال تجربتنا ، لم تتم مواجهة أي حالات انفصال مشيمي أو التهاب باطن المقلة أو تلف الشبكية الناجم عن فرط توتر.
بدلا من ذلك ، تم وصف الطرق التي تستخدم مناهج عبر الصلبة للولادة تحت الشبكية ، والتي تتجنب المرور عبر الجسم الزجاجي، 8،11. ومع ذلك ، من خلال تجربتنا ، لا تسمح هذه الإجراءات بمواقع حقن أو فقاعة دقيقة أو قابلة للتكرار ويجب إجراؤها فقط عند استخدام الفئران. بالإضافة إلى ذلك ، تتطلب هذه الإجراءات شقا صلبيا ذاتي الغلق بإبرة تعبر المشيمية وظهارة صبغة الشبكية (RPE) في موقع RD. هذا يشكل خطر هجرة الصباغ تحت الشبكية ، مما قد يؤدي إلى عواقب التهابية وقد يشوه نموذج RD11. علاوة على ذلك ، يتم إجراء الحقن دون رؤية طرف المحقنة ، مما يزيد من خطر الانفصال فوق المشيمي أو تحت المشيمية بدلا من RD. هناك أيضا خطر قطع الشبكية غير المقصود ، مما يؤدي إلى الولادة اللاحقة داخل الجسم الزجاجي ، خاصة عند العمل مع نماذج تنكس الشبكية التي تحتوي على شبكية أرق وأكثر هشاشة.
تشمل تطبيقات التوصيل تحت الشبكية أو RD المستحث اختبار علاجات مختلفة على نماذج تنكس الشبكية أو في حالات RD8،11،12،13،14. في كلتا الحالتين ، الهدف من الإجراء هو تقليد العمليات التي تحدث في النهاية في البشر. يمكن لكل من الأساليب عبر الصلبة وعبر الجسم الزجاجي نمذجة RD ، طالما أن ارتفاع ومدة RD كافيان15. في حالة التسليم تحت الشبكية ، فإن الطرق الحالية تكرر بشكل أوثق تلك المستخدمة في الرئيسيات غير البشرية16 والبشر5 ، وبالتالي تعزيز قابلية ترجمة البيانات.
Disclosures
S.P: الاستشاري والمصالح المالية الشخصية - Pixium Vision و GenSight Biologics (لا علاقة لأي من هذه الأنشطة بالبيانات المعروضة هنا).
Acknowledgements
تم دعم هذه الدراسة من قبل IHU FOReSIGHT (باريس) ، ومؤسسة Voir & Entendre (باريس) ، و UNADEV / Aviesan (في إطار مشروع "الحماية العصبية لمستقبلات الضوء المخروطية" ، باريس) ، HyVIS (GA 964468) ، مؤسسة مكافحة العمى (FFB PPA استعادة الرؤية: PPA-0919-0772-INSERM; FFB PPA Usher 1B: PPA-0922-0840-INSERM). تم توفير رواتب AD من خلال منح من مؤسسة البحث الطبي، (المنحة رقم M2R202106013349، باريس)، ومؤسسة فرنسا (رقم المنحة WB-2023-49302، باريس) والجمعية الفرنسية لطب العيون. لم يكن للراعي أو المنظمات الممولة أي دور في تصميم أو إجراء هذا البحث.
Materials
| Name | Company | Catalog Number | Comments |
| Atipemazole (Antidorm 4.27mg/mL) | Axience SAS, Pantin, France | / | Awakening |
| Chloramphenicol-retinol (Ophtalon 10mg/g) | TVM, Lempdes, France | FR/V/3787889 6/1989 | Postoperative care |
| Cover slips Mini 8mm | World Precision Instruments, Sarasota, FL | / | https://www.wpiinc.com/var-1040-cover-slips-pkg-100.html?srsltid=AfmBOoraZfMhuUuY_7rQbM5YKfqM2VR1PT0L-UHQ5uQUdjaeZuogbKP1&utm_source=chatgpt.com |
| Hydroxypropyl methylcellulose | FCI S.A.S., Paris, France | / | Viscous subretinal delivery |
| Ketamine (Ketamidor 100 mg/mL) | Axience SAS, Pantin, France | / | General anesthesia |
| Lumera 700 | Carl Zeiss, Oberkochen, Germany | https://www.zeiss.com/meditec/en/products/surgical-microscopes/ophthalmic-microscopes/opmi-lumera-700.html?utm_source=chatgpt.com | Ophthalmic microscope |
| Medetomidine (Domitor 0.85 mg/mL) | Vetoquinol S.A., Paris, France | https://www.vetoquinol.com/en | General anesthesia |
| Microinjector Micro 4 | World Precision Instruments, Sarasota, FL | SYS-MICRO4 | Injection |
| Oxybuprocaine 1.6 mg/0.4 mL | Théa, Clermont-Ferrand, France | https://www.laboratoires-thea.com/en/chlorhydrate-doxybuprocaine-thea?utm_source=chatgpt.com | Local anesthesia |
| PBS | Life Technologies Europe B.V., Bleiswijk, The Netherlands | 14190-094 | Aqueous subretinal delivery |
| Syringe (10 or 20 µL) | Hamilton, Reno, NV | 80300 | Injection |
| Tear gel (Lubrithal) | Dechron, Shrewsbury, UK | https://www.dechra.ca/our-products/ca/companion-animal/dog/non-prescription/lubrithal?utm_source=chatgpt.com | Cornea protection |
| Tropicamide (Mydriaticum 1 mg/mL) | Théa, Clermont-Ferrand, France | / | Pupil dilation |
References
- Guymer, R. H., Campbell, T. G. Age-related macular degeneration. Lancet. 401 (10386), 1459-1472 (2023).
- Hartong, D. T., Berson, E. L., Dryja, T. P. Retinitis pigmentosa. Lancet. 368 (9549), 1795-1809 (2006).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. Lancet. 376 (9735), 124-136 (2010).
- Murakami, Y., et al. Photoreceptor cell death and rescue in retinal detachment and degenerations. Prog Retin Eye Res. 37, 114-140 (2013).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: A randomised, controlled, open-label, phase 3 trial. Lancet. 390, 849-860 (2017).
- Gagliardi, G., Ben M'Barek, K., Goureau, O. Photoreceptor cell replacement in macular degeneration and retinitis pigmentosa: A pluripotent stem cell-based approach. Prog Retin Eye Res. 71, 1-25 (2019).
- Zeng, R., Zhang, Y., Shi, F., Kong, F. A novel experimental mouse model of retinal detachment: Complete functional and histologic recovery of the retina. Invest Ophthalmol Vis Sci. 53, 1685-1695 (2012).
- Matsumoto, H., Miller, J. W., Vavvas, D. G. Retinal detachment model in rodents by subretinal injection of sodium hyaluronate. J Vis Exp. 79, e50660 (2013).
- Timmers, A. M., Zhang, H., Squitieri, A., Gonzalez-Pola, C. Subretinal injections in rodent eyes: Effects on electrophysiology and histology of rat retina. Mol Vis. 7, 131-137 (2001).
- Benner, J. D., Hay, A., Landers, M. B., Hjelmeland, L. M., Morse, L. S. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within 7 days reduces outer retinal degeneration. Ophthalmology. 101, 672-681 (1994).
- Secondi, R., Kong, J., Blonska, A. M., Staurenghi, G., Sparrow, J. R. Fundus autofluorescence findings in a mouse model of retinal detachment. Invest Ophthalmol Vis Sci. 53, 5190-5197 (2012).
- Becker, S., Wang, H., Stoddard, G. J., Hartnett, M. E. Effect of subretinal injection on retinal structure and function in a rat oxygen-induced retinopathy model. Mol Vis. 23, 832-843 (2017).
- Sene, A., Apte, R. S. Inflammation-induced photoreceptor cell death. Adv Exp Med Biol. 1074, 203-208 (2018).
- Zhang, Z. Y., Sun, Y. J., Song, J. Y., Fan, B., Li, G. Y. Experimental models and examination methods of retinal detachment. Brain Res Bull. 169, 51-62 (2021).
- Machemer, R. Experimental retinal detachment in the owl monkey. IV. The reattached retina. Am J Ophthalmol. 66, 1075-1091 (1968).
- Dentel, A., et al. Adaptive optics flood illumination ophthalmoscopy in nonhuman primates: Findings in normal and short-term induced detached retinae. Ophthalmol Sci. 3 (4), 100316 (2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved